Method Article
Generación y cultivo de organoides derivados de pacientes con cáncer de ovario seroso de alto grado
En este artículo
Resumen
Los organoides derivados del paciente (PDO) son un cultivo tridimensional (3D) que puede imitar el entorno tumoral in vitro. En el cáncer de ovario seroso de alto grado, las PDO representan un modelo para estudiar nuevos biomarcadores y terapias.
Resumen
Los organoides son modelos tumorales dinámicos 3D que se pueden cultivar con éxito a partir de tejido tumoral ovárico derivado del paciente, ascitis o líquido pleural y ayudan en el descubrimiento de nuevas terapias y biomarcadores predictivos para el cáncer de ovario. Estos modelos recapitulan la heterogeneidad clonal, el microambiente tumoral y las interacciones célula-célula y célula-matriz. Además, se ha demostrado que coinciden con el tumor primario morfológicamente, citológicamente, inmunohistoquímicamente y genéticamente. Por lo tanto, los organoides facilitan la investigación sobre las células tumorales y el microambiente tumoral y son superiores a las líneas celulares. El presente protocolo describe distintos métodos para generar organoides de cáncer de ovario derivados de pacientes a partir de tumores de pacientes, ascitis y muestras de líquido pleural con una tasa de éxito superior al 97%. Las muestras de pacientes se separan en suspensiones celulares mediante digestión mecánica y enzimática. Luego, las células se colocan utilizando un extracto de membrana basal (BME) y se apoyan con medios de crecimiento optimizados que contienen suplementos específicos para el cultivo de cáncer de ovario seroso de alto grado (HGSOC). Después de formar organoides iniciales, los PDO pueden sostener el cultivo a largo plazo, incluido el paso por expansión para experimentos posteriores.
Introducción
En 2021, aproximadamente 21,410 mujeres en los Estados Unidos fueron diagnosticadas recientemente con cáncer epitelial de ovario, y 12,940 mujeres murieron de esta enfermedad1. Aunque se han logrado avances suficientes en cirugía y quimioterapia, más de 70% de los pacientes con enfermedad avanzada desarrollan resistencia quimioterapéutica y mueren dentro de los 5 años posteriores al diagnóstico 2,3. Por lo tanto, se necesitan urgentemente nuevas estrategias para tratar esta enfermedad mortal y modelos representativos y confiables para la investigación preclínica.
Las líneas celulares cancerosas y los xenoinjertos derivados de pacientes (PDX) creados a partir de tumores ováricos primarios son los principales instrumentos utilizados en la investigación del cáncer de ovario. Una ventaja importante de las líneas celulares de cáncer es su rápida expansión. Sin embargo, su cultivo continuo da como resultado alteraciones fenotípicas y genotípicas que hacen que las líneas celulares cancerosas se desvíen de la muestra original del tumor primario de cáncer. Debido a las diferencias existentes entre la línea celular del cáncer y el tumor primario, los ensayos farmacológicos que tienen efectos positivos en las líneas celulares no tienen los mismos efectos en los ensayos clínicos2. Para superar estas limitaciones, se utilizan modelos PDX. Estos modelos se crean mediante la implantación de tejido fresco de cáncer de ovario en ratones inmunodeficientes. Como son modelos in vivo , se parecen con mayor precisión a las características biológicas humanas y, a su vez, son más predictivos de los resultados de los medicamentos. Sin embargo, estos modelos también tienen limitaciones significativas, incluyendo el costo, el tiempo y los recursos necesarios para generarlos4.
Las PDO ofrecen un modelo alternativo para la investigación preclínica que supera las limitaciones tanto de las líneas celulares cancerosas como de los modelos PDX. Las PDO recapitulan el tumor y el microambiente tumoral de un paciente y, así, proporcionan un modelo intratable in vitro ideal para la investigación preclínica 2,3,5. Estos modelos 3D tienen capacidades de autoorganización que modelan el tumor primario, que es una característica que sus contrapartes de línea celular bidimensional (2D) no poseen. Además, se ha demostrado que estos modelos representan genética y funcionalmente sus tumores progenitores y, por lo tanto, son modelos confiables para estudiar nuevos procesos terapéuticos y biológicos. En resumen, ofrecen capacidades de expansión y almacenamiento a largo plazo similares a las líneas celulares, pero también abarcan el microambiente y las interacciones célula-célula inherentes a los modelos de ratón 4,6.
El presente protocolo describe la creación de PDOs a partir de tumores derivados de pacientes, ascitis y muestras de líquido pleural con una tasa de éxito superior al 97%. Los cultivos PDO pueden expandirse durante múltiples generaciones y usarse para probar la sensibilidad a la terapia farmacológica y los biomarcadores predictivos. Este método representa una técnica que podría utilizarse para personalizar los tratamientos en función de las respuestas terapéuticas de las DOP.
Protocolo
Todas las muestras de tejido humano recolectadas para la investigación se obtuvieron de acuerdo con el protocolo aprobado por la Junta de Revisión Institucional (IRB). Los protocolos descritos a continuación se realizaron en un entorno estéril de cultivo de tejidos humanos. Se obtuvo el consentimiento informado por escrito de sujetos humanos. Las pacientes elegibles tenían que tener un diagnóstico o presunto diagnóstico de cáncer de ovario, estar dispuestas y ser capaces de firmar el consentimiento informado y tener al menos 18 años de edad. El tejido tumoral (tumor primario maligno o sitios metastásicos), la ascitis y el líquido pleural se obtuvieron de pacientes que dieron su consentimiento en el momento del procedimiento. Estas muestras fueron transportadas inmediatamente al laboratorio y procesadas para la generación de organoides utilizando los métodos descritos a continuación.
1. Preparación de los medios
- Preparación completa de los medios organoides
- Preparar R-spondin 1/medio acondicionado Noggin siguiendo un informe previamente publicado7.
NOTA: El medio condicionado R-spondin-1/Noggin es una alternativa más asequible a las proteínas recombinantes disponibles comercialmente. Las células HEK293T que secretan de manera estable R-spondin-1 y Noggin a través de la transducción mediada por lentivirus fueron un generoso regalo de Ron Bose, de la Facultad de Medicina de la Universidad de Washington en St. Louis, y Anil Rustgi, New York-Presbyterian/Columbia University Irving Medical Center 8,9,10. El medio acondicionado comercial podría usarse como sustituto (ver Tabla de materiales).
- Preparar R-spondin 1/medio acondicionado Noggin siguiendo un informe previamente publicado7.
- Para hacer el medio organoide completo, combine 10% de R-spondina 1/medio condicionado con Noggin, 50 ng/mL EGF, 10 ng/mL FGF-10, 10 ng/mL FGF2, 1x B27, 10 mmol/L nicotinamida, 1.25 mmol/L N-acetilcisteína, 1 μmol/L de prostaglandina E2, 10 μmol/L SB202190, 500 nmol/L A83-01 e inhibidor de ROCK de 10 μM (ver Tabla de materiales).
NOTA: El medio puede conservarse a 4 °C durante un máximo de 3 meses. Este medio fue adaptado de Hill et al.11. Las concentraciones e ingredientes del medio son los mismos, con la adición de un inhibidor de ROCK. - Prepare el medio base organoide combinando 500 ml de una formulación avanzada de DMEM/F12 con 1% de penicilina-estreptomicina, 1x dipéptido, L-alanil-L-glutamina y 1x HEPES (10 mM) (ver Tabla de materiales).
2. Recolección de organoides de ascitis y líquido pleural
NOTA: La ascitis y el líquido pleural deben procesarse lo antes posible para obtener el mejor rendimiento de los organoides. Descongele el tampón de reacción de BME, DNasa I y DNasa I previamente acitado (consulte la Tabla de materiales) colocándolo en hielo hasta que el contenido se licúe.
- Obtenga ascitis y líquido pleural de los pacientes que dan su consentimiento en el momento de las cirugías o procedimientos de atención estándar, y transporte a temperatura ambiente en un contenedor de viaje al laboratorio.
NOTA: Toda ascitis o procesamiento de líquido pleural debe realizarse en un ambiente estéril. - Transfiera 50 ml de ascitis o líquido pleural a 50 ml de tubos cónicos (el número de tubos depende del volumen de ascitis obtenido). Centrifugadora a 1.650 x g durante 5 min a 4 °C. Después de la centrifugación, utilice una pipeta de vidrio Pasteur para aspirar cuidadosamente el sobrenadante.
- Continuar añadiendo 50 ml de ascitis o líquido pleural al pellet previamente centrifugado, y centrifugar de nuevo a 1.650 x g durante 5 min a 4 °C. Aspirar cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur. Repita este paso hasta que se hayan procesado todas las ascitis o el líquido pleural.
- Preparar una solución de DNasa I de 100 μg/ml combinando 1.000 μL de agua libre de nucleasa, 100 μL de tampón de reacción de la DNasa I y 10 μL de DNasa I.
NOTA: El tratamiento con DNasa I aplicado es suficiente para hacer una suspensión unicelular independientemente de la presencia de agregados celulares en algunas muestras de pacientes12. - Resuspender cada pellet celular en 1 mL de solución de DNasa I de 100 μg/mL. Agregue suavemente la solución de DNasa I gota a gota y deje que el tubo se incube durante 15 minutos a temperatura ambiente.
NOTA: Agregue un mínimo de 1 ml de solución de DNasa I. Si 1 ml no es suficiente para perturbar el pellet, agregue 1 ml adicional. - Después de la incubación, añadir 25 ml de medio base organoide (paso 1.3) a las células, e invertir suavemente para mezclar. A continuación, centrifugar a 1.650 x g durante 5 min a 4 °C. Después de la centrifugación, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur.
- Resuspenda los gránulos de células recién formados en 5 ml precalentados de 1x tampón de lisis de glóbulos rojos (RBC) (consulte la Tabla de materiales). Ajuste el vórtice a 458 x g y vortice las soluciones en cada tubo cónico. Una vez que las soluciones sean homogéneas, utilice una pipeta serológica para combinar el contenido de todos los tubos cónicos en un solo tubo cónico de 50 ml.
- Incubar el tubo cónico que contiene la solución vortexed a temperatura ambiente durante 5 min. Una vez finalizada la incubación, centrifugar a 1.650 x g durante 5 min a 4 °C.
NOTA: Examine el pellet. Un pellet rosa/rojo indica la presencia de glóbulos rojos, lo que requeriría que el paso de amortiguación de lisis de glóbulos rojos se repita hasta que el pellet ya no sea rojo. - Después de la centrifugación, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur. A continuación, lavar el pellet con 10 ml de PBS, vaporizar la solución a 458 x g y centrifugar a 1.650 x g durante 5 min a 4 °C.
- Si se forma un pellet de células grandes, aspirar el PBS con una pipeta de vidrio Pasteur y añadir 1 ml de medio base organoide (paso 1.3) encima del pellet. Vortex la solución a 458 x g y transferir 300-400 μL a un tubo de microcentrífuga. Centrifugar el tubo de microcentrífuga a 1.650 x g durante 5 min a 4 °C.
NOTA: La porción del pellet celular no colocada en el tubo de microcentrífuga se puede congelar para su uso futuro (500 μL de células a 1 ml de DMSO al 10% en FBS). El pellet de celda congelada se puede almacenar durante semanas a -80 ° C y durante años si se coloca en nitrógeno líquido13. - Aspirar cuidadosamente el medio base organoide (paso 1.3) con una pipeta de vidrio Pasteur y resuspender en BME (ver Tabla de materiales) utilizando puntas frías.
NOTA: La cantidad de BME se basa en el tamaño del pellet. Se recomienda utilizar un 25% de medio base organoide (paso 1.3) con células resuspendidas al 75% de BME. - Placa 40 μL alícuotas de la solución celular resuspendida en una placa de 6 pocillos. Placa de hasta cinco alícuotas por pocillo (Figura 1).
- Colocar inmediatamente la placa en una incubadora a 37 °C durante 20 minutos para permitir que el BME se solidifique. Después de la incubación, añadir suavemente 2 ml de medio organoide completo (paso 1.2) en cada pocillo.
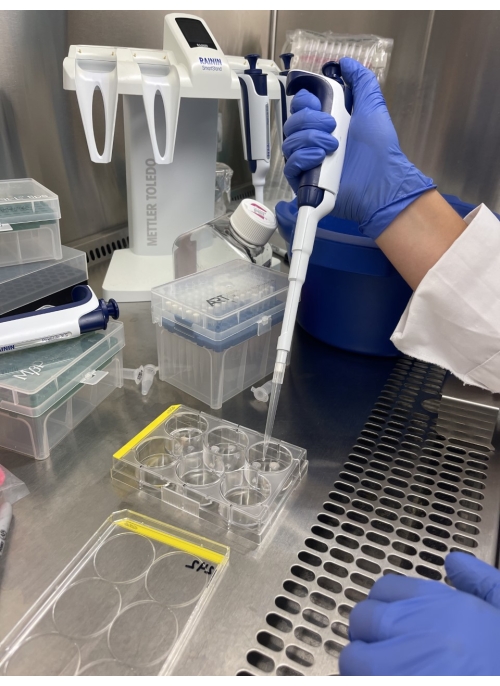
Figura 1: Recubrimiento de organoides de cáncer de ovario derivados de pacientes. Imagen representativa del revestimiento organoide. Las alícuotas de la mezcla de organoides se chapan cuidadosamente, asegurando que no se formen burbujas. Haga clic aquí para ver una versión más grande de esta figura.
3. Recolección de organoides de tejidos
NOTA: El tejido debe procesarse lo antes posible para obtener el mejor rendimiento de los organoides.
- Recolectar y transportar el tumor en hielo en un recipiente de viaje que contenga PBS.
- Colocar la muestra en una placa de cultivo de tejido de 10 cm (Figura 2). Usando un bisturí desechable, pica el tejido. A continuación, utilizando el extremo opaco de una jeringa desechable, aplaste el tejido hasta que se haya creado una mezcla homogénea.
- Usando fórceps, coloque la mezcla de tejido homogéneo en un tubo de disociación. Por cada 1-2 ml de tejido homogeneizado, añadir 7-8 ml de solución de colagenasa tipo II de 1 mg/ml (ver Tabla de materiales) en medio base organoide (paso 1.3) y 1 ml de solución de DNasa I. Vortex la solución a 458 x g.
NOTA: La cantidad de tejido determinará la cantidad de solución de colagenasa y la cantidad de tubos necesarios. - Use la máquina de disociación (consulte la Tabla de materiales) para licuar el tejido mientras está en la solución de colagenasa. Ejecute el programa 37C_h_TDK3 (1 h) hasta que sea una suspensión de una sola celda.
NOTA: Será necesario volver a ejecutar el programa si la mezcla resultante no es homogénea (es decir, si todavía hay trozos de tejido presentes en la mezcla). Si el tejido se digiere pero la solución es viscosa, diluir con medio base organoide (paso 1.3). - Transfiera la mezcla homogeneizada a un nuevo tubo cónico de 50 ml y añada 20-40 ml de medio base organoide (paso 1.3). Luego, filtre la solución a través de un filtro celular de 100 μm en un tubo cónico de 50 ml recién etiquetado.
- Centrifugar la mezcla filtrada a 1.650 x g durante 5 min a 4 °C. Luego, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur.
- Preparar una solución de DNasa I de 100 μg/ml combinando 1.000 μL de agua libre de nucleasa, 100 μL de tampón de reacción de la DNasa I y 10 μL de DNasa I.
NOTA: El tratamiento con DNasa I aplicado es suficiente para hacer una suspensión unicelular independientemente de la presencia de agregados celulares en algunas muestras de pacientes12. - Resuspender las células en 1 ml de solución de DNasa I de 100 ug/ml. Agregue suavemente la solución de DNasa I gota a gota y deje que el tubo se incube durante 15 minutos a temperatura ambiente.
- Después de la incubación, añadir 25 ml de medio base organoide (paso 1.3) a las células, e invertir suavemente para mezclar. A continuación, centrifugar a 1.650 x g durante 5 min a 4 °C. Después de la centrifugación, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur.
- Resuspender el pellet celular recién formado en 5 ml de tampón de lisis 1x RBC precalentado. Vortex las soluciones en cada tubo cónico a 458 x g.
- Incubar el tubo cónico que contiene el pellet celular resuspendido en el tampón de lisis RBC durante 5 min. Una vez finalizada la incubación, centrifugar a 1.650 x g durante 5 min a 4 °C.
NOTA: Examine el pellet. Un pellet rosa / rojo indica la presencia de glóbulos rojos, lo que requeriría que el paso de amortiguación de lisis de glóbulos rojos se repita hasta que el pellet aparezca blanco. - Después de la centrifugación, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur. A continuación, lavar el pellet con 10 ml de PBS, vaporizar la solución a 458 x g y centrifugar a 1.650 x g durante 5 min a 4 °C.
- Si se forma un pellet de células grandes, aspirar el PBS con una pipeta de vidrio Pasteur y añadir 1 ml de medio base organoide (paso 1.3) encima del pellet. Vortex la solución a 458 x g y transferir 300-400 μL a un tubo de microcentrífuga. Centrifugadora a 1.650 x g durante 5 min a 4 °C.
NOTA: La porción del pellet celular no colocada en el tubo de microcentrífuga se puede congelar para su uso futuro (500 μL de células a 1 ml de DMSO al 10% en FBS) (paso 5.1). El pellet de celda congelada se puede almacenar durante semanas a -80 ° C y durante años si se coloca en nitrógeno líquido13. - Aspirar cuidadosamente el medio base organoide con una pipeta de vidrio Pasteur y resuspender en BME con puntas frías.
NOTA: La cantidad de BME se basa en el tamaño del pellet. Se recomienda añadir un 25% de medio base organoide (paso 1.3) con células resuspendidas al 75% de BME. - Colocar la solución celular resuspendida en una placa de 6 pocillos en alícuotas de 40 μL. Planchar hasta cinco alícuotas por pozo.
- Coloque inmediatamente la placa del pozo en la incubadora durante 20 minutos. Después de la incubación, añadir suavemente 2 ml de medio organoide completo (paso 1.2) en cada pocillo.

Figura 2: Tejido tumoral antes de la disección. Imagen representativa del tejido tumoral obtenido para la generación de organoides. Haga clic aquí para ver una versión más grande de esta figura.
4. Paso de organoides
NOTA: Si la muestra es confluente, cada pocillo organoide se puede pasar semanalmente a dos nuevos pocillos.
- Utilizando una pipeta de 1 ml, añadir 1 ml de medio base organoide (paso 1.3) a cada pocillo y pipetear el medio hacia arriba y hacia abajo directamente sobre las lengüetas del organoide para disociarlo. Recoger todo el medio que contiene los pellets resuspendidos en un tubo cónico de 15 ml.
- Centrifugar el tubo cónico de 15 ml que contiene la mezcla a 1.650 x g durante 5 min a 4 °C. Luego, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur.
- Agregue 1 ml de enzima recombinante libre de origen animal (consulte la Tabla de materiales) a la bolita celular, haga un vórtice de la solución a 458 x g y transfiérala a un tubo de microcentrífuga de 1,5 ml. Dejar que el tubo se incube durante 15 minutos en un baño de agua a 37 °C.
- Después de la incubación, centrifugar a 1.650 x g durante 5 min a 4 °C. Luego, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur.
- Resuspender el pellet en BME.
NOTA: La cantidad de BME se basa en el tamaño del pellet. Se recomienda añadir un 25% de medios base organoides (paso 1.3) con células resuspendidas al 75% de BME. - Colocar la solución celular resuspendida en una placa de 6 pocillos en alícuotas de 40 μL. Planchar hasta cinco alícuotas por pozo. Una vez que todas las alícuotas hayan sido plateadas, coloque inmediatamente la placa del pozo en la incubadora durante 20 minutos. Después de la incubación, añadir suavemente 2 ml de medio organoide completo (paso 1.2) en cada pocillo.
5. Congelación y descongelación de organoides
- Congelación de organoides
- Comience con los pasos 4.1-4.4.
- Resuspender el pellet celular en 0.5-1 ml de medio de congelación de cultivo celular de recuperación (ver Tabla de materiales) y transferir 1 ml a cada criovial.
- Luego, coloque los crioviales en un recipiente lleno de isopropanol a -80 °C durante un máximo de 2 semanas antes de transferirlos a un tanque de nitrógeno líquido para su almacenamiento a largo plazo13.
- Descongelación de organoides
- Retirar las muestras del depósito de nitrógeno líquido y descongelar al baño maría a 37 °C.
- Una vez descongelado, transferir a un tubo cónico de 15 ml y centrifugar a 1.650 x g durante 5 min a 4 °C. Después de la centrifugación, aspire cuidadosamente el sobrenadante con una pipeta de vidrio Pasteur.
- Resuspender el pellet en BME.
NOTA: La cantidad de BME se basa en el tamaño del pellet. Se recomienda añadir un 25% de medios base organoides (paso 1.3) con células resuspendidas al 75% de BME. - Colocar la solución celular resuspendida en una placa de 6 pocillos en alícuotas de 40 μL. Colocar hasta cinco alícuotas por pozo.
- Coloque inmediatamente la placa en la incubadora durante 20 minutos. Después de la incubación, añadir suavemente 2 ml de medio organoide completo (paso 1.2) a los pocillos.
6. Incrustación y generación de portaobjetos fijados en parafina (FFPE) para evaluar la composición organoide
- Después de cultivar organoides durante al menos 10 días para asegurar un tamaño adecuado, retire el medio organoide completo de los pocillos y agregue 1 ml de fijador de paraformaldehído al 2% (PFA). Incubar a temperatura ambiente durante 5-10 min.
- Después de la incubación, lavar las alícuotas de organoides cultivados 3 veces durante 5 min cada vez con 1 ml de PBS.
- Retire el PBS de cada pocillo y agregue 1 ml de agar caliente al 2% en H2O desionizado a cada pocillo. Al agregar el agar, levante las alícuotas organoides cultivadas de la placa con una espátula.
NOTA: Es importante no dejar que el agar se endurezca antes de levantar las alícuotas organoides cultivadas.- Permita que el agar se solidifique en el pozo a temperatura ambiente.
- Usando una espátula pequeña, libere el agar solidificado del pozo y guárdelo en un casete hasta 48 h (consulte la Tabla de materiales) a 4 ° C en etanol al 70% hasta el procesamiento14.
- Incrustar las muestras en parafina 15, cortar los portaobjetos a un espesor de 5 μm y teñir los portaobjetos con tinción de hematoxilina y eosina (H&E, consulte la Tabla de materiales) utilizando un protocolo estándar15.
Resultados
Para generar DOP, las muestras se digirieron mecánica y enzimáticamente en suspensiones unicelulares. Las células se resuspendieron en BME y se complementaron con medios específicamente diseñados (Figura 3). Los organoides se establecen típicamente en un marco de tiempo de 10 días, después de lo cual demuestran organoides discretos en cultivo (Figura 4).

Figura 3: Esquema de colecciones de pacientes formadas en organoides. El tejido del paciente, la ascitis o el líquido pleural se digieren mecánica o enzimáticamente. La suspensión unicelular se coloca en BME, donde el cultivo prolifera con la ayuda de medios de crecimiento especializados adaptados a HGSOC. Haga clic aquí para ver una versión más grande de esta figura.
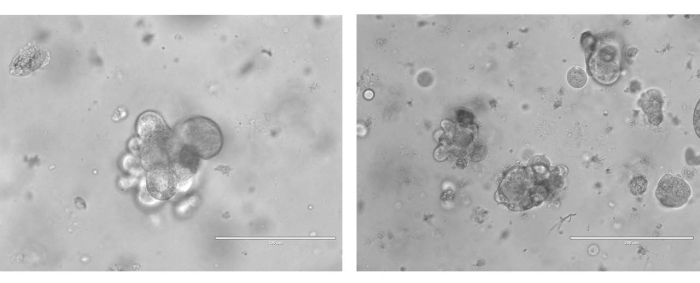
Figura 4: Imágenes representativas de dos organoides únicos de cáncer de ovario derivados de pacientes después de 7 días de crecimiento. Las imágenes del organoide fueron tomadas a 40x. La barra de escala de campo claro en la imagen de la izquierda es de 100 μm y en la imagen de la derecha es de 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
A partir del protocolo presentado, se produjo un biobanco de 23 organoides y se cultivó durante más de 5 meses con paso regular. Las características clínicas de los tumores de origen se presentan en la Tabla 1. La mayoría de los tumores estaban en estadio avanzado (100%), carcinoma seroso de alto grado (92,9%) y tratamiento previo (85,7%).
| N = 23 | |
| Edad (años) | 63,5 ± 9,7 |
| Etapa FIGO III IV Pendiente | 13 (56.5) 9 (39.2) 1 (4.3) |
| Histología Seroso de alto grado Carcinosarcoma Seroso de bajo grado | 21 (92.9) 1 (7.1) 1 (4.3) |
| Mutación BRCA Sí No | 1 (4.3) 22 (95.7) |
| Líneas previas de quimioterapia 0 1-5 ≥5 | 20 (85.7) 0 2 (14.2) |
Tabla 1: Características del biobanco DOP. La tabla contiene las características específicas de los organoides generados utilizando el presente protocolo. Estas características incluyen la edad, el estadio FIGO (Federación Internacional de Ginecología y Obstetricia), la histología, el estado de mutación BRCA (gen BReast CAncer) y las líneas previas de quimioterapia.
Los cultivos de organoides se pueden evaluar incrustando en agarosa y evaluando con H&E (Figura 5).
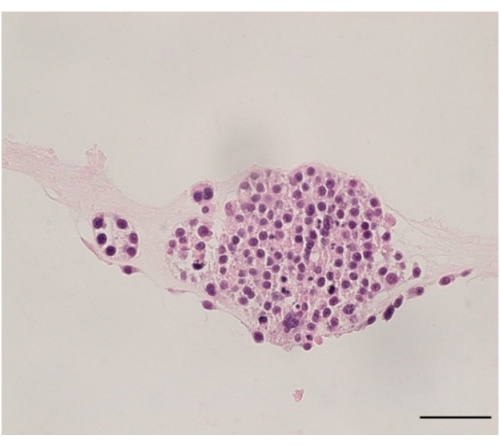
Figura 5: Tinción con hematoxilina y eosina de DOP. Imagen representativa de la tinción H&E de un organoide de cáncer de ovario generado a partir de una muestra de paciente. La imagen fue tomada a 40x, y la barra de escala es de 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El cáncer de ovario es extremadamente mortal debido a su etapa avanzada en el momento del diagnóstico, así como al desarrollo común de resistencia a la quimioterapia. Se han logrado muchos avances en la investigación del cáncer de ovario mediante la utilización de líneas celulares cancerosas y modelos PDX; Sin embargo, existe una necesidad evidente de un modelo in vitro más representativo y asequible. Las PDO han demostrado representar con precisión la heterogeneidad tumoral, el microambiente tumoral y las características genómicas y transcriptómicas de sus tumores primarios y, por lo tanto, son modelos preclínicos ideales para diversos enfoques de investigación, como la implementación de modelos organoides en la terapia farmacológica16.
El protocolo descrito aquí es muy efectivo y confiable, como lo indica la tasa de éxito del 97%. Es importante destacar que el presente protocolo contiene medidas críticas a las que se debe prestar especial atención. En primer lugar, al recolectar organoides del tejido, es esencial asegurarse de que la muestra esté completamente homogeneizada. Esto puede requerir ejecutar el programa de disociación más de una vez si es necesario. Si la muestra no es homogénea, las piezas restantes de tejido pueden comprometer el crecimiento de organoides. En segundo lugar, como la temperatura de trabajo de BME es de 2-8 °C, es importante realizar todos los pasos que involucran este reactivo en hielo para evitar la polimerización. Además, al resuspender y chapar con BME, es crucial evitar burbujas, ya que esto hace que las alícuotas organoides chapadas sean inestables, lo que hace que se desprendan de la placa. Por último, el BME utilizado en este protocolo se generó a partir del tumor Engelbreth-Holm-Swarm (EHS) y, por lo tanto, tiene el potencial de una composición inconsistente entre lotes. Estas diferencias pueden afectar la generación y el crecimiento de organoides. No existe una forma específica de superar esta limitación, ya que los autores desconocen las opciones alternativas de BME17. La investigación futura es necesaria para establecer materiales alternativos para BME o andamios 3D. Dadas todas las consideraciones anteriores, es importante enfatizar que estos métodos deben adaptarse y probarse para diferentes entornos y equipos de laboratorio.
A pesar de los avances que los organoides pueden proporcionar a la investigación del cáncer de ovario, existen limitaciones para la implementación de modelos de organoides. La generación y el mantenimiento de organoides son procesos largos y costosos. La cantidad de tiempo requerido para el crecimiento de organoides permite la introducción de contaminación. Además, la variabilidad del crecimiento requiere una supervisión constante para garantizar que la cantidad de medios disponibles sea suficiente para el desarrollo de organoides y que la contaminación no esté presente. Además, la composición celular de los organoides es variable. Las células inmunes están presentes inicialmente, pero por lo general no persisten más allá del segundo pasaje. Esto puede superarse con la suplementación con citoquinas en los medios de comunicación, pero está fuera del alcance de nuestro trabajo actual. Las células estromales parecen persistir a través del paso, pero los componentes dependen en gran medida de la muestra inicial18,19. Se necesita más trabajo para comprender mejor los componentes celulares exactos y la persistencia de cada tipo de célula. La generación de organoides a partir de pacientes sometidos a varias líneas de quimioterapia es desafiante y problemática. Se necesitan más estudios para comprender el impacto de la quimioterapia en la generación y el desarrollo de organoides. Por último, en nuestra experiencia, el número de organoides generados a partir de una cantidad específica de tejido, ascitis o líquido pleural es impredecible. Por ejemplo, la misma cantidad de tumor, ascitis o líquido pleural recolectado de dos pacientes diferentes dará como resultado diferentes cantidades de organoides. Se están realizando más investigaciones para obtener información sobre los mejores tipos de células para la supervivencia y viabilidad de los organoides.
No obstante, las PDO ofrecen oportunidades únicas para la investigación preclínica en comparación con las líneas celulares y los modelos PDX. Si bien se han logrado avances con respecto al diagnóstico y tratamiento del cáncer de ovario, todavía hay un trabajo significativo por hacer, y las PDO son una herramienta especial necesaria para avanzar en la investigación del cáncer de ovario.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Estamos agradecidos por la orientación de Ron Bose, MD, PhD, y la ayuda de Barbara Blachut, MD, en el establecimiento de este protocolo. También nos gustaría reconocer a la Escuela de Medicina de la Universidad de Washington en el Departamento de Obstetricia y Ginecología de St. Louis y la División de Oncología Ginecológica, al Programa de Becarios del Decano de la Universidad de Washington y al Programa de Desarrollo de Científicos Reproductivos por su apoyo a este proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| 1% HEPES | Life Technologies | 15630080 | |
| 1% Penicillin-Streptomycin | Fisher Scientific | 30002CI | |
| 1.5 mL Eppendorf Tubes | Genesee Scientific | 14125 | |
| 10 cm Tissue Culture Dish | TPP | 93100 | |
| 10 mL Serological Pipet | |||
| 100 µm Cell Filter | MidSci | 100ICS | |
| 15 mL centrifuge tubes | Corning | 430052 | |
| 2 mL Cryovial | Simport Scientific | T301-2 | |
| 2% Paraformaldehyde Fixative | Sigma-Aldrich | ||
| 37 °C water bath | NEST | 602052 | |
| 3dGRO R-Spondin-1 Conditioned Media Supplement | Millipore Sigma | SCM104 | |
| 6 well plates | TPP | 92006 | |
| 70% Ethanol | Sigma-Aldrich | R31541GA | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Advanced DMEM/F12 | ThermoFisher | 12634028 | |
| Agar | Lamda Biotech | C121 | |
| B-27 | Life Technologies | 17504044 | |
| Centrifuge | |||
| Cultrex Type 2 | R&D Systems | 3533-010-02 | basement membrane extract |
| DNase I | New England Bio Labs | M0303S | |
| DNase I Reaction Buffer | New England Bio Labs | M0303S | |
| EGF | PeproTech | AF-100-15 | |
| FBS | Sigma-Aldrich | F2442 | |
| FGF-10 | PeproTech | 100-26 | |
| FGF2 | PeproTech | 100-18B | |
| gentleMACS C Tubes | Miltenyi BioTech | 130-096-334 | |
| gentleMACS Octo Dissociator with Heaters | Miltenyi BioTech | 130-096-427 | We use the manufacturers protocol. |
| GlutaMAX | Life Technologies | 35050061 | dipeptide, L-alanyl-L-glutamine |
| Hematoxylin and Eosin Staining Kit | Fisher Scientific | NC1470670 | |
| Histoplast Paraffin Wax | Fisher Scientific | 22900700 | |
| Microcentrifuge | |||
| Mr. Frosty Freezing Container | Fisher Scientific | 07202363S | |
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| p1000 Pipette with Tips | |||
| p200 Pipette with Tips | |||
| Pasteur Pipettes 9" | Fisher Scientific | 1367820D | |
| PBS | Fisher Scientific | MT21031CM | |
| Pipet Controller | |||
| Prostaglandin E2 | R&D Systems | 2296 | |
| Puromycin | ThermoFisher | A1113802 | |
| Recombinant Murine Noggin | PeproTech | 250-38 | |
| Recovery Cell Culture Freezing Medium | Invitrogen | 12648010 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | |
| ROCK Inhibitor (Y-27632) | R&D Systems | 1254/1 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| T75 Flask | MidSci | TP90076 | |
| Tissue Culture Hood | |||
| Tissue Embedding Cassette | |||
| TrypLE Express | Invitrogen | 12604013 | animal origin-free, recombinant enzyme |
| Type II Collagenase | Life Technologies | 17101015 | |
| Vortex |
Referencias
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Fujii, E., Kato, A., Suzuki, M. Patient-derived xenograft (PDX) models: Characteristics and points to consider for the process of establishment. Journal of Toxicologic Pathology. 33 (3), 153-160 (2020).
- Yang, J., et al. Application of ovarian cancer organoids in precision medicine: Key challenges and current opportunities. Frontiers in Cell and Developmental Biology. 9, 701429 (2021).
- Yang, H., et al. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Karakasheva, T. A., et al. Generation and characterization of patient-derived head and neck, oral, and esophageal cancer organoids. Current Protocols in Stem Cell Biology. 53 (1), 109 (2020).
- Madison, B. B., et al. Let-7 represses carcinogenesis and a stem cell phenotype in the intestine via regulation of Hmga2. PLoS Genetics. 11 (8), 1005408 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Murray, E., et al. HER2 and APC mutations promote altered crypt-villus morphology and marked hyperplasia in the intestinal epithelium. Cellular and Molecular Gastroenterology and Hepatology. 12 (3), 1105-1120 (2021).
- Hill, S. J., et al. Prediction of DNA repair inhibitor response in short-term patient-derived ovarian cancer organoids. Cancer Discovery. 8 (11), 1404-1421 (2018).
- Passarelli, M. C., et al. Leucyl-tRNA synthetase is a tumour suppressor in breast cancer and regulates codon-dependent translation dynamics. Nature Cell Biology. 24 (3), 307-315 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Stumm, M. M., et al. Validation of a postfixation tissue storage and transport medium to preserve histopathology and molecular pathology analyses (total and phosphoactivated proteins, and FISH). American Journal of Clinical Pathology. 137 (3), 429-436 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nanki, Y., et al. Patient-derived ovarian cancer organoids capture the genomic profiles of primary tumours applicable for drug sensitivity and resistance testing. Scientific Reports. 10, 12581 (2020).
- Mead, B. E., et al. Screening for modulators of the cellular composition of gut epithelia via organoid models of intestinal stem cell differentiation. Nature Biomedical Engineering. 6 (4), 476-494 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados