Method Article
Implante Ortotópico de Células Cancerosas Derivadas do Paciente em Camundongos Recapitula o Câncer Colorretal Avançado
Neste Artigo
Resumo
Este protocolo descreve o implante ortotópico de células cancerosas derivadas de pacientes na parede do ceco de camundongos imunodeficientes. O modelo recapitula a doença metastática avançada do câncer colorretal e permite a avaliação de novas drogas terapêuticas em um cenário clinicamente relevante de metástases pulmonares e hepáticas.
Resumo
Na última década, modelos mais sofisticados de câncer colorretal (CCR) pré-clínicos foram estabelecidos usando células cancerosas derivadas do paciente e tumoroides 3D. Uma vez que organoides tumorais derivados do paciente podem manter as características do tumor original, esses modelos pré-clínicos confiáveis permitem o rastreamento de drogas para câncer e o estudo de mecanismos de resistência a drogas. No entanto, a morte relacionada ao CCR em pacientes está associada principalmente à presença de doença metastática. Portanto, é essencial avaliar a eficácia de terapias anticâncer em modelos in vivo relevantes que realmente recapitulem as principais características moleculares da metástase de câncer humano. Estabelecemos um modelo ortotópico baseado na injeção de células cancerosas derivadas do paciente com CCR diretamente na parede do ceco de camundongos. Essas células tumorais desenvolvem tumores primários no ceco que metastatizam para o fígado e pulmões, o que é frequentemente observado em pacientes com CCR avançado. Este modelo de CRC em camundongos pode ser usado para avaliar as respostas a drogas monitoradas por tomografia microcomputadorizada (μCT), um método de imagem em pequena escala clinicamente relevante que pode facilmente identificar tumores primários ou metástases em pacientes. Aqui, descrevemos o procedimento cirúrgico e a metodologia necessária para implantar células cancerosas derivadas do paciente na parede do ceco de camundongos imunodeficientes.
Introdução
O câncer colorretal (CCR) é a segunda causa de morte por câncer nomundo1. A capacidade de gerar modelos tumorais in vitro ou in vivo derivados de células tumorais individuais de pacientes tem avançado a medicina de precisão em oncologia. Na última década, organoides derivados de pacientes (DOPs) ou xenoenxertos (PDXs) têm sido utilizados por muitos grupos de pesquisa em todo omundo2. As DOPs são estruturas multicelulares in vitro que se assemelham às características do tecido tumoral original e podem se auto-organizar e se auto-renovar3. Esses promissores modelos in vitro podem ser usados com sucesso para triagem de fármacos e facilitar a pesquisa translacional. Por outro lado, os modelos PDX recapitulam fielmente o CCR original em todos os níveis relevantes, desde a histologia até as características moleculares e a resposta a drogas 2,4.
In vivo Os modelos PDX são principalmente cultivados como tumores subcutâneos em camundongos imunodeficientes. Usando essa abordagem, PDXs tornaram-se o padrão-ouro na pesquisa do câncer, particularmente para estudar a sensibilidade ou resistência a drogas. No entanto, as mortes relacionadas ao CCR estão principalmente associadas à presença de lesões metastáticas no fígado, no pulmão ou na cavidade peritoneal, e nenhuma das duas abordagens (DOP ou PDX) pode recapitular o quadro clínico avançado. Além disso, demonstrou-se que o sítio específico de crescimento tumoral determina características biológicas importantes que têm impacto na eficácia da droga e no prognóstico dadoença2. Portanto, há uma necessidade urgente de estabelecer modelos pré-clínicos que possam ser usados para avaliar a eficácia de drogas antineoplásicas em um cenário metastático clinicamente relevante6.
Os tomógrafos microcomputadorizados (μCT) podem funcionar como tomógrafos clínicos reduzidos, fornecendo imagens de tumor primário e metástase em camundongos com uma resolução de imagem em escala proporcional à das imagens de TC de pacientes comcâncer7. Para neutralizar o baixo contraste de partes moles da técnica de μCT, agentes de contraste iodados radiológicos podem ser usados para melhorar o contraste e avaliar a carga tumoral. Usando uma abordagem de duplo contraste, iodo oral e intraperitoneal é administrado em diferentes momentos. O contraste administrado por via oral ajuda a definir os limites entre o tecido tumoral e o conteúdo ceco no interior do intestino. Por outro lado, o contraste administrado por via intraperitoneal permite a identificação dos limites externos da massa tumoral, que frequentemente cresce e invade operitônio8.
O manuscrito descreve um protocolo para realizar implante ortotópico de células cancerosas derivadas de pacientes na parede do ceco de camundongos imunodeficientes e a metodologia para monitorar o crescimento de tumores intestinais usando a tomografia computadorizada. O presente artigo mostra que o modelo recapitula o cenário clínico de tumores intestinais avançados e doença metastática em pacientes com CCR que não podem ser estudados usando modelos DOP ou PDXO. Uma vez que os modelos PDX ortotópicos de CCR recapitulam o cenário clínico de pacientes com CCR, concluímos que eles são os melhores até o momento para testar a eficácia de drogas antitumorais em tumores intestinais avançados e doença metastática.
Protocolo
Consentimento informado foi obtido de todos os pacientes. O projeto foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Vall d'Hebron, Barcelona, Espanha (parecer ID: PR(IR)79/2009 PR(AG)114/2014, PR(AG)18/2018). Amostras de tecido colônico humano consistiram de biópsias de áreas não necróticas de adenocarcinomas primários ou metástases hepáticas, correspondendo a pacientes com câncer de cólon e reto submetidos à ressecção tumoral. Os experimentos foram conduzidos seguindo a diretriz de cuidados com animais da União Europeia (86/609/CEE) e aprovados pelo Comitê de Ética em Experimentação Animal do VHIR - Instituto de Pesquisa Vall d'Hebron (ID: 40/08 CEEA, 47/08/10 CEEA e 12/18 CEEA).
NOTA: Fêmea NOD-SCID (NOD. CB17-Prkdcscid/NcrCrl) camundongos de 8 semanas de idade foram comprados do Charles River Laboratories.
1. Derivação de células do paciente
- Extração tumoral
NOTA: O procedimento a seguir é realizado em um gabinete biológico à temperatura ambiente (TR) no biotério.- Obter amostras tumorais de cirurgias ou biópsias dos pacientes e de PDXs crescendo subcutaneamente em camundongos.
- Para a injeção ortotópica, preparar as células tumorais a partir de modelos estabelecidos de tumor PDX subcutâneo em vez de tecido obtido diretamente dospacientes9.
- Gerar tumores PDX inoculando uma suspensão de 1 x 105 células tumorais em solução salina tamponada com fosfato (PBS) (50 μL) misturada com matriz de Matrigel (50 μL) por via subcutânea no flanco de camundongos NOD-SCID2.
- Medir o crescimento do tumor usando um paquímetro a cada dois dias.
NOTA: É importante ressaltar que nosso laboratório gerou um biobanco de mais de 350 modelos PDX. Os modelos tumorais de CRC-PDX utilizados no protocolo são modelos PDX estabelecidos em laboratório que foram amplificados mais de três passagens em camundongos, e passaram os critérios de inclusão/exclusão com resultado positivo (Tabela 1).
- Medir o crescimento do tumor usando um paquímetro a cada dois dias.
- Eutanásia dos camundongos por deslocamento cervical quando os tumores subcutâneos atingirem o tamanho máximo estabelecido pelo CEEA (1 cm de diâmetro), ou quando os animais atingirem os critérios de desfecho.
- Extrair o tumor e removê-lo cuidadosamente da pele e tecido não tumoral circundante usando tesoura e pinça.
- Armazenar os tumores colhidos em PBS a 4 °C até a próxima etapa.
NOTA: Dissociar os tumores em suspensão celular o mais rápido possível após a remoção de sua localização original nas lesões dos pacientes ou xenoenxertos subcutâneos em camundongos. A viabilidade celular é significativamente reduzida 24 h após a remoção do tecido, resultando em uma implantação ineficiente em camundongos receptores.
- Preparação celular
NOTA: O procedimento a seguir é realizado em um gabinete biológico à temperatura ambiente (TR) na sala de cultura de tecidos.- Dissociar os tumores usando uma lâmina em uma placa de cultura de 10 cm com 1 mL de meio CoCSCM 6Ab completo (Tabela 2) (para facilitar a picagem). Colocar a amostra dissociada homogénea num tubo cónico de 15 ml.
- Adicionar o meio CoCSCM 6Ab completo a um volume final de 5 mL (não usar mais de 3 mL de amostra dissociada no mesmo tubo).
NOTA: O CCR primário ressecado de pacientes está naturalmente contaminado com bactérias e fungos. É essencial remover patógenos presentes na amostra original do paciente usando um coquetel de seis antibióticos (penicilina, estreptomicina, fungizona, canamicina, gentamicina e nistatina). A injeção de células tumorais contaminadas com bactérias em camundongos imunodeficientes pode resultar em morte animal. - Incubar com 50 μL de DNase I (0,08 kU/mL) e 50 μL de colagenase (1,5 mg/mL) (meio de digestão; Tabela 2) durante 1 h a 37 °C numa incubadora de cultura celular, a uma posição de 45°. Misturar bem a solução a cada 15 minutos com uma pipeta de 5 mL antes da incubação.
NOTA: Dissociar o tecido tumoral e digeri-lo por pipetagem várias vezes para obter uma solução de célula única. Isso é essencial para contar as células antes de injetar em camundongos receptores e, portanto, conseguir uma implantação homogênea de células tumorais. - Adicione 5 mL do meio completo de CoCSCM 6Ab e misture bem com uma pipeta de 5 mL.
- Classificar a solução com um filtro celular de 100 μm usando um novo tubo estéril de 50 mL.
- Gire as células classificadas a 500 x g por 8 min no TR.
- Aspirar o sobrenadante.
- Ressuspender o pellet em 3 mL de solução tampão de lise 1x hemácias.
- Incubar por 10 min no TR.
- Adicionar 3 mL de meio CoCSCM 6Ab completo, pipetar a amostra e girar a 500 x g por 10 min no TR.
- Ressuspender o pellet com 5-10 mL de meio CoCSCM 6Ab completo e usar um contador de células para calcular o número total de células.
- Girar as células a 500 x g por 10 min em TR e ressuspender em 10 mL de PBS.
- Ressuspender o pellet para obter uma concentração de 20 x 106 células/mL, e misturar bem para obter uma suspensão celular homogênea.
- Preparar seringas de 29 G (agulha 0,5 mL U 100, 0,33 mm [29 G] x 12,7 mm) para injeção de ceco na cultura de tecidos (uma seringa/camundongo). Coloque 50 μL da suspensão de células tumorais (1 x 106 células/injeção) na seringa e mantenha-a congelada. Certifique-se de que as bolhas de ar são removidas da suspensão celular.
NOTA: A eliminação de bolhas de ar quando as células tumorais são carregadas na seringa é essencial para evitar a injeção de um volume excessivo na parede do ceco, o que poderia resultar em ruptura tecidual e perda de amostra. É imperativo misturar bem a suspensão celular ao carregar a seringa para evitar o tamanho irregular do tumor entre camundongos no mesmo experimento.
2. Injeção ortotópica no ceco
NOTA: O procedimento a seguir é realizado em uma bancada em uma sala específica livre de patógenos (SPF) no biotério. Os equipamentos utilizados são previamente limpos e esterilizados. Além disso, é esterilizado novamente em um esterilizador portátil entre indivíduos ou zonas no biotério.
- Limpe o local cirúrgico pulverizando com detergente desinfetante e limpando.
- Depilar o abdômen de camundongos usando uma máquina de depilação de camundongos.
- Coloque o rato em decúbito dorsal. Utilizar isoflurano a 2% para anestesiar o animal. Confirme o efeito da anestesia beliscando suavemente a extremidade e observando a ausência de estimulação.
- Coloque uma gota de 50-100 μL de pomada veterinária (3 mg/g Lacryvisc) nos olhos para evitar o ressecamento durante a anestesia.
- Desinfete o abdome de camundongos esfregando com clorexidina ou iodopovidona várias vezes em movimento circular.
- Faça uma incisão longitudinal de 1 cm sobre o abdome inferior usando tesoura cirúrgica. Separe cuidadosamente a pele para cada local para apresentar o peritônio que está sob a pele.
- Faça uma incisão de 0,5-1 cm na membrana do peritônio, grande o suficiente para exteriorizar o ceco.
OBS: Exteriorizar o ceco sem manipular excessivamente os órgãos internos, o que poderia aumentar drasticamente a letalidade do procedimento. - Isole cuidadosamente o ceco do rato utilizando uma gaze pré-cortada e estéril.
- Umedeça o ceco com soro fisiológico durante todo o procedimento.
- Imobilizar o ceco segurando-o cuidadosamente com pinça e introduzir a agulha superficialmente na parede do ceco. Evite capilares e vasos no local da injeção. Remova as bolhas da suspensão celular.
- Injetar os 50μL inteiros da suspensão de células tumorais lentamente. Geralmente leva cerca de 10 s para administrar. Evite perfurar o lúmen do ceco com a agulha, pois isso resulta na eliminação da suspensão de células tumorais do corpo através do peristaltismo intestinal.
NOTA: Injetar a suspensão de células tumorais no ceco dos camundongos é a etapa mais desafiadora de todo o procedimento. Uma luz brilhante focada no local da injeção e uma lupa de aumento devem ser usadas nesta parte do protocolo. Introduzir a agulha paralelamente à superfície do ceco. O ceco é um tecido muito frágil; Portanto, a imobilização do ceco deve ser realizada com pinça cirúrgica e aplicação de pressão suave para evitar ruptura tecidual resultando em hemorragia. O sucesso da implantação resulta em uma bolha branca (pastilha de células) na parede do ceco. Se a bolha não puder ser visualizada, pode indicar que o ceco foi perfurado e as células terminaram no lúmen do ceco, resultando em sua depuração pelo trato intestinal. - Após a injeção, remova lentamente a agulha do ceco e aplique uma pressão suave no local da injeção com um aplicador com ponta de algodão, para evitar que as células tumorais escapem e reduzir o sangramento leve.
- Limpe o ceco com solução salina para remover quaisquer detritos.
- Devolva o ceco de volta para o abdômen do animal.
- Fechar o peritônio com pontos 5/0.
- Feche a pele do abdome com pontos 5/0.
- Administrar antibióticos no pós-operatório (100 mg/kg de amoxicilina ou 20 mg/kg de enrofloxacina) e analgésicos (5 mg/mL de metacam/meloxicam) por injeção subcutânea. Coloque os ratos em uma almofada de aquecimento e mantenha-os lá até que tenham se recuperado totalmente. Em seguida, devolva-os à gaiola com outros animais.
3. Avaliação do crescimento do tumor ortotópico pela μCT
NOTA: O procedimento a seguir é realizado na plataforma de imagem pré-clínica (PIP) da instalação animal.
- Realizar todos os procedimentos com animais seguindo as normas do comitê de ética institucional.
- Iniciar o monitoramento do volume tumoral por μCT 2 semanas após a injeção das células e, posteriormente, a cada semana.
- Diluir recentemente o contraste iopamiro (300 mg/mL) em solução salina, na proporção de 3:1 para ambas as doses. Administrar 300 mL de iopamiro por gavagem oral.
NOTA: Devido ao baixo contraste de partes moles da μCT, um agente de contraste é recomendado para melhorar a sensibilidade da técnica. O protocolo inclui a administração oral de um agente à base de iodo (iopamiro) para delimitar a carga tumoral intraluminal e a administração intraperitoneal secundária do mesmo agente para definir a carga tumoral na face visceral do intestino. Experimentos piloto foram realizados anteriormente para determinar o tempo exato que o agente de contraste precisa para chegar ao ceco de camundongos antes de sua eliminação. No caso do iopamiro, é em torno de 2 h. - Após 2 h, administrar uma injeção intraperitoneal de 300 mL de iopamiro previamente diluído. A administração ajuda a definir os limites do tumor na face parietal.
- Anestesiar os animais com isoflurano a 2%.
- Após confirmar que o animal está corretamente anestesiado apertando o pé do camundongo, coloque-o no leito de varredura do μCT. A melhor posição é supina (de bruços).
- No software de controle, inicie o modo ao vivo (modo fluoroscopia) para colocar a área abdominal no campo de visão (FOV) do scanner. Para isso, mova o leito para frente e para trás e lateralmente até atingir a posição desejada. Gire o tubo de raios X e o detector a 90° e mova o leito de varredura no eixo y para centralizar completamente o animal.
- Use os seguintes parâmetros para as imagens de μCT: FOV de 30 mm, 26 s de tempo de aquisição, 90 kV de tensão de corrente e 200 μA de amperagem de corrente, usando um sistema de imagem FX μCT.
- Devolva os animais às suas gaiolas para recuperação quando a varredura terminar. Fornecer suporte térmico e monitorar os animais até que eles se recuperem da anestesia antes de retornar ao alojamento.
- A aquisição do μCT produz um arquivo de 250 Mb para cada exame. Os arquivos de dados criados têm um formato VOX. A fim de torná-los acessíveis para qualquer software de análise de imagem, converta os arquivos para o formato DICOM usando o software de gerenciamento de banco de dados do μCT. Armazene o lote de arquivos criados em um disco rígido portátil para analisá-los usando qualquer computador com software de imagem disponível.
NOTA: Durante a análise de imagem, o ceco está localizado como um intestino dilatado com um conteúdo radiodenso (iopamiro), frequentemente no lado esquerdo do abdome caudal. Na flexura visceral do ceco, observa-se espessamento parietal em relação às regiões intestinais adjacentes. O espessamento corresponde ao crescimento tumoral. - Uma vez localizado o tumor, encontrar o maior diâmetro nas diferentes incidências (axial, coronal e sagital). Medir esses três eixos e calcular o volume tumoral seguindo a fórmula elipsoide: volume = 4/3π x (semieixo x semieixo x semieixo y x semieixo z)10.
4. Intervenção terapêutica em camundongos portadores de tumores ortotópicos
- Monitorar os camundongos portadores de tumores ortotópicos semanalmente.
- Quando um sinal de μCT tumoral é detectado na maioria dos camundongos, realize outra μCT na semana seguinte para confirmar a presença do tumor.
NOTA: O tempo para iniciar o tratamento depende do modelo PDX utilizado, e varia de 3 a 12 semanas após a inoculação de células tumorais no ceco. - Randomizar os camundongos em quatro grupos: um grupo veículo (n = 10-15 camundongos), um grupo de drogas de teste (n = 10-15 camundongos), um grupo de quimioterapia padrão de tratamento (n = 10-15 camundongos) e um grupo de tratamento combinado (n = 10-15 camundongos).
- Tratar os ratinhos por via intraperitoneal com solução salina (grupo veículo), o fármaco de teste (20 mg/kg) (grupo de droga de teste), irinotecano (50 mg/kg) (grupo de tratamento padrão) ou o medicamento de teste (20 mg/kg) com irinotecano (50 mg/kg) (grupo de tratamento combinado). Realizar a administração uma vez por semana até o final do experimento.
- Monitorar o crescimento do tumor semanalmente por μCT durante todo o curso do experimento.
- Ao final do experimento, eutanasiar os camundongos por deslocamento cervical e coletar fígados, pulmões e quaisquer outras possíveis lesões em outros órgãos.
- Incluir as amostras de tecido em e incubá-las em formalina a 4% durante a noite. Use o tecido do intestino de um camundongo sem um tumor no ceco como controle.
- Retire os da formalina e incube com etanol 70% por pelo menos 3 h.
- Embutir as com parafina, utilizando-se protocolos padrão de instalações histopatológicas.
- Realizar coloração de hematoxilina e eosina (H&E) do ceco, fígado e pulmão, utilizando protocolos padrão de instalações de histopatologia.
Resultados
Camundongos implantados ortotopicamente com células cancerosas derivadas do paciente foram monitorados semanalmente por μCT. Ao final do experimento, os animais foram eutanasiados. Intestinos, cecos (Figura 1A,B), fígados, pulmões e qualquer outra possível lesão foram coletados, incluídos em um e fixados com formalina a 4% durante a noite. Tecido intestinal de camundongo sem tumor no ceco foi utilizado como controle (Figura 1C). Finalmente, as foram trocadas para etanol 70% por pelo menos 3 h e a parafina embutida. As colorações de hematoxilina e eosina (H&E) do ceco, fígado e pulmões foram realizadas utilizando-se protocolos padrão de instalações histopatológicas para identificar células tumorais (Figura 2, Figura 3 e Figura 4).
Em outro experimento, camundongos portadores de tumores ortotópicos foram monitorados semanalmente. Quando um sinal de μCT tumoral foi detectado na maioria dos camundongos (cerca de 2-4 semanas, dependendo do modelo PDX), os animais foram randomizados em quatro grupos e tratados com o veículo, a droga teste (20 mg/kg), a quimioterapia padrão irinotecana (50 mg/kg) ou a droga teste com irinotecano. Os fármacos foram administrados por via intraperitoneal uma vez por semana até o final do experimento. O crescimento tumoral foi monitorado semanalmente por μCT durante todo o experimento. Os resultados indicaram que a droga teste induziu uma redução do volume tumoral, calculado pelas imagens de μCT, e que foi aumentada em combinação com o tratamento com irinotecano (Figura 5 e Figura 6).
Estudos prévios em nosso laboratório demonstraram que o potencial metastático (carcinomatose, metástase pulmonar e hepática) dos modelos ortotópicos de CRC-PDX depende do modelo PDX utilizado (Tabela 3)2. No presente estudo, a eficácia terapêutica na formação de metástases também foi avaliada. Os resultados indicaram que a droga teste, irinotecano, e a combinação erradicaram a formação de metástases pulmonares e hepáticas em camundongos tratados (Tabela 4)11.

Figura 1: Imagens macroscópicas do intestino de camundongos portadores de tumores ortotópicos CRC-PDX. Imagens macroscópicas do intestino de dois camundongos portadores de tumor ortotópico PDX (A,B) ao final do experimento. Os tumores cecos são definidos em vermelho nas imagens. (C) Imagem intestinal de um camundongo sem tumor no ceco como controle. Barras de escala = 5 mm (A,B); 1 cm (C). Clique aqui para ver uma versão maior desta figura.
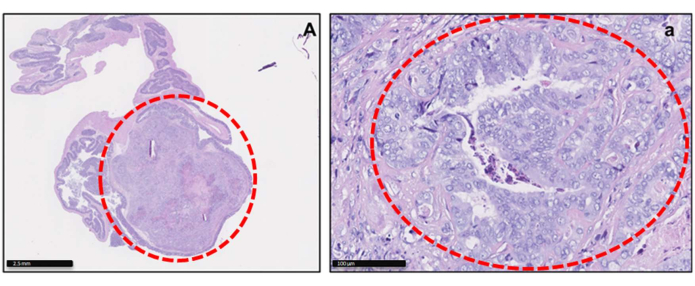
Figura 2: Imagens histológicas dos tumores ortotópicos do CRC-PDX. Coloração H&E de um modelo de tumor PDX no ceco ao final do experimento em baixa (A) e alta (a) magnificação. Os tumores cecos são definidos em vermelho nas imagens. Barras de escala = 2,5 mm (A); 100 mm (a). Clique aqui para ver uma versão maior desta figura.

Figura 3: Imagens histológicas de metástase pulmonar derivadas da coloração H&E do tumor CRC-PDX ortotópico de um pulmão de um camundongo com um tumor PDX ortotópico. Metástases pulmonares podem ser observadas em aumentos baixos (A) e altos (a). As metástases pulmonares são definidas em vermelho nas imagens. Barras de escala = 250 mm (A); 100 mm (a). Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagens histológicas de metástases hepáticas derivadas de tumores ortotópicos de CRC-PDX. Coloração H&E de um fígado de um camundongo com um tumor PDX ortotópico. Metástases hepáticas podem ser observadas em aumentos baixos (A) e altos (a). Metástases hepáticas são definidas em vermelho nas imagens. As barras de escala são indicadas nas imagens. Barras de escala = 500 mm (A); 50 mm (a). Clique aqui para ver uma versão maior desta figura.
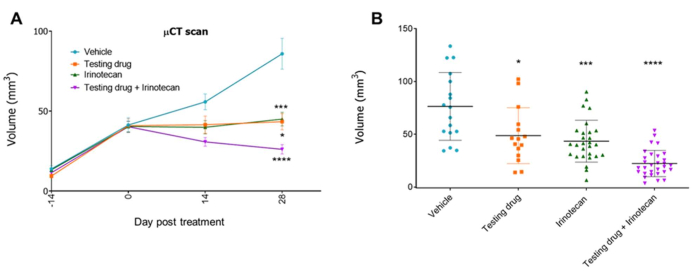
Figura 5: Eficácia terapêutica de um fármaco teste em um modelo ortotópico de CRC-PDX. Exemplo de experimento com quatro grupos (veículo, droga teste, irinotecano e droga teste com irinotecano)11. O volume tumoral obtido das imagens de μCT é representado ao longo do tempo (A) e ao final do experimento (dia 42) (B). Barras, ± SE (n = 15-30) e *p < 0,05, ***p < 0,001, ****p < 0,0001 versus veículo (teste t, frente e verso). Clique aqui para ver uma versão maior desta figura.

Figura 6: Imagens de μCT de camundongos portadores de tumores ortotópicos CRC-PDX em tratamento. Imagens representativas de μCT de camundongos portadores de tumores ortotópicos tratados com uma droga terapêutica. O ceco (vermelho) e a massa tumoral (azul) são definidos nas imagens. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Estabelecimento do PDX subcutâneo. Exemplo de três modelos PDX estabelecidos em laboratório (P1, P2 e P3) do nosso biobanco2 de mais de 350 modelos PDX com o número de células inoculadas, a incidência de estabelecimento de PDX e as passagens em camundongos. Clique aqui para baixar esta tabela.
Tabela 2: Reagentes para preparar os fatores de crescimento (GF) MIX 10X, o CoCSCM 6Ab sem EGF, FGF2 e fatores de crescimento, o meio completo de CoCSCM 6Ab e o meio de digestão. Clique aqui para baixar esta tabela.
Tabela 3: Potencial metastático dos modelos ortotópicos de CRC-PDX. Exemplo de três modelos ortotópicos de CRC-PDX estabelecidos em laboratório (P1, P2 e P3) do nosso biobanco2. Aqui, o número de células inoculadas, a incidência de formação de tumor de ceco e a incidência de gerar carcinomatose, metástase pulmonar ou metástase hepática são indicados. Clique aqui para baixar esta tabela.
Tabela 4: Eficácia terapêutica metastática de uma droga teste em um modelo ortotópico de CRC-PDX. Exemplo de experimento com quatro grupos (veículo, droga teste, irinotecano e droga teste com irinotecano)11. Aqui, o número de camundongos em cada grupo e quais deles desenvolveram carcinomatose, metástase pulmonar ou metástase hepática ao final do experimento são indicados. Clique aqui para baixar esta tabela.
Discussão
Nas últimas décadas, muitas novas terapias antineoplásicas têm sido desenvolvidas e testadas em pacientes com diferentes tipos de tumores, incluindo o câncer colorretal (CCR). Embora resultados promissores em modelos pré-clínicos tenham sido observados em muitos casos, a eficácia terapêutica em pacientes com CCR metastático avançado tem sido frequentemente limitada. Portanto, há uma necessidade urgente de modelos pré-clínicos que permitam testar a eficácia de novas drogas terapêuticas em um cenário metastático clinicamente relevante.
O manuscrito descreve em detalhes um modelo PDX ortotópico avançado de CCR baseado na implantação de células tumorais de pacientes na parede do ceco de camundongosimunodeficientes12.
A metodologia é demorada e exige concentração. Em média, a injeção de um experimento com 30 camundongos pode levar cerca de 11 h no total, incluindo: 1) coleta de tumor PDX (1 h); processamento tumoral (4 h); e implante de ceco (6 h). O procedimento deve ser realizado em condições estéreis, minimizando o tempo de processamento e injeção do tumor, enquanto manipula os órgãos internos com muito cuidado para evitar mortalidade relacionada à cirurgia. Portanto, é altamente recomendável que vários experimentos piloto sejam realizados com linhagens de células tumorais ou células PDX, para treinar os pesquisadores e familiarizá-los com o procedimento. Além disso, dois pesquisadores devem estar envolvidos no procedimento, um para coletar e processar o tumor, bem como ajudar com as suturas dos animais, e o outro para realizar a cirurgia real.
Também é importante considerar que os tumores do ceco podem crescer no lúmen do intestino ou dentro do ceco, dependendo do modelo PDX e do local específico da injeção. O resultado do crescimento do tumor é difícil de controlar e pode afetar drasticamente a sobrevivência dos camundongos, resultando em tumores menores e uma obstrução intestinal grave quando os tumores crescem dentro do lúmen. Os camundongos devem, portanto, ser monitorados semanalmente, a partir da semana após a implantação celular. Uma vez que a maioria dos camundongos apresenta sinal tumoral pela μCT, os animais sem sinal devem ser excluídos, e os demais randomizados em grupos experimentais com base no volume tumoral. Para obter resultados estatisticamente significativos, cada grupo experimental deve incluir de 12 a 15 camundongos.
O monitoramento de camundongos portadores de tumor é essencial para determinar a eficácia de novos agentes terapêuticos em modelos ortotópicos clinicamente relevantes. A μCT permite a identificação e quantificação do volume do tumor primário em camundongos. O uso de duplo contraste aumenta significativamente a sensibilidade da técnica de μCT, melhorando a qualidade das imagens8. O crescimento de células tumorais no ceco pode levar a tumores intraluminais se crescerem em direção ao lúmen do intestino, ou tumores extraluminais se crescerem fora do lúmen do intestino. Ambos os cenários foram observados com a metodologia anterior, e dependem do modelo PDX utilizado e do local de injeção. Os camundongos se recuperaram completamente do exame, sem evidência clínica de dano renal ou outras incidências. Os resultados mostram que a μCT pode ser uma ferramenta útil para monitorar o desenvolvimento e o crescimento longitudinal do CCR.
Modelos ortotópicos recapitulam com precisão o CCR clínico12 e são muito úteis para testar o efeito de novas drogas terapêuticas no crescimento do tumor primário e nas metástases hepáticas e pulmonares 2,11. No entanto, um protocolo escrito detalhado pode não ser suficiente para que um novo grupo de pesquisa estabeleça modelos tão complexos. Em resposta, o presente vídeo tem como objetivo orientar os grupos de pesquisa a implementarem esse procedimento em suas pesquisas. Mostra o procedimento de implantação de células na parede do ceco de camundongos imunodeficientes e a metodologia para monitorar o crescimento do tumor intestinal usando a μCT scanning.
Divulgações
Nenhum.
Agradecimentos
Agradecemos à Fundação Cellex , à rede CIBERONC e ao Instituto de Salud Carlos III pelo apoio. Além disso, agradecemos também à plataforma de imagem pré-clínica do Vall d'Hebron Research Institute (VHIR), onde os experimentos foram realizados.
Materiais
| Name | Company | Catalog Number | Comments |
| REAGENT | |||
| Apo-Transferrin | MERCK LIFE SCIENCE S.L.U. | T1147-500MG | |
| B27 Supplement | Life Technologies S.A (Spain) | 17504044 | |
| Chlorhexidine Aqueous Solution 2% | DH MATERIAL MÉDICO, S.L. | 1111696250 | |
| Collagenase | MERCK LIFE SCIENCE S.L.U. | C0130-500MG | |
| D-(+)-Glucose | MERCK LIFE SCIENCE S.L.U. | G6152 | |
| DMEM /F12 | LIFE TECHNOLOGIES S.A. | 21331-020 | |
| DNase I | MERCK LIFE SCIENCE S.L.U. | D4263-5VL | |
| EGF | PEPRO TECH EC LTD. | AF-100-15-500 µg | |
| FGF basic | PEPRO TECH EC LTD. | 100-18B | |
| Fungizone | Life Technologies S.A (Spain) | 15290026 | |
| Gentamycin | LIFE TECHNOLOGIES S.A. | 15750037 | |
| Heparin Sodium Salt | MERCK LIFE SCIENCE S.L.U. | H4784-250MG | |
| Insulin | MERCK LIFE SCIENCE S.L.U. | I9278-5ML | |
| Iopamiro | |||
| Isoflurane | - | - | |
| Kanamycin | LIFE TECHNOLOGIES S.A. | 15160047 | |
| L-Glutamine | LIFE TECHNOLOGIES S.A. | 25030032 | |
| Matrigel Matrix | CULTEK, S.L.U. | 356235/356234/354234 | |
| Metacam, 5 mg/mL | - | - | |
| Non-essential amino acids | LIFE TECHNOLOGIES S.A. | 11140035 | |
| Nystatin | MERCK LIFE SCIENCE S.L.U. | N4014-50MG | |
| Pen/Strep | Life Technologies S.A (Spain) | 15140122 | |
| Phosphate-buffered saline (PBS), sterile | Labclinics S.A | L0615-500 | |
| Progesterone | MERCK LIFE SCIENCE S.L.U. | P0130-25G | |
| Putrescine | MERCK LIFE SCIENCE S.L.U. | P5780-5G | |
| RBC Lysis Buffer | Labclinics S.A | 00-4333-57 | |
| Sodium Pyruvate | LIFE TECHNOLOGIES S.A. | 11360039 | |
| Sodium Selenite | MERCK LIFE SCIENCE S.L.U. | S5261-25G | |
| ESSENTIAL SUPPLIES | |||
| 8 weeks-old NOD.CB17-Prkdcscid/NcrCrl mice | - | - | |
| BD Micro-Fine 0.5 ml U 100 needle 0.33 mm (29G) x 12.7 mm | BECTON DICKINSON, S.A.U. | 320926 | |
| Blade #24 | - | - | |
| Cell Strainer 100 µm | Cultek, SLU | 45352360 | |
| Forceps and Surgical scissors | - | - | |
| Heating pad | - | - | |
| Lacryvisc, 3 mg/g, ophthalmic gel | - | - | |
| Surfasafe | - | - | |
| Suture PROLENE 5-0 | JOHNSON&JOHNSON S, A. | 8720H | |
| EQUIPMENT/SOFTWARE | |||
| Quantum FX µCT Imaging system | Perkin Elmer | Perkin Elmer | http://www.perkinelmer.com/es/product/quantum-gx-instrument-120-240-cls140083 |
Referências
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Puig, I., et al. A personalized preclinical model to evaluate the metastatic potential of patient-derived colon cancer initiating cells. Clinical Cancer Research. 19 (24), 6787-6801 (2013).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nature Reviews. Cancer. 17 (4), 254-268 (2017).
- Vatandoust, S., Price, T. J., Karapetis, C. S. Colorectal cancer: Metastases to a single organ. World Journal of Gastroenterology. 21 (41), 11767-11776 (2015).
- Cespedes, M. V., et al. Orthotopic microinjection of human colon cancer cells in nude mice induces tumor foci in all clinically relevant metastatic sites. The American Journal of Pathology. 170 (3), 1077-1085 (2007).
- Durkee, B. Y., Weichert, J. P., Halberg, R. B. Small animal micro-CT colonography. Methods. 50 (1), 36-41 (2010).
- Boll, H., et al. Double-contrast micro-CT colonoscopy in live mice. International Journal of Colorectal Disease. 26 (6), 721-727 (2011).
- O'Brien, C. A., Pollett, A., Gallinger, S., Dick, J. E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 445 (7123), 106-110 (2007).
- Jensen, M. M., Jorgensen, J. T., Binderup, T., Kjaer, A. Tumor volume in subcutaneous mouse xenografts measured by microCT is more accurate and reproducible than determined by 18F-FDG-microPET or external caliper. BMC Medical Imaging. 8, 16 (2008).
- Herpers, B., et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR x LGR5 bispecific antibody with efficacy in epithelial tumors. Nature Cancer. 3 (4), 418-436 (2022).
- Chicote, I., Camara, J. A., Palmer, H. G. Advanced colorectal cancer orthotopic patient-derived xenograft models for cancer and stem cell research. Methods in Molecular Biology. 2171, 321-329 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados