Method Article
생쥐에서 환자 유래 암세포의 정형외피 이식은 진행성 대장암을 재현합니다.
요약
이 프로토콜은 면역 결핍 마우스의 맹장벽에 환자 유래 암세포의 orthotopic 이식을 설명합니다. 이 모델은 진행성 대장암 전이성 질환을 요약하고 폐 및 간 전이에 대한 임상적으로 관련된 시나리오에서 새로운 치료 약물을 평가할 수 있도록 합니다.
초록
지난 10년 동안 환자 유래 암세포와 3D 종양체를 사용하여 보다 정교한 전임상 대장암(CRC) 모델이 확립되었습니다. 환자 유래 종양 오가노이드는 원래 종양의 특성을 유지할 수 있기 때문에 이러한 신뢰할 수 있는 전임상 모델을 통해 항암제 스크리닝 및 약물 내성 메커니즘 연구를 수행할 수 있습니다. 그러나 환자의 CRC 관련 사망은 대부분 전이성 질환의 존재와 관련이 있습니다. 따라서 인간 암 전이의 주요 분자적 특징을 진정으로 재현하는 관련 in vivo 모델에서 항암 요법의 효능을 평가하는 것이 필수적입니다. CRC 환자 유래 암세포를 마우스의 맹장벽에 직접 주입하는 것을 기반으로 한 orthotopic 모델을 구축했습니다. 이 종양 세포는 간과 폐로 전이되는 맹장에서 원발성 종양을 발생시키며, 이는 진행성 CRC 환자에서 자주 관찰됩니다. 이 CRC 마우스 모델은 환자의 원발성 종양 또는 전이를 쉽게 식별할 수 있는 임상적으로 관련된 소규모 이미징 방법인 마이크로 컴퓨터 단층 촬영(μCT)으로 모니터링되는 약물 반응을 평가하는 데 사용할 수 있습니다. 여기에서는 면역 결핍 마우스의 맹장 벽에 환자 유래 암세포를 이식하는 수술 절차와 필요한 방법론을 설명합니다.
서문
대장암(CRC)은 전 세계적으로 암 사망의 두 번째 주요 원인입니다1. 개별 환자 종양 세포에서 파생된 체외 또는 생체 내 종양 모델을 생성할 수 있는 능력은 종양학 분야의 정밀 의학을 발전시켰습니다. 지난 10년 동안 환자 유래 오가노이드(PDO) 또는 이종이식(PDX)은 전 세계의 많은 연구 그룹에서 사용되었습니다2. PDO는 원래 종양 조직의 특징과 유사한 다세포 체외 구조로, 자가 조직화와 자가 재생이 가능하다3. 이러한 유망한 in vitro 모델은 약물 스크리닝 및 중개 연구 촉진에 성공적으로 사용될 수 있습니다. 반면, PDX 모델은 조직학에서 분자 형질 및 약물 반응 2,4에 이르기까지 모든 관련 수준에서 원래의 CRC를 충실하게 재현합니다.
생체 내 PDX 모델은 대부분 면역 결핍 마우스에서 피하 종양으로 성장합니다. 이 접근법을 사용하여 PDX는 암 연구, 특히 약물 민감도 또는 내성 연구에서 황금 표준이 되었습니다. 그러나 CRC 관련 사망은 대부분 간, 폐 또는 복막강의 전이성 병변의 존재와 관련이 있으며, 두 가지 접근법(PDO 또는 PDX) 중 어느 것도 진행된 임상 환경을 재현할 수 없습니다. 또한, 종양 성장의 특정 부위는 약물 효능 및 질병 예후에 영향을 미치는 중요한 생물학적 특성을 결정하는 것으로 나타났다2. 따라서 임상적으로 유의미한 전이성 환경에서 항암제의 효능을 평가하는 데 사용할 수 있는 전임상 모델 구축이 시급하다6.
마이크로 컴퓨터 단층 촬영(μCT) 스캐너는 축소된 임상 CT 스캐너로 기능할 수 있으며, 암 환자의 CT 영상에 비례하는 확대된 이미지 해상도로 생쥐의 원발성 종양 및 전이 영상을 제공할 수 있다7. μCT 기법의 열악한 연조직 조영제를 상쇄하기 위해 방사선 요오드화 조영제를 사용하여 조영제를 개선하고 종양 부담을 평가할 수 있습니다. 이중 조영제 접근법을 사용하여 구강 및 복강 내 요오드를 서로 다른 타이밍에 투여합니다. 경구로 투여된 조영제는 종양 조직과 장 내 맹장 함량 사이의 한계를 정의하는 데 도움이 됩니다. 다른 한편으로는, 복강내로 투여된 조영제는 종양 덩어리의 외부 한계를 식별할 수 있게 해주는데, 종양 덩어리는 자주 성장하여 복막8을 침범한다.
이 원고는 면역결핍 마우스의 맹장벽에 환자 유래 암세포의 정형외피 이식을 수행하는 프로토콜과 μCT 스캔을 사용하여 장 종양 성장을 모니터링하는 방법론을 설명합니다. 본 논문은 PDO나 PDXO 모델로는 연구할 수 없는 CRC 환자의 진행성 장 종양 및 전이성 질환의 임상 시나리오를 재현한 것이다. CRC의 orthotopic PDX 모델은 CRC 환자의 임상 시나리오를 요약하기 때문에 진행성 장 종양 및 전이성 질환에서 항종양제의 효능을 테스트하는 데 현재까지 가장 적합하다는 결론을 내렸습니다.
프로토콜
모든 환자로부터 서면 동의서를 받았습니다. 이 프로젝트는 스페인 바르셀로나에 있는 Vall d'Hebron University Hospital의 연구 윤리 위원회의 승인을 받았습니다(승인 ID: PR(IR)79/2009 PR(AG)114/2014, PR(AG)18/2018). 인간 결장 조직 샘플은 종양 절제술을 받은 대장암 및 직장암 환자에 해당하는 원발성 선암 또는 간 전이의 비괴사 부위에서 생검한 것으로 구성되었습니다. 실험은 유럽 연합의 동물 관리 지침(86/609/EEC)에 따라 수행되었으며 VHIR-the Vall d'Hebron Research Institute의 동물 실험 윤리 위원회(ID: 40/08 CEEA, 47/08/10 CEEA 및 12/18 CEEA)의 승인을 받았습니다.
참고: 암 NOD-SCID(NOD. CB17-Prkdcscid/NcrCrl) 생후 8주령의 마우스를 Charles River Laboratories로부터 구입하였다.
1. 환자 세포 유도
- 종양 적출
알림: 다음 절차는 동물 시설의 실온(RT)에서 생물학적 캐비닛에서 수행됩니다.- 환자의 수술 또는 생검 및 마우스에서 피하로 자라는 PDX에서 종양 샘플을 얻습니다.
- 정형외과 주사의 경우, 환자로부터 직접 수득한 조직 대신 확립된 피하 PDX 종양 모델로부터 종양 세포를 준비한다9.
- NOD-SCID 마우스 2의 옆구리에 Matrigel 매트릭스(50μL)와 혼합된 인산염 완충 식염수(PBS)(50μL)에 1 x 105 종양 세포의 현탁액을 피하 접종하여 PDX 종양을 생성합니다2.
- 캘리퍼스를 사용하여 이틀에 한 번씩 종양 성장을 측정합니다.
참고: 중요한 것은 우리 실험실이 350개 이상의 PDX 모델로 구성된 바이오뱅크를 생성했다는 것입니다. 프로토콜에 사용된 CRC-PDX 종양 모델은 실험실에서 확립된 PDX 모델로, 마우스에서 3개 이상의 통로를 증폭하고 양성 결과로 포함/제외 기준을 통과했습니다(표 1).
- 캘리퍼스를 사용하여 이틀에 한 번씩 종양 성장을 측정합니다.
- 피하 종양이 CEEA에서 설정한 최대 크기(직경 1cm)에 도달하거나 동물이 종점 기준에 도달하면 자궁경부 탈구로 마우스를 안락사시킵니다.
- 종양을 추출하고 가위와 집게를 사용하여 피부와 주변의 비종양 조직에서 조심스럽게 제거합니다.
- 채취한 종양을 다음 단계까지 4°C의 PBS에 보관합니다.
참고: 환자의 병변 또는 마우스의 피하 이종이식에서 원래 위치에서 제거한 후 가능한 한 빨리 세포 현탁액의 종양을 해리하십시오. 조직 제거 후 24시간이 지나면 세포 생존율이 현저히 감소하여 수용 마우스에 비효율적인 이식이 발생합니다.
- 세포 준비
알림: 다음 절차는 조직 배양실의 실온(RT)에서 생물학적 캐비닛에서 수행됩니다.- 10mL의 완전한 CoCSCM 6Ab 배지(표 2)가 있는 1cm 배양 플레이트의 블레이드를 사용하여 종양을 해리합니다(더 쉽게 다지기 위해). 균질한 해리된 샘플을 15mL 코니컬 튜브에 넣습니다.
- 최종 부피 5mL에 완전한 CoCSCM 6Ab 배지를 추가합니다(동일한 튜브에 3mL 이하의 해리된 시료 사용).
참고: 환자로부터 절제된 1차 CRC는 자연적으로 박테리아와 곰팡이로 오염되어 있습니다. 6가지 항생제(페니실린, 스트렙토마이신, 곰팡이존, 카나마이신, 겐타마이신, 니스타틴)를 혼합하여 원래 환자 샘플에 존재하는 병원균을 제거하는 것이 중요합니다. 면역결핍 마우스에 박테리아로 오염된 종양 세포를 주입하면 동물이 죽을 수 있습니다. - 50 μL의 DNase I (0.08 kU/mL) 및 50 μL의 콜라겐분해효소 (1.5 mg/mL)로 배양합니다(분해 배지; 표 2) 세포 배양 인큐베이터의 37°C에서 45° 위치에서 1시간 동안. 배양 전에 5mL 피펫으로 15분마다 용액을 잘 혼합합니다.
참고: 종양 조직을 해리하고 피펫팅으로 여러 번 소화하여 단일 세포 용액을 얻습니다. 이는 수용 마우스에 주입하기 전에 세포를 계수하여 종양 세포의 균질한 이식을 달성하는 데 필수적입니다. - 5mL의 완전한 CoCSCM 6Ab 배지를 넣고 5mL 피펫과 잘 섞습니다.
- 새로운 멸균 50mL 튜브를 사용하여 100μm 세포 스트레이너로 용액을 분류합니다.
- 정렬된 셀을 RT에서 500 x g 에서 8분 동안 회전시킵니다.
- 상층액을 흡인합니다.
- 펠릿을 3mL의 1x RBC 용해 완충 용액에 재현탁시킵니다.
- RT에서 10분 동안 배양합니다.
- 3mL의 완전한 CoCSCM 6Ab 배지를 추가하고 샘플을 피펫팅한 다음 500 x g 에서 RT에서 10분 동안 회전합니다. 상층액을 흡입합니다.
- 펠릿을 5-10mL의 완전한 CoCSCM 6Ab 배지로 재현탁시키고 세포 카운터를 사용하여 총 세포 수를 계산합니다.
- RT에서 10분 동안 500 x g 에서 세포를 회전시키고 10mL의 PBS에 재현탁시킵니다.
- 펠릿을 재현탁시켜 20 x 106 cells/mL의 농도를 얻고, 잘 혼합하여 균질한 세포 현탁액을 얻는다.
- 조직 배양액(주사기/마우스 1개)에서 맹장 주사를 위해 29G 주사기(0.5mL U 100 바늘, 0.33mm[29G] x 12.7mm)를 준비합니다. 종양 세포 현탁액 50μL(1 x 106 세포/주사)를 주사기에 넣고 얼음 위에 보관합니다. 셀 현탁액에서 기포가 제거되었는지 확인하십시오.
참고: 종양 세포가 주사기에 로딩될 때 기포를 제거하는 것은 조직 파열 및 샘플 손실을 초래할 수 있는 맹장벽에 과도한 부피의 주입을 방지하는 데 필수적입니다. 주사기를 로딩할 때 세포 현탁액을 잘 혼합하여 동일한 실험에서 마우스 간에 종양 크기가 고르지 않게 하는 것이 중요합니다.
2. 맹장에 있는 orthotopic 주입
알림: 다음 절차는 동물 시설의 특정 SPF(Pathogen Free) 방의 벤치에서 수행됩니다. 사용된 장비는 이전에 세척 및 멸균되었습니다. 또한 동물 시설의 개인 또는 구역 사이의 휴대용 소독기에서 다시 소독됩니다.
- 소독 세제를 뿌리고 닦아 수술 부위를 청소하십시오.
- 쥐 제모 기계를 사용하여 쥐 복부를 제모하십시오.
- 마우스를 누운 자세로 놓습니다. 동물을 마취시키기 위해 2 % 이소플루란을 사용하십시오. 사지를 부드럽게 꼬집어 자극이 없는 것을 관찰하여 마취 효과를 확인합니다.
- 마취 중 건조함을 방지하기 위해 50-100μL의 동물용 연고(3mg/g Lacryvisc)를 눈에 떨어뜨립니다.
- 클로르헥시딘 또는 포비돈 요오드로 원을 그리며 여러 번 문질러 쥐의 복부를 소독합니다.
- 수술용 가위를 사용하여 하복부를 1cm 세로로 절개합니다. 피부 아래에 있는 복막이 보이도록 각 부위에 피부를 조심스럽게 분리합니다.
- 맹장이 바깥쪽으로 나올 만큼 충분히 큰 복막 막에 0.5-1cm를 절개합니다.
참고: 내부 장기를 과도하게 조작하지 않고 맹장을 외부화하면 절차의 치사율이 크게 증가할 수 있습니다. - 미리 절단된 멸균 거즈를 사용하여 쥐에서 맹장을 조심스럽게 분리합니다.
- 전체 절차 동안 식염수로 맹장을 적십니다.
- 맹장을 집게로 조심스럽게 잡아 고정시키고 바늘을 맹장 벽에 표면적으로 삽입하십시오. 주사 부위의 모세혈관과 혈관을 피하십시오. 셀 현탁액에서 기포를 제거합니다.
- 종양세포 현탁액 50μL 전체를 천천히 주입합니다. 일반적으로 투여하는 데 약 10초가 걸립니다. 바늘로 맹장 내강을 천공하면 장 연동 운동을 통해 몸에서 종양 세포 현탁액이 제거되므로 피하십시오.
참고: 생쥐의 맹장에 종양 세포 현탁액을 주입하는 것은 전체 절차에서 가장 어려운 단계입니다. 주사 부위에 초점을 맞춘 밝은 빛과 확대경을 프로토콜의 이 부분에 사용해야 합니다. 맹장 표면과 평행하게 바늘을 삽입하십시오. 맹장은 매우 연약한 조직입니다. 따라서 맹장의 고정은 수술용 겸자를 사용하고 출혈을 유발하는 조직 파열을 방지하기 위해 부드러운 압력을 가하여 수행해야 합니다. 성공적으로 착상하면 맹장 벽에 흰색 기포(세포 알갱이)가 생깁니다. 기포를 시각화할 수 없는 경우 맹장에 구멍이 뚫리고 세포가 맹장 내강에서 끝나 장관에서 제거되었음을 나타낼 수 있습니다. - 주입 후 맹장에서 바늘을 천천히 떼어내고 솜 어플리케이터로 주사 부위를 부드럽게 눌러 종양 세포가 빠져나가는 것을 방지하고 약간의 출혈을 줄입니다.
- 식염수로 맹장을 청소하여 이물질을 제거합니다.
- 맹장을 동물의 복부로 되돌려 놓으십시오.
- 5/0 봉합사를 사용하여 복막을 닫습니다.
- 5/0 봉합사를 사용하여 복부 피부를 닫습니다.
- 수술 후 항생제(아목시실린 100mg/kg 또는 엔로플록사신 20mg/kg)와 진통제(5mg/mL 메타캠/멜록시캄)를 피하주사로 투여합니다. 마우스를 가열 패드에 놓고 완전히 회복될 때까지 그대로 두십시오. 그런 다음 다른 동물과 함께 케이지로 돌려보냅니다.
3. μCT 스캔을 이용한 정형외과 종양 성장 평가
참고: 다음 절차는 동물 시설의 전임상 이미징 플랫폼(PIP)에서 수행됩니다.
- 모든 동물 시술은 기관 윤리위원회 규정에 따라 수행한다.
- 세포 주입 2주 후 μCT로 종양 부피 모니터링을 시작하고 그 이후에는 매주 모니터링을 시작합니다.
- 조영제 iopamiro(300mg/mL)를 식염수에 3:1의 비율로 두 용량 모두 갓 희석합니다. 300mL의 iopamiro 구강으로 투여합니다.
참고: μCT의 연조직 조영제가 좋지 않기 때문에 기술의 감도를 향상시키기 위해 조영제를 사용하는 것이 좋습니다. 이 프로토콜에는 내강 내 종양 부담을 구분하기 위한 요오드 기반 제제(iopamiro)의 경구 투여와 장의 내장 표면에서 종양 부담을 정의하기 위한 동일한 약제의 2차 복강 내 투여가 포함됩니다. 조영제가 제거되기 전에 쥐의 맹장에 도착해야 하는 정확한 시간을 결정하기 위해 파일럿 실험이 이전에 수행되었습니다. iopamiro의 경우 약 2 시간입니다. - 2시간 후 이전에 희석한 아이오파미로 300mL를 복강내 주사합니다. 투여는 정수리 얼굴의 종양 한계를 정의하는 데 도움이 됩니다.
- 2% 이소플루란을 사용하여 동물을 마취합니다.
- 마우스의 발을 꼬집어 동물이 올바르게 마취되었는지 확인한 후 동물을 μCT의 스캐닝 베드에 놓습니다. 가장 좋은 자세는 누운 자세(앞면이 위로)입니다.
- 제어 소프트웨어에서 라이브 모드(형광 투시 모드)를 시작하여 복부 영역을 스캐너의 시야(FOV)에 배치합니다. 그렇게 하려면 원하는 위치에 도달할 때까지 침대를 앞뒤로 그리고 옆으로 움직입니다. X선관과 검출기를 90° 회전하고 스캐닝 베드를 y축으로 이동하여 동물을 완전히 중앙에 맞춥니다.
- FX μCT 이미징 시스템을 사용하여 μCT 스캔 이미지에 대해 30mm FOV, 26초의 획득 시간, 90kV의 전류 전압 및 200μA의 전류 암페어 매개변수를 사용합니다.
- 스캔이 완료되면 동물을 케이지로 돌려보내 회수합니다. 동물이 마취에서 회복될 때까지 온열 지원을 제공하고 관찰한 후 집으로 돌아갑니다.
- μCT 수집은 각 스캔에 대해 250Mb 크기의 파일을 생성합니다. 생성된 데이터 파일은 VOX 형식입니다. 모든 이미징 분석 소프트웨어에서 액세스할 수 있도록 μCT의 데이터베이스 관리 소프트웨어를 사용하여 파일을 DICOM 형식으로 변환하십시오. 생성된 파일 배치를 휴대용 하드 디스크에 저장하여 이미징 소프트웨어를 사용할 수 있는 모든 컴퓨터를 사용하여 분석합니다.
참고: 이미지 분석 중에 맹장은 종종 꼬리 복부의 왼쪽에 방사성 밀도가 높은 내용(iopamiro)이 있는 확장된 장으로 국소화됩니다. 맹장의 내장 굴곡에서는 인접한 장 부위에 비해 벽이 두꺼워지는 것이 관찰됩니다. 비후는 종양 성장에 해당합니다. - 종양이 국소화되면 다양한 보기(축, 관상, 시상)에서 가장 높은 직경을 찾습니다. 이 세 축을 측정하고 타원체 공식에 따라 종양 부피를 계산합니다: 부피 = 4/3π x (x-반축 x y-반축 x z-반축)10.
4. 정형외과 종양을 가진 마우스에 대한 치료 개입
- 매주 기립성 종양이 있는 마우스를 모니터링합니다.
- 대부분의 마우스에서 종양 μCT 스캔 신호가 감지되면 다음 주에 다시 μCT 스캔을 수행하여 종양의 존재를 확인합니다.
참고: 치료 시작 시간은 사용된 PDX 모델에 따라 다르며 맹장에서 종양 세포 접종 후 3-12주까지 다양합니다. - 생쥐를 비히클 그룹(n = 10-15 생쥐), 테스트 약물 그룹(n = 10-15 생쥐), 표준 치료 화학 요법 그룹(n = 10-15 생쥐) 및 병용 치료 그룹(n = 10-15 생쥐)의 네 그룹으로 무작위 배정합니다.
- 생쥐를 복강내 식염수(비히클 그룹), 시험약(20mg/kg)(시험약물군), 이리노테칸(50mg/kg)(표준 치료군) 또는 시험약(20mg/kg)과 이리노테칸(50mg/kg)(병용치료군)으로 치료한다. 실험이 끝날 때까지 일주일에 한 번 투여를 수행하십시오.
- 실험 과정 전반에 걸쳐 μCT 스캔을 통해 매주 종양 성장을 모니터링합니다.
- 실험이 끝나면 자궁 경부 탈구로 쥐를 안락사시키고 간, 폐 및 다른 장기의 기타 가능한 병변을 수집합니다.
- 조직 샘플을 카세트에 넣고 하룻밤 동안 4% 포르말린으로 배양합니다. 맹장에 종양이 없는 쥐의 장 조직을 대조군으로 사용합니다.
- 포르말린에서 카세트를 제거하고 70 % 에탄올로 최소 3 시간 동안 배양합니다.
- 조직 병리학 시설 표준 프로토콜을 사용하여 파라핀이 포함된 카세트를 내장합니다.
- 조직병리학 시설 표준 프로토콜을 사용하여 맹장, 간 및 폐에서 헤마톡실린 및 에오신(H&E) 염색을 수행합니다.
결과
환자 유래 암세포를 정형외형적으로 이식한 마우스는 μCT 스캔으로 매주 모니터링했습니다. 실험이 끝나자 동물들은 안락사되었다. 장, 세카(그림 1A,B), 간, 폐 및 기타 가능한 병변을 수집하여 카세트에 포함시키고 밤새 4% 포르말린으로 고정했습니다. 맹장에 종양이 없는 쥐의 장 조직을 대조군으로 사용했습니다(그림 1C). 마지막으로, 카세트를 최소 3시간 동안 70% 에탄올로 변경하고 파라핀을 내장했습니다. 종양 세포를 식별하기 위해 조직 병리학 시설 표준 프로토콜을 사용하여 ceca, 간 및 폐의 헤마톡실린 및 에오신(H&E) 염색을 수행했습니다(그림 2, 그림 3 및 그림 4).
또 다른 실험에서는 기형외과 종양이 있는 쥐를 매주 모니터링했습니다. 대부분의 마우스에서 종양 μCT 스캔 신호가 검출되면(PDX 모델에 따라 약 2-4주), 동물을 4개 그룹으로 무작위 배정하고 비히클, 테스트 약물(20mg/kg), 표준 치료 화학 요법 이리노테칸(50mg/kg) 또는 이리노테칸이 포함된 테스트 약물로 치료했습니다. 약물은 실험이 끝날 때까지 일주일에 한 번 복강내로 투여되었습니다. 종양 성장은 실험 과정 전반에 걸쳐 μCT 스캔을 통해 매주 모니터링되었습니다. 그 결과, 테스트 약물이 μCT 스캔 이미지로 계산한 종양 부피의 감소를 유도했으며, 이는 이리노테칸 치료와 병용하여 강화되었음을 나타냅니다(그림 5 및 그림 6).
우리 연구실의 이전 연구에서는 orthotopic CRC-PDX 모델의 전이성 가능성(암종, 폐 및 간 전이)이 사용된 PDX 모델에 따라 달라진다는 것을 보여주었습니다(표 3)2. 본 연구에서는 전이 형성에 대한 치료 효능도 평가하였다. 그 결과, 시험약인 이리노테칸과 그 병용요법은 처리된 마우스에서 폐 및 간 전이의 형성을 근절하는 것으로 나타났다(표 4)11.

그림 1: orthotopic CRC-PDX 종양이 있는 마우스의 장에 대한 거시적 이미지. 실험이 끝날 때 orthotopic PDX 종양(A,B)이 있는 두 마우스의 거시적 장 이미지. 맹장 종양은 이미지에서 빨간색으로 정의됩니다. (C) 대조군으로서의 맹장에 종양이 없는 쥐의 장 이미지. 축척 막대 = 5mm(A,B); 1cm(C)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
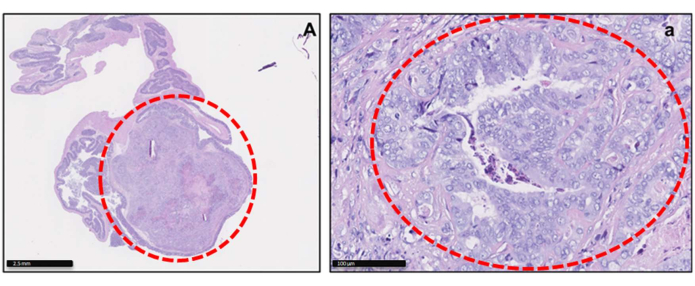
그림 2: orthotopic CRC-PDX 종양의 조직학적 이미지. 저배율(A) 및 고배율(a)에서 실험 종료 시 맹장에서 PDX 종양 모델의 H&E 염색. 맹장 종양은 이미지에서 빨간색으로 정의됩니다. 스케일 바 = 2.5mm(A); 100mm(a)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: orthotopic PDX 종양이 있는 마우스의 폐에 대한 orthotopic CRC-PDX 종양 H&E 염색에서 파생된 폐 전이의 조직학적 이미지. 폐 전이는 저배율(A)과 고배율(a)에서 관찰할 수 있습니다. 폐 전이는 이미지에서 빨간색으로 정의됩니다. 스케일 바 = 250mm(A); 100mm(a)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: orthotopic CRC-PDX 종양에서 유래한 간 전이의 조직학적 이미지. orthotopic PDX 종양이 있는 마우스의 간 H&E 염색. 간 전이는 저배율(A) 및 고배율(a)에서 관찰할 수 있습니다. 간 전이는 이미지에서 빨간색으로 정의됩니다. 축척 막대가 이미지에 표시됩니다. 스케일 바 = 500mm(A); 50mm(a)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
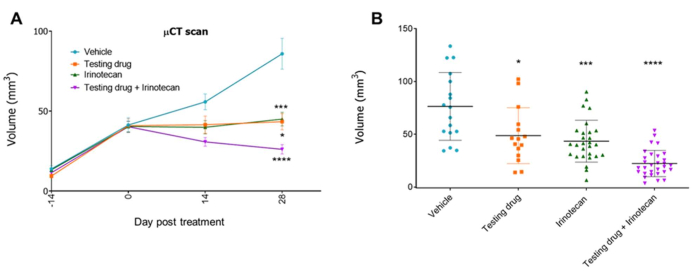
그림 5: orthotopic CRC-PDX 모델에서 테스트 약물의 치료 효능. 4개 그룹(비히클, 시험용 약물, 이리노테칸 및 이리노테칸 시험용)을 사용한 실험의 예11. μCT 스캔 이미지에서 얻은 종양 부피는 시간 경과(A) 및 실험 종료 시(42일)(B)에 표시됩니다. 막대, ± SE(n = 15-30) 및 *p < 0.05, ***p < 0.001, ****p < 0.0001(t-검정, 양측). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 치료 중인 orthotopic CRC-PDX 종양이 있는 마우스의 μCT 이미지. 치료 약물로 치료된 정형외과 종양이 있는 마우스의 대표적인 μCT 이미지. 맹장(빨간색)과 종양 종괴(파란색)가 이미지에 정의되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 피하 PDX의 확립. 실험실에서 확립된 3개의 PDX 모델(P1, P2 및 P3)의 예는 350개 이상의 PDX모델 중 350개 이상의 PDX 모델을 접종한 세포 수, PDX 확립 발생률 및 마우스의 통로와 함께 제공합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 성장 인자(GF) MIX 10X, EGF, FGF2 및 성장 인자가 없는 CoCSCM 6Ab, CoCSCM 6Ab 완전 배지 및 분해 배지를 제조하기 위한 시약. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: orthotopic CRC-PDX 모델의 전이 가능성. 실험실에서 확립된 세 가지 orthotopic CRC-PDX 모델(P1, P2 및 P3)의 예는 바이오뱅크2입니다. 여기에는 접종한 세포의 수, 맹장 종양 형성의 발생률, 암종, 폐 전이 또는 간 전이의 발생률이 표시됩니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: orthotopic CRC-PDX 모델에서 테스트 약물의 치료 전이성 효능. 4개 그룹(비히클, 시험용 약물, 이리노테칸 및 이리노테칸 시험용)을 사용한 실험의 예11. 여기서, 각 그룹의 마우스의 수와 실험 종료 시 암종, 폐 전이 또는 간 전이가 발생한 마우스가 표시됩니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
지난 수십 년 동안 대장암(CRC)을 포함한 다양한 종양 유형의 환자를 대상으로 많은 새로운 항암 치료법이 개발되고 테스트되었습니다. 많은 사례에서 전임상 모델에서 유망한 결과가 관찰되었지만, 진행성 전이성 CRC 환자에 대한 치료 효능은 종종 제한되었습니다. 따라서 임상적으로 관련된 전이성 시나리오에서 새로운 치료 약물의 효능을 테스트할 수 있는 전임상 모델이 시급합니다.
이 원고는 면역결핍 마우스의 맹장벽에 환자 종양 세포의 이식을 기반으로 하는 고급 CRC orthotopic PDX 모델을 상세히 기술하고있다 12.
이 방법론은 시간이 많이 걸리고 집중력이 요구됩니다. 평균적으로, 30마리의 마우스를 사용한 실험의 주사는 다음을 포함하여 총 약 11시간이 소요될 수 있습니다: 1) PDX 종양 수집(1시간); 종양 처리(4시간); 및 맹장 이식 (6 시간). 이 시술은 무균 상태에서 수행되어야 하며, 종양 처리 및 주입 시간을 최소화하는 동시에 수술 관련 사망을 피하기 위해 내부 장기를 매우 신중하게 조작해야 합니다. 따라서 종양 세포주 또는 PDX 세포를 사용하여 여러 파일럿 실험을 수행하여 연구자를 교육하고 절차에 익숙해지도록 하는 것이 좋습니다. 또한 두 명의 연구원이 절차에 참여해야 하는데, 한 명은 종양을 채취하고 처리하며 동물의 봉합을 돕고 다른 한 명은 실제 수술을 수행해야 합니다.
또한 맹장 종양은 PDX 모델과 주사 부위에 따라 장의 내강 또는 맹장 내부로 자랄 수 있다는 점을 고려하는 것이 중요합니다. 종양 성장의 결과는 통제하기 어렵고 마우스의 생존에 극적인 영향을 미칠 수 있으며, 종양이 내강 내부에서 자랄 때 종양이 더 작아지고 심각한 장 폐색이 발생할 수 있습니다. 따라서 마우스는 세포 이식 후 주부터 매주 모니터링해야 합니다. 대부분의 마우스가 μCT 스캔에 의해 종양 신호를 나타내면 신호가 없는 동물은 배제하고 나머지는 종양 부피에 따라 실험 그룹으로 무작위 배정해야 합니다. 통계적으로 유의미한 결과를 얻기 위해 각 실험 그룹에는 12-15마리의 마우스가 포함되어야 합니다.
종양 보유 마우스를 모니터링하는 것은 임상적으로 관련된 orthotopic 모델에서 새로운 치료제의 효능을 결정하는 데 필수적입니다. μCT 스캔을 통해 생쥐의 원발성 종양 부피를 식별하고 정량화할 수 있습니다. 이중 콘트라스트를 사용하면 μCT 기술의 감도가 크게 향상되어 이미지 품질이 향상됩니다8. 맹장에서 종양 세포가 성장하면 장의 내강 쪽으로 자라는 경우 내강 내 종양이 발생하고, 장의 내강 밖으로 자라는 경우 내강 외 종양이 발생할 수 있습니다. 두 시나리오 모두 이전 방법론에서 관찰되었으며 사용된 PDX 모델 및 주입 부위에 따라 다릅니다. 쥐는 신장 손상이나 다른 사건에 대한 임상적 증거 없이 스캔에서 완전히 회복되었습니다. 결과는 μCT 영상이 CRC의 발달 및 종적 성장을 모니터링하는 데 유용한 도구가 될 수 있음을 보여줍니다.
기형외과 모델은 임상 CRC 12를 정확하게 요약하고 원발성 종양 성장과 간 및 폐 전이에 대한 새로운 치료 약물의 효과를 테스트하는 데 매우 유용합니다 2,11. 그러나 상세한 서면 프로토콜은 새로운 연구 그룹이 이러한 복잡한 모델을 수립하는 데 충분하지 않을 수 있습니다. 이에 대응하여 본 비디오는 연구 그룹이 이 절차를 연구에 구현하도록 안내하는 것을 목표로 합니다. 면역 결핍 마우스의 맹장 벽에 세포를 이식하는 절차와 μCT 스캔을 사용하여 장 종양 성장을 모니터링하는 방법을 보여줍니다.
공개
없음.
감사의 말
Cellex Foundation, CIBERONC 네트워크 및 Instituto de Salud Carlos III의 지원에 감사드립니다. 또한 실험이 수행된 Vall d'Hebron Research Institute(VHIR)의 전임상 이미징 플랫폼에도 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| REAGENT | |||
| Apo-Transferrin | MERCK LIFE SCIENCE S.L.U. | T1147-500MG | |
| B27 Supplement | Life Technologies S.A (Spain) | 17504044 | |
| Chlorhexidine Aqueous Solution 2% | DH MATERIAL MÉDICO, S.L. | 1111696250 | |
| Collagenase | MERCK LIFE SCIENCE S.L.U. | C0130-500MG | |
| D-(+)-Glucose | MERCK LIFE SCIENCE S.L.U. | G6152 | |
| DMEM /F12 | LIFE TECHNOLOGIES S.A. | 21331-020 | |
| DNase I | MERCK LIFE SCIENCE S.L.U. | D4263-5VL | |
| EGF | PEPRO TECH EC LTD. | AF-100-15-500 µg | |
| FGF basic | PEPRO TECH EC LTD. | 100-18B | |
| Fungizone | Life Technologies S.A (Spain) | 15290026 | |
| Gentamycin | LIFE TECHNOLOGIES S.A. | 15750037 | |
| Heparin Sodium Salt | MERCK LIFE SCIENCE S.L.U. | H4784-250MG | |
| Insulin | MERCK LIFE SCIENCE S.L.U. | I9278-5ML | |
| Iopamiro | |||
| Isoflurane | - | - | |
| Kanamycin | LIFE TECHNOLOGIES S.A. | 15160047 | |
| L-Glutamine | LIFE TECHNOLOGIES S.A. | 25030032 | |
| Matrigel Matrix | CULTEK, S.L.U. | 356235/356234/354234 | |
| Metacam, 5 mg/mL | - | - | |
| Non-essential amino acids | LIFE TECHNOLOGIES S.A. | 11140035 | |
| Nystatin | MERCK LIFE SCIENCE S.L.U. | N4014-50MG | |
| Pen/Strep | Life Technologies S.A (Spain) | 15140122 | |
| Phosphate-buffered saline (PBS), sterile | Labclinics S.A | L0615-500 | |
| Progesterone | MERCK LIFE SCIENCE S.L.U. | P0130-25G | |
| Putrescine | MERCK LIFE SCIENCE S.L.U. | P5780-5G | |
| RBC Lysis Buffer | Labclinics S.A | 00-4333-57 | |
| Sodium Pyruvate | LIFE TECHNOLOGIES S.A. | 11360039 | |
| Sodium Selenite | MERCK LIFE SCIENCE S.L.U. | S5261-25G | |
| ESSENTIAL SUPPLIES | |||
| 8 weeks-old NOD.CB17-Prkdcscid/NcrCrl mice | - | - | |
| BD Micro-Fine 0.5 ml U 100 needle 0.33 mm (29G) x 12.7 mm | BECTON DICKINSON, S.A.U. | 320926 | |
| Blade #24 | - | - | |
| Cell Strainer 100 µm | Cultek, SLU | 45352360 | |
| Forceps and Surgical scissors | - | - | |
| Heating pad | - | - | |
| Lacryvisc, 3 mg/g, ophthalmic gel | - | - | |
| Surfasafe | - | - | |
| Suture PROLENE 5-0 | JOHNSON&JOHNSON S, A. | 8720H | |
| EQUIPMENT/SOFTWARE | |||
| Quantum FX µCT Imaging system | Perkin Elmer | Perkin Elmer | http://www.perkinelmer.com/es/product/quantum-gx-instrument-120-240-cls140083 |
참고문헌
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Puig, I., et al. A personalized preclinical model to evaluate the metastatic potential of patient-derived colon cancer initiating cells. Clinical Cancer Research. 19 (24), 6787-6801 (2013).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nature Reviews. Cancer. 17 (4), 254-268 (2017).
- Vatandoust, S., Price, T. J., Karapetis, C. S. Colorectal cancer: Metastases to a single organ. World Journal of Gastroenterology. 21 (41), 11767-11776 (2015).
- Cespedes, M. V., et al. Orthotopic microinjection of human colon cancer cells in nude mice induces tumor foci in all clinically relevant metastatic sites. The American Journal of Pathology. 170 (3), 1077-1085 (2007).
- Durkee, B. Y., Weichert, J. P., Halberg, R. B. Small animal micro-CT colonography. Methods. 50 (1), 36-41 (2010).
- Boll, H., et al. Double-contrast micro-CT colonoscopy in live mice. International Journal of Colorectal Disease. 26 (6), 721-727 (2011).
- O'Brien, C. A., Pollett, A., Gallinger, S., Dick, J. E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 445 (7123), 106-110 (2007).
- Jensen, M. M., Jorgensen, J. T., Binderup, T., Kjaer, A. Tumor volume in subcutaneous mouse xenografts measured by microCT is more accurate and reproducible than determined by 18F-FDG-microPET or external caliper. BMC Medical Imaging. 8, 16 (2008).
- Herpers, B., et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR x LGR5 bispecific antibody with efficacy in epithelial tumors. Nature Cancer. 3 (4), 418-436 (2022).
- Chicote, I., Camara, J. A., Palmer, H. G. Advanced colorectal cancer orthotopic patient-derived xenograft models for cancer and stem cell research. Methods in Molecular Biology. 2171, 321-329 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유