Method Article
L’implantation orthotopique de cellules cancéreuses dérivées de patients chez la souris récapitule le cancer colorectal avancé
Dans cet article
Résumé
Ce protocole décrit l’implantation orthotopique de cellules cancéreuses dérivées de patients dans la paroi du caecum de souris immunodéficientes. Le modèle récapitule la maladie métastatique du cancer colorectal avancé et permet l’évaluation de nouveaux médicaments thérapeutiques dans un scénario cliniquement pertinent de métastases pulmonaires et hépatiques.
Résumé
Au cours de la dernière décennie, des modèles précliniques plus sophistiqués de cancer colorectal (CCR) ont été établis à l’aide de cellules cancéreuses dérivées de patients et de tumoroïdes 3D. Étant donné que les organoïdes tumoraux dérivés du patient peuvent conserver les caractéristiques de la tumeur d’origine, ces modèles précliniques fiables permettent le dépistage des médicaments anticancéreux et l’étude des mécanismes de résistance aux médicaments. Cependant, la mortalité liée au CCR chez les patients est principalement associée à la présence d’une maladie métastatique. Il est donc essentiel d’évaluer l’efficacité des thérapies anticancéreuses dans des modèles in vivo pertinents qui récapitulent véritablement les principales caractéristiques moléculaires des métastases cancéreuses humaines. Nous avons établi un modèle orthotopique basé sur l’injection de cellules cancéreuses dérivées de patients atteints de CCR directement dans la paroi du caecum de souris. Ces cellules tumorales développent des tumeurs primaires dans le caecum qui métastasent dans le foie et les poumons, ce qui est fréquemment observé chez les patients atteints d’un CCR avancé. Ce modèle murin de CCR peut être utilisé pour évaluer les réponses aux médicaments surveillées par microtomodensitométrie (μCT), une méthode d’imagerie à petite échelle cliniquement pertinente qui permet d’identifier facilement les tumeurs primaires ou les métastases chez les patients. Nous décrivons ici l’intervention chirurgicale et la méthodologie requise pour implanter des cellules cancéreuses dérivées du patient dans la paroi du caecum de souris immunodéficientes.
Introduction
Le cancer colorectal (CCR) est la deuxième cause de décès par cancer dans le monde1. La capacité de générer des modèles tumoraux in vitro ou in vivo dérivés de cellules tumorales individuelles de patients a fait progresser la médecine de précision en oncologie. Au cours de la dernière décennie, les organoïdes dérivés de patients (PDO) ou les xénogreffes (PDX) ont été utilisés par de nombreux groupes de recherche à travers le monde2. Les AOP sont des structures multicellulaires in vitro qui ressemblent aux caractéristiques du tissu tumoral d’origine et peuvent s’auto-organiser et s’auto-renouveler3. Ces modèles in vitro prometteurs peuvent être utilisés avec succès pour le criblage de médicaments et faciliter la recherche translationnelle. D’autre part, les modèles PDX récapitulent fidèlement le CCR original à tous les niveaux pertinents, de l’histologie aux traits moléculaires et à la réponse aux médicaments 2,4.
In vivo Les modèles PDX sont principalement cultivés sous forme de tumeurs sous-cutanées chez les souris immunodéficientes. Grâce à cette approche, les PDX sont devenus l’étalon-or de la recherche sur le cancer, en particulier pour l’étude de la sensibilité ou de la résistance aux médicaments. Cependant, les décès liés au CCR sont principalement associés à la présence de lésions métastatiques dans le foie, le poumon ou la cavité péritonéale, et aucune des deux approches (PDO ou PDX) ne peut récapituler le cadre clinique avancé. De plus, il a été démontré que le site spécifique de la croissance tumorale détermine des caractéristiques biologiques importantes qui ont un impact sur l’efficacité des médicaments et le pronostic de la maladie2. Par conséquent, il est urgent d’établir des modèles précliniques qui peuvent être utilisés pour évaluer l’efficacité des médicaments anticancéreux dans un contexte métastatique cliniquement pertinent6.
Les tomodensitomètres (μCT) peuvent fonctionner comme des tomodensitomètres cliniques réduits, fournissant une imagerie des tumeurs primaires et des métastases chez la souris à une résolution d’image à l’échelle proportionnelle à celle des images CT des patients atteints de cancer7. Pour contrer le faible contraste des tissus mous de la technique μCT, des agents de contraste iodés radiologiques peuvent être utilisés pour améliorer le contraste et évaluer la charge tumorale. À l’aide d’une approche à double contraste, l’iode par voie orale et intrapéritonéale est administré à des moments différents. Le produit de contraste administré par voie orale aide à définir les limites entre le tissu tumoral et le contenu en caecum à l’intérieur de l’intestin. D’autre part, le produit de contraste administré par voie intrapéritonéale permet d’identifier les limites externes de la masse tumorale, qui se développe fréquemment et envahit le péritoine8.
Le manuscrit décrit un protocole pour effectuer l’implantation orthotopique de cellules cancéreuses dérivées de patients dans la paroi du caecum de souris immunodéficientes, et la méthodologie pour surveiller la croissance tumorale intestinale à l’aide de la tomodensitométrie. Le présent manuscrit montre que le modèle récapitule le scénario clinique des tumeurs intestinales avancées et des maladies métastatiques chez les patients atteints de CCR qui ne peuvent pas être étudiés à l’aide de modèles PDO ou PDXO. Étant donné que les modèles PDX orthotopiques du CCR récapitulent le scénario clinique des patients atteints de CCR, nous concluons qu’ils sont les meilleurs à ce jour pour tester l’efficacité des médicaments antitumoraux dans les tumeurs intestinales avancées et les maladies métastatiques.
Protocole
Le consentement éclairé écrit de tous les patients a été obtenu. Le projet a été approuvé par le Comité d’éthique de la recherche de l’hôpital universitaire Vall d’Hebron, Barcelone, Espagne (approbation ID : PR(IR)79/2009 PR(AG)114/2014, PR(AG)18/2018). Les échantillons de tissus du côlon humain étaient des biopsies provenant de zones non nécrotiques d’adénocarcinomes primitifs ou de métastases hépatiques, correspondant à des patients atteints de cancer du côlon et du rectum ayant subi une résection tumorale. Les expériences ont été menées conformément à la directive de l’Union européenne sur les soins des animaux (86/609/CEE) et ont été approuvées par le Comité d’éthique de l’expérimentation animale de l’Institut de recherche VHIR-la Vall d’Hébron (ID : 40/08 CEEA, 47/08/10 CEEA et 12/18 CEEA).
REMARQUE : Femelle NOD-SCID (NOD. Des souris CB17-Prkdcscid/NcrCrl) âgées de 8 semaines ont été achetées aux laboratoires Charles River.
1. Dérivation des cellules du patient
- Extraction de tumeurs
REMARQUE : La procédure suivante est effectuée dans une armoire biologique à température ambiante (RT) dans l’animalerie.- Obtenir des échantillons de tumeurs à partir de chirurgies ou de biopsies des patients et de PDX se développant par voie sous-cutanée chez la souris.
- Pour l’injection orthotopique, préparer les cellules tumorales à partir de modèles tumoraux PDX sous-cutanés établis au lieu de tissus obtenus directement chez les patients9.
- Générer des tumeurs PDX en inoculant une suspension de 1 x 105 cellules tumorales dans une solution saline tamponnée au phosphate (PBS) (50 μL) mélangée à une matrice Matrigel (50 μL) par voie sous-cutanée dans le flanc de souris NOD-SCID2.
- Mesurez la croissance tumorale à l’aide d’un pied à coulisse tous les deux jours.
NOTE : Il est important de noter que notre laboratoire a généré une biobanque de plus de 350 modèles PDX. Les modèles de tumeurs CRC-PDX utilisés dans le protocole sont des modèles PDX établis en laboratoire qui ont été amplifiés plus de trois fois chez la souris et qui ont passé les critères d’inclusion/exclusion avec un résultat positif (tableau 1).
- Mesurez la croissance tumorale à l’aide d’un pied à coulisse tous les deux jours.
- Euthanasier les souris par luxation cervicale lorsque les tumeurs sous-cutanées atteignent la taille maximale établie par la CEEA (1 cm de diamètre), ou lorsque les animaux atteignent les critères finaux.
- Extrayez la tumeur et retirez-la soigneusement de la peau et des tissus non tumoraux environnants à l’aide de ciseaux et de pinces.
- Conservez les tumeurs prélevées dans du PBS à 4 °C jusqu’à l’étape suivante.
REMARQUE : Dissocier les tumeurs en suspension cellulaire dès que possible après leur retrait de leur emplacement d’origine dans les lésions des patients ou les xénogreffes sous-cutanées chez la souris. La viabilité cellulaire est considérablement réduite 24 h après l’ablation des tissus, ce qui entraîne une implantation inefficace chez les souris receveuses.
- Préparation des cellules
REMARQUE : La procédure suivante est effectuée dans une armoire biologique à température ambiante (RT) dans la salle de culture tissulaire.- Dissocier les tumeurs à l’aide d’une lame dans une plaque de culture de 10 cm avec 1 mL de milieu CoCSCM 6Ab complet (tableau 2) (pour faciliter le hachage). Placer l’échantillon dissocié homogène dans un tube conique de 15 ml.
- Ajouter le milieu CoCSCM 6Ab complet jusqu’à l’obtention d’un volume final de 5 mL (ne pas utiliser plus de 3 mL d’échantillon dissocié dans le même tube).
REMARQUE : Le CCR primaire réséqué chez les patients est naturellement contaminé par des bactéries et des champignons. Il est essentiel d’éliminer les agents pathogènes présents dans l’échantillon d’origine du patient à l’aide d’un cocktail de six antibiotiques (pénicilline, streptomycine, fongizone, kanamycine, gentamycine et nystatine). L’injection de cellules tumorales contaminées par des bactéries chez des souris immunodéficientes peut entraîner la mort de l’animal. - Incuber avec 50 μL de DNase I (0,08 kU/mL) et 50 μL de collagénase (1,5 mg/mL) (milieu de digestion ; Tableau 2) pendant 1 h à 37 °C dans un incubateur de culture cellulaire, à 45°. Bien mélanger la solution toutes les 15 min à l’aide d’une pipette de 5 mL avant l’incubation.
REMARQUE : Dissocier le tissu tumoral et le digérer en pipetant plusieurs fois pour obtenir une solution unicellulaire. Ceci est essentiel pour compter les cellules avant l’injection chez les souris receveuses et ainsi obtenir une implantation homogène des cellules tumorales. - Ajouter 5 mL de milieu CoCSCM 6Ab complet et bien mélanger avec une pipette de 5 mL.
- Trier la solution à l’aide d’un tamis cellulaire de 100 μm à l’aide d’un nouveau tube stérile de 50 ml.
- Faites tourner les cellules triées à 500 x g pendant 8 min à RT.
- Aspirer le surnageant.
- Remettre la pastille en suspension dans 3 mL de solution tampon de lyse des globules rouges 1x.
- Incuber pendant 10 min à RT.
- Ajouter 3 mL de milieu CoCSCM 6Ab complet, pipeter l’échantillon et essorer à 500 x g pendant 10 min à RT. Aspirer le surnageant.
- Remettre la pastille en suspension avec 5 à 10 mL de milieu CoCSCM 6Ab complet et utiliser un compteur de cellules pour calculer le nombre total de cellules.
- Faire tourner les cellules à 500 x g pendant 10 min à RT et les remettre en suspension dans 10 mL de PBS.
- Remettre la pastille en suspension pour obtenir une concentration de 20 x 106 cellules/mL, et bien mélanger pour obtenir une suspension cellulaire homogène.
- Préparer des seringues de 29 G (aiguille U 100 de 0,5 mL, 0,33 mm [29 G] x 12,7 mm) pour l’injection de caecum dans la culture tissulaire (une seringue/souris). Chargez 50 μL de la suspension de cellules tumorales (1 x 106 cellules/injection) dans la seringue et maintenez-la sur glace. Assurez-vous que les bulles d’air sont éliminées de la suspension de la cellule.
REMARQUE : L’élimination des bulles d’air lorsque les cellules tumorales sont chargées dans la seringue est essentielle pour éviter l’injection d’un volume excessif dans la paroi du caecum, ce qui pourrait entraîner une rupture des tissus et une perte d’échantillon. Il est impératif de bien mélanger la suspension cellulaire lors du chargement de la seringue pour éviter une taille tumorale inégale chez les souris d’une même expérience.
2. Injection orthotopique dans le caecum
REMARQUE : La procédure suivante est effectuée sur une paillasse dans une salle exempte d’agents pathogènes spécifiques (SPF) à l’animalerie. Le matériel utilisé est préalablement nettoyé et stérilisé. De plus, il est stérilisé à nouveau dans un stérilisateur portatif entre les individus ou les zones de l’animalerie.
- Nettoyez le site chirurgical en vaporisant un détergent désinfectant et en essuyant.
- Épilez l’abdomen de la souris à l’aide d’une machine d’épilation de souris.
- Placez la souris en position couchée. Utilisez de l’isoflurane à 2 % pour anesthésier l’animal. Confirmez l’effet de l’anesthésie en pinçant doucement l’extrémité et en observant l’absence de stimulation.
- Placez une goutte de 50 à 100 μL de pommade vétérinaire (3 mg/g de Lacryvisc) dans les yeux pour prévenir la sécheresse pendant l’anesthésie.
- Désinfectez l’abdomen de la souris en frottant plusieurs fois avec de la chlorhexidine ou de la povidone iodée dans un mouvement circulaire.
- Faites une incision longitudinale de 1 cm sur le bas-ventre à l’aide de ciseaux chirurgicaux. Séparez soigneusement la peau de chaque site pour présenter le péritoine qui se trouve sous la peau.
- Faites une incision de 0,5 à 1 cm dans la membrane du péritoine, assez grande pour extérioriser le caecum.
REMARQUE : Extérioriser le caecum sans manipuler excessivement les organes internes, ce qui pourrait augmenter considérablement la létalité de la procédure. - Isolez soigneusement le caecum de la souris à l’aide d’une gaze stérile prédécoupée.
- Humidifiez le caecum avec une solution saline tout au long de la procédure.
- Immobiliser le caecum en le saisissant soigneusement avec une pince et introduire l’aiguille superficiellement dans la paroi du caecum. Évitez les capillaires et les vaisseaux au site d’injection. Retirez les bulles de la suspension cellulaire.
- Injectez lentement la totalité des 50 μL de suspension de cellules tumorales. Il faut généralement environ 10 s pour l’administrer. Évitez de perforer la lumière du caecum avec l’aiguille, car cela entraîne l’élimination de la suspension de cellules tumorales du corps par péristaltisme intestinal.
REMARQUE : L’injection de la suspension de cellules tumorales dans le caecum des souris est l’étape la plus difficile de toute la procédure. Une lumière vive focalisée sur le site d’injection et une loupe grossissante doivent être utilisées dans cette partie du protocole. Introduisez l’aiguille parallèlement à la surface du caecum. Le caecum est un tissu très fragile ; Par conséquent, l’immobilisation du caecum doit être effectuée à l’aide d’une pince chirurgicale et en appliquant une légère pression pour éviter la rupture des tissus entraînant une hémorragie. Une implantation réussie se traduit par une bulle blanche (pastille de cellules) dans la paroi du caecum. Si la bulle ne peut pas être visualisée, cela peut indiquer que le caecum a été perforé et que les cellules se sont terminées dans la lumière du caecum, ce qui entraîne leur élimination par le tractus intestinal. - Après l’injection, retirez lentement l’aiguille du caecum et appliquez une légère pression sur le site d’injection avec un applicateur à embout en coton, pour éviter que les cellules tumorales ne s’échappent et réduire les légers saignements.
- Nettoyez le caecum avec une solution saline pour éliminer tous les débris.
- Remettez le caecum dans l’abdomen de l’animal.
- Fermez le péritoine à l’aide de sutures 5/0.
- Fermez la peau de l’abdomen à l’aide de sutures 5/0.
- Administrer des antibiotiques postopératoires (100 mg/kg d’amoxicilline ou 20 mg/kg d’enrofloxacine) et des antalgiques (5 mg/mL de métacam/méloxicam) par injection sous-cutanée. Placez les souris sur un coussin chauffant et gardez-les là jusqu’à ce qu’elles soient complètement rétablies. Ensuite, remettez-les dans la cage avec d’autres animaux.
3. Évaluation de la croissance tumorale orthotopique à l’aide de la tomodensitométrie μCT
REMARQUE : La procédure suivante est effectuée dans la plate-forme d’imagerie préclinique (PIP) de l’animalerie.
- Effectuer toutes les procédures relatives aux animaux conformément aux règlements du comité d’éthique de l’établissement.
- Commencez à surveiller le volume de la tumeur par μCT 2 semaines après l’injection de cellules, et toutes les semaines par la suite.
- Diluer fraîchement l’agent de contraste iopamiro (300 mg/mL) dans une solution saline, dans un rapport de 3 :1 pour les deux doses. Administrer 300 mL d’iopamiro par gavage oral.
REMARQUE : En raison du faible contraste des tissus mous du μCT, un agent de contraste est recommandé pour améliorer la sensibilité de la technique. Le protocole comprend l’administration orale d’un agent à base d’iode (iopamiro) pour délimiter la charge tumorale intraluminale, et l’administration intrapéritonéale secondaire du même agent pour définir la charge tumorale dans la face viscérale de l’intestin. Des expériences pilotes ont déjà été réalisées pour déterminer le temps exact dont l’agent de contraste a besoin pour arriver dans le caecum des souris avant son élimination. Dans le cas de iopamiro, c’est environ 2 h. - Après 2 h, administrer une injection intrapéritonéale de 300 mL d’iopamiro préalablement dilué. L’administration aide à définir les limites tumorales dans le visage pariétal.
- Anesthésier les animaux avec de l’isoflurane à 2 %.
- Après avoir vérifié que l’animal est correctement anesthésié en pinçant le pied de la souris, placez l’animal dans le lit de balayage du μCT. La meilleure position est le décubitus dorsal (face vers le haut).
- Dans le logiciel de contrôle, démarrez le mode en direct (mode fluoroscopie) pour placer la zone abdominale dans le champ de vision (FOV) du scanner. Pour ce faire, déplacez le lit vers l’avant et vers l’arrière et latéralement jusqu’à ce que la position souhaitée soit atteinte. Faites pivoter le tube à rayons X et le détecteur de 90° et déplacez le lit de balayage sur l’axe des ordonnées pour centrer complètement l’animal.
- Utilisez les paramètres suivants pour les images de balayage μCT : champ de vision de 30 mm, temps d’acquisition de 26 s, tension de courant de 90 kV et ampérage de courant de 200 μA, à l’aide d’un système d’imagerie μCT FX.
- Remettez les animaux dans leurs cages pour qu’ils soient récupérés lorsque l’analyse est terminée. Fournir un soutien thermique et surveiller les animaux jusqu’à ce qu’ils se remettent de l’anesthésie avant de retourner au logement.
- L’acquisition μCT permet d’obtenir un fichier d’une taille de 250 Mo pour chaque balayage. Les fichiers de données créés ont un format VOX. Afin de les rendre accessibles à tout logiciel d’analyse d’imagerie, convertissez les fichiers au format DICOM à l’aide du logiciel de gestion de base de données du μCT. Stockez le lot de fichiers créés sur un disque dur portable afin de les analyser à l’aide de n’importe quel ordinateur disposant d’un logiciel d’imagerie.
REMARQUE : Lors de l’analyse de l’image, le caecum est localisé sous la forme d’un intestin dilaté avec un contenu radiodense (iopamiro), souvent dans le côté gauche de l’abdomen caudal. Dans la flexion viscérale du caecum, un épaississement de la paroi est observé, par rapport aux régions intestinales adjacentes. L’épaississement correspond à la croissance tumorale. - Une fois la tumeur localisée, trouvez le diamètre le plus élevé dans les différentes vues (axiale, coronaire et sagittale). Mesurez ces trois axes et calculez le volume de la tumeur en suivant la formule de l’ellipsoïde : volume = 4/3π x (x-demi-axe x y-demi-axe x z-demi-axe)10.
4. Intervention thérapeutique chez les souris porteuses de tumeurs orthotopiques
- Surveillez les souris porteuses de tumeurs orthotopiques chaque semaine.
- Lorsqu’un signal de scintigraphie μCT tumorale est détecté chez la plupart des souris, effectuez une autre scintigraphie μCT la semaine suivante pour confirmer la présence de la tumeur.
REMARQUE : Le temps nécessaire pour commencer le traitement dépend du modèle PDX utilisé et varie de 3 à 12 semaines après l’inoculation des cellules tumorales dans le caecum. - Randomiser les souris en quatre groupes : un groupe de véhicules (n = 10 à 15 souris), un groupe de tests de médicaments (n = 10 à 15 souris), un groupe de chimiothérapie standard (n = 10 à 15 souris) et un groupe de traitement combiné (n = 10 à 15 souris).
- Traiter les souris par voie intrapéritonéale avec une solution saline (groupe véhicule), le médicament d’essai (20 mg / kg) (groupe de médicament d’essai), l’irinotécan (50 mg / kg) (groupe de traitement standard) ou le médicament d’essai (20 mg / kg) avec l’irinotécan (50 mg / kg) (groupe de traitement combiné). Effectuez l’administration une fois par semaine jusqu’à la fin de l’expérience.
- Surveillez la croissance tumorale chaque semaine par μCT tout au long de l’expérience.
- À la fin de l’expérience, euthanasiez les souris par luxation cervicale et prélevez des foies, des poumons et toute autre lésion possible dans d’autres organes.
- Inclure les échantillons de tissus dans des cassettes et les incuber dans du formol à 4 % pendant la nuit. Utilisez le tissu intestinal d’une souris sans tumeur dans le caecum comme témoin.
- Retirer les cassettes du formol et les incuber avec de l’éthanol à 70 % pendant au moins 3 h.
- Intégrez les cassettes avec de la paraffine, en utilisant les protocoles standard des installations d’histopathologie.
- Effectuer la coloration de l’hématoxyline et de l’éosine (H&E) à partir du caecum, du foie et des poumons, en utilisant les protocoles standard des installations d’histopathologie.
Résultats
Des souris implantées orthotopiquement avec des cellules cancéreuses dérivées de patients ont été surveillées chaque semaine par μCT. À la fin de l’expérience, les animaux ont été euthanasiés. Les intestins, le cèca (Figure 1A,B), le foie, les poumons et toute autre lésion possible ont été recueillis, inclus dans une cassette et fixés avec du formol à 4 % pendant la nuit. Le tissu intestinal d’une souris sans tumeur dans le caecum a été utilisé comme témoin (Figure 1C). Enfin, les cassettes ont été remplacées à 70 % d’éthanol pendant au moins 3 h et à la paraffine. La coloration de l’hématoxyline et de l’éosine (H&E) à partir de la cèque, du foie et des poumons a été réalisée à l’aide des protocoles standard des installations d’histopathologie pour identifier les cellules tumorales (Figure 2, Figure 3 et Figure 4).
Dans une autre expérience, des souris porteuses de tumeurs orthotopiques ont été surveillées chaque semaine. Lorsqu’un signal de scintigraphie μCT tumorale a été détecté chez la plupart des souris (environ 2 à 4 semaines, selon le modèle PDX), les animaux ont été randomisés en quatre groupes et traités soit avec le véhicule, soit avec le médicament de test (20 mg / kg), soit avec la chimiothérapie standard irinotécan (50 mg / kg), soit avec le médicament de test avec l’irinotécan. Les médicaments ont été administrés par voie intrapéritonéale une fois par semaine jusqu’à la fin de l’expérience. La croissance tumorale a été surveillée chaque semaine par μCT tout au long de l’expérience. Les résultats ont indiqué que le médicament d’essai induisait une réduction du volume tumoral, calculée par les images de tomodensitométrie μCT, et qui a été renforcée en association avec un traitement par irinotécan (Figure 5 et Figure 6).
Des études antérieures dans notre laboratoire ont montré que le potentiel métastatique (carcinose pulmonaire, métastases pulmonaires et hépatiques) des modèles orthotopiques CRC-PDX dépend du modèle PDX utilisé (tableau 3)2. Dans la présente étude, l’efficacité thérapeutique sur la formation de métastases a également été évaluée. Les résultats ont indiqué que le médicament d’essai, l’irinotécan, et la combinaison ont éradiqué la formation de métastases pulmonaires et hépatiques chez les souris traitées (tableau 4)11.

Figure 1 : Images macroscopiques de l’intestin de souris porteuses de tumeurs orthotopiques CRC-PDX. Images macroscopiques de l’intestin de deux souris porteuses d’une tumeur orthotopique PDX (A,B) à la fin de l’expérience. Les tumeurs du caecum sont définies en rouge sur les images. (C) Une image de l’intestin d’une souris sans tumeur dans le caecum comme témoin. Barres d’échelle = 5 mm (A,B) ; 1 cm (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
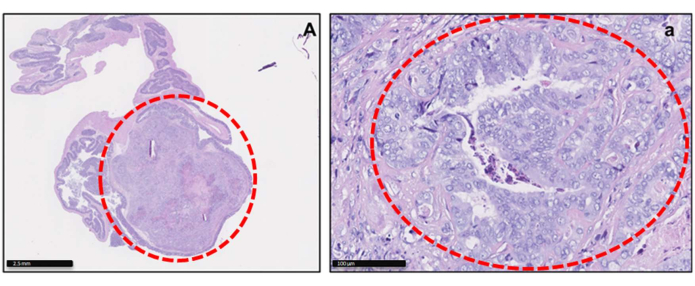
Figure 2 : Images histologiques de tumeurs orthotopiques CRC-PDX. Coloration H&E d’un modèle de tumeur PDX dans le caecum à la fin de l’expérience à faible (A) et à fort (a) grossissement. Les tumeurs du caecum sont définies en rouge sur les images. Barres d’échelle = 2,5 mm (A) ; 100 mm (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Images histologiques de métastases pulmonaires dérivées d’une tumeur orthotopique CRC-PDX Coloration H&E d’un poumon d’une souris porteuse d’une tumeur orthotopique PDX. Des métastases pulmonaires peuvent être observées à faible (A) et à fort (a) grossissement. Les métastases pulmonaires sont définies en rouge sur les images. Barres d’échelle = 250 mm (A) ; 100 mm (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Images histologiques de métastases hépatiques dérivées de tumeurs orthotopiques CRC-PDX. Coloration H&E d’un foie d’une souris porteuse d’une tumeur orthotopique PDX. Des métastases hépatiques peuvent être observées à un grossissement faible (A) et élevé (A). Les métastases hépatiques sont définies en rouge sur les images. Des barres d’échelle sont indiquées dans les images. Barres d’échelle = 500 mm (A) ; 50 mm (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.
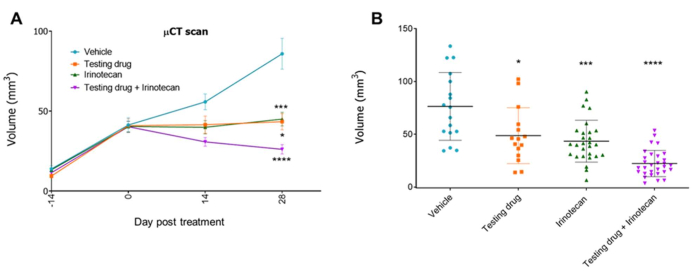
Figure 5 : Efficacité thérapeutique d’un médicament d’essai dans un modèle orthotopique CRC-PDX. Exemple d’une expérience avec quatre groupes (véhicule, médicament testé, irinotécan et médicament testant avec irinotécan)11. Le volume tumoral obtenu à partir des images de scintigraphie μCT est représenté au fil du temps (A) et à la fin de l’expérience (jour 42) (B). Barres, ± ET (n = 15-30) et *p < 0,05, ***p < 0,001, ****p < 0,0001 par rapport au véhicule (test t, recto-verso). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Images μCT de souris porteuses de tumeurs orthotopiques CRC-PDX sous traitement. Images μCT représentatives de souris porteuses de tumeurs orthotopiques traitées avec un médicament thérapeutique. Le caecum (rouge) et la masse tumorale (bleu) sont définis dans les images. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Etablissement de la PDX sous-cutanée. Exemple de trois modèles PDX établis en laboratoire (P1, P2 et P3) de notre biobanque2 de plus de 350 modèles PDX avec le nombre de cellules inoculées, l’incidence de l’établissement de PDX et les passages chez la souris. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Réactifs pour préparer les facteurs de croissance (GF) MIX 10X, le CoCSCM 6Ab sans EGF, FGF2 et facteurs de croissance, le milieu complet CoCSCM 6Ab et le milieu de digestion. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Potentiel métastatique des modèles orthotopiques CRC-PDX. Exemple de trois modèles orthotopiques CRC-PDX établis en laboratoire (P1, P2 et P3) de notre biobanque2. Ici, le nombre de cellules inoculées, l’incidence de la formation de tumeurs du caecum et l’incidence de générer une carcinomose, des métastases pulmonaires ou des métastases hépatiques sont indiqués. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Efficacité métastatique thérapeutique d’un médicament d’essai dans un modèle orthotopique CRC-PDX. Exemple d’une expérience avec quatre groupes (véhicule, médicament testé, irinotécan et médicament testant avec irinotécan)11. Ici, le nombre de souris dans chaque groupe et lesquelles d’entre elles ont développé une carcinose ou une métastase pulmonaire à la fin de l’expérience sont indiqués. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Au cours des dernières décennies, de nombreuses nouvelles thérapies anticancéreuses ont été développées et testées chez des patients atteints de différents types de tumeurs, y compris le cancer colorectal (CCR). Bien que des résultats prometteurs dans des modèles précliniques aient été observés dans de nombreux cas, l’efficacité thérapeutique chez les patients atteints d’un CCR métastatique avancé a souvent été limitée. Par conséquent, il y a un besoin urgent de modèles précliniques qui permettent de tester l’efficacité de nouveaux médicaments thérapeutiques dans un scénario métastatique cliniquement pertinent.
Le manuscrit décrit en détail un modèle PDX orthotopique avancé de CCR basé sur l’implantation de cellules tumorales de patients dans la paroi du caecum de souris immunodéficientes12.
La méthodologie est chronophage et demande de la concentration. En moyenne, l’injection d’une expérience avec 30 souris peut prendre environ 11 h au total, y compris : 1) la collecte de tumeurs PDX (1 h) ; traitement de la tumeur (4 h) ; et l’implantation de caecum (6 h). La procédure doit être effectuée dans des conditions stériles, en minimisant le temps de traitement et d’injection de la tumeur, tout en manipulant les organes internes avec beaucoup de soin pour éviter la mortalité liée à la chirurgie. Il est donc fortement recommandé de réaliser plusieurs expériences pilotes avec des lignées cellulaires tumorales ou des cellules PDX, afin de former les investigateurs et de les familiariser avec la procédure. De plus, deux chercheurs doivent être impliqués dans la procédure, l’un pour collecter et traiter la tumeur, ainsi que pour aider avec les sutures des animaux, et l’autre pour effectuer la chirurgie proprement dite.
Il est également important de considérer que les tumeurs du caecum peuvent se développer dans la lumière de l’intestin ou à l’intérieur du cæcum, selon le modèle PDX et le site spécifique de l’injection. Le résultat de la croissance tumorale est difficile à contrôler et peut affecter considérablement la survie des souris, entraînant des tumeurs plus petites et une occlusion intestinale sévère lorsque les tumeurs se développent à l’intérieur de la lumière. Les souris doivent donc être surveillées chaque semaine, à partir de la semaine suivant l’implantation cellulaire. Une fois que la plupart des souris présentent un signal tumoral par le μCT, les animaux sans signal doivent être exclus et les autres randomisés en groupes expérimentaux en fonction du volume de la tumeur. Pour obtenir des résultats statistiquement significatifs, chaque groupe expérimental doit inclure 12 à 15 souris.
Le suivi des souris porteuses de tumeurs est essentiel pour déterminer l’efficacité de nouveaux agents thérapeutiques dans des modèles orthotopiques cliniquement pertinents. Les tomodensitogrammes μCT permettent d’identifier et de quantifier le volume de la tumeur primaire chez la souris. L’utilisation d’un double contraste augmente considérablement la sensibilité de la technique μCT, améliorant ainsi la qualité des images8. La croissance des cellules tumorales dans le caecum peut conduire à des tumeurs intraluminales si elles se développent vers la lumière de l’intestin, ou à des tumeurs extraluminales si elles se développent hors de la lumière de l’intestin. Les deux scénarios ont été observés avec la méthodologie précédente et dépendent du modèle PDX utilisé et du site d’injection. Les souris se sont complètement rétablies après l’examen, sans aucun signe clinique de lésions rénales ou d’autres incidences. Les résultats montrent que l’imagerie μCT peut être un outil utile pour surveiller le développement et la croissance longitudinale du CCR.
Les modèles orthotopiques récapitulent avec précision le CCR clinique12 et sont très utiles pour tester l’effet de nouveaux médicaments thérapeutiques sur la croissance tumorale primaire et les métastases hépatiques et pulmonaires 2,11. Cependant, un protocole écrit détaillé peut ne pas suffire à un nouveau groupe de recherche pour établir des modèles aussi complexes. En réponse, la présente vidéo vise à guider les groupes de recherche dans la mise en œuvre de cette procédure dans leurs recherches. Il montre la procédure d’implantation des cellules de la paroi du caecum de souris immunodéficientes et la méthodologie pour surveiller la croissance tumorale intestinale à l’aide de la scintigraphie μCT.
Déclarations de divulgation
Aucun.
Remerciements
Nous remercions la Fondation Cellex, le réseau CIBERONC et l’Instituto de Salud Carlos III pour leur soutien. De plus, nous remercions également la plateforme d’imagerie préclinique de l’Institut de recherche Vall d’Hebron (VHIR), où les expériences ont été réalisées.
matériels
| Name | Company | Catalog Number | Comments |
| REAGENT | |||
| Apo-Transferrin | MERCK LIFE SCIENCE S.L.U. | T1147-500MG | |
| B27 Supplement | Life Technologies S.A (Spain) | 17504044 | |
| Chlorhexidine Aqueous Solution 2% | DH MATERIAL MÉDICO, S.L. | 1111696250 | |
| Collagenase | MERCK LIFE SCIENCE S.L.U. | C0130-500MG | |
| D-(+)-Glucose | MERCK LIFE SCIENCE S.L.U. | G6152 | |
| DMEM /F12 | LIFE TECHNOLOGIES S.A. | 21331-020 | |
| DNase I | MERCK LIFE SCIENCE S.L.U. | D4263-5VL | |
| EGF | PEPRO TECH EC LTD. | AF-100-15-500 µg | |
| FGF basic | PEPRO TECH EC LTD. | 100-18B | |
| Fungizone | Life Technologies S.A (Spain) | 15290026 | |
| Gentamycin | LIFE TECHNOLOGIES S.A. | 15750037 | |
| Heparin Sodium Salt | MERCK LIFE SCIENCE S.L.U. | H4784-250MG | |
| Insulin | MERCK LIFE SCIENCE S.L.U. | I9278-5ML | |
| Iopamiro | |||
| Isoflurane | - | - | |
| Kanamycin | LIFE TECHNOLOGIES S.A. | 15160047 | |
| L-Glutamine | LIFE TECHNOLOGIES S.A. | 25030032 | |
| Matrigel Matrix | CULTEK, S.L.U. | 356235/356234/354234 | |
| Metacam, 5 mg/mL | - | - | |
| Non-essential amino acids | LIFE TECHNOLOGIES S.A. | 11140035 | |
| Nystatin | MERCK LIFE SCIENCE S.L.U. | N4014-50MG | |
| Pen/Strep | Life Technologies S.A (Spain) | 15140122 | |
| Phosphate-buffered saline (PBS), sterile | Labclinics S.A | L0615-500 | |
| Progesterone | MERCK LIFE SCIENCE S.L.U. | P0130-25G | |
| Putrescine | MERCK LIFE SCIENCE S.L.U. | P5780-5G | |
| RBC Lysis Buffer | Labclinics S.A | 00-4333-57 | |
| Sodium Pyruvate | LIFE TECHNOLOGIES S.A. | 11360039 | |
| Sodium Selenite | MERCK LIFE SCIENCE S.L.U. | S5261-25G | |
| ESSENTIAL SUPPLIES | |||
| 8 weeks-old NOD.CB17-Prkdcscid/NcrCrl mice | - | - | |
| BD Micro-Fine 0.5 ml U 100 needle 0.33 mm (29G) x 12.7 mm | BECTON DICKINSON, S.A.U. | 320926 | |
| Blade #24 | - | - | |
| Cell Strainer 100 µm | Cultek, SLU | 45352360 | |
| Forceps and Surgical scissors | - | - | |
| Heating pad | - | - | |
| Lacryvisc, 3 mg/g, ophthalmic gel | - | - | |
| Surfasafe | - | - | |
| Suture PROLENE 5-0 | JOHNSON&JOHNSON S, A. | 8720H | |
| EQUIPMENT/SOFTWARE | |||
| Quantum FX µCT Imaging system | Perkin Elmer | Perkin Elmer | http://www.perkinelmer.com/es/product/quantum-gx-instrument-120-240-cls140083 |
Références
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Puig, I., et al. A personalized preclinical model to evaluate the metastatic potential of patient-derived colon cancer initiating cells. Clinical Cancer Research. 19 (24), 6787-6801 (2013).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nature Reviews. Cancer. 17 (4), 254-268 (2017).
- Vatandoust, S., Price, T. J., Karapetis, C. S. Colorectal cancer: Metastases to a single organ. World Journal of Gastroenterology. 21 (41), 11767-11776 (2015).
- Cespedes, M. V., et al. Orthotopic microinjection of human colon cancer cells in nude mice induces tumor foci in all clinically relevant metastatic sites. The American Journal of Pathology. 170 (3), 1077-1085 (2007).
- Durkee, B. Y., Weichert, J. P., Halberg, R. B. Small animal micro-CT colonography. Methods. 50 (1), 36-41 (2010).
- Boll, H., et al. Double-contrast micro-CT colonoscopy in live mice. International Journal of Colorectal Disease. 26 (6), 721-727 (2011).
- O'Brien, C. A., Pollett, A., Gallinger, S., Dick, J. E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 445 (7123), 106-110 (2007).
- Jensen, M. M., Jorgensen, J. T., Binderup, T., Kjaer, A. Tumor volume in subcutaneous mouse xenografts measured by microCT is more accurate and reproducible than determined by 18F-FDG-microPET or external caliper. BMC Medical Imaging. 8, 16 (2008).
- Herpers, B., et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR x LGR5 bispecific antibody with efficacy in epithelial tumors. Nature Cancer. 3 (4), 418-436 (2022).
- Chicote, I., Camara, J. A., Palmer, H. G. Advanced colorectal cancer orthotopic patient-derived xenograft models for cancer and stem cell research. Methods in Molecular Biology. 2171, 321-329 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon