Method Article
Desenvolvimento de organoides da Pituitária do Rato como Modelo In Vitro para Explorar a Biologia das Células-Tronco Pituitárias
Neste Artigo
Resumo
A glândula pituitária é o principal regulador do sistema endócrino do corpo. Este artigo descreve o desenvolvimento de organoides da pituitária do camundongo como um novo modelo in vitro 3D para estudar a população de células-tronco da glândula da qual a biologia e a função permanecem mal compreendidas.
Resumo
A pituitária é a glândula endócrina mestre que regula os principais processos fisiológicos, incluindo crescimento corporal, metabolismo, maturação sexual, reprodução e resposta ao estresse. Há mais de uma década, células-tronco foram identificadas na glândula pituitária. No entanto, apesar da aplicação de abordagens in vivo transgênicas, seu fenótipo, biologia e papel permanecem incertos. Para enfrentar esse enigma, um novo e inovador modelo in vitro organoide é desenvolvido para desvendar profundamente a biologia das células-tronco pituitárias. Os organoides representam estruturas celulares 3D que, sob condições culturais definidas, se auto-desenvolvem a partir das células-tronco (epiteliais) de um tecido e recapitulam múltiplas marcas dessas células-tronco e seu tecido. É mostrado aqui que organoides derivados da hipófise do rato desenvolvem-se a partir das células-tronco da glândula e recapitulam fielmente suas características fenotípicas e funcionais in vivo . Entre outros, reproduzem o estado de ativação das células-tronco como in vivo ocorrendo em resposta a danos locais transgenicamente infligidos. Os organoides são expansíveis a longo prazo, mantendo robustamente seu fenótipo de caule. O novo modelo de pesquisa é altamente valioso para decifrar o fenótipo e o comportamento das células-tronco durante as condições-chave da remodelação pituitária, que vão desde a maturação neonatal até o desbotamento associado ao envelhecimento e de glândulas saudáveis a doentes. Aqui, um protocolo detalhado é apresentado para estabelecer organoides derivados da pituitária do rato, que fornecem uma poderosa ferramenta para mergulhar no mundo ainda enigmático das células-tronco pituitárias.
Introdução
A pituitária é uma pequena glândula endócrina localizada na base do cérebro, onde está conectada ao hipotálamo. A glândula integra insumos periféricos e centrais (hipotalâmicos) para gerar uma liberação hormonal afinada e coordenada, regulando assim órgãos endócrinos de alvo a jusante (como glândulas suprarrenais e gônados) para produzir hormônios apropriados no momento adequado. A pituitária é o principal regulador do sistema endócrino e, portanto, é legitimamente denominada a glândula mestre1.
A pituitária do rato é composta por três lóbulos (Figura 1), ou seja, o lobo anterior (AL), o lobo intermediário (IL) e o lobo posterior (PL). A al endócrina principal contém cinco tipos de células hormonais, incluindo somatotropes que produzem hormônio do crescimento (GH); lactotropas gerando prolactina (PRL); corticotrópicas que secretam hormônio adrenocorticotrópico (ACTH); thyrotropes responsáveis pela produção de hormônio estimulante da tireoide (TSH); e gonadotropes que fazem hormônio luteinizador (LH) e hormônio estimulante do folículo (FSH). O PL consiste em projeções axonais do hipotálamo em que os hormônios ocitocina e vasopressina (hormônio antidiurético) são armazenados. O IL está localizado entre a AL e o PL e abriga melanantropos que produzem hormônio estimulante de melanócitos (MSH). Na pituitária humana, o IL regrede durante o desenvolvimento, e os melanotropos são espalhados dentro da AL1. Além das células endócrinas, a glândula pituitária também contém um conjunto de células-tronco, essencialmente marcadas pelo fator de transcrição SOX2 2,3,4,5,6. Estas células SOX2+ estão localizadas na zona marginal (MZ), o revestimento epitelial da fissura (um lúmen remanescente embrionário entre a AL e a IL), ou são espalhadas como aglomerados por todo o parenchyma da AL, propondo assim dois nichos de células-tronco na glândula (Figura 1)2,3,4,5,6.
Dada a natureza indispensável da hipófise, o mau funcionamento da glândula está associado à morbidade grave. O hiperpituitarismo (caracterizado pela supernecreção de um ou mais hormônios) e hipopituitarismo (produção defeituosa ou ausente de um ou mais hormônios) podem ser causados por tumores neuroendócrinos pituitários (PitNETs; por exemplo, tumores produtores de ACTH que levam à doença de Cushing) ou por defeitos genéticos (por exemplo, deficiência de GH resultando em nanô)7. Além disso, cirurgia pituitária (por exemplo, para remover tumores), infecções (por exemplo, tuberculose hipotalâmica-pituitária, ou infecções após meningite bacteriana ou encefalite), síndrome de Sheehan (necrose devido ao fluxo sanguíneo insuficiente devido à forte perda de sangue ao nascer), apoplexia pituitária e lesão cerebral traumática são outras causas importantes de hipofunção pituitária8 . Foi demonstrado que a pituitária do camundongo possui a capacidade regenerativa, sendo capaz de reparar danos locais introduzidos pela ablação transgênica das células endócrinas 9,10. As células-tronco SOX2+ reagem agudamente à lesão infligida mostrando um fenótipo ativado, marcado por maior proliferação (resultando em expansão de células-tronco) e aumento da expressão de fatores e caminhos relacionados à haste (por exemplo, WNT/NOTCH). Além disso, as células-tronco começam a expressar o hormônio ablado, resultando finalmente na restauração substancial da população celular empobrecida ao longo dos seguintes (5 a 6) meses 9,10. Além disso, durante a fase de maturação neonatal da glândula (as primeiras 3 semanas após o nascimento), as células-tronco pituitárias estão prosperando em um estado ativado 6,11,12,13, enquanto o envelhecimento organismo está associado à diminuição da funcionalidade de células-tronco in situ, devido a um ambiente inflamatório crescente (micro-) ao envelhecimento (ou 'inflamação')10,14 . Além disso, a tumorigênese na glândula também está associada à ativaçãode células-tronco 7,15. Embora a ativação de células-tronco tenha sido detectada em várias situações de remodelação pituitária (revisada em 7,16), os mecanismos subjacentes permanecem incertos. Uma vez que as abordagens in vivo (como o rastreamento de linhagem em camundongos transgênicos) não forneceram uma imagem clara ou abrangente de células-tronco pituitárias, o desenvolvimento de modelos in vitro confiáveis para explorar a biologia de células-tronco em hipófise normal e doente é essencial. A cultura in vitro padrão de células-tronco primárias pituitárias permanece inadequada devido à capacidade de crescimento muito limitada e condições não fisiológicas (2D) com perda rápida de fenótipo (para uma visão geral mais detalhada, veja16). Culturas de esfera 3D (pituosferas) foram estabelecidas a partir de células-tronco pituitárias identificadas pela população lateral e fenótipo SOX2+ 2,3,4. As pituferas crescem clonalmente a partir das células-tronco, expressam marcadores de tronco e mostram capacidade de diferenciação nos tipos de células endócrinas. No entanto, eles não se expandem consideravelmente, mostrando apenas passabilidade limitada (2-3 passagens)3,4. Estruturas semelhantes a esferas também foram obtidas de aglomerados de células-tronco pituitárias não dissociados quando cultivadas em Matrigel 50% diluído por 1 semana, mas a expansão não foi mostrada17. A abordagem pituisphere é usada principalmente como uma ferramenta de leitura para números de células-tronco, mas outras aplicações são limitadas por capacidade de expansão inferior16.
Para resolver e superar essas deficiências, um novo modelo 3D foi recentemente estabelecido, ou seja, organoides, a partir da maior AL endócrina de camundongos contendo as células-tronco MZ e parenchymal. Foi demonstrado que os organoides são de fato derivados das células-tronco da hipófise e recapitulam fielmente seu fenótipo18. Além disso, os organoides são expansíveis a longo prazo, mantendo robustamente sua natureza de caule. Portanto, eles fornecem um método confiável para expandir células-tronco primárias pituitárias para exploração profunda. Tal exploração não é alcançável com o número limitado de células-tronco que podem ser isoladas de uma pituitária, que também não são expansíveis em condições 2D16. Foi demonstrado que os organoides são ferramentas valiosas e confiáveis para descobrir novas características de células-tronco pituitárias (traduzíveis para in vivo)14,18. É importante ressaltar que o modelo organoide espelha fielmente o estado de ativação de células-tronco pituitárias como ocorrendo durante danos teciduais locais e maturação neonatal, mostrando maior eficiência de formação e replicando vias moleculares regulamentadas14,18. Assim, o modelo organoide derivado da hipófise é um inovador e poderoso modelo de pesquisa de biologia de células-tronco pituitárias, bem como uma ferramenta de leitura de ativação de células-tronco.
Este protocolo descreve em detalhes o estabelecimento de organoides derivados da pituitária do rato. Para este objetivo, a AL é isolada e dissociada em células únicas, que são incorporadas em matrigel extracelular (aquion referido como ECM). O conjunto célula-ECM é então cultivado em um meio definido, essencialmente contendo fatores de crescimento de células-tronco e reguladores embrionários pituitários (ainda mais chamados de "meio organoide pituitário" (PitOM)18; Tabela 1). Uma vez que os organoides são totalmente desenvolvidos (após 10-14 dias), eles podem ser ainda mais expandidos através de passagem sequencial e submetidos a extensa exploração a jusante (por exemplo, imunofluorescência, RT-qPCR e transcrição em massa ou unicelular; Figura 1). A longo prazo, espera-se que os organoides de células-tronco pituitárias abram caminho para abordagens de reparação tecidual e medicina regenerativa.
Protocolo
Os experimentos em animais para este estudo foram aprovados pelo Ku Leuven Ethical Committee for Animal Experimentation (P153/2018). Todos os camundongos foram alojados na unidade animal da universidade em condições padronizadas (temperatura constante de 23 ± 1,5 °C, umidade relativa 40%-60%, e um ciclo dia/noite de 12 h), com acesso a água e alimentos ad libitum.
1. Ratos
- Use cepas de mouse disponíveis comercialmente, como ratos C57BL/6J, de idade para jovens adultos (8-12 semanas de idade). Em geral, 2-3 camundongos fornecem um número suficiente de células de AL para o protocolo.
2. Isolamento e dissociação do mouse AL
NOTA: Os médios A, B e C são preparados com antecedência19,20. As composições são mostradas na Tabela 2.
- Isolamento do rato AL
- Eutanize os camundongos por asfixia de CO2 , seguido de decapitação (Figura 2A). Lave cabeças de camundongos com água deionizada para remover o sangue e pulverizá-los com 70% de EtOH para gerar um ambiente estéril.
- Utilizando ferramentas cirúrgicas estéreis, remova a pele da cabeça entre as orelhas (Figura 2B).
- Abra o crânio e remova o cérebro.
- Quebrar a 'ponte do nariz' (ou seja, parte anterior do osso frontal; Figura 2B) com uma tesoura estéril.
- Abra ainda mais o crânio com uma tesoura, começando pela ponte do nariz quebrada em direção às orelhas, em ambos os lados (Figura 2C).
- Remova o crânio e o cérebro com pinças estéreis, sem tocar na glândula pituitária (Figura 2D).
- Remova o diafragma sellae com pinças sem cortes, sem danificar a pituitária. Descarte o PL e o IL da AL sob um estereoscópio.
NOTA: O PL e o IL estão ligados e, portanto, removidos simultaneamente. Estas partes aparecem como tecido branco, em comparação com a AL cor-de-rosa (Figura 2D). - Isole cuidadosamente a AL com pinças sem corte e colete-a em um frasco de 10 mL Erlenmeyer, preenchido com 3 mL de médio A (ver Tabela 2). Coloque o frasco no gelo até que seja mais processamento.
- Dissociação do mouse AL
- Retire o supernascido (SN) médio A do frasco de Erlenmeyer contendo a AL isolada. Adicione 2 mL de solução de trippsina pré-armada (37 °C) e incubar a 37 °C por 15 min.
- Sem remover a solução de trippsina, adicione 2 mL de solução DNase pré-armada (37 °C) (2 μg/mL em médio A; filtrado estéril através de uma malha de 0,22 μm) e gire o frasco de Erlenmeyer 10 vezes. Deixe a hipófise afundar até o fundo (~1 min) e remova o SN.
- Adicione 2 mL de solução inibidora de trippsina pré-armada (37 °C) (0,1 mg/mL no médio A; filtrado estéril através de uma malha de 0,22 μm) e incubar a 37 °C por 10 min. Deixe o sedimento pituitário até o fundo e remova o SN.
- Adicione 2 mL de pré-armado (37 °C) médio B (ver Tabela 2) e incubar a 37 °C por 5 min. Sem retirar o SN, adicione 2 mL de meio C pré-armado (37 °C) (ver Tabela 2) e incubar a 37 °C por 15 min.
- Deixe a hipófise afundar até o fundo e remova o SN. Enxágüe a pituitária três vezes com o meio C pré-armado (37 °C).
- Dissociar a pituitária em células únicas.
- Adicione 2 mL de meio C pré-armado (37 °C) e expulse a glândula pituitária com uma pipeta Pasteur estéril e polida de fogo várias vezes, até que os fragmentos não sejam mais visíveis.
- Transfira a suspensão para um tubo de 15 mL com 4,5 mL de solução DNase pré-armada (37 °C) (2 μg/mL em médio A; filtrado estéril através de uma malha de 0,22 μm). Enxágüe o Erlenmeyer três vezes com 2 mL de meio C pré-armado (37 °C) e transfira a suspensão para o tubo de 15 mL.
- Misture a suspensão celular coletada e filtre-a através de um coador de células de 40 μm em um tubo de 30 mL. Enxágüe o tubo de 15 mL e o coador celular três vezes com 2 mL de C médio e transfira a suspensão para o tubo de 30 mL.
- Posicione a ponta de uma pipeta pasteur de vidro, preenchida com 2 mL de solução de albumina de soro bovino (BSA) de 3% (no meio A; filtrada estéril através de uma malha de 0,22 μm), na parte inferior do tubo e pipeta suavemente para fora para formar uma camada de densidade visível. Centrifugar a 190 x g por 10 min a 4 °C.
- Remova o SN invertendo o tubo em um movimento fluente e remova as gotículas SN restantes com uma ponta P1000. Resuspenque a pelota celular em 1 mL de DMEM/F12 avançado de gelo (Adv DMEM/F12) e quantifique as células com um contador de células.
3. Estabelecimento e cultivo de organoides derivados da AL
NOTA: Descongele o ECM no gelo com antecedência (2-3 h por 1 mL) e mantenha-o no gelo durante a duração do protocolo.
- Semeadura e cultivo organoide
- Centrifugar a suspensão da célula AL a 190 x g por 10 min a 4 °C e remover o SN. Resuspende a pelota de célula no Adv DMEM/F12 usando o volume específico calculado para atingir uma densidade celular de 1,1 x 106 células/mL.
NOTA: Por exemplo, se a suspensão da célula contiver 500.000 células/mL, deve-se resuspensar a pelota celular em 454,54 μL de Adv DMEM/F12 para atingir a densidade desejada de 1,1 x 106 células/mL. - Tire o volume de suspensão celular necessário para o revestimento (de acordo com o número desejado de poços para sementes para desenvolvimento organoide) e adicione ECM em uma proporção de 30:70 (suspensão celular de 30% (em Adv DMEM/F12 ) e 70% ECM). Misture bem por pipetting para cima e para baixo.
NOTA: Por exemplo, para uma gotícula de 30 μL (ver passo 3.1.3), deve-se (suavemente) misturar 9 μL de suspensão celular (contendo ~10.000 células quando retirado da suspensão 1.1 x 106 células/mL) com 21 μL de ECM. - Por bem, deposite uma gota de 30 μL da mistura de suspensão celular/ECM (ver passo 3.1.2) em uma placa pré-aquecida (37 °C) de 48 poços. Vire a placa de cabeça para baixo e deixe o ECM solidificar a 37 °C por 20 min.
NOTA: Pré-aqueça as placas de cultura por pelo menos 24 h a 37 °C. - Retorne a placa à sua orientação adequada e adicione cuidadosamente 250 μL de PitOM pré-armado (37 °C) (ver Tabela 1) complementado com 10 μM Inibidor de Rocha (Y-27632).
- Continue a cultivar os organoides mudando o meio (desprovido de Y-27632) a cada 2-3 dias até que os organoides sejam totalmente cultivados, o que leva entre 10-14 dias (Figura 3A). Então, passagem os organoides.
NOTA: Ao aspirar o meio, certifique-se de não interromper a cúpula ECM. Incline ligeiramente a placa de cultura e remova o meio da borda inferior do poço. O meio fresco (pré-armado a 37 °C) deve ser adicionado suavemente ao lado do poço. Se as gotículas de gel desacoplam, colete os organoides e resuspende e cultue-os novamente em uma nova gotícula ECM.
- Centrifugar a suspensão da célula AL a 190 x g por 10 min a 4 °C e remover o SN. Resuspende a pelota de célula no Adv DMEM/F12 usando o volume específico calculado para atingir uma densidade celular de 1,1 x 106 células/mL.
- Passagem organoide
- Aspire o meio suavemente e adicione 400 μL de Adv DMEM/F12 gelado para desintegrar o ECM e coletar os organoides em um tubo de microcentrifuge. Lave uma vez com 400 μL de Adv DMEM/F12 EM gelado. Centrifugar a 200 x g por 5 min a 4 °C.
- Remova o SN cuidadosamente e adicione 400 μL de enzima expressa trypLE (1X) pré-armada (37 °C). Misture invertendo o tubo várias vezes e incubar a 37 °C por 5 min.
- Adicione 400 μL de Adv DMEM/F12 gelado e centrífuga a 200 x g por 5 min a 4 °C. Remova o SN.
- Resuspenque a pelota com 100 μL de Adv DMEM/F12 gelado e, posteriormente, quebre os organoides, encanar vigorosamente para cima e para baixo com uma ponta P200 estreita (ou seja, empurre para baixo a ponta vazia contra a parte inferior do tubo de microcentrifuuge, para reduzir seu diâmetro de abertura) até que fragmentos organoides (com um diâmetro em torno de 50 μm) sejam obtidos (Figura 3B).
NOTA: A mistura de dissociação deve conter fragmentos predominantemente organoides e apenas algumas células únicas. A dissociação severa dos organoides em células únicas impacta negativamente o re-crescimento dos organoides. - Adicione 800 μL de Adv DMEM/F12 e centrífuga a 190 x g por 10 min a 4 °C. Remova o SN.
- Passagem os organoides em uma proporção de 1:2 para 1:4. Resuspenncie a pelota em um volume adequado de Adv DMEM/F12 conforme necessário para chapeamento e adicione ECM em uma proporção de 30:70 (30% de suspensão celular e 70% ECM). Misture bem por pipetting para cima e para baixo.
- Sementes e cultura os organoides descritos acima nas etapas 3.1.3-3.1.5.
NOTA: Em média, 20 organoides se desenvolvem por poço a partir das 10.000 células inteiras de AL semeadas (0,2%). Estes organoides de passagem 0 podem ser divididos em uma razão de 1:2, resultando em >50 organoides se desenvolvendo por poço (passagem 1). Os organoides podem então ser divididos em uma proporção de 1:2 a 1:4 durante as passagens subsequentes. O re-crescimento dos organoides desacelera após ~10 passagens (correspondentes a 3 meses de cultura), concretizados em organoides gradualmente menores e menores.
4. Criopreservação de organoides derivados da AL e descongelamento
- Criopreservação de organoides
- Siga o protocolo de aprovação da etapa 3.2.1 até a etapa 3.2.5.
- Resuspende a pelota organoide (contendo fragmentos e células) com 1 mL de meio criopreservador (Tabela 3). Transfira a suspensão para um criovial e coloque-a no gelo.
NOTA: Organoides (ou seja, fragmentos e células resultantes) de até quatro poços da placa de 48 poços podem ser combinados em um criovial. - Coloque os criovias em um recipiente de congelamento e transfira-os para -80 °C.
- Após 24 h, transfira as amostras para uma criobox e armazene-as em nitrogênio líquido (-196 °C) para armazenamento a longo prazo.
- Descongelamento de organoides criopreservados
- Remova o criovial do tanque de nitrogênio líquido e coloque-o no gelo. Imediatamente proceda com o protocolo de descongelamento.
- Descongele a solução com os fragmentos organoides criopreservados e células únicas a 37 °C (banho de água).
NOTA: Não guarde a solução por mais de 2 min a 37 °C para evitar a toxicidade celular por DMSO. - Transfira o conteúdo para um tubo de 15 mL contendo 10 mL de Adv DMEM/F12 gelado com 30% de soro bovino fetal (FBS). Enxágüe o criovial com 1 mL de Adv DMEM/F12 com 30% de FBS.
- Centrifugar a 190 x g por 10 min a 4 °C. Resuspenja a pelota com 1 mL de Adv DMEM/F12 gelado e transfira a suspensão para um tubo de microcentrífuga.
- Centrifugar a 190 x g por 10 min a 4 °C. Resuspenncie a pelota em um volume adequado de Adv DMEM/F12 conforme necessário para chapeamento e adicione ECM em uma proporção de 30:70. Misture bem por pipetting para cima e para baixo.
- Sementes e cultura os organoides descritos acima nas etapas 3.1.3-3.1.5.
5. Validação de organoides derivados da AL
- Coleta e lise de organoides para isolamento do RNA
- Coletar e centrifugar os organoides conforme descrito acima (passo 3.2.1).
- Remova o SN e adicione 350 μL de tampão de lise com 1% de 2 mercapto-etanol. Vórtice para 30 s e armazenar a -80 °C ou proceder imediatamente ao isolamento do RNA.
ATENÇÃO: Cuidado que o 2-mercapto-etanol é um composto tóxico. Todo o trabalho deve ser feito em um capuz de fumaça química enquanto usa luvas de nitrito, uma máscara de poeira e óculos de segurança. 2-Mercapto-etanol pode causar danos irreversíveis aos olhos e à pele.
- Fixação e incorporação de organoides para coloração imuno-histoquímica/fluorescência
- Coletar e centrifugar os organoides conforme descrito acima (passo 3.2.1).
- Remova o SN, adicione 1 mL de paraformaldeído (PFA) e incuba por 30 minutos à temperatura ambiente (RT) em um agitador orbital (100 rpm).
ATENÇÃO: PfA é um conhecido cancerígeno humano que pode causar danos irreversíveis à córnea. Todo o trabalho deve ser feito em um capuz de fumaça química. Luvas de nitrito e óculos de segurança devem ser sempre usados. - Centrifugar a 200 x g por 5 min e remover o SN. Adicione 1 mL de PBS, incubar 10 min no RT em um agitador orbital (100 rpm), e centrífuga a 90 x g por 3 min a 4 °C. Repita o passo de lavagem duas vezes. Armazenar na PBS a 4 °C.
- Para processamento e desidratação tecidual, remova o SN e adicione 150 μL de gel de 2% de agarose (em PBS) à pelota organoide usando uma ponta p200 alargada pré-armada (feita cortando um pequeno pedaço da ponta). Imediatamente encarregue todo o volume e ejete na tampa do tubo de microcentrífuga.
NOTA: É importante trabalhar rapidamente, pois o gel que contém os organoides se solidificará rapidamente. - Deixe o gel solidificar firmemente por 30 minutos e mova o disco de gel para um de histologia. Mergulhe e armazene em 50% EtOH, até a desidratação no processador de tecidos.
- Para a incorporação da parafina, coloque o disco de gel (usando fórceps) em um molde de incorporação e encha com parafina quente (60 °C). Coloque os moldes a 4 °C até que a parafina esteja sólida (aproximadamente 45 min). Estas amostras podem ser armazenadas a 4 °C ou podem ser imediatamente submetidas à secção.
- Microtome os blocos de parafina contendo organoides com espessura de 5 μm e coletam as amostras em lâminas de vidro. Adicione uma gota de água deionizada por baixo de cada seção para permitir o alongamento adequado da seção e coloque os slides em uma placa de aquecimento plana a 37 °C durante a noite. Armazene os slides com seções a 4 °C ou continue diretamente com a coloração imunohistoquímica ou imunofluorescência.
Resultados
Após o isolamento e dissociação da AL, as células únicas obtidas são semeadas em ECM e cultivadas em PitOM (Figura 1, Tabela 1). A Figura 3A exibe a cultura celular e a densidade na semeadura (Dia 0). Alguns pequenos detritos podem estar presentes (Figura 3A, pontas de flecha branca), mas desaparecerão na passagem. Quatorze dias após a semeadura, os organoides derivados da AL são totalmente desenvolvidos (Figura 3A). Os organoides exibem uma morfologia cística, com uma camada epitelial que inclui um lúmen. Nesta fase, os organoides atingem um diâmetro de 500 μm e têm que ser passagem. A Figura 3B mostra a cultura organoide derivada da AL após a passagem no momento indicado após a reesculação dos fragmentos organoides dissociados.
Ocasionalmente, uma ou mais estruturas densas podem aparecer na cultura organoide (Figura 3A, Desfavorável). Ao passar, organoides densos tendem a assumir, terminando em culturas com apenas estruturas densas após algumas passagens (Figura 3B, Desfavorável). Portanto, recomenda-se não proceder com poços que contenham organoides densos (passagem 0). Alternativamente, organoides densos podem ser descartados por sedimentação, o que deixa os organoides císticos para continuar. A origem desses organoides densos não é, no momento, clara, mas eles mostram uma natureza pituitária menos pronunciada18. Se os organoides não, ou menos eficientemente, voltarem a crescer após a aprovação, os procedimentos de dissociação precisam ser otimizados. Em particular, deve-se prestar atenção para não dissociar muito severo; os organoides devem ser divididos em fragmentos, não em células únicas (Figura 3B, Dia 0, inset).
A análise de coloração da imunofluorescência confirma o caráter epitelial dos organoides derivados da AL, pois expressam os marcadores epiteliais E-cadherin (E-Cad) e citokeratina 8/18 (CK8/18; Figura 3C), que, além disso, foram descritos como marcadores de células-tronco na pituitária18. A natureza da haste dos organoides é adicionalmente demonstrada pela expressão SOX2 e TROP2, ambas também identificadas como marcadores de células-tronco pituitárias (Figura 3C)14,18. LHX3, um fator de transcrição especificamente expresso na pituitária (em desenvolvimento precoce), valida o fenótipo pituitário dos organoides (Figura 3C). Algumas das células que constituem organoides estão em estado de proliferação, expressando o marcador de proliferação Ki67 (Figura 3C).
Mais exploração e validação do fenótipo pituitário (caule) dos organoides derivados da AL é realizada com PCR transcrição reversa-quantitativa (RT-qPCR). A alta expressão dos marcadores de caule Sox2, Cdh1 (codificação E-Cad), Krt8, Krt18 e Trop2 está presente nos organoides, claramente maior do que na AL primária, indicando que os organoides enriquecem para as células-tronco e, portanto, representam o compartimento de células-tronco al, como descrito anteriormente (Figura 3D)18. Notavelmente, os fatores de transcrição do desenvolvimento Pitx1 e Pitx2 permanecem expressos após o desenvolvimento em vários tipos de células hormonais na AL, e, portanto, sua alta expressão na AL também. As culturas mantêm robustamente seu fenótipo de caule, como demonstrado pela expressão (alta) sustentada desses marcadores após múltiplas passagens (Figura 3D).

Figura 1: Visão geral do estabelecimento, manutenção, caracterização e potencial de aplicação de organoides de pituitária saudável e doente. AL, lobo anterior; IL, lobo intermediário; PL, lobo posterior; MZ, zona marginal; PitOM, meio organoide pituitário (criado com BioRender.com). Os nichos de células-tronco na AL são indicados em roxo. Clique aqui para ver uma versão maior desta figura.
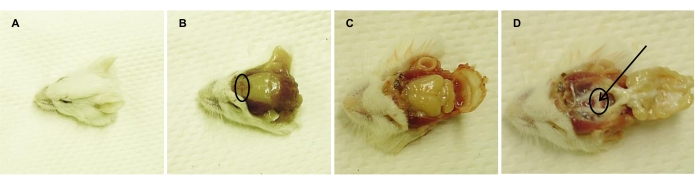
Figura 2: Isolamento da glândula pituitária do rato adulto eutanizado. Imagens representativas tomadas consecutivamente após (A) decapitação, (B) remoção da pele da cabeça (ponte do nariz é cercada), (C) abertura do crânio e (D) remoção do cérebro, expondo a glândula pituitária (cercada). A seta aponta para o PL, que é descartado (juntamente com o IL associado), deixando a AL para isolamento e dissociação. Clique aqui para ver uma versão maior desta figura.

Figura 3: Estabelecimento e validação de organoides derivados da AL. (A) semeadura celular al e desenvolvimento organoide em PitOM em dias indicados (passagem 0). A linha superior apresenta crescimento organoide favorável, com apenas estruturas císticas se desenvolvendo. A linha inferior mostra crescimento desfavorável com uma grande estrutura densa aparecendo (encaixotado). Pontas de flechas brancas indicam detritos, pontas de flechas pretas indicam células únicas (ampliadas no inset). (B) Fragmentos organoides (ampliados no inset) semeados na passagem (Dia 0) e recrescimento de organoides como observado 7 dias depois. A linha superior mostra crescimento organoide favorável, com apenas estruturas císticas crescendo. A linha inferior mostra um recrescimento desfavorável com organoides densos tomando conta da cultura. (C) Mancha de imunofluorescência de E-Cad, SOX2, TROP2 (todos vermelhos), CK8/18, LHX3 e Ki67 (todos verdes) em organoides derivados da AL. Os núcleos são rotulados com Hoechst33342 (azul). Pontas de flecha indicam células Ki67+. As barras de escala são indicadas. (D) Análise da expressão genética dos marcadores de caule (Sox2, Cdh1, Krt8, Krt18, Trop2) e fatores de transcrição do desenvolvimento (Pitx1, Pitx2) em organoides primários derivados de AL e AL (Passagem 0 significa 14 dias após a semeadura celular) determinada por RT-qPCR (média ± SEM). Os pontos de dados representam réplicas biológicas. Os valores do limiar do ciclo delta (dCT) são mostrados, calculados usando a fórmula: CT (gene de interesse) - CT (gene de limpeza Actb). Quanto mais positivo o valor dCT (que é apresentado no eixo Y abaixo do eixo X zero), menor será o nível de expressão do gene de interesse. Quanto menor (ou mais negativo) o valor dCT, maior o nível de expressão 14,18,21,22. Clique aqui para ver uma versão maior desta figura.
| Meio organoide pituitário (PitOM) | |
| Componente | Concentração |
| DMEM avançado/F12 | |
| Hepes | 1% |
| Penicilina-Estreptomicina | 1% |
| Glutamax | 1% |
| Suplemento B-27 (50X), menos vitamina A | 1X |
| L-Glutamina (200 mM) | 2 mM |
| Proteína básica FGF/FGF2/bFGF (157 aa) humana recombinante | 20 ng/mL |
| IGF-1 Humano Recombinante | 100 ng/mL |
| Suplemento N-2 (100X) | 1X |
| N-acetil-cisteína | 1,25 mM |
| Humano recombinante/Murine FGF-8b | 200 ng/mL |
| FGF-10 Humano Recombinante | 100 ng/mL |
| A83-01 (inibidor de quinase semelhante ao receptor de activina 4/5/7) | 0,50 μM |
| Rato recombinante Sonic Hedgehog/Shh (C25II) N-Terminus | 100 ng/mL |
| Proteína EGF Humana Recombinante, CF | 50 ng/mL |
| SB202190 (inibidor de proteínas ativados por mitogênio p38) | 10 μM |
| Noggin humano recombinante | 100 ng/mL |
| Toxina da cólera de Vibrio cólerae | 100 ng/mL |
| R-Spondin-1 Humano Recombinante | 200 ng/mL |
| Il-6 humano recombinante | 20 ng/mL |
Mesa 1. Composição do PitOM. O PitOM é filtrado através de um filtro de malha de 0,22 μm e armazenado a 4 °C por um máximo de 2 semanas.
| Médio A | |
| Componente | Quantidade |
| DMEM, pó, alta glicose | 13,38 g |
| HEPES | 5,96 g |
| Piruvato de sódio (C3h3Nao3) | 0,11 g |
| Penicilina G sal de sódio | 35,00 mgs |
| Sal sulfato de estreptomicina | 50,00 mg |
| Cloreto de Sódio (NaCl) | 0,50 g |
| Carbonato de hidrogênio de sódio (NaHCO3) | 1,00 g |
| Albumina Bovina (grau de cultura celular) | 3,00 g |
| Água estéril | 1,00 L |
| Médio C | |
| Componente | Quantidade |
| Cloreto de Sódio (NaCl) | 7,50 g |
| Cloreto de potássio (KCl) | 0,40 g |
| Fosfato de sódio di-hidrogênio 1-hidratado | 0,14 g |
| D-glicose | 1,00 g |
| HEPES | 4,76 g |
| Sal sulfato de estreptomicina | 50,00 mg |
| Penicilina G sal de sódio | 35,00 mgs |
| Phenol vermelho | 10,00 mgs |
| Albumina Bovina (grau de cultura celular) | 3,00 g |
| Carbonato de hidrogênio de sódio (NaHCO3) | 1,00 g |
| Água estéril | 1,00 L |
| Médio B | |
| Componente | Quantidade |
| Titriplex III (dihidrato de sal dissódio edetate) | 0,74 g |
| Médio C | 100 mL |
Mesa 2. Composição dos médios A, B e C. Todas as mídias são filtradas através de um filtro de malha de 0,22 μm e armazenadas a 4 °C por um máximo de 4 meses. O pH dos médios A e C deve ser ajustado para 7,3.
| Meio de criopreservação | |
| Componente | Concentração |
| DMEM avançado/F12 | 60% |
| FBS | 30% |
| DMSO | 10% |
Mesa 3. Composição do meio criopreservador.
Discussão
Os organoides derivados da AL, como descrito aqui, representam um poderoso modelo de pesquisa para estudar células-tronco pituitárias in vitro. Atualmente, essa abordagem organoide é a única ferramenta disponível para crescer e expandir as células-tronco primárias. Um modelo organoide pituitário derivado de células-tronco embrionárias (ESC) ou células-tronco pluripotentes induzidas (iPSC) foi relatado anteriormente, o que recapitula de perto a organogênese embrionária pituitária23; no entanto, embora altamente útil para estudar o desenvolvimento pituitário ou modelo de doença pituitária 23,24,25, o protocolo relatado, a partir do ESC/iPSC, é muito demorado em comparação com o protocolo descrito aqui, e os organoides resultantes também não são expansíveis.
A cultura bem sucedida de organoides de células-tronco pituitárias depende de alguns passos críticos no protocolo. É importante emplacar um número adequado de células na semeadura celular inicial. Um número muito alto dará origem a culturas superlotadas, o que deteriora a viabilidade dos organoides e obstrui a expansão organoide completa, enquanto um número muito baixo de células resultará em formação organoide limitada. Além disso, é importante não perturbar a integridade da cúpula do ECM uma vez na cultura. A adição e remoção do meio deve ser feita com muito cuidado, sem tocar na gota de gel. Além disso, o pré-aquecimento do meio cultural reduz o risco de despolimerização do gel. Finalmente, passar os organoides corretamente (ou seja, dissociar-se a fragmentos e não a células únicas) é crucial para uma expansão eficiente das culturas.
Esses organoides de células-tronco pituitárias podem ser aproveitados para responder perguntas sobre o fenótipo, biologia e função das células-tronco. Eles já foram comprovados valiosos na descoberta de novas características de células-tronco, bem como marcadores de ativação de células-tronco associadas a danos pituitários e como uma ferramenta de leitura para a atividade de células-tronco (Figura 1)14,18. Os esforços atuais incluem sua derivação da pituitária doente, como hipopituitarismo e PitNETs (Figura 1). Eventualmente, os organoides também podem ser engajados em uma plataforma de rastreamento de medicamentos, conforme estabelecido com sucesso para outras doenças26,27. Portanto, será necessário um aumento mais elevado das culturas organoides para alcançar uma análise de alto rendimento. Já se notou que os organoides derivados da AL podem ser cultivados eficientemente em um formato de 96 poços, resultando também em culturas mais homogêneas.
Observou-se que após ~10 passagens (correspondentes a 3 meses de cultura), a eficiência do crescimento organoide diminuiu gradualmente com organoides crescendo em menor número e tamanho menor. Esse declínio de crescimento pode ser inerente à natureza intrínseca das células-tronco pituitárias, que podem não precisar se auto-renovar muitas vezes na glândula in vivo, que só está lentamente virando, ficando esgotada após algumas rodadas de divisão16,28. Embora esse eventual declínio de crescimento possa ser considerado como uma limitação, o modelo é altamente útil, uma vez que a expansão organoide durante as passagens anteriores é mais do que suficiente para extensas análises a jusante.
Outro aspecto que pode ser considerado como uma limitação é que os organoides de células-tronco pituitárias não apresentam capacidade de diferenciação proeminente para os tipos de células endócrinas da AL, mesmo após o xenoenxerto sob a cápsula renal de camundongos imunodeficientes (o que resultou em um número limitado de células GH+ e PRL+ conforme descrito em detalhe na referência18). Ou as condições in vitro certas para conduzir as células-tronco à diferenciação ainda não são identificadas, ou o papel principal das células-tronco (especialmente na glândula adulta) não está situado na geração de novas células endócrinas (uma vez que provavelmente não são necessárias na glândula preguiçosa, mas apenas em condições perturbadas ou desafiadas)9,10,14, 18 anos. Em vez disso, a função principal pode estar situada em outros aspectos biológicos (por exemplo, sinalização paracrina para o progenitor/precursor hormonal ou células maduras em condições básicas, mas provavelmente mais ativas (desenvolvimento, reparação, doença)13,16. De fato, embora as células-tronco pituitárias tenham se mostrado possuídas com capacidade de diferenciação multipotente especialmente no período embrionário e neonatal, é concebível que as células-tronco na glândula adulta não (precisam) manter essa capacidade, dada a rotatividade muito baixa da glândula adulta16,28. É possível que as células-tronco pituitárias adultas atuem mais como um centro de sinalização paracrina, envolvido em estimular ou regular as células progenitor/precursor/endócrinacircundante 13,16. Assim, a diferenciação robusta dos organoides de células-tronco pituitárias que culminam na secreção hormonal pode ser uma expectativa errônea que nunca será alcançada.
Em conjunto, o protocolo aqui apresentado oferece uma ferramenta rapidamente aplicável e confiável para expandir robustamente células-tronco primárias pituitárias em uma configuração 3D in vitro. O protocolo dá origem a organoides que capturam fielmente o fenótipo de células-tronco pituitárias. O sistema já foi aplicado com sucesso para estudar biologia de células-tronco pituitárias e ativação14,18, e os achados são altamente traduzíveis para a situação in vivo.
Divulgações
Os autores não declaram interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado por subsídios do Ku Leuven Research Fund e do Fundo de Pesquisa Científica (FWO) - Flandres. E.L. (11A3320N) e C.N. (1S14218N) são apoiados por uma Bolsa de Doutorado da FWO/FWO-SB.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250 | |
| 48-well plates, TC treated, individually wrapped | Costar | 734-1607 | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Advanced DMEM | Gibco | 12491023 | |
| Albumin Bovine (cell culture grade) | Serva | 47330 | |
| B-27 Supplement (50X), minus vitamin A | Gibco | 12587010 | |
| Base moulds | VWR | 720-1918 | |
| Buffer RLT | Qiagen | 79216 | |
| Cassettes, Q Path Microtwin | VWR | 720-2191 | |
| Cell strainer, 40 µm mesh, disposable | Falcon | 352340 | |
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | D5025 | |
| D-glucose | Merck | 108342 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM, powder, high glucose | Gibco | 52100039 | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | J1800AMNZ | |
| Epredia HistoStar Embedding Workstation, 220 to 240Vac | Thermo Fisher Scientific | 12587976 | |
| Ethanol Absolute 99.8+% | Thermo Fisher Scientific | 10342652 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| HEPES | Sigma-Aldrich | H4034 | |
| HEPES Buffer Solution | Gibco | 15630056 | |
| InSolution Y-27632 | Sigma-Aldrich | 688001 | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-Free | Corning | 15505739 | |
| Mr. Frosty Freezing Container | Thermo Fisher Scientific | 5100-0001 | |
| N-2 Supplement (100X) | Thermo Fisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A7250 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | Thermo Fisher Scientific | 375353 | |
| Paraformaldehyde for synthesis (PFA) | Merck | 818715 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Penicillin G sodium salt | Sigma-Aldrich | P3032 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Phenol red | Merck | 107241 | |
| Potassium Chloride (KCl) | Merck | 104936 | |
| Recombinant Human EGF Protein, CF | R&D systems | 236-EG | |
| Recombinant Human FGF basic/FGF2/bFGF (157 aa) Protein | R&D systems | 234-FSE | |
| Recombinant Human FGF-10 | Peprotech | 100-26 | |
| Recombinant Human IGF-1 | Peprotech | 100-11 | |
| Recombinant Human IL-6 | Peprotech | 200-06 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human R-Spondin-1 | Peprotech | 120-38 | |
| Recombinant Human/Murine FGF-8b | Peprotech | 100-25 | |
| Recombinant Mouse Sonic Hedgehog/Shh (C25II) N-Terminus | R&D systems | 464-SH | |
| RNeasy micro kit | Qiagen | 74004 | |
| SB202190 | Sigma-Aldrich | S7067 | |
| SeaKem LE Agarose | Lonza | 50004 | |
| Sodium Chloride (NaCl) | BDH | 102415K | |
| Sodium di-Hydrogen Phosphate 1-hydrate | PanReac-AppliChem | A1047 | |
| Sodium Hydrogen Carbonate (NaHCO3) | Merck | 106329 | |
| Sodium-Pyruvate (C3H3NaO3) | Sigma-Aldrich | P5280 | |
| Stericup-GP, 0.22 µm | Millipore | SCGPU02RE | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 0.22 μm | Millipore | SCGP00525 | |
| Sterile water | Fresenius | B230531 | |
| Streptomycin sulfate salt | Sigma-Aldrich | S6501 | |
| Syringe, with BD Microlance needle with intradermal bevel, 26G | BD Plastipak | BDAM303176 | |
| Thermo Scientific Excelsior ES Tissue Processor | Thermo Scientific | 12505356 | |
| Titriplex III | Merck | 108418 | |
| TrypL Express Enzyme (1X), phenol red | Thermo Fisher Scientific | 12605028 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma-Aldrich | T9003 | |
| Trypsin solution 2.5 % | Thermo Fisher Scientific | 15090046 |
Referências
- Melmed, S. . The pituitary. 3rd ed. , 1 (2011).
- Chen, J., et al. The adult pituitary contains a cell population displaying stem/progenitor cell and early-embryonic characteristics. Endocrinology. 146 (9), 3985-3998 (2005).
- Chen, J., et al. Pituitary progenitor cells tracked down by side population dissection. Stem Cells. 27 (5), 1182-1195 (2009).
- Fauquier, T., Rizzoti, K., Dattani, M., Lovell-Badge, R., Robinson, I. C. A. F. SOX2-expressing progenitor cells generate all of the major cell types in the adult mouse pituitary gland. Proceedings of the National Academy of Sciences of the United States of America. 105 (8), 2907-2912 (2008).
- Rizzoti, K., Akiyama, H., Lovell-Badge, R. Mobilized adult pituitary stem cells contribute to endocrine regeneration in response to physiological demand. Cell Stem Cell. 13 (4), 419-432 (2013).
- Andoniadou, C. L., et al. Sox2+ stem/progenitor cells in the adult mouse pituitary support organ homeostasis and have tumor-inducing potential. Cell Stem Cell. 13 (4), 433-445 (2013).
- Nys, C., Vankelecom, H. Pituitary disease and recovery: How are stem cells involved. Molecular and Cellular Endocrinology. 525 (4), 111176 (2021).
- Schneider, H. J., Aimaretti, G., Kreitschmann-Andermahr, I., Stalla, G. K., Ghigo, E. Hypopituitarism. Lancet. 369 (9571), 1461-1470 (2007).
- Fu, Q., et al. The adult pituitary shows stem/progenitor cell activation in response to injury and is capable of regeneration. Endocrinology. 153 (7), 3224-3235 (2012).
- Willems, C., et al. Regeneration in the pituitary after cell-ablation injury: time-related aspects and molecular analysis. Endocrinology. 157 (2), 705-721 (2016).
- Gremeaux, L., Fu, Q., Chen, J., Vankelecom, H. Activated phenotype of the pituitary stem/progenitor cell compartment during the early-postnatal maturation phase of the gland. Stem Cells and Development. 21 (5), 801-813 (2012).
- Zhu, X., Tollkuhn, J., Taylor, H., Rosenfeld, M. G. Notch-dependent pituitary SOX2+ stem cells exhibit a timed functional extinction in regulation of the postnatal gland. Stem Cell Reports. 5 (6), 1196-1209 (2015).
- Russell, J. P., et al. Pituitary stem cells produce paracrine WNT signals to control the expansion of their descendant progenitor cells. eLife. 10 (1), 59142 (2021).
- Vennekens, A., et al. Interleukin-6 is an activator of pituitary stem cells upon local damage, a competence quenched in the aging gland. Proceedings of the National Academy of Sciences of the United States of America. 118 (25), 2100052118 (2021).
- Mertens, F., et al. Pituitary tumors contain a side population with tumor stem cell-associated characteristics. Endocrine-Related Cancer. 22 (4), 481-504 (2015).
- Laporte, E., Vennekens, A., Vankelecom, H. Pituitary remodeling throughout life: are resident stem cells involved. Frontiers in Endocrinology. 11 (1), 604519 (2021).
- Yoshida, S., et al. Isolation of adult pituitary stem/progenitor cell clusters located in the parenchyma of the rat anterior lobe. Stem Cell Research. 17 (2), 318-329 (2016).
- Cox, B., et al. Organoids from pituitary as novel research model to study pituitary stem cell biology. Journal of Endocrinology. 240 (2), 287-308 (2019).
- Denef, C., Hautekeete, E., De Wolf, A., Vanderschueren, B. Pituitary basophils from immature male and female rats: distribution of gonadotrophs and thyrotrophs as studied by unit gravity sedimentation. Endocrinology. 130 (3), 724-735 (1978).
- Vander Schueren, B., Denef, C., Cassiman, J. J. Ultrastructural and functional characteristics of rat pituitary cell aggregates. Endocrinology. 110 (2), 513-523 (1982).
- Claes, C., et al. Human stem cell-derived monocytes and microglia-like cells reveal impaired amyloid plaque clearance upon heterozygous or homozygous loss of TREM2. Alzheimer's and Dementia. 15 (3), 453-464 (2019).
- Trompeter, H. -. I., et al. MicroRNAs miR-26a, miR-26b, and miR-29b accelerate osteogenic differentiation of unrestricted somatic stem cells from human cord blood. BMC Genomics. 14, 111 (2013).
- Suga, H., et al. Self-formation of functional adenohypophysis in three-dimensional culture. Nature. 480 (7375), 57-62 (2011).
- Matsumoto, R., et al. Congenital pituitary hypoplasia model demonstrates hypothalamic OTX2 regulation of pituitary progenitor cells. Journal of Clinical Investigation. 130 (2), 641-654 (2019).
- Kanie, K., et al. Pathogenesis of anti-PIT-1 antibody syndrome: PIT-1 presentation by HLA class I on anterior pituitary cells. Journal of the Endocrine Society. 3 (11), 1969-1978 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Yan, H. H. N., et al. A comprehensive human gastric cancer organoid biobank captures tumor subtype heterogeneity and enables therapeutic screening. Cell Stem Cell. 23 (6), 882-897 (2018).
- Nolan, L. A., Kavanagh, E., Lightman, S. L., Levy, A. Anterior pituitary cell population control: basal cell turnover and the effects of adrenalectomy and dexamethasone treatment. Journal of Neuroendocrinology. 10 (3), 207-215 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados