Method Article
تطوير المواد العضوية من الغدة النخامية الفأر كما في المختبر نموذج لاستكشاف بيولوجيا الخلايا الجذعية النخامية
In This Article
Summary
الغدة النخامية هي المنظم الرئيسي لنظام الغدد الصماء في الجسم. تصف هذه المقالة تطور المواد العضوية من الغدة النخامية للفأر كنموذج 3D جديد في المختبر لدراسة مجموعة الخلايا الجذعية في الغدة التي لا تزال البيولوجيا والوظيفة غير مفهومة بشكل جيد.
Abstract
الغدة النخامية هي الغدة الصماء الرئيسية التي تنظم العمليات الفسيولوجية الرئيسية ، بما في ذلك نمو الجسم ، والتمثيل الغذائي ، والنضج الجنسي ، والتكاثر ، والاستجابة للإجهاد. منذ أكثر من عقد من الزمان ، تم تحديد الخلايا الجذعية في الغدة النخامية. ومع ذلك ، على الرغم من تطبيق مناهج المعدلة وراثيا في الجسم الحي ، إلا أن نمطها الظاهري والبيولوجيا ودورها لا يزال غير واضح. لمعالجة هذا اللغز ، تم تطوير نموذج عضوي جديد ومبتكر في المختبر لكشف بيولوجيا الخلايا الجذعية النخامية بعمق. تمثل المواد العضوية هياكل الخلايا 3D التي ، في ظل ظروف ثقافة محددة ، تتطور ذاتيا من الخلايا الجذعية (الظهارية) للأنسجة وتلخص علامات مميزة متعددة لتلك الخلايا الجذعية وأنسجتها. يظهر هنا أن المواد العضوية المشتقة من الغدة النخامية للفئران تتطور من الخلايا الجذعية للغدة وتلخص بأمانة خصائصها الظاهرية والوظيفية في الجسم الحي . من بين أمور أخرى ، فإنها تعيد إنتاج حالة تنشيط الخلايا الجذعية كما هو الحال في الجسم الحي التي تحدث استجابة للضرر الموضعي المعدل وراثيا. المواد العضوية قابلة للتوسع على المدى الطويل مع الاحتفاظ بقوة بنمطها الظاهري الجذعي. ويعد النموذج البحثي الجديد ذا قيمة عالية لفك رموز النمط الظاهري للخلايا الجذعية وسلوكها خلال الظروف الرئيسية لإعادة تشكيل الغدة النخامية، بدءا من نضج حديثي الولادة إلى التلاشي المرتبط بالشيخوخة، ومن الغدد الصحية إلى الغدد المريضة. هنا ، يتم تقديم بروتوكول مفصل لإنشاء المواد العضوية المشتقة من الغدة النخامية للفئران ، والتي توفر أداة قوية للغوص في عالم الخلايا الجذعية النخامية الغامض.
Introduction
الغدة النخامية هي غدة صماء صغيرة تقع في قاعدة الدماغ ، حيث ترتبط بمنطقة ما تحت المهاد. تدمج الغدة المدخلات الطرفية والمركزية (تحت المهاد) لتوليد إطلاق هرمون مضبوط ومنسق ، وبالتالي تنظيم أعضاء الغدد الصماء المستهدفة في المصب (مثل الغدد الكظرية والغدد التناسلية) لإنتاج الهرمونات المناسبة في الوقت المناسب. الغدة النخامية هي المنظم الرئيسي لنظام الغدد الصماء ، وبالتالي يطلق عليها بحق الغدة الرئيسية1.
تتكون الغدة النخامية للفأر من ثلاثة فصوص (الشكل 1) ، أي الفص الأمامي (AL) ، والفص الوسيط (IL) ، والفص الخلفي (PL). الغدد الصماء الرئيسية AL يحتوي على خمسة أنواع من الخلايا الهرمونية, بما في ذلك somatotropes التي تنتج هرمون النمو (GH); اللاكتوتروبات التي تولد البرولاكتين (PRL) ؛ القشرية التي تفرز هرمون قشر الكظر (ACTH) ؛ الثيروتروب المسؤول عن إنتاج هرمون تحفيز الغدة الدرقية (TSH) ؛ والغدد التناسلية التي تصنع الهرمون الملوتن (LH) والهرمون المنبه للجريب (FSH). يتكون PL من إسقاطات محورية من منطقة ما تحت المهاد حيث يتم تخزين هرمونات الأوكسيتوسين وفاسوبريسين (هرمون مضاد لإدرار البول). يقع IL بين AL و PL ويضم الميلانوتروب التي تنتج هرمون تحفيز الخلايا الصباغية (MSH). في الغدة النخامية البشرية ، يتراجع IL أثناء التطور ، وتنتشر الميلانوتروب داخل AL1. بالإضافة إلى خلايا الغدد الصماء ، تحتوي الغدة النخامية أيضا على مجموعة من الخلايا الجذعية ، تتميز بشكل أساسي بعامل النسخ SOX2 2,3,4,5,6. تقع خلايا SOX2+ هذه في المنطقة الهامشية (MZ) ، البطانة الظهارية للشق (تجويف بقايا جنينية بين AL و IL) ، أو تنتشر كمجموعات في جميع أنحاء حمة AL ، مما يقترح اثنين من منافذ الخلايا الجذعية في الغدة (الشكل 1) 2،3،4،5،6.
بالنظر إلى الطبيعة التي لا غنى عنها للغدة النخامية ، يرتبط خلل في الغدة بأمراض خطيرة. يمكن أن يحدث فرط الغدة النخامية (الذي يتميز بالإفراط في إفراز واحد أو أكثر من الهرمونات) وقصور الغدة النخامية (إنتاج معيب أو مفقود لواحد أو أكثر من الهرمونات) بسبب أورام الغدد الصماء العصبية النخامية (PitNETs ؛ على سبيل المثال ، الأورام المنتجة ل ACTH التي تؤدي إلى مرض كوشينغ) أو بسبب العيوب الوراثية (على سبيل المثال ، نقص هرمون النمو مما يؤدي إلى التقزم)7. بالإضافة إلى ذلك ، فإن جراحة الغدة النخامية (على سبيل المثال ، لإزالة الأورام) ، والالتهابات (على سبيل المثال ، السل تحت المهاد والغدة النخامية ، أو العدوى التي تلي التهاب السحايا الجرثومي أو التهاب الدماغ) ، ومتلازمة شيهان (نخر بسبب عدم كفاية تدفق الدم بسبب فقدان الدم الشديد عند الولادة) ، وسكتة الغدة النخامية وإصابة الدماغ الرضحية هي أسباب مهمة أخرى لنقص وظائف الغدة النخامية8 . وقد تبين أن الغدة النخامية للفأر تمتلك القدرة التجديدية ، حيث تكون قادرة على إصلاح الضرر المحلي الناجم عن الاستئصال المعدل وراثيا لخلايا الغدد الصماء 9,10. تتفاعل الخلايا الجذعية SOX2+ بشكل حاد مع الإصابة التي تظهر نمطا ظاهريا نشطا ، يتميز بانتشار معزز (مما يؤدي إلى توسع الخلايا الجذعية) وزيادة التعبير عن العوامل والمسارات المرتبطة بالجذعية (على سبيل المثال ، WNT / NOTCH). علاوة على ذلك ، تبدأ الخلايا الجذعية في التعبير عن الهرمون المبتور ، مما يؤدي في النهاية إلى استعادة كبيرة لمجموعة الخلايا المستنفدة على مدى الأشهر التالية (5 إلى 6) 9,10. أيضا ، خلال مرحلة نضج حديثي الولادة للغدة (أول 3 أسابيع بعد الولادة) ، تزدهر الخلايا الجذعية النخامية في حالة تنشيط 6,11,12,13 ، في حين ترتبط الشيخوخة العضوية بانخفاض وظائف الخلايا الجذعية في الموقع ، بسبب زيادة البيئة الالتهابية (الدقيقة) عند الشيخوخة (أو "الالتهاب")10,14 . بالإضافة إلى ذلك ، يرتبط تكوين الورم في الغدة أيضا بتنشيط الخلايا الجذعية 7,15. على الرغم من اكتشاف تنشيط الخلايا الجذعية في العديد من حالات إعادة تشكيل الغدة النخامية (تمت مراجعتها في 7,16) ، إلا أن الآليات الأساسية لا تزال غير واضحة. نظرا لأن النهج في الجسم الحي (مثل تتبع النسب في الفئران المعدلة وراثيا) لم تقدم صورة واضحة أو شاملة للخلايا الجذعية للنخامة ، فإن تطوير نماذج موثوقة في المختبر لاستكشاف بيولوجيا الخلايا الجذعية في الغدة النخامية الطبيعية والمريضة أمر ضروري. لا تزال الزراعة القياسية في المختبر للخلايا الجذعية الأولية للنخامة غير كافية بسبب قدرة النمو المحدودة للغاية والظروف غير الفسيولوجية (2D) مع الفقدان السريع للنمط الظاهري (للحصول على نظرة عامة أكثر تفصيلا ، انظر16). تم إنشاء مزارع المجال ثلاثي الأبعاد (pituispheres) من الخلايا الجذعية النخامية كما تم تحديدها من قبل السكان الجانبيين والنمط الظاهري SOX2 + 2,3,4. تنمو البيتيسفير بشكل مستنسخ من الخلايا الجذعية ، وتعبر عن علامات الجذعية وتظهر قدرة التمايز في أنواع خلايا الغدد الصماء. ومع ذلك ، فإنها لا تتوسع بشكل كبير بينما تظهر فقط قابلية مرور محدودة (2-3 مقاطع) 3,4. كما تم الحصول على هياكل تشبه الكرة من مجموعات الخلايا الجذعية النخامية غير المنفصلة عند استزراعها في 50٪ من Matrigel المخفف لمدة أسبوع واحد ، ولكن لم تظهر قابلية التوسع17. يستخدم نهج البيتوسفير في الغالب كأداة قراءة لأعداد الخلايا الجذعية ، ولكن التطبيقات الأخرى محدودة بقدرة توسع أقل شأنا16.
لمعالجة هذه العيوب والتغلب عليها ، تم مؤخرا إنشاء نموذج 3D جديد ، أي المواد العضوية ، بدءا من AL الغدد الصماء الرئيسية للفئران التي تحتوي على MZ والخلايا الجذعية المتني. وقد تبين أن المواد العضوية مشتقة بالفعل من الخلايا الجذعية للغدة النخامية وتلخص بأمانة نمطها الظاهري18. علاوة على ذلك ، فإن المواد العضوية قابلة للتوسع على المدى الطويل ، مع الحفاظ بقوة على طبيعتها الجذعية. لذلك ، فإنها توفر طريقة موثوقة لتوسيع الخلايا الجذعية الأولية للنخامة للاستكشاف العميق. مثل هذا الاستكشاف غير قابل للتحقيق مع العدد المحدود من الخلايا الجذعية التي يمكن عزلها من الغدة النخامية ، والتي هي أيضا غير قابلة للتوسيع في ظروف ثنائية الأبعاد16. وقد تبين أن المواد العضوية هي أدوات قيمة وموثوقة للكشف عن ميزات الخلايا الجذعية النخامية الجديدة (يمكن ترجمتها إلى الجسم الحي)14،18. الأهم من ذلك ، أن النموذج العضوي يعكس بأمانة حالة تنشيط الخلايا الجذعية النخامية كما يحدث أثناء تلف الأنسجة المحلية ونضج حديثي الولادة ، مما يدل على تعزيز كفاءة التكوين وتكرار المسارات الجزيئية غير المنظمة14،18. وبالتالي ، فإن نموذج العضوية المشتق من الغدة النخامية هو نموذج بحثي مبتكر وقوي لبيولوجيا الخلايا الجذعية النخامية بالإضافة إلى أداة قراءة تنشيط الخلايا الجذعية.
يصف هذا البروتوكول بالتفصيل إنشاء المواد العضوية المشتقة من الغدة النخامية للفئران. تحقيقا لهذا الهدف ، يتم عزل AL وفصله إلى خلايا مفردة ، والتي يتم تضمينها في مصفوفة محاكاة خارج الخلية Matrigel (يشار إليها هنا باسم ECM). ثم يتم استزراع مجموعة الخلايا ECM في وسط محدد ، يحتوي بشكل أساسي على عوامل نمو الخلايا الجذعية ومنظمات الغدة النخامية الجنينية (يشار إليها أيضا باسم "وسط الغدة النخامية" العضوي (PitOM)18 ؛ الجدول 1). بمجرد اكتمال تطوير المواد العضوية (بعد 10-14 يوما) ، يمكن توسيعها بشكل أكبر من خلال المرور المتسلسل للحوض الصغير وإخضاعها لاستكشاف مكثف في اتجاه المصب (على سبيل المثال ، التألق المناعي ، RT-qPCR ، والنسخ السائبة أو أحادية الخلية ؛ الشكل 1). على المدى الطويل ، من المتوقع أن تمهد الخلايا الجذعية النخامية العضوية الطريق لنهج إصلاح الأنسجة والطب التجديدي.
Protocol
تمت الموافقة على التجارب على الحيوانات لهذه الدراسة من قبل لجنة KU Leuven الأخلاقية للتجارب على الحيوانات (P153/2018). تم إيواء جميع الفئران في منشأة الحيوانات في الجامعة في ظل ظروف موحدة (درجة حرارة ثابتة تبلغ 23 ± 1.5 درجة مئوية ، والرطوبة النسبية 40٪ -60٪ ، ودورة نهارية / ليلية من 12 ساعة) ، مع إمكانية الوصول إلى الماء والغذاء بشكل خاص.
1. الفئران
- استخدم سلالات الماوس المتاحة تجاريا، مثل الفئران C57BL/6J، من سن الشباب البالغين (8-12 أسبوعا). بشكل عام ، توفر 2-3 فئران عددا كافيا من خلايا AL للبروتوكول.
2. عزل وتفكك الماوس AL
ملاحظة: يتم إعداد المتوسط A و B و C مقدما19,20. وترد التراكيب في الجدول 2.
- عزل الفأر AL
- القتل الرحيم للفئران عن طريق اختناق ثاني أكسيد الكربون2 ، يليه قطع الرأس (الشكل 2 أ). اغسل رؤوس الفئران بالماء منزوع الأيونات لإزالة الدم ورشها ب 70٪ EtOH لتوليد بيئة معقمة.
- باستخدام أدوات جراحية معقمة ، قم بإزالة جلد الرأس بين الأذنين (الشكل 2B).
- افتح الجمجمة وأزل الدماغ.
- كسر "جسر الأنف" (أي الجزء الأمامي من العظم الجبهي; الشكل 2 ب) مع مقص معقم.
- افتح الجمجمة أكثر باستخدام المقص ، بدءا من جسر الأنف المكسور نحو الأذنين ، على كلا الجانبين (الشكل 2C).
- قم بإزالة الجمجمة والدماغ باستخدام ملاقط معقمة ، دون لمس الغدة النخامية (الشكل 2D).
- قم بإزالة الحجاب الحاجز sellae باستخدام ملاقط حادة ، دون الإضرار بالغدة النخامية. تخلص من PL و IL من AL تحت المجهر المجسم.
ملاحظة: يتم ربط PL و IL وبالتالي إزالتهما في وقت واحد. تظهر هذه الأجزاء كأنسجة بيضاء ، مقارنة ب AL الوردي اللون (الشكل 2D). - اعزل AL بعناية باستخدام ملاقط حادة واجمعها في قارورة Erlenmeyer سعة 10 مل ، مملوءة ب 3 مل من A المتوسطة (انظر الجدول 2). ضع القارورة على الثلج حتى تتم معالجتها مرة أخرى.
- انفصال الفأر AL
- قم بإزالة الوسط الفائق (SN) A من قارورة Erlenmeyer التي تحتوي على AL. أضف 2 مل من محلول التربسين المسخن مسبقا (37 درجة مئوية) بنسبة 2.5٪ واحتضنه عند 37 درجة مئوية لمدة 15 دقيقة.
- بدون إزالة محلول التربسين ، أضف 2 مل من محلول DNase المسخن مسبقا (37 درجة مئوية) (2 ميكروغرام / مل في الوسط A ؛ معقم يتم تصفيته من خلال شبكة 0.22 ميكرومتر) ، وقم بتدوير قارورة Erlenmeyer 10 مرات. دع الغدة النخامية تغرق في القاع (~ 1 دقيقة) وقم بإزالة SN.
- أضف 2 مل من محلول مثبط التربسين المسخن مسبقا (37 درجة مئوية) (0.1 مجم / مل في الوسط A ؛ معقم يتم تصفيته من خلال شبكة 0.22 ميكرومتر) واحتضنه عند 37 درجة مئوية لمدة 10 دقائق. دع الرواسب النخامية إلى القاع وقم بإزالة SN.
- أضف 2 مل من الوسط B المسخن مسبقا (37 درجة مئوية) (انظر الجدول 2) واحتضنه عند 37 درجة مئوية لمدة 5 دقائق. بدون إزالة SN ، أضف 2 مل من درجة الحرارة المسبقة (37 درجة مئوية) متوسطة C (انظر الجدول 2) واحتضنها عند 37 درجة مئوية لمدة 15 دقيقة.
- دع الغدة النخامية تغرق في القاع وإزالة SN. شطف الغدة النخامية ثلاث مرات مع درجة حرارة مسبقة (37 درجة مئوية) متوسطة مئوية.
- فصل الغدة النخامية إلى خلايا واحدة.
- أضف 2 مل من درجة الحرارة المسبقة (37 درجة مئوية) متوسطة C. استنشق واطرد الغدة النخامية باستخدام ماصة باستور معقمة ومصقولة باللهب عدة مرات ، حتى لا تكون الشظايا مرئية بعد الآن.
- انقل التعليق إلى أنبوب 15 مل مع 4.5 مل من محلول DNase المسخن مسبقا (37 درجة مئوية) (2 ميكروغرام / مل في الوسط A ؛ معقم التصفية من خلال شبكة 0.22 ميكرومتر). شطف Erlenmeyer ثلاث مرات مع 2 مل من درجة الحرارة المسبقة (37 درجة مئوية) متوسطة C ونقل التعليق إلى أنبوب 15 مل.
- امزج تعليق الخلية الذي تم جمعه وقم بتصفيته من خلال مصفاة خلية 40 ميكرومتر في أنبوب سعة 30 مل. شطف أنبوب 15 مل ومصفاة الخلية ثلاث مرات مع 2 مل من C المتوسطة ونقل التعليق إلى أنبوب 30 مل.
- ضع طرف ماصة باستور الزجاجية ، المملوءة ب 2 مل من محلول ألبومين مصل البقر (BSA) بنسبة 3٪ (في الوسط A ؛ معقم التصفية من خلال شبكة 0.22 ميكرومتر) ، في الجزء السفلي من الأنبوب وماصة بلطف لتشكيل طبقة كثافة مرئية. جهاز طرد مركزي عند 190 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- قم بإزالة SN عن طريق عكس الأنبوب في حركة واحدة بطلاقة وإزالة قطرات SN المتبقية بطرف P1000. أعد تعليق حبيبة الخلية في 1 مل من DMEM / F12 المتقدم البارد (Adv DMEM / F12) وحدد كمية الخلايا باستخدام عداد الخلايا.
3. إنشاء وزراعة المواد العضوية المشتقة من AL
ملاحظة: قم بإذابة ECM على الجليد مقدما (2-3 ساعات لمدة 1 مل) واحتفظ به على الجليد طوال مدة البروتوكول.
- البذر العضوي والزراعة
- قم بالطرد المركزي لنظام تعليق AL الخلوي عند 190 × g لمدة 10 دقائق عند 4 درجات مئوية وقم بإزالة SN. أعد تعليق بيليه الخلية في Adv DMEM/F12 باستخدام الحجم المحدد المحسوب للوصول إلى كثافة خلية تبلغ 1.1 × 106 خلايا/مل.
ملاحظة: على سبيل المثال ، إذا كان تعليق الخلية يحتوي على 500000 خلية / مل ، فيجب على المرء إعادة تعليق بيليه الخلية في 454.54 ميكرولتر من Adv DMEM / F12 للوصول إلى الكثافة المطلوبة من 1.1 × 106 خلايا / مل. - أخرج حجم تعليق الخلايا اللازم للطلاء (وفقا للعدد المطلوب من الآبار للبذور لتطوير العضوية) وأضف ECM بنسبة 30: 70 (تعليق الخلية 30٪ (في Adv DMEM / F12 ) و 70٪ ECM). تخلط جيدا عن طريق سحب لأعلى ولأسفل.
ملاحظة: على سبيل المثال ، بالنسبة لقطرة واحدة من 30 ميكرولتر (انظر الخطوة 3.1.3) ، يجب على المرء (بلطف) خلط 9 ميكرولتر من تعليق الخلية (يحتوي على ~ 10000 خلية عند أخذها من تعليق 1.1 × 106 خلايا / مل) مع 21 ميكرولتر من ECM. - لكل بئر ، قم بإيداع قطرة 30 ميكرولتر من خليط تعليق الخلية / ECM (انظر الخطوة 3.1.2) على لوحة 48 بئرا تم تسخينها مسبقا (37 درجة مئوية). اقلب اللوحة رأسا على عقب واترك ECM يتصلب عند 37 درجة مئوية لمدة 20 دقيقة.
ملاحظة: قم بتسخين ألواح الاستزراع مسبقا لمدة 24 ساعة على الأقل عند 37 درجة مئوية. - أعد اللوحة إلى اتجاهها الصحيح وأضف بعناية 250 ميكرولتر من PitOM المسخن مسبقا (37 درجة مئوية) (انظر الجدول 1) المكمل بمثبط الصخور 10 ميكرومتر (Y-27632).
- استمر في زراعة المواد العضوية عن طريق تغيير الوسط (الخالي من Y-27632) كل 2-3 أيام حتى تنمو المواد العضوية بالكامل ، الأمر الذي يستغرق ما بين 10-14 يوما (الشكل 3A). ثم ، تمرير المواد العضوية.
ملاحظة: عند شفط الوسط، تأكد من عدم تعطيل قبة ECM. قم بإمالة لوحة الثقافة قليلا وإزالة الوسط من الحافة السفلية للبئر. يجب إضافة الوسط الطازج (المسخن مسبقا عند 37 درجة مئوية) بلطف إلى جانب البئر. إذا تم فك الالتصاق قطرات الجل ، فقم بجمع المواد العضوية وإعادة تعليقها وزراعتها مرة أخرى في قطرة ECM جديدة.
- قم بالطرد المركزي لنظام تعليق AL الخلوي عند 190 × g لمدة 10 دقائق عند 4 درجات مئوية وقم بإزالة SN. أعد تعليق بيليه الخلية في Adv DMEM/F12 باستخدام الحجم المحدد المحسوب للوصول إلى كثافة خلية تبلغ 1.1 × 106 خلايا/مل.
- مرور عضوي
- استنشاق الوسط بلطف وإضافة 400 ميكرولتر من Adv DMEM / F12 البارد المثلج لتفكيك ECM وجمع المواد العضوية في أنبوب الطرد المركزي الدقيق. يغسل مرة واحدة مع 400 ميكرولتر من الثلج البارد Adv DMEM / F12 EM. جهاز طرد مركزي عند 200 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة SN بعناية وأضف 400 ميكرولتر من إنزيم TrypLE Express المسخن مسبقا (37 درجة مئوية) (1X). اخلطي المزيج عن طريق عكس الأنبوب عدة مرات ، واحتضنيه عند 37 درجة مئوية لمدة 5 دقائق.
- أضف 400 ميكرولتر من Adv DMEM / F12 البارد المثلج وأجهزة الطرد المركزي عند 200 × g لمدة 5 دقائق عند 4 درجات مئوية. إزالة SN.
- أعد تعليق الكريات ب 100 ميكرولتر من Adv DMEM / F12 البارد ، ثم قم بتفتيت المواد العضوية عن طريق السحب بقوة لأعلى ولأسفل باستخدام طرف P200 ضيق (أي دفع الطرف الفارغ لأسفل ضد الجزء السفلي من أنبوب الطرد المركزي الدقيق ، لتقليل قطر فتحه) حتى يتم الحصول على شظايا عضوية (يبلغ قطرها حوالي 50 ميكرومتر) (الشكل 3B).
ملاحظة: يجب أن يحتوي خليط التفكك على شظايا عضوية في الغالب وعدد قليل من الخلايا المفردة. يؤثر التفكك القاسي للعضويات إلى خلايا مفردة سلبا على إعادة نمو المواد العضوية. - أضف 800 ميكرولتر من Adv DMEM / F12 وأجهزة الطرد المركزي عند 190 × g لمدة 10 دقائق عند 4 درجات مئوية. إزالة SN.
- تمرير المواد العضوية بنسبة 1: 2 إلى 1: 4. أعد تعليق الكريات في حجم مناسب من Adv DMEM/F12 حسب الحاجة للطلاء وأضف ECM بنسبة 30:70 (تعليق خلوي بنسبة 30٪ و 70٪ ECM). تخلط جيدا عن طريق سحب لأعلى ولأسفل.
- البذور وزراعة المواد العضوية كما هو موضح أعلاه في الخطوات 3.1.3-3.1.5.
ملاحظة: في المتوسط، يتطور 20 مادة عضوية لكل بئر من 10000 خلية كاملة من خلايا AL المبذرة (0.2٪). يمكن تقسيم هذه المقاطع العضوية 0 بنسبة 1: 2 ، مما يؤدي إلى تطور >50 عضويا لكل بئر (المقطع 1). يمكن بعد ذلك تقسيم المواد العضوية بنسبة 1: 2 إلى 1: 4 خلال المقاطع اللاحقة. تتباطأ إعادة نمو المواد العضوية بعد حوالي 10 مقاطع (المقابلة ل 3 أشهر من الثقافة) ، تتجسد في عضويات أقل وأصغر تدريجيا.
4. الحفظ بالتبريد للعضويات المشتقة من AL وإذابتها
- الحفظ بالتبريد للمواد العضوية
- اتبع بروتوكول المرور من الخطوة 3.2.1 حتى الخطوة 3.2.5.
- أعد تعليق الكريات العضوية (التي تحتوي على شظايا وخلايا) مع 1 مل من وسط الحفظ بالتبريد (الجدول 3). انقل التعليق إلى تبريد وضعه على الجليد.
ملاحظة: يمكن الجمع بين المواد العضوية (أي الشظايا والخلايا الناتجة) من ما يصل إلى أربعة آبار من صفيحة 48 بئرا في بئر واحدة مبردة. - ضع الكريوفيالات في حاوية تجميد وانقلها إلى -80 درجة مئوية.
- بعد 24 ساعة ، انقل العينات إلى صندوق تبريد وخزنها في النيتروجين السائل (-196 درجة مئوية) للتخزين على المدى الطويل.
- ذوبان المواد العضوية المحفوظة بالتجميد
- قم بإزالة المبرد من خزان النيتروجين السائل وضعه على الجليد. المضي قدما على الفور مع بروتوكول الذوبان.
- قم بإذابة المحلول بشظايا العضوية المحفوظة بالتجميد والخلايا المفردة عند 37 درجة مئوية (حمام مائي).
ملاحظة: لا تحتفظ بالمحلول لأكثر من 2 دقيقة عند 37 درجة مئوية لتجنب سمية الخلايا بواسطة DMSO. - انقل المحتوى إلى أنبوب سعة 15 مل يحتوي على 10 مل من Adv DMEM / F12 البارد مع مصل بقري جنيني بنسبة 30٪ (FBS). شطف المبرد مع 1 مل من Adv DMEM/F12 مع 30٪ FBS.
- جهاز طرد مركزي عند 190 × جم لمدة 10 دقائق عند 4 درجات مئوية. أعد تعليق الكريات مع 1 مل من Adv DMEM / F12 البارد المثلج وانقل التعليق إلى أنبوب جهاز طرد مركزي دقيق.
- جهاز طرد مركزي عند 190 × جم لمدة 10 دقائق عند 4 درجات مئوية. أعد تعليق الكريات في حجم مناسب من Adv DMEM/F12 حسب الحاجة للطلاء وأضف ECM بنسبة 30:70. تخلط جيدا عن طريق سحب لأعلى ولأسفل.
- البذور وزراعة المواد العضوية كما هو موضح أعلاه في الخطوات 3.1.3-3.1.5.
5. التحقق من صحة المواد العضوية المشتقة من AL
- جمع وتحلل المواد العضوية لعزل الحمض النووي الريبي
- جمع وطرد مركزي المواد العضوية كما هو موضح أعلاه (الخطوة 3.2.1).
- قم بإزالة SN وإضافة 350 ميكرولتر من المخزن المؤقت للتحلل مع 1٪ 2-mercapto-ethanol. دوامة لمدة 30 ثانية وتخزينها في -80 درجة مئوية أو المضي قدما على الفور إلى عزل الحمض النووي الريبي.
تحذير: احذر من أن 2-mercapto-ethanol هو مركب سام. يجب أن يتم كل العمل في غطاء الدخان الكيميائي أثناء ارتداء قفازات النتريل وقناع الغبار ونظارات السلامة. 2-ميركابتو-الإيثانول يمكن أن يسبب ضررا لا رجعة فيه للعينين والجلد.
- تثبيت وتضمين المواد العضوية لتلطيخ الكيمياء النسيجية المناعية / التألق
- جمع وطرد مركزي المواد العضوية كما هو موضح أعلاه (الخطوة 3.2.1).
- قم بإزالة SN ، وأضف 1 مل من 4٪ paraformaldehyde (PFA) واحتضنه لمدة 30 دقيقة في درجة حرارة الغرفة (RT) على شاكر مداري (100 دورة في الدقيقة).
تحذير: PFA هو مادة مسرطنة بشرية معروفة يمكن أن تسبب أضرارا لا رجعة فيها للقرنية. يجب أن يتم كل العمل في غطاء الدخان الكيميائي. يجب دائما ارتداء قفازات النتريل ونظارات السلامة. - جهاز طرد مركزي عند 200 × g لمدة 5 دقائق وإزالة SN. أضف 1 مل من PBS ، واحتضن 10 دقائق في RT على شاكر مداري (100 دورة في الدقيقة) ، وجهاز طرد مركزي عند 90 × g لمدة 3 دقائق عند 4 درجات مئوية. كرر خطوة الغسيل مرتين. يخزن في PBS عند 4 درجات مئوية.
- لمعالجة الأنسجة والجفاف ، قم بإزالة SN وإضافة 150 ميكرولتر من هلام الأغاروز بنسبة 2٪ (في PBS) إلى الكريات العضوية باستخدام طرف p200 الموسع مسبقا (المصنوع عن طريق قطع قطعة صغيرة من الطرف). قم على الفور بسحب الحجم بالكامل وإخراجه في غطاء أنبوب الطرد المركزي الدقيق.
ملاحظة: من المهم العمل بسرعة ، لأن الجل الذي يحتوي على المواد العضوية سوف يتصلب بسرعة. - دع الجل يتصلب بقوة لمدة 30 دقيقة وانقل قرص الجل إلى كاسيت الأنسجة. اغمر وخزن في 50٪ EtOH ، حتى الجفاف في معالج الأنسجة.
- لتضمين البارافين ، ضع قرص الجل (باستخدام الملقط) في قالب تضمين واملأه بالبارافين الدافئ (60 درجة مئوية). ضع القوالب على درجة حرارة 4 درجات مئوية حتى يصبح البارافين صلبا (حوالي 45 دقيقة). يمكن تخزين هذه العينات إما عند 4 درجات مئوية أو يمكن إخضاعها على الفور للتقسيم.
- ميكروتوم كتل البارافين التي تحتوي على المواد العضوية بسماكة 5 ميكرومتر وجمع العينات على الشرائح الزجاجية. أضف قطرة واحدة من الماء منزوع الأيونات أسفل كل قسم للسماح بالتمدد السليم للقسم ووضع الشرائح على لوحة تسخين مسطحة عند 37 درجة مئوية بين عشية وضحاها. قم بتخزين الشرائح بأقسام عند 4 درجات مئوية أو استمر مباشرة في تلطيخ المناعة النسيجية الكيميائية أو التألق المناعي.
النتائج
بعد عزل وتفكك AL ، يتم زرع الخلايا المفردة التي تم الحصول عليها في ECM وتنمو في PitOM (الشكل 1 ، الجدول 1). ويبين الشكل 3 ألف زراعة الخلايا وكثافتها عند البذر (اليوم 0). قد يكون بعض الحطام الصغير موجودا (الشكل 3A ، رؤوس الأسهم البيضاء) ، لكنه سيختفي عند المرور. بعد أربعة عشر يوما من البذر ، يتم تطوير المواد العضوية المشتقة من AL بالكامل (الشكل 3A). تظهر المواد العضوية مورفولوجيا كيسية ، مع طبقة ظهارية تحيط بتجويف. في هذه المرحلة ، يصل قطر المواد العضوية إلى 500 ميكرومتر ويجب مرورها. ويبين الشكل 3 باء الثقافة العضوية المشتقة من AL بعد المرور في الوقت المشار إليه بعد إعادة بذر الشظايا العضوية المنفصلة.
في بعض الأحيان ، قد يظهر واحد أو أكثر من الهياكل الكثيفة في الثقافة العضوية (الشكل 3A ، غير مواتية). عند المرور ، تميل المواد العضوية الكثيفة إلى تولي زمام الأمور ، وينتهي بها المطاف في الثقافات ذات الهياكل الكثيفة فقط بعد بضع مقاطع (الشكل 3B ، غير مواتية). لذلك ، يوصى بعدم المضي قدما في الآبار التي تحتوي على عضويات كثيفة (الممر 0). بدلا من ذلك ، يمكن التخلص من المواد العضوية الكثيفة عن طريق الترسيب ، مما يترك المواد العضوية الكيسية للاستمرار. أصل هذه المواد العضوية الكثيفة غير واضح في الوقت الحاضر ، لكنها تظهر طبيعة الغدة النخامية أقل وضوحا18. إذا لم تقم المواد العضوية ، أو إعادة النمو بكفاءة أقل بعد المرور ، فيجب تحسين إجراءات الانفصال. على وجه الخصوص ، يجب على المرء أن ينتبه إلى عدم الانفصال القاسي للغاية. يجب تقسيم المواد العضوية إلى شظايا ، وليس إلى خلايا مفردة (الشكل 3B ، اليوم 0 ، داخلي).
يؤكد تحليل تلطيخ التألق المناعي الطابع الظهاري للعضويات المشتقة من AL ، لأنها تعبر عن العلامات الظهارية E-cadherin (E-Cad) و cytokeratin 8/18 (CK8/18; الشكل 3C)، والتي وصفت علاوة على ذلك بأنها علامات الخلايا الجذعية في الغدة النخامية18. بالإضافة إلى ذلك ، يتم إثبات الطبيعة الجذعية للعضويات من خلال تعبير SOX2 و TROP2 ، وكلاهما تم تحديده أيضا على أنه علامات الخلايا الجذعية النخامية (الشكل 3C) 14,18. LHX3 ، وهو عامل نسخ يتم التعبير عنه على وجه التحديد في الغدة النخامية (في وقت مبكر) ، يتحقق من صحة النمط الظاهري للغدة النخامية العضوية (الشكل 3C). بعض الخلايا المكونة للعضويات في حالة تكاثرية ، معبرا عن علامة الانتشار Ki67 (الشكل 3C).
يتم إجراء مزيد من الاستكشاف والتحقق من صحة النمط الظاهري للنخامة (الجذعية) للعضويات المشتقة من AL باستخدام تفاعل البوليميراز المتسلسل الكمي العكسي (RT-qPCR). التعبير العالي عن علامات الجذعية Sox2 و Cdh1 (ترميز E-Cad) و Krt8 و Krt18 و Trop2 موجود في المواد العضوية ، أعلى بوضوح من AL الأولي ، مما يشير إلى أن المواد العضوية تثري الخلايا الجذعية وبالتالي تمثل حجرة الخلايا الجذعية AL ، كما هو موضح سابقا (الشكل 3D)18. والجدير بالذكر أن عوامل النسخ التنموية Pitx1 و Pitx2 تظل معبرا عنها بعد التطور في العديد من أنواع الخلايا الهرمونية في AL ، وبالتالي تعبيرها العالي في AL أيضا. تحتفظ الثقافات بقوة بنمطها الظاهري الجذعي ، كما يتضح من التعبير المستمر (العالي) لهذه العلامات بعد مقاطع متعددة (الشكل 3D).

الشكل 1: نظرة عامة على إنشاء وصيانة وتوصيف وتطبيق إمكانات العضوية من الغدة النخامية الصحية والمريضة. AL ، الفص الأمامي. IL ، الفص المتوسط. PL ، الفص الخلفي. MZ ، المنطقة الهامشية ؛ PitOM ، وسط الغدة النخامية العضوي (تم إنشاؤه باستخدام BioRender.com). يشار إلى منافذ الخلايا الجذعية في AL باللون الأرجواني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
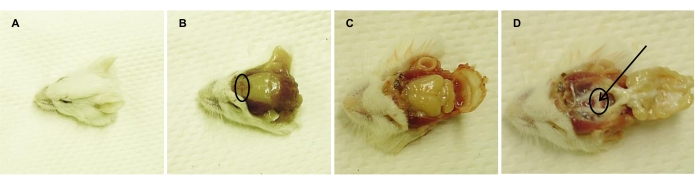
الشكل 2: عزل الغدة النخامية عن الفأر الرحيم البالغ. صور تمثيلية تم التقاطها على التوالي بعد (أ) قطع الرأس ، (ب) إزالة جلد الرأس (جسر الأنف مطوق) ، (ج) فتح الجمجمة ، و (د) إزالة الدماغ ، وكشف الغدة النخامية (محاطا). يشير السهم إلى PL ، الذي يتم التخلص منه (مع IL المرتبط) ، تاركا AL للعزل والتفكك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: إنشاء والتحقق من صحة المواد العضوية المشتقة من AL. (A) بذر الخلايا AL والتطور العضوي في PitOM في الأيام المحددة (الممر 0). يظهر الصف العلوي نموا عضويا مواتيا ، مع تطور الهياكل الكيسية فقط. يظهر الصف السفلي نموا غير موات مع ظهور هيكل كثيف كبير (معبأ). تشير رؤوس الأسهم البيضاء إلى الحطام ، وتشير رؤوس الأسهم السوداء إلى خلايا مفردة (مكبرة في الجزء الداخلي). (ب) شظايا عضوية (مكبرة في داخلية) مبذرة عند المرور (اليوم 0) وإعادة نمو المواد العضوية كما لوحظ بعد 7 أيام. يظهر الصف العلوي إعادة نمو عضوي موات ، مع نمو الهياكل الكيسية فقط. يظهر الصف السفلي إعادة نمو غير مواتية مع استيلاء المواد العضوية الكثيفة على الثقافة. (ج) تلطيخ التألق المناعي ل E-Cad و SOX2 و TROP2 (كلها حمراء) و CK8/18 و LHX3 و Ki67 (كلها خضراء) في المواد العضوية المشتقة من AL. يتم تصنيف النوى مع Hoechst33342 (أزرق). تشير رؤوس الأسهم إلى خلايا Ki67+. يشار إلى أشرطة المقياس. (د) تحليل التعبير الجيني لعلامات الجذعية (Sox2 ، Cdh1 ، Krt8 ، Krt18 ، Trop2) ، وعوامل النسخ التنموية (Pitx1 ، Pitx2) في المواد العضوية الأولية AL و AL المشتقة (الممر 0 يعني 14 يوما بعد بذر الخلايا) التي تحددها RT-qPCR (متوسط ± SEM). تمثل نقاط البيانات النسخ المتماثلة البيولوجية. يتم عرض قيم عتبة دورة دلتا (dCT) ، محسوبة باستخدام الصيغة: CT (جين الاهتمام) - CT (جين التدبير المنزلي Actb). كلما كانت قيمة dCT أكثر إيجابية (التي يتم تقديمها على المحور Y أسفل المحور X الصفري) ، انخفض مستوى التعبير عن الجين محل الاهتمام. كلما انخفضت قيمة dCT (أو أكثر سالبة) ، ارتفع مستوى التعبير 14,18,21,22. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| وسط الغدة النخامية العضوية (PitOM) | |
| مكون | تركيز |
| DMEM / F12 المتقدم | |
| هيبس | 1% |
| البنسلين-ستربتومايسين | 1% |
| جلوتاماكس | 1% |
| مكمل B-27 (50X)، ناقص فيتامين (أ) | 1X |
| L-الجلوتامين (200 ملليمتر) | 2 مللي متر |
| بروتين FGF البشري المؤتلف الأساسي / FGF2 / bFGF (157 aa) | 20 نانوغرام/مل |
| IGF البشري المؤتلف-1 | 100 نانوغرام/مل |
| N-2 الملحق (100X) | 1X |
| N-أسيتيل-السيستين | 1.25 ملليمتر |
| الإنسان المؤتلف / مورين FGF-8b | 200 نانوغرام/مل |
| FGF الإنسان المؤتلف - 10 | 100 نانوغرام/مل |
| A83-01 (كيناز يشبه مستقبلات أكتيفين 4/5/7) | 0.50 ميكرومتر |
| المؤتلف الماوس سونيك القنفذ / SHH (C25II) N-المحطة | 100 نانوغرام/مل |
| بروتين EGF البشري المؤتلف ، CF | 50 نانوغرام/مل |
| SB202190 (مثبط كيناز البروتين المنشط بالميتوجين p38) | 10 ميكرومتر |
| نوجين الإنسان المؤتلف | 100 نانوغرام/مل |
| سموم الكوليرا من ضمة الكوليرا | 100 نانوغرام/مل |
| الإنسان المؤتلف R-Spondin-1 | 200 نانوغرام/مل |
| الإنسان المؤتلف IL-6 | 20 نانوغرام/مل |
الجدول 1. تكوين PitOM. يتم ترشيح PitOM من خلال مرشح شبكي 0.22 ميكرومتر وتخزينه عند 4 درجات مئوية لمدة أقصاها أسبوعان.
| متوسط A | |
| مكون | كم |
| DMEM ، مسحوق ، ارتفاع نسبة الجلوكوز | 13.38 غ |
| هيبس | 5.96 غ |
| الصوديوم بيروفات (C 3 H 3 NaO3) | 0.11 غ |
| البنسلين G ملح الصوديوم | 35.00 ملغ |
| ملح كبريتات الستربتومايسين | 50.00 ملغ |
| كلوريد الصوديوم (كلوريد الصوديوم) | 0.50 غ |
| كربونات هيدروجين الصوديوم (NaHCO3) | 1.00 غ |
| الزلال البقري (درجة زراعة الخلايا) | 3.00 غ |
| مياه معقمة | 1.00 لتر |
| متوسط C | |
| مكون | كم |
| كلوريد الصوديوم (كلوريد الصوديوم) | 7.50 غ |
| كلوريد البوتاسيوم (KCl) | 0.40 غ |
| الصوديوم ثنائي هيدروجين فوسفات 1-هيدرات | 0.14 غ |
| د-الجلوكوز | 1.00 غ |
| هيبس | 4.76 غ |
| ملح كبريتات الستربتومايسين | 50.00 ملغ |
| البنسلين G ملح الصوديوم | 35.00 ملغ |
| أحمر الفينول | 10.00 ملغ |
| الزلال البقري (درجة زراعة الخلايا) | 3.00 غ |
| كربونات هيدروجين الصوديوم (NaHCO3) | 1.00 غ |
| مياه معقمة | 1.00 لتر |
| متوسطة B | |
| مكون | كم |
| Titriplex III (ثنائي هيدرات ملح الصوديوم ثنائي الصوديوم) | 0.74 غ |
| متوسط C | 100 مل |
الجدول 2. تكوين المتوسطة A و B و C. تتم تصفية جميع الوسائط من خلال مرشح شبكي 0.22 ميكرومتر وتخزينها عند 4 درجات مئوية لمدة أقصاها 4 أشهر. يجب ضبط الرقم الهيدروجيني للمتوسطين A و C إلى 7.3.
| وسيط الحفظ بالتبريد | |
| مكون | تركيز |
| DMEM / F12 المتقدم | 60% |
| FBS | 30% |
| DMSO | 10% |
الجدول 3. تكوين وسط الحفظ بالتبريد.
Discussion
تمثل المواد العضوية المشتقة من AL ، كما هو موضح هنا ، نموذجا بحثيا قويا لدراسة الخلايا الجذعية النخامية في المختبر. في الوقت الحاضر ، هذا النهج العضوي هو الأداة الوحيدة المتاحة لنمو وتوسيع الخلايا الجذعية الأولية للنخامة بشكل موثوق وقوي. وقد أبلغ سابقا عن نموذج عضوي للغدة النخامية مشتق من الخلايا الجذعية الجنينية (ESC) أو الخلايا الجذعية المستحثة متعددة القدرات (iPSC)، والتي تلخص عن كثب التكوين العضوي الجنيني للغدة النخامية23؛ ومع ذلك ، على الرغم من أنه مفيد للغاية لدراسة تطور الغدة النخامية أو نموذج مرض الغدة النخامية23،24،25 ، فإن البروتوكول المبلغ عنه ، بدءا من ESC / iPSC ، يستغرق وقتا طويلا للغاية مقارنة بالبروتوكول الموضح هنا ، كما أن المواد العضوية الناتجة غير قابلة للتوسيع.
يعتمد نجاح زراعة الخلايا الجذعية النخامية العضوية على بعض الخطوات الحاسمة في البروتوكول. من المهم وضع عدد مناسب من الخلايا عند البذر الأولي للخلايا. سيؤدي العدد الكبير جدا إلى ظهور ثقافات مكتظة ، مما يؤدي إلى تدهور صلاحية المواد العضوية ويعوق التوسع العضوي الكامل ، في حين أن عددا منخفضا جدا من الخلايا سيؤدي إلى تكوين عضوي محدود. علاوة على ذلك ، من المهم عدم الإخلال بسلامة قبة ECM بمجرد دخولها إلى الثقافة. يجب أن تتم إضافة وإزالة الوسط بعناية فائقة ، دون لمس قطرة الجل. بالإضافة إلى ذلك ، فإن الاحترار المسبق لوسط الثقافة يقلل من خطر إزالة البلمرة من الجل. وأخيرا ، فإن تمرير المواد العضوية بشكل صحيح (أي الانفصال إلى شظايا وليس إلى خلايا واحدة) أمر بالغ الأهمية للتوسع الفعال للثقافات.
يمكن تسخير هذه الخلايا العضوية للخلايا الجذعية النخامية للإجابة على الأسئلة المتعلقة بالنمط الظاهري للخلايا الجذعية والبيولوجيا والوظيفة. وقد ثبت بالفعل قيمتها في الكشف عن ميزات الخلايا الجذعية الجديدة وكذلك علامات تنشيط الخلايا الجذعية المرتبطة بتلف الغدة النخامية وكأداة قراءة لنشاط الخلايا الجذعية (الشكل 1)14،18. وتشمل الجهود الحالية اشتقاقها من الغدة النخامية المريضة، مثل قصور الغدة النخامية و PitNETs (الشكل 1). في نهاية المطاف ، يمكن أيضا إشراك المواد العضوية في منصة لفحص الأدوية ، كما ثبت بنجاح لأمراض أخرى26,27. لذلك ، سيكون من الضروري زيادة رفع مستوى الثقافات العضوية للوصول إلى تحليل الإنتاجية العالية. وقد لوحظ بالفعل أن المواد العضوية المشتقة من AL يمكن زراعتها بكفاءة في شكل 96 بئرا ، مما يؤدي أيضا إلى ثقافات أكثر تجانسا.
وقد لوحظ أنه بعد ~ 10 مقاطع (المقابلة ل 3 أشهر من الثقافة) ، انخفضت كفاءة النمو العضوي تدريجيا مع إعادة نمو المواد العضوية بأعداد أقل وحجم أصغر. قد يكون هذا الانخفاض في النمو متأصلا في الطبيعة الجوهرية للخلايا الجذعية النخامية ، والتي قد لا تحتاج إلى التجديد الذاتي عدة مرات في الغدة في الجسم الحي ، والتي تتحول ببطء فقط ، وبالتالي تصبح منهكة بعد جولتين من الانقسام16,28. على الرغم من أن هذا الانخفاض في النمو في نهاية المطاف يمكن اعتباره قيدا ، إلا أن النموذج مفيد للغاية لأن التوسع العضوي خلال المقاطع السابقة أكثر من كاف لإجراء تحليلات شاملة في المصب.
جانب آخر يمكن اعتباره قيدا هو أن الخلايا الجذعية النخامية العضوية لا تظهر قدرة تمايز بارزة تجاه أنواع خلايا الغدد الصماء في AL ، حتى بعد التطعيمات الغريبة تحت كبسولة الكلى للفئران التي تعاني من نقص المناعة (مما أدى إلى عدد محدود من خلايا GH + و PRL + كما هو موضح بالتفصيل في المرجع18). إما أن الظروف الصحيحة في المختبر لدفع الخلايا الجذعية إلى التمايز لم يتم تحديدها بعد ، أو أن الدور الرئيسي للخلايا الجذعية (خاصة في الغدة البالغة) لا يقع في توليد خلايا الغدد الصماء الجديدة (حيث من المحتمل ألا تكون هناك حاجة إليها في الغدة الكسولة ولكن فقط في الظروف المضطربة أو الصعبة)9،10،14 ، 18. بدلا من ذلك ، قد تكون الوظيفة الرئيسية موجودة في جوانب بيولوجية أخرى (على سبيل المثال ، إشارات paracrine إلى السلف الهرموني / السلائف أو الخلايا الناضجة في الحالات الأساسية ، ولكن من المحتمل أن تكون أكثر نشاطا (التنموية ، الإصلاح ، المرض))13,16. في الواقع ، على الرغم من أن الخلايا الجذعية النخامية قد ثبت أنها تمتلك قدرة تمايز متعددة القدرات خاصة في الفترة الجنينية وحديثي الولادة ، فمن المتصور أن الخلايا الجذعية في الغدة البالغة لا (تحتاج) إلى الحفاظ على هذه القدرة ، نظرا للدوران المنخفض جدا للغدة البالغة16,28. من الممكن أن تعمل الخلايا الجذعية النخامية البالغة بشكل أكبر كمركز إشارات باراكرين ، تشارك في تحفيز أو تنظيم الخلايا السلفية / السلائف / الغدد الصماء المحيطة13,16. وبالتالي ، فإن التمايز القوي للخلايا الجذعية النخامية العضوية التي تبلغ ذروتها في إفراز الهرمونات قد يكون توقعا خاطئا لن يتم الوصول إليه أبدا.
مجتمعة ، يقدم البروتوكول المعروض هنا أداة قابلة للتطبيق بسرعة وموثوقة لتوسيع الخلايا الجذعية الأولية للنخامة بقوة في إعداد 3D في المختبر. يؤدي البروتوكول إلى ظهور عضويات تلتقط بأمانة النمط الظاهري للخلايا الجذعية النخامية. وقد تم بالفعل تطبيق النظام بنجاح لدراسة بيولوجيا الخلايا الجذعية النخامية وتفعيل14،18 ، والنتائج قابلة للترجمة بشكل كبير إلى الوضع في الجسم الحي.
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل من خلال منح من صندوق أبحاث KU Leuven وصندوق البحث العلمي (FWO) - فلاندرز. يتم دعم E.L. (11A3320N) ، و C.N. (1S14218N) من خلال زمالة الدكتوراه من FWO / FWO-SB.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250 | |
| 48-well plates, TC treated, individually wrapped | Costar | 734-1607 | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Advanced DMEM | Gibco | 12491023 | |
| Albumin Bovine (cell culture grade) | Serva | 47330 | |
| B-27 Supplement (50X), minus vitamin A | Gibco | 12587010 | |
| Base moulds | VWR | 720-1918 | |
| Buffer RLT | Qiagen | 79216 | |
| Cassettes, Q Path Microtwin | VWR | 720-2191 | |
| Cell strainer, 40 µm mesh, disposable | Falcon | 352340 | |
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | D5025 | |
| D-glucose | Merck | 108342 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM, powder, high glucose | Gibco | 52100039 | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | J1800AMNZ | |
| Epredia HistoStar Embedding Workstation, 220 to 240Vac | Thermo Fisher Scientific | 12587976 | |
| Ethanol Absolute 99.8+% | Thermo Fisher Scientific | 10342652 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| HEPES | Sigma-Aldrich | H4034 | |
| HEPES Buffer Solution | Gibco | 15630056 | |
| InSolution Y-27632 | Sigma-Aldrich | 688001 | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-Free | Corning | 15505739 | |
| Mr. Frosty Freezing Container | Thermo Fisher Scientific | 5100-0001 | |
| N-2 Supplement (100X) | Thermo Fisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A7250 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | Thermo Fisher Scientific | 375353 | |
| Paraformaldehyde for synthesis (PFA) | Merck | 818715 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Penicillin G sodium salt | Sigma-Aldrich | P3032 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Phenol red | Merck | 107241 | |
| Potassium Chloride (KCl) | Merck | 104936 | |
| Recombinant Human EGF Protein, CF | R&D systems | 236-EG | |
| Recombinant Human FGF basic/FGF2/bFGF (157 aa) Protein | R&D systems | 234-FSE | |
| Recombinant Human FGF-10 | Peprotech | 100-26 | |
| Recombinant Human IGF-1 | Peprotech | 100-11 | |
| Recombinant Human IL-6 | Peprotech | 200-06 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human R-Spondin-1 | Peprotech | 120-38 | |
| Recombinant Human/Murine FGF-8b | Peprotech | 100-25 | |
| Recombinant Mouse Sonic Hedgehog/Shh (C25II) N-Terminus | R&D systems | 464-SH | |
| RNeasy micro kit | Qiagen | 74004 | |
| SB202190 | Sigma-Aldrich | S7067 | |
| SeaKem LE Agarose | Lonza | 50004 | |
| Sodium Chloride (NaCl) | BDH | 102415K | |
| Sodium di-Hydrogen Phosphate 1-hydrate | PanReac-AppliChem | A1047 | |
| Sodium Hydrogen Carbonate (NaHCO3) | Merck | 106329 | |
| Sodium-Pyruvate (C3H3NaO3) | Sigma-Aldrich | P5280 | |
| Stericup-GP, 0.22 µm | Millipore | SCGPU02RE | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 0.22 μm | Millipore | SCGP00525 | |
| Sterile water | Fresenius | B230531 | |
| Streptomycin sulfate salt | Sigma-Aldrich | S6501 | |
| Syringe, with BD Microlance needle with intradermal bevel, 26G | BD Plastipak | BDAM303176 | |
| Thermo Scientific Excelsior ES Tissue Processor | Thermo Scientific | 12505356 | |
| Titriplex III | Merck | 108418 | |
| TrypL Express Enzyme (1X), phenol red | Thermo Fisher Scientific | 12605028 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma-Aldrich | T9003 | |
| Trypsin solution 2.5 % | Thermo Fisher Scientific | 15090046 |
References
- Melmed, S. . The pituitary. 3rd ed. , 1 (2011).
- Chen, J., et al. The adult pituitary contains a cell population displaying stem/progenitor cell and early-embryonic characteristics. Endocrinology. 146 (9), 3985-3998 (2005).
- Chen, J., et al. Pituitary progenitor cells tracked down by side population dissection. Stem Cells. 27 (5), 1182-1195 (2009).
- Fauquier, T., Rizzoti, K., Dattani, M., Lovell-Badge, R., Robinson, I. C. A. F. SOX2-expressing progenitor cells generate all of the major cell types in the adult mouse pituitary gland. Proceedings of the National Academy of Sciences of the United States of America. 105 (8), 2907-2912 (2008).
- Rizzoti, K., Akiyama, H., Lovell-Badge, R. Mobilized adult pituitary stem cells contribute to endocrine regeneration in response to physiological demand. Cell Stem Cell. 13 (4), 419-432 (2013).
- Andoniadou, C. L., et al. Sox2+ stem/progenitor cells in the adult mouse pituitary support organ homeostasis and have tumor-inducing potential. Cell Stem Cell. 13 (4), 433-445 (2013).
- Nys, C., Vankelecom, H. Pituitary disease and recovery: How are stem cells involved. Molecular and Cellular Endocrinology. 525 (4), 111176 (2021).
- Schneider, H. J., Aimaretti, G., Kreitschmann-Andermahr, I., Stalla, G. K., Ghigo, E. Hypopituitarism. Lancet. 369 (9571), 1461-1470 (2007).
- Fu, Q., et al. The adult pituitary shows stem/progenitor cell activation in response to injury and is capable of regeneration. Endocrinology. 153 (7), 3224-3235 (2012).
- Willems, C., et al. Regeneration in the pituitary after cell-ablation injury: time-related aspects and molecular analysis. Endocrinology. 157 (2), 705-721 (2016).
- Gremeaux, L., Fu, Q., Chen, J., Vankelecom, H. Activated phenotype of the pituitary stem/progenitor cell compartment during the early-postnatal maturation phase of the gland. Stem Cells and Development. 21 (5), 801-813 (2012).
- Zhu, X., Tollkuhn, J., Taylor, H., Rosenfeld, M. G. Notch-dependent pituitary SOX2+ stem cells exhibit a timed functional extinction in regulation of the postnatal gland. Stem Cell Reports. 5 (6), 1196-1209 (2015).
- Russell, J. P., et al. Pituitary stem cells produce paracrine WNT signals to control the expansion of their descendant progenitor cells. eLife. 10 (1), 59142 (2021).
- Vennekens, A., et al. Interleukin-6 is an activator of pituitary stem cells upon local damage, a competence quenched in the aging gland. Proceedings of the National Academy of Sciences of the United States of America. 118 (25), 2100052118 (2021).
- Mertens, F., et al. Pituitary tumors contain a side population with tumor stem cell-associated characteristics. Endocrine-Related Cancer. 22 (4), 481-504 (2015).
- Laporte, E., Vennekens, A., Vankelecom, H. Pituitary remodeling throughout life: are resident stem cells involved. Frontiers in Endocrinology. 11 (1), 604519 (2021).
- Yoshida, S., et al. Isolation of adult pituitary stem/progenitor cell clusters located in the parenchyma of the rat anterior lobe. Stem Cell Research. 17 (2), 318-329 (2016).
- Cox, B., et al. Organoids from pituitary as novel research model to study pituitary stem cell biology. Journal of Endocrinology. 240 (2), 287-308 (2019).
- Denef, C., Hautekeete, E., De Wolf, A., Vanderschueren, B. Pituitary basophils from immature male and female rats: distribution of gonadotrophs and thyrotrophs as studied by unit gravity sedimentation. Endocrinology. 130 (3), 724-735 (1978).
- Vander Schueren, B., Denef, C., Cassiman, J. J. Ultrastructural and functional characteristics of rat pituitary cell aggregates. Endocrinology. 110 (2), 513-523 (1982).
- Claes, C., et al. Human stem cell-derived monocytes and microglia-like cells reveal impaired amyloid plaque clearance upon heterozygous or homozygous loss of TREM2. Alzheimer's and Dementia. 15 (3), 453-464 (2019).
- Trompeter, H. -. I., et al. MicroRNAs miR-26a, miR-26b, and miR-29b accelerate osteogenic differentiation of unrestricted somatic stem cells from human cord blood. BMC Genomics. 14, 111 (2013).
- Suga, H., et al. Self-formation of functional adenohypophysis in three-dimensional culture. Nature. 480 (7375), 57-62 (2011).
- Matsumoto, R., et al. Congenital pituitary hypoplasia model demonstrates hypothalamic OTX2 regulation of pituitary progenitor cells. Journal of Clinical Investigation. 130 (2), 641-654 (2019).
- Kanie, K., et al. Pathogenesis of anti-PIT-1 antibody syndrome: PIT-1 presentation by HLA class I on anterior pituitary cells. Journal of the Endocrine Society. 3 (11), 1969-1978 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Yan, H. H. N., et al. A comprehensive human gastric cancer organoid biobank captures tumor subtype heterogeneity and enables therapeutic screening. Cell Stem Cell. 23 (6), 882-897 (2018).
- Nolan, L. A., Kavanagh, E., Lightman, S. L., Levy, A. Anterior pituitary cell population control: basal cell turnover and the effects of adrenalectomy and dexamethasone treatment. Journal of Neuroendocrinology. 10 (3), 207-215 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved