Method Article
Desarrollo de organoides a partir de la hipófisis del ratón como modelo in vitro para explorar la biología de las células madre hipofisarias
En este artículo
Resumen
La glándula pituitaria es el regulador clave del sistema endocrino del cuerpo. Este artículo describe el desarrollo de organoides a partir de la hipófisis del ratón como un nuevo modelo 3D in vitro para estudiar la población de células madre de la glándula, cuya biología y función siguen siendo poco conocidas.
Resumen
La hipófisis es la glándula endocrina maestra que regula los procesos fisiológicos clave, incluido el crecimiento corporal, el metabolismo, la maduración sexual, la reproducción y la respuesta al estrés. Hace más de una década, se identificaron células madre en la glándula pituitaria. Sin embargo, a pesar de la aplicación de enfoques transgénicos in vivo , su fenotipo, biología y papel siguen sin estar claros. Para abordar este enigma, se desarrolla un nuevo e innovador modelo organoide in vitro para desentrañar profundamente la biología de las células madre hipofisarias. Los organoides representan estructuras celulares 3D que, bajo condiciones de cultivo definidas, se desarrollan a partir de las células madre (epiteliales) de un tejido y recapitulan múltiples características de esas células madre y su tejido. Aquí se muestra que los organoides derivados de la hipófisis del ratón se desarrollan a partir de las células madre de la glándula y recapitulan fielmente sus características fenotípicas y funcionales in vivo . Entre otros, reproducen el estado de activación de las células madre como in vivo que ocurre en respuesta al daño local infligido transgénicamente. Los organoides son expandibles a largo plazo mientras conservan robustamente su fenotipo de tallo. El nuevo modelo de investigación es muy valioso para descifrar el fenotipo y el comportamiento de las células madre durante las condiciones clave de remodelación de la hipófisis, que van desde la maduración neonatal hasta el desvanecimiento asociado al envejecimiento, y desde las glándulas sanas hasta las enfermas. Aquí, se presenta un protocolo detallado para establecer organoides derivados de la hipófisis del ratón, que proporcionan una herramienta poderosa para sumergirse en el pero enigmático mundo de las células madre hipofisarias.
Introducción
La hipófisis es una pequeña glándula endocrina ubicada en la base del cerebro, donde está conectada al hipotálamo. La glándula integra entradas periféricas y centrales (hipotalámicas) para generar una liberación hormonal sintonizada y coordinada, regulando así los órganos endocrinos objetivo aguas abajo (como las glándulas suprarrenales y las gónadas) para producir hormonas apropiadas en el momento adecuado. La hipófisis es el regulador clave del sistema endocrino y, por lo tanto, se denomina legítimamente la glándula maestra1.
La hipófisis del ratón consta de tres lóbulos (Figura 1), es decir, el lóbulo anterior (AL), el lóbulo intermedio (IL) y el lóbulo posterior (PL). El principal AL endocrino contiene cinco tipos de células hormonales, incluidos los somatotropos que producen la hormona del crecimiento (GH); lactotropos generadores de prolactina (PRL); corticótropos que secretan hormona adrenocorticotrópica (ACTH); tirotropos responsables de la producción de hormona estimulante de la tiroides (TSH); y gonadotropos que producen hormona luteinizante (LH) y hormona foliculoestimulante (FSH). El PL consiste en proyecciones axonales del hipotálamo en las que se almacenan las hormonas oxitocina y vasopresina (hormona antidiurética). La IL se encuentra entre el AL y el PL y alberga melanótropos que producen la hormona estimulante de melanocitos (MSH). En la hipófisis humana, la IL retrocede durante el desarrollo, y los melanotropos se propagan dentro de la AL1. Además de las células endocrinas, la glándula pituitaria también contiene un grupo de células madre, esencialmente marcadas por el factor de transcripción SOX2 2,3,4,5,6. Estas células SOX2+ se encuentran en la zona marginal (MZ), el revestimiento epitelial de la hendidura (una luz remanente embrionaria entre la AL y la IL), o se diseminan como grupos a lo largo del parénquima de la AL, proponiendo así dos nichos de células madre en la glándula (Figura 1)2,3,4,5,6.
Dada la naturaleza indispensable de la hipófisis, el mal funcionamiento de la glándula se asocia con una morbilidad grave. El hiperpituitarismo (caracterizado por la secreción excesiva de una o más hormonas) y el hipopituitarismo (producción defectuosa o faltante de una o más hormonas) pueden ser causados por tumores neuroendocrinos hipofisarios (PitNET; por ejemplo, tumores productores de ACTH que conducen a la enfermedad de Cushing) o por defectos genéticos (por ejemplo, deficiencia de GH que resulta en enanismo)7. Además, la cirugía hipofisaria (por ejemplo, para extirpar tumores), infecciones (por ejemplo, tuberculosis hipotalámico-hipofisaria o infecciones posteriores a meningitis bacteriana o encefalitis), síndrome de Sheehan (necrosis debido a un flujo sanguíneo insuficiente debido a una gran pérdida de sangre al nacer), apoplejía hipofisaria y lesión cerebral traumática son otras causas importantes de hipofunción hipofisaria8 . Se ha demostrado que la hipófisis del ratón posee la capacidad regenerativa, siendo capaz de reparar el daño local introducido por la ablación transgénica de células endocrinas 9,10. Las células madre SOX2+ reaccionan agudamente a la lesión infligida mostrando un fenotipo activado, marcado por una mayor proliferación (lo que resulta en la expansión de las células madre) y una mayor expresión de factores y vías relacionados con la madre (por ejemplo, WNT / NOTCH). Además, las células madre comienzan a expresar la hormona ablacionada, lo que finalmente resulta en una restauración sustancial de la población celular agotada durante los siguientes (5 a 6) meses 9,10. Además, durante la fase de maduración neonatal de la glándula (las primeras 3 semanas después del nacimiento), las células madre hipofisarias prosperan en un estado activado 6,11,12,13, mientras que el envejecimiento del organismo se asocia con una disminución de la funcionalidad de las células madre in situ, debido a un entorno inflamatorio (micro) creciente en el envejecimiento (o 'inflamación')10,14 . Además, la tumorigénesis en la glándula también se asocia con la activación de células madre 7,15. Aunque la activación de células madre se ha detectado en varias situaciones de remodelación hipofisaria (revisado en 7,16), los mecanismos subyacentes siguen sin estar claros. Dado que los enfoques in vivo (como el rastreo de linaje en ratones transgénicos) no han proporcionado una imagen clara o completa de las células madre hipofisarias, el desarrollo de modelos in vitro confiables para explorar la biología de las células madre en la hipófisis normal y enferma es esencial. El cultivo in vitro estándar de células madre hipofisarias primarias sigue siendo inadecuado debido a la capacidad de crecimiento muy limitada y las condiciones no fisiológicas (2D) con una rápida pérdida del fenotipo (para una visión general más detallada, ver16). Se han establecido cultivos de esferas 3D (pituisferas) a partir de células madre hipofisarias identificadas por población lateral y fenotipoSOX2+ 2,3,4. Las pituiesferas crecen clonalmente a partir de las células madre, expresan marcadores de tallo y muestran capacidad de diferenciación en los tipos de células endocrinas. Sin embargo, no se expanden considerablemente mientras muestran solo una pasadibilidad limitada (2-3 pasajes)3,4. También se obtuvieron estructuras en forma de esfera a partir de grupos de células madre hipofisarias no disociadas cuando se cultivaron en Matrigel diluido al 50% durante 1 semana, pero no se mostró capacidad de expansión17. El enfoque de la pituisfera se utiliza principalmente como una herramienta de lectura para el número de células madre, pero las aplicaciones adicionales están limitadas por una capacidad de expansión inferior16.
Para abordar y superar estas deficiencias, recientemente se ha establecido un nuevo modelo 3D, es decir, organoides, a partir de la principal AL endocrina de ratones que contienen la MZ y las células madre parenquimatosas. Se ha demostrado que los organoides se derivan de las células madre de la hipófisis y recapitulan fielmente su fenotipo18. Además, los organoides son expandibles a largo plazo, mientras que mantienen robustamente su naturaleza de tallo. Por lo tanto, proporcionan un método confiable para expandir las células madre hipofisarias primarias para una exploración profunda. Tal exploración no es alcanzable con el número limitado de células madre que se pueden aislar de una hipófisis, que tampoco son expandibles en condiciones 2D16. Se ha demostrado que los organoides son herramientas valiosas y fiables para descubrir nuevas características de las células madre hipofisarias (traducibles a in vivo)14,18. Es importante destacar que el modelo organoide refleja fielmente el estado de activación de las células madre hipofisarias como ocurre durante el daño tisular local y la maduración neonatal, mostrando una mayor eficiencia de formación y replicando las vías moleculares reguladas al alza14,18. Por lo tanto, el modelo organoide derivado de la hipófisis es un modelo de investigación de biología de células madre hipofisarias innovador y poderoso, así como una herramienta de lectura de activación de células madre.
Este protocolo describe en detalle el establecimiento de organoides derivados de la hipófisis del ratón. Con este objetivo, la AL se aísla y se disocia en células individuales, que están incrustadas en Matrigel que imita la matriz extracelular (en adelante, ECM). El ensamblaje célula-ECM se cultiva en un medio definido, que contiene esencialmente factores de crecimiento de células madre y reguladores embrionarios hipofisarios (también denominado "medio organoide hipofisario" (PitOM)18; Tabla 1). Una vez que los organoides están completamente desarrollados (después de 10-14 días), pueden expandirse aún más a través del pasaje secuencial y someterse a una extensa exploración aguas abajo (por ejemplo, inmunofluorescencia, RT-qPCR y transcriptómica a granel o de una sola célula; Figura 1). A largo plazo, se espera que los organoides de células madre hipofisarias allanen el camino hacia los enfoques de reparación de tejidos y la medicina regenerativa.
Protocolo
Los experimentos con animales para este estudio fueron aprobados por el Comité Ético de Ku Leuven para la Experimentación Animal (P153/2018). Todos los ratones fueron alojados en las instalaciones de animales de la universidad en condiciones estandarizadas (temperatura constante de 23 ± 1,5 ° C, humedad relativa del 40% al 60% y un ciclo día/noche de 12 h), con acceso a agua y alimentos ad libitum.
1. Ratones
- Utilice cepas de ratón disponibles comercialmente, como ratones C57BL/6J, de edad adulta joven (8-12 semanas de edad). En general, 2-3 ratones proporcionan un número suficiente de células AL para el protocolo.
2. Aislamiento y disociación de AL de ratón
NOTA: Los medios A, B y C se preparan con anticipación19,20. Las composiciones se muestran en la Tabla 2.
- Aislamiento de AL de ratón
- Sacrificar a los ratones mediante asfixia por CO2 , seguida de decapitación (Figura 2A). Lavar las cabezas de los ratones con agua desionizada para eliminar la sangre y rociarlas con un 70% de EtOH para generar un ambiente estéril.
- Usando herramientas quirúrgicas estériles, retire la piel de la cabeza entre las orejas (Figura 2B).
- Abra el cráneo y retire el cerebro.
- Romper el "puente nasal" (es decir, la parte anterior del hueso frontal; Figura 2B) con tijeras estériles.
- Abra el cráneo aún más con tijeras, comenzando desde el puente de la nariz roto hacia las orejas, en ambos lados (Figura 2C).
- Retire el cráneo y el cerebro con pinzas estériles, sin tocar la glándula pituitaria (Figura 2D).
- Retire las velas de diafragma con pinzas romas, sin dañar la hipófisis. Deseche el PL y el IL del AL bajo un estereomicroscopio.
NOTA: El PL y el IL están vinculados y, por lo tanto, se eliminan simultáneamente. Estas partes aparecen como tejido blanco, en comparación con el AL de color rosa (Figura 2D). - Aísle cuidadosamente la AL con pinzas romas y recójala en un matraz Erlenmeyer de 10 ml, lleno de 3 ml de medio A (ver Tabla 2). Coloque el matraz sobre hielo hasta su posterior procesamiento.
- Disociación de AL de ratón
- Retire el medio sobrenadante (SN) A del matraz Erlenmeyer que contiene el AL aislado. Añadir 2 ml de solución de tripsina al 2,5 % precalentada (37 °C) e incubar a 37 °C durante 15 min.
- Sin retirar la solución de tripsina, añadir 2 ml de solución de DNasa precalentada (37 °C) (2 μg/ml en el medio A; filtrada estérilmente a través de una malla de 0,22 μm) y girar el matraz Erlenmeyer 10 veces. Deje que la hipófisis se hunda hasta el fondo (~ 1 min) y retire el SN.
- Añadir 2 ml de solución inhibidora de tripsina precalentada (37 °C) (0,1 mg/ml en el medio A; filtrada estérilmente a través de una malla de 0,22 μm) e incubar a 37 °C durante 10 min. Deje que la hipófisis sedimente hacia el fondo y retire el SN.
- Añadir 2 ml de medio B precalentado (37 °C) (véase el cuadro 2) e incubar a 37 °C durante 5 min. Sin quitar el SN, añadir 2 ml de C medio precalentado (37 °C) (véase el cuadro 2) e incubar a 37 °C durante 15 min.
- Deje que la hipófisis se hunda hasta el fondo y retire el SN. Enjuague la hipófisis tres veces con C medio precalentado (37 °C).
- Disociar la hipófisis en células individuales.
- Agregue 2 ml de C medio precalentado (37 ° C). Aspire y expulse la glándula pituitaria con una pipeta Pasteur estéril y pulida al fuego varias veces, hasta que los fragmentos ya no sean visibles.
- Transfiera la suspensión a un tubo de 15 ml con 4,5 ml de solución de DNasa precalentada (37 °C) (2 μg/ml en medio A; filtrada estérilmente a través de una malla de 0,22 μm). Enjuague el Erlenmeyer tres veces con 2 ml de C medio precalentado (37 °C) y transfiera la suspensión al tubo de 15 ml.
- Mezcle la suspensión celular recolectada y filtre a través de un colador celular de 40 μm en un tubo de 30 ml. Enjuague el tubo de 15 ml y el colador celular tres veces con 2 ml de C medio y transfiera la suspensión al tubo de 30 ml.
- Coloque la punta de una pipeta Pasteur de vidrio, llena con 2 ml de solución de albúmina sérica bovina al 3% (BSA) (en medio A; filtrada estérilmente a través de una malla de 0,22 μm), en la parte inferior del tubo y pipetee suavemente para formar una capa de densidad visible. Centrifugadora a 190 x g durante 10 min a 4 °C.
- Retire el SN invirtiendo el tubo en un movimiento fluido y retire las gotas SN restantes con una punta P1000. Resuspender el pellet celular en 1 mL de DMEM/F12 Avanzado helado (Adv DMEM/F12) y cuantificar las células con un contador celular.
3. Establecimiento y cultivo de organoides derivados de AL
NOTA: Descongele el ECM en hielo con anticipación (2-3 h por 1 ml) y manténgalo en hielo durante la duración del protocolo.
- Siembra y cultivo de organoides
- Centrifugar la suspensión de la célula AL a 190 x g durante 10 min a 4 °C y retirar el SN. Resuspend el pellet celular en Adv DMEM/F12 utilizando el volumen específico calculado para alcanzar una densidad celular de 1,1 x 106 células/ml.
NOTA: Por ejemplo, si la suspensión celular contiene 500,000 células / ml, se debe resuspendir el pellet celular en 454.54 μL de Adv DMEM / F12 para alcanzar la densidad deseada de 1.1 x 106 celdas / ml. - Saque el volumen de suspensión celular necesario para el recubrimiento (de acuerdo con el número deseado de pocillos para sembrar para el desarrollo de organoides) y agregue ECM en una proporción de 30:70 (suspensión celular del 30% (en Adv DMEM / F12 ) y 70% ECM). Mezclar bien pipeteando hacia arriba y hacia abajo.
NOTA: Por ejemplo, para una gota de 30 μL (ver paso 3.1.3), se deben mezclar (suavemente) 9 μL de suspensión celular (que contiene ~10,000 células cuando se toma de la suspensión de 1.1 x 106 celdas/ml) con 21 μL de ECM. - Por pozo, deposite una gota de 30 μL de la mezcla de suspensión celular/ECM (véase el paso 3.1.2) en una placa de 48 pocillos precalentada (37 °C). Gire la placa boca abajo y deje que el ECM se solidifique a 37 °C durante 20 min.
NOTA: Precaliente las placas de cultivo durante al menos 24 h a 37 °C. - Devuelva la placa a su orientación adecuada y agregue cuidadosamente 250 μL de PitOM precalentado (37 °C) (ver Tabla 1) complementado con un inhibidor de roca de 10 μM (Y-27632).
- Continúe cultivando los organoides cambiando el medio (desprovisto de Y-27632) cada 2-3 días hasta que los organoides estén completamente desarrollados, lo que toma entre 10-14 días (Figura 3A). Luego, pasa los organoides.
NOTA: Al aspirar el medio, asegúrese de no interrumpir la cúpula de ECM. Incline ligeramente la placa de cultivo y retire el medio del borde inferior del pozo. El medio fresco (precalentado a 37 °C) debe agregarse suavemente al costado del pozo. Si las gotas de gel se desprenden, recoja los organoides y vuelva a suspenderlos y cultive nuevamente en una nueva gota de ECM.
- Centrifugar la suspensión de la célula AL a 190 x g durante 10 min a 4 °C y retirar el SN. Resuspend el pellet celular en Adv DMEM/F12 utilizando el volumen específico calculado para alcanzar una densidad celular de 1,1 x 106 células/ml.
- Paso organoide
- Aspire el medio suavemente y agregue 400 μL de Adv DMEM / F12 helado para desintegrar el ECM y recoger los organoides en un tubo de microcentrífuga. Lavar una vez con 400 μL de Adv DMEM/F12 EM helado. Centrifugar a 200 x g durante 5 min a 4 °C.
- Retire el SN con cuidado y agregue 400 μL de enzima TrypLE Express precalentada (37 °C) (1X). Mezclar invirtiendo el tubo varias veces, e incubar a 37 °C durante 5 min.
- Añadir 400 μL de Adv DMEM/F12 helado y centrifugar a 200 x g durante 5 min a 4 °C. Quite el SN.
- Resuspender el pellet con 100 μL de Adv DMEM/F12 helado y posteriormente romper los organoides mediante el pipeteo vigoroso hacia arriba y hacia abajo con una punta P200 estrechada (es decir, empujar hacia abajo la punta vacía contra la parte inferior del tubo de la microcentrífuga, para reducir su diámetro de apertura) hasta obtener fragmentos organoides (con un diámetro de alrededor de 50 μm) (Figura 3B).
NOTA: La mezcla de disociación debe contener predominantemente fragmentos organoides y solo unas pocas células individuales. La disociación severa de los organoides en células individuales afecta negativamente el recrecimiento de los organoides. - Añadir 800 μL de Adv DMEM/F12 y centrifugar a 190 x g durante 10 min a 4 °C. Quite el SN.
- Pasa los organoides en una proporción de 1:2 a 1:4. Resuspender el pellet en un volumen adecuado de Adv DMEM/F12 según sea necesario para el recubrimiento y agregar ECM en una proporción de 30:70 (30% de suspensión celular y 70% de ECM). Mezclar bien pipeteando hacia arriba y hacia abajo.
- Sembrar y cultivar los organoides como se describe anteriormente en los pasos 3.1.3-3.1.5.
NOTA: En promedio, se desarrollan 20 organoides por pozo a partir de las 10,000 células AL enteras sembradas (0.2%). Estos organoides de paso 0 se pueden dividir en una proporción de 1: 2, lo que resulta en >50 organoides que se desarrollan por pozo (pasaje 1). Los organoides se pueden dividir en una proporción de 1: 2 a 1: 4 durante los pasajes posteriores. El recrecimiento de los organoides se ralentiza después de ~ 10 pasajes (correspondientes a 3 meses de cultivo), concretados en gradualmente menos y organoides más pequeños.
4. Criopreservación de organoides derivados de AL y descongelación
- Criopreservación de organoides
- Siga el protocolo de paso desde el paso 3.2.1 hasta el paso 3.2.5.
- Resuspend el pellet organoide (que contiene fragmentos y células) con 1 mL de medio de criopreservación (Tabla 3). Transfiera la suspensión a un criovial y colóquela sobre hielo.
NOTA: Los organoides (es decir, fragmentos y células resultantes) de hasta cuatro pocillos de la placa de 48 pocillos se pueden combinar en un criovial. - Coloque los crioviales en un recipiente de congelación y transfiéralos a -80 °C.
- Después de 24 h, transfiera las muestras a un criobox y guárdelas en nitrógeno líquido (-196 °C) para su almacenamiento a largo plazo.
- Descongelación de organoides criopreservados
- Retire el criovial del tanque de nitrógeno líquido y colóquelo sobre hielo. Proceda inmediatamente con el protocolo de descongelación.
- Descongelar la solución con los fragmentos organoides criopreservados y las células individuales a 37 °C (baño de agua).
NOTA: No mantenga la solución durante más de 2 min a 37 °C para evitar la toxicidad celular por DMSO. - Transfiera el contenido a un tubo de 15 ml que contenga 10 ml de Adv DMEM/F12 helado con 30% de suero fetal bovino (FBS). Enjuague el criovial con 1 mL de Adv DMEM/F12 con 30% fbs.
- Centrifugadora a 190 x g durante 10 min a 4 °C. Vuelva a suspender el pellet con 1 ml de Adv DMEM/F12 helado y transfiera la suspensión a un tubo de microcentrífuga.
- Centrifugadora a 190 x g durante 10 min a 4 °C. Resuspender el pellet en un volumen adecuado de Adv DMEM/F12 según sea necesario para el recubrimiento y agregar ECM en una proporción de 30:70. Mezclar bien pipeteando hacia arriba y hacia abajo.
- Sembrar y cultivar los organoides como se describe anteriormente en los pasos 3.1.3-3.1.5.
5. Validación de organoides derivados de AL
- Recolección y lisis de organoides para aislamiento de ARN
- Recoger y centrifugar los organoides como se ha descrito anteriormente (paso 3.2.1).
- Retire el SN y agregue 350 μL de tampón de lisis con 1% de 2-mercapto-etanol. Vórtice durante 30 s y almacenar a -80 °C o proceder inmediatamente al aislamiento de ARN.
PRECAUCIÓN: Tenga en cuenta que el 2-mercapto-etanol es un compuesto tóxico. Todo el trabajo debe realizarse en una campana de humos químicos mientras se usan guantes de nitrilo, una máscara contra el polvo y gafas de seguridad. El 2-mercaptoetanol puede causar daños irreversibles en los ojos y la piel.
- Fijación e incrustación de organoides para tinción inmunohistoquímica/-fluorescencia
- Recoger y centrifugar los organoides como se ha descrito anteriormente (paso 3.2.1).
- Retire el SN, agregue 1 ml de paraformaldehído al 4% (PFA) e incube durante 30 minutos a temperatura ambiente (RT) en un agitador orbital (100 rpm).
PRECAUCIÓN: El PFA es un carcinógeno humano conocido que puede causar daños irreversibles a la córnea. Todo el trabajo debe hacerse en una campana de humos químicos. Siempre se deben usar guantes de nitrilo y gafas de seguridad. - Centrifugar a 200 x g durante 5 min y retirar el SN. Añadir 1 ml de PBS, incubar 10 min a RT en un agitador orbital (100 rpm) y centrifugar a 90 x g durante 3 min a 4 °C. Repita el paso de lavado dos veces. Conservar en PBS a 4 °C.
- Para el procesamiento de tejidos y la deshidratación, retire el SN y agregue 150 μL de gel de agarosa al 2% (en PBS) al pellet organoide usando una punta p200 ensanchada precalentada (hecha cortando un pequeño trozo de la punta). Inmediatamente pipetee todo el volumen hacia arriba y expulse en la tapa del tubo de la microcentrífuga.
NOTA: Es importante trabajar rápidamente, ya que el gel que contiene los organoides se solidificará rápidamente. - Deje que el gel se solidifique firmemente durante 30 minutos y mueva el disco de gel a un cassette de histología. Sumergir y almacenar en 50% etOH, hasta la deshidratación en el procesador de tejidos.
- Para la incrustación de parafina, coloque el disco de gel (usando fórceps) en un molde de incrustación y llénelo con parafina tibia (60 ° C). Coloque los moldes a 4 °C hasta que la parafina esté sólida (aproximadamente 45 min). Estas muestras pueden almacenarse a 4 °C o pueden someterse inmediatamente a seccionamiento.
- Microtome los bloques de parafina que contienen organoides a 5 μm de espesor y recoger las muestras en portaobjetos de vidrio. Agregue una gota de agua desionizada debajo de cada sección para permitir el estiramiento adecuado de la sección y coloque los toboganes en una placa de calentamiento plana a 37 ° C durante la noche. Guarde los portaobjetos con secciones a 4 °C o continúe directamente con tinción inmunohistoquímica o inmunofluorescencia.
Resultados
Después del aislamiento y la disociación de la AL, las células individuales obtenidas se siembran en ECM y se cultivan en PitOM (Figura 1, Tabla 1). La Figura 3A muestra el cultivo celular y la densidad en la siembra (Día 0). Algunos pequeños escombros pueden estar presentes (Figura 3A, puntas de flecha blancas), pero desaparecerán al pasar. Catorce días después de la siembra, los organoides derivados de AL están completamente desarrollados (Figura 3A). Los organoides exhiben una morfología quística, con una capa epitelial que encierra un lumen. En esta etapa, los organoides alcanzan un diámetro de 500 μm y tienen que ser pasados. La Figura 3B muestra el cultivo de organoides derivado de AL después de la pasividad en el momento indicado después de la resiembra de los fragmentos organoides disociados.
Ocasionalmente, una o más estructuras densas pueden aparecer en el cultivo de organoides (Figura 3A, Desfavorable). Cuando pasan, los organoides densos tienden a tomar el control, terminando en cultivos con solo estructuras densas después de un par de pasajes (Figura 3B, Desfavorable). Por lo tanto, se recomienda no proceder con pozos que contengan organoides densos (pasaje 0). Alternativamente, los organoides densos pueden descartarse por sedimentación, lo que deja que los organoides quísticos continúen. El origen de estos organoides densos no está claro en la actualidad, pero muestran una naturaleza hipofisaria menos pronunciada18. Si los organoides no crecen, o vuelven a crecer de manera menos eficiente después de la pasadura, los procedimientos de disociación deben optimizarse. En particular, hay que prestar atención a no disociar demasiado duro; los organoides deben dividirse en fragmentos, no en células individuales (Figura 3B, Día 0, recuadro).
El análisis de tinción por inmunofluorescencia confirma el carácter epitelial de los organoides derivados de AL, ya que expresan los marcadores epiteliales E-cadherina (E-Cad) y citoqueratina 8/18 (CK8/18; Figura 3C), que, además, han sido descritos como marcadores de células madre en la hipófisis18. La naturaleza de tallo de los organoides se demuestra adicionalmente por la expresión de SOX2 y TROP2, los cuales también se identificaron como marcadores de células madre hipofisarias (Figura 3C)14,18. LHX3, un factor de transcripción expresado específicamente en la hipófisis (de desarrollo temprano), valida el fenotipo hipofisario de los organoides (Figura 3C). Algunas de las células organoides constituyentes se encuentran en estado proliferativo, expresando el marcador de proliferación Ki67 (Figura 3C).
La exploración y validación adicional del fenotipo hipofisario (tallo) de los organoides derivados de AL se realiza con PCR cuantitativa de transcripción inversa (RT-qPCR). La alta expresión de los marcadores de tallo Sox2, Cdh1 (codificando E-Cad), Krt8, Krt18 y Trop2 está presente en los organoides, claramente más alta que en la AL primaria, lo que indica que los organoides se enriquecen para las células madre y, por lo tanto, representan el compartimiento de células madre AL, como se describió anteriormente (Figura 3D)18. En particular, los factores de transcripción del desarrollo Pitx1 y Pitx2 permanecen expresados después del desarrollo en varios tipos de células hormonales en la AL, y por lo tanto su alta expresión en la AL también. Los cultivos conservan robustamente su fenotipo de tallo, como lo demuestra la expresión sostenida (alta) de estos marcadores después de múltiples pasajes (Figura 3D).

Figura 1: Visión general del establecimiento, mantenimiento, caracterización y potencial de aplicación de organoides de hipófisis sana y enferma. AL: lóbulo anterior; IL: lóbulo intermedio; PL: lóbulo posterior; MZ, zona marginal; PitOM, medio organoide hipofisario (creado con BioRender.com). Los nichos de células madre en el AL están indicados en púrpura. Haga clic aquí para ver una versión más grande de esta figura.
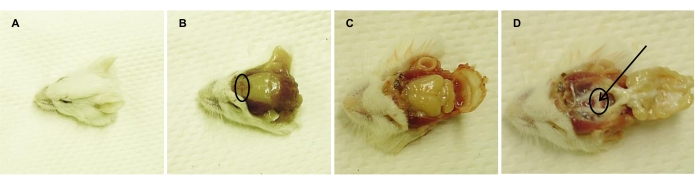
Figura 2: Aislamiento de la glándula pituitaria del ratón adulto sacrificado. Imágenes representativas tomadas consecutivamente después de (A) decapitación, (B) extirpación de la piel de la cabeza (el puente nasal está rodeado), (C) apertura del cráneo y (D) extirpación del cerebro, exponiendo la glándula pituitaria (rodeada). La flecha apunta al PL, que se descarta (junto con el IL asociado), dejando el AL para el aislamiento y la disociación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Establecimiento y validación de organoides derivados de AL. (A) Siembra de células AL y desarrollo de organoides en PitOM en los días indicados (paso 0). La fila superior muestra un crecimiento organoide favorable, con solo estructuras quísticas en desarrollo. La fila inferior muestra un crecimiento desfavorable con una gran estructura densa que aparece (en caja). Las puntas de flecha blancas indican escombros, las puntas de flecha negras indican celdas individuales (ampliadas en el recuadro). (B) Fragmentos organoides (magnificados en recuadro) sembrados en el pasaje (Día 0) y el rebrote de organoides como se observó 7 días después. La fila superior muestra un rebrote organoide favorable, con solo estructuras quísticas creciendo. La fila inferior muestra un rebrote desfavorable con organoides densos que se apoderan del cultivo. (C) Tinción por inmunofluorescencia de E-Cad, SOX2, TROP2 (todo rojo), CK8/18, LHX3 y Ki67 (todos verdes) en organoides derivados de AL. Los núcleos están etiquetados con Hoechst33342 (azul). Las puntas de flecha indican celdas Ki67+. Se indican las barras de escala. (D) Análisis de la expresión génica de marcadores de tallo (Sox2, Cdh1, Krt8, Krt18, Trop2) y factores de transcripción del desarrollo (Pitx1, Pitx2) en organoides primarios derivados de AL y AL (Paso 0 significa 14 días después de la siembra celular) determinado por RT-qPCR (media ± SEM). Los puntos de datos representan réplicas biológicas. Se muestran los valores del umbral del ciclo delta (dCT), calculados utilizando la fórmula: CT (gen de interés) - CT (gen de limpieza Actb). Cuanto más positivo sea el valor de dCT (que se presenta en el eje Y por debajo del eje X cero), menor será el nivel de expresión del gen de interés. Cuanto menor (o más negativo) sea el valor de dCT, mayor será el nivel de expresión 14,18,21,22. Haga clic aquí para ver una versión más grande de esta figura.
| Medio organoide hipofisario (PitOM) | |
| Componente | Concentración |
| DMEM/F12 avanzado | |
| Hepes | 1% |
| Penicilina-Estreptomicina | 1% |
| Glutamax | 1% |
| Suplemento de B-27 (50X), menos vitamina A | 1X |
| L-glutamina (200 mM) | 2 mM |
| Proteína FGF humana recombinante básica/FGF2/bFGF (157 aa) | 20 ng/ml |
| IGF-1 humano recombinante | 100 ng/ml |
| Suplemento N-2 (100X) | 1X |
| N-acetil-cisteína | 1,25 mM |
| FGF-8b humano/murino recombinante | 200 ng/ml |
| FGF-10 humano recombinante | 100 ng/ml |
| A83-01 (inhibidor de la quinasa 4/5/7 similar al receptor de activina) | 0,50 μM |
| Ratón recombinante Sonic Hedgehog/Shh (C25II) N-Terminus | 100 ng/ml |
| Proteína EGF humana recombinante, FQ | 50 ng/ml |
| SB202190 (inhibidor de la proteína quinasa activada por mitógenos p38) | 10 μM |
| Noggin humano recombinante | 100 ng/ml |
| Toxina del cólera de Vibrio cholerae | 100 ng/ml |
| R-Spondin-1 humano recombinante | 200 ng/ml |
| IL-6 humana recombinante | 20 ng/ml |
Tabla 1. Composición de PitOM. PitOM se filtra a través de un filtro de malla de 0,22 μm y se almacena a 4 °C durante un máximo de 2 semanas.
| Medio A | |
| Componente | Cantidad |
| DMEM, polvo, glucosa alta | 13,38 g |
| HEPES | 5,96 g |
| Piruvato de sodio (C3H3NaO3) | 0,11 g |
| Sal sódica de penicilina G | 35,00 mg |
| Sal de sulfato de estreptomicina | 50,00 mg |
| Cloruro de sodio (NaCl) | 0,50 g |
| Carbonato de hidrógeno sódico (NaHCO3) | 1,00 g |
| Albúmina bovina (grado de cultivo celular) | 3,00 g |
| Agua estéril | 1,00 L |
| Medio C | |
| Componente | Cantidad |
| Cloruro de sodio (NaCl) | 7,50 g |
| Cloruro de potasio (KCl) | 0,40 g |
| Fosfato de di-hidrógeno de sodio 1-hidrato | 0,14 g |
| D-glucosa | 1,00 g |
| HEPES | 4,76 g |
| Sal de sulfato de estreptomicina | 50,00 mg |
| Sal sódica de penicilina G | 35,00 mg |
| Rojo fenol | 10,00 mg |
| Albúmina bovina (grado de cultivo celular) | 3,00 g |
| Carbonato de hidrógeno sódico (NaHCO3) | 1,00 g |
| Agua estéril | 1,00 L |
| Medio B | |
| Componente | Cantidad |
| Titriplex III (Edetate disódico sal dihidratada) | 0,74 g |
| Medio C | 100 ml |
Tabla 2. Composición del medio A, B y C. Todos los medios se filtran a través de un filtro de malla de 0,22 μm y se almacenan a 4 °C durante un máximo de 4 meses. El pH de la media A y C debe ajustarse a 7.3.
| Medio de criopreservación | |
| Componente | Concentración |
| DMEM/F12 avanzado | 60% |
| FBS (en inglés) | 30% |
| DMSO | 10% |
Tabla 3. Composición del medio de criopreservación.
Discusión
Los organoides derivados de AL, como se describe aquí, representan un poderoso modelo de investigación para estudiar las células madre hipofisarias in vitro. En la actualidad, este enfoque organoide es la única herramienta disponible para crecer y expandir de manera confiable y robusta las células madre hipofisarias primarias. Anteriormente se ha notificado un modelo organoide hipofisario derivado de células madre embrionarias (ESC) o células madre pluripotentes inducidas (iPSC), que recapitula estrechamente la organogénesis embrionaria hipofisaria23; sin embargo, aunque es muy útil para estudiar el desarrollo hipofisario o el modelo de enfermedad hipofisaria 23,24,25, el protocolo informado, a partir de ESC / iPSC, consume mucho tiempo en comparación con el protocolo descrito aquí, y los organoides resultantes tampoco son expandibles.
El cultivo exitoso de organoides de células madre pituitarias depende de algunos pasos críticos en el protocolo. Es importante colocar un número apropiado de células en la siembra celular inicial. Un número muy alto dará lugar a cultivos superpoblados, lo que deteriora la viabilidad de los organoides y obstruye la expansión completa de los organoides, mientras que un número muy bajo de células dará lugar a una formación limitada de organoides. Además, es importante no perturbar la integridad de la cúpula ECM una vez en cultivo. Agregar y quitar el medio debe hacerse con mucho cuidado, sin tocar la gota de gel. Además, el calentamiento previo del medio de cultivo reduce el riesgo de despolimerización del gel. Finalmente, pasar los organoides correctamente (es decir, disociarse a fragmentos y no a células individuales) es crucial para la expansión eficiente de los cultivos.
Estos organoides de células madre hipofisarias se pueden aprovechar para responder preguntas sobre el fenotipo, la biología y la función de las células madre. Ya se ha demostrado que son valiosos para descubrir nuevas características de las células madre, así como marcadores de activación de células madre asociadas al daño hipofisario y como una herramienta de lectura para la actividad de las células madre (Figura 1)14,18. Los esfuerzos actuales incluyen su derivación de hipófisis enfermas, como el hipopituitarismo y los PitNET (Figura 1). Eventualmente, los organoides también pueden participar en una plataforma para la detección de drogas, como se estableció con éxito para otras enfermedades26,27. Por lo tanto, será necesario un mayor escalado de los cultivos de organoides para alcanzar un análisis de alto rendimiento. Ya se ha notado que los organoides derivados de AL se pueden cultivar de manera eficiente en un formato de 96 pocillos, lo que también resulta en cultivos más homogéneos.
Se ha observado que después de ~ 10 pasajes (correspondientes a 3 meses de cultivo), la eficiencia del crecimiento de los organoides disminuyó gradualmente con los organoides que vuelven a crecer en números más bajos y de menor tamaño. Esta disminución del crecimiento puede ser inherente a la naturaleza intrínseca de las células madre hipofisarias, que pueden no necesitar autorrenovarse muchas veces en la glándula in vivo, que solo está girando lentamente, agotándose así después de un par de rondas de división16,28. Aunque esta eventual disminución del crecimiento podría considerarse como una limitación, el modelo es muy útil ya que la expansión de los organoides durante los pasajes anteriores es más que suficiente para análisis extensos aguas abajo.
Otro aspecto que podría considerarse como una limitación es que los organoides de células madre hipofisarias no muestran una capacidad de diferenciación prominente hacia los tipos de células endocrinas de la AL, incluso después del xenoinjerto bajo la cápsula renal de ratones inmunodeficientes (lo que resultó en un número limitado de células GH + y PRL + como se describe en detalle en la referencia18). O bien aún no se han identificado las condiciones in vitro adecuadas para conducir a las células madre a la diferenciación, o el papel principal de las células madre (especialmente en la glándula adulta) no se encuentra en la generación de nuevas células endocrinas (ya que probablemente no sea necesario en la glándula perezosa, sino solo en condiciones perturbadas o desafiadas)9,10,14, 18. En cambio, la función principal puede estar situada en otros aspectos biológicos (por ejemplo, señalización paracrina al progenitor/precursor hormonal o a las células maduras en condiciones básicas, pero probablemente más en condiciones activas (desarrollo, reparación, enfermedad)13,16. De hecho, aunque se ha demostrado que las células madre hipofisarias poseen capacidad de diferenciación multipotente, especialmente en el período embrionario y neonatal, es concebible que las células madre en la glándula adulta no (necesitan) mantener esta capacidad, dado el muy bajo recambio de la glándula adulta16,28. Es posible que las células madre hipofisarias adultas actúen más como un centro de señalización paracrina, involucrado en la estimulación o regulación de las células progenitoras/precursoras/endocrinas circundantes13,16. Por lo tanto, la diferenciación robusta de los organoides de células madre pituitarias que culmina en la secreción de hormonas puede ser una expectativa errónea que nunca se alcanzará.
En conjunto, el protocolo presentado aquí ofrece una herramienta rápidamente aplicable y confiable para expandir robustamente las células madre hipofisarias primarias en un entorno 3D in vitro. El protocolo da lugar a organoides que capturan fielmente el fenotipo de células madre hipofisarias. El sistema ya se ha aplicado con éxito para estudiar la biología de las células madre hipofisarias y la activación 14,18, y los hallazgos son altamente traducibles a la situación in vivo.
Divulgaciones
Los autores no declaran intereses financieros contrapuestos.
Agradecimientos
Este trabajo fue apoyado por subvenciones del Fondo de Investigación de Ku Leuven y el Fondo para la Investigación Científica (FWO) - Flandes. E.L. (11A3320N) y C.N. (1S14218N) están respaldados por una beca de doctorado de la FWO / FWO-SB.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250 | |
| 48-well plates, TC treated, individually wrapped | Costar | 734-1607 | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Advanced DMEM | Gibco | 12491023 | |
| Albumin Bovine (cell culture grade) | Serva | 47330 | |
| B-27 Supplement (50X), minus vitamin A | Gibco | 12587010 | |
| Base moulds | VWR | 720-1918 | |
| Buffer RLT | Qiagen | 79216 | |
| Cassettes, Q Path Microtwin | VWR | 720-2191 | |
| Cell strainer, 40 µm mesh, disposable | Falcon | 352340 | |
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | D5025 | |
| D-glucose | Merck | 108342 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM, powder, high glucose | Gibco | 52100039 | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | |
| Epredia SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | J1800AMNZ | |
| Epredia HistoStar Embedding Workstation, 220 to 240Vac | Thermo Fisher Scientific | 12587976 | |
| Ethanol Absolute 99.8+% | Thermo Fisher Scientific | 10342652 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| HEPES | Sigma-Aldrich | H4034 | |
| HEPES Buffer Solution | Gibco | 15630056 | |
| InSolution Y-27632 | Sigma-Aldrich | 688001 | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-Free | Corning | 15505739 | |
| Mr. Frosty Freezing Container | Thermo Fisher Scientific | 5100-0001 | |
| N-2 Supplement (100X) | Thermo Fisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A7250 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | Thermo Fisher Scientific | 375353 | |
| Paraformaldehyde for synthesis (PFA) | Merck | 818715 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Penicillin G sodium salt | Sigma-Aldrich | P3032 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Phenol red | Merck | 107241 | |
| Potassium Chloride (KCl) | Merck | 104936 | |
| Recombinant Human EGF Protein, CF | R&D systems | 236-EG | |
| Recombinant Human FGF basic/FGF2/bFGF (157 aa) Protein | R&D systems | 234-FSE | |
| Recombinant Human FGF-10 | Peprotech | 100-26 | |
| Recombinant Human IGF-1 | Peprotech | 100-11 | |
| Recombinant Human IL-6 | Peprotech | 200-06 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human R-Spondin-1 | Peprotech | 120-38 | |
| Recombinant Human/Murine FGF-8b | Peprotech | 100-25 | |
| Recombinant Mouse Sonic Hedgehog/Shh (C25II) N-Terminus | R&D systems | 464-SH | |
| RNeasy micro kit | Qiagen | 74004 | |
| SB202190 | Sigma-Aldrich | S7067 | |
| SeaKem LE Agarose | Lonza | 50004 | |
| Sodium Chloride (NaCl) | BDH | 102415K | |
| Sodium di-Hydrogen Phosphate 1-hydrate | PanReac-AppliChem | A1047 | |
| Sodium Hydrogen Carbonate (NaHCO3) | Merck | 106329 | |
| Sodium-Pyruvate (C3H3NaO3) | Sigma-Aldrich | P5280 | |
| Stericup-GP, 0.22 µm | Millipore | SCGPU02RE | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 0.22 μm | Millipore | SCGP00525 | |
| Sterile water | Fresenius | B230531 | |
| Streptomycin sulfate salt | Sigma-Aldrich | S6501 | |
| Syringe, with BD Microlance needle with intradermal bevel, 26G | BD Plastipak | BDAM303176 | |
| Thermo Scientific Excelsior ES Tissue Processor | Thermo Scientific | 12505356 | |
| Titriplex III | Merck | 108418 | |
| TrypL Express Enzyme (1X), phenol red | Thermo Fisher Scientific | 12605028 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma-Aldrich | T9003 | |
| Trypsin solution 2.5 % | Thermo Fisher Scientific | 15090046 |
Referencias
- Melmed, S. . The pituitary. 3rd ed. , 1 (2011).
- Chen, J., et al. The adult pituitary contains a cell population displaying stem/progenitor cell and early-embryonic characteristics. Endocrinology. 146 (9), 3985-3998 (2005).
- Chen, J., et al. Pituitary progenitor cells tracked down by side population dissection. Stem Cells. 27 (5), 1182-1195 (2009).
- Fauquier, T., Rizzoti, K., Dattani, M., Lovell-Badge, R., Robinson, I. C. A. F. SOX2-expressing progenitor cells generate all of the major cell types in the adult mouse pituitary gland. Proceedings of the National Academy of Sciences of the United States of America. 105 (8), 2907-2912 (2008).
- Rizzoti, K., Akiyama, H., Lovell-Badge, R. Mobilized adult pituitary stem cells contribute to endocrine regeneration in response to physiological demand. Cell Stem Cell. 13 (4), 419-432 (2013).
- Andoniadou, C. L., et al. Sox2+ stem/progenitor cells in the adult mouse pituitary support organ homeostasis and have tumor-inducing potential. Cell Stem Cell. 13 (4), 433-445 (2013).
- Nys, C., Vankelecom, H. Pituitary disease and recovery: How are stem cells involved. Molecular and Cellular Endocrinology. 525 (4), 111176 (2021).
- Schneider, H. J., Aimaretti, G., Kreitschmann-Andermahr, I., Stalla, G. K., Ghigo, E. Hypopituitarism. Lancet. 369 (9571), 1461-1470 (2007).
- Fu, Q., et al. The adult pituitary shows stem/progenitor cell activation in response to injury and is capable of regeneration. Endocrinology. 153 (7), 3224-3235 (2012).
- Willems, C., et al. Regeneration in the pituitary after cell-ablation injury: time-related aspects and molecular analysis. Endocrinology. 157 (2), 705-721 (2016).
- Gremeaux, L., Fu, Q., Chen, J., Vankelecom, H. Activated phenotype of the pituitary stem/progenitor cell compartment during the early-postnatal maturation phase of the gland. Stem Cells and Development. 21 (5), 801-813 (2012).
- Zhu, X., Tollkuhn, J., Taylor, H., Rosenfeld, M. G. Notch-dependent pituitary SOX2+ stem cells exhibit a timed functional extinction in regulation of the postnatal gland. Stem Cell Reports. 5 (6), 1196-1209 (2015).
- Russell, J. P., et al. Pituitary stem cells produce paracrine WNT signals to control the expansion of their descendant progenitor cells. eLife. 10 (1), 59142 (2021).
- Vennekens, A., et al. Interleukin-6 is an activator of pituitary stem cells upon local damage, a competence quenched in the aging gland. Proceedings of the National Academy of Sciences of the United States of America. 118 (25), 2100052118 (2021).
- Mertens, F., et al. Pituitary tumors contain a side population with tumor stem cell-associated characteristics. Endocrine-Related Cancer. 22 (4), 481-504 (2015).
- Laporte, E., Vennekens, A., Vankelecom, H. Pituitary remodeling throughout life: are resident stem cells involved. Frontiers in Endocrinology. 11 (1), 604519 (2021).
- Yoshida, S., et al. Isolation of adult pituitary stem/progenitor cell clusters located in the parenchyma of the rat anterior lobe. Stem Cell Research. 17 (2), 318-329 (2016).
- Cox, B., et al. Organoids from pituitary as novel research model to study pituitary stem cell biology. Journal of Endocrinology. 240 (2), 287-308 (2019).
- Denef, C., Hautekeete, E., De Wolf, A., Vanderschueren, B. Pituitary basophils from immature male and female rats: distribution of gonadotrophs and thyrotrophs as studied by unit gravity sedimentation. Endocrinology. 130 (3), 724-735 (1978).
- Vander Schueren, B., Denef, C., Cassiman, J. J. Ultrastructural and functional characteristics of rat pituitary cell aggregates. Endocrinology. 110 (2), 513-523 (1982).
- Claes, C., et al. Human stem cell-derived monocytes and microglia-like cells reveal impaired amyloid plaque clearance upon heterozygous or homozygous loss of TREM2. Alzheimer's and Dementia. 15 (3), 453-464 (2019).
- Trompeter, H. -. I., et al. MicroRNAs miR-26a, miR-26b, and miR-29b accelerate osteogenic differentiation of unrestricted somatic stem cells from human cord blood. BMC Genomics. 14, 111 (2013).
- Suga, H., et al. Self-formation of functional adenohypophysis in three-dimensional culture. Nature. 480 (7375), 57-62 (2011).
- Matsumoto, R., et al. Congenital pituitary hypoplasia model demonstrates hypothalamic OTX2 regulation of pituitary progenitor cells. Journal of Clinical Investigation. 130 (2), 641-654 (2019).
- Kanie, K., et al. Pathogenesis of anti-PIT-1 antibody syndrome: PIT-1 presentation by HLA class I on anterior pituitary cells. Journal of the Endocrine Society. 3 (11), 1969-1978 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Yan, H. H. N., et al. A comprehensive human gastric cancer organoid biobank captures tumor subtype heterogeneity and enables therapeutic screening. Cell Stem Cell. 23 (6), 882-897 (2018).
- Nolan, L. A., Kavanagh, E., Lightman, S. L., Levy, A. Anterior pituitary cell population control: basal cell turnover and the effects of adrenalectomy and dexamethasone treatment. Journal of Neuroendocrinology. 10 (3), 207-215 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados