Method Article
Ensaio de Glicosylase Uracil-DNA por Desorção a Laser Assistida por Matriz/Análise de Espectrometria de Massa
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um método não-rótulo, não-isotópico não-radio-isotópico para avaliar a atividade uracil-DNA glicosylase foi desenvolvido usando espectrometria de massa MALDI-TOF para análise direta do produto que contém local apurinic/apyrimidinic. O ensaio provou ser bastante simples, específico, rápido e fácil de usar para a medição de glicosilase de DNA.
Resumo
Uracil-DNA glicosylase (UDG) é um componente-chave na via de reparo de excisão base para a correção de uracil formado a partir de deaminação hidrolítica da citosina. Assim, é crucial para a manutenção da integridade do genoma. Um método altamente específico, não rotulado, não-radio-isotópico foi desenvolvido para medir a atividade udg. Um duplex de DNA sintético contendo um uracil específico do local foi cortado pelo UDG e, em seguida, submetido à análise de espectrometria de massa assistida pela Matrix(MALDI-TOF MS). Um protocolo foi estabelecido para preservar o produto apurinic/apyrimidinic (AP) no DNA sem quebra de fios. A alteração do valor m/z do substrato para o produto foi utilizada para avaliar a hidrólise uracil por UDG. Um substrato G:U foi utilizado para análise cinética UDG que produz o Km = 50 nM, Vmax = 0,98 nM/s e Kcat = 9,31 s-1. A aplicação deste método a um ensaio inibidor de gllicosylase uracil (UGI) rendeu um valor IC50 de 7,6 pM. A especificidade do UDG usando uracil em várias posições dentro de substratos de DNA de fio único e duplamente encalhados demonstrou diferentes eficiências de decote. Assim, este método simples, rápido e versátil MALDI-TOF MS pode ser um excelente método de referência para várias glicosilases de DNA monofuncionais. Também tem o potencial como ferramenta para a triagem inibidora de glicosilase de DNA.
Introdução
Embora o uracil seja uma base normal no RNA, é uma lesão comum e altamente mutagênica no DNA genômico. Uracil pode surgir de deaminação hidrolítica espontânea/enzimática de uma desoxicytidina. Em cada célula viva, essa desaminação ocorre 100-500 vezes por dia sob condições fisiológicas1,2. Se essas alterações não forem reparadas, pode haver uma mudança na composição da sequência de DNA, causando mutação. Como uracil no DNA prefere emparelhar com dATP durante a replicação, se a citosina desaminar para uracil, em dois eventos de replicação, haverá uma nova mutação de transição G:C para A:T em metade do DNA progêneo3.
Entre as estratégias celulares para manter a estabilidade genética, o reparo da excisão de base (BER) é um mecanismo essencial que repara bases danificadas, como uracil, no DNA4. BER é um processo altamente conservado evolutivamente. Existem duas vias ber gerais: a via de remendo curto que leva a um trecho de reparo de um único nucleotídeo e a via de remendo longo que produz um setor de reparo de pelo menos dois nucleotídeos5. BER é um mecanismo coordenado que ocorre em várias etapas. O primeiro passo no BER é a hidrólise enzimática da base nucleotídea danificada por uma glicosilase de DNA específica para gerar um local intermediário apurinic/apyrimidinic (AP) 6. Isso é seguido pelo decote da espinha dorsal do fosfato de açúcar no local ap por uma endonuclease, a limpeza do DNA termina por uma lise, preenchimento de lacunas por uma polimerase de DNA, e selando o corte final por um ligase5.
Uracil-DNA glicosylase (UDG) hidrolisa o uracil de DNA contendo uracil para BER em Escherichia coli. Ensaios convencionais de UDG utilizando DNA radiolabeled envolvendo diferentes técnicas de separação6,7,8,9,10,11,12,13 são geralmente demorados, intensivos em mão-de-obra, com reagentes de rotulagem dispendiosos, procedimentos complicados e que exigem treinamento intensivo e prática para reduzir riscos de exposição a materiais radioativos. Ensaios de oligonucleotídeos fluorométricos foram desenvolvidos como um substituto para a rotulagem de radioisótopos14, além de faróis moleculares e tecnologia de transferência de energia de ressonância Förster15,16,17,18,19,20. No entanto, é necessária rotulagem específica para todos os métodos acima mencionados. Recentemente foram desenvolvidos ensaios biosensores sem rótulo21,22,23 e métodos colorimétricos baseados na formação de um G-quadruplex24,25,26. No entanto, vários pares A:U ou sequências especialmente projetadas nas sondas complicam a definição da unidade enzimápica.
MALDI-TOF MS é uma tecnologia que pode ser de grande utilidade na análise de DNA. As aplicações desenvolvidas incluem genotipismo de nucleotídeo único genotipagem27,28, análise de nucleotídeos modificados29 e identificação intermediária de reparo de DNA30,31,32,33,34. Maldi-TOF MS deve ser prontamente adotado para análise de glicosylase de DNA para detectar produtos de DNA contendo local de AP. No entanto, os ap-sites no DNA são propensos a quebra de fios em muitas condições experimentais33. Um ensaio UDG é apresentado aqui usando MALDI-TOF MS para medir diretamente a produção do local AP sem ruído significativo de quebra de fios. Este método livre de rótulos é fácil de trabalhar e tem um alto potencial para a aplicação farmacêutica do rastreamento inibidor de glicosylase de DNA.
Protocolo
1. Preparação de substrato/modelo
- Design uracil substrato/modelo duplex com um conteúdo G+C equilibrado de ~50 ± 10% e temperatura mínima de fusão de 50 °C para a região duplex.
NOTA: Uma diferença de nucleotídeos entre 18 substratos e 19 modelos nt (Tabela 1 e Figura 1) ajuda a melhor interpretação do sinal de MS e a ressaração adequada. A cadeia de modelo serve como DNA complementar para gerar incompatibilidades A-U ou G-U (Tabela 1), mas também pode ser usada como sinal de referência em medições de MS. O uso de oligonucleotídeos sintéticos purificados pelo HPLC é satisfatório para este estudo. - Dissolver o DNA em 1 mM EDTA e 10 mM Tris-HCl (pH 8.0 a 25 °C) (TE) a uma concentração de 100 μmol/L como estoque e armazenar a -20 °C. Diluir este estoque de 20 μL com TE para um volume final de 800 μL (diluição de 25 vezes para 4 μmol/L). Meça a absorvância da solução de DNA em um espectrofotômetro visível UV em λ = 260 nm para garantir a concentração atribuída pelo fabricante. Por exemplo: A260 = 0,204 para 4 μmol/L de U+9 e A260 = 0,192 para 4 μmol/L de T1 (Tabela 1).
- Realize a análise MALDI-TOF MS (seções 4-6) para controle de qualidade oligonucleotídeo inspecionando sinais de pico únicos nos valores de m/z designados, bem como verificando se a relação sinal-ruído é >100 (Figura 1B e Figura 1D).
2. Ensaio de glicosylase de DNA
- Usando um substrato G:U de T1/U+9 duplex (Tabela 1 e Figura 1A) para a reação glicosylase, por exemplo, em um tubo de microcentrifuge estéril de 1,5 mL, adicione 70 μL de H2O, 10 μL de 10x UDG tampão de reação, 5 μL de estoque T1 e 5 μL de ação U+9 (etapa 1.2.).
NOTA: Escolha o tipo correto de micropipette e siga as instruções dos fabricantes para manusear o volume necessário. Por exemplo, use uma pipeta de 2 μL para dispensar 0,1-2 μL de líquido, use uma pipeta de 10 μL para dispensar 2-10 μL de líquido e use uma pipeta de 100 μL para dispensar 20-100 μL de líquido para garantir a precisão e precisão dos resultados. O volume descrito da mistura de reagentes é para 10 ensaios; ajustar o volume para o número desejado de reações. O buffer de reação 1x UDG contém 1 mM EDTA, 1 mM dithiothreitol e 20 mM Tris-HCl (pH 8.0 a 25 °C). Consulte a Tabela de Materiais para obter a fonte do buffer de reação UDG de 10x. - Feche o tubo com segurança; incubar em um banho de água por 30 min a 65 °C, depois por 30 min a 37 °C, e finalmente no gelo por 3 min para garantir o ressarcer adequado do substrato/modelo duplex.
- Em um tubo de microcentrifuge estéril de 1,5 mL, adicione 49 μL de tampão de reação UDG 1x gelado e 1 μL de UDG (5.000 unidades/mL; ver a Tabela de Materiais), diluindo para 0,1 unidades/μL. Faça diluições seriais com tampão UDG 1x para as concentrações enzimáticas desejadas de 0,05, 0,02 ou 0,01 unidades/μL. Mantenha sempre o UDG diluído no gelo.
NOTA: Em uma reação de 10 μL, 0,1 unidades de UDG podem cortar mais de 30 pmol de uracil a partir de um duplex T1/U+9 em 3 min. - Em um tubo de microcentrifuge estéril de 1,5 mL, adicione 9,0 μL de mistura de substrato a partir da etapa 2.2 e pré-ataque do tubo a 37 °C. Adicione 1,0 μL do UDG diluído da etapa 2.3. Use um temporizador para cronometrar a reação e aperte o tubo para misturar o conteúdo.
NOTA: Para um ensaio de definição de unidade, o tempo de incubação é de 30 minutos. Para um ensaio cinético, utilize uma análise de curso de tempo de 0,5, 1, 2, 3, 5 min para obter a taxa inicial. Para um ensaio de inibição ugi, cronometre a reação para 15 min. - Centrifugar os tubos com a mistura de reação para 3-5 s a 3.200 × g em temperatura ambiente. Em seguida, transfira a reação imediatamente para 37 °C.
- Rescisão de reação
- Prepare soluções de 0,25 M HCl e base 0,23 M Tris. Em um tubo de ensaio de 15 mL, adicione 10 mL de uma solução de 1 mM EDTA e 20 mM Tris-HCl (pH 8.0 a 25 °C) para imitar 1x tampão de reação UDG. Acidificar com 1 mL de 0,25 M HCl e verificar com um medidor de pH para garantir que o pH seja ~2 ± 0,5. Neutralizar com 1 mL de base 0,23 M Tris e verificar com um medidor de pH para um pH final de 6,5 ± 0,5.
NOTA: O uso de tiras de teste de pH é uma maneira rápida e fácil de reconfirmar os níveis de pH da mistura de reagentes. - Adicione 1 μL de 0,25 M HCl para acidificar a mistura de reação de 10 μL para inativar a enzima e colocá-la no gelo por 6 minutos. Adicione 1 μL de base tris de 0,23 M para neutralizar os produtos de DNA para evitar a quebra do local ap por exposição prolongada ao ácido. Adicione 13 μL TE para aumentar o volume da mistura do produto para transferência de chips matricial e, em seguida, coloque-o no gelo.
NOTA: O produto AP é quimicamente instável e deve ser analisado por MALDI-TOF MS dentro de 2 dias. Após armazenamento prolongado por mais de uma semana, o acúmulo de uma porção substancial de quebras de fios ocorre devido a reações de eliminação β/δ dos produtos AP (Figura 1D-G).
- Prepare soluções de 0,25 M HCl e base 0,23 M Tris. Em um tubo de ensaio de 15 mL, adicione 10 mL de uma solução de 1 mM EDTA e 20 mM Tris-HCl (pH 8.0 a 25 °C) para imitar 1x tampão de reação UDG. Acidificar com 1 mL de 0,25 M HCl e verificar com um medidor de pH para garantir que o pH seja ~2 ± 0,5. Neutralizar com 1 mL de base 0,23 M Tris e verificar com um medidor de pH para um pH final de 6,5 ± 0,5.
- Transfira todos os produtos de reação UDG de 25 μL de tubos de microcentrifuuga para uma placa de microtiter de 384 poços.
NOTA: Altas concentrações de cáções, como sódio ou potássio em tampões, geram interferência na análise MALDI-TOF MS e, portanto, requerem desselga. Como o buffer de reação UDG E. coli contém concentrações muito baixas de cations, a dessação não é necessária. No entanto, modifique este protocolo para medir outras reações de glicosylase de DNA contendo cações metálicas que requerem dessalgação como descrito anteriormente35.
3. Transfira produtos de reação UDG para um chip de matriz
- Abra a porta do distribuidor de nanoliter (veja a Tabela de Materiais) e carregue a placa de microtiter de 384 poços da etapa 2.7 para o suporte da placa do convés.
- Insira a matriz do chip na posição correspondente da placa de batedor. Coloque a placa de batedor carregada no convés de processamento do distribuidor de nanoliter e feche a porta.
- Toque no botão executar na tela de transferência e aguarde que o instrumento comece a distribuir amostras da placa de microtiter de 384 poços para o chip matrix.
- Use a opção guia Visão para mostrar a imagem do chip e os volumes de distribuição para cada ponto durante a dispensação. Certifique-se de que o volume manchado no chip esteja na faixa de 5-10 nL.
4. Configure os parâmetros de ensaio no espectrômetro de massa
- Use o programa de aplicação (ver a Tabela de Materiais) para preparar um arquivo .xlsx contendo o valor de m/z de sinal previsto para importação.
NOTA: As configurações em FILE I.xlsx (Tabela 2) são configurações de exemplo para o ensaio UDG do substrato G:U na seção 2. - Use o programa de aplicativos para criar e definir um novo ensaio UDG clicando com o botão direito do mouse no Grupo de Ensaio de Importação em Formato de Designer e selecionando o arquivo .xlsx da lista suspensa (por exemplo, FILE I.xlsx da etapa 4.1).
- Clique com o botão direito do cliente:Project:Plate button e clique na parte superior da árvore de opção suspensa para estabelecer uma nova placa de ensaio. Na caixa de diálogo, digite um nome de arquivo (por exemplo, CTT20210620 para o código de laboratório e data de ensaio), e no tipo de placa suspensa, selecione o tipo de placa de 384 poços e pressione OK. Procure uma placa em branco para aparecer à direita da tela.
- Clique na opção Ensaio ; selecione o ensaio (por exemplo, ARQUIVO I.xlsx) da lista suspensa.
- Para atribuir o ensaio selecionado (por exemplo, FILE I.xlsx) a cada posição de ponto de amostra na placa, mova o cursor para cada posição da placa em branco, clique para destacar o poço e clique com o botão direito do mouse para selecionar Adicionar Plex.
- Use um computador desktop ou laptop para preparar uma lista de trabalho em formato .xlsx sem cabeçalho (por exemplo, 0620.xlsx da Tabela 3) para todas as amostras do chip a partir da etapa 2.7. Clique no botão Adicionar novo projeto de amostra ; selecione o arquivo (por exemplo, 0620.xlsx) da lista suspensa para importar a lista de trabalho.
- Procure todos os códigos de amostra de teste na lista de trabalho (por exemplo, a partir de 0620.xlsx) à esquerda da tela. Clique no código de amostra na lista de trabalho e clique com o botão direito do mouse na posição correspondente da placa para vincular os testes a cada posição.
5. Operação do espectrômetro de massa
- Use o programa de aplicação para vincular o espectrômetro de massa (ver a Tabela de Materiais) ao chip de amostra (da seção 3) a ser analisado.
- Clique na configuração padrão. Na caixa de diálogo, digite um nome de arquivo da etapa 4.3 (por exemplo, CTT20210620); no Nome do Experimento, digite o ID do chip no Código de Barras do Chip e salve as configurações.
- Inicie o programa de controle de espectrômetro de massa (veja a Tabela de Materiais).
- Pressione o botão Entrar/Sair do espectrômetro de massa e deixe o deck se estender. Retire o suporte do chip e insira o chip de amostra da etapa 3.4 no suporte do chip. Coloque o suporte do chip carregado no convés estendido e pressione o botão Entrar/Para que o chip de amostra entre no instrumento.
- Clique duas vezes no ícone Adquirir do programa de aplicativo. Na janela Adquirir , clique na guia de execução automática para iniciar o instrumento e adquira espectros de massa das amostras no chip.
6. Visualização de espectros de massa e análise dos dados
- Executar o programa de análise de dados (ver a Tabela de Materiais).
- Navegue pela árvore do banco de dados e selecione o ID do chip a partir da etapa 5.2. Clique para destacar bem um alvo no chip e clique no ícone de espectro para mostrar o espectro de massa.
- Clique com o botão direito do mouse para escolher o Diálogo de Personalização para cortar uma gama específica de espectro em uma nova janela. Clique no Eixo X para digitar os limites superiores e inferiores do m/z e pressione OK para mostrar o espectro de alcance especificado, incluindo os sinais de interesse.
NOTA: A quantidade de DNA é proporcional à intensidade máxima em cada unidade de valor m/z. - Meça a altura máxima dos valores m/z dos sinais correspondentes ao substrato U, produto AP e modelo. Clique no pico e veja a altura máxima no canto superior esquerdo da tela.
NOTA: Um espectro de 1.600 unidades de largura/1.200 é uma dimensão razoável para inspeção em uma tela de computador, bem como para registro. - Para salvar o espectro para registro, clique com o botão direito do mouse em Exportar e selecione o tipo de arquivo JPEG na lista suspensa. Clique em Destino e Veja disco para selecionar o dispositivo de armazenamento na lista suspensa (por exemplo, flash disc E:). Digite o nome do arquivo (por exemplo, 0620_1-2.jpg) e clique em Exportar.
- Se necessário, imprima um arquivo JPEG exportado e meça a altura máxima manualmente usando uma régua.
Resultados
Modelos e substratos
Tomando oligonucleotídeos sintéticos com U no centro (U+9) emparelhados com um modelo G como exemplo (Figura 1A), um controle em branco de quantidades equimolares de modelo e substrato contendo uracil pode ser usado para controle de qualidade da pureza oligonucleotídeo sintético (Figura 1B; os sinais correspondem ao m/z designado e ao baixo ruído de fundo). Para a análise dos dados de MS, as alturas máximas foram medidas (Figura 2). Esperava-se que o DNA do modelo de 19 nt permanecesse inalterado após a hidrólise da glicosilase; portanto, o sinal poderia servir como referência para a quantitação do produto AP (Figura 1C).
Condição de reação e espectros de massa
Este ensaio de glicosilase de DNA é simples e fácil de realizar usando um oligonucleotídeo não rotulado para uma reação padrão para obter resultados limpos e confiáveis (Figura 1). A gama de espectros ms deve cobrir todos os sinais gerados a partir de substratos, modelos e produtos de reação (Figura 1B). A diferença de 1 nt entre o substrato e o modelo correspondente produziu um perfil de sinal bem separado tanto para o modelo quanto para o substrato (Figura 1B). As primers Equimolar U+9 e T1 apresentaram intensidades de pico semelhantes sem diferenças significativas. A digestão extensiva do UDG (0,5 unidades para uma reação de 30 minutos) demonstrou decote uracil completo. O sinal do produto AP também foi bem separado do substrato contendo uracil (Figura 1C d+9 AP-produto m/z = 5447,6 versus Figura 1B U+9 substrato m/z = 5541,6). A técnica de ionização maldi relativamente leve36 utilizada neste estudo minimizou os sinais associados a quebras de fios induzidos pela reação de eliminação de β em locais AP37, que não foram significativos no espectro de massa. No geral, o fundo de reação é muito limpo sem ruído perceptível (Figura 1C).
Sob condições equimolar, a intensidade relativa do sinal do produto AP foi comparável à do substrato U usando o modelo T1 como referência (Figura 1B, U+9/T1 versus d+9/T1). Assim, o cálculo da atividade udg baseia-se na entrada exata do substrato contendo U (50 pmol ou 20 pmol) de acordo com Eq (1).
Atividade UDG = (sinal de produto AP) / (Sinal de substrato U + sinal de produto AP) × [U] (1)
Parâmetros cinéticos UDG determinados pelo ensaio MALDI-TOF MS
Como mostrado na Figura 2, ao longo da reação de 3 min, as reações de UDG de 0,01 unidades a 0,1 unidades demonstraram tanto a dose quanto a dependência do tempo. Foi utilizada uma concentração de 3,2 pM (0,1 unidades por reação de 100 μL) para a determinação dos parâmetros cinéticos, Km e kcat, para um substrato G:U (Tabela 1). As alíquotas da reação udg foram removidas e saciadas por 30 s e 60 s. Os dados cinéticos foram obtidos em condições quando o substrato contendo uracil foi menos de 50% digerido, e cinco concentrações de substrato que variavam de 10 a 200 nM foram submetidas à análise. O curso de tempo presteady-state mostrou excelente linearidade para análise de taxas. Um exemplo de um plot de taxa de reação é mostrado na Figura 3A, onde as intensidades relativas de sinal de MS do produto e do substrato são convertidas em concentração (nM). A taxa de reação UDG (v) é apresentada como nM do site AP produzido por segundo. O Km e o Vmax foram calculados a partir de um enredo lineweaver-burk (Figura 3B). Os parâmetros cinéticos UDG derivados do ensaio MALDI-TOF MS foram, portanto, determinados como Km = 50 nM, Vmax = 0,98 nM s-1 e Kcat = 9,31 s-1. Os valores são comparáveis aos resultados dos ensaios anteriores de liberação 3H-uracil onde o Km = 40 nM e Kcat = 13,3 s-138.
O duplex G:U+9 foi submetido a ensaios de sensibilidade udg. A unidade medida pelo ensaio MALDI-TOF MS foi plotada contra a unidade definida pelo fabricante por um método convencional de liberação 3H-uracil38. Como mostrado na Figura 3C, a unidade medida maldi-TOF MS foi proporcional à unidade definida de 0,001 unidades a 0,02 unidades com a equação de correlação de y = 0,933x + 0,0003 e coeficiente de determinação R2 = 0,9974. O limite de detecção é de 0,001 unidades como coeficiente de variação = 9,2%, ~5 vezes a relação sinal-ruído. Assim, este ensaio MALDI-TOF MS fornece sensibilidade suficiente, uma vez que o UDG é usado principalmente no nível da unidade39.
Especificidade do substrato do UDG
Uma das características características deste ensaio UDG MALDI-TOF MS é que ele é livre de rótulos, o que torna alta versatilidade para design de substrato. Este recurso é muito útil para analisar a especificidade do substrato do UDG. Como demonstrado na Tabela 1, o uracil poderia ser inserido em qualquer lugar próximo à extremidade de 5' ou 3' de DNA de um único fio ou duplamente encalhado para um ensaio de especificidade. Para a especificidade do substrato, é sabido que o UDG é altamente ativo na remoção de uracil de DNA de um único fio38. De fato, como mostrado na Tabela 1, a excisão uracil do substrato de um único fio (SSU) foi diminuída 3,7 vezes quando anexada ao fio de DNA complementar, formando o duplex G:U. Para o comumente usado A:U duplex6,7,8, a taxa de reação foi reduzida em quase 10 vezes em relação ao SSU. O UDG não atuou em U no termo de DNA (Substratos de Tabela 1 de G:U+1, G:U-1 e G:U-2), o que é consistente com estudos anteriores40,41. Curiosamente, u na 2ª e 3ª posições do 5'-terminus exibiu uma taxa catalítica UDG maior do que a U no centro em 2 vezes e 1,5 vezes, respectivamente (Tabela 1, G:U+2 e G:U+3 versus G:U). UDG extirpou U 3-nt do 3'-end com 8% menos atividade que o U no centro (Tabela 1, G:U-3 contra G:U).
Inibição inibidora do inibidor de glicosilase uracil da reação udg
Inibidor de glicoslase uracil (UGI) é uma proteína bacteriófago, que inibe o UDG de E. coli por proteína reversível com uma estequiometria de 1:142. A inibição da atividade UDG por UGI é mostrada na Figura 4. Na presença de 0,05 unidades (100 pM) de UGI, a atividade de 0,05 unidades de UDG (8 pM) foi inibida a um nível indetectável. O IC50 foi de 7,6 pM. Assim, o ensaio UDG MALDI-TOF MS pode ser facilmente modificado para um ensaio de triagem em massa para a descoberta de inibidores de outras glicosylases de DNA.
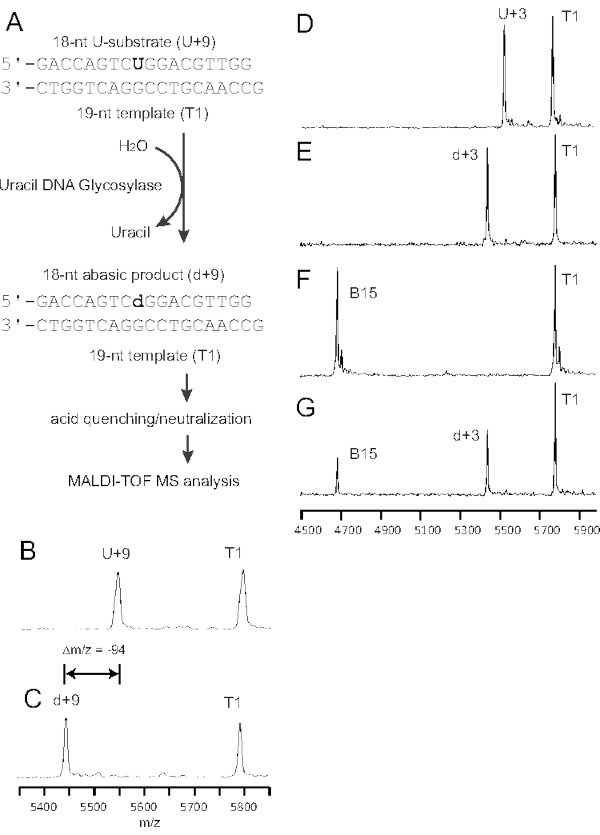
Figura 1: O sistema modelo para um ensaio de glicosylase de DNA. (A) Fio de lesão contendo uma única uridina (U+9) foi enlatado em um modelo (T1), formando uma incompatibilidade G:U (negrito). Uracil-DNA glicosylase detecta e remove o uracil, formando um local AP (d). Quando submetida a MALDI-TOF MS, a diferença nos valores de m/z entre os produtos de DNA contendo U e AP pode ser resolvida conforme mostrado em B. (B) Um DNA de 18 nt contendo uma única uridina (U+9) a um modelo de 19 nt (T1) (Tabela 1) foi testado como uma enzima em branco de 50 pmol de substrato em 40 μL de tampão de reação e submetido à análise de MS. (C) Uma digestão enzimática quase completa de 50 pmol de substrato em uma reação de 10 μL usando 0,5 unidades de UDG a 37 °C por 30 min. (D) Um DNA de 18 nt contendo uma única uridina (U+3) enlatado à enzima T1 em branco de 50 pmol em tampão de reação de 40 μL foi submetido à análise de MS. (E) Uma digestão enzimática quase completa de 50 pmol de substrato U+3 em uma reação de 10 μL usando 0,5 unidades de UDG a 37 °C por 30 min para produzir d+3 e submetida à análise de MS dentro de 30 h. (F) A condição de reação foi a mesma de E , exceto que o produto d+3 estava em 0,1 M NaOH a 95 °C por 30 min para desencadear uma reação beta-eliminação produzindo produto fragmentado B15 e submetido à análise de ESM. (G) A condição de reação foi a mesma do E, exceto que o produto d+3 foi armazenado a -20 °C por mais de 7 dias; uma fração de d+3 convertida em produtos fragmentados B15. Este número é modificado de 43. Abreviaturas: nt = nucleotídeo; MS = espectrometria de massa; MALDI-TOF MS = Desorção a laser assistida por matriz/ionização tempo de voo MS; AP = apurinic/apyrimidinic; UDG = Uracil-DNA glicosylase; T1 = 19 nt modelo contendo G; U+9 = 18 nt substrato contendo U; d+9 = 18 nt PRODUTO contendo local AP; U+3 = 18 nt substrato contendo U; d+3 = 18 nt Produto contendo local AP; B15 = 15 nt produto fragmentado de eliminação beta. Clique aqui para ver uma versão maior desta figura.
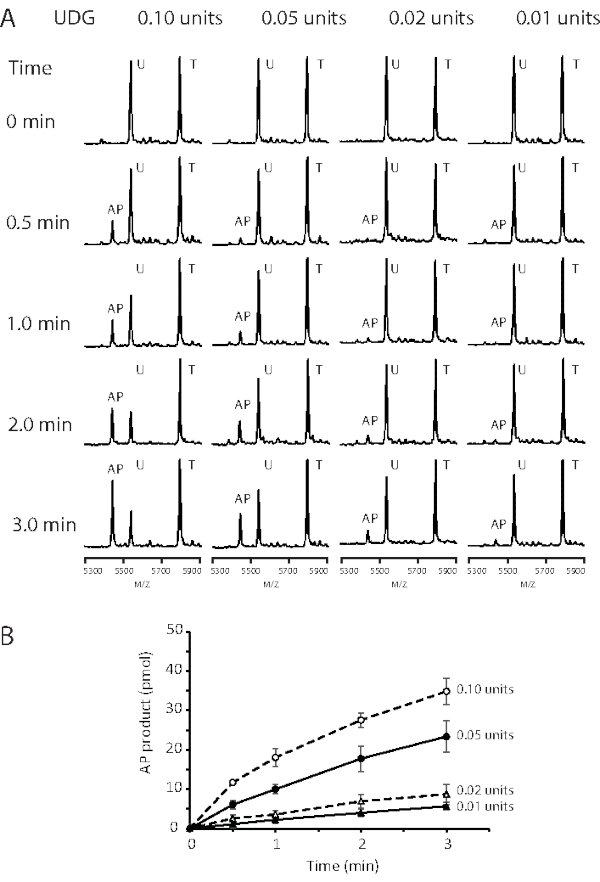
Figura 2: Análise do curso de tempo para atividade de UDG em diferentes concentrações enzimáticas. DNA substrato, 50 pmol, contendo lesão G:U foi incubado com 0,01, 0,02, 0,05 e 0,1 unidades de UDG a 37 °C. As alíquotas (10 μL) foram retiradas da mistura de reação em 0, 0,5, 1, 2 e 3 min e saciadas com um volume igual de fenol/clorofórmio. (A) Espectros de massa MALDI-TOF ilustrando a dependência de concentração do processamento de substratos G:U por UDG. (B) A quantidade de produto foi plotada em função do tempo. UDG: 0,01 (triângulos fechados com linha sólida), 0,02 (triângulo aberto com linha tracejada), 0,05 (círculo fechado com linha sólida) e 0,1 unidades (círculos abertos com linha sólida). Os dados são as médias de três determinações independentes, e as barras de erro representam 1 S.D. Este número é modificado de 43. Abreviaturas: nt = nucleotídeo; MALDI-TOF = Tempo de desorção/ionização a laser assistido por matriz; AP = apurinic/apyrimidinic; UDG = Uracil-DNA glicosylase; T = 19 nt modelo contendo G; U = 18 nt substrato contendo U; AP = 18 nt PRODUTO contendo local AP. Clique aqui para ver uma versão maior desta figura.
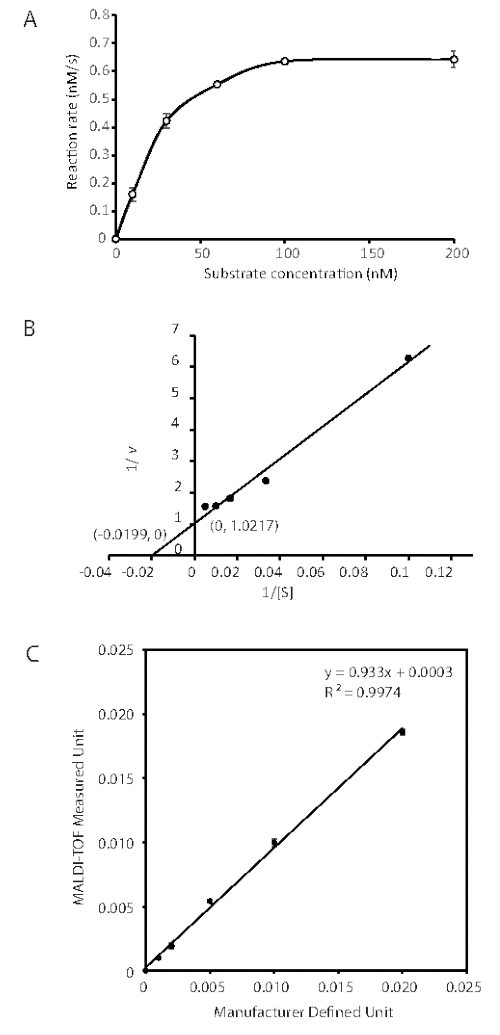
Figura 3: Determinação de parâmetros cinéticos de UDG utilizando análise MALDI-TOF. Curva Michaelis-Menten e tramas de Lineweaver-Burk para determinar o Km e kcat para a excisão catalisada por enzimas UDG de Uracil a partir do DNA. O teste de DNA glicosylase MALDI-TOF MS foi realizado utilizando 0,1 unidades de UDG e diferentes concentrações (10, 30, 60, 100, 200 nM) de substratos em reação de 100 μL para 30 s e 60 s. (A) curva Michaelis-Menten gerada a partir de três experimentos independentes. As barras de erro representam 1 plano de Linha SD. (B) Para o ensaio; as interceptações indicadas permitem o cálculo Km e Vmax. (C) Ensaio UDG por análise MALDI-TOF MS em comparação com a unidade atribuída pelo fabricante. A atividade enzimática foi medida pela remoção uracil formando o local AP em uma reação de 10 μL contendo 50 pmol (0,56 μg) de G:U dentro de um duplex de DNA de 18/19 nt por 30 min a 37 °C. O UDG foi diluído com tampão [50% glicerol, 20 mM Tris-HCl (pH 7.5), 30 mM NaCl, 0,5 mM EDTA, 1 mM dithiothreitol] no gelo. Uma unidade foi definida como a quantidade de enzima que catalisou a liberação de 60 pmol de uracil por minuto. As barras de erro mostram o desvio padrão de seis experimentos. Este número é modificado de 43. Abreviaturas: nt = nucleotídeo; MALDI-TOF = Tempo de desorção/ionização a laser assistido por matriz; UDG = Uracil-DNA glicosylase; AP = apurinic/apyrimidinic; V, velocidade de reação nM/s. Clique aqui para ver uma versão maior desta figura.
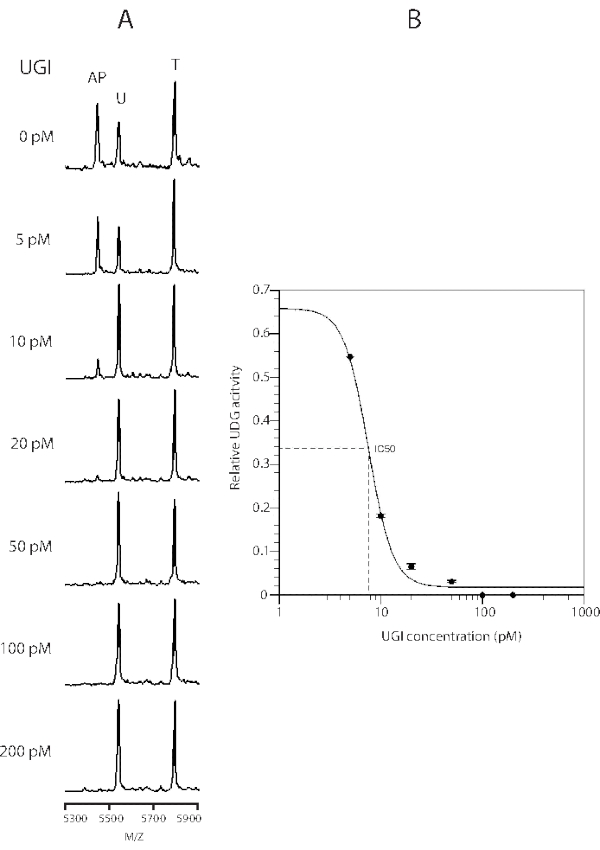
Figura 4: Curva de inibição da enzima UDG por adição de UGI. A curva de inibição foi determinada utilizando reações de 20 μL com 0,05 unidades de UDG (8 pM) e 50 pmol de substrato por 15 min na presença de UGI de 0,001 unidades (5 pM) a 0,1 unidades (200 pM). Os dados são as médias de três determinações independentes, e as barras de erro representam 1 SD. Os dados se encaixam com uma calculadora de IC50 on-line (ver a Tabela de Materiais). Este número é modificado de 43. Abreviaturas: UDG = Uracil-DNA glicosylase; UGI = inibidor de glicosylase uracil. Clique aqui para ver uma versão maior desta figura.
| Substratos de DNA | Oligonucleotídeosa | Sequência de DNA | Ratec inicial | k gato | |
| (pmol/seg) | (s-1) | ||||
| ssU+9 | U+9 | 5'-GACCAGTCUGGACGTTGG-3' | 0,560 ± 0,098 | 35 | |
| ssU+3 | U+3 | 5'-GAUCAGTCCGGACGTTGG-3' | 0,756 ± 0,083 | 47.3 | |
| ssU-3 | U-3 | 5'-GACCAGTCCGGACGTUGG-3' | 0,448 ± 0,087 | 28 | |
| G:U | T1 | 3'-CTGGTCAGGCCTGCAACCGG-5' | 0.149 ± 0,046 | 9.31 | |
| U+9 | 5'-GACCAGTCUGGACGTTGG-3' | ||||
| A:U | T2 | 3'-CTGGTCAGACCTGCAACCGG5-5' | 0,053 ± 0,018 | 3.31 | |
| U+9 | 5'-GACCAGTCUGGACGTTGG-3' | ||||
| G:U5'+3 | T1 | 3'-CTGGTCAGGCCTGCAACCGG-5' | 0.256 ± 0,044 | 16 | |
| U+3 | 5'-GAUCAGTCCGGACGTTGG-3' | ||||
| G:U5'+2 | T3 | 3'-CGGGTCAGGCCTGCAACCGG-5' | 0,567 ± 0,016 | 35.4 | |
| U+2 | 5'-GUCCAGTCCGGACGTTGG-3' | ||||
| G:U5'+1 | T4 | 3'-GTGGTCAGGCCTGCAACCGG5-5' | NDD | ND | |
| U+1 | 5'-UACCAGTCCGGACGTTGG-3' | ||||
| G:U3'-3 | T5 | 3'-CTGGTCAGGCCTGCAGCCG-5' | 0.138 ± 0.015 | 8.63 | |
| U-3 | 5'-GACCAGTCCGGACGTUGG-3' | ||||
| G:U3'-2 | T6 | 3'-CTGGTCAGGCCTGCAAGC-5' | ND | ND | |
| U-2 | 5'-GACCAGTCCGGACGTTUG-3' | ||||
| G:U3'-1 | T7 | 3'-CTGGTCAGGCCTGCAACGG-5' | ND | ND | |
| sub-1 | 5'-GACCAGTCCGGACGTTGU-3' | ||||
Tabela 1: Composições de substrato e especificidades de UDG. Esta tabela mostra o DNA de 18 nt u-contendo designado por U±N. O '+' indica a contagem da posição uracil do terminus de 5' e o '-' indica a contagem da posição uracil do terminus de 3'. Por exemplo, U+9 é a 9ª posição do terminus de 5', U-3 é a 3ª posição do terminus de 3' O modelo complementar de 19 nt de T1 a T7 seria emparelhado com o DNA contendo U formando incompatibilidades G:U ou A:U, conforme indicado. As bases uracil estão em negrito. As reações foram utilizando 50 pmol de substratos u, 0,05 unidades de UDG, em 10 μL como descrito no protocolo seção 2. Esta Tabela é modificada a partir de 43. Abreviaturas: UDG = uracil DNA glicosylase; nt = nucleotídeo; ND, não detectável.
| 2º-PCRP | 1º-PCRP | AMP_LEN | UP_CONF | MP_CONF | Tm | PcGC | PWARN | UEP_DIR | UEP_MASS | UEP_SEQ | EXT1_ CHAMADA | massa EXT1_ |
| NA | NA | NA | NA | NA | NA | NA | F | 5789.8 | GCCAACGTCCGGACTGGTC | |||
| NA | NA | NA | NA | NA | NA | NA | F | 5541.6 | GACCAGTCUGGACGTTGG | |||
Tabela 2: ARQUIVO I.xlsx arquivo. As configurações foram utilizadas para a Figura 1B, C e Figura 2A; 0 min entradas. O sistema MALDI-TOF MS utilizado neste estudo foi projetado especificamente para analisar o polimorfismo de nucleotídeo único por uma única extensão nucleotídea do primer estendido na região de variação de sequência genética amplificada. Para o ensaio UDG, apenas seis campos foram utilizados na preparação do grupo de ensaio FILE I. Abreviaturas: WELL = o número de poço atribuído ao ensaio; TERMO = mistura de terminação; SNP_ID = nome da sequência de entrada do polimorfismo de nucleotídeo único; 2º-PCRP = primer de amplicon para a frente; 1º-PCRP = primer de amplicon reverso; AMP_LEN = comprimento de amplicon; UP_CONF = escore de amplificação uniplex; MP_CONF = escore de amplificação multiplex; Tm = temperatura de fusão; PcGC = percentual de teor gc; PWARN = códigos de aviso de design de ensaio; UEP_DIR = direção de extensão de primer; UEP_MASS = massa de primer não atenuada; UEP_SEQ = sequência de primer não atenuada; EXT1_CALL = nome dado ao pico de massa de analito 1; EXT1_MASS = massa de analito 1.
| 0620_1-2 |
| 0620_1-3 |
| 0620_1-4 |
| 0620_1-5 |
| 0620_1-6 |
| 0620_1-7 |
| 0620_1-8 |
Tabela 3: 0620.xlsx arquivo. Estas configurações foram utilizadas para as reações de inibição ugi na Figura 4A. Abreviação: UGI = inibidor de glicosylase uracil.
Discussão
Este artigo fornece um procedimento detalhado para o uso de um método de ensaio UDG MALDI-TOF MS para detectar diretamente produtos de DNA contendo AP. As principais vantagens deste método são que os substratos contendo uracil são livres de rótulos, escaláveis, fáceis de trabalhar e oferecem maior flexibilidade no design de substratos.
A extração de fenol/clorofórmio recomendada pelo fornecedor UDG permite a inativação da enzima para evitar a degradação do DNA do produto. No entanto, o protocolo de extração de fenol envolve a tediosa separação de fases de produtos químicos perigosos. Um método alternativo de terminação de ácido usando HCl para reduzir o pH de reação para 2 ± 0,5 também inativado efetivamente UDG. A neutralização subsequente com a base tris poderia evitar danos ao DNA. Quando o produto AP foi submetido à análise de MS dentro de 30h, não houve sinais de perda ou modificação de base no espectro de massa (Figura 1E). O buffer Tris nas reações foi fornecido com o UDG comercial. No entanto, várias aminas, incluindo Tris, podem incisar locais AP através de beta-eliminação, embora em altas concentrações de reagentes44. Algumas alternativas, como HEPES e tampão fosfato, podem ser consideradas para evitar o risco de decote do site AP por beta-eliminação.
Como um potencial método de referência UDG, um duplex de substrato G:U centrado (Tabela 1, T1/U+9) é recomendado como o substrato padrão pelas seguintes razões: 1. para relevância fisiológica, G:U é superior à A:U, pois a desaminação da citosina em pares G:C resulta em lesões G:U. 2. Enquanto o E. coli UDG demonstra maior especificidade para hidrolisar U a partir de DNA de uma única cadeia, a reparação de uma lesão U em DNA mono-encalhado é incomum. 3. Para todos os substratos G:U testados, G:U+2 e G:U+3 demonstraram taxas de reação mais altas do que G:U+9. No entanto, uma lesão de desaminação de DNA adjacente a uma quebra de fio é incomum. Para imitar lesões nativas, colocar um G:U no centro do duplex de DNA seria mais apropriado.
Curiosamente, o método MALDI-TOF MS gerou parâmetros cinéticos UDG, e as unidades enzimáticas da reação G:U (Figura 3A-C) foram muito semelhantes aos resultados convencionalmente derivados usando 3H-uracil38. No entanto, o único substrato G:U neste estudo é muito diferente do DNA bacteriófago PBS1 descrito anteriormente com múltiplos erros de síntese de DNA38. Além disso, o UDG mostrou atividade 3 vezes maior com G:U do que com o substrato A:U (Tabela 1, Km e Kcat de G:U versus A:U). Este resultado aparentemente contraditório pode ser atribuído à sequência de DNA do substrato PBS1 contendo 36% de U na forma de múltiplas lesões A:U45 em comparação com apenas 3% de U no G: U substrato (Tabela 1). Enquanto isso, o UDG é uma enzima muito "processiva", ou seja, um único evento de ligação proteína-DNA provoca múltiplos decotes uracil12. A descoberta de uma correlação quase perfeita entre esses dois métodos UDG torna este método de MS uma opção atraente em vez do ensaio tradicional de radioisótopos.
Esta abordagem é facilmente escalável. Todas as reações de UDG neste estudo foram realizadas manualmente utilizando micropipettos e tubos de microcentrifuuge, com ~30 testes realizados em um determinado dia. Assim, menos de um décimo da capacidade do conjunto de chips de formato de placa de 384 poços para o sistema MALDI-TOF MS (ver a Tabela de Materiais) descrito nas seções 3-5 foi utilizada. Em contraste, a adaptação de um sistema automatizado de pipetting para uma microplacão de 384 poços poderia facilmente aumentar a saída diária desta abordagem usando o método de terminação ácida. Assim, 300 reações udg levariam ~1 h. O sistema MALDI-TOF MS (ver a Tabela de Materiais) poderia produzir dados de espectros de massa para até 300 reações em 1 h. Assim, um processo simplificado exigiria 2h para completar 300 ensaios UDG MALDI-TOF MS.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Agradecemos ao Centro Integrado de Genômica Funcional da NCFPB (Taipei, Taiwan) e ao NRPB Pharmacogenomics Lab (Taipei, Taiwan) pelo apoio técnico. Este trabalho foi apoiado pelo Ministério da Ciência e Tecnologia, Taiwan, R.O.C. [número de subvenção MOST109-2314-B-002 -186 para K.-Y.S., MOST 107-2320-B-002-016-MY3 para S.-Y.C., MOST 110-2320-B-002-043 para W.-h.F.]. H.-L.C. é um beneficiário de uma bolsa de doutorado da Universidade Nacional de Taiwan. Financiamento para cobrança de acesso aberto: Ministério da Ciência e Tecnologia, R.O.C.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Amino-2-hydroxymethyl-propane-1,3-diol (Tris base) | J.T baker | Protocol 1,2 | |
| Autoclaved deionized water | MILLIPORE | Protocol 1,2 | |
| EDTA | J.T Baker | Protocol 1,2 | |
| Gloves | AQUAGLOVE | Protocol 1,2,3 | |
| Hydrochloric acid (HCl) | SIGMA | Protocol 1,2 | |
| Ice bucket | Taiwan.Inc | Protocol 2 | |
| Low retention pipette tips(0.5-10 µL) | extra gene | Protocol 1,2 | |
| Low retention pipette tips(1,250 µL) | national scientific supply co, Inc. | Protocol 1,2 | |
| Low retention pipette tips(200 µL) | national scientific supply co, Inc. | Protocol 1,2 | |
| MassARRAY | Agena Bioscience, CA | Protocol 4, 5 Mass spectrometry control programs include Typer Chip Linker, SpectroACQUIRE, and Start RT Process. | |
| MassARRAY Nanodispenser | AAT Bioquest, Inc. | RS1000 | Protocol 3 |
| Microcentrifuge | Kubota | Protocol 2 | |
| Microcentrifuge | Clubio | Protocol 2 | |
| Microcentrifuge tube (1.5 mL) | National scientific supply co, Inc. | Protocol 2 | |
| Microcentrifuge tube rack | Taiwan.Inc | Protocol 1,2 | |
| Micropipette (P1000) | Gilson | Protocol 1,2 | |
| Micropipette (P2) | Gilson | Protocol 1,2 | |
| Micropipette (P10) | Gilson | Protocol 1,2 | |
| Micropipette (P100) | Gilson | Protocol 1,2 | |
| Micropipette (P200) | Gilson | Protocol 1,2 | |
| Micropipette (SL2) | Rainin | Protocol 1,2 | |
| Oligonucleotides | Integrated DNA Technologies (Singapore) | Protocol 1,2 | |
| Quest Graph IC50 Calculator (v.1) | AAT Bioquest, Inc. | Fig. 4 https://www.aatbio.com/tools/ic50-calculator-v1 | |
| Sodium hydroxide (NaOH) | WAKO | Protocol 2 | |
| SpectroCHIP array | Agena Bioscience, CA | #01509 | Protocol 3, 5 |
| Timer | Taiwan.Inc | Protocol 2 | |
| Typer 4.0 software | Agena Bioscience, CA | #10145 | Protocol 6 Typer 4.0 consists four programs including Assay Designer, Assay Editor, Plate Editor, and Typer Analyzer. |
| UDG Reaction Buffer (10x) | New England Biolabs, MA | B0280S | Protocol 2 |
| Uracil Glycosylase Inhibitor | New England Biolabs, MA | M0281S | Protocol 2 |
| Uracil-DNA Glycosylase | New England Biolabs, MA | M0280L | Protocol 2 |
| UV-VISBLE spectrophotometer UV-1601 | SHIMADZU | Protocol 1 | |
| Water bath | ZETA ZC-4000 (Taiwan.Inc) | Protocol 2 |
Referências
- Frederico, L. A., Kunkel, T. A., Shaw, B. R. A sensitive genetic assay for the detection of cytosine deamination: determination of rate constants and the activation energy. Biochemistry. 29 (10), 2532-2537 (1990).
- Kavli, B., Otterlei, M., Slupphaug, G., Krokan, H. E. Uracil in DNA-General mutagen, but normal intermediate in acquired immunity. DNA Repair. 6 (4), 505-516 (2007).
- Duncan, B. K., Miller, J. H. Mutagenic deamination of cytosine residues in DNA. Nature. 287 (5782), 560-561 (1980).
- Gros, L., Saparbaev, M. K., Laval, J. Enzymology of the repair of free radicals-induced DNA damage. Oncogene. 21 (58), 8905-8925 (2002).
- Robertson, A. B., Klungland, A., Rognes, T., Leiros, I. Base excision repair: The long and short of it. Cellular and Molecular Life Sciences. 66 (6), 981-993 (2009).
- Lindahl, T. An N-glycosidase from Escherichia coli that releases free uracil from DNA containing deaminated cytosine residues. Proceedings of The National Academy of Sciences of the United States of America. 71 (9), 3649-3653 (1974).
- Caradonna, S. J., Cheng, Y. C. Uracil DNA-glycosylase. Purification and properties of this enzyme isolated from blast cells of acute myelocytic leukemia patients. Journal of Biological Chemistry. 255 (6), 2293-2300 (1980).
- Krokan, H., Urs Wittwer, C. Uracil DNA-glycosylase from HeLa cells: general properties, substrate specificity and effect of uracil analogs. Nucleic Acids Research. 9 (11), 2599-2614 (1981).
- Tchou, J., et al. 8-oxoguanine (8-hydroxyguanine) DNA glycosylase and its substrate specificity. Proceedings of The National Academy of Sciences of the United States of America. 88 (11), 4690-4694 (1991).
- Knævelsrud, I., et al. Excision of uracil from DNA by the hyperthermophilic Afung protein is dependent on the opposite base and stimulated by heat-induced transition to a more open structure. Mutation Research-DNA Repair. 487 (3-4), 173-190 (2001).
- Minko, I. G., et al. Recognition of DNA adducts by edited and unedited forms of DNA glycosylase NEIL1. DNA Repair. 85, 102741 (2020).
- Bennett, S. E., Sanderson, R. J., Mosbaugh, D. W. Processivity of Escherichia coli and rat liver mitochondrial uracil-DNA glycosylase is affected by NaCl concentration. Biochemistry. 34 (18), 6109-6119 (1995).
- Xia, L., O'Connor, T. R. DNA glycosylase activity assay based on streptavidin paramagnetic bead substrate capture. Analytical Biochemistry. 298 (2), 322-326 (2001).
- Kreklau, E. L., et al. A novel fluorometric oligonucleotide assay to measure O(6)-methylguanine DNA methyltransferase, methylpurine DNA glycosylase, 8-oxoguanine DNA glycosylase and abasic endonuclease activities: DNA repair status in human breast carcinoma cells overexpressing methylpurine DNA glycosylase. Nucleic Acids Research. 29 (12), 2558-2566 (2001).
- Liu, B., et al. Real-time monitoring of uracil removal by uracil-DNA glycosylase using fluorescent resonance energy transfer probes. Analytical Biochemistry. 366 (2), 237-243 (2007).
- Zhang, L., Zhao, J., Jiang, J., Yu, R. A target-activated autocatalytic DNAzyme amplification strategy for the assay of base excision repair enzyme activity. Chemical Communications. 48 (70), 8820-8822 (2012).
- Zhou, D. M., et al. Graphene oxide-hairpin probe nanocomposite as a homogeneous assay platform for DNA base excision repair screening. Biosensors and Bioelectronics. 41, 359-365 (2013).
- Wang, X., Hou, T., Lu, T., Li, F. Autonomous exonuclease iii-assisted isothermal cycling signal amplification: A facile and highly sensitive fluorescence DNA glycosylase activity assay. Analytical Chemistry. 86 (19), 9626-9631 (2014).
- Wu, Y., Wang, L., Zhu, J., Jiang, W. A DNA machine-based fluorescence amplification strategy for sensitive detection of uracil-DNA glycosylase activity. Biosensors and Bioelectronics. 68, 654-659 (2015).
- Xi, Q., Li, J. J., Du, W. F., Yu, R. Q., Jiang, J. H. A highly sensitive strategy for base excision repair enzyme activity detection based on graphene oxide mediated fluorescence quenching and hybridization chain reaction. Analyst. 141 (1), 96-99 (2016).
- Liu, X., et al. A novel electrochemical biosensor for label-free detection of uracil DNA glycosylase activity based on enzyme-catalyzed removal of uracil bases inducing strand release. Electrochimica Acta. 113, 514-518 (2013).
- McWilliams, M. A., Anka, F. H., Balkus, K. J., Slinker, J. D. Sensitive and selective real-time electrochemical monitoring of DNA repair. Biosensors and Bioelectronics. 54, 541-546 (2014).
- Jiao, F., et al. A novel and label-free biosensors for uracil-DNA glycosylase activity based on the electrochemical oxidation of guanine bases at the graphene modified electrode. Talanta. 147, 98-102 (2016).
- Liu, X., et al. Label-free colorimetric assay for base excision repair enzyme activity based on nicking enzyme assisted signal amplification. Biosensors and Bioelectronics. 54, 598-602 (2014).
- Nie, H., Wang, W., Li, W., Nie, Z., Yao, S. A colorimetric and smartphone readable method for uracil-DNA glycosylase detection based on the target-triggered formation of G-quadruplex. Analyst. 140 (8), 2771-2777 (2015).
- Du, Y. C., Jiang, H. X., Huo, Y. F., Han, G. M., Kong, D. M. Optimization of strand displacement amplification-sensitized G-quadruplex DNAzyme-based sensing system and its application in activity detection of uracil-DNA glycosylase. Biosensors and Bioelectronics. 77, 971-977 (2016).
- Haff, L. A., Smirnov, I. P. Single-nucleotide polymorphism identification assays using a thermostable DNA polymerase and delayed extraction MALDI-TOF mass spectrometry. Genome Research. 7 (4), 378-388 (1997).
- Blondal, T., et al. A novel MALDI-TOF based methodology for genotyping single nucleotide polymorphisms. Nucleic Acids Research. 31 (24), 155 (2003).
- Cui, Z., Theruvathu, J. A., Farrel, A., Burdzy, A., Sowers, L. C. Characterization of synthetic oligonucleotides containing biologically important modified bases by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Analytical Biochemistry. 379 (2), 196-207 (2008).
- Darwanto, A., Farrel, A., Rogstad, D. K., Sowers, L. C. Characterization of DNA glycosylase activity by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Analytical Biochemistry. 394 (1), 13-23 (2009).
- Redrejo-Rodríguez, M., et al. New insights in the removal of the Hydantoins, oxidation product of pyrimidines, via the base excision and Nucleotide incision repair pathways. PLoS ONE. 6 (7), 21039 (2011).
- Prorok, P., et al. Uracil in duplex DNA is a substrate for the nucleotide incision repair pathway in human cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (39), 3695-3703 (2013).
- Alexeeva, M., et al. Excision of uracil from DNA by hSMUG1 includes strand incision and processing. Nucleic Acids Research. 47 (2), 779-793 (2019).
- Thapar, U., Demple, B. Deployment of DNA polymerases beta and lambda in single-nucleotide and multinucleotide pathways of mammalian base excision DNA repair. DNA Repair. 76, 11-19 (2019).
- Su, K. Y., et al. Proofreading and DNA repair assay using single nucleotide extension and MALDI-TOF mass spectrometry analysis. Journal of Visualized Experiments : JoVE. (136), e57862 (2018).
- Hillenkamp, F., Karas, M., Beavis, R. C., Chait, B. T. Matrix-assisted laser desorption/ionization mass spectrometry of biopolymers. Analytical Chemistry. 63 (24), 1193-1202 (1991).
- Brammer, K. W., Jones, A. S., Mian, A. M., Walker, R. T. Study of the use of alkaline degradation of DNA derivative as a procedure for the determination of nucleotide distribution. Biochimica et Biophysica Acta. 166 (3), 732-734 (1968).
- Lindahl, T., Ljungquist, S., Siegert, W., Nyberg, B., Sperens, B. DNA N-glycosidases: properties of uracil-DNA glycosidase from Escherichia coli. Journal of Biological Chemistry. 252 (10), 3286-3294 (1977).
- Rashtchian, A., Buchman, G. W., Schuster, D. M., Berninger, M. S. Uracil DNA glycosylase-mediated cloning of polymerasechain reaction-amplified DNA: Application to genomic and cDNA cloning. Analytical Biochemistry. 206 (1), 91-97 (1992).
- Varshney, U., van de Sande, J. H. Specificities and kinetics of uracil excision from uracil-containing DNA oligomers by Escherichia coli uracil DNA glycosylase. Biochemistry. 30 (16), 4055-4061 (1991).
- Delort, A. M., et al. Excision of uracil residues in DNA: Mechanism of action of Escherichia coli and Micrococcus luteus uracil-DNA glycosylases. Nucleic Acids Research. 13 (2), 319-335 (1985).
- Wang, Z. G., Smith, D. G., Mosbaugh, D. W. Overproduction and characterization of the uracil-DNA glycosylase inhibitor of bacteriophage PBS2. Gene. 99 (1), 31-37 (1991).
- Chang, H. L., et al. Measurement of uracil-DNA glycosylase activity by matrix assisted laser desorption/ionization time-of-flight mass spectrometry technique. DNA Repair. 97, 103028 (2021).
- Minko, I. G., et al. Catalysts of DNA strand cleavage at apurinic/apyrimidinic sites. Scientific Reports. 6 (1), 28894 (2016).
- Lindahl, T. Uracil-DNA glycosylase from Escherichia coli. Methods in Enzymology. 65, 284-290 (1980).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados