Method Article
فحص الجليكوزيلاز Uracil-DNA بواسطة تحليل الطيف الكتلي للامتصاص / التأين بالليزر بمساعدة المصفوفة
* These authors contributed equally
In This Article
Summary
تم تطوير طريقة غير موسومة وغير نظيرية مشعة لفحص نشاط اليوراسيل - الحمض النووي للجليكوسيلاز باستخدام مطياف الكتلة MALDI-TOF لتحليل المنتج المباشر المحتوي على موقع apurinic / apyrimidinic. أثبت الفحص أنه بسيط للغاية ومحدد وسريع وسهل الاستخدام لقياس جليكوزيلاز الحمض النووي.
Abstract
يعد اليوراسيل - الحمض النووي غليكوزيلاز (UDG) مكونا رئيسيا في مسار إصلاح استئصال القاعدة لتصحيح اليوراسيل المتكون من إزالة الأمين المائي للسيتوزين. وبالتالي ، فمن الأهمية بمكان للحفاظ على سلامة الجينوم. ووضعت طريقة محددة للغاية وغير موسومة وغير نظائر مشعة لقياس نشاط ال UDG. تم شق دوبلكس الحمض النووي الاصطناعي الذي يحتوي على يوراسيل خاص بالموقع بواسطة UDG ثم تم إخضاعه لتحليل الطيف الكتلي للامتصاص بالليزر / التأين بمساعدة المصفوفة (MALDI-TOF MS). تم إنشاء بروتوكول للحفاظ على منتج موقع apurinic / apyrimidinic (AP) في الحمض النووي دون كسر حبل. تم استخدام التغيير في قيمة m / z من الركيزة إلى المنتج لتقييم التحلل المائي لليوراسيل بواسطة UDG. تم استخدام الركيزة G:U للتحليل الحركي UDG مما أسفر عن Km = 50 nM ، Vmax = 0.98 nM / s ، و Kcat = 9.31 s-1. أدى تطبيق هذه الطريقة على اختبار مثبط جليكوزيلاز اليوراسيل (UGI) إلى قيمة IC50 تبلغ 7.6 جزء في المليون. أظهرت خصوصية UDG باستخدام uracil في مواقع مختلفة داخل ركائز الحمض النووي المفردة والمزدوجة التي تقطعت بها السبل كفاءات انقسام مختلفة. وبالتالي ، يمكن أن تكون طريقة MALDI-TOF MS البسيطة والسريعة ومتعددة الاستخدامات طريقة مرجعية ممتازة لمختلف جليكوزيلاز الحمض النووي أحادي الوظيفة. كما أن لديها القدرة كأداة لفحص مثبطات الحمض النووي للجليكوزيلاز.
Introduction
على الرغم من أن اليوراسيل هو قاعدة طبيعية في الحمض النووي الريبي ، إلا أنه آفة شائعة ومطفرة للغاية في الحمض النووي الجينومي. يمكن أن ينشأ Uracil من إزالة الأمين المائي التلقائي / الأنزيمي من deoxycytidine. في كل خلية حية ، يحدث هذا التطهير 100-500 مرة في اليوم في ظل الظروف الفسيولوجية1,2. إذا لم يتم إصلاح هذه التعديلات ، فقد يكون هناك تغيير في تكوين تسلسل الحمض النووي ، مما يسبب طفرة. نظرا لأن اليوراسيل في الحمض النووي يفضل الاقتران مع dATP أثناء التكرار ، إذا كان السيتوزين يزيل الأمينات إلى اليوراسيل ، في حدثين للتكرار ، ستكون هناك طفرة انتقالية جديدة من G:C إلى A:T في نصف الحمض النووي للذرية 3.
من بين الاستراتيجيات الخلوية للحفاظ على الاستقرار الوراثي ، يعد إصلاح استئصال القاعدة (BER) آلية أساسية لإصلاح القواعد التالفة ، مثل اليوراسيل ، في DNA4. BER هي عملية محفوظة تطوريا للغاية. هناك مساران عامان ل BER: مسار التصحيح القصير المؤدي إلى مسار إصلاح لنيوكليوتيد واحد ومسار التصحيح الطويل الذي ينتج مسارا لإصلاح اثنين على الأقل من النيوكليوتيدات 5. BER هي آلية منسقة تحدث في عدة خطوات. الخطوة الأولى في BER هي التحلل المائي الأنزيمي لقاعدة النيوكليوتيدات التالفة بواسطة جليكوزيلاز الحمض النووي الخاص بالتلف لتوليد موقع وسيط أبورينيك / أبيريميدينيك (AP) 6. ويتبع ذلك انقسام العمود الفقري للسكر والفوسفات في موقع AP بواسطة endonuclease ، وينتهي تنظيف الحمض النووي بواسطة لياز ، وملء الفجوة بواسطة بوليميراز الحمض النووي ، وختم النيك النهائي بواسطة ligase5.
يقوم اليوراسيل-الحمض النووي غليكوزيلاز (UDG) بتحلل اليوراسيل من الحمض النووي المحتوي على اليوراسيل ل BER في الإشريكية القولونية. عادة ما تكون فحوصات UDG التقليدية باستخدام الحمض النووي الموسوم إشعاعيا والتي تنطوي على تقنيات فصل مختلفة6،7،8،9،10،11،12،13 تستغرق وقتا طويلا وكثيفة العمالة ، مع كواشف وضع العلامات المكلفة ، والإجراءات المعقدة ، وتتطلب تدريبا وممارسة مكثفين للحد من مخاطر التعرض للمواد المشعة. تم تطوير مقايسات أوليغونوكليوتيد الفلورومترية كبديل لوضع العلامات على النظائر المشعة14، بالإضافة إلى المنارات الجزيئية وتكنولوجيا نقل طاقة الرنين Förster15,16,17,18,19,20. ومع ذلك ، هناك حاجة إلى وضع علامات محددة لجميع الطرق المذكورة أعلاه. تم مؤخرا تطوير اختبارات أجهزة الاستشعار الحيوية الخالية من الملصقات 21،22،23 وطرق قياس الألوان القائمة على تشكيل G-quadruplex24،25،26. ومع ذلك ، فإن أزواج A: U المتعددة أو التسلسلات المصممة خصيصا في المجسات تعقد تعريف وحدة الإنزيم.
MALDI-TOF MS هي تقنية يمكن أن تكون ذات فائدة كبيرة في تحليل الحمض النووي. وتشمل التطبيقات التي تم تطويرها التنميط الجيني متعدد الأشكال أحادي النوكليوتيدات27،28، وتحليل النيوكليوتيدات المعدلة29، وتحديد وسيط إصلاح الحمض النووي30،31،32،33،34. يجب اعتماد MALDI-TOF MS بسهولة لتحليل جليكوزيلاز الحمض النووي للكشف عن منتجات الحمض النووي التي تحتوي على موقع AP. ومع ذلك ، فإن مواقع AP في الحمض النووي عرضة لكسر الخيوط في ظل العديد من الظروف التجريبية 33. يتم عرض فحص UDG هنا باستخدام MALDI-TOF MS لقياس إنتاج موقع AP مباشرة دون ضوضاء كبيرة في كسر الحبل السري. هذه الطريقة الخالية من الملصقات سهلة الاستخدام ولديها إمكانات عالية للتطبيق الصيدلاني لفحص مثبطات الحمض النووي للجليكوزيلاز.
Protocol
1. إعداد الركيزة / القالب
- تصميم الركيزة / قالب اليوراسيل دوبلكس مع محتوى G + C متوازن من ~ 50 ± 10 ٪ والحد الأدنى من درجة حرارة الانصهار من 50 درجة مئوية لمنطقة دوبلكس.
ملاحظة: يساعد اختلاف واحد في النيوكليوتيدات بين ركائز 18 nt وقوالب 19 nt (الجدول 1 والشكل 1) على تحسين تفسير إشارة MS والتلدين المناسب. يعمل شريط القالب كحمض نووي تكميلي لتوليد عدم تطابق A-U أو G-U (الجدول 1) ولكن يمكن استخدامه أيضا كإشارة مرجعية في قياسات MS. استخدام أوليغونوكليوتيدات الاصطناعية المنقاة من HPLC مرض لهذه الدراسة. - يذوب الحمض النووي في 1 mM EDTA و 10 mM Tris-HCl (الرقم الهيدروجيني 8.0 عند 25 درجة مئوية) (TE) بتركيز 100 ميكرومول / لتر كمخزون ويخزن عند -20 درجة مئوية. قم بتخفيف هذا المخزون 20 ميكرولتر مع TE إلى حجم نهائي قدره 800 ميكرولتر (تخفيف 25 ضعفا إلى 4 ميكرومول / لتر). قم بقياس امتصاص محلول الحمض النووي في مقياس الطيف الضوئي المرئي للأشعة فوق البنفسجية عند λ = 260 نانومتر لضمان التركيز المعين من قبل الشركة المصنعة. على سبيل المثال: A260 = 0.204 ل 4 ميكرومول / لتر من U + 9 و A260 = 0.192 ل 4 ميكرومول / لتر من T1 (الجدول 1).
- إجراء تحليل MALDI-TOF MS (الأقسام 4-6) لمراقبة جودة أوليغونوكليوتيد من خلال فحص إشارات الذروة الفريدة عند قيم M/Z المعينة وكذلك عن طريق التحقق من أن نسبة الإشارة إلى الضوضاء هي >100 (الشكل 1B والشكل 1D).
2. فحص الحمض النووي غليكوزيلاز
- باستخدام ركيزة G:U من T1 / U + 9 المزدوجة (الجدول 1 والشكل 1A) لتفاعل الجليكوسيلاز ، على سبيل المثال ، في أنبوب طرد مركزي دقيق معقم 1.5 مل ، أضف 70 ميكرولتر من H2O ، و 10 ميكرولتر من المخزن المؤقت لتفاعل UDG 10x ، و 5 ميكرولتر من مخزون T1 ، و 5 ميكرولتر من مخزون U + 9 (الخطوة 1.2).
ملاحظة: اختر النوع الصحيح من الماصة الدقيقة واتبع تعليمات الشركات المصنعة للتعامل مع وحدة التخزين المطلوبة. على سبيل المثال ، استخدم ماصة 2 ميكرولتر لتوزيع 0.1-2 ميكرولتر من السائل ، واستخدم ماصة 10 ميكرولتر لتوزيع 2-10 ميكرولتر من السائل ، واستخدم ماصة 100 ميكرولتر لتوزيع 20-100 ميكرولتر من السائل لضمان دقة ودقة النتائج. الحجم الموصوف لمزيج الكاشف هو ل 10 مقاييسات. ضبط مستوى الصوت لعدد التفاعلات المطلوب. يحتوي المخزن المؤقت لتفاعل UDG 1x على 1 mM EDTA و 1 mM dithiothreitol و 20 mM Tris-HCl (الرقم الهيدروجيني 8.0 عند 25 درجة مئوية). راجع جدول المواد لمعرفة مصدر المخزن المؤقت لتفاعل UDG بمعدل 10 أضعاف. - أغلق الأنبوب بإحكام. احتضن في حمام مائي لمدة 30 دقيقة عند 65 درجة مئوية ، ثم لمدة 30 دقيقة عند 37 درجة مئوية ، وأخيرا على الجليد لمدة 3 دقائق لضمان التلدين السليم للركيزة / القالب على الوجهين.
- في أنبوب الطرد المركزي الدقيق المعقم سعة 1.5 مل ، أضف 49 ميكرولتر من المخزن المؤقت لتفاعل 1x UDG البارد و 1 ميكرولتر من UDG (5000 وحدة / مل ؛ انظر جدول المواد) ، مع التخفيف إلى 0.1 وحدة / ميكرولتر. قم بإجراء تخفيفات تسلسلية باستخدام مخزن مؤقت UDG 1x إلى تركيزات الإنزيم المطلوبة من 0.05 أو 0.02 أو 0.01 وحدة / ميكرولتر.
ملاحظة: في تفاعل 10 ميكرولتر، يمكن ل 0.1 وحدة من UDG شق أكثر من 30 بمول من اليوراسيل من دوبلكس T1/U+9 في 3 دقائق. - في أنبوب الطرد المركزي الدقيق المعقم سعة 1.5 مل ، أضف 9.0 ميكرولتر من مزيج الركيزة من الخطوة 2.2 وقم بتسخين الأنبوب إلى 37 درجة مئوية. أضف 1.0 ميكرولتر من UDG المخفف من الخطوة 2.3. استخدم مؤقت لتوقيت التفاعل وقم بتحريك الأنبوب لخلط المحتويات.
ملاحظة: بالنسبة لفحص تعريف الوحدة، يكون وقت الحضانة 30 دقيقة. لإجراء فحص حركي ، استخدم تحليلا زمنيا من 0.5 ، 1 ، 2 ، 3 ، 5 دقائق للحصول على المعدل الأولي. لإجراء فحص تثبيط UGI ، قم بتوقيت التفاعل لمدة 15 دقيقة. - قم بطرد الأنابيب مركزيا باستخدام خليط التفاعل لمدة 3-5 ثانية عند 3200 × جم عند درجة الحرارة المحيطة. ثم انقل التفاعل على الفور إلى 37 درجة مئوية.
- إنهاء التفاعل
- إعداد حلول من 0.25 M HCl و 0.23 M Tris قاعدة. في أنبوب اختبار 15 مل ، أضف 10 مل من محلول 1 mM EDTA و 20 mM Tris-HCl (الرقم الهيدروجيني 8.0 عند 25 درجة مئوية) لتقليد المخزن المؤقت لتفاعل UDG 1x. تحمض مع 1 مل من 0.25 M HCl وتحقق مع مقياس الرقم الهيدروجيني للتأكد من أن الرقم الهيدروجيني هو ~ 2 ± 0.5. قم بالتحييد باستخدام 1 مل من قاعدة Tris 0.23 M وتحقق باستخدام مقياس الأس الهيدروجيني للحصول على درجة حموضة نهائية تبلغ 6.5 ± 0.5.
ملاحظة: يعد استخدام شرائط اختبار الأس الهيدروجيني طريقة سريعة وسهلة لإعادة تأكيد مستويات الأس الهيدروجيني لمزيج الكاشف. - أضف 1 ميكرولتر من 0.25 M HCl لتحمض خليط تفاعل 10 ميكرولتر لتعطيل الإنزيم ووضعه على الجليد لمدة 6 دقائق. أضف 1 ميكرولتر من قاعدة 0.23 M Tris لتحييد منتجات الحمض النووي لتجنب كسر موقع AP عن طريق التعرض الطويل للحمض. أضف 13 ميكرولتر TE لزيادة حجم خليط المنتج لنقل رقاقة المصفوفة ثم ضعه على الثلج.
ملاحظة: منتج AP غير مستقر كيميائيا ويجب تحليله بواسطة MALDI-TOF MS في غضون 2 أيام. بعد التخزين المطول لأكثر من أسبوع ، يحدث تراكم جزء كبير من فواصل الخيوط بسبب تفاعلات التخلص من β / δ لمنتجات AP (الشكل 1D-G).
- إعداد حلول من 0.25 M HCl و 0.23 M Tris قاعدة. في أنبوب اختبار 15 مل ، أضف 10 مل من محلول 1 mM EDTA و 20 mM Tris-HCl (الرقم الهيدروجيني 8.0 عند 25 درجة مئوية) لتقليد المخزن المؤقت لتفاعل UDG 1x. تحمض مع 1 مل من 0.25 M HCl وتحقق مع مقياس الرقم الهيدروجيني للتأكد من أن الرقم الهيدروجيني هو ~ 2 ± 0.5. قم بالتحييد باستخدام 1 مل من قاعدة Tris 0.23 M وتحقق باستخدام مقياس الأس الهيدروجيني للحصول على درجة حموضة نهائية تبلغ 6.5 ± 0.5.
- انقل جميع منتجات تفاعل UDG سعة 25 ميكرولتر من أنابيب الطرد المركزي الدقيق إلى صفيحة ميكروتيتر 384 بئرا.
ملاحظة: التركيزات العالية من الكاتيونات ، مثل الصوديوم أو البوتاسيوم في المخازن المؤقتة ، تولد تداخلا في تحليل MALDI-TOF MS وبالتالي تتطلب تحلية المياه. نظرا لأن المخزن المؤقت لتفاعل E. coli UDG يحتوي على تركيزات منخفضة جدا من الكاتيونات ، فإن تحلية المياه ليست ضرورية. ومع ذلك ، قم بتعديل هذا البروتوكول لقياس تفاعلات غليكوزيلاز الحمض النووي الأخرى التي تحتوي على كاتيونات معدنية تتطلب تحلية المياه كما هو موضح سابقا35.
3. نقل منتجات تفاعل UDG إلى شريحة مصفوفة
- افتح باب موزع النانولتر (انظر جدول المواد) وقم بتحميل لوحة الميكروتيتر 384 بئر من الخطوة 2.7 على حامل اللوحة في سطح السفينة.
- أدخل صفيف رقاقة المصفوفة في موضع لوحة الكشافة المقابل. ضع لوحة الكشافة المحملة على سطح المعالجة الخاص بموزع النانولتر وأغلق الباب.
- المس زر التشغيل على شاشة النقل، وانتظر حتى يبدأ الجهاز في توزيع العينات من لوحة الميكروتيتر 384 بئر إلى شريحة المصفوفة.
- استخدم خيار علامة التبويب Vision لإظهار صورة الشريحة ووحدات تخزين التوزيع لكل بقعة أثناء التوزيع. تأكد من أن الحجم المرقط على الشريحة يتراوح بين 5-10 نانولتر.
4. إعداد معلمات الفحص على مطياف الكتلة
- استخدم البرنامج التطبيقي (انظر جدول المواد) لإعداد ملف .xlsx يحتوي على قيمة m/z المتوقعة للإشارة للاستيراد.
ملاحظة: الإعدادات في FILE I.xlsx (الجدول 2) هي أمثلة على إعدادات فحص UDG للركيزة G:U في القسم 2. - استخدم برنامج التطبيق لإنشاء فحص UDG جديد وتعريفه بالنقر بزر الماوس الأيمن فوق الخيار استيراد مجموعة مقايسة بتنسيق المصمم وتحديد ملف .xlsx من القائمة المنسدلة (على سبيل المثال، FILE I.xlsx من الخطوة 4.1).
- انقر بزر الماوس الأيمن فوق الزر Customer:Project:Plate وانقر فوق الجزء العلوي من شجرة الخيارات المنسدلة لإنشاء لوحة فحص جديدة. في مربع الحوار، اكتب اسم ملف (على سبيل المثال، CTT20210620 لرمز المختبر وتاريخ الفحص)، وفي القائمة المنسدلة نوع اللوحة ، حدد نوع اللوحة 384 بئرا واضغط على موافق. ابحث عن لوحة فارغة لتظهر على يسار الشاشة.
- انقر فوق خيار المقايسة ; حدد الفحص (على سبيل المثال، FILE I.xlsx) من القائمة المنسدلة.
- لتعيين المقايسة المحددة (على سبيل المثال، FILE I.xlsx) لكل موضع بقعة عينة على اللوحة، حرك المؤشر إلى كل موضع من مواضع اللوحة الفارغة، وانقر لتمييز البئر، وانقر بزر الماوس الأيمن لتحديد إضافة بلكس.
- استخدم كمبيوتر سطح مكتب أو كمبيوتر محمول لإعداد قائمة عمل بتنسيق .xlsx بدون رأس (على سبيل المثال، 0620.xlsx من الجدول 3) لجميع العينات الموجودة على الشريحة من الخطوة 2.7. انقر فوق الزر إضافة نموذج مشروع جديد ؛ حدد الملف (على سبيل المثال، 0620.xlsx) من القائمة المنسدلة لاستيراد قائمة العمل.
- ابحث عن جميع رموز نماذج الاختبار في قائمة العمل (على سبيل المثال، من 0620.xlsx) على يسار الشاشة. انقر فوق نموذج التعليمات البرمجية في قائمة العمل، وانقر بزر الماوس الأيمن فوق الموضع المقابل للوحة لربط الاختبارات بكل موضع.
5. تشغيل مطياف الكتلة
- استخدم البرنامج التطبيقي لربط مطياف الكتلة (انظر جدول المواد) بشريحة العينة (من القسم 3) المراد تحليلها.
- انقر على الإعداد الافتراضي. في مربع الحوار، اكتب اسم ملف من الخطوة 4.3 (على سبيل المثال، CTT20210620)؛ في اسم التجربة، اكتب معرف الشريحة في الباركود الخاص بالشريحة، واحفظ الإعدادات.
- ابدأ برنامج التحكم في مطياف الكتلة (انظر جدول المواد).
- اضغط على زر الإدخال/الخروج الخاص بمقياس الطيف الكتلي واترك سطح السفينة يتمدد. أخرج حامل الشريحة وأدخل شريحة العينة من الخطوة 3.4 في حامل الشريحة. ضع حامل الشريحة المحملة على السطح الممتد واضغط على زر الإدخال/الخروج لتدخل شريحة العينة إلى الجهاز.
- انقر نقرا مزدوجا فوق رمز الحصول على برنامج التطبيق. في النافذة الحصول على، انقر فوق علامة التبويب تشغيل تلقائي لبدء تشغيل الأداة والحصول على أطياف الكتلة من العينات الموجودة على الشريحة.
6. عرض أطياف الكتلة وتحليل البيانات
- قم بتشغيل برنامج تحليل البيانات (انظر جدول المواد).
- استعرض شجرة قاعدة البيانات وحدد معرف الشريحة من الخطوة 5.2. انقر لتسليط الضوء على هدف جيدا على الشريحة ، وانقر فوق رمز الطيف لإظهار الطيف الكتلي.
- انقر بزر الماوس الأيمن لاختيار مربع حوار التخصيص لاقتصاص نطاق معين من الطيف في نافذة جديدة. انقر فوق X-Axis لكتابة الحدود العليا والسفلية ل m/z، واضغط على موافق ( OK) لإظهار طيف النطاق المحدد، بما في ذلك إشارات الاهتمام.
ملاحظة: تتناسب كمية الحمض النووي مع شدة الذروة في كل وحدة قيمة m/z. - قم بقياس ارتفاع الذروة لقيم m/z للإشارات المقابلة للركيزة U والمنتج AP والقالب. انقر على الذروة واعرض ارتفاع الذروة في الزاوية العلوية اليسرى من الشاشة.
ملاحظة: يعد الطيف الذي يبلغ عرضه 1600 / 1200 وحدة بعدا معقولا للفحص على شاشة الكمبيوتر وكذلك لحفظ السجلات. - لحفظ الطيف لحفظ السجلات، انقر بزر الماوس الأيمن فوق تصدير وحدد نوع ملف JPEG في القائمة المنسدلة. انقر فوق الوجهة وتصفح القرص لتحديد جهاز التخزين في القائمة المنسدلة (على سبيل المثال ، قرص فلاش E:). اكتب اسم الملف (على سبيل المثال، 0620_1-2.jpg) وانقر فوق تصدير.
- إذا لزم الأمر، اطبع ملف JPEG تم تصديره وقم بقياس ارتفاع الذروة يدويا باستخدام مسطرة.
النتائج
القوالب والركائز
مع أخذ oligonucleotides الاصطناعية مع U في الوسط (U + 9) مقترنة بقالب G كمثال (الشكل 1A) ، يمكن استخدام تحكم فارغ في الكميات متساوية المولار من القالب والركيزة المحتوية على اليوراسيل لمراقبة جودة نقاء oligonucleotide الاصطناعي (الشكل 1B ؛ تتطابق الإشارات مع m / z المعين وضوضاء الخلفية المنخفضة). بالنسبة لتحليل بيانات MS ، تم قياس ارتفاعات الذروة (الشكل 2). ومن المتوقع أن يظل الحمض النووي لقالب 19 nt دون تغيير بعد التحلل المائي للجليكوزيلاز. ولذلك، يمكن أن تكون الإشارة بمثابة مرجع لقياس كمية المنتج AP (الشكل 1C).
حالة التفاعل وأطياف الكتلة
إن فحص جليكوزيلاز الحمض النووي هذا بسيط وسهل التنفيذ باستخدام أوليغونوكليوتيد غير مسمى للحصول على تفاعل قياسي للحصول على نتائج نظيفة وموثوقة (الشكل 1). يجب أن يغطي نطاق أطياف MS جميع الإشارات المتولدة من الركائز والقوالب ومنتجات التفاعل (الشكل 1B). أنتج الفرق البالغ 1 nt بين الركيزة والقالب المقابل ملف تعريف إشارة مفصولا جيدا لكل من القالب والركيزة (الشكل 1B). أظهر الاشعال متساوي المواء U + 9 و T1 كثافة ذروة مماثلة دون اختلافات كبيرة. أظهر الهضم المكثف ل UDG (0.5 وحدة لتفاعل 30 دقيقة) انقساما كاملا في اليوراسيل. كما تم فصل إشارة منتج AP بشكل جيد عن إشارة الركيزة المحتوية على اليوراسيل (الشكل 1C d + 9 AP-product m/z = 5447.6 مقابل الشكل 1B U + 9 الركيزة m / z = 5541.6). وقد قللت تقنية التأين MALDI الخفيفة نسبيا(36 ) المستخدمة في هذه الدراسة من الإشارات المرتبطة بفواصل الخيوط الناجمة عن تفاعل إزالة β في مواقع AP37، والتي لم تكن ذات دلالة في أطياف الكتلة. بشكل عام ، خلفية التفاعل نظيفة للغاية دون ضوضاء ملحوظة (الشكل 1C).
وفي ظل ظروف متساوية المولية، كانت كثافة الإشارة النسبية لمنتج AP مماثلة لكثافة إشارة الركيزة U باستخدام قالب T1 كمرجع (الشكل 1B، U+9/T1 مقابل d+9/T1). وبالتالي ، يعتمد حساب نشاط UDG على المدخلات الدقيقة للركيزة المحتوية على U (50 pmol أو 20 pmol) وفقا ل Eq (1).
نشاط UDG = (إشارة المنتج AP) / (إشارة الركيزة U + إشارة المنتج AP) × [U] (1)
المعلمات الحركية UDG التي يحددها فحص MALDI-TOF MS
وكما هو مبين في الشكل 2، أظهرت تفاعلات UDG من 0.01 وحدة إلى 0.1 وحدة اعتمادا على الجرعة والوقت على حد سواء. تم استخدام تركيز 3.2 pM (0.1 وحدة لكل تفاعل 100 ميكرولتر) لتحديد المعلمات الحركية ، Km و kcat ، لركيزة G:U (الجدول 1). تمت إزالة أليكوتس تفاعل UDG وإخمادها لمدة 30 ثانية و 60 ثانية. تم الحصول على البيانات الحركية في ظل ظروف عندما تم هضم الركيزة المحتوية على اليوراسيل بنسبة أقل من 50٪ ، وخضعت خمسة تركيزات ركيزة تتراوح من 10 إلى 200 نانومتر للتحليل. أظهرت دورة وقت الحالة المستقرة الممتازة خطية ممتازة لتحليل المعدل. ويرد مثال على مخطط معدل التفاعل في الشكل 3A، حيث يتم تحويل شدة إشارة MS النسبية للناتج والركيزة إلى تركيز (nM). يتم تقديم معدل تفاعل UDG (v) على أنه نانومتر من موقع AP المنتج في الثانية. تم حساب Km و Vmax من مؤامرة Lineweaver-Burk (الشكل 3B). وهكذا تم تحديد المعلمات الحركية UDG المشتقة من فحص MALDI-TOF MS لتكون Km = 50 nM ، Vmax = 0.98 nM S-1 ، و Kcat = 9.31 S-1. القيم قابلة للمقارنة مع نتائج اختبارات إطلاق 3H-uracil السابقة حيث Km = 40 nM و Kcat = 13.3 s-138.
خضع الدوبلكس G:U+9 لفحوصات حساسية UDG. تم رسم الوحدة التي تم قياسها بواسطة اختبار MALDI-TOF MS مقابل الوحدة المحددة للشركة المصنعة بواسطة طريقة تقليدية لإطلاق 3H-uracil38. وكما هو مبين في الشكل 3C، كانت الوحدة المقاسة MALDI-TOF MS-متناسبة مع الوحدة المحددة من 0.001 وحدة إلى 0.02 وحدة مع معادلة الارتباط y = 0.933x + 0.0003 ومعامل التحديد R2 = 0.9974. حد الكشف هو 0.001 وحدة حيث أن معامل التباين = 9.2٪ ، ~ 5 أضعاف نسبة الإشارة إلى الضوضاء. وبالتالي ، فإن اختبار MALDI-TOF MS هذا يوفر حساسية كافية حيث يتم استخدام UDG في الغالب على مستوى الوحدة39.
خصوصية الركيزة من UDG
واحدة من السمات المميزة لفحص UDG MALDI-TOF MS هذا هي أنه خال من الملصقات ، مما يجعل تنوعا عاليا لتصميم الركيزة. هذه الميزة مفيدة جدا لتحليل خصوصية الركيزة ل UDG. وكما هو مبين في الجدول 1، يمكن إدخال اليوراسيل في أي مكان بالقرب من الطرف 5 أو 3 من الحمض النووي الأحادي أو المزدوج لفحص الخصوصية. من أجل خصوصية الركيزة ، من المعروف جيدا أن UDG نشط للغاية في إزالة اليوراسيل من DNA38 أحادي العالق. في الواقع ، كما هو موضح في الجدول 1 ، تم تقليل استئصال اليوراسيل من الركيزة المفردة (ssU) بمقدار 3.7 أضعاف عند تلدين حبلا من الحمض النووي التكميلي ، مما شكل G:U دوبلكس. بالنسبة لدوبلكس A:U الشائع الاستخدام6,7,8 ، تم تخفيض معدل التفاعل بمقدار 10 أضعاف تقريبا بالنسبة إلى ssU. لم يتصرف UDG على U في محطة الحمض النووي (ركائز الجدول 1 من G:U+1 و G:U-1 و G:U-2) ، وهو ما يتفق مع الدراسات السابقة40,41. ومن المثير للاهتمام أن U في المركزين 2 و 3 من المحطة 5 'أظهر معدل تحفيز UDG أعلى من U في الوسط بمقدار ضعفين و 1.5 ضعف ، على التوالي (الجدول 1 ، G : U + 2 و G : U + 3 مقابل G : U). UDG اقتطع U 3-nt من النهاية 3 مع نشاط أقل بنسبة 8 ٪ من U في المركز (الجدول 1 ، G:U-3 مقابل G:U).
تثبيط مثبط اليوراسيل غليكوزيلاز لتفاعل UDG
مثبط اليوراسيل غليكوزيلاز (UGI) هو بروتين بكتيري ، والذي يمنع E. coli UDG عن طريق ربط البروتين القابل للانعكاس مع قياس stoichiometry من 1: 142. ويبين الشكل 4 تثبيط نشاط UDG بواسطة UGI. في وجود 0.05 وحدة (100 pM) من UGI ، تم تثبيط نشاط 0.05 وحدة من UDG (8 pM) إلى مستوى لا يمكن اكتشافه. كان IC50 7.6 مساء. وبالتالي ، يمكن تعديل فحص UDG MALDI-TOF MS بسهولة إلى فحص فحص جماعي لاكتشاف مثبطات جليكوزيلاز الحمض النووي الأخرى.
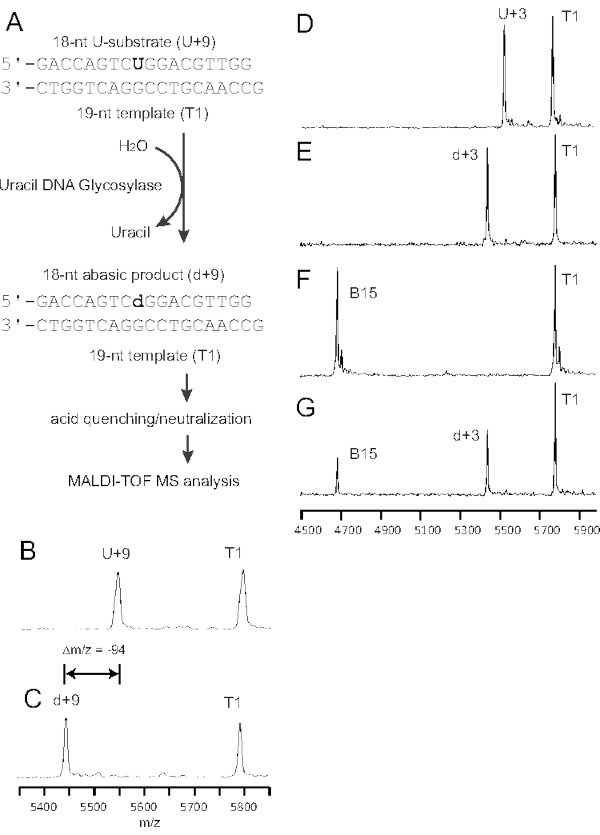
الشكل 1: نظام نموذجي لفحص جليكوزيلاز الحمض النووي. (A) تم صلب حبلا للآفة يحتوي على يوريدين واحد (U + 9) إلى قالب (T1) ، مما شكل عدم تطابق G:U (غامق). يكتشف اليوراسيل الحمض النووي غليكوزيلاز ويزيل اليوراسيل ، ويشكل موقع AP (d). عند التعرض ل MALDI-TOF MS ، يمكن حل الفرق في قيم M / Z بين الحمض النووي المحتوي على U ومنتجات AP كما هو موضح في B. (ب) تم اختبار حمض نووي 18 نانوت يحتوي على يوريدين واحد (U+9) صلب على قالب 19 نانوت (T1) (الجدول 1) كإنزيم فارغ من 50 بمول من الركيزة في 40 ميكرولتر من المخزن المؤقت للتفاعل وخضع لتحليل التصلب المتعدد. (ج) هضم إنزيم شبه كامل ل 50 بمول من الركيزة في تفاعل 10 ميكرولتر باستخدام 0.5 وحدة من UDG عند 37 درجة مئوية لمدة 30 دقيقة (D) خضع الحمض النووي 18 nt الذي يحتوي على يوريدين واحد (U + 3) ملدن إلى إنزيم T1 فارغ من ركيزة 50 pmol في المخزن المؤقت لتفاعل 40 ميكرولتر لتحليل MS. (ه) هضم إنزيم شبه كامل من 50 بمول من الركيزة U + 3 في تفاعل 10 ميكرولتر باستخدام 0.5 وحدة من UDG عند 37 درجة مئوية لمدة 30 دقيقة لإنتاج d + 3 ويخضع لتحليل MS في غضون 30 ساعة. (F) كانت حالة التفاعل هي نفسها كما في E باستثناء أن المنتج d + 3 كان في 0.1 M NaOH عند 95 درجة مئوية لمدة 30 دقيقة لتشغيل تفاعل التخلص من بيتا ينتج منتج مجزأ B15 وتخضع لتحليل التصلب المتعدد. (ز) كانت حالة التفاعل هي نفسها كما في الفئة هاء باستثناء أن المنتج d+3 كان مخزنا عند -20 درجة مئوية لأكثر من 7 أيام؛ جزء صغير من d+3 تم تحويله إلى منتجات مجزأة B15. تم تعديل هذا الرقم من 43. الاختصارات: nt = النيوكليوتيدات; MS = قياس الطيف الكتلي; MALDI-TOF MS = MS الارتزاز بالليزر بمساعدة المصفوفة / التأين وقت الرحلة MS ؛ AP = apurinic / apyrimidinic; UDG = اليوراسيل الحمض النووي غليكوزيلاز; T1 = 19 nt قالب يحتوي على G; U + 9 = 18 nt U تحتوي على ركيزة ؛ d+9 = 18 nt AP المنتج المحتوي على الموقع؛ U + 3 = 18 nt U تحتوي على ركيزة ؛ d+3 = 18 nt AP المنتج المحتوي على الموقع؛ B15 = 15 nt بيتا القضاء على المنتج المجزأ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
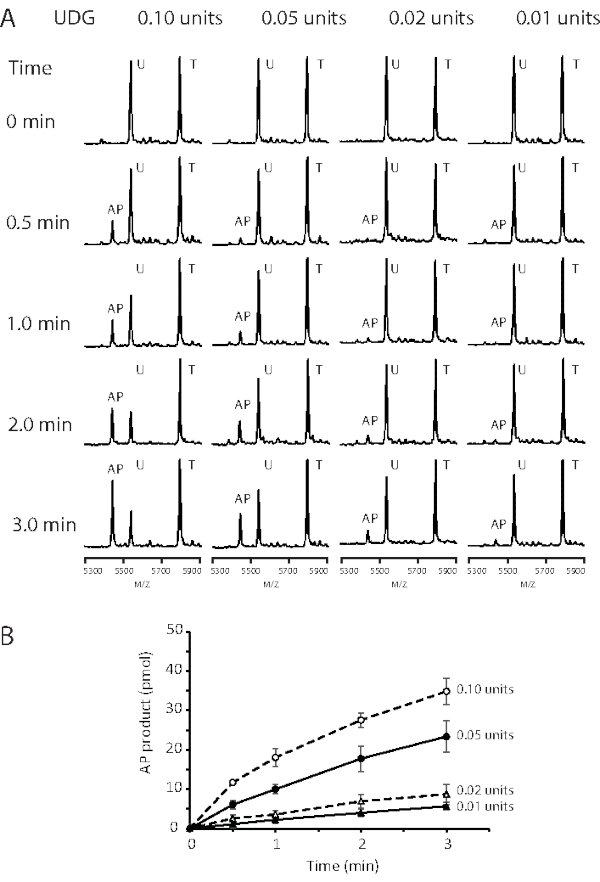
الشكل 2: تحليل الدورة الزمنية لنشاط UDG بتركيزات إنزيم مختلفة. تم احتضان الحمض النووي للركيزة ، 50 pmol ، الذي يحتوي على آفة G: U مع 0.01 و 0.02 و 0.05 و 0.1 وحدة من UDG عند 37 درجة مئوية. تم أخذ Aliquots (10 ميكرولتر) من خليط التفاعل في 0 و 0.5 و 1 و 2 و 3 دقيقة وتم إخمادها بحجم متساو من الفينول / الكلوروفورم. (أ) أطياف كتلة MALDI-TOF توضح اعتماد تركيز معالجة ركائز G:U بواسطة UDG. (ب) تم رسم كمية المنتج كدالة للوقت. UDG: 0.01 (مثلثات مغلقة مع خط صلب) ، 0.02 (مثلث مفتوح مع خط متقطع) ، 0.05 (دائرة مغلقة مع خط صلب) ، و 0.1 وحدة (دوائر مفتوحة مع خط صلب). البيانات هي متوسطات ثلاثة تحديدات مستقلة ، وتمثل أشرطة الخطأ 1 S.D. تم تعديل هذا الرقم من 43. الاختصارات: nt = النيوكليوتيدات; MALDI-TOF = الارتزاز بالليزر بمساعدة المصفوفة / التأين وقت الطيران ؛ AP = apurinic / apyrimidinic; UDG = اليوراسيل الحمض النووي غليكوزيلاز; T = 19 nt قالب يحتوي على G; U = 18 nt الركيزة المحتوية على U ؛ AP = 18 nt AP المنتج الذي يحتوي على الموقع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
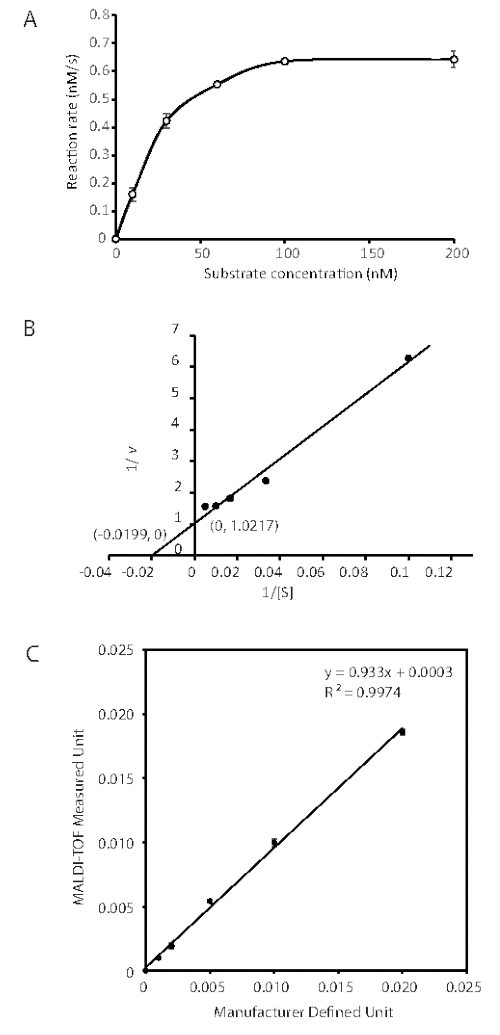
الشكل 3: تحديد المعلمات الحركية ل UDG باستخدام تحليل MALDI-TOF. يرسم منحنى Michaelis-Menten و Lineweaver-Burk لتحديد Km و kcat لاستئصال Uracil المحفز بإنزيم UDG من الحمض النووي. تم إجراء فحص الحمض النووي غليكوزيلاز MALDI-TOF MS باستخدام 0.1 وحدة من UDG وتركيزات مختلفة (10 ، 30 ، 60 ، 100 ، 200 نانومتر) من الركائز في تفاعل 100 ميكرولتر لمدة 30 ثانية و 60 ثانية. (A) منحنى Michaelis-Menten المتولد من ثلاث تجارب مستقلة. تمثل أشرطة الخطأ 1 SD. (B) مؤامرة Lineweaver-Burk للفحص ؛ تسمح الاعتراضات المشار إليها بحساب Km و Vmax. (ج) فحص UDG بواسطة تحليل MALDI-TOF MS مقارنة بالوحدة المعينة من قبل الشركة المصنعة. تم قياس نشاط الإنزيم عن طريق إزالة اليوراسيل لتشكيل موقع AP في تفاعل 10 ميكرولتر يحتوي على 50 pmol (0.56 μg) من G: U داخل 18/19 nt الحمض النووي المزدوج لمدة 30 دقيقة عند 37 درجة مئوية. تم تخفيف UDG مع المخزن المؤقت [50٪ الجلسرين ، 20 mM Tris-HCl (الرقم الهيدروجيني 7.5) ، 30 mM NaCl ، 0.5 mM EDTA ، 1 mM dithiothreitol] على الجليد. تم تعريف الوحدة على أنها كمية الإنزيم التي حفزت إطلاق 60 بمول من اليوراسيل في الدقيقة. تظهر أشرطة الخطأ الانحراف المعياري لست تجارب. تم تعديل هذا الرقم من 43. الاختصارات: nt = النيوكليوتيدات; MALDI-TOF = الارتزاز بالليزر بمساعدة المصفوفة / التأين وقت الطيران ؛ UDG = اليوراسيل الحمض النووي غليكوزيلاز; AP = apurinic / apyrimidinic; V, سرعة التفاعل nM/s. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
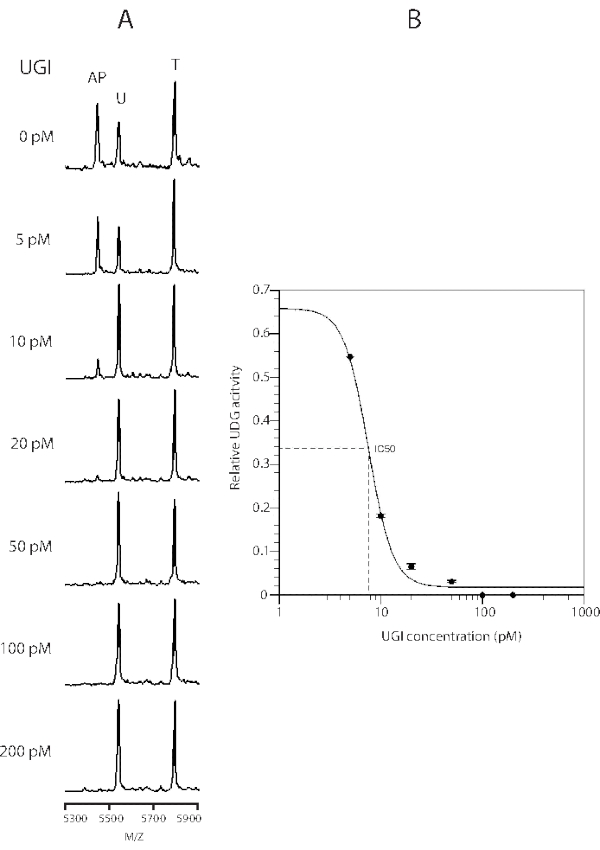
الشكل 4: منحنى تثبيط إنزيم UDG بإضافة UGI. تم تحديد منحنى التثبيط باستخدام تفاعلات 20 ميكرولتر مع 0.05 وحدة من UDG (8 pM) و 50 pmol من الركيزة لمدة 15 دقيقة في وجود UGI من 0.001 وحدة (5 pM) إلى 0.1 وحدة (200 pM). البيانات هي متوسطات ثلاثة تحديدات مستقلة ، وتمثل أشرطة الخطأ 1 S.D. تتناسب البيانات مع آلة حاسبة IC50 عبر الإنترنت (انظر جدول المواد). تم تعديل هذا الرقم من 43. الاختصارات: UDG = Uracil-DNA glycosylase; UGI = مثبط اليوراسيل غليكوزيلاز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| ركائز الحمض النووي | قلة النوكليوتيدات | تسلسل الحمض النووي(ب) | المعدل الأولي(ج) | ك القط | |
| (بمول/ثانية) | (ق-1) | ||||
| إس إس يو+9 | يو+9 | 5'-GACCAGTCUGGACGTTGG-3' | 0.560 ± 0.098 | 35 | |
| إس إس يو+3 | يو+3 | 5'-GAUCAGTCCGGACGTTGG-3' | 0.756 ± 0.083 | 47.3 | |
| إس إس يو-3 | يو-3 | 5'-GACCAGTCCGGACGTUGG-3' | 0.448 ± 0.087 | 28 | |
| G:U | تي 1 | 3'-CTGGTCAGGCCTGCAACCG-5' | 0.149 ± 0.046 | 9.31 | |
| يو+9 | 5'-GACCAGTCUGGACGTTGG-3' | ||||
| ج: يو | T2 | 3'-CTGGTCAGACCTGCAACCG-5' | 0.053 ± 0.018 | 3.31 | |
| يو+9 | 5'-GACCAGTCUGGACGTTGG-3' | ||||
| G: U5 '+3 | تي 1 | 3'-CTGGTCAGGCCTGCAACCG-5' | 0.256 ± 0.044 | 16 | |
| يو+3 | 5'-GAUCAGTCCGGACGTTGG-3' | ||||
| G: U5 '+2 | تي 3 | 3'-CGGGTCAGGCCTGCAACCG-5' | 0.567 ± 0.016 | 35.4 | |
| يو+2 | 5'-GUCCAGTCCGGACGTTGG-3' | ||||
| G: U5 '+1 | تي 4 | 3'-GTGGTCAGGCCTGCAACCG-5' | NDd | ND | |
| يو+1 | 5'-UACCAGTCCGGACGTTGG-3' | ||||
| G: U3'-3 | تي 5 | 3'-CTGGTCAGGCCTGCAGCCG-5' | 0.138 ± 0.015 | 8.63 | |
| يو-3 | 5'-GACCAGTCCGGACGTUGG-3' | ||||
| G: U3'-2 | تي 6 | 3'-CTGGTCAGGCCTGCAAGC-5' | ND | ND | |
| يو-2 | 5'-GACCAGTCCGGACGTTUG-3' | ||||
| G: U3 '-1 | تي 7 | 3'-CTGGTCAGGCCTGCAACGG-5' | ND | ND | |
| يو-1 | 5'-GACCAGTCCGGACGTTGU-3' | ||||
الجدول 1: تركيبات الركيزة وخصائص UDG. يوضح هذا الجدول الحمض النووي المحتوي على U 18 nt الذي حددته U±N. يشير "+" إلى حساب موضع اليوراسيل من المحطة 5 ، ويشير "-" إلى حساب موضع اليوراسيل من المحطة 3. على سبيل المثال ، U + 9 هو المركز التاسع من المحطة 5 ، U-3 هو المركز الثالث من المحطة 3. سيتم إقران القالب التكميلي 19 nt من T1 إلى T7 مع الحمض النووي الذي يحتوي على U لتشكيل عدم تطابق G:U أو A:U كما هو موضح. قواعد Uracil بالخط العريض. كانت التفاعلات تستخدم 50 pmol من ركائز U ، 0.05 وحدة من UDG ، في 10 ميكرولتر كما هو موضح في قسم البروتوكول 2. تم تعديل هذا الجدول من 43. الاختصارات: UDG = جليكوزيلاز الحمض النووي اليوراسيل. nt = النيوكليوتيدات; ND ، لا يمكن اكتشافها.
| 2nd-PCRP | 1st-PCRP | AMP_LEN | UP_CONF | MP_CONF | تي إم | بي سي جي سي | بوارن | UEP_DIR | UEP_MASS | UEP_SEQ | مكالمة EXT1_ | كتلة EXT1_ |
| غير متوفر | غير متوفر | غير متوفر | غير متوفر | غير متوفر | غير متوفر | غير متوفر | F | 5789.8 | GCCAACGTCCGGACTGGTC | |||
| غير متوفر | غير متوفر | غير متوفر | غير متوفر | غير متوفر | غير متوفر | غير متوفر | F | 5541.6 | GACCAGTCUGGACGTTGG | |||
الجدول 2: الملف الأول.xlsx الملف. تم استخدام الإعدادات للشكل 1B و C والشكل 2A. 0 دقيقة إدخالات. تم تصميم نظام MALDI-TOF MS المستخدم في هذه الدراسة خصيصا لتحليل تعدد أشكال النوكليوتيدات المفردة عن طريق امتداد نيوكليوتيد واحد للتمهيدي الممتد إلى منطقة تباين تسلسل الجينات المضخم. بالنسبة لفحص UDG ، تم استخدام ستة حقول فقط عند إعداد مجموعة الفحص FILE I. الاختصارات: WELL = رقم البئر المخصص للفحص ؛ TERM = مزيج الإنهاء; SNP_ID = اسم تسلسل الإدخال لتعدد أشكال النيوكليوتيدات المفردة ؛ 2nd-PCRP = التمهيدي أمبليكون إلى الأمام. 1st-PCRP = عكس أمبليكون التمهيدي; AMP_LEN = طول الأمبليكون ؛ UP_CONF = درجة تضخيم uniplex ؛ MP_CONF = درجة تضخيم الإرسال المتعدد ؛ Tm = درجة حرارة الانصهار ؛ PcGC = النسبة المئوية لمحتوى GC ؛ PWARN = رموز تحذير تصميم المقايسة ؛ UEP_DIR = اتجاه تمديد التمهيدي ؛ UEP_MASS = كتلة تمهيدية غير ممتدة ؛ UEP_SEQ = تسلسل تمهيدي غير ممتد ؛ EXT1_CALL = الاسم المعطى لذروة كتلة التحليل 1 ؛ EXT1_MASS = كتلة التحليل 1.
| 0620_1-2 |
| 0620_1-3 |
| 0620_1-4 |
| 0620_1-5 |
| 0620_1-6 |
| 0620_1-7 |
| 0620_1-8 |
الجدول 3: 0620.xlsx ملف. تم استخدام هذه الإعدادات لتفاعلات تثبيط UGI في الشكل 4A. اختصار: UGI = مثبط اليوراسيل غليكوزيلاز.
Discussion
توفر هذه الورقة إجراء مفصلا لاستخدام طريقة فحص UDG MALDI-TOF MS للكشف مباشرة عن منتجات الحمض النووي المحتوية على AP. المزايا الرئيسية لهذه الطريقة هي أن الركائز التي تحتوي على اليوراسيل خالية من الملصقات ، وقابلة للتطوير ، وسهلة العمل معها ، وتوفر مرونة أكبر في تصميم الركيزة.
يتيح استخراج الفينول / الكلوروفورم الموصى به من قبل مورد UDG تعطيل الإنزيم لمنع تدهور الحمض النووي للمنتج. ومع ذلك ، فإن بروتوكول استخراج الفينول ينطوي على فصل مرحلي شاق للمواد الكيميائية الخطرة. طريقة بديلة لإنهاء الحمض باستخدام HCl لخفض درجة الحموضة التفاعل إلى 2 ± 0.5 أيضا تعطيل UDG بشكل فعال. التحييد اللاحق مع قاعدة تريس يمكن أن يمنع تلف الحمض النووي. عندما خضع منتج AP لتحليل MS في غضون 30 ساعة ، لم تكن هناك علامات على فقدان القاعدة أو تعديلها في أطياف الكتلة (الشكل 1E). تم تزويد المخزن المؤقت Tris في ردود الفعل مع UDG التجاري. ومع ذلك ، يمكن للعديد من الأمينات ، بما في ذلك Tris ، شق مواقع AP عن طريق التخلص من بيتا ، وإن كان ذلك بتركيزات عالية من الكاشف44. يمكن النظر في بعض البدائل ، مثل HEPES و الفوسفات العازل ، لتجنب خطر انقسام موقع AP عن طريق القضاء على بيتا.
كطريقة مرجعية محتملة ل UDG ، يوصى باستخدام ازدواج الركيزة المتمركزة G:U (الجدول 1 ، T1 / U + 9) كركيزة قياسية للأسباب التالية: 1. بالنسبة للأهمية الفسيولوجية ، فإن G:U متفوقة على A:U حيث يؤدي إزالة السيتوزين في أزواج G:C إلى آفات G:U. 2. في حين أن E. coli UDG يوضح خصوصية أعلى لتحلل U من الحمض النووي الأحادي الخيط ، فإن إصلاح آفة U في الحمض النووي الأحادي الذي تقطعت به السبل أمر غير شائع. 3. بالنسبة لجميع ركيزة G: U التي تم اختبارها ، أظهر G: U + 2 و G: U + 3 معدلات تفاعل أعلى من G: U + 9. ومع ذلك ، فإن آفة إزالة الحمض النووي المجاورة لكسر الخيط غير شائعة. لمحاكاة الآفات الأصلية ، سيكون وضع G: U في وسط ازدواج الحمض النووي أكثر ملاءمة.
ومن المثير للاهتمام أن طريقة MALDI-TOF MS ولدت معلمات حركية UDG ، وكانت وحدات الإنزيم لتفاعل G:U (الشكل 3A-C) مشابهة جدا للنتائج المشتقة تقليديا باستخدام 3H-uracil38. ومع ذلك ، فإن الركيزة المفردة G:U في هذه الدراسة تختلف اختلافا كبيرا عن الحمض النووي للبكتيريا PBS1 الموصوفة سابقا مع A:U متعددة من أخطاء تخليق الحمض النووي38. علاوة على ذلك ، أظهر UDG نشاطا أعلى 3 مرات مع G: U مقارنة بالركيزة A: U (الجدول 1 ، Km و Kcat من G: U مقابل A: U). يمكن أن تعزى هذه النتيجة المتناقضة على ما يبدو إلى تسلسل الحمض النووي للركيزة PBS1 التي تحتوي على 36٪ من U في شكل آفات A: U متعددة45 مقارنة ب 3٪ فقط من U في G: U الركيزة (الجدول 1). وفي الوقت نفسه ، UDG هو إنزيم "عملي" للغاية ، أي أن حدثا واحدا لربط البروتين والحمض النووي يثير انقسامات يوراسيل متعددة12. إن العثور على علاقة فردية شبه مثالية بين هاتين الطريقتين UDG يجعل طريقة MS هذه خيارا جذابا بدلا من فحص النظائر المشعة التقليدية.
هذا النهج قابل للتطوير بسهولة. تم إجراء جميع تفاعلات UDG في هذه الدراسة يدويا باستخدام الماصات الدقيقة وأنابيب الطرد المركزي الدقيقة ، مع إجراء حوالي 30 اختبارا في يوم معين. وهكذا، استخدم أقل من عشر سعة صفيف رقاقة شكل لوحة 384 بئرا لنظام MALDI-TOF MS (انظر جدول المواد) الموصوف في الأقسام 3-5. وعلى النقيض من ذلك، فإن تكييف نظام السحب الآلي لصفيحة صغيرة من 384 بئرا يمكن أن يزيد بسهولة من الناتج اليومي لهذا النهج باستخدام طريقة إنهاء الحمض. وبالتالي ، فإن تفاعلات 300 UDG ستستغرق ~ 1 ساعة. يمكن لنظام MALDI-TOF MS (انظر جدول المواد) إنتاج بيانات أطياف الكتلة لما يصل إلى 300 تفاعل في 1 ساعة. وبالتالي ، فإن العملية المبسطة تتطلب 2 ساعة لإكمال 300 فحص UDG MALDI-TOF MS.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر المرفق الأساسي المتكامل لعلم الجينوم الوظيفي التابع للمجلس الوطني لعلم الجينوم الوظيفي (تايبيه، تايوان) ومختبر الجينوم الدوائي NRPB (تايبيه، تايوان) على دعمهما التقني. تم دعم هذا العمل من قبل وزارة العلوم والتكنولوجيا ، تايوان ، R.O.C. [رقم المنحة MOST109-2314-B-002 -186 إلى K.-Y.S. ، ومعظمها 107-2320-B-002-016-MY3 إلى S.-Y.C. ، ومعظمها 110-2320-B-002-043 إلى W.-h.F.]. H.-L.C. حاصل على زمالة الدكتوراه من جامعة تايوان الوطنية. تمويل رسوم الوصول المفتوح: وزارة العلوم والتكنولوجيا، R.O.C.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Amino-2-hydroxymethyl-propane-1,3-diol (Tris base) | J.T baker | Protocol 1,2 | |
| Autoclaved deionized water | MILLIPORE | Protocol 1,2 | |
| EDTA | J.T Baker | Protocol 1,2 | |
| Gloves | AQUAGLOVE | Protocol 1,2,3 | |
| Hydrochloric acid (HCl) | SIGMA | Protocol 1,2 | |
| Ice bucket | Taiwan.Inc | Protocol 2 | |
| Low retention pipette tips(0.5-10 µL) | extra gene | Protocol 1,2 | |
| Low retention pipette tips(1,250 µL) | national scientific supply co, Inc. | Protocol 1,2 | |
| Low retention pipette tips(200 µL) | national scientific supply co, Inc. | Protocol 1,2 | |
| MassARRAY | Agena Bioscience, CA | Protocol 4, 5 Mass spectrometry control programs include Typer Chip Linker, SpectroACQUIRE, and Start RT Process. | |
| MassARRAY Nanodispenser | AAT Bioquest, Inc. | RS1000 | Protocol 3 |
| Microcentrifuge | Kubota | Protocol 2 | |
| Microcentrifuge | Clubio | Protocol 2 | |
| Microcentrifuge tube (1.5 mL) | National scientific supply co, Inc. | Protocol 2 | |
| Microcentrifuge tube rack | Taiwan.Inc | Protocol 1,2 | |
| Micropipette (P1000) | Gilson | Protocol 1,2 | |
| Micropipette (P2) | Gilson | Protocol 1,2 | |
| Micropipette (P10) | Gilson | Protocol 1,2 | |
| Micropipette (P100) | Gilson | Protocol 1,2 | |
| Micropipette (P200) | Gilson | Protocol 1,2 | |
| Micropipette (SL2) | Rainin | Protocol 1,2 | |
| Oligonucleotides | Integrated DNA Technologies (Singapore) | Protocol 1,2 | |
| Quest Graph IC50 Calculator (v.1) | AAT Bioquest, Inc. | Fig. 4 https://www.aatbio.com/tools/ic50-calculator-v1 | |
| Sodium hydroxide (NaOH) | WAKO | Protocol 2 | |
| SpectroCHIP array | Agena Bioscience, CA | #01509 | Protocol 3, 5 |
| Timer | Taiwan.Inc | Protocol 2 | |
| Typer 4.0 software | Agena Bioscience, CA | #10145 | Protocol 6 Typer 4.0 consists four programs including Assay Designer, Assay Editor, Plate Editor, and Typer Analyzer. |
| UDG Reaction Buffer (10x) | New England Biolabs, MA | B0280S | Protocol 2 |
| Uracil Glycosylase Inhibitor | New England Biolabs, MA | M0281S | Protocol 2 |
| Uracil-DNA Glycosylase | New England Biolabs, MA | M0280L | Protocol 2 |
| UV-VISBLE spectrophotometer UV-1601 | SHIMADZU | Protocol 1 | |
| Water bath | ZETA ZC-4000 (Taiwan.Inc) | Protocol 2 |
References
- Frederico, L. A., Kunkel, T. A., Shaw, B. R. A sensitive genetic assay for the detection of cytosine deamination: determination of rate constants and the activation energy. Biochemistry. 29 (10), 2532-2537 (1990).
- Kavli, B., Otterlei, M., Slupphaug, G., Krokan, H. E. Uracil in DNA-General mutagen, but normal intermediate in acquired immunity. DNA Repair. 6 (4), 505-516 (2007).
- Duncan, B. K., Miller, J. H. Mutagenic deamination of cytosine residues in DNA. Nature. 287 (5782), 560-561 (1980).
- Gros, L., Saparbaev, M. K., Laval, J. Enzymology of the repair of free radicals-induced DNA damage. Oncogene. 21 (58), 8905-8925 (2002).
- Robertson, A. B., Klungland, A., Rognes, T., Leiros, I. Base excision repair: The long and short of it. Cellular and Molecular Life Sciences. 66 (6), 981-993 (2009).
- Lindahl, T. An N-glycosidase from Escherichia coli that releases free uracil from DNA containing deaminated cytosine residues. Proceedings of The National Academy of Sciences of the United States of America. 71 (9), 3649-3653 (1974).
- Caradonna, S. J., Cheng, Y. C. Uracil DNA-glycosylase. Purification and properties of this enzyme isolated from blast cells of acute myelocytic leukemia patients. Journal of Biological Chemistry. 255 (6), 2293-2300 (1980).
- Krokan, H., Urs Wittwer, C. Uracil DNA-glycosylase from HeLa cells: general properties, substrate specificity and effect of uracil analogs. Nucleic Acids Research. 9 (11), 2599-2614 (1981).
- Tchou, J., et al. 8-oxoguanine (8-hydroxyguanine) DNA glycosylase and its substrate specificity. Proceedings of The National Academy of Sciences of the United States of America. 88 (11), 4690-4694 (1991).
- Knævelsrud, I., et al. Excision of uracil from DNA by the hyperthermophilic Afung protein is dependent on the opposite base and stimulated by heat-induced transition to a more open structure. Mutation Research-DNA Repair. 487 (3-4), 173-190 (2001).
- Minko, I. G., et al. Recognition of DNA adducts by edited and unedited forms of DNA glycosylase NEIL1. DNA Repair. 85, 102741 (2020).
- Bennett, S. E., Sanderson, R. J., Mosbaugh, D. W. Processivity of Escherichia coli and rat liver mitochondrial uracil-DNA glycosylase is affected by NaCl concentration. Biochemistry. 34 (18), 6109-6119 (1995).
- Xia, L., O'Connor, T. R. DNA glycosylase activity assay based on streptavidin paramagnetic bead substrate capture. Analytical Biochemistry. 298 (2), 322-326 (2001).
- Kreklau, E. L., et al. A novel fluorometric oligonucleotide assay to measure O(6)-methylguanine DNA methyltransferase, methylpurine DNA glycosylase, 8-oxoguanine DNA glycosylase and abasic endonuclease activities: DNA repair status in human breast carcinoma cells overexpressing methylpurine DNA glycosylase. Nucleic Acids Research. 29 (12), 2558-2566 (2001).
- Liu, B., et al. Real-time monitoring of uracil removal by uracil-DNA glycosylase using fluorescent resonance energy transfer probes. Analytical Biochemistry. 366 (2), 237-243 (2007).
- Zhang, L., Zhao, J., Jiang, J., Yu, R. A target-activated autocatalytic DNAzyme amplification strategy for the assay of base excision repair enzyme activity. Chemical Communications. 48 (70), 8820-8822 (2012).
- Zhou, D. M., et al. Graphene oxide-hairpin probe nanocomposite as a homogeneous assay platform for DNA base excision repair screening. Biosensors and Bioelectronics. 41, 359-365 (2013).
- Wang, X., Hou, T., Lu, T., Li, F. Autonomous exonuclease iii-assisted isothermal cycling signal amplification: A facile and highly sensitive fluorescence DNA glycosylase activity assay. Analytical Chemistry. 86 (19), 9626-9631 (2014).
- Wu, Y., Wang, L., Zhu, J., Jiang, W. A DNA machine-based fluorescence amplification strategy for sensitive detection of uracil-DNA glycosylase activity. Biosensors and Bioelectronics. 68, 654-659 (2015).
- Xi, Q., Li, J. J., Du, W. F., Yu, R. Q., Jiang, J. H. A highly sensitive strategy for base excision repair enzyme activity detection based on graphene oxide mediated fluorescence quenching and hybridization chain reaction. Analyst. 141 (1), 96-99 (2016).
- Liu, X., et al. A novel electrochemical biosensor for label-free detection of uracil DNA glycosylase activity based on enzyme-catalyzed removal of uracil bases inducing strand release. Electrochimica Acta. 113, 514-518 (2013).
- McWilliams, M. A., Anka, F. H., Balkus, K. J., Slinker, J. D. Sensitive and selective real-time electrochemical monitoring of DNA repair. Biosensors and Bioelectronics. 54, 541-546 (2014).
- Jiao, F., et al. A novel and label-free biosensors for uracil-DNA glycosylase activity based on the electrochemical oxidation of guanine bases at the graphene modified electrode. Talanta. 147, 98-102 (2016).
- Liu, X., et al. Label-free colorimetric assay for base excision repair enzyme activity based on nicking enzyme assisted signal amplification. Biosensors and Bioelectronics. 54, 598-602 (2014).
- Nie, H., Wang, W., Li, W., Nie, Z., Yao, S. A colorimetric and smartphone readable method for uracil-DNA glycosylase detection based on the target-triggered formation of G-quadruplex. Analyst. 140 (8), 2771-2777 (2015).
- Du, Y. C., Jiang, H. X., Huo, Y. F., Han, G. M., Kong, D. M. Optimization of strand displacement amplification-sensitized G-quadruplex DNAzyme-based sensing system and its application in activity detection of uracil-DNA glycosylase. Biosensors and Bioelectronics. 77, 971-977 (2016).
- Haff, L. A., Smirnov, I. P. Single-nucleotide polymorphism identification assays using a thermostable DNA polymerase and delayed extraction MALDI-TOF mass spectrometry. Genome Research. 7 (4), 378-388 (1997).
- Blondal, T., et al. A novel MALDI-TOF based methodology for genotyping single nucleotide polymorphisms. Nucleic Acids Research. 31 (24), 155 (2003).
- Cui, Z., Theruvathu, J. A., Farrel, A., Burdzy, A., Sowers, L. C. Characterization of synthetic oligonucleotides containing biologically important modified bases by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Analytical Biochemistry. 379 (2), 196-207 (2008).
- Darwanto, A., Farrel, A., Rogstad, D. K., Sowers, L. C. Characterization of DNA glycosylase activity by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Analytical Biochemistry. 394 (1), 13-23 (2009).
- Redrejo-Rodríguez, M., et al. New insights in the removal of the Hydantoins, oxidation product of pyrimidines, via the base excision and Nucleotide incision repair pathways. PLoS ONE. 6 (7), 21039 (2011).
- Prorok, P., et al. Uracil in duplex DNA is a substrate for the nucleotide incision repair pathway in human cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (39), 3695-3703 (2013).
- Alexeeva, M., et al. Excision of uracil from DNA by hSMUG1 includes strand incision and processing. Nucleic Acids Research. 47 (2), 779-793 (2019).
- Thapar, U., Demple, B. Deployment of DNA polymerases beta and lambda in single-nucleotide and multinucleotide pathways of mammalian base excision DNA repair. DNA Repair. 76, 11-19 (2019).
- Su, K. Y., et al. Proofreading and DNA repair assay using single nucleotide extension and MALDI-TOF mass spectrometry analysis. Journal of Visualized Experiments : JoVE. (136), e57862 (2018).
- Hillenkamp, F., Karas, M., Beavis, R. C., Chait, B. T. Matrix-assisted laser desorption/ionization mass spectrometry of biopolymers. Analytical Chemistry. 63 (24), 1193-1202 (1991).
- Brammer, K. W., Jones, A. S., Mian, A. M., Walker, R. T. Study of the use of alkaline degradation of DNA derivative as a procedure for the determination of nucleotide distribution. Biochimica et Biophysica Acta. 166 (3), 732-734 (1968).
- Lindahl, T., Ljungquist, S., Siegert, W., Nyberg, B., Sperens, B. DNA N-glycosidases: properties of uracil-DNA glycosidase from Escherichia coli. Journal of Biological Chemistry. 252 (10), 3286-3294 (1977).
- Rashtchian, A., Buchman, G. W., Schuster, D. M., Berninger, M. S. Uracil DNA glycosylase-mediated cloning of polymerasechain reaction-amplified DNA: Application to genomic and cDNA cloning. Analytical Biochemistry. 206 (1), 91-97 (1992).
- Varshney, U., van de Sande, J. H. Specificities and kinetics of uracil excision from uracil-containing DNA oligomers by Escherichia coli uracil DNA glycosylase. Biochemistry. 30 (16), 4055-4061 (1991).
- Delort, A. M., et al. Excision of uracil residues in DNA: Mechanism of action of Escherichia coli and Micrococcus luteus uracil-DNA glycosylases. Nucleic Acids Research. 13 (2), 319-335 (1985).
- Wang, Z. G., Smith, D. G., Mosbaugh, D. W. Overproduction and characterization of the uracil-DNA glycosylase inhibitor of bacteriophage PBS2. Gene. 99 (1), 31-37 (1991).
- Chang, H. L., et al. Measurement of uracil-DNA glycosylase activity by matrix assisted laser desorption/ionization time-of-flight mass spectrometry technique. DNA Repair. 97, 103028 (2021).
- Minko, I. G., et al. Catalysts of DNA strand cleavage at apurinic/apyrimidinic sites. Scientific Reports. 6 (1), 28894 (2016).
- Lindahl, T. Uracil-DNA glycosylase from Escherichia coli. Methods in Enzymology. 65, 284-290 (1980).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved