Method Article
Um protocolo para bypass gástrico Roux-en-Y em ratos usando grampos lineares
Neste Artigo
Resumo
O bypass gástrico Roux-en-Y (RYGB) é realizado para tratar obesidade e diabetes. No entanto, os mecanismos subjacentes à eficácia do RYGB não são totalmente compreendidos, e os estudos são limitados pela dificuldade técnica que leva à alta mortalidade em modelos animais. Este artigo fornece instruções sobre como executar RYGB em ratos com altas taxas de sucesso.
Resumo
O bypass gástrico Roux-en-Y (RYGB) é comumente realizado para o tratamento de obesidade grave e diabetes tipo 2. No entanto, o mecanismo de perda de peso e mudanças metabólicas não são bem compreendidos. Acredita-se que múltiplos fatores desempenham um papel, incluindo redução da ingestão calórica, diminuição da absorção de nutrientes, aumento da saciedade, liberação de hormônios promotores da saciedade, mudanças no metabolismo do ácido biliar e alterações na microbiota intestinal.
O modelo RYGB de ratos apresenta uma estrutura ideal para estudar esses mecanismos. Trabalhos anteriores em modelos de camundongos tiveram altas taxas de mortalidade, variando de 17 a 52%, limitando sua adoção. Modelos de ratos demonstram mais reserva fisiológica ao estímulo cirúrgico e são tecnicamente mais fáceis de adotar, pois permitem o uso de grampeadores cirúrgicos. Um desafio com os grampeadores cirúrgicos, no entanto, é que eles muitas vezes deixam uma grande bolsa gástrica que não é representativa do RYGB em humanos.
Neste protocolo, apresentamos um protocolo RYGB em ratos que resultam em uma pequena bolsa gástrica usando grampeadores cirúrgicos. Utilizando dois incêndios grampeador que removem oomaca florestal do rato, obtemos uma bolsa gástrica menor semelhante à que segue um típico RYGB humano. O grampeamento cirúrgico também resulta em melhor hemostasia do que divisão afiada. Além disso, o forestomach do rato não contém glândulas e sua remoção não deve alterar a fisiologia do RYGB.
A perda de peso e as alterações metabólicas na coorte RYGB foram significativas em comparação com a coorte falsa, com tolerância significativamente menor à glicose em 14 semanas. Além disso, este protocolo tem uma excelente sobrevida de 88,9% após o RYGB. As habilidades descritas neste protocolo podem ser adquiridas sem experiência microcirúrgica prévia. Uma vez dominado, este procedimento fornecerá uma ferramenta reprodutível para estudar os mecanismos e efeitos do RYGB.
Introdução
A obesidade e o diabetes tipo 2 tornaram-se epidemias mundiais1. Embora a perda de peso médico possa melhorar o diabetes em pacientes, aqueles com diabetes grave se beneficiam mais da cirurgia bariátrica. A cirurgia bariátrica tem se mostrado segura e eficaz na perda de peso e na melhoria ou cura do diabetes tipo2 ,3, mesmo naqueles com doença de longa data4. Procedimentos bariátricos metabólicos, como a atual cirurgia de bypass gástrico Roux-en-Y (RYGB), induzem melhorias rápidas e sustentadas na homeostase de glicose, ao mesmo tempo em que reduzem a necessidade de medicamentos diabéticos5,6,7.
Após o RYGB, a melhora da homeostase da glicose ocorre rapidamente e é independente da perda de peso8. Duas teorias importantes foram propostas para explicar as mudanças metabólicas associadas à remissão do diabetes que ocorrem após a cirurgia metabólica. Primeiro, a hipótese hindgut postula que, após o bypass, maiores concentrações de nutrientes não digeridos atingem o intestino distal aumentando a liberação de hormônios como o GLP-1. Por outro lado, a hipótese do foregut sugere que contornar o intestino proximal reduz a secreção de hormônios anti-incretina. Ambos os efeitos podem levar à melhora precoce do metabolismo da glicose9.
Modelos animais têm o potencial de ser uma ferramenta poderosa para estudar esses mecanismos. No entanto, uma grande barreira na utilização de modelos de ratos ou ratos é a dificuldade técnica na realização desses procedimentos. A maioria dos estudos tem se apoiado nos modelos de ratos ou ratos10,11,12. Os modelos de mouse têm sido difíceis, pois o estômago do mouse é muito pequeno para usar dispositivos grampeador11, e as taxas de mortalidade são inaceitáveis, variando de 17 a 52%13. Em ratos, alguns protocolos permanecem tecnicamente difíceis de realizar devido à complexa ligadura de vasos gástricos antes de dividir o estômago12,14. Outros modelos dividem o estômago usando um grampeador, mas deixam uma bolsa grande não consistente com a anatomia humana pós RYGB11. Neste modelo, fornecemos instruções detalhadas sobre como executar RYGB usando grampeadores lineares em um modelo de rato resultando em uma bolsa gástrica mais de acordo com a anatomia humana. No geral, este procedimento foi associado a excelentes taxas de sobrevivência e desfechos metabólicos.
Protocolo
Os protocolos de uso de animais foram aprovados pelo Comitê de Cuidados e Uso animal da Universidade de Alberta (AUP00003000). Consulte a Figura 1 para um diagrama demonstrando a anatomia RYGB.
1. Bypass gástrico Roux-en-Y
- Preparação de animais e configuração operacional
- Uma semana antes da cirurgia, forneça aos ratos terapia de reidratação oral e dieta líquida, além de sua dieta sólida e água para aclimatá-los a esta nova dieta.
- Ratos rápidos com acesso apenas à água por 12-18 h antes da cirurgia.
- Certifique-se de que os ratos estão em jejum em uma plataforma de fio elevada para que eles não possam consumir material de cama.
- Injete ratos com buprenorfina longa subcutânea (RS) a uma dose de 1 mg/kg imediatamente antes da cirurgia.
- Autoclave todos os instrumentos cirúrgicos, toalhas e cortinas.
- Limpe a superfície de operação, a almofada de aquecimento e o cone do nariz anestésico com 70% de etanol.
- Configure a superfície de operação com um microscópio operacional, máquina anestésica e suprimentos de uma maneira ergonômica para o cirurgião operacional.
- Use uma almofada de aquecimento regulada pela temperatura e estafina para 37 °C.
- Coloque uma cortina estéril ou toalha sobre a almofada de aquecimento.
- Encha um tubo cônico estéril de 50 mL com 0,9% de soro fisiológico.
- Indução e preparação anestésicos
- Induzir anestesia utilizando 4% de isoflurane conforme protocolos previamente estabelecidos15.
- Aplique pressão no pé traseiro dos quatro membros para garantir que não haja resposta à dor.
- Verifique se há anestesia adequada e taxa respiratória após cada 5 minutos.
- Aplique lubrificante em ambos os olhos para evitar a secagem.
- Raspar o cabelo do abdômen.
- Limpe o abdômen com uma solução povidone-iodo. Deixe a solução secar e se transforme em luvas estéreis.
- Drape o rato com uma abertura na cortina para expor o abdômen.
- Coloque instrumentos, suturas, cotonetes de algodão e uma seringa de 10 mL em um local que permita fácil acesso durante o procedimento.
- Laparotomia mediana
- Faça uma incisão de 3 cm na linha média superior do abdômen usando um bisturi, logo abaixo do processo xifoide como um marco.
- Usando tesoura, divida a fáscia e o peritônio, com o cuidado de ficar na linha média na linha alba para reduzir o sangramento do reto abdominus. Se houver sangramento, controle-o com térmica ou eletrocauteria.
- Mobilizando o estômago
- Usando dois cotonetes de algodão molhado, disseco sem rodeios os acessórios gástricos.
- Ao encontrar aderências densas, use cautery térmico para dividir os acessórios gástricos com cuidado para evitar cauterizar o estômago. Divida bruscamente o ligamento entre o estômago e o lobo hepático acessório para reduzir o risco de ruptura hepática com mobilização estomacal.
- Para vasos sanguíneos maiores, especialmente nas artérias gástricas curtas, ligadura usando sutura de polipropileno 6-0.
- Crie uma janela no lado distal direito do esôfago, mas proximal à artéria gástrica esquerda. Certifique-se de que um cotonete pode alcançar esta área posteriormente. O estômago é adequadamente mobilizado quando pode ser exteriorizado fora do abdômen.
- Identifique e divida o jejunum
- Identifique o ligamento de Treitz seguindo o jejunum proximally até observá-lo é apego ao mesocólon transversal.
- Meça 7 cm distally, identifique um local entre vasos mesenéricos e divida o intestino com micro tesoura. Evite as manchas de Peyer ao dividir o intestino. Tome cuidado para dividir apenas o intestino e não o mesentery.
- Coloque uma esponja limpa e salina encharcada antes de dividir o intestino para minimizar a contaminação.
- Verifique a presença de um pequeno navio de travessia na mesenteria na borda do intestino delgado e divida isso com cauteria para evitar sangramento.
- Continue a dividir o mesentery 1 cm em direção à base mesentérica.
- Identifique o jejunum proximal e distal. Coloque o jejunum proximal sob uma gaze molhada à direita do rato e o jejunum distal à esquerda do rato.
- Grampeando o estômago
- Insira um grampeador linear de 45 mm com altura de grampo de 3,5 mm através da linha branca do forestomach para criar uma bolsa menor. Espere por 10 s antes de disparar o grampeador.
- Coloque a pressão usando gaze nas linhas de grampo por 1 minuto para garantir hemostasia. Se a hemostasia não for alcançada apenas com pressão, o sangramento ao longo da linha de grampo é overdelo usando 6-0 figura de polipropileno de oito suturas.
- Realize um segundo fogo básico através do estômago na janela criada anteriormente. Espere por 10 s antes de disparar o grampeador. A pressão é mantida ao longo da linha de grampo para garantir a hemostasia, e pode ser necessário ovais.
- Gastrojejunostomia
- Faça uma gastrotomia imediatamente depois de grampear o estômago. Atrasos nisso podem causar distensão gástrica e aspiração, pois o estômago é descontínuo após o segundo grampo gástrico.
- Usando um bisturi de 11 lâminas, crie uma gastrotomia na bolsa distal. Expresse conteúdo gástrico através da gastrotomia. Isso é importante para evitar a distensão gástrica e a aspiração. Alonge esta gastrotomia usando micro tesoura para aproximadamente 5 mm. A gastrotomia é feita grande o suficiente para a ponta do cotonete de algodão só para caber.
- Mobilize a extremidade distal do jejunum adjacente à gastrotomia e coloque de tal forma que a mesenteria não seja torcida.
- Enquanto sutura a anastomose, certifique-se de que o intestino seja mantido úmido, cobrindo-o com gaze salina e reaplicando salino regularmente.
- Usando 6-0 polidioxina ou sutura de polipropileno, coloque uma sutura de permanência na margem inferior da anastomose e retraia suavemente usando um estalo. Amarre com três nós.
- Coloque uma sutura de permanência na margem superior da anastomose e retraia suavemente usando um estalo. Amarre com seis nós.
- Suturar o lado anterior da anastomose de forma contínua, levando mordidas de 1 mm de largura e 1 mm de distância com cuidado para evitar tomar o traseiro.
- Uma vez que a sutura tenha atingido a sutura inferior, amarre-as com mais seis nós.
- Uma vez que o lado anterior esteja completo, vire o intestino e o estômago e passe a sutura inferior através do defeito mesentérico. Reaplique o snap e retraia-se inferiormente.
- Para o lado posterior da anastomose, coloque a espessura total interrompida 6-0 suturas, 1 mm de largura e espaçada 1 mm de distância, com cuidado para evitar tomar o traseiro. Estes estão empatados com seis nós cada.
NOTA: O lado anterior da anastomose é suturado de forma contínua, enquanto o lado posterior é feito de forma interrompida. Isso evita uma restrição potencial ou estenose associada a um fechamento circunferencial contínuo. - Verifique se há vazamento empurrando suavemente conteúdo luminal através da anastomose. Se houver áreas com vazamento, reforce-as cuidadosamente com suturas interrompidas. Tome cuidado para evitar tomar a parede de trás ao reforçar com suturas extras.
- Jejunojejunostomia
- Da gastrojejunostomia, meça 20 cm distally.
- Crie uma jejunotomia no lado antimesenteric usando o bisturi de 11 lâminas. Evite fazer a jejunotomia sobre as manchas de Peyer.
- Este jejunotomia usando micro tesoura, de tal forma que é do mesmo tamanho do membro biliopancreatic. Certifique-se de que um cotonete só se encaixa dentro.
- Coloque o membro biliopancreatic de tal forma que não haja torção da mesenteria.
- Realize a anastomose de forma semelhante à gastrojejunostomia com suturas de 6-0 nos lados superior e inferior. O lado anterior é realizado com suturas contínuas, enquanto o lado posterior é realizado com suturas interrompidas.
- Certifique-se de que o intestino está úmido com soro fisiológico durante esta anastomose.
- Verifique se há vazamentos empurrando suavemente o conteúdo luminal através da anastomose. Se houver áreas com vazamento, reforce-as com suturas interrompidas.
- Reposicione o intestino e o estômago
- Certifique-se de que não há torção da bolsa, estômago remanescente ou fígado. Certifique-se de que o lobo esquerdo do fígado é anterior ao estômago e não preso atrás da bolsa, pois isso pode causar isquemia hepática compressiva.
- Posicione o intestino no abdômen em sua posição natural de tal forma que não haja torção.
- Fechamento abdominal
- Feche a fáscia com poliglactina 3-0 de forma contínua. Também pode ser utilizado 3-0 polidioxina.
- Feche a pele com 2-0 de seda de forma contínua.
- Emergência anestésico
- Diminua o isoflurane para zero, mas continue o oxigênio suplementar.
- Administre um anestésico local como um bloco de respingos na incisão.
- Administre 10 mL de dextrose subcutânea de 5% em soro fisiológico normal (D5NS) no tecido subcutâneo atrás do pescoço.
- Coloque uma coleira de rato elizabetano antes que o rato esteja totalmente acordado. Tome cuidado para encaixá-lo snugly, mas não muito apertado para causar desconforto.
NOTA: A coleira é mantida até o dia 5 para evitar a deshiscência da ferida.
2. Cirurgia falsa
NOTA: A cirurgia falsa é realizada semelhante ao RYGB, no entanto, não são realizadas anastomosas.
- Uma gastrotomia é criada e depois fechada com 6-0 polidioxina ou suturas de polipropileno.
- Uma jejunotomia é criada 7 cm distal no ligamento de Treitz e depois fechada com 6-0 polidioxina ou suturas de polipropileno.
3. Cuidados pós-operatórios
- Cuidados pós-operatórios
- Abrigar ratos individualmente e mantê-los em plataformas de arame elevado até que alimentos sólidos sejam reintroduzidos para evitar o consumo de roupas de cama e obstrução luminal.
NOTA: A dieta pós-operatória é retomada gradualmente, pois o edema na gastrojejunostomia pode causar obstrução com a retomada precoce da dieta sólida. - Inspecione os pés diariamente enquanto os ratos estão em plataformas de arame elevado para quaisquer alterações de pele.
- Mantenha os ratos na água e dieta de terapia de reidratação oral durante as primeiras 72 horas.
- Administre 10 mL de D5NS a cada 12 h para as primeiras 72 h.
- Administre buprenorfina de ação curta subcutânea a 0,01 mg/kg se os ratos parecerem estar com dor. A Escala de Careta de Ratos é usada para avaliar a dor16.
- No pós-operatório 3, adicione dieta líquida de roedores. Continue fornecendo água e terapia de reidratação oral.
- No pós-operatório 5, reinicie a dieta rica em gordura. Continue fornecendo água e dieta líquida. Remova a coleira elizabetano.
- No pós-operatório 7, descontinuar a dieta líquida.
- Remova as suturas da pele no pós-operatório 10-14.
- Abrigar ratos individualmente e mantê-los em plataformas de arame elevado até que alimentos sólidos sejam reintroduzidos para evitar o consumo de roupas de cama e obstrução luminal.
Resultados
Animais e moradia
36 ratos Wistar machos foram alojados em pares e foram alimentados com 60% de roedores estéreis com alta gordura a partir das seis semanas de idade(Figura 2). Com 16 semanas de idade, eles foram submetidos a RYGB ou cirurgia falsa. Após a primeira semana pós-operatória, os ratos foram retomados em uma dieta rica em gordura. Metade dos ratos foram eutanizados em 2 semanas após o operatório e a outra metade foi eutanásia em 14 semanas de pós-operatório.
Mortalidade
No total, 33 (91,7%) ratos sobreviveram ao ponto final do estudo planejado. Todos os ratos submetidos à eutanásia precoce foram submetidos à necropsia por um veterinário. Dois ratos foram eutanizados em 24 horas. Um RYGB tinha pneumonite de aspiração e um rato falso tinha deshiscência fascial com intestino não aspirador. Outro rato RYGB foi eutanizado em duas semanas devido ao vazamento anastomótico da gastrojejunostomia. No total, 88,9% dos ratos RYGB sobreviveram para estudar ponto final.
Peso corporal
Ratos submetidos ao RYGB tinham um peso pós-operatório menor do que ratos falsos. A Figura 3 demonstra pesos absolutos para ratos no pós-operatório, enquanto a Figura 4 demonstra a variação percentual de peso pós-operatória que foi estatisticamente significativa em todos os momentos do pós-operatório. Aos 14 semanas, os ratos que tinham RYGB tiveram uma variação percentual média de peso de 6,4% enquanto os ratos com cirurgia falsa tiveram 23,7% (p = 0,0001).
Teste de tolerância à glicose intraperitoneal
A glicemia de jejum não foi significativamente diferente entre nenhuma das coortes. No entanto, a área sob a curva foi significativamente menor em RYGB em comparação com sham em 13 semanas (18,1 vs 23,8 mmol-h/L, p=0,046, Figura 5), mas foi a mesma para RYGB vs sham em 1 semana (20,8 vs 23,3 mmol-h/L, p=0,68).
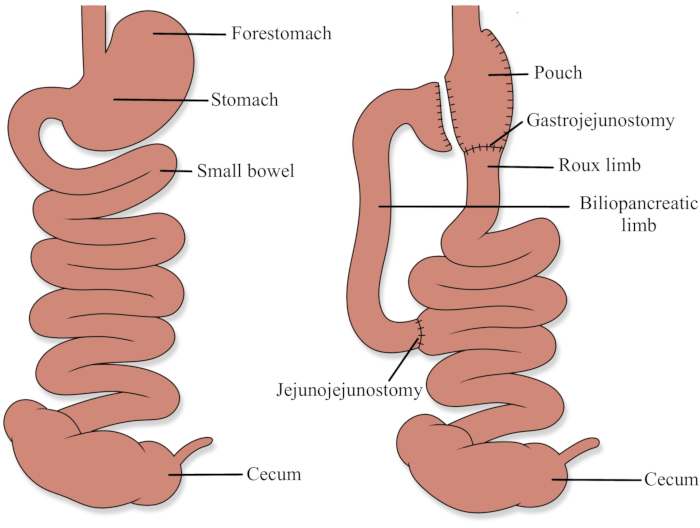
Figura 1: Anatomia do bypass gástrico Roux-en-Y Clique aqui para ver uma versão maior desta figura.

Figura 2: Peso absoluto pré-operatório na dieta rica em gordura; RYGB, Roux-en-Y bypass gástrico Clique aqui para ver uma versão maior desta figura.

Figura 3: Peso absoluto pós-operatório na dieta rica em gordura; RYGB, Roux-en-Y bypass gástrico Clique aqui para ver uma versão maior desta figura.

Figura 4: Variação percentual de peso pós-operatório na dieta rica em gordura; RYGB, Roux-en-Y bypass gástrico Clique aqui para ver uma versão maior desta figura.

Figura 5: Teste de tolerância à glicose intraperitoneal em bypass gástrico vs sham às 13 semanas. RYGB, Roux-en-Y bypass gástrico Clique aqui para ver uma versão maior desta figura.
Discussão
O RYGB envolve a criação de uma pequena bolsa gástrica (menos de 30 mL), e a criação de um membro biliopancreatic e um membro Roux(Figura 1). Em humanos, o membro biliopancreatic é tipicamente de 30 a 50 cm e transporta secreções do remanescente gástrico, fígado e pâncreas. O membro Roux tem tipicamente 75 a 150 cm de comprimento e é o canal principal para alimentos ingeridos. O canal comum é o distal intestinal delgado restante para onde os dois membros se juntam e é onde ocorre a maioria da digestão e absorção, como enzimas pancreáticas e bile misturam com alimentos ingeridos17.
O mecanismo de perda de peso em RYGB é multimodal. A pequena bolsa gástrica reduz a ingestão de alimentos através de restrição mecânica. O bypass resulta em um componente malabsorptivo, pois uma porção significativa do intestino delgado não está absorvendo calorias e nutrientes. Mais recentemente, estudos demonstraram que os hormônios intestinais desempenham um papel significativo na perda de peso após o RYGB também. Estes são principalmente através de ghrelin, peptídeo-YY, colecistocina (CCK) e vias hormonais GLP-118.
Modelos de ratos fornecem um método poderoso para estudar os mecanismos por trás do peso e dos efeitos metabólicos do RYGB. Neste artigo, apresentamos um protocolo RYGB que tem baixa mortalidade com perda de peso significativa e efeitos metabólicos. Uma vez que o operador se familiarizou com a técnica, o procedimento levou aproximadamente 90 minutos para ser realizado. O protocolo também pode ser modificado com comprimentos mais longos de biliopancreatic e roux para potencialmente aumentar a perda de peso e efeito metabólico. Além disso, é tecnicamente mais viável do que outros modelos, pois permite o uso de grampeadores cirúrgicos para alcançar hemostasia e minimizar o tempo de operação. Modelos que dependem de divisão acentuada do estômago sem grampeamento muitas vezes resultam em maior mortalidade devido à perda significativa de sangue. As habilidades técnicas necessárias para a realização do procedimento foram relativamente fáceis de adquirir, e os alunos puderam realizar confortavelmente o procedimento após aproximadamente cinco a dez procedimentos de não recuperação.
Um dos passos críticos deste protocolo é limitar a perda de sangue durante a mobilização do estômago. O uso cuidadoso do cautery térmico combinado com a ligadura sutura dos vasos é importante. Também é importante realizar pelo menos metade da circunferência dos anastomoses de forma interrompida. Isso evita o excesso de rigor nas anastomoses. Além disso, a verificação de vazamentos é crucial, pois estes podem levar à sepse e à morte. Antes de fechar o abdômen, é essencial que o lobo esquerdo do fígado seja colocado em sua posição natural, anterior e que não haja rotação no intestino ou no estômago, pois isso pode levar à isquemia visceral.
O cuidado pós-operatório é vital para este protocolo. Plataformas de fio elevadas são necessárias durante o jejum e o pós-operatório, pois o consumo de material sólido leva a obstruções anastomóticas. É de vital importância fornecer fluido subcutâneo, pois os ratos podem não tolerar fluidos orais no pós-operatório imediato. Os ratos devem ser aclimatados à terapia de reidratação oral e dieta líquida, pois os ratos podem evitar novas dietas devido a associações com dor pós-operatória. Este protocolo alimentar contribui para uma perda significativa de peso no pós-operatório imediato tanto no RYGB quanto nas coortes sham, e a recuperação de peso no grupo sham levou cerca de cinco semanas. No entanto, a adesão rigorosa a este protocolo pós-operatório é vital para reduzir a morbidade e a mortalidade após o RYGB. Além disso, o exame frequente dos ratos que utilizam a Escala de Careta de Ratos é importante para detectar para a morbidade. Em nosso estudo, um rato desenvolveu um vazamento anastomótico tardio que foi rapidamente detectado usando esta escala e permitiu que a eutanásia precoce reduzisse o sofrimento.
Uma das vantagens deste método é que resulta em uma bolsa menor através do uso de grampeadores cirúrgicos para reduzir o sangramento gástrico. Quando tentamos dividir o estômago sem grampeadores, isso leva a um sangramento excessivo e uma taxa de mortalidade muito maior. No entanto, isso também leva à remoção do ryomaca florestal, e isso pode levar a alterações fisiológicas diferentes das do RYGB humano. No entanto, o forestomach é exclusivo dos roedores e não contém glândulas, e não deve causar alterações nos hormônios intestinais.
A limitação mais importante deste método é que ele requer duas recargas de grampeador cirúrgico por rato, o que pode ser caro. No entanto, excelentes resultados de sobrevivência potencialmente reduzem o custo exigindo menos ratos para um estudo, resultando em melhor utilização de instalações de criação, equipamentos cirúrgicos e pessoal de pesquisa.
Divulgações
A Ethicon forneceu dois grampeadores de corte linear de 45 mm, várias recargas de grampeador de 3,5 mm e suturas de polipropileno 6-0. Os autores não têm outros conflitos de interesse para declarar.
Agradecimentos
Este estudo foi financiado pela American Society for Metabolic and Bariatric Surgery Research Award. A Ethicon graciosamente forneceu suturas, grampeadores e clipes. A pesquisa de doutorado do autor principal foi financiada pelo Programa de Pesquisadores Clínicos da Universidade de Alberta e pela Alberta Innovates Clinician Fellowship. Também gostaríamos de agradecer a Michelle Tran por sua ilustração médica da anatomia do RYGB.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-0 Silk Sutures | Ethicon | K533 | |
| 3-0 Vicryl Sutures | Ethicon | J219H | |
| 4% Isoflurane | N/A | N/A | |
| 5% Dextrose and 0.9% Sodium Chloride Solution - 1000 mL | Baxter | 2B1064 | |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| 6-0 Prolene Sutures | Ethicon | 8805H | |
| Anesthetic Machine | N/A | N/A | |
| Animal Hair Shaver | N/A | N/A | |
| Betadine Solution | N/A | N/A | |
| Castrojievo Needle Holder with lock 14 cm (smooth curved) | World Precision Instruments | 503258 | |
| ECHELON FLEX Articulating Endoscopic Linear Cutter | Ethicon | EC45A | |
| Economy Tweezers #4 | World Precision Instruments | 501978 | |
| ENDOPATH ETS Articulating Linear Cutter 45mm Reloads | Ethicon | 6R45B | |
| Far Infrared Warming Pad Controller with warming pad (15.2 cm W x 20.3 cm L), pad temperature probe, and 10 disposable, non-sterile sleeve protectors | Kent Scientific | RT-0515 | |
| Large Rat Elizabethan Collar | Kent Scientific | EC404VL-10 | |
| Liquid Diet Feeding Tube (150 mL) | Bio-Serv | 9007 | |
| Liquid Diet Feeding Tube Holder (short adjustable) | Bio-Serv | 9015 | |
| Micro Mosquito Forceps | World Precision Instruments | 500452 | |
| Micro Scissors | World Precision Instruments | 503365 | |
| Mouse Diet, High Fat Fat Calories (60%), Soft Pellets | Bio-Serv | S3282 | |
| No. 11 Blade and Scalpel Handle | N/A | N/A | |
| OPMI Vario Surgical Microscope | ZEISS | S88 | |
| Raised Floor Grid | Tecniplast | GM500150 Raised Floor Grid | |
| Rodent Liquid Diet, Lieber-DeCarli '82, Control, 4 Liters/Bag | Bio-Serv | F1259 | |
| Sodium Chloride Irrigation 0.9% Solution - 500 mL | Baxter | JF7633 | |
| Sterile Cotton Swabs | N/A | N/A | |
| Sterile Drape | N/A | N/A | |
| Sterile Towel | N/A | N/A | |
| Thermal Cautery Unit | World Precision Instruments | 501293 |
Referências
- Courcoulas, A. P., et al. Three-year outcomes of bariatric surgery vs lifestyle intervention for type 2 diabetes mellitus treatment. JAMA Surgery. 15213 (10), 1-9 (2015).
- Ardestani, A., Rhoads, D., Tavakkoli, A. Insulin cessation and diabetes remission after bariatric surgery in adults with insulin-treated type 2 diabetes. Diabetes Care. 38 (4), 659-664 (2015).
- Casella, G., et al. Ten-year duration of type 2 diabetes as prognostic factor for remission after sleeve gastrectomy. Surgery for Obesity and Related Diseases. 7 (6), 697-702 (2011).
- Panunzi, S., De Gaetano, A., Carnicelli, A., Mingrone, G. Predictors of remission of diabetes mellitus in severely obese individuals undergoing bariatric surgery. Annals of Surgery. 261 (3), 459-467 (2015).
- Edelman, S., et al. Control of type 2 diabetes after 1 year of laparoscopic adjustable gastric banding in the helping evaluate reduction in obesity (HERO) study. Diabetes, Obesity and Metabolism. 16 (10), 1009-1015 (2014).
- Mingrone, G., et al. Metabolic surgery versus conventional medical therapy in patients with type 2 diabetes: 10-year follow-up of an open-label, single-centre, randomised controlled trial. The Lancet. 397 (10271), 293-304 (2021).
- Thaler, J. P., Cummings, D. E. Minireview: Hormonal and metabolic mechanisms of diabetes remission after gastrointestinal surgery. Endocrinology. 150 (6), 2518-2525 (2009).
- Mingrone, G., Castagneto-Gissey, L. Mechanisms of early improvement / resolution of type 2 diabetes after bariatric surgery. Diabetes and Metabolism. 35 (6), 518-523 (2009).
- Arapis, K., et al. Remodeling of the residual gastric mucosa after Roux-en-Y gastric bypass or vertical sleeve gastrectomy in diet-induced obese rats. PloS One. 10 (3), 012414 (2015).
- Bruinsma, B. G., Uygun, K., Yarmush, M. L., Saeidi, N. Surgical models of Roux-en-Y gastric bypass surgery and sleeve gastrectomy in rats and mice. Nature Protocols. 10 (3), 495-507 (2015).
- Bueter, M., et al. Roux-en-Y gastric bypass operation in rats protocol. Journal of visualized experiments : JoVE. (64), (2012).
- Stevenson, M., Lee, J., Lau, R. G., Brathwaite, C. E. M., Ragolia, L. Surgical mouse models of vertical sleeve gastrectomy and Roux-en Y gastric bypass: a Review. Obesity Surgery. , (2019).
- Hao, Z., et al. Reprogramming of defended body weight after Roux-En-Y gastric bypass surgery in diet-induced obese mice. Obesity. 24 (3), 654-660 (2016).
- Adult rodent anesthesia SOP. UBC Animal Care Guidelines Available from: https://animalcare.ubc.ca/sites/default/files/documents/ACC-01-2017_Anesthesia.pdf (2017)
- Sotocinal, S. G., et al. The Rat Grimace Scale: a partially automated method for quantifying pain in the laboratory rat via facial expressions. Molecular pain. , 1-10 (2011).
- Elder, K. A., Wolfe, B. M. Bariatric surgery: A review of procedures and outcomes. Gastroenterology. 132 (6), 2253-2271 (2007).
- Bariatric procedures for the management of severe obesity: Descriptions. UpToDate Available from: https://www-uptodate-com.remotexs.ntu.edu.sg/ (2017)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados