Method Article
Ein Protokoll für Roux-en-Y Magenbypass bei Ratten mit linearen Heftern
In diesem Artikel
Zusammenfassung
Roux-en-Y Magenbypass (RYGB) wird zur Behandlung von Fettleibigkeit und Diabetes durchgeführt. Die Mechanismen, die der Wirksamkeit von RYGB zugrunde liegen, sind jedoch nicht vollständig verstanden, und die Studien sind durch technische Schwierigkeiten begrenzt, die zu einer hohen Mortalität in Tiermodellen führen. Dieser Artikel enthält Anweisungen zur Durchführung von RYGB bei Ratten mit hohen Erfolgsraten.
Zusammenfassung
Roux-en-Y Magenbypass (RYGB) wird häufig zur Behandlung von schwerer Fettleibigkeit und Typ-2-Diabetes durchgeführt. Der Mechanismus der Gewichtsabnahme und metabolische Veränderungen sind jedoch nicht gut verstanden. Es wird angenommen, dass mehrere Faktoren eine Rolle spielen, darunter eine reduzierte Kalorienaufnahme, eine verminderte Nährstoffaufnahme, ein erhöhtes Sättigungsgefühl, die Freisetzung von sättigungsfördernden Hormonen, Verschiebungen im Gallensäurestoffwechsel und Veränderungen in der Darmmikrobiota.
Das Ratten-RYGB-Modell bietet einen idealen Rahmen, um diese Mechanismen zu untersuchen. Frühere Arbeiten an Mausmodellen hatten hohe Sterblichkeitsraten, die zwischen 17 und 52% lagen, was ihre Akzeptanz einschränkte. Rattenmodelle zeigen eine mehr physiologische Reserve gegenüber chirurgischen Reizen und sind technisch einfacher zu übernehmen, da sie die Verwendung von chirurgischen Heftern ermöglichen. Eine Herausforderung bei chirurgischen Heftern ist jedoch, dass sie oft einen großen Magenbeutel hinterlassen, der nicht repräsentativ für RYGB beim Menschen ist.
In diesem Protokoll präsentieren wir ein RYGB-Protokoll bei Ratten, das zu einem kleinen Magenbeutel mit chirurgischen Heftern führt. Mit zwei Hefterfeuern, die den Voromach der Ratte entfernen, erhalten wir einen kleineren Magenbeutel, der dem eines typischen menschlichen RYGB ähnelt. Chirurgisches Heften führt auch zu einer besseren Hämostase als scharfe Teilung. Darüber hinaus enthält der Voromach der Ratte keine Drüsen und seine Entfernung sollte die Physiologie von RYGB nicht verändern.
Gewichtsverlust und metabolische Veränderungen in der RYGB-Kohorte waren im Vergleich zur Scheinkohorte signifikant, mit signifikant niedrigerer Glukosetoleranz nach 14 Wochen. Darüber hinaus hat dieses Protokoll ein ausgezeichnetes Überleben von 88,9% nach RYGB. Die in diesem Protokoll beschriebenen Fähigkeiten können ohne vorherige mikrochirurgische Erfahrung erworben werden. Einmal gemeistert, wird dieses Verfahren ein reproduzierbares Werkzeug zur Untersuchung der Mechanismen und Auswirkungen von RYGB bieten.
Einleitung
Fettleibigkeit und Typ-2-Diabetes sind zu weltweiten Epidemien geworden1. Obwohl medizinische Gewichtsabnahme Diabetes bei Patienten verbessern kann, profitieren diejenigen mit schwerem Diabetes am meisten von bariatrischen Operationen. Bariatrische Chirurgie hat sich als sicher und wirksam bei der Gewichtsabnahme und Verbesserung oder Heilung von Typ-2-Diabetes2,3erwiesen, auch bei Menschen mit langjähriger Krankheit4. Metabolische bariatrische Verfahren, wie die aktuelle Goldstandard-Roux-en-Y-Magenbypass-Operation (RYGB), induzieren schnelle und anhaltende Verbesserungen der Glukose-Homöostase und reduzieren gleichzeitig den Bedarf an Diabetikern5,6,7.
Nach RYGB tritt die Verbesserung der Glukose-Homöostase schnell auf und ist unabhängig vom Gewichtsverlust8. Zwei Haupttheorien wurden vorgeschlagen, um die metabolischen Veränderungen im Zusammenhang mit der Diabetes-Remission zu erklären, die nach einer metabolischen Operation auftreten. Erstens postuliert die Hinterdarmhypothese, dass nach dem Bypass höhere Konzentrationen unverdauter Nährstoffe in den distalen Darm gelangen und die Freisetzung von Hormonen wie GLP-1 verstärken. Auf der anderen Seite legt die Vordarmhypothese nahe, dass die Umgehung des proximalen Darms die Sekretion von Anti-Inkretin-Hormonen reduziert. Beide Effekte könnten zu einer frühzeitigen Verbesserung des Glukosestoffwechsels führen9.
Tiermodelle haben das Potenzial, ein leistungsfähiges Werkzeug zu sein, um diese Mechanismen zu untersuchen. Ein großes Hindernis bei der Verwendung von Maus- oder Rattenmodellen ist jedoch die technische Schwierigkeit bei der Durchführung dieser Verfahren. Die meisten Studien stützten sich auf Maus- oder Rattenmodelle10,11,12. Mausmodelle waren schwierig, da der Mausmagen zu klein ist, um Heftgeräte11zu verwenden, und die Sterblichkeitsraten sind inakzeptabel hoch und liegen zwischen 17 und 52%13. Bei Ratten bleiben einige Protokolle aufgrund der komplexen Ligatur der Magengefäße vor der Teilung des Magens technisch schwierig durchzuführen12,14. Andere Modelle teilen den Magen mit einem Hefter, lassen aber einen großen Beutel, der nicht mit der menschlichen Anatomie nach RYGBübereinstimmt 11. In diesem Modell bieten wir detaillierte Anweisungen zur Durchführung von RYGB mit linearen Heftern in einem Rattenmodell, was zu einem Magenbeutel führt, der der menschlichen Anatomie besser entspricht. Insgesamt war dieses Verfahren mit hervorragenden Überlebensraten und metabolischen Ergebnissen verbunden.
Protokoll
Tierverwendungsprotokolle wurden vom Health Science Animal Care and Use Committee an der University of Alberta (AUP00003000) genehmigt. In Abbildung 1 finden Sie ein Diagramm, das die RYGB-Anatomie demonstriert.
1. Roux-en-Y Magenbypass
- Vorbereitung der Tiere und operativer Aufbau
- Versorgen Sie die Ratten eine Woche vor der Operation zusätzlich zu ihrer festen Ernährung und Wasser mit oraler Rehydratationstherapie und flüssiger Diät, um sie an diese neue Diät zu gewöhnen.
- Schnelle Ratten mit nur Zugang zu Wasser für 12-18 h vor der Operation.
- Stellen Sie sicher, dass Ratten auf einer erhöhten Drahtplattform gefastet werden, damit sie kein Einstreumaterial verbrauchen können.
- Injektion von Ratten mit subkutaner langer Buprenorphin-Retfösefreisetzung (SR) in einer Dosis von 1 mg/kg unmittelbar vor der Operation.
- Autoklaven Sie alle chirurgischen Instrumente, Handtücher und Vorhänge.
- Reinigen Sie die Bedienfläche, das Heizkissen und den Anästhesienasenkegel mit 70% Ethanol.
- Richten Sie die Operationsfläche mit Operationsmikroskop, Anästhesiegerät und Zubehör ergonomisch für den operierenden Chirurgen ein.
- Verwenden Sie ein temperaturgeregeltes Heizkissen und stellen Sie es auf 37 °C ein.
- Legen Sie einen sterilen Vorhang oder ein Handtuch über das Heizkissen.
- Füllen Sie ein 50 ml steriles konisches Röhrchen mit 0,9% Kochsalzlösung.
- Anästhesieinduktion und -vorbereitung
- Induzieren Sie die Anästhesie mit 4% Isofluran gemäß den zuvor festgelegten Protokollen15.
- Drücken Sie den Hinterfuß aller vier Gliedmaßen aus, um sicherzustellen, dass es keine Schmerzreaktion gibt.
- Überprüfen Sie nach 5 Minuten auf ausreichende Anästhesie und Atemfrequenz.
- Tragen Sie Gleitmittel auf beide Augen auf, um ein Austrocknen zu verhindern.
- Rasieren Sie Haare aus dem Bauch.
- Reinigen Sie den Bauch mit einer Povidon-Jod-Lösung. Lassen Sie die Lösung trocknen und wechseln Sie sie in sterile Handschuhe.
- Drapieren Sie die Ratte mit einer Öffnung im Vorhang, um den Bauch freizulegen.
- Legen Sie Instrumente, Nähte, Wattestäbchen und eine 10-ml-Spritze an einem Ort auf, der einen einfachen Zugang während des Eingriffs ermöglicht.
- Mediane Laparotomie
- Machen Sie einen 3 cm großen Schnitt in der oberen Mittellinie des Abdomens mit einem Skalpell, direkt unter dem Xyphoid-Prozess als Orientierungspunkte.
- Teilen Sie mit einer Schere die Faszie und das Peritoneum, wobei Sie darauf achten, die Mittellinie auf der Linea alba zu halten, um Blutungen aus dem Rektus abdominus zu reduzieren. Wenn es Blutungen gibt, kontrollieren Sie es mit Thermischer oder Elektrokauterie.
- Mobilisierung des Magens
- Sezieren Sie mit zwei nassen Wattestäbchen stumpf Magenaufsätze.
- Wenn Sie auf dichte Adhäsionen stoßen, verwenden Sie thermische Kauterie, um Magenansätze vorsichtig zu teilen, um eine Kauterisierung des Magens zu vermeiden. Teilen Sie das Band scharf zwischen dem Magen und dem akzessozierenden Leberlappen, um das Risiko eines Leberrisses bei Magenmobilisierung zu reduzieren.
- Für größere Blutgefäße, insbesondere an den kurzen Magenarterien, ligaieren Sie mit 6-0 Polypropylen-Naht.
- Erstellen Sie ein Fenster auf der rechten distalen Seite der Speiseröhre, aber proximal zur linken Magenarterie. Stellen Sie sicher, dass ein Wattestäbchen nachdreicht in diesen Bereich gelangen kann. Der Magen wird ausreichend mobilisiert, wenn er außerhalb des Bauches äußerlich gemacht werden kann.
- Identifizieren und teilen Sie das Jejunum
- Identifizieren Sie das Band von Treitz, indem Sie dem Jejunum proximal folgen, bis es beobachtet wird, dass es sich um eine Bindung an das Transversalmesokolon handelt.
- Messen Sie 7 cm distally, identifizieren Sie einen Ort zwischen Mesenteric-Gefäßen und teilen Sie den Darm mit einer Mikroschere. Vermeiden Sie Peyers Flecken, wenn Sie den Darm teilen. Achten Sie darauf, nur den Darm und nicht das Mesentery zu teilen.
- Legen Sie einen sauberen, salzhaltigen, getränkten Schwamm vor die Teilung des Darms, um die Kontamination zu minimieren.
- Überprüfen Sie das Vorhandensein eines kleinen Kreuzungsgefäßes im Mesenterium an der Grenze des Dünndarms und teilen Sie es mit Kauter, um Blutungen zu vermeiden.
- Teilen Sie das Mesentery weiter 1 cm in Richtung der Mesenteric-Basis.
- Identifizieren Sie das proximale und distale Jejunum. Legen Sie das proximale Jejunum unter eine nasse Gaze auf der rechten Seite der Ratte und das distale Jejunum auf der linken Seite der Ratte.
- Den Magen heften
- Setzen Sie einen linearen 45-mm-Schneidhefter mit einer Stapelhöhe von 3,5 mm über die weiße Linie des Vormalers ein, um einen kleineren Beutel zu erstellen. Warten Sie 10 s, bevor Sie den Hefter abfeuern.
- Drücken Sie die Heftlinien 1 minute lang mit Gaze auf die Klammerleitungen, um eine Hämostase zu gewährleisten. Wenn die Hämostase nicht allein mit Druck erreicht wird, wird die Blutung entlang der Klammerlinie mit 6-0 Polypropylenfigur von acht Nähten übergenäht.
- Führen Sie ein zweites Klammerfeuer über den Magen in das zuvor erstellte Fenster durch. Warten Sie 10 s, bevor Sie den Hefter abfeuern. Der Druck wird entlang der Klammerlinie gehalten, um eine Hämostase zu gewährleisten, und eine Übernähe kann erforderlich sein.
- Gastrojejunostomie
- Machen Sie eine Gastrotomie unmittelbar nach dem Heften des Magens. Verzögerungen können magenössernen und aspirationen verursachen, da der Magen nach dem zweiten Magenklammern diskontinuierlich ist.
- Erstellen Sie mit einem 11-Klingen-Skalpell eine Gastrotomie am distalen Beutel. Drücken Sie Mageninhalt durch die Gastrotomie aus. Dies ist wichtig, um Magendehnung und Aspiration zu verhindern. Verlängern Sie diese Gastrotomie mit einer Mikroschere auf ca. 5 mm. Die Gastrotomie ist groß genug gemacht, damit die Wattestäbchenspitze einfach durchpasst.
- Mobilisieren Sie das distale Ende des Jejunums neben der Gastrotomie und platzieren Sie es so, dass das Mesenterium nicht verdreht wird.
- Stellen Sie beim Nähen der Anastomose sicher, dass der Darm feucht gehalten wird, indem Sie ihn mit salzgetränkter Gaze bedecken und regelmäßig Kochsalzlösung auftragen.
- Mit 6-0 Polydioxanon oder Polypropylen-Naht eine Bleibsnähte am unteren Rand der Anastomose platzieren und mit einem Schnappschuss vorsichtig zurückziehen. Krawatte mit drei Knoten.
- Legen Sie eine Aufenthaltsnähte am oberen Rand der Anastomose und ziehen Sie sich vorsichtig mit einem Schnappschuss zurück. Krawatte mit sechs Knoten.
- Nähen Sie die vordere Seite der Anastomose kontinuierlich ab und nehmen Sie Bisse von 1 mm Breite und 1 mm Abstand mit Sorgfalt, um zu vermeiden, dass die Rückseite genommen wird.
- Sobald die Naht die untere Haltenäht erreicht hat, binden Sie diese mit weiteren sechs Knoten zusammen.
- Sobald die vordere Seite fertig ist, drehen Sie den Darm und den Magen um und passieren Sie die minderwertige Bleibnähte durch den Mesenteraldefekt. Ziehen Sie den Snap erneut an und ziehen Sie ihn minderwertig zurück.
- Für die hintere Seite der Anastomose, legen Sie volle Dicke unterbrochen 6-0 Nähte, 1 mm breit und 1 mm auseinander, mit Vorsicht, um zu vermeiden, dass die Rückseite genommen wird. Diese sind mit jeweils sechs Knoten gebunden.
HINWEIS: Die vordere Seite der Anastomose wird kontinuierlich vernäht, während die hintere Seite unterbrochen wird. Dies verhindert eine mögliche Striktur oder Stenose, die mit einem kontinuierlichen umfangsschließenden Verschluss verbunden ist. - Überprüfen Sie die Leckage, indem Sie den Luminalinhalt sanft über die Anastomose drücken. Wenn es Bereiche mit Leckagen gibt, verstärken Sie sie vorsichtig mit unterbrochenen Nähten. Achten Sie darauf, die Rückwand nicht zu nehmen, wenn Sie mit zusätzlichen Nähten verstärken.
- Jejunojejunostomie
- Von der Gastrojejunostomie, messen Sie 20 cm distally.
- Erstellen Sie eine Jejunotomie auf der Zeitsenterenteriumsseite mit dem 11-Klingen-Skalpell. Vermeiden Sie es, die Jejunotomie über Peyers Patches zu machen.
- Erweitern Sie diese Jejunotomie mit einer Mikroschere, so dass sie die gleiche Größe wie die biliopankreatische Extremität hat. Stellen Sie sicher, dass ein Wattestäbchen einfach hineinpasst.
- Legen Sie das biliopankreatische Glied so, dass es keine Verdrehung des Mesenterys gibt.
- Führen Sie die Anastomose ähnlich wie die Gastrojejunostomie mit 6-0-Nähten auf der oberen und unteren Seite durch. Die vordere Seite wird mit kontinuierlichen Nähten durchgeführt, während die hintere Seite mit unterbrochenen Nähten durchgeführt wird.
- Stellen Sie sicher, dass der Darm während dieser Anastomose mit Kochsalzlösung feucht gehalten wird.
- Überprüfen Sie auf Leckagen, indem Sie den Luminalinhalt sanft durch die Anastomose drücken. Wenn es Bereiche mit Leckagen gibt, verstärken Sie sie mit unterbrochenen Nähten.
- Positionieren Sie Darm und Magen neu
- Stellen Sie sicher, dass der Beutel, der Restmagen oder die Leber nicht verdreht werden. Stellen Sie sicher, dass der linke Leberlappen vor dem Magen liegt und nicht hinter dem Beutel eingeschlossen ist, da dies zu kompressiver Leberischämie führen kann.
- Positionieren Sie den Darm im Bauch in seiner natürlichen Position, so dass es keine Verdrehung gibt.
- Bauchverschluss
- Schließen Sie die Faszie kontinuierlich mit 3-0 Polyglactin. 3-0 Polydioxanon kann ebenfalls verwendet werden.
- Schließen Sie die Haut mit 2-0 Seide in einer kontinuierlichen Weise.
- Anästhesie-Emergenz
- Verringern Sie Isofluran auf Null, aber setzen Sie den zusätzlichen Sauerstoff fort.
- Verabreichen Sie ein Lokalanästhetikum als Spritzblock auf den Schnitt.
- Verabreichen Sie 10 ml subkutane 5% Dextrose in normaler Kochsalzlösung (D5NS) im Unterhautgewebe hinter dem Hals.
- Legen Sie ein elisabethanisches Rattenhalsband an, bevor die Ratte vollständig wach ist. Achten Sie darauf, es eng zu passen, aber nicht zu eng, um Beschwerden zu verursachen.
HINWEIS: Das Halsband wird bis zum 5. Tag aufbewahrt, um eine Wunddehiszenz zu verhindern.
2. Scheinchirurgie
HINWEIS: Die Scheinoperation wird ähnlich wie RYGB durchgeführt, es werden jedoch keine Anastomosen durchgeführt.
- Eine Gastrotomie wird erstellt und dann mit 6-0 Polydioxanon- oder Polypropylennähten verschlossen.
- Eine Jejunotomie wird 7 cm distal zum Band von Treitz angelegt und dann mit 6-0 Polydioxanon- oder Polypropylennähten verschlossen.
3. Nachsorge
- Postoperative Versorgung
- Beherbergen Sie Ratten einzeln und halten Sie sie auf erhöhten Drahtplattformen, bis wieder feste Nahrung eingeführt wird, um den Verzehr von Einstreu und luminaler Obstruktion zu verhindern.
HINWEIS: Die postoperative Diät wird allmählich wieder aufgenommen, da Ödeme bei der Gastrojejunostomie eine Obstruktion mit der frühen Wiederaufnahme einer festen Ernährung verursachen können. - Untersuchen Sie die Füße täglich, während sich Ratten auf erhöhten Drahtplattformen auf Hautveränderungen befinden.
- Halten Sie Ratten für die ersten 72 Stunden auf Wasser und orale Rehydratationstherapie-Diät.
- Verabreichen Sie 10 ml D5NS alle 12 h für die ersten 72 h.
- Subkutanes kurzwirksames Buprenorphin in Höhe von 0,01 mg/kg verabreichen, wenn Ratten Schmerzen zu haben scheinen. Die Ratten-Grimast-Skala wird verwendet, um Schmerzen zu beurteilen16.
- Fügen Sie am postoperativen Tag 3 eine flüssige Nagetierdiät hinzu. Stellen Sie weiterhin Wasser und orale Rehydratationstherapie zur Verfügung.
- Starten Sie am postoperativen Tag 5 die fettreiche Diät neu. Stellen Sie weiterhin Wasser und flüssige Ernährung zur Verfügung. Entfernen Sie das elisabethanische Halsband.
- Brechen Sie am postoperativen Tag 7 die flüssige Diät ab.
- Entfernen Sie die Hautnähte am postoperativen Tag 10-14.
- Beherbergen Sie Ratten einzeln und halten Sie sie auf erhöhten Drahtplattformen, bis wieder feste Nahrung eingeführt wird, um den Verzehr von Einstreu und luminaler Obstruktion zu verhindern.
Ergebnisse
Tiere und Unterbringung
36 männliche Wistar-Ratten wurden paarweise untergebracht und ab einem Alter von sechs Wochen mit 60% steriler Nagetier-Fettreicher diät gefüttert(Abbildung 2). Im Alter von 16 Wochen unterzogen sie sich einer RYGB- oder Scheinoperation. Nach der ersten postoperativen Woche wurden die Ratten wieder fettreich ernährt. Die Hälfte der Ratten wurde nach 2 Wochen postoperativ eingeschläfert und die andere Hälfte nach 14 Wochen postoperativ eingeschläfert.
Sterblichkeit
Insgesamt überlebten 33 (91,7%) Ratten den geplanten Studienendpunkt. Alle Ratten, die sich einer frühen Euthanasie unterzogen, wurden von einem Tierarzt nekropsisch untersucht. Zwei Ratten wurden innerhalb von 24 Stunden eingeschläfert. Ein RYGB hatte eine Aspirationspneumonitis und eine Scheinratte hatte eine fasziale Dehiszenz mit unheilbarem Darm. Eine weitere RYGB-Ratte wurde nach zwei Wochen aufgrund eines anastomotischen Lecks aus der Gastrojejunostomie eingeschläfert. Insgesamt überlebten 88,9% der RYGB-Ratten den Studienendpunkt.
Körpergewicht
Ratten, die sich RYGB unterzogen, hatten ein geringeres postoperatives Gewicht als Scheinratten. Abbildung 3 zeigt die absoluten Gewichte für Ratten postoperativ, während Abbildung 4 eine postoperative prozentuale Gewichtsänderung zeigt, die zu allen Zeitpunkten postoperativ statistisch signifikant war. Nach 14 Wochen hatten Ratten, die RYGB hatten, eine mittlere prozentuale Gewichtsveränderung von 6,4%, während Ratten mit Scheinoperation 23,7% (p = 0,0001) auftenten.
Intraperitoneale Glukosetoleranztests
Der Nüchternblutzucker unterschied sich zwischen keiner der Kohorten signifikant. Der Bereich unter der Kurve war jedoch bei RYGB im Vergleich zu Schein nach 13 Wochen signifikant niedriger (18,1 vs. 23,8 mmol-h/L, p=0,046, Abbildung 5),war aber für RYGB vs. Sham nach 1 Woche gleich (20,8 vs. 23,3 mmol-h/L, p=0,68).
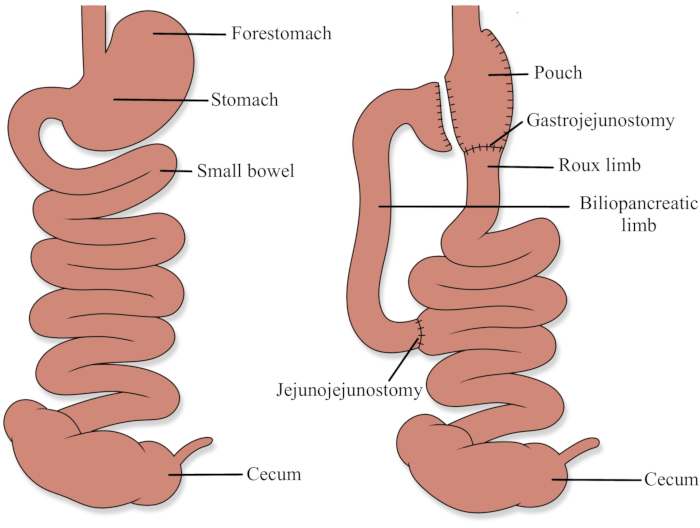
Abbildung 1: Roux-en-Y Magenbypass-Anatomie Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Präoperatives absolutes Gewicht bei fettreicher Diät; RYGB, Roux-en-Y Magenbypass Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Postoperatives absolutes Gewicht bei fettreicher Ernährung; RYGB, Roux-en-Y Magenbypass Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Postoperative prozentuale Gewichtsänderung bei fettreicher Ernährung; RYGB, Roux-en-Y Magenbypass Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Intraperitoneale Glukosetoleranztests im Magenbypass vs. Schein nach 13 Wochen. RYGB, Roux-en-Y Magenbypass Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
RYGB beinhaltet die Schaffung eines kleinen Magenbeutels (weniger als 30 ml) und die Schaffung eines biliopankreatischen Glieds und eines Roux-Glieds (Abbildung 1). Beim Menschen ist die biliopankreatische Extremität typischerweise 30 bis 50 cm groß und transportiert Sekrete aus dem Magenrest, der Leber und der Bauchspeicheldrüse. Das Roux-Glied ist typischerweise 75 bis 150 cm lang und ist der primäre Kanal für die Aufnahme von Nahrung. Der gemeinsame Kanal ist der verbleibende Dünndarm distal zu der Stelle, an der sich die beiden Gliedmaßen verbinden und wo der Großteil der Verdauung und Absorption stattfindet, da sich Pankreasenzyme und Galle mit aufgenommener Nahrung vermischen17.
Der Mechanismus der Gewichtsabnahme in RYGB ist multimodal. Der kleine Magenbeutel reduziert die Nahrungsaufnahme durch mechanische Einschränkung. Der Bypass führt zu einer malabsorptiven Komponente, da ein erheblicher Teil des Dünndarms keine Kalorien und Nährstoffe aufnimmt. In jüngerer Zeit haben Studien gezeigt, dass Darmhormone auch nach RYGB eine wichtige Rolle bei der Gewichtsabnahme spielen. Diese sind hauptsächlich durch Ghrelin, Peptid-YY, Cholecystokinin (CCK) und GLP-1 Hormonwege18.
Rattenmodelle bieten eine leistungsstarke Methode, um die Mechanismen hinter dem Gewicht und den metabolischen Auswirkungen von RYGB zu untersuchen. In diesem Artikel stellen wir ein RYGB-Protokoll vor, das eine niedrige Mortalität mit signifikantem Gewichtsverlust und metabolischen Effekten aufweist. Sobald sich der Bediener mit der Technik vertraut gemacht hatte, dauerte der Eingriff etwa 90 Minuten. Das Protokoll kann auch mit längeren biliopankreatischen und Roux-Gliedmaßenlängen modifiziert werden, um möglicherweise den Gewichtsverlust und die metabolische Wirkung zu erhöhen. Darüber hinaus ist es technisch praktikabler als andere Modelle, da es die Verwendung von chirurgischen Heftern ermöglicht, um Hämostase zu erreichen und die Operationszeit zu minimieren. Modelle, die auf eine scharfe Teilung des Magens ohne Heften angewiesen sind, führen aufgrund eines signifikanten Blutverlustes oft zu einer höheren Mortalität. Die technischen Fähigkeiten, die für die Durchführung des Verfahrens erforderlich waren, waren relativ einfach zu erwerben, und die Lernenden konnten das Verfahren nach etwa fünf bis zehn Nicht-Wiederherstellungsverfahren bequem durchführen.
Einer der kritischen Schritte dieses Protokolls ist die Begrenzung des Blutverlusts während der Mobilisierung des Magens. Die sorgfältige Verwendung von thermischer Kauterie in Kombination mit der Nahtligatur der Gefäße ist wichtig. Es ist auch wichtig, mindestens die Hälfte des Umfangs der Anastomosen unterbrochen durchzuführen. Dies verhindert eine übermäßige Verengung an den Anastomosen. Darüber hinaus ist die Überprüfung auf Leckagen von entscheidender Bedeutung, da diese zu Sepsis und Tod führen können. Vor dem Schließen des Abdomens ist es wichtig, dass der linke Leberlappen in seine natürliche, vordere Position gebracht wird und dass es keine Rotation im Darm oder magen gibt, da dies zu viszeraler Ischämie führen kann.
Die postoperative Versorgung ist für dieses Protokoll von entscheidender Bedeutung. Erhöhte Drahtplattformen sind sowohl während der Fasten- als auch in der postoperativen Periode erforderlich, da der Verbrauch von festem Material zu anastomotischen Hindernissen führt. Es ist von entscheidender Bedeutung, subkutane Flüssigkeit bereitzustellen, da die Ratten in der unmittelbaren postoperativen Phase möglicherweise keine oralen Flüssigkeiten vertragen. Die Ratten sollten an die orale Rehydratationstherapie und die flüssige Diät gewöhnt werden, da Ratten aufgrund von Assoziationen mit postoperativen Schmerzen neue Diäten vermeiden können. Dieses Ernährungsprotokoll trägt sowohl in der RYGB- als auch in der Scheinkohorte zu einem signifikanten Gewichtsverlust in der unmittelbaren postoperativen Phase bei, und die Gewichtserholung in der Scheingruppe dauerte etwa fünf Wochen. Die strikte Einhaltung dieses postoperativen Protokolls ist jedoch unerlässlich, um die Morbidität und Mortalität nach RYGB zu reduzieren. Darüber hinaus ist eine häufige Untersuchung der Ratten mit der Ratten-Grimassenskala wichtig, um Morbidität zu erkennen. In unserer Studie entwickelte eine Ratte ein spätes anastomotisches Leck, das mit dieser Skala schnell entdeckt wurde und eine frühe Euthanasie ermöglichte, um das Leiden zu reduzieren.
Einer der Vorteile dieser Methode ist, dass sie durch die Verwendung von chirurgischen Heftern zu einem kleineren Beutel führt, um Magenblutungen zu reduzieren. Wenn wir versuchten, den Magen ohne Hefter scharf zu teilen, führt dies zu übermäßigen Blutungen und einer viel höheren Sterblichkeitsrate. Dies führt jedoch auch zur Entfernung des Vormalms, was zu physiologischen Veränderungen führen kann, die sich von denen des menschlichen RYGB unterscheiden. Der Voromach ist jedoch einzigartig für Nagetiere und enthält keine Drüsen und sollte keine Veränderungen der Darmhormone verursachen.
Die wichtigste Einschränkung dieser Methode ist, dass sie zwei chirurgische Hefter-Nachladungen pro Ratte erfordert, was teuer sein kann. Hervorragende Überlebensergebnisse können jedoch die Kosten senken, da weniger Ratten für eine Studie benötigt werden, was zu einer besseren Nutzung von Haltungseinrichtungen, chirurgischen Geräten und Forschungspersonal führt.
Offenlegungen
Ethicon lieferte zwei lineare 45-mm-Schneidhefter, mehrere 3,5-mm-Hefter-Nachladungen und 6-0-Polypropylen-Nähte. Autoren haben keine weiteren Interessenkonflikte zu erklären.
Danksagungen
Diese Studie wurde vom American Society for Metabolic and Bariatric Surgery Research Award finanziert. Ethicon lieferte gnädig Nähte, Hefter und Clips. Die Doktorarbeit des Hauptautors wurde vom University of Alberta Clinician Investigator Program und dem Alberta Innovates Clinician Fellowship finanziert. Wir möchten uns auch bei Michelle Tran für ihre medizinische Illustration der RYGB-Anatomie bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-0 Silk Sutures | Ethicon | K533 | |
| 3-0 Vicryl Sutures | Ethicon | J219H | |
| 4% Isoflurane | N/A | N/A | |
| 5% Dextrose and 0.9% Sodium Chloride Solution - 1000 mL | Baxter | 2B1064 | |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| 6-0 Prolene Sutures | Ethicon | 8805H | |
| Anesthetic Machine | N/A | N/A | |
| Animal Hair Shaver | N/A | N/A | |
| Betadine Solution | N/A | N/A | |
| Castrojievo Needle Holder with lock 14 cm (smooth curved) | World Precision Instruments | 503258 | |
| ECHELON FLEX Articulating Endoscopic Linear Cutter | Ethicon | EC45A | |
| Economy Tweezers #4 | World Precision Instruments | 501978 | |
| ENDOPATH ETS Articulating Linear Cutter 45mm Reloads | Ethicon | 6R45B | |
| Far Infrared Warming Pad Controller with warming pad (15.2 cm W x 20.3 cm L), pad temperature probe, and 10 disposable, non-sterile sleeve protectors | Kent Scientific | RT-0515 | |
| Large Rat Elizabethan Collar | Kent Scientific | EC404VL-10 | |
| Liquid Diet Feeding Tube (150 mL) | Bio-Serv | 9007 | |
| Liquid Diet Feeding Tube Holder (short adjustable) | Bio-Serv | 9015 | |
| Micro Mosquito Forceps | World Precision Instruments | 500452 | |
| Micro Scissors | World Precision Instruments | 503365 | |
| Mouse Diet, High Fat Fat Calories (60%), Soft Pellets | Bio-Serv | S3282 | |
| No. 11 Blade and Scalpel Handle | N/A | N/A | |
| OPMI Vario Surgical Microscope | ZEISS | S88 | |
| Raised Floor Grid | Tecniplast | GM500150 Raised Floor Grid | |
| Rodent Liquid Diet, Lieber-DeCarli '82, Control, 4 Liters/Bag | Bio-Serv | F1259 | |
| Sodium Chloride Irrigation 0.9% Solution - 500 mL | Baxter | JF7633 | |
| Sterile Cotton Swabs | N/A | N/A | |
| Sterile Drape | N/A | N/A | |
| Sterile Towel | N/A | N/A | |
| Thermal Cautery Unit | World Precision Instruments | 501293 |
Referenzen
- Courcoulas, A. P., et al. Three-year outcomes of bariatric surgery vs lifestyle intervention for type 2 diabetes mellitus treatment. JAMA Surgery. 15213 (10), 1-9 (2015).
- Ardestani, A., Rhoads, D., Tavakkoli, A. Insulin cessation and diabetes remission after bariatric surgery in adults with insulin-treated type 2 diabetes. Diabetes Care. 38 (4), 659-664 (2015).
- Casella, G., et al. Ten-year duration of type 2 diabetes as prognostic factor for remission after sleeve gastrectomy. Surgery for Obesity and Related Diseases. 7 (6), 697-702 (2011).
- Panunzi, S., De Gaetano, A., Carnicelli, A., Mingrone, G. Predictors of remission of diabetes mellitus in severely obese individuals undergoing bariatric surgery. Annals of Surgery. 261 (3), 459-467 (2015).
- Edelman, S., et al. Control of type 2 diabetes after 1 year of laparoscopic adjustable gastric banding in the helping evaluate reduction in obesity (HERO) study. Diabetes, Obesity and Metabolism. 16 (10), 1009-1015 (2014).
- Mingrone, G., et al. Metabolic surgery versus conventional medical therapy in patients with type 2 diabetes: 10-year follow-up of an open-label, single-centre, randomised controlled trial. The Lancet. 397 (10271), 293-304 (2021).
- Thaler, J. P., Cummings, D. E. Minireview: Hormonal and metabolic mechanisms of diabetes remission after gastrointestinal surgery. Endocrinology. 150 (6), 2518-2525 (2009).
- Mingrone, G., Castagneto-Gissey, L. Mechanisms of early improvement / resolution of type 2 diabetes after bariatric surgery. Diabetes and Metabolism. 35 (6), 518-523 (2009).
- Arapis, K., et al. Remodeling of the residual gastric mucosa after Roux-en-Y gastric bypass or vertical sleeve gastrectomy in diet-induced obese rats. PloS One. 10 (3), 012414 (2015).
- Bruinsma, B. G., Uygun, K., Yarmush, M. L., Saeidi, N. Surgical models of Roux-en-Y gastric bypass surgery and sleeve gastrectomy in rats and mice. Nature Protocols. 10 (3), 495-507 (2015).
- Bueter, M., et al. Roux-en-Y gastric bypass operation in rats protocol. Journal of visualized experiments : JoVE. (64), (2012).
- Stevenson, M., Lee, J., Lau, R. G., Brathwaite, C. E. M., Ragolia, L. Surgical mouse models of vertical sleeve gastrectomy and Roux-en Y gastric bypass: a Review. Obesity Surgery. , (2019).
- Hao, Z., et al. Reprogramming of defended body weight after Roux-En-Y gastric bypass surgery in diet-induced obese mice. Obesity. 24 (3), 654-660 (2016).
- Adult rodent anesthesia SOP. UBC Animal Care Guidelines Available from: https://animalcare.ubc.ca/sites/default/files/documents/ACC-01-2017_Anesthesia.pdf (2017)
- Sotocinal, S. G., et al. The Rat Grimace Scale: a partially automated method for quantifying pain in the laboratory rat via facial expressions. Molecular pain. , 1-10 (2011).
- Elder, K. A., Wolfe, B. M. Bariatric surgery: A review of procedures and outcomes. Gastroenterology. 132 (6), 2253-2271 (2007).
- Bariatric procedures for the management of severe obesity: Descriptions. UpToDate Available from: https://www-uptodate-com.remotexs.ntu.edu.sg/ (2017)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten