Method Article
Determinação de Aulas De Lipídios e Lipídios Totais em Amostras Marinhas
Neste Artigo
Resumo
Este protocolo é para a determinação de lipídios na água do mar e espécimes biológicos. Lipídios em filtrados são extraídos com clorofórmio ou misturas de clorofórmio e metanol no caso de sólidos. As classes lipídicas são medidas pela cromatografia de camada fina da haste com detecção de ionização de chamas e sua soma dá o teor lipíduo total.
Resumo
Os lipídios são em grande parte compostos de carbono e hidrogênio e, portanto, fornecem uma energia específica maior do que outras macromoléculas orgânicas no mar. Por serem ricos em carbono e hidrogênio, eles também são hidrofóbicos e podem atuar como um portador de solvente e absorção de contaminantes orgânicos e, portanto, podem ser condutores de bioacumulação poluente em ecossistemas marinhos. Sua natureza hidrofóbica facilita seu isolamento da água do mar ou espécimes biológicos: a análise lipídica marinha começa com a amostragem e, em seguida, a extração em solventes orgânicos não polares, fornecendo um método conveniente para sua separação de outras substâncias em uma matriz aquática.
Se a água do mar foi amostrada, o primeiro passo geralmente envolve a separação em facções 'dissolvidas' e 'partículas' definidas operacionalmente por filtragem. Amostras são coletadas e lipídios isolados da matriz amostral tipicamente com clorofórmio para matéria verdadeiramente dissolvida e coloides, e com misturas de clorofórmio e metanol para sólidos e espécimes biológicos. Esses extratos podem conter várias classes de fontes biogênicas e antropogênicas. Neste momento, podem ser determinados lipídios totais e classes lipídicas. O lipídio total pode ser medido somando classes lipídicas individualmente determinadas que normalmente foram separadas cromatograficamente. A cromatografia de camada fina (TLC) com detecção de ionização de chamas (FID) é regularmente utilizada para a análise quantitativa de lipídios a partir de amostras marinhas. O TLC-FID fornece informações de classe lipídica sinóptica e, por meio de aulas de resumição, uma medição lipídica total.
As informações de classe lipídica são especialmente úteis quando combinadas com medidas de componentes individuais, por exemplo, ácidos graxos e/ou esteróis, após sua liberação de extratos lipídicos. A grande variedade de estruturas e funções lipídicas significa que elas são amplamente utilizadas em pesquisas ecológicas e biogeoquímicas que avaliam a saúde do ecossistema e o grau de influência por impactos antropogênicos. Eles têm sido empregados para medir substâncias de valor dietético à fauna marinha (por exemplo, aquafeeds e/ou presas), e como um indicador da qualidade da água (por exemplo, hidrocarbonetos).
Introdução
Os métodos aqui descritos dizem respeito a substâncias que são definidas operacionalmente como lipídios marinhos. Esta definição baseia-se em sua comodidade à extração líquido-líquido em solventes orgânicos não polares, e fornece um método conveniente para sua separação de outras substâncias em uma matriz aquática. Sua natureza hidrofóbica facilita seu isolamento da água do mar ou espécimes biológicos, bem como seu enriquecimento, e a remoção de sais e proteínas.
A medição do conteúdo lipídado e sua composição em organismos marinhos tem sido de grande interesse em ecologia alimentar, nutrição de aquicultura e ciência alimentar há décadas. Lipídios são componentes universais em organismos vivos, agindo como moléculas essenciais nas membranas celulares, como principais fontes de energia biodispondiária, fornecendo isolamento térmico e flutuação, e servindo como moléculas de sinalização. Embora os procedimentos para a determinação lipídica em outros campos tenham sido bem descritos, seu uso com amostras marinhas geralmente requer modificações para se adaptar às condições de campo, bem como ao tipo de amostra1.
Para amostras de água do mar, o primeiro passo geralmente requer a separação nas frações operacionalmente definidas de 'dissolvido' e 'partículas', normalmente por filtragem (Protocolo passo 1). A fração de partículas é o que é retido pelo filtro, e o tamanho dos poros é importante na definição do corte2. Muitas vezes, quando estamos amostrando material particulado, gostaríamos de relacionar concentrações lipídicas a concentrações totais de massa, nesse caso uma amostra separada, menor, (por exemplo, 10 mL) tem que ser tomada para este fim (Protocolo passo 1, nota). Para obter uma determinação de massa precisa é importante adicionar formato de amônio (35 g/L) no final da filtragem.
O filtrado de água do mar da amostra maior deve variar entre 250 mL e 1 L, dependendo do tipo de amostra e é submetido à extração líquido-líquido em um funil separador (Protocolo passo 2). A natureza hidrofóbica dos lipídios significa que eles podem ser separados de outros compostos por extração em um solvente não-polar, como clorofórmio. Um sistema de duas camadas é criado onde os lipídios se particionam na camada orgânica, enquanto os componentes solúveis em água permanecem na camada aquosa.
Amostras de partículas em um filtro, ou amostras biológicas são extraídas com uma extração folch et al.modificada 3,também envolvendo clorofórmio (Protocolo passo 3). Mais uma vez, um sistema orgânico/aquoso é criado no qual os lipídios se particionam para a fase orgânica, enquanto moléculas solúveis em água permanecem na fase aquosa, e as proteínas são precipitadas. De fato, para sólidos, a maioria dos laboratórios utiliza alguma variação do procedimento folch et al. extração3 envolvendo clorofórmio e metanol. Para filtros, o primeiro passo é homogeneizar em 2 mL de clorofórmio e 1 mL de metanol.
Durante a extração, deve-se tomar cuidado para proteger os lipídios de modificações químicas ou enzimáticas, mantendo amostras e solventes no gelo para reduzir a hidrólise da ligação éster ou a oxidação de ligação carbono-carbono. Tecidos e lipídios celulares são bastante bem protegidos por antioxidantes naturais e por compartimentação4; no entanto, após a homogeneização das amostras, o conteúdo celular é combinado tornando lipídios mais dispostos à alteração, quimicamente ou enzimaticamente. Alguns lipídios, como a maioria dos esteróis, são muito estáveis, enquanto outros, como os que contêm ácidos graxos poli-insaturados, são mais suscetíveis à oxidação química. Outros, como esteróis com ligações duplas conjugadas, são propensos à oxidação catalisada pela luz5. Após extrações, lipídios são muito mais suscetíveis à oxidação química, e as amostras devem ser armazenadas sob um gás inerte, como nitrogênio. Um fluxo suave de nitrogênio também seria usado para concentrar extratos.
Após a concentração, os lipídios seriam normalmente quantificados a granel, pois são um componente importante dos ecossistemas marinhos que proporcionam uma alta concentração de energia, mais que o dobro do kJ/g de carboidratos e proteínas. Invariavelmente, eles seriam quantificados em seguida como componentes individuais: a análise abrangente dos lipídios geralmente envolve a separação em categorias mais simples, de acordo com sua natureza química. Assim, uma análise completa envolve a medição de lipídios totais, classes lipídicas e compostos individuais.
O lipídio total pode ser determinado tomando a soma das classes lipídicas medidas individualmente separadas pela cromatografia6. Um extrato lipídeto marinho pode conter mais de uma dúzia de classes de fontes biogênicas e antropogênicas. A grande variedade de estruturas lipídicas significa que muita informação pode ser obtida determinando agrupamentos individuais de estruturas. As classes lipídicas individualmente, ou em certos grupos, têm sido utilizadas para sinalizar a presença de certos tipos de organismos, bem como seu estado fisiológico e atividade2. Eles também têm sido usados como um indicador das origens dos materiais orgânicos, incluindo matéria orgânica dissolvida (DOM), bem como contaminantes hidrofóbicos.
Triacilglycerols, fosfolipídios e esteróis estão entre as classes lipídicas biogênicas mais importantes. Os dois primeiros estão bioquimicamente relacionados, pois possuem uma espinha dorsal glicerol à qual dois ou três ácidos graxos são esterificados(Figura 1). Triacylglycerols, juntamente com ésteres de cera são substâncias de armazenamento muito importantes, enquanto outras classes lipídicas contendo ácidos graxos, como diacilicoglicerols, ácidos graxos livres e monoacírgicos são geralmente constituintes menores. Os ácidos graxos livres estão presentes em concentrações mais baixas em organismos vivos, pois os insaturados podem ser tóxicos7. Esteróis (tanto em suas formas livres quanto esterificadas) e álcoois gordurosos também estão incluídos entre os lipídios menos polares, enquanto glicólipídios e fosfolipídios são lipídios polares. Os lipídios polares têm um grupo hidrofílico, que permite a formação de bicamadas lipídicas encontradas em membranas celulares. Esteróis livres também são componentes estruturais de membrana, e quando tomados em relação aos triacylglices fornecem uma condição ou índice nutricional (TAG : ST) que tem sido amplamente utilizado8. Quando tomados em razão para fosfolipídios (ST : PL) podem ser usados para indicar sensibilidade da planta ao sal: valores mais elevados mantêm a integridade estrutural e diminuem a permeabilidade da membrana9. O inverso dessa razão (PL : ST) tem sido estudado em tecidos bivalve durante a adaptação da temperatura10.
As classes lipídicas marinhas podem ser separadas por cromatografia de camada fina (TLC) em hastes revestidas de gel de sílica (Protocolo passo 4) e, em seguida, detectadas e quantificadas pela detecção de ionização de chama (FID) em um scanner FID automático. O TLC/FID tornou-se rotineiramente usado para amostras marinhas, pois fornece rapidamente dados de classe lipídica sinóptica de pequenas amostras, e ao tomar a soma de todas as classes, um valor para lipídios totais. O TLC/FID foi submetido a uma avaliação de garantia de qualidade (QA) e foi encontrado para atender aos padrões necessários para calibração externa consistente, baixos espaços em branco e análise precisa de replicação11. Os coeficientes de variação (CV) ou desvios padrão relativos estão em torno de 10%, e os dados lipídicos totais do scanner FID são normalmente cerca de 90% daqueles obtidos por gravimétricos e outros métodos2. A gravimetria dá lipídios totais mais elevados provavelmente porque o scanner FID mede apenas compostos não voláteis, e também como resultado da possível inclusão de material não lipídico em medidas gravimétricas.
As informações fornecidas pela análise da classe lipídica são especialmente úteis quando combinadas com determinações de ácidos graxos como indivíduos, ou esteróis, ou os dois em combinação. O primeiro passo para essas análises envolve a liberação de todos os ácidos graxos componentes juntamente com esteróis nos extratos lipídicos (Protocolo passo 5). A grande variedade de estruturas e funções lipídicas significa que eles têm visto amplo uso em estudos ecológicos e biogeoquímicos que avaliam a saúde do ecossistema e até que ponto foram influenciados por insumos antropogênicos e terrestres. Eles têm sido usados para medir a biossíntese de substâncias de valor dietético para a fauna marinha, bem como para indicar a qualidade das amostras de água. Medir lipídios em amostras de núcleos de sedimentos ajuda a mostrar a sensibilidade dos sedimentos às mudanças no uso da terra humana perto da margem terrestre-marítima.
A principal ferramenta para identificar e quantificar compostos lipídicos individuais tem sido tradicionalmente cromatografia gasosa (GC) com FID. Antes da análise, porém, esses compostos são mais voláteis por derivatização. Os ácidos graxos são liberados na presença de um catalisador ácido (H2SO4) das classes lipídicas aciis(Figura 1). Em química orgânica, o grupo acil (R-C=O) é geralmente derivado de um ácido carboxílico (R-COOH). Eles são então reestrificados para ésteres de metila ácidos graxos (FAME) que dá melhores separações nas colunas GC (Protocolo passo 5).
Protocolo
NOTA: Para limpar vidros, instrumentos e filtros para análises lipídicas, lave-os 3 vezes com metanol seguido de 3 lavagens com clorofórmio, ou aqueça-as a 450°C por pelo menos 8 horas.
1. Procedimento de filtragem para água do mar dissolvido e lipídios particulados
NOTA: A fração específica de interesse é definida operacionalmente pelo procedimento de filtragem. Neste caso, o tamanho dos poros é de 1,2 μm.
- Configure o coletor de filtragem sem filtro e enxágue a configuração com água do mar filtrada.
- O uso de fórceps limpos coloca um filtro de fibra de vidro de 47 mm (GF/C), que foi lavado, no sistema de filtragem limpo.
- Pegue a amostra e gire suavemente para resuspensar qualquer material que possa ter se instalado no fundo do recipiente de coleta. Meça com precisão um volume conhecido, neste caso 1 L, e filtre-o através do filtro.
NOTA: O volume dependerá da quantidade de material particulado na amostra: geralmente entre 250 mL e 5 L, dependendo da estação e localização. - Quando a amostra for medida, molhe suavemente o filtro com água do mar filtrada. Adicione toda a amostra lentamente ao sistema de filtragem e enxágue o cilindro graduado com água do mar filtrada para garantir que todas as partículas sejam adicionadas ao filtro. Enxágüe a configuração com água do mar filtrada nas laterais para garantir que todas as partículas sejam enxaguadas no filtro.
- Permita que toda a água do mar passe pelo filtro, mas não permita que o filtro seque completamente, pois pode interromper as células do filtro; quebrar a sucção como o último da água desaparece.
- Usando fórceps limpos e uma pipeta limpa, dobre o filtro ao meio, em seguida, em terços e, em seguida, ao meio do comprimento para enrolar o filtro em um tubo. Coloque-o em um frasco de vidro limpo e rotulado de 10 mL.
- Cubra o filtro com 2 mL de clorofórmio. Encha o espaço da cabeça com nitrogênio e vedação com fita PTFE. Coloque em um rack em um congelador de -20 °C. As amostras serão estáveis a esta temperatura até um ano.
NOTA: Para relacionar as concentrações lipídicas com concentrações totais de massa, também é necessária uma medição de peso seco. Isso envolve colocar um filtro pré-pesado de 24 mm em uma configuração de filtragem de peso seco, mexer a amostra e tomar uma pequena subsampleção que é filtrada sobre o pequeno filtro. Quando o filtro está quase seco, cerca de 10 mL de formato de amônio de 3,5% são adicionados ao filtro. O filtro é dobrado ao meio, devolvido a uma placa de Petri rotulada e colocado em um congelador.
2. Extração líquido-líquido de água do mar ou amostras líquidas
-
Preparando a amostra
- Meça um volume conhecido de filtrado em um cilindro de vidro limpo lipídedo graduado. Coloque esta amostra em um funil separador de 1 L limpo. Em seguida, adicione 20 mL de clorofórmio à amostra e agite por 2 minutos, ventando com frequência.
-
Remoção do primeiro extrato e adição de ácido após a primeira separação
- Enrole o funil em papel alumínio e espere de 5 a 10 minutos para que a separação ocorra. Retire a parte inferior da folha para ver as duas camadas. Colete a parte inferior, camada orgânica através da torneira em um frasco redondo limpo, tomando cuidado para não incluir nenhuma camada superior. Tampe o frasco de fundo redondo sob nitrogênio e coloque no congelador.
- Adicione 0,25 mL de H2SO4 concentrado para cada litro de amostra, à amostra no funil separador e agite o funil suavemente.
- Adicione 10 mL de clorofórmio e agite vigorosamente por 2 minutos enquanto ventilar com frequência. Permita que a separação ocorra.
-
Segunda e terceira separações
- Aguarde a separação e adicione a camada inferior no frasco de fundo redondo.
- Adicione um terço de 10 mL de clorofórmio, e agite por 2 minutos, novamente ventando com frequência. Após a separação, adicione a camada inferior ao frasco de fundo redondo.
- Transfira o extrato no frasco de fundo redondo para um evaporador rotativo, evapore e transfira para um frasco de 2 mL.
3. Protocolo de extração de sólidos (extração modificada de Folch et al.3)
-
Configuração
NOTA: A configuração de extração requer um recipiente isolado cheio de gelo. Os solventes incluem metanol, água extraída de clorofórmio e clorofórmio 2:1:metanol. Todos os solventes devem ser colocados no gelo para que estejam frios quando as extrações forem iniciadas. As amostras também vão para o gelo, para que tudo permaneça frio.- Enxágüe todos os tubos e tampas forradas de PTFE 3 vezes com metanol e depois 3 vezes com clorofórmio. Um tubo de centrífuga e um frasco de 15 mL com tampa são necessários para cada extração.
- Coloque a amostra em um tubo de centrífuga contendo 2 mL de clorofórmio. O tamanho da amostra depende da quantidade de lipídio presente, aproximadamente 5 a 10 mg de lipídio preferido.
-
Moagem e extração
- Adicione aproximadamente 1 mL de metanol gelado e triture a amostra em uma polpa rapidamente com um homogeneizador limpo ou haste de ptfe/metal..
- Lave a haste de volta no tubo com aproximadamente 1 mL de clorofórmio gelado 2:1: metanol e depois com 1/2 mL de água extraída de clorofórmio gelado. Se necessário, use um conjunto limpo de fórceps para forçar as partículas de volta ao frasco antes de lavar. Tampe o tubo e sonicar a mistura por 4 minutos em um banho ultrassônico (35 - 42 kHz).
-
Pipetação dupla: Centrifugar a amostra por 2 min a 1800 × g. Colete toda a camada orgânica (camada inferior) usando a técnica de pipetação dupla na qual uma pipeta de 5 3/4" com a lâmpada acesa livremente é suavemente empurrada através das duas camadas, enquanto aperta a lâmpada, fazendo com que bolhas saiam.
- Quando a parte inferior da segunda camada for atingida, use o polegar para remover a lâmpada sem desenhar a camada orgânica na pipeta. Coloque uma pipeta de 9" dentro da de 5 3/4" e remova a camada inferior através da pipeta de 5 3/4".
- Coloque o extrato em um frasco limpo. Continue a tirar a camada inferior até que tudo seja removido.
-
Pipetas de lavagem: Enxágue a pipeta de 9" no frasco contendo a camada orgânica usando 1,5 mL de clorofórmio gelado para lavar a parte externa da pipeta e 1,5 mL para lavar por dentro. Gire suavemente essa pipeta durante a lavagem e certifique-se de que todo o clorofórmio escorre pela pipeta em frasco.
- Enxágüe a pipeta de 5 3/4" no tubo contendo a camada aquosa da mesma forma.
- Sonicato e centrifugar as amostras e pipeta dupla quando separados, usando novas pipetas cada vez. Repita pelo menos três vezes e acumule todas as camadas orgânicas. Depois de remover a camada orgânica pela terceira vez, lave ambas as pipetas no frasco contendo a camada orgânica.
- Usando um fluxo suave de nitrogênio, concentre-se até o volume, depois sele com fita PTFE e armazene em um congelador.
4. Desenvolvimento de sistemas e etapas para separação tlc de vara de classes lipídicas marinhas
-
Preparando as hastes para tlc
- Digitalize as hastes no scanner FID automático três vezes
- Detectando uma amostra: Aplique amostras e padrões com uma seringa nas hastes ou um pouco abaixo da origem. Dispense 0,5 μL e toque na gota na haste. Deixe secar antes de colocar a próxima gota no mesmo local. Localmente todas as amostras em uma linha em varas.
- Foco em acetona: Focus amostras duas vezes (três vezes se as amostras são muito concentradas) em 70 mL de acetona. Observe a frente do solvente enquanto sobe a haste até que a parte inferior do ponto se funda com a parte superior. Retire as hastes, seque-as por cerca de 5 s e repita o procedimento para produzir uma faixa estreita de material lipíduo perto da parte inferior da haste.
- Seque e condiciona as hastes em uma câmara de umidade constante por 5 minutos. Uma câmara de umidade constante é um dessecador com uma solução saturada de cloreto de cálcio sob a placa.
-
Sequência que leva ao primeiro cromatógrafo (hidrocarboneto para cetona)
-
Primeiro sistema de desenvolvimento: O primeiro sistema de desenvolvimento é o hexano:éter de dietil:ácido formico, 98.95:1:0.05. Use uma seringa para adicionar o ácido fórmico, mas primeiro enxágue a seringa 3× com ácido fórmico. Enxágüe o ácido fórmico da seringa imediatamente depois com clorofórmio. Use 30 mL da mistura para molhar o papel e enxaguar o tanque. Descarte a solução de enxágue e adicione os 70 mL restantes ao tanque.
- Pegue os racks e abaixe-os suavemente para dentro do tanque. Observe até que a frente do solvente atinja os pontos de amostra e inicie o temporizador. Depois de 25 min, retire as hastes da câmara de desenvolvimento, seque na câmara de umidade constante por 5 minutos, e redesenvolve na mesma solução por mais 20 minutos.
- Seque as hastes por 5 minutos no scanner FID automático e, em seguida, escaneie até o ponto mais baixo atrás do pico cetona usando uma varredura PPS de 25.
-
Primeiro sistema de desenvolvimento: O primeiro sistema de desenvolvimento é o hexano:éter de dietil:ácido formico, 98.95:1:0.05. Use uma seringa para adicionar o ácido fórmico, mas primeiro enxágue a seringa 3× com ácido fórmico. Enxágüe o ácido fórmico da seringa imediatamente depois com clorofórmio. Use 30 mL da mistura para molhar o papel e enxaguar o tanque. Descarte a solução de enxágue e adicione os 70 mL restantes ao tanque.
-
Sequência que leva ao segundo cromatógrama (triacylglycerol to diacylglycerol):
- Condiciona as hastes por 5 minutos na câmara de umidade constante.
- Segundo sistema de desenvolvimento: O segundo sistema de desenvolvimento é hexano:éter de dietil:ácido formico, 79:20:1. Adicione ~30 mL ao tanque de desenvolvimento para molhar o papel e enxaguar o tanque. Em seguida, descarte e desenvolva as hastes por 40 min nos 70 mL restantes. Para a melhor separação entre os picos TAG (saturado) e TAG (poli-insaturado) use uma mistura de 79.9:20:0.1, mas para separação dos picos ST e DAG use uma mistura de 79:20:1.
- Seque e escaneie até o ponto mais baixo atrás do pico de diaciglicerol em uma segunda varredura parcial usando uma varredura PPS 11.
-
Sequência que leva ao terceiro cromatógrama (lipídio polar acetona-móvel e fosfolipídio)
- Condiciona as hastes por 5 minutos na câmara de umidade constante.
- Desenvolva as hastes duas vezes por 15 minutos em 70 mL de acetona. Entre os desenvolvimentos, o ar secou as hastes por cerca de 30 segundos.
- Condiciona as hastes por 5 minutos na câmara de umidade constante.
- Terceiro sistemade desenvolvimento : O terceiro sistema de desenvolvimento é uma mistura de clorofórmio, metanol e água extraída de clorofórmio, 50:40:10. Desenvolva as hastes duas vezes por 10 minutos em 70 mL da mistura. Entre os desenvolvimentos, o ar secou as hastes por cerca de 30 segundos.
- Seque e escaneie toda a extensão das hastes.
5. Derivatização fame com H2SO4 no MeOH
-
Fazendo o reagente Hilditch
- Preparando o metanol: Coloque 100 mL de MeOH em um frasco volutivo limpo e, em seguida, polvilhe suavemente em NaSO4 anidro até que o fundo do frasco esteja coberto. Uma vez coberto, inverta duas vezes para que qualquer água no metanol seja absorvida pelo NaSO4. Depois de inverter e tremer, deixe descansar por pelo menos 5 minutos.
- Adicionando o ácido: Decante lentamente o metanol em um frasco de vidro (até agora o NaSO4 é um caroço duro no fundo do frasco) e o H2SO4 é adicionado. Adicione lentamente 1,5 mL de ácido sulfúrico ao metanol usando uma pipeta. Adicione algumas gotas de cada vez e uma vez que todo o ácido tenha sido adicionado, tampa e mexa suavemente para misturar. A solução está agora pronta para ser usada para derivativos, mas deve ser feita semanalmente.
-
Fazendo os derivativos
- Transfira aproximadamente 200 μg de lipídios de um frasco extrato que teve o volume trazido até uma quantidade conhecida, em um frasco limpo de 15 mL e evaporar sob nitrogênio para secar. O valor removido será determinado pela concentração da amostra do TLC/FID. Use uma pipeta limpa para remover a amostra.
- Quando a amostra secar, adicione 1,5 mL de diclorometano e 3 mL do recém-feito reagente Hilditch.
- Vórtice a amostra, e sonicá-la em um banho ultrassônico por 4 minutos para remover lipídios que aderiram ao frasco de vidro. Encha o frasco com nitrogênio, tampa e sele-o com fita PTFE e aqueça a 100°C por 1 hora.
-
Parando a reação
- Deixe as amostras esfriarem completamente até a temperatura ambiente por 10 minutos após a remoção do forno e, em seguida, abra os frascos cuidadosamente.
- Adicione lentamente aproximadamente 0,5 mL solução de bicarbonato de sódio saturado (9 g/100 mL de água extraída de clorofórmio), depois hexano de 1,5 mL. Agite ou vórtice o frasco, em seguida, deixe-se ficar de pé para que ele separe em 2 camadas.
-
Colecionando os FAME's
- Remoção da camada superior: Uma vez que a derivatização tenha sido interrompida, e haja uma separação clara, remova a fase superior, orgânica e coloque em um frasco de 2 mL limpo lipídio.
- Evaporar o solvente no frasco de 2 mL até a secura e recarregá-lo com hexano para aproximadamente 0,5 mL.
- Encha o espaço da cabeça do frasco com nitrogênio, tampa e sele o frasco com fita PTFE, sonicate por mais 4 minutos para suspender novamente os ácidos graxos, e então ele está pronto para ir para o GC.
NOTA: Se forem necessárias concentrações de ácidos graxos, a camada aquosa deve ser lavada três vezes com hexano e todas as camadas orgânicas agrupadas no frasco de 2 mL. Isso envolve adicionar 2 mL de hexano, vórtice da amostra, centrifugar e remover a camada orgânica, tudo repetido 3 vezes.
Resultados
Como o setor de produção de alimentos que mais cresce, a aquicultura está evoluindo em termos de inovações tecnológicas e adaptações para atender às necessidades em mudança. Uma delas é reduzir a dependência de farinha de peixe de origem selvagem e óleo de peixe, que fornecem ingredientes de ração para muitas espécies de aquicultura. Os óleos de plantas terrestres estão sendo investigados como substitutos sustentáveis e econômicos para o óleo de peixe em aquafeeds, e o fígado é um tecido alvo para análise, pois é o local principal para o metabolismo lipídico12. A Figura 2 mostra os cromogramas de TLC-FID crus obtidos do nosso padrão de nove componentes, uma dieta que formulamos com óleo de peixe a 7% e óleo de colza em 5%, e tecido hepático de um salmão atlântico alimentado com essa dieta. A Tabela 1 mostra os dados obtidos após a análise de réplicas dietéticas e amostras de diferentes peixes. Esses dados foram obtidos após a construção de curvas padrão a partir de respostas FID scanner para quantificar as classes lipídicas nos extratos usando o software Peak Simple (versão 4.54). Os dados mostram a prevalência de triaciglicerols nas dietas e fígados e também a importância dos fosfolipídios de membrana no fígado.
As margens continentais geralmente apresentam uma produtividade biológica muito alta e são especialmente importantes no ciclismo de carbono. A produtividade primária da superfície atinge mais o fundo do mar em águas rasas, e assim medir a quantidade e a qualidade das partículas que se instalam da camada mista superior para a teia alimentar benthic é de grande interesse. Sendo ricos em carbono e com um teor energético muito alto, os lipídios são componentes importantes da produtividade das prateleiras continentais. Historicamente, as águas adjacentes à Terra Nova e ao Labrador apoiaram uma das maiores pescas do mundo por cerca de cinco séculos, e temos estudado a produção e transferência de lipídios neste sistema13. A Figura 3 mostra cromatógramas TLC-FID obtidos do nosso padrão, lipídios na resolução de material particulado coletado a 220 m da costa de Newfoundland, e lipídios em um pequeno mysid, Erithrops erithrophtalma coletado perto da mesma profundidade. Desta vez, os cromatógrafos foram processados através de software de plotagem e as duas varreduras parciais foram combinadas com a varredura completa final. A tabela 2 mostra os dados obtidos após a análise de amostras de réplica de material particulado de assentamento e do mysid. Entre 19 taxas de 5 filos, a pequena mísida teve, em média, a maior concentração lipídica (6% do peso molhado)13.
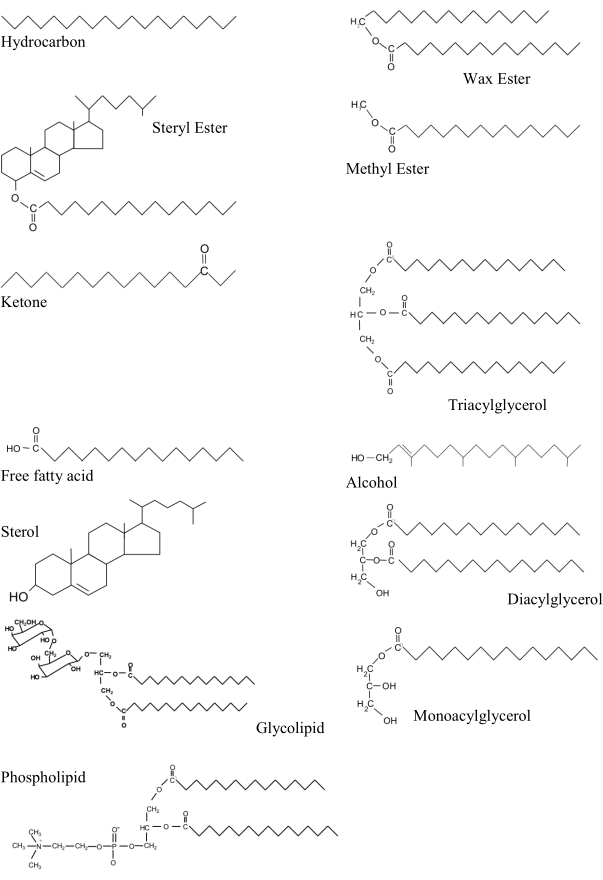
Figura 1: Principais classes lipídicas em amostras marinhas em uma ordem aproximada de crescente polaridade. Cada estrutura é desenhada com a parte mais hidrofóbica da molécula apontando para o direito da Figura. Compostos representativos para aulas lipídicas são:- hidrocarboneto: nonadecano; éster de cera: palmitato hexadecyl; ester steryl: palmitato de eststeryl; éster de metila: palmitato de metila; cetona: 3-hexdecanona; triacylglycerol: tripalmitina; ácido graxo livre: ácido palmítico; álcool: fitol; esterol: colesterol; diaciglicerol: dipalmitoyl gliceol; monoacílglicerol: glicerol monopalmitoyl; glicolipídio: digalactosyl diacylglycerol; fosfolipídio: dipalmitoyl fosphatidylcholine. Clique aqui para ver uma versão maior desta figura.

Figura 2: Cromatógrafos TLC-FID de composição lipídica a partir de um experimento de alimentação de aquicultura. Extratos foram vistos em hastes TLC revestidas de gel de sílica e um sistema de desenvolvimento de três estágios foi usado para separar classes lipídicas. Os primeiros e segundo sistemas de desenvolvimento foram hexano:éter de dietil:ácido fórmico (98.95:1:0.05) e (79.9:20:0.1) respectivamente, a fim de separar lipídios neutros, incluindo triacylglycerol, ácido graxo livre e esterol para digitalização no scanner automático de FID. Os terceiros sistemas de desenvolvimento consistiam em 100% de acetona antes do clorofórmio:metanol:água (5:4:1) a fim de separar lipídios polares e fosfolipídios. Curvas padrão (i.e., nonadecane, palmitato de cholesteryl, 3-hexdecanona, tripalmitina, ácido palmítico, álcool cetila, colesterol, glicerol monopalmitoyl, fosfartidylcolina dipalmitoyl) foram usadas para quantificar as classes lipídicas nos extratos usando o software Peak Simple (versão 4.54). Clique aqui para ver uma versão maior desta figura.

Figura 3: Cromatógramas TLC-FID de composição lipídica de amostras quase inferiores da terra nova costeira. a) padrão de nove componentes, b) 220 m de material particulado de 220 m de conception bay, newfoundland, c) aulas lipídicas no mysid, Erythrops erythrophtalma. Por favor clique aqui para ver uma versão maior desta figura.
| Dieta de óleo de peixe/óleo de colza | Fígado de salmão atlântico | |
| Hidrocarbonetos | 1.3±0.9 | 0,5±0.2 |
| Ésteres Steryl/Ésteres de Cera | 0,4±0.6 | 0,6±0.3 |
| Ésteres etílicos | 0 | 0 |
| Esters de metila | 0 | 0 |
| Cetonas etílicos | 0 | 0,3±0.2 |
| Cetonas de metila | 0 | 0 |
| Éteres Glyceryl | 0 | 0 |
| Triacylglycerols | 145,0±26,3 | 16.9±8.1 |
| Ácidos Graxos Gratuitos | 21.9±2.2 | 1.2±0.9 |
| Álcoois | 0 | 1.4±0.4 |
| Esteróis | 6.8±2.1 | 2.6±0.2 |
| Diaciglicerols | 0 | 0 |
| Lipídios Polares Móveis acetona | 14.0±2.5 | 2.2±0.6 |
| Fosfolipídios | 12,5±4.0 | 22.0±2.0 |
| Lipídios Totais | 201.8±27.4 | 47,7±11.8 |
Tabela 1: Composição lipídica em um experimento de alimentação de aquicultura. Os dados são (desvio médio±padrão) de uma dieta experimental contendo 6,80% de óleo de peixe e 4,80% de óleo de colza, como alimentado (mg g-1 peso molhado), e de fígados de salmão atlântico (mg g-1 peso molhado) após alimentar essa dieta por 12 semanas.
| Assentamento de material particulado | Eritropo eritrophtalma | |
| Ésteres/Ésteres de Cera Steryl (% lipídio total) | 10.2±8.28 | 8,85±1,67 |
| Triacylglycerols (% lipídio total) | 19.7±5.35 | 58,5±9.19 |
| Fosfolipídios (% lipídio total) | 16.2 ± 3.51 | 21.4±5.35 |
| Lipídios neutros (% lipídio total) | 12,5±4.0 | 73,4±5.46 |
| Índice de lipólise (%) | 18.1±5.20 | 2.77±2,78 |
| Lipídios Totais | 0,57±0,25 | 5.86±1.44 |
| Lipídios neutros: hidrocarbonetos, estéres de cera e steryl, cetonas, triacylglices, ácidos graxos livres; (FFA), álcoois (ALC), esteróis, diaciclglices; LI: índice de lipólise [(FFA + ALC) (lipídios aciis + ALC)–1]; Lipídio total (soma de classes lipídicas determinadas por TLC/FID) material particulado - % peso seco, Mysid - % peso molhado | ||
Tabela 2: Composição lipídica de amostras próximas do fundo da Terra Nova costeira. Os dados são (desvio médio±padrão) de 220 m de material particulado de Conception Bay Newfoundland, e do mistísid, Erithrops erithrophtalma.
Nota de rodapé: Lipídios neutros: hidrocarbonetos, estéres de cera e steryl, cetonas, triacylgliceols, ácidos graxos livres; (FFA), álcoois (ALC), esteróis, diaciclglices; LI: índice de lipólise [(FFA+ ALC) (lipídios aciis + ALC)-1]; Lipídio total (soma de fid determinada classe lipídica) material particulado - % peso seco, Mysid - % peso molhado.
Discussão
A velocidade com que o sistema TLC-FID fornece informações de classe lipídica sinóptica de pequenas amostras torna o TLC-FID uma ferramenta capaz de triagem de amostras marinhas antes de realizar procedimentos analíticos mais envolvidos. Tais análises geralmente requerem a liberação de compostos componentes de extratos lipídes e derivação para aumentar a volatilidade no caso da cromatografia gasosa. O TLC-FID combinado com o GC-FID foi encontrado como uma combinação poderosa para extratos de frutos do mar e outros alimentos14. Para análises lipídicas marinhas bem sucedidas é fundamental que as amostras estejam protegidas contra degradação e contaminação em toda parte e que se tenha muito cuidado com a aplicação da amostra na haste. Uma abordagem é aplicar toda a amostra marinha na haste usando um pipettor microcapilário15, e uma inovação em tipos de amostras marinhas é adicionar amostras de microcamadas de superfície do mar e aerossol às amostras de água do mar16.
O sistema FID no scanner automático fornece uma rápida quantitação de microgramas sem derivatização ou limpeza; no entanto, não é tão sensível, preciso ou linear como encontrado em cromatógrafos a gás. Isso significa que as curvas de calibração devem ser construídas, e que ocasionalmente pode ser necessário analisar amostras em duas cargas diferentes, a fim de manter picos de classe lipídica menores e maiores dentro das faixas de calibração.
Usando a instalação de varredura parcial no scanner FID, é possível separar várias classes de lipídios de uma única aplicação de amostra para uma haste. No entanto, a cromatografia no ácido sílico não resolve esteres de cera (WE) e ésteres de steryl (SE), e algumas classes podem ser incluídas no pico "lipídio polar acetona-móvel" (AMPL)pico 17. We-SE foi a principal classe lipídica em oócitos de peixe-osso e sugere-se que eles são usados para suportar flutuação e/ou armazenamento de energia18.
Em AMPL de organismos fotossintéticos, os glicoclycerolipids muitas vezes eluto juntamente com monoacylgliceols e pigmentos em acetona. Isso pode apresentar uma preocupação de quantitação, pois clorofila a e glicolipídios monogalactosyl diacylgliceol (MGDG) e digalactosyl diacylglycerol (DGDG) têm diferentes respostas FID no scanner; no entanto, usamos 1 glicerol monopalmitoyl como padrão para a classe AMPL, e isso tem uma resposta intermediária entre eles17.
Embora alguns picos de scanner FID possam conter mais de uma classe lipídica, às vezes é útil para reagrupar funcionalmente classes lipídicas separadas. Por exemplo, AMPL e PL foram agrupados em lipídios polares e, em seguida, em lipídios estruturais com a adição de esterol19. Tais agrupamentos foram utilizados para estudar períodos críticos para uso lipídebra durante o desenvolvimento em invertebrados19. Outros agrupamentos envolvendo ácidos graxos livres e álcoois podem ser usados como indicadores de degradação, como o índice de lipólise(Tabela 2) ou o índice de hidrólise1. LI é o índice de lipólise de todos os lipídios acimais, enquanto o HI é o índice de hidrólise de lipídios acimais não polares. Os valores LI são sempre inferiores aos de OI para qualquer amostra, pois todos os lipídios acimais estão incluídos.
Ocasionalmente, a divisão de picos ocorre em separações de varas de extratos de amostras marinhas devido à presença de altos níveis de espécies poli-insaturadas que podem dificultar a identificação. Isso tem sido observado com ésteres de cera(Figura 3),triacilglicerols e ácidos graxos livres20,21, e requer co-spoting com padrões autênticos e/ou confirmação com outras técnicas cromatográficas. Da mesma forma, a divisão do pico pode ocorrer na região lipídica polar(Figura 2 e Figura 3),e outros desenvolvimentos podem ser realizados para separar componentes glicolipídios e pigmentos17,22 e classes fosfolipídicas22,23.
Divulgações
Os autores não têm interesses financeiros concorrentes.
Agradecimentos
Esta pesquisa foi financiada pelo Conselho de Ciências Naturais e Pesquisa em Engenharia do Canadá (NSERC) 105379 para C.C. Parrish. A Rede de Treinamento de Equipamentos e Instrumentos De Pesquisa Core da Universidade Memorial (CREAIT) ajudou a financiar esta publicação.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 ml vials | VWR | 66009-560 | |
| 1-hexadecanol | Sigma | 258741-1G | |
| 1-Monopalmitoyl-rac-glycerol | Sigma | M1640-1g | |
| 2 ml vials | VWR | 46610-722 | |
| 25 mm glass fibre filters | Fisher | 09 874 32A | |
| 2ml pipet bulbs | VWR | 82024-554 | |
| 47 mm glass fibre filters | Fisher | 09 874 32 | |
| 5 3/4" pipets | Fisher | 1367820A | |
| 9" pipets | Fisher | 1367820C | |
| Acetone | VWR | CAAX0116-1 | |
| Agilent GC-FID 6890 | Agilent | ||
| Calcium Chloride ANHS 500gm | VWR | CACX0160-1 | |
| Caps for 2 ml vials | VWR | 46610-712 | |
| chloroform | VWR | CACX1054-1 | |
| Cholesteryl palmitate | Sigma | C6072-1G | |
| Chromarod S5 | Shell USA | 3252 | |
| Dichloromethane | VWR | CADX0831-1 | |
| DL-a-phosphatidylcholine, dipalmotoyl | Sigma | P5911-1g | |
| Ethyl Ether, ACS grade anhydr 4L | VWR | CAEX0190-4 | |
| Glyceryl tripalmitate | Sigma | T5888-100MG | |
| Hamilton Syringe 702SNR 25µl | Sigma | 58381 | |
| Helium | Air Liquide | A0492781 | |
| Hexane | VWR | CAHX0296-1 | |
| Hydrogen regulator | VWR | 55850-484 | |
| Iatroscan MK6 | Shell USA | ||
| Kimwipes | Fisher | 066662 | |
| Medical Air | Air Liquide | A0464563 | |
| Medium nitrile gloves | Fisher | 191301597C | |
| Nitrile gloves L | VWR | CA82013-782 | |
| Nitrogen | Air Liquide | A0464775 | |
| Nitrogen Regulator | VWR | 55850-474 | |
| Nonadecane | Sigma | 74158-1G | |
| Palmitic acid | Sigma | P0500-10G | |
| Repeating dispenser | Sigma | 20943 | |
| Sodium Bicarbonate 1kg | VWR | CA97062-460 | |
| Sodium Sulfate Anhy ACS 500gr | VWR | CA71008-804 | |
| Sulfuric acid | VWR | CASX1244-5 | |
| Teflon tape | Fisher | 14610120 | |
| tissue master 125 115V w/7mm homogenator | OMNI International | TM125-115 | |
| TLC development tank | Shell USA | 3201 | |
| UHP hydrogen | Air Liquide | A0492788 | |
| VWR solvent repippetter | VWR | 82017-766 | |
| VWR timer Flashing LED 2 channel | VWR | 89140-196 | |
| Zebron ZB-Wax GC column | Phenomenex | 7HM-G013-11 |
Referências
- Couturier, L. I. E., et al. State of art and best practices for fatty acid analysis in aquatic sciences. ICES Journal of Marine Science. , (2020).
- Parrish, C. C. Lipids in Marine Ecosystems. ISRN Oceanography. , 604045(2013).
- Folch, J., Lees, M., Stanley, G. H. S. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226, 497-509 (1957).
- Vaz, F. M., Pras-Raves, M., Bootsma, A. H., van Kampen, A. H. C. Principles and practice of lipidomics. Journal of Inherited Metabolic Disease. , (2014).
- Wolf, C., Quinn, P. J. Lipidomics: practical aspects and applications. Progress in Lipid Research. 47, 15-36 (2008).
- Parrish, C. C. Determination of total lipid, lipid classes, and fatty acids in aquatic samples. Lipids in Freshwater Ecosystems. Arts, M. T., ainman, B. C. , Springer-Verlag. New York. 4-20 (1999).
- Jüttner, F. Liberation of 5,8,11,14,17-eicosapentaenoic acid and other polyunsaturated fatty acids from lipids as a grazer defense reaction in epilithic diatom biofilms. Journal of Phycology. 37, 744-755 (2001).
- Carreón-Palau, L., Parrish, C. C., Pérez-España, H., Aguiñiga-Garcia, S. Elemental ratios and lipid classes in a coral reef food web under river influence. Progress in Oceanography. 164, 1-11 (2018).
- Maciel, E., et al. Bioprospecting of marine macrophytes using MS-based lipidomics as a new approach. Marine Drugs. 14, 49(2016).
- Pernet, F., Tremblay, R., Comeau, L., Guderley, H. Temperature adaptation in two bivalve species from different thermal habitats: energetics and remodelling of membrane lipids. Journal of Experimental Biology. 210, 2999-3014 (2007).
- Bergen, B. J., Quinn, J. G., Parrish, C. C. Quality-assurance study of marine lipid-class determination using Chromarod/Iatroscan thin-layer chromatography-flame ionization detector. Environmental Toxicology and Chemistry. 19, 2189-2197 (2000).
- Foroutani, B. M., Parrish, C. C., Wells, J., Taylor, R. G., Rise, M. L. Minimizing marine ingredients in diets of farmed Atlantic salmon (Salmo salar): effects on liver and head kidney lipid class, fatty acid and elemental composition. Fish Physiology & Biochemistry. 46, 2331-2353 (2020).
- Parrish, C. C., Deibel, D., Thompson, R. J. Effect of sinking spring phytoplankton blooms on lipid content and composition in suprabenthic and benthic invertebrates in a cold ocean coastal environment. Marine Ecology Progress Series. 391, 33-51 (2009).
- Sinanoglou, V. J., et al. On the combined application of Iatroscan TLC-FID and GC-FID to identify total, neutral, and polar lipids and their fatty acids extracted from foods. ISRN Chromatography. , 59024(2013).
- Peters-Didier, J., Sewell, M. A. Maternal investment and nutrient utilization during early larval development of the sea cucumber Australostichopus mollis. Marine Biology. 164, 178(2017).
- Triesch, N., et al. Concerted measurements of lipids in seawater and on submicron aerosol particles at the Cape Verde Islands: biogenic sources, selective transfer and high enrichments. Atmospheric Chemistry and Physics. 21, 4267-4283 (2021).
- Parrish, C. C., Bodennec, G., Gentien, P. Determination of glycoglycerolipids by Chromarod thin-layer chromatography with Iatroscan flame ionization detection. Journal of Chromatography A. 741, 91-97 (1996).
- Mejri, S., et al. Bonefish (Albula vulpes) oocyte lipid class and fatty acid composition related to their development. Environmental Biology of Fishes. 102, 221-232 (2019).
- Sewell, M. A. Utilization of lipids during early development of the sea urchin Evechinus chloroticus. Marine Ecology Progress Series. 304, 133-142 (2005).
- Parrish, C. C., Bodennec, G., Gentien, P. Separation of polyunsaturated and saturated lipids from marine phytoplankton on silica gel coated Chromarods. Journal of Chromatography A. 607, 97-104 (1992).
- Stevens, C. J., Deibel, D., Parrish, C. C. Incorporation of bacterial fatty acids and changes in a wax ester-based omnivory index during a long-term incubation experiment with Calanus glacialis Jaschnov. Journal of Experimental Marine Biology and Ecology. 303, 135-156 (2004).
- Goutx, M., et al. Short term summer to autumn variability of dissolved lipid classes in the Ligurian Sea (NW Mediterranean). Biogeosciences. 6, 1229-1246 (2009).
- Conlan, J. A., Rocker, M. M., Francis, D. S. A. comparison of two common sample preparation techniques for lipid and fatty acid analysis in three different coral morphotypes reveals quantitative and qualitative differences. PeerJ. 5, 3645(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados