Method Article
Détermination des classes totales de lipides et de lipides dans les échantillons marins
Dans cet article
Résumé
Ce protocole est destiné à la détermination des lipides dans l’eau de mer et les spécimens biologiques. Les lipides dans les filtrats sont extraits avec du chloroforme ou des mélanges de chloroforme et de méthanol dans le cas des solides. Les classes de lipides sont mesurées par chromatographie sur couche mince de bâtonnets avec détection par ionisation de flamme et leur somme donne la teneur totale en lipides.
Résumé
Les lipides sont en grande partie composés de carbone et d’hydrogène et, par conséquent, fournissent une énergie spécifique plus grande que les autres macromolécules organiques dans la mer. Étant riches en carbone et en hydrogène, ils sont également hydrophobes et peuvent agir comme un solvant et un vecteur d’absorption pour les contaminants organiques et peuvent donc être des moteurs de la bioaccumulation des polluants dans les écosystèmes marins. Leur nature hydrophobe facilite leur isolement de l’eau de mer ou des spécimens biologiques : l’analyse des lipides marins commence par l’échantillonnage puis l’extraction dans des solvants organiques non polaires, fournissant une méthode pratique pour leur séparation des autres substances dans une matrice aquatique.
Si de l’eau de mer a été échantillonnée, la première étape consiste généralement à la séparation en factions « dissoutes » et « particulaires » définies opérationnellement par filtration. Les échantillons sont prélevés et les lipides isolés de la matrice de l’échantillon généralement avec du chloroforme pour la matière vraiment dissoute et les colloïdes, et avec des mélanges de chloroforme et de méthanol pour les solides et les échantillons biologiques. Ces extraits peuvent contenir plusieurs classes provenant de sources biogéniques et anthropiques. À ce stade, les lipides totaux et les classes de lipides peuvent être déterminés. Les lipides totaux peuvent être mesurés en additionnant les classes de lipides déterminées individuellement qui ont généralement été séparées chromatographiquement. La chromatographie sur couche mince (TLC) avec détection par ionisation de flamme (FID) est régulièrement utilisée pour l’analyse quantitative des lipides provenant d’échantillons marins. TLC-FID fournit des informations synoptiques sur les classes lipidiques et, en additionnant les classes, une mesure totale des lipides.
Les informations sur la classe des lipides sont particulièrement utiles lorsqu’elles sont combinées avec des mesures de composants individuels, par exemple des acides gras et / ou des stérols, après leur libération à partir d’extraits lipidiques. La grande variété de structures et de fonctions lipidiques signifie qu’elles sont largement utilisées dans la recherche écologique et biogéochimique évaluant la santé des écosystèmes et le degré d’influence des impacts anthropiques. Ils ont été utilisés pour mesurer les substances ayant une valeur alimentaire pour la faune marine (p. ex., les aliments aquatiques et/ou les proies) et comme indicateur de la qualité de l’eau (p. ex., hydrocarbures).
Introduction
Les méthodes décrites ici concernent des substances qui sont définies opérationnellement comme des lipides marins. Cette définition est basée sur leur aptitude à l’extraction liquide-liquide dans des solvants organiques non polaires, et elle fournit une méthode pratique pour leur séparation des autres substances dans une matrice aquatique. Leur nature hydrophobe facilite leur isolement de l’eau de mer ou des spécimens biologiques, ainsi que leur enrichissement et l’élimination des sels et des protéines.
La mesure de la teneur en lipides et de sa composition dans les organismes marins présente un grand intérêt pour l’écologie du réseau trophique, la nutrition aquacole et la science alimentaire depuis des décennies. Les lipides sont des composants universels dans les organismes vivants, agissant comme des molécules essentielles dans les membranes cellulaires, comme des sources majeures d’énergie biodisponible, fournissant une isolation thermique et une flottabilité, et servant de molécules de signalisation. Bien que les procédures de détermination des lipides dans d’autres domaines aient été bien décrites, leur utilisation avec des échantillons marins nécessite généralement des modifications pour s’adapter aux conditions de terrain ainsi qu’au type d’échantillon1.
Pour les échantillons d’eau de mer, la première étape nécessite généralement une séparation en fractions « dissoutes » et « particulaires » définies opérationnellement, normalement par filtration (étape 1 du protocole). La fraction particulaire est ce qui est retenu par le filtre, et la taille des pores est importante dans la définition de la coupure2. Souvent, lorsque nous échantillonnons des particules, nous aimerions établir un lien entre les concentrations lipidiques et les concentrations massiques totales, auquel cas un échantillon distinct et plus petit (p. ex., 10 mL) doit être prélevé à cette fin (étape 1 du Protocole, note). Pour obtenir une détermination précise de la masse, il est important d’ajouter du formiate d’ammonium (35 g/L) à la fin de la filtration.
Le filtrat d’eau de mer de l’échantillon le plus grand doit représenter entre 250 mL et 1 L selon le type d’échantillon et est soumis à une extraction liquide-liquide dans un entonnoir séparateur (étape 2 du protocole). La nature hydrophobe des lipides signifie qu’ils peuvent être séparés des autres composés par extraction dans un solvant non polaire tel que le chloroforme. Un système à deux couches est créé où les lipides se divisent en couche organique tandis que les composants solubles dans l’eau restent dans la couche aqueuse.
Les échantillons de particules sur un filtre, ou les échantillons biologiques sont extraits avec une extraction modifiée de Folch et al.3, impliquant également du chloroforme (étape 3 du protocole). Encore une fois, un système organique / aqueux est créé dans lequel les lipides se divisent en phase organique, tandis que les molécules solubles dans l’eau restent dans la phase aqueuse et que les protéines sont précipitées. En fait, pour les solides, la plupart des laboratoires utilisent une variante de la procédure d’extraction Folch et al.3 impliquant du chloroforme et du méthanol. Pour les filtres, la première étape consiste à homogénéiser en 2 mL de chloroforme et 1 mL de méthanol.
Pendant l’extraction, il faut veiller à protéger les lipides des modifications chimiques ou enzymatiques, en conservant les échantillons et les solvants sur la glace pour réduire l’hydrolyse des liaisons ester ou l’oxydation à double liaison carbone-carbone. Les tissus et les lipides cellulaires sont assez bien protégés par des antioxydants naturels et par compartimentation4; cependant, à la suite de l’homogénéisation des échantillons, le contenu cellulaire est combiné, ce qui rend les lipides plus disposés à l’altération, chimiquement ou enzymatiquement. Certains lipides, comme la plupart des stérols, sont très stables, tandis que d’autres, comme ceux contenant des acides gras polyinsaturés, sont plus sensibles à l’oxydation chimique. D’autres, comme les stérols à doubles liaisons conjuguées, sont sujets à l’oxydation catalysée par la lumière5. Après les extractions, les lipides sont beaucoup plus sensibles à l’oxydation chimique et les échantillons doivent être stockés sous un gaz inerte tel que l’azote. Un doux flux d’azote serait également utilisé pour concentrer les extraits.
Après concentration, les lipides seraient alors normalement quantifiés en vrac car ils constituent un composant important des écosystèmes marins fournissant une forte concentration d’énergie, plus de deux fois le kJ / g de glucides et de protéines. Invariablement, ils seraient ensuite quantifiés en tant que composants individuels: l’analyse complète des lipides implique généralement une séparation en catégories plus simples, en fonction de leur nature chimique. Ainsi, une analyse complète implique de mesurer les lipides totaux, les classes de lipides et les composés individuels.
Le lipide total peut être déterminé en prenant la somme des classes de lipides mesurées individuellement séparées par chromatographie6. Un extrait lipidique marin peut contenir plus d’une douzaine de classes provenant de sources biogéniques et anthropiques. La grande variété de structures lipidiques signifie que beaucoup d’informations peuvent être obtenues en déterminant des groupes individuels de structures. Des classes de lipides individuellement, ou dans certains groupes, ont été utilisées pour signaler la présence de certains types d’organismes, ainsi que leur état physiologique et leur activité2. Ils ont également été utilisés comme indicateur de l’origine des matières organiques, y compris la matière organique dissoute (DOM) ainsi que les contaminants hydrophobes.
Les triacylglycérols, les phospholipides et les stérols font partie des classes de lipides biogéniques les plus importantes. Les deux premiers sont biochimiquement liés car ils possèdent une colonne vertébrale de glycérol à laquelle deux ou trois acides gras sont estérifiés (Figure 1). Les triacylglycérols, ainsi que les esters de cire sont des substances de stockage très importantes, tandis que d’autres classes de lipides contenant des acides gras tels que les diacylglycérols, les acides gras libres et les monoacylglycérols sont généralement des constituants mineurs. Les acides gras libres sont présents à des concentrations plus faibles dans les organismes vivants, car les acides insaturés peuvent être toxiques7. Les stérols (à la fois sous leur forme libre et estérifiée) et les alcools gras sont également inclus parmi les lipides les moins polaires, tandis que les glycolipides et les phospholipides sont des lipides polaires. Les lipides polaires ont un groupe hydrophile, ce qui permet la formation de bicouches lipidiques présentes dans les membranes cellulaires. Les stérols libres sont également des composants structurels membranaires, et lorsqu’ils sont pris en rapport avec les triacylglycérols, ils fournissent une condition ou un indice nutritionnel (TAG: ST) qui a été largement utilisé8. Lorsqu’ils sont pris en rapport aux phospholipides (ST : PL), ils peuvent être utilisés pour indiquer la sensibilité des plantes au sel: des valeurs plus élevées maintiennent l’intégrité structurelle et diminuent la perméabilité membranaire9. L’inverse de ce rapport (PL : ST) a été étudié dans les tissus bivalves lors de l’adaptation à la température10.
Les classes de lipides marins peuvent être séparées par chromatographie sur couche mince (TLC) sur des tiges revêtues de gel de silice (étape 4 du protocole), puis détectées et quantifiées par détection par ionisation de flamme (FID) dans un scanner FID automatique. Le TLC/FID est devenu couramment utilisé pour les échantillons marins car il fournit rapidement des données synoptiques sur les classes lipidiques à partir de petits échantillons et, en prenant la somme de toutes les classes, une valeur pour les lipides totaux. Le TLC/FID a fait l’objet d’une évaluation de l’assurance de la qualité (AQ) et s’est avéré conforme aux normes requises pour un étalonnage externe cohérent, des blancs faibles et une analyse de réplication précise11. Les coefficients de variation (CV) ou les écarts-types relatifs sont d’environ 10 %, et les données lipidiques totales du scanner FID sont normalement d’environ 90 % de celles obtenues par gravimétrie et d’autres méthodes2. La gravimétrie donne des lipides totaux plus élevés probablement parce que le scanner FID ne mesure que des composés non volatils, et aussi à la suite de l’inclusion possible de matériau non lipidique dans les mesures gravimétriques.
Les informations fournies par l’analyse de la classe lipidique sont particulièrement utiles lorsqu’elles sont combinées avec des déterminations d’acides gras en tant qu’individus, ou de stérols, ou les deux en combinaison. La première étape vers ces analyses implique la libération de tous les acides gras constitutifs ainsi que des stérols dans les extraits lipidiques (étape 5 du protocole). La grande variété de structures et de fonctions lipidiques signifie qu’ils ont été largement utilisés dans les études écologiques et biogéochimiques évaluant la santé des écosystèmes et la mesure dans laquelle ils ont été influencés par les apports anthropiques et terrestres. Ils ont été utilisés pour mesurer la biosynthèse de substances ayant une valeur alimentaire pour la faune marine ainsi que pour indiquer la qualité des échantillons d’eau. La mesure des lipides dans les carottes de sédiments aide à montrer la sensibilité des sédiments aux changements dans l’utilisation des terres par l’homme près de la marge terre-mer.
Le principal outil d’identification et de quantification des composés lipidiques individuels est traditionnellement la chromatographie en phase gazeuse (CG) avec FID. Avant l’analyse cependant, ces composés sont rendus plus volatils par la dérivatisation. Les acides gras sont libérés en présence d’un catalyseur acide(H2SO4)à partir de classes de lipides acyliques(Figure 1). En chimie organique, le groupe acyle (R-C=O) est généralement dérivé d’un acide carboxylique (R-COOH). Ils sont ensuite réestérifiés en esters méthyliques d’acides gras (FAME) ce qui donne de meilleures séparations sur les colonnes GC (étape 5 du protocole).
Protocole
REMARQUE: Pour nettoyer la verrerie, les instruments et les filtres pour les analyses lipidiques, lavez-les 3 fois avec du méthanol suivi de 3 lavages au chloroforme, ou chauffez-les à 450 ° C pendant au moins 8 heures.
1. Procédure de filtration de l’eau de mer dissoute et des lipides particulaires
REMARQUE: La fraction particulière d’intérêt est définie sur le plan opérationnel par la procédure de filtration. Dans ce cas, la taille des pores est de 1,2 μm.
- Installez le collecteur de filtration sans filtre et rincez l’installation avec de l’eau de mer filtrée.
- À l’aide de pinces propres, placez un filtre en fibre de verre (GF / C) de 47 mm, qui a été lavé, dans le système de filtration propre.
- Prenez l’échantillon et faites tourbillonner doucement pour ressuspender tout matériau qui pourrait s’être déposé au fond du récipient de collecte. Mesurez avec précision un volume connu, dans ce cas 1 L, et filtrez-le à travers le filtre.
REMARQUE: Le volume dépendra de la quantité de particules dans l’échantillon: généralement entre 250 mL et 5 L selon la saison et l’emplacement. - Lorsque l’échantillon a été mesuré, mouillez doucement le filtre avec de l’eau de mer filtrée. Ajoutez l’échantillon entier lentement au système de filtration et rincez le cylindre gradué avec de l’eau de mer filtrée pour vous assurer que toutes les particules sont ajoutées au filtre. Rincez l’installation avec de l’eau de mer filtrée sur les côtés pour vous assurer que toutes les particules sont rincées sur le filtre.
- Laissez toute l’eau de mer passer à travers le filtre, mais ne laissez pas le filtre sécher complètement car cela pourrait perturber les cellules du filtre; casser l’aspiration lorsque la dernière de l’eau disparaît.
- À l’aide de pinces propres et d’une pipette propre, pliez le filtre en deux, puis en tiers, puis en deux dans le sens de la longueur pour rouler le filtre dans un tube. Placez-le dans un flacon en verre propre et étiqueté de 10 mL.
- Couvrir le filtre avec 2 mL de chloroforme. Remplissez l’espace de la tête avec de l’azote et scellez avec du ruban PTFE. Placer dans une grille dans un congélateur à -20 °C. Les échantillons seront stables à cette température jusqu’à un an.
REMARQUE: Pour relier les concentrations lipidiques aux concentrations massiques totales, une mesure du poids sec est également nécessaire. Cela implique de mettre un filtre pré-pesé de 24 mm dans une configuration de filtration de poids sec, de remuer l’échantillon et de prélever un petit sous-échantillon qui est filtré sur le petit filtre. Lorsque le filtre est presque sec, environ 10 mL de formiate d’ammonium à 3,5 % sont ajoutés au filtre. Le filtre est plié en deux, retourné dans une boîte de Petri étiquetée et placé dans un congélateur.
2. Extraction liquide-liquide d’eau de mer ou d’échantillons liquides
-
Préparation de l’échantillon
- Mesurer un volume connu de filtrat dans un cylindre gradué en verre propre aux lipides. Placez cet échantillon dans un entonnoir séparateur propre de 1 L. Ajoutez ensuite 20 mL de chloroforme à l’échantillon et agitez pendant 2 min, en évavent fréquemment.
-
Élimination du premier extrait et ajout d’acide après la première séparation
- Enveloppez l’entonnoir dans du papier d’aluminium et attendez 5 à 10 minutes pour que la séparation se produise. Retirez le fond de la feuille pour voir les deux couches. Recueillez la couche organique inférieure à travers le robinet d’arrêt dans une fiole à fond rond propre, en prenant soin de ne pas inclure la couche supérieure. Coiuchez la fiole à fond rond sous azote et placez-la au congélateur.
- Ajouter 0,25 mL de H 2 SO4concentré pourchaque litre d’échantillon à l’échantillon dans l’entonnoir séparateur et agiter doucement l’entonnoir.
- Ajouter 10 mL de chloroforme et agiter vigoureusement pendant 2 min tout en évançant fréquemment. Permettez à la séparation d’avoir lieu.
-
Deuxième et troisième séparations
- Attendez la séparation et ajoutez la couche inférieure dans la fiole à fond rond.
- Ajouter un troisième 10 mL de chloroforme et agiter pendant 2 minutes, en évavent à nouveau fréquemment. Après la séparation, ajoutez la couche inférieure à la fiole à fond rond.
- Transférer l’extrait dans la fiole à fond rond dans un évaporateur rotatif, évaporer et transférer dans un flacon de 2 mL.
3. Protocole d’extraction des solides (extraction modifiée de Folch et al.3)
-
Coup monté
REMARQUE: La configuration d’extraction nécessite un récipient isolé rempli de glace. Les solvants comprennent le méthanol, l’eau extraite du chloroforme et le chloroforme:méthanol 2:1. Tous les solvants doivent être placés sur de la glace de sorte qu’ils soient froids au moment où les extractions sont commencées. Les échantillons vont également sur la glace, de sorte que tout reste froid.- Rincez tous les tubes et les bouchons doublés de PTFE 3 fois avec du méthanol, puis 3 fois avec du chloroforme. Un tube de centrifugeuse et un flacon de 15 mL avec un bouchon sont nécessaires pour chaque extraction.
- Placer l’échantillon dans un tube de centrifugeuse contenant 2 mL de chloroforme. La taille de l’échantillon dépend de la quantité de lipides présents, environ 5 à 10 mg de lipides préférés.
-
Broyage et extraction
- Ajouter environ 1 mL de méthanol glacé et broyer rapidement l’échantillon en pâte à l’écheveillement à l’éventreur propre ou à la tige en PTFE/métal.
- Lavez la tige dans le tube avec environ 1 mL de chloroforme glacé 2:1 : méthanol, puis avec 1/2 mL d’eau glacée extraite du chloroforme. Si nécessaire, utilisez un ensemble propre de pinces pour forcer les particules à retourner dans le flacon avant de les laver. Coiuchez le tube et soniquez le mélange pendant 4 minutes dans un bain à ultrasons (35 - 42 kHz).
-
Double pipetage: Centrifuger l’échantillon pendant 2 min à 1800 × g. Collectez toute la couche organique (couche inférieure) à l’aide de la technique de double pipetage dans laquelle une pipette de 5 3/4 « avec l’ampoule lâchement est doucement poussée à travers les deux couches, tout en pressant l’ampoule, provoquant la sortie de bulles.
- Lorsque le bas de la deuxième couche est atteint, utilisez le pouce pour retirer l’ampoule sans dessiner la couche organique dans la pipette. Placez une pipette de 9 po à l’intérieur de celle de 5 3/4 po et retirez la couche inférieure à travers la pipette de 5 3/4 po.
- Placez l’extrait dans un flacon propre. Continuez à enlever la couche inférieure jusqu’à ce qu’elle soit entièrement enlevée.
-
Pipettes de lavage: Rincez la pipette de 9 po dans le flacon contenant la couche organique en utilisant 1,5 mL de chloroforme glacé pour laver l’extérieur de la pipette et 1,5 mL pour laver l’intérieur. Tournez doucement cette pipette pendant le lavage et assurez-vous que tout le chloroforme coule dans la pipette dans un flacon.
- Rincez la pipette 5 3/4 » dans le tube contenant la couche aqueuse de la même manière.
- Sonicate et centrifuger les échantillons et la double pipette lorsqu’ils sont séparés, en utilisant de nouvelles pipettes à chaque fois. Répétez au moins trois fois et remettez en commun toutes les couches organiques. Après avoir retiré la couche organique pour la troisième fois, lavez les deux pipettes dans le flacon contenant la couche organique.
- À l’aide d’un léger flux d’azote, concentrez-vous jusqu’au volume, puis scellez avec du ruban PTFE et conservez-le au congélateur.
4. Développement de systèmes et d’étapes pour la séparation TLC des classes de lipides marins
-
Préparation des tiges pour TLC
- Scannez à blanc les tiges dans le scanner FID automatique trois fois
- Repérage d’un échantillon: Appliquez des échantillons et des étalons avec une seringue sur les tiges à l’origine ou juste en dessous. Distribuer 0,5 μL et toucher la goutte sur la tige. Laisser sécher avant de placer la goutte suivante au même endroit. Repérez tous les échantillons dans une ligne sur des tiges.
- Mise au point dans l’acétone: Focalisation des échantillons deux fois (trois fois si les échantillons sont très concentrés) dans 70 mL d’acétone. Observez le front du solvant pendant qu’il grimpe sur la tige jusqu’à ce que le bas de la tache fusionne avec le haut. Retirez les tiges, séchez-les pendant environ 5 s, puis répétez la procédure pour produire une bande étroite de matière lipidique près du fond de la tige.
- Sécher et conditionner les tiges dans une chambre à humidité constante pendant 5 min. Une chambre à humidité constante est un dessiccateur avec une solution saturée de chlorure de calcium sous la plaque.
-
Séquence menant au premier chromatogramme (hydrocarbure à cétone)
-
Premier système de développement: Le premier système de développement est hexane:diéthyléther:acide formique, 98.95:1:0.05. Utilisez une seringue pour ajouter l’acide formique, mais rincez d’abord la seringue 3× avec de l’acide formique. Rincez l’acide formique hors de la seringue immédiatement après avec du chloroforme. Utilisez 30 mL du mélange pour mouiller le papier et rincer le réservoir. Jeter la solution de rinçage et ajouter les 70 mL restants dans le réservoir.
- Prenez les supports et abaissez-les doucement dans le réservoir. Observez jusqu’à ce que le front du solvant atteigne les points d’échantillonnage, puis démarrez la minuterie. Après 25 min, retirez les tiges de la chambre de développement, séchez dans la chambre à humidité constante pendant 5 min et redéveloppez-les dans la même solution pendant encore 20 min.
- Séchez les tiges pendant 5 minutes dans le scanner FID automatique, puis numérisez jusqu’au point le plus bas derrière le pic cétique à l’aide d’un balayage PPS de 25.
-
Premier système de développement: Le premier système de développement est hexane:diéthyléther:acide formique, 98.95:1:0.05. Utilisez une seringue pour ajouter l’acide formique, mais rincez d’abord la seringue 3× avec de l’acide formique. Rincez l’acide formique hors de la seringue immédiatement après avec du chloroforme. Utilisez 30 mL du mélange pour mouiller le papier et rincer le réservoir. Jeter la solution de rinçage et ajouter les 70 mL restants dans le réservoir.
-
Séquence menant au deuxième chromatogramme (triacylglycérol à diacylglycérol):
- Conditionnez les tiges pendant 5 min dans la chambre à humidité constante.
- Deuxième système de développement: Le deuxième système de développement est hexane:diéthyléther:acide formique, 79:20:1. Ajouter ~30 mL au réservoir de développement pour mouiller le papier et rincer le réservoir. Ensuite, jetez et développez les tiges pendant 40 min dans les 70 mL restants. Pour une meilleure séparation entre les pics TAG (saturés) et TAG (polyinsaturés), utilisez un mélange de 79,9:20:0,1, mais pour la séparation des pics ST et DAG, utilisez un mélange de 79:20:1.
- Sécher et scanner au point le plus bas derrière le pic de diacylglycérol dans un deuxième scan partiel à l’aide d’un scan PPS 11.
-
Séquence menant au troisième chromatogramme (lipide polaire et phospholipide mobile acétone)
- Conditionnez les tiges pendant 5 minutes dans la chambre à humidité constante.
- Développer les tiges deux fois pendant 15 minutes dans 70 mL d’acétone. Entre les développements, les tiges sèchent à l’air libre pendant environ 30 secondes.
- Conditionnez les tiges pendant 5 minutes dans la chambre à humidité constante.
- Troisième système de développement: Le troisième système de développement est un mélange de chloroforme, de méthanol et d’eau extraite du chloroforme, 50:40:10. Développer les bâtonnets deux fois pendant 10 minutes dans 70 mL du mélange. Entre les développements, séchez les tiges à l’air libre pendant environ 30 secondes.
- Sécher et scanner toute la longueur des tiges.
5. Dérivatisation FAME avec H2SO4 en MeOH
-
Fabrication du réactif Hilditch
- Préparation du méthanol: Placer 100 mL de MeOH dans une fiole jaugée propre puis saupoudrer doucement de NaSO4 anhydre jusqu’à ce que le fond de la fiole soit recouvert. Une fois recouvert, inverser deux fois de sorte que toute eau dans le méthanol soit absorbée par le NaSO4. Après l’inversion et le tremblement, laissez-le reposer pendant au moins 5 min.
- Ajout de l’acide: Décantez lentement le méthanol dans un bocal en verre (le NaSO4 est maintenant un morceau dur dans le fond de la fiole) et leH2SO4 est ajouté. Ajouter lentement 1,5 mL d’acide sulfurique au méthanol à l’aide d’une pipette. Ajouter quelques gouttes à la fois et une fois que tout l’acide a été ajouté, coiuer et remuer doucement pour mélanger. La solution est maintenant prête à être utilisée pour les produits dérivés, mais elle doit être préparée sur une base hebdomadaire.
-
Fabrication des dérivés
- Transférer environ 200 μg de lipides d’un flacon d’extrait dont le volume a été porté à une quantité connue, dans un flacon propre de 15 mL et évaporer sous azote jusqu’à la sécheresse. La quantité retirée sera déterminée par la concentration de l’échantillon de TLC/FID. Utilisez une pipette propre pour retirer l’échantillon.
- Lorsque l’échantillon a séché, ajouter 1,5 mL de dichlorométhane et 3 mL du réactif Hilditch nouvellement fabriqué.
- Vortex l’échantillon et sonique dans un bain à ultrasons pendant 4 minutes pour éliminer les lipides qui ont adhéré au flacon en verre. Remplissez le flacon d’azote, bouchon et scellez-le avec du ruban PTFE et chauffez à 100 °C pendant 1 heure.
-
Arrêter la réaction
- Laissez les échantillons refroidir complètement à la température ambiante pendant 10 minutes après le retrait du four, puis ouvrez soigneusement les flacons.
- Ajouter lentement environ 0,5 mL de solution saturée de bicarbonate de sodium (9 g/100 mL d’eau extraite du chloroforme), puis 1,5 mL d’hexane. Agiter ou vortexer le flacon, puis laisser reposer pour qu’il se sépare en 2 couches.
-
Collecte des FAME
- Retraitde la couche supérieure : Une fois que la dérivatisation a été arrêtée et qu’il y a une séparation claire, retirez la phase organique supérieure et placez-la dans un flacon lipidique propre de 2 mL.
- Évaporer le solvant dans le flacon de 2 mL à sec et le remplir d’hexane à environ 0,5 mL.
- Remplissez l’espace de tête du flacon avec de l’azote, coiffez et scellez le flacon avec du ruban PTFE, soniquez pendant encore 4 minutes pour suspendre à nouveau les acides gras, puis il est prêt à aller au GC.
REMARQUE: Si des concentrations d’acides gras sont nécessaires, la couche aqueuse doit être lavée trois fois avec de l’hexane et toutes les couches organiques regroupées dans le flacon de 2 mL. Cela implique l’ajout de 2 mL d’hexane, le vortex de l’échantillon, la centrifugation et l’élimination de la couche organique, le tout répété 3 fois.
Résultats
En tant que secteur de la production alimentaire à la croissance la plus rapide, l’aquaculture évolue en termes d’innovations technologiques et d’adaptations pour répondre aux exigences changeantes. L’un d’eux consiste à réduire la dépendance à la farine et à l’huile de poisson d’origine sauvage, qui fournissent des ingrédients alimentaires à de nombreuses espèces aquacoles. Les huiles végétales terrestres sont à l’étude en tant que substituts durables et économiques de l’huile de poisson dans les aliments aquatiques, et le foie est un tissu cible pour l’analyse car il est le principal site du métabolisme des lipides12. La figure 2 montre les chromatogrammes TLC-FID bruts obtenus à partir de notre étalon à neuf composants, un régime que nous avons formulé avec de l’huile de poisson à 7% et de l’huile de colza à 5%, et du tissu hépatique provenant d’un saumon de l’Atlantique nourri avec ce régime. Le tableau 1 montre les données obtenues après l’analyse des répliques alimentaires et des échantillons de différents poissons. Ces données ont été obtenues après avoir construit des courbes standard à partir des réponses FID du scanner pour quantifier les classes de lipides dans les extraits à l’aide du logiciel Peak Simple (version 4.54). Les données montrent la prévalence des triacylglycérols dans l’alimentation et le foie et aussi l’importance des phospholipides membranaires dans le foie.
Les marges continentales présentent généralement une productivité biologique très élevée et sont particulièrement importantes dans le cycle du carbone. La productivité primaire de surface atteint davantage le fond marin dans des eaux moins profondes, et la mesure de la quantité et de la qualité des particules se déposant de la couche mixte supérieure dans le réseau trophique benthique est donc d’un grand intérêt. Riches en carbone et ayant un contenu énergétique très élevé, les lipides sont des composants importants de la productivité des plateaux continentaux. Historiquement, les eaux adjacentes à Terre-Neuve-et-Labrador ont soutenu l’une des plus grandes pêcheries au monde pendant environ cinq siècles, et nous étudions la production et le transfert de lipides dans ce système13. La figure 3 montre les chromatogrammes TLC-FID obtenus à partir de notre étalon, les lipides dans les matières particulaires décantées recueillies à 220 m au large des côtes de Terre-Neuve, et les lipides dans un petit myside, Erythrops erythrophtalma recueillis près de la même profondeur. Cette fois, les chromatogrammes ont été traités à l’au moyen d’un logiciel de traçage et les deux balayages partiels ont été combinés avec le balayage complet final. Le tableau 2 montre les données obtenues après l’analyse d’échantillons répliqués de particules décantées et du mysid. Parmi les 19 taxons de 5 phyla, le petit myside avait, en moyenne, la plus forte concentration lipidique (6% du poids humide)13.
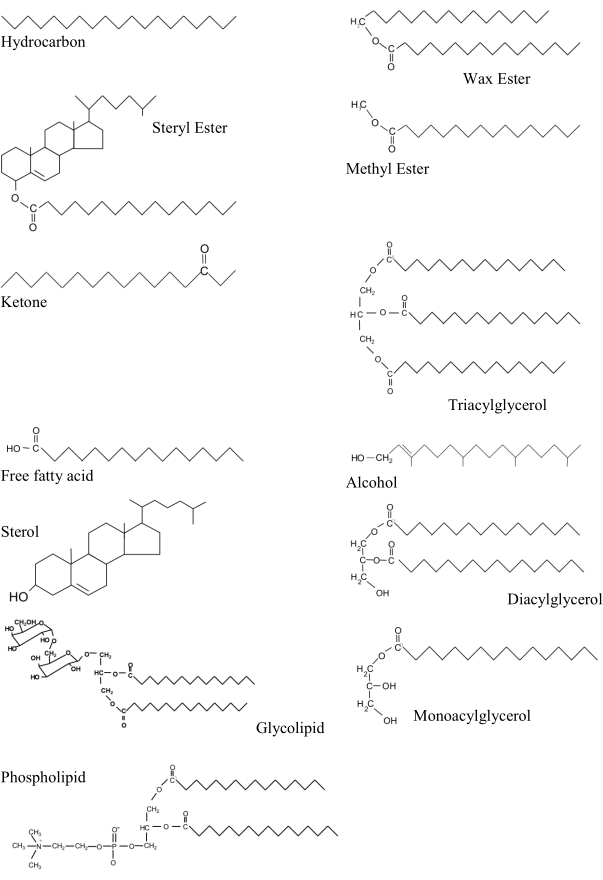
Figure 1: Principales classes lipidiques dans les échantillons marins dans un ordre approximatif d’augmentation de polarité. Chaque structure est dessinée avec la partie la plus hydrophobe de la molécule pointant vers la droite de la figure. Les composés représentatifs des classes lipidiques sont:- hydrocarbures: nonadécane; ester de cire: palmitate d’hexadécyle; ester de stéryle: palmitate de cholestéryle; ester méthylique: palmitate de méthyle; cétone: 3-hexadécanone; triacylglycérol: tripalmitine; acide gras libre: acide palmitique; alcool: phytol; stérol: cholestérol; diacylglycérol: dipalmitoyl glycérol; monoacylglycérol: monopalmitoyl glycérol; glycolipide: digalactosyl diacylglycérol; phospholipide: dipalmitoyl phosphatidylcholine. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Chromatogrammes TLC-FID de la composition lipidique d’une expérience d’alimentation aquacole. Des extraits ont été repérés sur des tiges de TLC recouvertes de gel de silice et un système de développement en trois étapes a été utilisé pour séparer les classes de lipides. Les premier et deuxième systèmes de développement étaient hexane:diéthyl éther:acide formique (98,95:1:0,05) et (79,9:20:0,1) respectivement afin de séparer les lipides neutres, y compris le triacylglycérol, l’acide gras libre et le stérol pour le balayage dans le scanner FID automatique. Les troisièmes systèmes de développement consistaient en 100% d’acétone avant chloroforme:méthanol:eau (5:4:1) afin de séparer les lipides polaires mobiles à l’acétone et les phospholipides. Des courbes standard (c.-à-d. nonadécane, palmitate de cholestéryle, 3-hexadécanone, tripalmitine, acide palmitique, alcool cétylique, cholestérol, monopalmitoyl glycérol, dipalmitoyl phosphatidylcholine) ont été utilisées pour quantifier les classes de lipides dans les extraits à l’aide du logiciel Peak Simple (version 4.54). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3: Chromatogrammes TLC-FID de la composition lipidique d’échantillons proches du fond de la côte de Terre-Neuve. a) étalon à neuf composants, b) 220 m de matières particulaires décantées de conception Bay, Terre-Neuve, c) classes lipidiques dans le myside, Erythrops erythrophtalma. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Régime alimentaire à l’huile de poisson/ huile de colza | Foie de saumon de l’Atlantique | |
| Hydrocarbures | 1,3±0,9 | 0,5±0,2 |
| Steryl Esters/Esters de cire | 0,4±0,6 | 0,6±0,3 |
| Esters éthyliques | 0 | 0 |
| Esters méthyliques | 0 | 0 |
| Cétones d’éthyle | 0 | 0,3±0,2 |
| Méthylcétones | 0 | 0 |
| Éthers de glycéryle | 0 | 0 |
| Triacylglycérols | 145,0±26,3 | 16.9±8.1 |
| Acides gras libres | 21.9±2.2 | 1.2±0.9 |
| Alcools | 0 | 1,4±0,4 |
| Stérols | 6.8±2.1 | 2.6±0.2 |
| Diacylglycérols | 0 | 0 |
| Lipides polaires mobiles à l’acétone | 14,0±2,5 | 2,2±0,6 |
| Phospholipides | 12,5±4,0 | 22,0±2,0 |
| Lipides totaux | 201,8±27,4 | 47,7±11,8 |
Tableau 1 : Composition lipidique dans une expérience d’alimentation en aquaculture. Les données sont (moyenne±élargité standard) d’un régime expérimental contenant 6,80 % d’huile de poisson et 4,80 % d’huile de colza, tel qu’il est nourri (mg g-1 poids humide), et de foies de saumon atlantique (mg g-1 poids humide) après avoir nourri ce régime pendant 12 semaines.
| Décantation des particules | Erythrops erythrophtalma | |
| Steryl Esters/Wax Esters (% lipides totaux) | 10,2±8,28 | 8,85±1,67 |
| Triacylglycérols (% lipides totaux) | 19,7±5,35 | 58,5±9,19 |
| Phospholipides (% lipides totaux) | 16,2 ± 3,51 | 21,4±5,35 |
| Lipides neutres (% lipides totaux) | 12,5±4,0 | 73,4±5,46 |
| Indice de lipolyse (%) | 18,1±5,20 | 2,77±2,78 |
| Lipides totaux | 0,57±0,25 | 5,86±1,44 |
| Lipides neutres: hydrocarbures, esters de cire et de stéryl, cétones, triacylglycérols, acides gras libres; (FFA), alcools (ALC), stérols, diacylglycérols; LI: indice de lipolyse [(FFA + ALC) (lipides acyl + ALC)–1]; Lipides totaux (somme des classes lipidiques déterminées par TLC/FID) particules - % poids sec, Mysid - % poids humide | ||
Tableau 2 : Composition lipidique d’échantillons prélevés près du fond sur la côte de Terre-Neuve. Les données sont (moyennes±inspection standard) de 220 m de matières particulaires décantées à partir de Conception Bay Newfoundland, et du mysid, Erythrops erythrophtalma.
Note de bas de page: Lipides neutres: hydrocarbures, esters de cire et de stéryl, cétones, triacylglycérols, acides gras libres; (FFA), alcools (ALC), stérols, diacylglycérols; LI: indice de lipolyse [(FFA+ ALC) (lipides acyle + ALC)-1]; Lipides totaux (somme des classes de lipides déterminées par fiD) particules - % poids sec, Mysid - % poids humide.
Discussion
La rapidité avec laquelle le système TLC-FID fournit des informations synoptiques sur la classe des lipides à partir de petits échantillons fait du TLC-FID un outil capable de filtrer les échantillons marins avant d’entreprendre des procédures analytiques plus complexes. De telles analyses nécessitent généralement la libération de composés constitutifs à partir d’extraits lipidiques et la dérivatisation pour augmenter la volatilité dans le cas de la chromatographie en phase gazeuse. TLC-FID combiné avec GC-FID s’est avéré être une combinaison puissante pour les extraits de fruits de mer et d’autres denrées alimentaires14. Pour des analyses réussies des lipides marins, il est essentiel que les échantillons soient protégés contre la dégradation et la contamination tout au long et qu’un grand soin soit apporté à l’application de l’échantillon sur la tige. Une approche consiste à appliquer l’ensemble de l’échantillon marin à la tige à l’aide d’un pipettor microcapillaire15, et une innovation dans les types d’échantillons marins consiste à ajouter des échantillons de microcouches de surface de la mer et d’aérosols aux échantillons d’eau de mer16.
Le système FID du scanner automatique fournit une quantification rapide des microgrammes sans dérivatisation ni nettoyage; cependant, il n’est pas aussi sensible, précis ou linéaire que dans les chromatographes en phase gazeuse. Cela signifie que des courbes d’étalonnage doivent être construites et qu’il peut parfois être nécessaire d’analyser des échantillons à deux charges différentes afin de maintenir les pics de classe lipidique plus petits et plus grands dans les plages d’étalonnage.
En utilisant la fonction de balayage partiel du scanner FID, il est possible de séparer plusieurs classes de lipides d’une seule application d’échantillon à une tige. Cependant, la chromatographie sur l’acide silicique ne parvient pas à résoudre les esters de cire (WE) et les esters de stéryl (SE), et quelques classes peuvent être incluses dans le pic « acétone-lipide polaire mobile » (AMPL)17. WE-SE était la principale classe de lipides dans les ovocytes de bonefish et il est suggéré qu’ils sont utilisés pour soutenir la flottabilité et / ou le stockage d’énergie18.
Dans l’AMPL provenant d’organismes photosynthétiques, les glycoclycérolipides éluent souvent avec les monoacylglycérols et les pigments de l’acétone. Cela peut présenter un problème de quantification car la chlorophylle a et les glycolipides monogalactosyl diacylglycérol (MGDG) et digalactosyl diacylglycérol (DGDG) ont des réponses FID différentes dans le scanner; cependant, nous utilisons le 1-monopalmitoyl glycérol comme norme pour la classe AMPL, et cela a une réponse intermédiaire parmi eux17.
Bien que certains pics de scanner FID puissent contenir plus d’une classe de lipides, il est parfois utile de regrouper fonctionnellement des classes de lipides séparées. Par exemple, l’AMPL et le PL ont été regroupés en lipides polaires puis en lipides structurels avec l’ajout de stérol19. De tels regroupements ont été utilisés pour étudier les périodes critiques pour l’utilisation des lipides au cours du développement chez les invertébrés19. D’autres groupes impliquant des acides gras libres et des alcools peuvent être utilisés comme indicateurs de dégradation tels que l’indice de lipolyse (Tableau 2) ou l’indice d’hydrolyse1. LI est l’indice de lipolyse de tous les lipides acyl tandis que HI est l’indice d’hydrolyse des lipides acyl non polaires. Les valeurs LI sont toujours inférieures à celles de HI pour n’importe quel échantillon car tous les lipides d’acyle sont inclus.
Parfois, le pic de fractionnement se produit dans les séparations de tiges d’extraits d’échantillons marins en raison de la présence de niveaux élevés d’espèces polyinsaturées, ce qui peut rendre l’identification difficile. Ceci a été observé avec les esters de cire (Figure 3), les triacylglycérols et les acides gras libres20,21, et nécessite une co-repérage avec des étalons authentiques et/ou une confirmation avec d’autres techniques chromatographiques. De même, un pic de division peut se produire dans la région des lipides polaires(Figure 2 et Figure 3),et d’autres développements peuvent être entrepris pour séparer les composants glycolipides et pigments17,22 et les classes de phospholipides22,23.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers concurrents.
Remerciements
Cette recherche a été financée par le Conseil de recherches en sciences naturelles et en génie du Canada (CNSR) numéro 105379 à C.C. Parrish. Le réseau CREAIT (Core Research Equipment & Instrument Training) de l’Université Memorial a contribué au financement de cette publication.
matériels
| Name | Company | Catalog Number | Comments |
| 15 ml vials | VWR | 66009-560 | |
| 1-hexadecanol | Sigma | 258741-1G | |
| 1-Monopalmitoyl-rac-glycerol | Sigma | M1640-1g | |
| 2 ml vials | VWR | 46610-722 | |
| 25 mm glass fibre filters | Fisher | 09 874 32A | |
| 2ml pipet bulbs | VWR | 82024-554 | |
| 47 mm glass fibre filters | Fisher | 09 874 32 | |
| 5 3/4" pipets | Fisher | 1367820A | |
| 9" pipets | Fisher | 1367820C | |
| Acetone | VWR | CAAX0116-1 | |
| Agilent GC-FID 6890 | Agilent | ||
| Calcium Chloride ANHS 500gm | VWR | CACX0160-1 | |
| Caps for 2 ml vials | VWR | 46610-712 | |
| chloroform | VWR | CACX1054-1 | |
| Cholesteryl palmitate | Sigma | C6072-1G | |
| Chromarod S5 | Shell USA | 3252 | |
| Dichloromethane | VWR | CADX0831-1 | |
| DL-a-phosphatidylcholine, dipalmotoyl | Sigma | P5911-1g | |
| Ethyl Ether, ACS grade anhydr 4L | VWR | CAEX0190-4 | |
| Glyceryl tripalmitate | Sigma | T5888-100MG | |
| Hamilton Syringe 702SNR 25µl | Sigma | 58381 | |
| Helium | Air Liquide | A0492781 | |
| Hexane | VWR | CAHX0296-1 | |
| Hydrogen regulator | VWR | 55850-484 | |
| Iatroscan MK6 | Shell USA | ||
| Kimwipes | Fisher | 066662 | |
| Medical Air | Air Liquide | A0464563 | |
| Medium nitrile gloves | Fisher | 191301597C | |
| Nitrile gloves L | VWR | CA82013-782 | |
| Nitrogen | Air Liquide | A0464775 | |
| Nitrogen Regulator | VWR | 55850-474 | |
| Nonadecane | Sigma | 74158-1G | |
| Palmitic acid | Sigma | P0500-10G | |
| Repeating dispenser | Sigma | 20943 | |
| Sodium Bicarbonate 1kg | VWR | CA97062-460 | |
| Sodium Sulfate Anhy ACS 500gr | VWR | CA71008-804 | |
| Sulfuric acid | VWR | CASX1244-5 | |
| Teflon tape | Fisher | 14610120 | |
| tissue master 125 115V w/7mm homogenator | OMNI International | TM125-115 | |
| TLC development tank | Shell USA | 3201 | |
| UHP hydrogen | Air Liquide | A0492788 | |
| VWR solvent repippetter | VWR | 82017-766 | |
| VWR timer Flashing LED 2 channel | VWR | 89140-196 | |
| Zebron ZB-Wax GC column | Phenomenex | 7HM-G013-11 |
Références
- Couturier, L. I. E., et al. State of art and best practices for fatty acid analysis in aquatic sciences. ICES Journal of Marine Science. , (2020).
- Parrish, C. C. Lipids in Marine Ecosystems. ISRN Oceanography. , 604045(2013).
- Folch, J., Lees, M., Stanley, G. H. S. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226, 497-509 (1957).
- Vaz, F. M., Pras-Raves, M., Bootsma, A. H., van Kampen, A. H. C. Principles and practice of lipidomics. Journal of Inherited Metabolic Disease. , (2014).
- Wolf, C., Quinn, P. J. Lipidomics: practical aspects and applications. Progress in Lipid Research. 47, 15-36 (2008).
- Parrish, C. C. Determination of total lipid, lipid classes, and fatty acids in aquatic samples. Lipids in Freshwater Ecosystems. Arts, M. T., ainman, B. C. , Springer-Verlag. New York. 4-20 (1999).
- Jüttner, F. Liberation of 5,8,11,14,17-eicosapentaenoic acid and other polyunsaturated fatty acids from lipids as a grazer defense reaction in epilithic diatom biofilms. Journal of Phycology. 37, 744-755 (2001).
- Carreón-Palau, L., Parrish, C. C., Pérez-España, H., Aguiñiga-Garcia, S. Elemental ratios and lipid classes in a coral reef food web under river influence. Progress in Oceanography. 164, 1-11 (2018).
- Maciel, E., et al. Bioprospecting of marine macrophytes using MS-based lipidomics as a new approach. Marine Drugs. 14, 49(2016).
- Pernet, F., Tremblay, R., Comeau, L., Guderley, H. Temperature adaptation in two bivalve species from different thermal habitats: energetics and remodelling of membrane lipids. Journal of Experimental Biology. 210, 2999-3014 (2007).
- Bergen, B. J., Quinn, J. G., Parrish, C. C. Quality-assurance study of marine lipid-class determination using Chromarod/Iatroscan thin-layer chromatography-flame ionization detector. Environmental Toxicology and Chemistry. 19, 2189-2197 (2000).
- Foroutani, B. M., Parrish, C. C., Wells, J., Taylor, R. G., Rise, M. L. Minimizing marine ingredients in diets of farmed Atlantic salmon (Salmo salar): effects on liver and head kidney lipid class, fatty acid and elemental composition. Fish Physiology & Biochemistry. 46, 2331-2353 (2020).
- Parrish, C. C., Deibel, D., Thompson, R. J. Effect of sinking spring phytoplankton blooms on lipid content and composition in suprabenthic and benthic invertebrates in a cold ocean coastal environment. Marine Ecology Progress Series. 391, 33-51 (2009).
- Sinanoglou, V. J., et al. On the combined application of Iatroscan TLC-FID and GC-FID to identify total, neutral, and polar lipids and their fatty acids extracted from foods. ISRN Chromatography. , 59024(2013).
- Peters-Didier, J., Sewell, M. A. Maternal investment and nutrient utilization during early larval development of the sea cucumber Australostichopus mollis. Marine Biology. 164, 178(2017).
- Triesch, N., et al. Concerted measurements of lipids in seawater and on submicron aerosol particles at the Cape Verde Islands: biogenic sources, selective transfer and high enrichments. Atmospheric Chemistry and Physics. 21, 4267-4283 (2021).
- Parrish, C. C., Bodennec, G., Gentien, P. Determination of glycoglycerolipids by Chromarod thin-layer chromatography with Iatroscan flame ionization detection. Journal of Chromatography A. 741, 91-97 (1996).
- Mejri, S., et al. Bonefish (Albula vulpes) oocyte lipid class and fatty acid composition related to their development. Environmental Biology of Fishes. 102, 221-232 (2019).
- Sewell, M. A. Utilization of lipids during early development of the sea urchin Evechinus chloroticus. Marine Ecology Progress Series. 304, 133-142 (2005).
- Parrish, C. C., Bodennec, G., Gentien, P. Separation of polyunsaturated and saturated lipids from marine phytoplankton on silica gel coated Chromarods. Journal of Chromatography A. 607, 97-104 (1992).
- Stevens, C. J., Deibel, D., Parrish, C. C. Incorporation of bacterial fatty acids and changes in a wax ester-based omnivory index during a long-term incubation experiment with Calanus glacialis Jaschnov. Journal of Experimental Marine Biology and Ecology. 303, 135-156 (2004).
- Goutx, M., et al. Short term summer to autumn variability of dissolved lipid classes in the Ligurian Sea (NW Mediterranean). Biogeosciences. 6, 1229-1246 (2009).
- Conlan, J. A., Rocker, M. M., Francis, D. S. A. comparison of two common sample preparation techniques for lipid and fatty acid analysis in three different coral morphotypes reveals quantitative and qualitative differences. PeerJ. 5, 3645(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon