Method Article
Bestimmung von Gesamtlipid und Lipidklassen in marinen Proben
In diesem Artikel
Zusammenfassung
Dieses Protokoll dient zur Bestimmung von Lipiden in Meerwasser und biologischen Proben. Lipide in Filtraten werden mit Chloroform oder Mischungen von Chloroform und Methanol im Falle von Feststoffen extrahiert. Lipidklassen werden durch Stäbchendünnschichtchromatographie mit Flammenionisationsdetektion gemessen und ihre Summe ergibt den Gesamtlipidgehalt.
Zusammenfassung
Lipide bestehen größtenteils aus Kohlenstoff und Wasserstoff und liefern daher eine größere spezifische Energie als andere organische Makromoleküle im Meer. Da sie kohlenstoff- und wasserstoffreich sind, sind sie auch hydrophob und können als Lösungsmittel und Absorptionsträger für organische Schadstoffe fungieren und somit Treiber der Schadstoffbioakkumulation in marinen Ökosystemen sein. Ihre hydrophobe Natur erleichtert ihre Isolierung von Meerwasser oder biologischen Proben: Die marine Lipidanalyse beginnt mit der Probenahme und dann der Extraktion in unpolaren organischen Lösungsmitteln und bietet eine bequeme Methode für ihre Trennung von anderen Substanzen in einer aquatischen Matrix.
Wenn Meerwasser beprobt wurde, besteht der erste Schritt in der Regel darin, durch Filtration in operativ definierte "gelöste" und "partikuläre" Fraktionen zu trennen. Proben werden entnommen und Lipide aus der Probenmatrix isoliert, typischerweise mit Chloroform für wirklich gelöste Stoffe und Kolloide und mit Mischungen aus Chloroform und Methanol für Feststoffe und biologische Proben. Solche Extrakte können mehrere Klassen aus biogenen und anthropogenen Quellen enthalten. Zu diesem Zeitpunkt können Gesamtlipide und Lipidklassen bestimmt werden. Das Gesamtlipid kann gemessen werden, indem individuell bestimmte Lipidklassen summiert werden, die üblicherweise chromatographisch getrennt wurden. Die Dünnschichtchromatographie (TLC) mit Flammenionisationsdetektion (FID) wird regelmäßig zur quantitativen Analyse von Lipiden aus marinen Proben eingesetzt. TLC-FID liefert synoptische Lipidklasseninformationen und durch Summieren von Klassen eine Gesamtlipidmessung.
Informationen zur Lipidklasse sind besonders nützlich, wenn sie mit Messungen einzelner Komponenten, z. B. Fettsäuren und/oder Sterole, nach ihrer Freisetzung aus Lipidextrakten kombiniert werden. Die große Vielfalt an Lipidstrukturen und -funktionen bedeutet, dass sie in der ökologischen und biogeochemischen Forschung umfassend eingesetzt werden, um die Gesundheit des Ökosystems und den Grad des Einflusses durch anthropogene Auswirkungen zu bewerten. Sie wurden verwendet, um Substanzen von diätetischem Wert für die Meeresfauna (z. B. Aquafeeds und / oder Beute) und als Indikator für die Wasserqualität (z. B. Kohlenwasserstoffe) zu messen.
Einleitung
Die hier beschriebenen Methoden betreffen Stoffe, die operativ als marine Lipide definiert sind. Diese Definition basiert auf ihrer Zugänglichkeit zur Flüssig-Flüssig-Extraktion in unpolaren organischen Lösungsmitteln und bietet eine bequeme Methode für ihre Trennung von anderen Substanzen in einer aquatischen Matrix. Ihre hydrophobe Natur erleichtert ihre Isolierung von Meerwasser oder biologischen Proben sowie deren Anreicherung und die Entfernung von Salzen und Proteinen.
Die Messung des Lipidgehalts und seiner Zusammensetzung in Meeresorganismen ist seit Jahrzehnten in der Nahrungsnetzökologie, der Aquakulturernährung und der Lebensmittelwissenschaft von großem Interesse. Lipide sind universelle Komponenten in lebenden Organismen, die als essentielle Moleküle in Zellmembranen fungieren, als Hauptquellen bioverfügbarer Energie, für Wärmeisolierung und Auftrieb sorgen und als Signalmoleküle dienen. Obwohl Verfahren zur Lipidbestimmung in anderen Bereichen gut beschrieben wurden, erfordert ihre Verwendung mit marinen Proben häufig Modifikationen, um sich an die Feldbedingungen sowie an den Probentyp1anzupassen.
Bei Meerwasserproben erfordert der erste Schritt in der Regel eine Trennung in die operativ definierten "gelösten" und "partikulären" Fraktionen, normalerweise durch Filtration (Protokoll schritt 1). Die Partikelfraktion ist das, was vom Filter zurückgehalten wird, und die Größe der Poren ist wichtig für die Definition des Cut-offs2. Wenn wir Feinstaubproben nehmen, möchten wir häufig die Lipidkonzentrationen mit den Gesamtmassenkonzentrationen in Beziehung setzen, in diesem Fall muss zu diesem Zweck eine separate, kleinere Probe (z. B. 10 ml) entnommen werden (Protokoll Schritt 1, Anmerkung). Um eine genaue Massenbestimmung zu erhalten, ist es wichtig, am Ende der Filtration Ammoniumformiat (35 g/L) hinzuzufügen.
Das Meerwasserfiltrat aus der größeren Probe sollte je nach Probentyp zwischen 250 mL und 1 L betragen und wird in einem Scheidetrichter einer Flüssig-Flüssig-Extraktion unterzogen (Protokollschritt 2). Die hydrophobe Natur von Lipiden bedeutet, dass sie durch Extraktion in einem unpolaren Lösungsmittel wie Chloroform von anderen Verbindungen getrennt werden können. Es entsteht ein zweischichtiges System, bei dem sich Lipide in die organische Schicht aufteilen, während wasserlösliche Komponenten in der wässrigen Schicht verbleiben.
Partikuläre Proben auf einem Filter oder biologische Proben werden mit einer modifizierten Folch et al. Extraktion3, ebenfalls unter Einbeziehung von Chloroform , extrahiert (Protokoll schritt 3). Auch hier entsteht ein organisch-wässriges System, in dem sich Lipide in die organische Phase aufteilen, während wasserlösliche Moleküle in der wässrigen Phase verbleiben und Proteine ausgefällt werden. Tatsächlich verwenden die meisten Laboratorien für Feststoffe eine Variation des Extraktionsverfahrens von Folch et al.mit Chloroform und Methanol. Für Filter besteht der erste Schritt darin, in 2 ml Chloroform und 1 ml Methanol zu homogenisieren.
Während der Extraktion sollte darauf geachtet werden, Lipide vor chemischer oder enzymatischer Veränderung zu schützen, indem Proben und Lösungsmittel auf Eis aufbewahrt werden, um die Esterbindungshydrolyse oder die Kohlenstoff-Kohlenstoff-Doppelbindungsoxidation zu reduzieren. Gewebe und Zelllipide sind durch natürliche Antioxidantien und durch Kompartimentierung recht gut geschützt4; Nach der Homogenisierung der Proben werden jedoch Zellinhalte kombiniert, wodurch Lipide chemisch oder enzymatisch stärker zur Veränderung neigen. Einige Lipide, wie die meisten Sterole, sind sehr stabil, während andere, wie solche, die mehrfach ungesättigte Fettsäuren enthalten, anfälliger für chemische Oxidation sind. Andere, wie Sterole mit konjugierten Doppelbindungen, sind anfällig für Oxidation, die durch Licht katalysiert wird5. Nach Extraktionen sind Lipide viel anfälliger für chemische Oxidation, und Proben sollten unter einem Inertgas wie Stickstoff gelagert werden. Ein sanfter Stickstoffstrom würde auch verwendet, um Extrakte zu konzentrieren.
Nach der Konzentration würden Lipide dann normalerweise in großen Mengen quantifiziert, da sie ein wichtiger Bestandteil mariner Ökosysteme sind und eine hohe Energiekonzentration liefern, mehr als das Doppelte des kJ / g von Kohlenhydraten und Proteinen. Ausnahmslos würden sie als nächstes als einzelne Komponenten quantifiziert werden: Die umfassende Analyse von Lipiden beinhaltet in der Regel eine Trennung in einfachere Kategorien, je nach ihrer chemischen Natur. Eine vollständige Analyse beinhaltet also die Messung von Gesamtlipiden, Lipidklassen und einzelnen Verbindungen.
Das Gesamtlipid kann bestimmt werden, indem man die Summe der einzeln gemessenen Lipidklassen nimmt, die durch Chromatographie getrennt werden6. Ein mariner Lipidextrakt kann mehr als ein Dutzend Klassen aus biogenen und anthropogenen Quellen enthalten. Die große Vielfalt der Lipidstrukturen bedeutet, dass viele Informationen durch die Bestimmung einzelner Gruppierungen von Strukturen gewonnen werden können. Lipidklassen einzeln oder in bestimmten Gruppen wurden verwendet, um das Vorhandensein bestimmter Arten von Organismen sowie deren physiologischen Status und Aktivitätzu signalisieren 2. Sie wurden auch als Indikator für die Herkunft von organischem Material verwendet, einschließlich gelöster organischer Substanz (DOM) sowie hydrophober Verunreinigungen.
Triacylglycerole, Phospholipide und Sterole gehören zu den wichtigeren biogenen Lipidklassen. Die ersten beiden sind biochemisch verwandt, da sie ein Glycerin-Rückgrat besitzen, an dem zwei oder drei Fettsäuren verestert sind (Abbildung 1). Triacylglycerole sind zusammen mit Wachsestern sehr wichtige Speicherstoffe, während andere fettsäurehaltige Lipidklassen wie Diacylglycerole, freie Fettsäuren und Monoacylglycerole im Allgemeinen nebensächliche Bestandteile sind. Freie Fettsäuren sind in geringeren Konzentrationen in lebenden Organismen vorhanden, da die ungesättigten giftig sein können7. Sterole (sowohl in ihrer freien als auch in ihrer veresterten Form) und Fettalkohole gehören ebenfalls zu den weniger polaren Lipiden, während Glykolipide und Phospholipide polare Lipide sind. Polare Lipide haben eine hydrophile Gruppe, die die Bildung von Lipiddoppelschichten in Zellmembranen ermöglicht. Freie Sterole sind auch Membranstrukturkomponenten, und wenn sie im Verhältnis zu Triacylglycerinen eingenommen werden, liefern sie einen Zustand oder Nährwertindex (TAG: ST), der weit verbreitet ist8. Wenn sie im Verhältnis zu Phospholipiden (ST : PL) eingenommen werden, können sie verwendet werden, um die Empfindlichkeit der Pflanze gegenüber Salz anzuzeigen: Höhere Werte erhalten die strukturelle Integrität und verringern die Membranpermeabilität9. Die Umkehrung dieses Verhältnisses (PL : ST) wurde in Muschelgewebe während der Temperaturanpassunguntersucht 10.
Marine Lipidklassen können durch Dünnschichtchromatographie (TLC) auf Kieselgel-beschichteten Stäbchen getrennt werden (Protokollschritt 4) und dann durch Flammenionisationsdetektion (FID) in einem automatischen FID-Scanner detektiert und quantifiziert werden. TLC/FID wird routinemäßig für marine Proben verwendet, da es schnell synoptische Lipidklassendaten aus kleinen Proben liefert und durch die Summe aller Klassen einen Wert für die Gesamtlipide nimmt. TLC/FID wurde einer Qualitätssicherungsbewertung (QS) unterzogen und es wurde festgestellt, dass sie die Standards erfüllt, die für eine konsistente externe Kalibrierung, niedrige Leerwerte und eine präzise Replikatanalyse erforderlich sind11. Variationskoeffizienten (CV) oder relative Standardabweichungen liegen bei etwa 10%, und die Gesamtlipiddaten des FID-Scanners betragen normalerweise etwa 90% derjenigen, die mit gravimetrischen und anderen Methoden erhalten werden2. Die Gravimetrie ergibt wahrscheinlich höhere Gesamtlipide, da der FID-Scanner nur nichtflüchtige Verbindungen misst und auch aufgrund einer möglichen Einbeziehung von nicht-lipidischem Material in gravimetrische Messungen.
Die Informationen, die durch die Lipidklassenanalyse geliefert werden, sind besonders nützlich, wenn sie mit Bestimmungen von Fettsäuren als Individuen oder Sterole oder den beiden in Kombination kombiniert werden. Der erste Schritt zu diesen Analysen beinhaltet die Freisetzung aller Komponentenfettsäuren zusammen mit Sterolen in den Lipidextrakten (Protokollschritt 5). Die große Vielfalt an Lipidstrukturen und -funktionen bedeutet, dass sie in ökologischen und biogeochemischen Studien zur Bewertung der Ökosystemgesundheit und des Ausmaßes, in dem sie durch anthropogene und terrestrische Inputs beeinflusst wurden, breite Anwendung gefunden haben. Sie wurden verwendet, um die Biosynthese von Substanzen zu messen, die für die Meeresfauna von diätetischem Wert sind, sowie um die Qualität von Wasserproben anzuzeigen. Die Messung von Lipiden in Sedimentkernproben hilft, die Empfindlichkeit von Sedimenten gegenüber Veränderungen der menschlichen Landnutzung in der Nähe des Land-Meer-Randes zu zeigen.
Das primäre Werkzeug zur Identifizierung und Quantifizierung einzelner Lipidverbindungen war traditionell die Gaschromatographie (GC) mit FID. Vor der Analyse werden diese Verbindungen jedoch durch Derivatisierung flüchtiger gemacht. Fettsäuren werden in Gegenwart eines sauren Katalysators(H2SO4)aus Acyllipidklassen freigesetzt (Abbildung 1). In der organischen Chemie leitet sich die Acylgruppe (R-C=O) üblicherweise von einer Carbonsäure (R-COOH) ab. Sie werden dann zu Fettsäuremethylestern (FAME) verestert, was zu besseren Trennungen auf GC-Säulen führt (Protokollschritt 5).
Protokoll
HINWEIS: Um Glaswaren, Instrumente und Filter für Lipidanalysen zu reinigen, waschen Sie sie 3 Mal mit Methanol, gefolgt von 3 Wäschen mit Chloroform, oder erhitzen Sie sie mindestens 8 Stunden lang auf 450 ° C.
1. Filtrationsverfahren für gelöstes Meerwasser und partikuläre Lipide
HINWEIS: Der jeweilige Zinsanteil wird operativ durch das Filtrationsverfahren definiert. In diesem Fall beträgt die Porengröße 1,2 μm.
- Stellen Sie den Filterverteiler ohne Filter auf und spülen Sie den Aufbau mit gefiltertem Meerwasser ab.
- Legen Sie mit einer sauberen Pinzette einen 47 mm Glasfaserfilter (GF/C), der gewaschen wurde, in das saubere Filtersystem.
- Nehmen Sie die Probe und schwenken Sie vorsichtig, um material, das sich möglicherweise auf dem Boden des Auffangbehälters abgesetzt hat, wieder aufzunehmen. Messen Sie ein bekanntes Volumen, in diesem Fall 1 L, genau ab und filtern Sie es durch den Filter.
HINWEIS: Das Volumen hängt von der Menge an Partikelmaterial in der Probe ab: in der Regel zwischen 250 ml und 5 l, abhängig von Saison und Standort. - Wenn die Probe abgemessen wurde, befeuchten Sie den Filter vorsichtig mit gefiltertem Meerwasser. Geben Sie die gesamte Probe langsam in das Filtersystem und spülen Sie den Messzylinder mit gefiltertem Meerwasser ab, um sicherzustellen, dass alle Partikel dem Filter zugeführt werden. Spülen Sie das Setup mit gefiltertem Meerwasser an den Seiten ab, um sicherzustellen, dass alle Partikel auf den Filter gespült werden.
- Lassen Sie das gesamte Meerwasser durch den Filter passieren, aber lassen Sie den Filter nicht vollständig austrocknen, da dies die Zellen auf dem Filter stören kann. Brechen Sie die Absaugung, wenn das letzte Wasser verschwindet.
- Falten Sie den Filter mit einer sauberen Pinzette und einer sauberen Pipette in zwei Hälften, dann in Dritteln und dann in halber Länge, um den Filter in ein Rohr zu rollen. Legen Sie es in eine saubere, beschriftete 10 ml Glasfläschchen.
- Decken Sie den Filter mit 2 ml Chloroform ab. Füllen Sie den Kopfraum mit Stickstoff und versiegeln Sie ihn mit PTFE-Klebeband. In einem Gestell in einem -20 °C Gefrierschrank aufbewahren. Die Proben werden bei dieser Temperatur bis zu einem Jahr stabil sein.
HINWEIS: Um die Lipidkonzentrationen mit den Gesamtmassenkonzentrationen in Beziehung zu setzen, ist auch eine Trockengewichtsmessung erforderlich. Dazu wird ein 24 mm vorgewägter Filter in einen Trockengewichtsfiltrationsaufbau gegeben, die Probe gerührt und eine kleine Teilprobe entnommen, die auf den kleinen Filter filtriert wird. Wenn der Filter fast trocken ist, werden dem Filter etwa 10 ml 3,5% iges Ammoniumformiat zugesetzt. Der Filter wird in zwei Hälften gefaltet, in eine beschriftete Petrischale zurückgeführt und in einen Gefrierschrank gelegt.
2. Flüssig-Flüssig-Extraktion von Meerwasser oder flüssigen Proben
-
Vorbereiten der Probe
- Messen Sie ein bekanntes Filtratvolumen in einen Lipid-Reinglas-Messzylinder. Legen Sie diese Probe in einen sauberen 1 L Trenntrichter. Dann 20 ml Chloroform in die Probe geben und 2 min schütteln, wobei häufig entlüftet wird.
-
Entfernung des ersten Extrakts und Zugabe von Säure nach erster Trennung
- Wickeln Sie den Trichter in Aluminiumfolie und warten Sie 5 bis 10 Minuten, bis die Trennung erfolgt. Ziehen Sie den Boden der Folie zurück, um die beiden Schichten zu sehen. Sammeln Sie die untere, organische Schicht durch den Absperrhahn in einem sauberen Kolben mit rundem Boden und achten Sie darauf, dass keine der oberen Schichten enthalten ist. Den Rundkolben unter Stickstoff verschließen und in den Gefrierschrank stellen.
- 0,25 ml konzentriertesH2SO4 für jeden Liter Probe in die Probe im Scheidetrichter geben und den Trichter vorsichtig schütteln.
- Fügen Sie 10 ml Chloroform hinzu und schütteln Sie 2 Minuten lang kräftig, während Sie häufig entlüften. Lass die Trennung stattfinden.
-
Zweite und dritte Trennung
- Warten Sie auf die Trennung, und geben Sie die unterste Schicht in den Rundkolben.
- Fügen Sie ein drittel 10 ml Chloroform hinzu und schütteln Sie für 2 Minuten, wieder häufig entlüften. Nach dem Trennen die unterste Schicht in den Rundkolben geben.
- Den Extrakt im Rundkolben in einen Rotationsverdampfer geben, verdampfen und in eine 2-ml-Durchstechflasche überführen.
3. Extraktionsprotokoll für Feststoffe (modifizierte Folch et al.3 Extraktion)
-
Einrichtung
HINWEIS: Der Extraktionsaufbau erfordert einen isolierten Behälter, der mit Eis gefüllt ist. Zu den Lösungsmitteln gehören Methanol, Chloroform extrahiertes Wasser und 2: 1 Chloroform: Methanol. Alle Lösungsmittel sollten auf Eis gelegt werden, so dass sie zum Zeitpunkt des Beginns der Extraktionen kalt sind. Die Proben gehen auch auf Eis, so dass alles kalt bleibt.- Spülen Sie alle Röhrchen und PTFE-ausgekleideten Kappen 3 mal mit Methanol und dann 3 mal mit Chloroform ab. Für jede Extraktion wird ein Zentrifugenröhrchen und eine 15-ml-Durchstechflasche mit Kappe benötigt.
- Die Probe wird in ein Zentrifugenröhrchen mit 2 ml Chloroform gegeben. Die Größe der Probe hängt von der Menge des vorhandenen Lipids ab, etwa 5 bis 10 mg Lipid bevorzugt.
-
Mahlen und Extrahieren
- Fügen Sie etwa 1 ml eiskaltes Methanol hinzu und mahlen Sie die Probe mit einem sauberen Homogenisator oder PTFE / Metall-Endstab schnell zu einem Zellstoff.
- Waschen Sie den Stab zurück in das Röhrchen mit ca. 1 ml eiskaltem 2:1 Chloroform: Methanol und dann mit 1/2 mL eiskaltem Chloroform-extrahiertem Wasser. Verwenden Sie bei Bedarf eine saubere Pinzette, um die Partikel vor dem Waschen zurück in die Durchstechflasche zu drücken. Kappen Sie das Röhrchen und beschallen Sie die Mischung für 4 Minuten in einem Ultraschallbad (35 - 42 kHz).
-
Doppelte Pipettung:Zentrifugieren Sie die Probe für 2 min bei 1800 × g. Sammeln Sie die gesamte organische Schicht (untere Schicht) mit der Doppeltpipettiertechnik, bei der eine 5 3/4 "Pipette mit der Glühbirne locker durch die beiden Schichten gedrückt wird, während die Glühbirne zusammengedrückt wird, wodurch Blasen herauskommen.
- Wenn der Boden der zweiten Schicht erreicht ist, verwenden Sie den Daumen, um die Glühbirne zu entfernen, ohne die organische Schicht in die Pipette zu ziehen. Legen Sie eine 9"-Pipette in die 5 3/4"-Pipette und entfernen Sie die untere Schicht durch die 5 3/4"-Pipette.
- Geben Sie den Extrakt in eine saubere Durchstechflasche. Entfernen Sie die untere Ebene, bis alles entfernt ist.
-
Waschpipetten:Spülen Sie die 9"-Pipette in die Durchstechflasche, die die organische Schicht enthält, mit 1,5 ml eiskaltem Chloroform, um die Außenseite der Pipette abzuwaschen, und 1,5 ml, um die Innenseite abzuwaschen. Drehen Sie diese Pipette vorsichtig während des Waschens und stellen Sie sicher, dass das gesamte Chloroform die Pipette hinunter in die Durchstechflasche läuft.
- Spülen Sie die 5 3/4 "Pipette auf die gleiche Weise in das Röhrchen, das die wässrige Schicht enthält.
- Beschallen und zentrifugieren Sie die Proben und verdoppeln Sie die Pipette, wenn sie getrennt werden, wobei jedes Mal neue Pipetten verwendet werden. Wiederholen Sie dies mindestens dreimal und bündeln Sie alle organischen Schichten. Nachdem Sie die organische Schicht zum dritten Mal entfernt haben, waschen Sie beide Pipetten in die Durchstechflasche, die die organische Schicht enthält.
- Mit einem sanften Stickstoffstrom auf Volumen konzentrieren, dann mit PTFE-Klebeband verschließen und in einem Gefrierschrank aufbewahren.
4. Entwicklung von Systemen und Schritten zur Stäbchen-TLC-Trennung mariner Lipidklassen
-
Vorbereiten der Ruten für TLC
- Blanko-Scan der Stäbchen im automatischen FID-Scanner dreimal
- Erkennen einer Probe:Tragen Sie Proben und Standards mit einer Spritze auf die Stäbchen am oder direkt unter dem Ursprung auf. Geben Sie 0,5 μL ab und berühren Sie den Tropfen zum Stab. Trocknen lassen, bevor sie den nächsten Tropfen auf die gleiche Stelle geben. Erkennen Sie alle Proben in einer Linie auf Stäben.
- Fokussierung in Aceton: FokussierenSie die Proben zweimal (dreimal, wenn die Proben sehr konzentriert sind) in 70 ml Aceton. Beobachten Sie die Lösungsmittelfront, während sie auf die Stange klettert, bis die Unterseite der Stelle mit der Oberseite verschmilzt. Entfernen Sie die Stäbchen, trocknen Sie sie für etwa 5 s und wiederholen Sie dann den Vorgang, um ein schmales Band aus Lipidmaterial in der Nähe des Bodens des Stäbchens zu erzeugen.
- Trocknen und konditionieren Sie die Stäbchen in einer Kammer mit konstanter Luftfeuchtigkeit für 5 min. Eine Kammer mit konstanter Luftfeuchtigkeit ist ein Exsikkator mit einer gesättigten Lösung von Calciumchlorid unter der Platte.
-
Sequenz, die zum ersten Chromatogramm führt (Kohlenwasserstoff zu Keton)
-
Erstes Entwicklungssystem: Das erste Entwicklungssystem ist Hexan:Diethylether:Ameisensäure, 98.95:1:0.05. Verwenden Sie eine Spritze, um die Ameisensäure hinzuzufügen, aber spülen Sie zuerst die Spritze 3× mit Ameisensäure. Spülen Sie die Ameisensäure unmittelbar danach mit Chloroform aus der Spritze. Verwenden Sie 30 ml der Mischung, um das Papier zu benetzen und den Tank abzuspülen. Entsorgen Sie die Spüllösung und geben Sie die restlichen 70 ml in den Tank.
- Nehmen Sie die Racks und senken Sie sie vorsichtig in den Tank. Beobachten Sie, bis die Lösungsmittelfront die Probenstellen erreicht, und starten Sie dann den Timer. Nach 25 min die Stäbe aus der Entwicklungskammer entfernen, 5 min in der Kammer mit konstanter Luftfeuchtigkeit trocknen und in derselben Lösung weitere 20 min neu entwickeln.
- Trocknen Sie die Stäbchen für 5 Minuten im automatischen FID-Scanner und scannen Sie dann mit einem PPS-Scan von 25 bis zum tiefsten Punkt hinter dem Keton-Peak.
-
Erstes Entwicklungssystem: Das erste Entwicklungssystem ist Hexan:Diethylether:Ameisensäure, 98.95:1:0.05. Verwenden Sie eine Spritze, um die Ameisensäure hinzuzufügen, aber spülen Sie zuerst die Spritze 3× mit Ameisensäure. Spülen Sie die Ameisensäure unmittelbar danach mit Chloroform aus der Spritze. Verwenden Sie 30 ml der Mischung, um das Papier zu benetzen und den Tank abzuspülen. Entsorgen Sie die Spüllösung und geben Sie die restlichen 70 ml in den Tank.
-
Sequenz, die zum zweiten Chromatogramm führt (Triacylglycerin zu Diacylglycerin):
- Konditionieren Sie die Stäbe für 5 min in der Kammer mit konstanter Luftfeuchtigkeit.
- Zweites Entwicklungssystem:Das zweite Entwicklungssystem ist Hexan:Diethylether:Ameisensäure, 79:20:1. Fügen Sie dem Entwicklungstank ~ 30 ml hinzu, um das Papier zu benetzen, und spülen Sie den Tank ab. Dann entsorgen und entwickeln Sie die Stäbchen für 40 min in den verbleibenden 70 ml. Für die beste Trennung zwischen den TAG -Peaks (gesättigt) und den TAG-Peaks (mehrfach ungesättigt) verwenden Sie eine Mischung aus 79,9:20:0,1, aber für die Trennung der ST- und DAG-Peaks verwenden Sie eine Mischung aus 79:20:1.
- Trocknen und scannen Sie in einem zweiten Teilscan mit einem PPS-Scan 11 bis zum tiefsten Punkt hinter dem Diacylglycerin-Peak.
-
Sequenz, die zum dritten Chromatogramm führt (Aceton-mobiles polares Lipid und Phospholipid)
- Konditionieren Sie die Stäbe für 5 Minuten in der Kammer mit konstanter Luftfeuchtigkeit.
- Entwickeln Sie die Stäbchen zweimal für 15 Minuten in 70 ml Aceton. Zwischen den Entwicklungen trocknen die Stäbe etwa 30 Sekunden an der Luft.
- Konditionieren Sie die Stäbe für 5 Minuten in der Kammer mit konstanter Luftfeuchtigkeit.
- Drittes Entwicklungssystem:Das dritte Entwicklungssystem ist eine Mischung aus Chloroform, Methanol und Chloroform-extrahiertem Wasser, 50:40:10. Entwickeln Sie die Stäbchen zweimal für 10 Minuten in 70 ml der Mischung. Zwischen den Entwicklungen trocknen Sie die Stäbe etwa 30 Sekunden an der Luft.
- Trocknen und scannen Sie die gesamte Länge der Stäbchen.
5. FAME-Derivatisierung mitH2SO4 in MeOH
-
Herstellung des Hilditch-Reagenzes
- Vorbereitung des Methanols:100 ml MeOH in einen sauberen Messkolben geben und dann vorsichtig mit wasserfreiem NaSO4 bestreuen, bis der Boden des Kolbens bedeckt ist. Einmal abgedeckt, zweimal invertieren, so dass das Wasser im Methanol vom NaSO4absorbiert wird. Nach dem Umkehren und Schütteln mindestens 5 Minuten ruhen lassen.
- Zugabe der Säure:Das Methanol langsam in ein Glasgefäß dekantieren (inzwischen ist dasNaSO4 ein harter Klumpen im Boden des Kolbens) und dasH2SO4 wird zugegeben. Langsam 1,5 ml Schwefelsäure mit einer Pipette in das Methanol geben. Fügen Sie ein paar Tropfen auf einmal hinzu und sobald die gesamte Säure hinzugefügt wurde, schließen Sie sie ab und rühren Sie vorsichtig um, um zu mischen. Die Lösung ist jetzt bereit, für Derivate verwendet zu werden, aber sie muss wöchentlich nachgeholt werden.
-
Herstellung der Derivate
- Etwa 200 μg Lipide aus einer Extraktfläschchen, bei der das Volumen auf eine bekannte Menge gebracht wurde, in eine saubere, 15 ml durchführbare Durchstechflasche geben und unter Stickstoff zur Trockenheit verdampfen. Die entnommene Menge wird durch die Konzentration der Probe aus TLC/FID bestimmt. Verwenden Sie eine saubere Pipette, um die Probe zu entfernen.
- Wenn die Probe getrocknet ist, fügen Sie 1,5 ml Dichlormethan und 3 ml des neu hergestellten Hilditch-Reagenz hinzu.
- Wirbeln Sie die Probe und beschallen Sie sie in einem Ultraschallbad für 4 min, um Lipide zu entfernen, die an der Glasfläschchen haften geblieben sind. Füllen Sie die Durchstechflasche mit Stickstoff, verschließen Sie sie mit PTFE-Klebeband und erhitzen Sie sie 1 Stunde lang bei 100 ° C.
-
Stoppen der Reaktion
- Lassen Sie die Proben nach dem Entfernen aus dem Ofen 10 minuten lang vollständig auf Raumtemperatur abkühlen und öffnen Sie dann die Durchstechflaschen vorsichtig.
- Langsam etwa 0,5 ml gesättigte Natriumbicarbonatlösung (9 g/100 ml Chloroform-extrahiertes Wasser) und dann 1,5 ml Hexan zugeben. Schütteln oder wirbeln Sie die Durchstechflasche und lassen Sie sie dann stehen, so dass sie sich in 2 Schichten trennt.
-
Sammeln der FAME's
- Entfernen der obersten Schicht:Sobald die Derivatisierung gestoppt wurde und eine klare Trennung vorliegt, entfernen Sie die obere, organische Phase und legen Sie sie in eine lipidreinigte 2 ml Durchstechflasche.
- Verdampfen Sie das Lösungsmittel in der 2-ml-Durchstechflasche auf Trockenheit und füllen Sie es mit Hexan auf ca. 0,5 ml auf.
- Füllen Sie den Kopfraum der Durchstechflasche mit Stickstoff, verschließen und verschließen Sie die Durchstechflasche mit PTFE-Klebeband, beschallen Sie für weitere 4 Minuten, um die Fettsäuren wieder zu suspendieren, und dann ist es bereit, zum GC zu gehen.
HINWEIS: Wenn Fettsäurekonzentrationen erforderlich sind, muss die wässrige Schicht dreimal mit Hexan gewaschen und alle organischen Schichten in der 2-ml-Durchstechflasche zusammengefasst werden. Dies beinhaltet die Zugabe von 2 ml Hexan, das Wirbeln der Probe, das Zentrifugieren und Entfernen der organischen Schicht, die alle 3 Mal wiederholt werden.
Ergebnisse
Als der am schnellsten wachsende Lebensmittelproduktionssektor entwickelt sich die Aquakultur in Bezug auf technologische Innovationen und Anpassungen an sich ändernde Anforderungen weiter. Eine davon besteht darin, die Abhängigkeit von Fischmehl und Fischöl aus wilden Quellen zu verringern, die Futterzutaten für viele Aquakulturarten liefern. Terrestrische Pflanzenöle werden als nachhaltiger und wirtschaftlicher Ersatz für Fischöl in Aquafeeds untersucht, und die Leber ist ein Zielgewebe für die Analyse, da sie der primäre Ort für den Fettstoffwechsel ist12. Abbildung 2 zeigt die rohen TLC-FID-Chromatogramme, die aus unserem Neun-Komponenten-Standard gewonnen wurden, einer Diät, die wir mit Fischöl zu 7% und Rapsöl zu 5% formuliert haben, und Lebergewebe von einem atlantischen Lachs, der mit dieser Diät gefüttert wurde. Tabelle 1 zeigt die Daten, die nach der Analyse von Nahrungsreplikaten und Proben von verschiedenen Fischen erhalten wurden. Diese Daten wurden nach der Konstruktion von Standardkurven aus Scanner-FID-Antworten zur Quantifizierung der Lipidklassen in den Extrakten mit der Peak Simple-Software (Version 4.54) erhalten. Die Daten zeigen die Prävalenz von Triacylglycerolen in der Ernährung und der Leber und auch die Bedeutung von Membranphospholipiden in der Leber.
Continental-Margen weisen im Allgemeinen eine sehr hohe biologische Produktivität auf und sind besonders wichtig für den Kreislauf von Kohlenstoff. Die primäre Oberflächenproduktivität erreicht den Meeresboden mehr in flacherem Wasser, und daher ist die Messung der Quantität und Qualität der Partikel, die sich von der oberen Mischschicht in das benthische Nahrungsnetz absetzen, von großem Interesse. Da sie reich an Kohlenstoff sind und einen sehr hohen Energiegehalt haben, sind Lipide wichtige Bestandteile der Produktivität von Kontinentalschelfen. Historisch gesehen unterstützten die an Neufundland und Labrador angrenzenden Gewässer etwa fünf Jahrhunderte lang eine der größten Fischereien der Welt, und wir haben die Produktion und den Transfer von Lipiden in diesem System untersucht13. Abbildung 3 zeigt TLC-FID-Chromatogramme, die aus unserem Standard gewonnen wurden, Lipide bei der Absetzung von Feinstaub, die in 220 m Entfernung vor der Küste Neufundlands gesammelt wurden, und Lipide in einem kleinen Mysid, Erythrops erythrophtalma, die in der Nähe der gleichen Tiefe gesammelt wurden. Diesmal wurden die Chromatogramme durch plottende Software verarbeitet und die beiden Teilscans mit dem endgültigen vollständigen Scan kombiniert. Tabelle 2 zeigt die Daten, die nach der Analyse von Replikatproben von absetzendem Feinstaub und Mysid erhalten wurden. Unter 19 Taxa aus 5 Stämmen hatte der kleine Mysid im Durchschnitt die höchste Lipidkonzentration (6% des Nassgewichts)13.
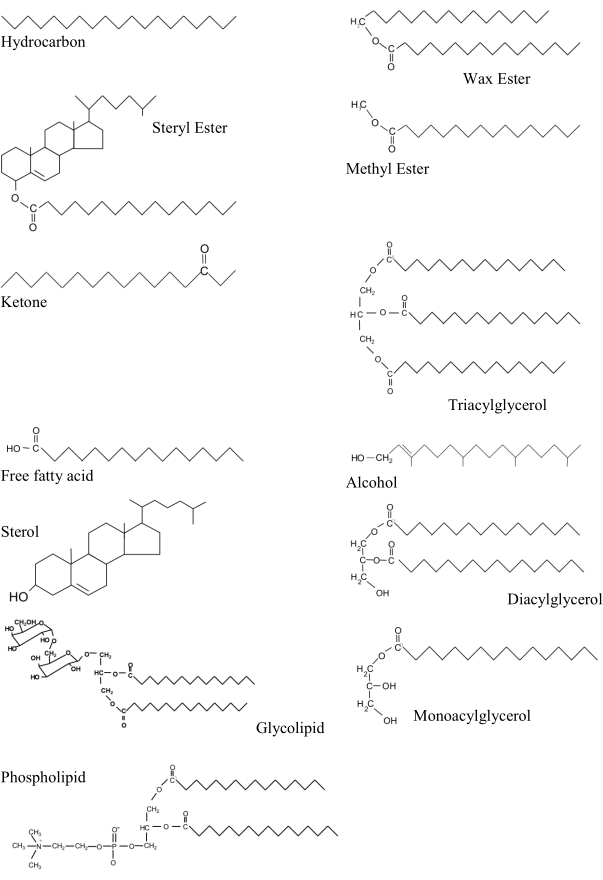
Abbildung 1: Hauptlipidklassen in marinen Proben in einer ungefähren Reihenfolge zunehmender Polarität. Jede Struktur ist mit dem hydrophobsten Teil des Moleküls gezeichnet, der nach rechts von der Abbildung zeigt. Repräsentative Verbindungen für Lipidklassen sind:- Kohlenwasserstoff: Nonadecan; Wachsester: Hexadecylpalmitat; Sterylester: Cholesterylpalmitat; Methylester: Methylpalmitat; Keton: 3-Hexdecanon; Triacylglycerin: Tripalmitin; freie Fettsäure: Palmitinsäure; Alkohol: Phytol; Sterol: Cholesterin; Diacylglycerin: Dipalmitoylglycerin; Monoacylglycerin: Monopalmitoylglycerin; Glycolipid: Digalactosyldiacylglycerin; Phospholipid: Dipalmitoylphosphatidylcholin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: TLC-FID-Chromatogramme der Lipidzusammensetzung aus einem Aquakultur-Fütterungsexperiment. Extrakte wurden auf Kieselgel-beschichteten TLC-Stäbchen entdeckt und ein dreistufiges Entwicklungssystem wurde verwendet, um Lipidklassen zu trennen. Das erste und zweite Entwicklungssystem waren Hexan:Diethylether:Ameisensäure (98.95:1:0.05) bzw. (79.9:20:0.1), um neutrale Lipide einschließlich Triacylglycerin, freie Fettsäure und Sterol für das Scannen im automatischen FID-Scanner zu trennen. Das dritte Entwicklungssystem bestand aus 100% Aceton vor Chloroform:Methanol:Wasser (5:4:1), um Aceton-mobile polare Lipide und Phospholipide zu trennen. Standardkurven (d.h. Nonadecan, Cholesterylpalmitat, 3-Hexdecanon, Tripalmitin, Palmitinsäure, Cetylalkohol, Cholesterin, Monopalmitoylglycerin, Dipalmitoylphosphatidylcholin) wurden verwendet, um die Lipidklassen in den Extrakten mit der Peak Simple-Software (Version 4.54) zu quantifizieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: TLC-FID-Chromatogramme der Lipidzusammensetzung von bodennahen Proben aus der neuseeländischen Küste. a) Neunkomponentenstandard, b) 220 m absetzender Feinstaub aus Conception Bay, Neufundland, c) Lipidklassen im Mysid, Erythrops erythrophtalma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Fischöl/Rapsöl Diät | Atlantische Lachsleber | |
| Kohlenwasserstoffe | 1,3±0,9 | 0,5±0,2 |
| Sterylester/Wachsester | 0,4±0,6 | 0,6±0,3 |
| Ethylester | 0 | 0 |
| Methylester | 0 | 0 |
| Ethylketone | 0 | 0,3±0,2 |
| Methylketone | 0 | 0 |
| Glycerylether | 0 | 0 |
| Triacylglycerole | 145,0±26,3 | 16.9±8.1 |
| Freie Fettsäuren | 21.9±2.2 | 1,2±0,9 |
| Alkohole | 0 | 1.4±0.4 |
| Sterole | 6.8±2.1 | 2,6±0,2 |
| Diacylglycerole | 0 | 0 |
| Aceton Mobile Polar Lipide | 14,0±2,5 | 2.2±0.6 |
| Phospholipide | 12,5±4,0 | 22,0±2,0 |
| Gesamtlipide | 201,8±27,4 | 47,7±11,8 |
Tabelle 1: Lipidzusammensetzung in einem Aquakultur-Fütterungsexperiment. Die Daten beziehen sich (Mittelwert±Standardabweichung) auf eine Versuchsdiät mit 6,80 % Fischöl und 4,80 % Rapsöl in der Fütterung (mg g-1 Nassgewicht) und auf Lebern von Atlantischem Lachs (mg g-1 Nassgewicht) nach Fütterung dieser Diät für 12 Wochen.
| Absetzen von Feinstaub | Erythrops erythrophtalma | |
| Sterylester/Wachsester (% Gesamtlipid) | 10.2±8.28 | 8,85±1,67 |
| Triacylglycerole (% Gesamtlipid) | 19.7±5.35 Uhr | 58,5±9,19 |
| Phospholipide (% Gesamtlipid) | 16,2 ± 3,51 | 21,4±5,35 |
| Neutrale Lipide (% Gesamtlipid) | 12,5±4,0 | 73,4±5,46 |
| Lipolyse-Index (%) | 18.1±5.20 Uhr | 2,77±2,78 |
| Gesamtlipide | 0,57±0,25 | 5,86±1,44 |
| Neutrale Lipide: Kohlenwasserstoffe, Wachs- und Steryllester, Ketone, Triacylglycerole, freie Fettsäuren; (FFA), Alkohole (ALC), Sterole, Diacylglycerole; LI: Lipolyseindex [(FFA + ALC) (Acyllipide + ALC)–1]; Gesamtlipid (Summe der TLC/FID-ermittelten Lipidklassen) Feinstaub - % Trockengewicht, Mysid - % Nassgewicht | ||
Tabelle 2: Lipidzusammensetzung von bodennahen Proben aus der Küste Neufundlands. Die Daten beziehen sich (Mittelwert±Standardabweichung) von 220 m absetzenden Feinstaub aus Conception Bay Neufundland und des Mysiden Erythrops erythrophtalma.
Fußnote: Neutrale Lipide: Kohlenwasserstoffe, Wachs- und Steryllester, Ketone, Triacylglycerole, freie Fettsäuren; (FFA), Alkohole (ALC), Sterole, Diacylglycerole; LI: Lipolyseindex [(FFA+ ALC) (Acyllipide + ALC)-1]; Gesamtlipid (Summe der FID-ermittelten Lipidklassen) Feinstaub - % Trockengewicht, Mysid - % Nassgewicht.
Diskussion
Die Geschwindigkeit, mit der das TLC-FID-System synoptische Lipidklasseninformationen aus kleinen Proben liefert, macht TLC-FID zu einem fähigen Werkzeug für das Screening von Meeresproben, bevor komplexere Analyseverfahren durchgeführt werden. Solche Analysen erfordern in der Regel die Freisetzung von Komponentenverbindungen aus Lipidextrakten und die Derivatisierung, um die Flüchtigkeit im Falle der Gaschromatographie zu erhöhen. TLC-FID in Kombination mit GC-FID hat sich als leistungsstarke Kombination für Extrakte aus Meeresfrüchten und anderen Lebensmitteln erwiesen14. Für erfolgreiche marine Lipidanalysen ist es entscheidend, dass die Proben durchgehend vor Abbau und Kontamination geschützt sind und dass bei der Anwendung der Probe auf den Stab große Sorgfalt walten gelassen wird. Ein Ansatz besteht darin, die gesamte Meeresprobe mit einem Mikrokapillarpipettor15auf den Stab aufzutragen, und eine Innovation bei marinen Probentypen besteht darin, Meerwasserproben16Mikroschicht- und Aerosolproben an der Meeresoberfläche hinzuzufügen.
Das FID-System im automatischen Scanner ermöglicht eine schnelle Mikrogramm-Quantifizierung ohne Derivatisierung oder Bereinigung; es ist jedoch nicht so empfindlich, präzise oder linear wie in Gaschromatographen. Dies bedeutet, dass Kalibrierkurven konstruiert werden müssen und dass es gelegentlich notwendig sein kann, Proben mit zwei verschiedenen Lasten zu analysieren, um sowohl kleinere als auch größere Lipidklassenpeaks innerhalb des Kalibrierbereichs zu halten.
Durch die Verwendung der Teilscan-Funktion im FID-Scanner ist es möglich, mehrere Lipidklassen von einer einzigen Probenapplikation auf einen Stab zu trennen. Die Chromatographie an Kieselsäure löst jedoch keine Wachsester (WE) und Sterylester (SE) auf, und einige Klassen können in den "Aceton-Mobile Polar Lipid" (AMPL) -Peak17aufgenommen werden. WE-SE war die Wichtigste Lipidklasse in Bonefish-Eizellen und es wird vermutet, dass sie zur Unterstützung des Auftriebs und / oder der Energiespeicherung verwendet werden18.
In AMPL aus photosynthetischen Organismen eluieren die Glykoclycerolipiden oft zusammen mit Monoacylglycerinen und Pigmenten in Aceton. Dies kann ein Quantifizierungsproblem darstellen, da Chlorophyll a und Glykolipide Monogalactosyldiacylglycerin (MGDG) und Digalactosyldiacylglycerol (DGDG) unterschiedliche FID-Reaktionen im Scanner haben; Wir verwenden jedoch 1-Monopalmitoylglycerin als Standard für die AMPL-Klasse, und dies hat ein Antwortzwischenprodukt unter ihnen17.
Während einige FID-Scanner-Peaks mehr als eine Lipidklasse enthalten können, ist es manchmal sinnvoll, getrennte Lipidklassen funktionell neu zu gruppieren. Zum Beispiel wurden AMPL und PL in polare Lipide und dann in Strukturlipide unter Zusatz von Sterol19 gruppiert. Solche Gruppierungen wurden verwendet, um kritische Perioden für die Lipidnutzung während der Entwicklung bei wirbellosen Tieren zuuntersuchen 19. Andere Gruppierungen mit freien Fettsäuren und Alkoholen können als Abbauindikatoren verwendet werden, wie der Lipolyseindex (Tabelle 2) oder der Hydrolyseindex1. LI ist der Lipolyseindex aller Acyllipide, während HI der Hydrolyseindex von unpolaren Acyllipiden ist. LI-Werte sind immer niedriger als die für HI für jede Probe, da alle Acyllipide enthalten sind.
Gelegentlich kommt es bei Stäbchentrennungen von Extrakten aus Meeresproben zu Peak-Splitting, da ein hoher Gehalt an mehrfach ungesättigten Arten vorhanden ist, was die Identifizierung erschweren kann. Dies wurde bei Wachsestern(Abbildung 3),Triacylglycerinen und freien Fettsäuren20,21beobachtet und erfordert ein Co-Spotting mit authentischen Standards und/oder eine Bestätigung mit anderen chromatographischen Techniken. In ähnlicher Weise kann eine Peakspaltung in der polaren Lipidregion auftreten (Abbildung 2 und Abbildung 3), und es können weitere Entwicklungen zur Abtrennung von Komponentenglykolipiden und Pigmenten17,22 und Phospholipidklassen22,23vorgenommen werden.
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen.
Danksagungen
Diese Forschung wurde von der Fördernummer des Natural Sciences and Engineering Research Council of Canada (NSERC) 105379 an C.C. Parrish finanziert. Das Core Research Equipment & Instrument Training (CREAIT) Network der Memorial University half bei der Finanzierung dieser Publikation.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 ml vials | VWR | 66009-560 | |
| 1-hexadecanol | Sigma | 258741-1G | |
| 1-Monopalmitoyl-rac-glycerol | Sigma | M1640-1g | |
| 2 ml vials | VWR | 46610-722 | |
| 25 mm glass fibre filters | Fisher | 09 874 32A | |
| 2ml pipet bulbs | VWR | 82024-554 | |
| 47 mm glass fibre filters | Fisher | 09 874 32 | |
| 5 3/4" pipets | Fisher | 1367820A | |
| 9" pipets | Fisher | 1367820C | |
| Acetone | VWR | CAAX0116-1 | |
| Agilent GC-FID 6890 | Agilent | ||
| Calcium Chloride ANHS 500gm | VWR | CACX0160-1 | |
| Caps for 2 ml vials | VWR | 46610-712 | |
| chloroform | VWR | CACX1054-1 | |
| Cholesteryl palmitate | Sigma | C6072-1G | |
| Chromarod S5 | Shell USA | 3252 | |
| Dichloromethane | VWR | CADX0831-1 | |
| DL-a-phosphatidylcholine, dipalmotoyl | Sigma | P5911-1g | |
| Ethyl Ether, ACS grade anhydr 4L | VWR | CAEX0190-4 | |
| Glyceryl tripalmitate | Sigma | T5888-100MG | |
| Hamilton Syringe 702SNR 25µl | Sigma | 58381 | |
| Helium | Air Liquide | A0492781 | |
| Hexane | VWR | CAHX0296-1 | |
| Hydrogen regulator | VWR | 55850-484 | |
| Iatroscan MK6 | Shell USA | ||
| Kimwipes | Fisher | 066662 | |
| Medical Air | Air Liquide | A0464563 | |
| Medium nitrile gloves | Fisher | 191301597C | |
| Nitrile gloves L | VWR | CA82013-782 | |
| Nitrogen | Air Liquide | A0464775 | |
| Nitrogen Regulator | VWR | 55850-474 | |
| Nonadecane | Sigma | 74158-1G | |
| Palmitic acid | Sigma | P0500-10G | |
| Repeating dispenser | Sigma | 20943 | |
| Sodium Bicarbonate 1kg | VWR | CA97062-460 | |
| Sodium Sulfate Anhy ACS 500gr | VWR | CA71008-804 | |
| Sulfuric acid | VWR | CASX1244-5 | |
| Teflon tape | Fisher | 14610120 | |
| tissue master 125 115V w/7mm homogenator | OMNI International | TM125-115 | |
| TLC development tank | Shell USA | 3201 | |
| UHP hydrogen | Air Liquide | A0492788 | |
| VWR solvent repippetter | VWR | 82017-766 | |
| VWR timer Flashing LED 2 channel | VWR | 89140-196 | |
| Zebron ZB-Wax GC column | Phenomenex | 7HM-G013-11 |
Referenzen
- Couturier, L. I. E., et al. State of art and best practices for fatty acid analysis in aquatic sciences. ICES Journal of Marine Science. , (2020).
- Parrish, C. C. Lipids in Marine Ecosystems. ISRN Oceanography. , 604045(2013).
- Folch, J., Lees, M., Stanley, G. H. S. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226, 497-509 (1957).
- Vaz, F. M., Pras-Raves, M., Bootsma, A. H., van Kampen, A. H. C. Principles and practice of lipidomics. Journal of Inherited Metabolic Disease. , (2014).
- Wolf, C., Quinn, P. J. Lipidomics: practical aspects and applications. Progress in Lipid Research. 47, 15-36 (2008).
- Parrish, C. C. Determination of total lipid, lipid classes, and fatty acids in aquatic samples. Lipids in Freshwater Ecosystems. Arts, M. T., ainman, B. C. , Springer-Verlag. New York. 4-20 (1999).
- Jüttner, F. Liberation of 5,8,11,14,17-eicosapentaenoic acid and other polyunsaturated fatty acids from lipids as a grazer defense reaction in epilithic diatom biofilms. Journal of Phycology. 37, 744-755 (2001).
- Carreón-Palau, L., Parrish, C. C., Pérez-España, H., Aguiñiga-Garcia, S. Elemental ratios and lipid classes in a coral reef food web under river influence. Progress in Oceanography. 164, 1-11 (2018).
- Maciel, E., et al. Bioprospecting of marine macrophytes using MS-based lipidomics as a new approach. Marine Drugs. 14, 49(2016).
- Pernet, F., Tremblay, R., Comeau, L., Guderley, H. Temperature adaptation in two bivalve species from different thermal habitats: energetics and remodelling of membrane lipids. Journal of Experimental Biology. 210, 2999-3014 (2007).
- Bergen, B. J., Quinn, J. G., Parrish, C. C. Quality-assurance study of marine lipid-class determination using Chromarod/Iatroscan thin-layer chromatography-flame ionization detector. Environmental Toxicology and Chemistry. 19, 2189-2197 (2000).
- Foroutani, B. M., Parrish, C. C., Wells, J., Taylor, R. G., Rise, M. L. Minimizing marine ingredients in diets of farmed Atlantic salmon (Salmo salar): effects on liver and head kidney lipid class, fatty acid and elemental composition. Fish Physiology & Biochemistry. 46, 2331-2353 (2020).
- Parrish, C. C., Deibel, D., Thompson, R. J. Effect of sinking spring phytoplankton blooms on lipid content and composition in suprabenthic and benthic invertebrates in a cold ocean coastal environment. Marine Ecology Progress Series. 391, 33-51 (2009).
- Sinanoglou, V. J., et al. On the combined application of Iatroscan TLC-FID and GC-FID to identify total, neutral, and polar lipids and their fatty acids extracted from foods. ISRN Chromatography. , 59024(2013).
- Peters-Didier, J., Sewell, M. A. Maternal investment and nutrient utilization during early larval development of the sea cucumber Australostichopus mollis. Marine Biology. 164, 178(2017).
- Triesch, N., et al. Concerted measurements of lipids in seawater and on submicron aerosol particles at the Cape Verde Islands: biogenic sources, selective transfer and high enrichments. Atmospheric Chemistry and Physics. 21, 4267-4283 (2021).
- Parrish, C. C., Bodennec, G., Gentien, P. Determination of glycoglycerolipids by Chromarod thin-layer chromatography with Iatroscan flame ionization detection. Journal of Chromatography A. 741, 91-97 (1996).
- Mejri, S., et al. Bonefish (Albula vulpes) oocyte lipid class and fatty acid composition related to their development. Environmental Biology of Fishes. 102, 221-232 (2019).
- Sewell, M. A. Utilization of lipids during early development of the sea urchin Evechinus chloroticus. Marine Ecology Progress Series. 304, 133-142 (2005).
- Parrish, C. C., Bodennec, G., Gentien, P. Separation of polyunsaturated and saturated lipids from marine phytoplankton on silica gel coated Chromarods. Journal of Chromatography A. 607, 97-104 (1992).
- Stevens, C. J., Deibel, D., Parrish, C. C. Incorporation of bacterial fatty acids and changes in a wax ester-based omnivory index during a long-term incubation experiment with Calanus glacialis Jaschnov. Journal of Experimental Marine Biology and Ecology. 303, 135-156 (2004).
- Goutx, M., et al. Short term summer to autumn variability of dissolved lipid classes in the Ligurian Sea (NW Mediterranean). Biogeosciences. 6, 1229-1246 (2009).
- Conlan, J. A., Rocker, M. M., Francis, D. S. A. comparison of two common sample preparation techniques for lipid and fatty acid analysis in three different coral morphotypes reveals quantitative and qualitative differences. PeerJ. 5, 3645(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten