Method Article
Avaliação in vitro da proteção do miocárdio após hipotermia-pré-condicionamento em um modelo de miócitos cardíacos humanos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os efeitos distintos de diferentes graus de hipotermia na proteção do miocárdio não foram minuciosamente avaliados. O objetivo do presente estudo foi quantificar os níveis de morte celular após diferentes tratamentos de hipotermia em um modelo baseado em cardiomiócito humano, estabelecendo as bases para futuras pesquisas moleculares aprofundadas.
Resumo
A disfunção miocárdica derivada da isquemia/reperfusão é um cenário clínico comum em pacientes após cirurgia cardíaca. Em particular, a sensibilidade dos cardiomiócitos à lesão isquêmica é maior do que a de outras populações celulares. Atualmente, a hipotermia oferece proteção considerável contra um insulto isquêmico esperado. No entanto, as investigações sobre complexas alterações moleculares induzidas por hipotermia permanecem limitadas. Portanto, é essencial identificar uma condição de cultura semelhante às condições in vivo que possam induzir danos semelhantes aos observados na condição clínica de forma reprodutível. Para imitar condições semelhantes à isquemia in vitro, as células nesses modelos foram tratadas por privação de oxigênio/glicose (OGD). Além disso, aplicamos um protocolo padrão de temperatura de tempo usado durante a cirurgia cardíaca. Além disso, propomos uma abordagem para utilizar um método simples, mas abrangente, para a análise quantitativa da lesão do miocárdio. Os níveis de apoptose e expressão das proteínas associadas à apoptose foram avaliados por citometria de fluxo e utilizando um kit ELISA. Neste modelo, testamos uma hipótese sobre os efeitos de diferentes condições de temperatura na apoptose cardiomiócito in vitro. A confiabilidade deste modelo depende de rigoroso controle de temperatura, procedimentos experimentais controláveis e resultados experimentais estáveis. Além disso, este modelo pode ser usado para estudar o mecanismo molecular da cardioproteção hipotérmica, que pode ter implicações importantes para o desenvolvimento de terapias complementares para uso com hipotermia.
Introdução
A disfunção miocárdica derivada da isquemia/reperfusão é um cenário clínico comum em pacientes após cirurgia cardíaca1,2. Durante a perfusão de baixo fluxo não pulsatile e períodos de parada circulatória total, ainda ocorre danos envolvendo todos os tipos de células cardíacas. Em particular, a sensibilidade dos cardiomiócitos à lesão isquêmica é maior do que a de outras populações celulares. Atualmente, a hipotermia terapêutica (TH) oferece proteção substancial contra um insulto isquêmico esperado em pacientes submetidos à cirurgia cardíaca3,4. O TH é definido como uma temperatura corporal do núcleo de 14-34 °C, embora não exista consenso quanto a uma definição de resfriamento durante a cirurgia cardíaca5,6,7. Em 2013, um painel internacional de especialistas propôs um sistema padronizado de relatórios para classificar várias faixas de temperatura de parada circulatória hipotérmica sistêmica8. Com base em estudos de eletroencefalografia e metabolismo do cérebro, eles dividiram a hipotermia em quatro níveis: hipotermia profunda (≤ 14 °C), hipotermia profunda (14,1-20 °C), hipotermia moderada (20,1-28 °C) e hipotermia leve (28,1-34 °C). O consenso dos especialistas proporcionou uma classificação clara e uniforme, permitindo que os estudos fossem mais comparáveis e proporcionassem resultados mais relevantes clinicamente. Esta proteção proporcionada pelo TH baseia-se em sua capacidade de reduzir a atividade metabólica das células, limitando ainda mais sua taxa de consumo de fosfatos de alta energia9,10. No entanto, o papel do TH na proteção do miocárdio é controverso e pode ter múltiplos efeitos dependendo do grau de hipotermia.
A I/R miocárdio é bem conhecida por ser acompanhada pelo aumento da apoptisecelular 11. Relatórios recentes observaram que a morte programada por cardiomiócito aumenta durante a cirurgia de coração aberto, podendo coincidir com a necrose, aumentando assim o número de células miocárdia mortas12. Portanto, reduzir a apoptose cardiomiócito é uma abordagem terapêutica útil na prática clínica. No modelo de cardiomiócito atrial hl-1 do camundongo, a hipotermia terapêutica foi demonstrada para reduzir a liberação mitocondrial do citocromo c e fator indutor de apoptose (AIF) durante a reperfusão13. No entanto, o efeito da temperatura na regulação da apoptose é controverso e parece depender do grau de hipotermia. Cooper e colegas observaram que, em comparação com um grupo de controle de bypass cardiopulmonar normoérmico, a taxa de apoptose do tecido miocárdio de suínos com a profunda parada circulatória hipotérmica foi aumentada14. Além disso, os resultados de alguns estudos sugerem que hipotermia profunda pode ativar a via da apoptose, enquanto hipotermia menos agressiva parece inibir a via12,15,16. A razão para este resultado pode ser devido aos efeitos confusos associados à lesão isquêmica e à falta de compreensão dos mecanismos pelos quais a temperatura afeta o tecido miocárdio. Portanto, os limites de temperatura nos quais a apoptose é aprimorada ou atenuada devem ser definidos com precisão.
Para se ter uma melhor compreensão dos mecanismos associados à eficácia da hipotermia e fornecer uma base racional para sua implementação em humanos, é essencial identificar uma condição cultural semelhante às condições in vivo que possam produzir danos semelhantes aos observados para a condição clínica de forma reprodutível. Um passo essencial para alcançar esse objetivo é estabelecer as condições ideais para induzir a apoptose cardiomiocócica. Assim, no presente estudo, exploramos os detalhes metodológicos relativos aos experimentos de privação de oxigênio-glicose com células cultivadas, um modelo áxile in vitro de isquemia-reperfusão. Além disso, avaliamos o efeito de diferentes tempos hipoxicos-isquêmicos na apoptose cardiomiófica, e verificamos nossa hipótese quanto ao efeito de diferentes condições de temperatura na apoptose celular in vitro.
Protocolo
As informações relativas aos reagentes e instrumentos comerciais estão listadas na Tabela de Materiais.
A linha de células cardiomiócitos humanas AC16 foi derivada da fusão de células primárias do tecido cardíaco ventricular adulto com fibroblastos humanos transformados em SV4017,que foram comprados da BLUEFBIO (Xangai, China). A linha celular desenvolve muitas características bioquímicas e morfológicas características dos cardiomiócitos. Além disso, a linha celular é amplamente utilizada para avaliar danos do miocárdio e função miocárdio in vitro18,19.
1. Cultura celular
NOTA: O meio de cultura basal consiste no meio de águia modificado de Dulbecco (DMEM), 10% de soro bovino fetal (FBS), 1% suplemento de crescimento de miócito cardíaco e solução de penicilina/estreptomicina de 1%. Armazene o meio a 4 °C e pré-aquecimento a 37 °C antes de usar.
- Remova as células criopreservadas de cardiomiócito humano (HCM) do nitrogênio líquido e descongele-as em um banho de água a 37 °C.
- Agite suavemente o frasco (<1 minuto) em um banho de água de 37 °C até que apenas um pequeno pedaço de gelo permaneça no frasco.
- Transfira o frasco para um capô de fluxo laminar estéril. Limpe o lado de fora do frasco com uma bola de algodão mergulhada em 70% de álcool.
- Transfira 4 mL de crescimento completo pré-armado para o tubo de centrífuga contendo as células descongeladas.
- Centrifugar a suspensão da célula a 200 × g por 10 minutos. Após a centrifugação, descarte o supernasce e resuspenque a pelota em 5 mL de meio completo.
- Mantenha as células a 37 °C em uma incubadora umidificada sob uma atmosfera com 95% de ar e 5% de CO2.
NOTA: Antes de colher as células para experimentos, as células podem crescer até atingir aproximadamente 60-70% de confluência.
2. Estabelecimento de um modelo de privação de oxigênio-glicose (OGD)
NOTA: Duas horas antes do período de estudo, substitua o meio de crescimento por meio livre de soro, e as células foram reincidadas em uma incubadora umidificada por 2h a 37 °C sob uma atmosfera com 5% de CO2.
- Aspire o meio a partir de uma placa de 6 poços e lave suavemente as células três vezes com soro fisco tamponado de fosfato (PBS).
- Adicione 2 mL de DMEM sem açúcar fresco por poço.
- Cultura as células a uma temperatura constante em uma incubadora de três gáss sob uma atmosfera com uma mistura de 95% N2, 5% CO2, e 0,1% O2 a 37 °C para 1, 2, 4, 8, 12 ou 16 h.
- Após o tratamento da hipóxia, aspire o meio da placa de 6 poços e lave as células com PBS (pH 7.4) três vezes.
- Adicione 2 mL de DMEM completo por poço.
- Mantenha as células a 37 °C em uma incubadora umidificada sob uma atmosfera com 95% de ar e 5% de CO2.
3. Protocolo de temperatura do tempo
NOTA: Um protocolo padrão de temperatura-hora é usado durante a cirurgia cardíaca, conforme descrito anteriormente por outros20,21. Tratar os HCMs de acordo com o seguinte protocolo (Figura 1): ponto de tempo 1 (T1) indica o fim da indução, o ponto de tempo 2 (T2) indica o fim da manutenção e o ponto de tempo 3 (T3) indica o fim do reaquecimento. Analisar células de controle mantidas em condições normômicas contínuas (37 °C). As condições de temperatura são criadas usando uma incubadora de três gases, que permite uma regulação precisa da temperatura.
- Duas horas antes dos experimentos, aspire o meio de cultura a partir de uma placa de 6 poços e adicione 2 mL de DMEM fresco sem soro por poço.
- Rec incubar as células em uma incubadora umidificada por 2h a 37 °C sob uma atmosfera com 5% de CO2.
- Depois de 2h, aspire o meio da placa de 6 poços e lave as células com PBS (pH 7.4) três vezes.
- Adicione 2 mL de DMEM fresco sem soro por poço.
- Reincodute as células da incubadora de três gases.
NOTA: Substitua o meio para remover células e detritos não ligados. - Mude imediatamente a temperatura colocando os pratos da cultura em uma incubadora de três gáss.
- Após 1h de resfriamento, aspire rapidamente o meio da placa de 6 poços e adicione 2 mL de DMEM sem açúcar fresco por poço.
- Cultura as células em uma incubadora de três gases sob uma atmosfera composta por 95% N2, 5% CO2e 0,1% O2 a 37 °C por 12 h para estabelecer hipóxia.
- Defina a temperatura como descrito abaixo.
NOTA: O protocolo começa com 10h de tratamento de baixa temperatura, seguido de uma fase de reaquecimento de 2h até 37 °C, e 24h de normotermia (37 °C). Em todos os momentos, três pratos de Petri são removidos para análise. - Após tratamento de baixa temperatura, aspire o meio da placa de 6 poços e lave com PBS (pH 7.4) três vezes.
- Adicione 2 mL de DMEM completo por poço.
- Mantenha as células a 37 °C em uma incubadora umidificada sob uma atmosfera com 95% de ar e 5% de CO2.
4. Ensaio de viabilidade CCK-8
- Aqueça a solução de 0,25% de trypsin-etilenodiaminetetraactic acid (EDTA) e PBS a 37 °C antes de usar.
- Aspire o meio, enxágue as células com 1 mL de PBS e, em seguida, adicione 0,5 mL de trippsina de 0,25% ao longo da parede do poço. Incubar a 37 °C até que quase todos os HCMs sejam destacados (aproximadamente 1 min).
- Adicione 1 mL de MMEM médio completo aos poços para neutralizar a trippsina.
- Transfira a suspensão celular para um tubo de centrífuga de 15 mL e pelota os HCMs por centrifugação a 500 × g por 3 min. Aspire o supernatante sem perturbar a pelota.
- Dispense 100 alíquotas de μL da suspensão celular (5000 células/bem) em uma placa de 96 poços. Pré-insuse a placa por 24 h em uma incubadora umidificada (a 37 °C.)
- Use as células cultivadas nas placas de 96 poços para gerar diferentes grupos de tratamento.
- Incubar a placa por um período de tempo apropriado (16 h) em uma incubadora.
- Adicione 10 μL de solução CCK-8 a cada poço da placa.
- Incubar a placa por 1 hora na incubadora.
- Meça a absorvância em 450 nm usando um leitor de microplacas.
ATENÇÃO: Tenha cuidado para não introduzir bolhas nos poços, pois interferem nas medições de leitura de OD.
5. Citometria de fluxo para análise de apoptose
- Realize etapas de trypsinização e centrifugação seguindo as etapas 4.2-4.4.
NOTA: As células são colhidas com trippsina sem EDTA. Para avaliar apoptose, tanto as células flutuantes quanto as aderentes são coletadas. - Centrifugar as células por 5 minutos a 1000 × g. Descarte o supernatante e resuspenque a pelota em 1 mL de PBS.
- Conte as células usando um hemócito. Usando uma pipeta, transfira 100 μL de suspensão celular tratada com azul trypan para um hemócito. Usando um contador de contagem manual, conte as células ao vivo e sem manutenção em um conjunto de 16 quadrados e, em seguida, use PBS para gerar uma suspensão celular a1×10 7 células/ml.
- Obtenha 200 μL de suspensão celular (5 × 105 -1 × 106 células).
- Centrifugar por 5 min a 1000 × g e resuspensar a pelota na solução de ligação Anexo V-FITC.
- Adicione 5 μL de Anexo V-FITC para tingir as células.
- Adicione 10 μL de iodeto de propídio na suspensão celular.
- Misture suavemente as células e incuba-as por 20 minutos à temperatura ambiente no escuro.
NOTA: As células são resuspendidas 2-3 vezes durante a incubação para melhorar a coloração. - Inicie o citómetro de fluxo e certifique-se de que o software está funcionando adequadamente.
- Abra duas janelas de gráfico de pontos no software de citometria de fluxo.
- Selecione a luz dispersa dianteira (FSC) no eixo X e luz dispersa lateral (SSC) no eixo Y para excluir detritos celulares e/ou aglomerados em termos de seu tamanho e granularidade, respectivamente.
- Selecione o canal de detecção PE (590 mm) e o FITC (530 mm), que é usado para medir a intensidade da fluorescência das células.
- Coloque o tubo de amostra em branco (HCMs que não foram tingidos) no cítmetro de fluxo.
- Clique em Gravar para coletar partículas da suspensão no tubo de amostra em branco e, em seguida, portão da população celular para análise suplementar no primeiro gráfico de pontos.
- Coloque as amostras de uma única mancha no braço de suporte do tubo. Clique em Gravar para coletar partículas da suspensão e, em seguida, portal a população celular para análise suplementar no primeiro gráfico de pontos.
- Colete os HCMs em outros tubos de amostra e otimize a medição ajustando as tensões dos canais de fluorescência.
NOTA: Amostras não manchadas e manchadas são usadas como controles de compensação durante o experimento. - Exiba as estatísticas de cada tubo amostral e calcule a taxa de apoptose de cada amostra.
6. Avaliação de despolarização mitocondrial
- Realize a experimentação e a centrifugação seguindo as etapas 4.2-4.4.
- Resuspenda as células em 500 μL de meio completo e, em seguida, ajuste a densidade celular ajustada para 1 × 105 - 6 × 106 células
- Adicione 0,5 mL de solução de trabalho JC-1 a cada tubo.
- Incubar as células em uma incubadora celular a 37 °C por 20 minutos.
NOTA: Durante o período de incubação, adicione 1 mL de 5× tampão de coloração JC-1 a 4 mL de água destilada para preparar o tampão de coloração JC-1. - Após a incubação, centrifugar as células a 600 × g por 3 min a 4 °C.
- Descarte o supernatante e resuspenque a pelota em 1 mL de tampão de coloração JC-1.
- Repita as etapas 6,5 a 6,6 três vezes.
- Resuspengue os HCMs em 1 mL de tampão de coloração gelada em um tubo de centrífuga de 1,5 mL e use as células para análise dentro de 30 minutos.
- Selecione o canal de detecção PE (590 nm) e o FITC (530 nm) para medir a intensidade de fluorescência do corante JC-1 nas células.
NOTA: Configure o citômetro de fluxo seguindo as etapas 5.10-5.17.
7. Ensaio de espécies reativas de oxigênio
- Realize a experimentação e a centrifugação seguindo as etapas 4.2-4.4.
- Manche as células em meio de cultura com 10 μM DCFDA e ajuste a densidade celular para 1 × 106 - 1 × 107 células
- Incubar por 30 minutos a 37 °C.
- Pipeta suavemente as células para cima/para baixo a cada 3-5 minutos.
- Após a incubação, lave as células três vezes com meio de cultura celular livre de soro.
- Analise as células em um citômetro de fluxo seguindo as etapas 5.10-5.17.
NOTA: O DCF está animado em 488 nm e a intensidade de emissão medida em 530 nm.
8. Medição do Caspase 3/ Caspase 8 Atividade
- Realize a trypsinização seguindo as etapas 4.2-4.4.
- Colete as células por centrifugação a 600 × g a 4 °C por 5 minutos.
- Adicione 100 μL de tampão de lise por 2 × 106 células.
- Lyse as células por 15 minutos no gelo.
- Depois de incubar por 15 minutos em um banho de gelo, centrifugar a amostra a 1,6 × 104 x g a 4 °C por 15 minutos.
- Transfira o supernatante para um tubo de centrífuga gelado para uso.
NOTA: A concentração proteica na amostra deve ser de pelo menos 1-3 mg/mL. - Remova Ac-DEVD-pNA (2 mM) e coloque-o em um banho de gelo para uso.
- Adicione com precisão 40 μL de solução tampão à placa etiquetada por enzima, adicione 80 μL da amostra e, finalmente, adicione 10 μL de Ac-DEVD-pNA (2 mM).
- Incubar a amostra a 37 °C durante 120 minutos.
- Mediu o valor A405 em um leitor de microplacão de acordo com as instruções do fabricante.
NOTA: A absorvância produzida pela pNA gerada pelo caspase-3/caspase-8 é calculada subtraindo o valor A405 do controle em branco do da amostra.
Resultados
O efeito da exposição ao OGD na viabilidade dos HCMs foi determinado pelo ensaio CCK-8. Em comparação com o observado no grupo controle, a viabilidade celular foi significativamente diminuída de forma dependente do tempo(Figura 2A). As taxas de apoptose de HCMs em diferentes horários após a reperfusão apresentaram tendência específica, onde de 0 a 16 h, as taxas de apoptose aumentaram gradualmente e atingiram a taxa máxima no ponto de tempo de 16h(Figura 2B). Como OGD para 12 h reduziu a atividade celular em ~50%, 12 h OGD foi usado para induzir danos celulares em experimentos subsequentes.
Posteriormente, examinamos o efeito da temperatura no processo de apoptose. Em comparação com o observado no grupo OGD, o percentual de células viáveis foi maior nos três grupos tratados com hipotermia(Figura 3B). Além disso, as células do grupo de hipotermia profunda apresentaram a maior viabilidade (>92%), 2,1 vezes maior do que a observada no grupo OGD. Além disso, os resultados da citometria de fluxo mostraram que a hipotermia impediu a apoptose de HCMs em condições de OGD(Figura 3A&3C). Como a disfunção mitocondrial está associada à apoptose, obtivemos dados adicionais para avaliar distúrbios mitocondriais. Os níveis ros intracelulares foram determinados utilizando-se um ensaio DCFH-DA. Em comparação com o observado no grupo OGD, o tratamento de hipotermia diminuiu os níveis de ROS intracelulares em HCMs (Figura 4A). Além disso, o potencial da membrana mitocondrial foi detectado com a coloração JC-1. Após o tratamento de OGD, a fluorescência vermelha do JC-1 foi significativamente reduzida, e a fluorescência verde foi significativamente aumentada. Em contraste, o tratamento de hipotermia inibiu significativamente o efeito induzido pelo OGD e aumentou a razão vermelha para a verde por uma grande margem(Figura 4B). Além disso, observou-se a diminuição da caspase 3/caspase-8 nas células que foram tratadas com tratamentos de hipotermia(Figura 4C,4D)
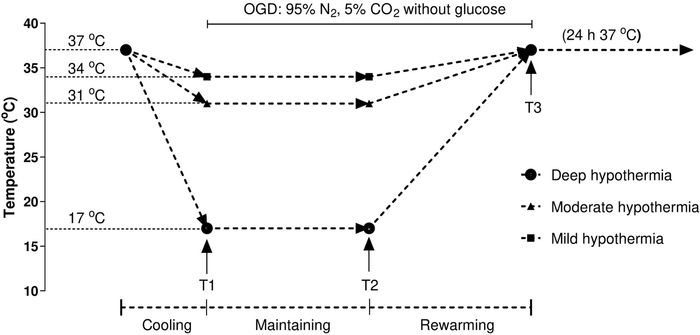
Figura 1: Fluxograma do procedimento experimental. Os HCMs foram tratados de acordo com o seguinte protocolo: o ponto de tempo 1 (T1) indica o fim da indução (resfriamento por 2h); o ponto de tempo 2 (T2) indica o fim da manutenção (hipotermia por 10h na temperatura desejada); e o ponto de tempo 3 (T3) indica o fim do reaquecimento (reaquecimento por duas h até 37 °C). A temperatura foi mantida na temperatura desejada: 34 °C para hipotermia leve, 31°C para hipotermia moderada e 17 °C para hipotermia grave. Foram analisadas células de controle mantidas em condições normômicas contínuas (37 °C). As condições de temperatura foram criadas utilizando uma incubadora de três gases, que permite uma regulação precisa da temperatura. Clique aqui para ver uma versão maior desta figura.

Figura 2: Avaliação da viabilidade celular e apoptose pelos ensaios CCK-8 e Anexo V/PI. (A) A viabilidade celular foi medida utilizando-se um ensaio de viabilidade celular. b Apoptose foi analisada por citometria de fluxo. *p < 0,05,***p < 0,001 versus grupo Normal. Clique aqui para ver uma versão maior desta figura.
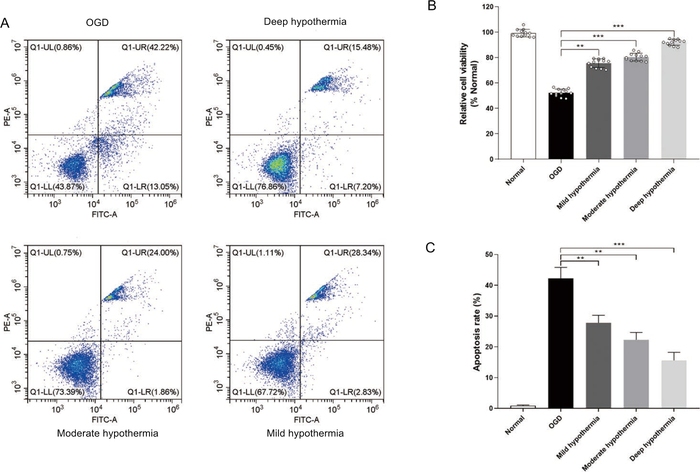
Figura 3: Avaliação da viabilidade celular e apoptose após tratamentos de hipotermia. (A) A apoptose celular foi detectada por citometria de fluxo. (B) Análise quantitativa da apoptose. (C) A viabilidade celular foi medida utilizando-se um ensaio de viabilidade celular. **p < 0,01,***p < 0,001 versus grupo Normal. Clique aqui para ver uma versão maior desta figura.

Figura 4: Análise da função mitocondrial e da atividade caspase-3 caspase-8. Um níveis ros intracelulares. B Quantificação do potencial da membrana mitocondrial. (C&D) A atividade caspase-8/caspase-3 foi estimada por meio de um kit ELISA. *p < 0,05, **p < 0,01, ***p < 0,001 contra grupo OGD. Clique aqui para ver uma versão maior desta figura.
Discussão
As complexidades dos animais intactos, incluindo as interações entre diferentes tipos de células, muitas vezes impedem estudos detalhados de componentes específicos da lesão de I/R. Portanto, é necessário estabelecer um modelo de célula in vitro que possa refletir com precisão as mudanças moleculares após a isquemia in vivo. Pesquisas sobre modelos OGD foram relatadas anteriormente13,22, e muitos métodos sofisticados foram estabelecidos23,24. O processo de preparação dos modelos OGD inclui dois passos fundamentais: privação de oxigênio e privação de glicose. No presente estudo, a privação de glicose foi realizada por célula de cultivo em meio livre de glicose, e a privação de oxigênio foi alcançada por substituição por nitrogênio, que atualmente é um método bem estabelecido para preparar os modelos OGD25,26. No entanto, dependendo do tipo celular, dois fatores devem ser considerados, incluindo:1) densidade de semeadura celular e 2) duração da exposição ao OGD. Quanto maior o número de células anexadas, mais forte a resistência ao estresse OGD, de tal forma que a duração da semeadura antes do OGD é crucial. Os HCMs (2 × 105 células/poços) foram semeados em placa de 6 poços por 30-34h antes do OGD, período em que as células eram aproximadamente 65% confluentes. Maior densidade celular reduzirá o impacto do OGD nas células. Além disso, é fundamental minimizar o potencial de perda das células durante as etapas de lavagem. O efeito da duração da exposição ao OGD é outro fator importante na avaliação da eficácia do modelo OGD. Por exemplo, para estudar os efeitos protetores dos medicamentos, é apropriado escolher uma duração que cause 40-50% de morte celular sem tratamento. Se a morte celular for muito extrema, por exemplo, 80%, então será desafiador quantificar o efeito protetor do reagente que está sendo analisado. Para os HCMs, a exposição ao OGD por 12 horas resultou em 42% de morte celular. Portanto, nos experimentos subsequentes, foi utilizado um tratamento OGD de 12 horas para induzir danos celulares.
Devido à diferença de cinética hipotérmica entre ambientes in vivo e in vitro, a abordagem ideal e os mecanismos de indução de hipotermia para o modelo de cardiomiócito permanecem incertos. Nas últimas décadas, vários modelos in vitro foram desenvolvidos para estudar cardiomiócitos a baixas temperaturas. Por exemplo, Jana Krech et al. estabeleceram um modelo celular moderado de hipotermia para estudar o efeito da temperatura na apoptose miocárdica após isquemia-reperfusão13. Embora muitos estudos tenham se concentrado nos efeitos fisiológicos do resfriamento, há também um grande número de efeitos colaterais nocivos que ocorrem durante o reaquecimento27. Os resultados de estudos anteriores mostraram que o reaquecimento pode induzir disfunção contratil nos cardiomiócitos isolados27,28. Portanto, a temperatura e a velocidade do reaquecimento são particularmente essenciais. Para controlar rigorosamente o efeito da temperatura, aplicamos o protocolo padrão de temperatura-tempo utilizado durante a cirurgia cardíaca, como mencionado anteriormente20,21. Neste modelo, a temperatura é controlada com precisão dentro da faixa de temperatura necessária, incluindo três estágios: 1) o período de resfriamento (1h); 2) o período de manutenção da temperatura (10h); e 3) o período de reaquecimento da temperatura (2 h). Além disso, as temperaturas utilizadas neste estudo são típicas de temperaturas baixas leves (34° C), moderadas (31 ° C) e severas (17°C), comparáveis às utilizadas em publicações anteriores29,30,31. Por fim, também testamos nossa hipótese sobre os efeitos de diferentes condições de temperatura na apoptose cardiomiocócica in vitro. Como esperado, os resultados mostraram que a temperatura reduziu significativamente os níveis de ROS, restaurou a MMP e diminuiu a atividade caspase-8 / caspase-3.
Estamos cientes de que este estudo foi realizado utilizando uma linha celular não contratida e um modelo in vitro, que não foi afetado por nenhum fluido corporal. Apesar dessas limitações, a melhora significativa da apoptose celular decorrente do tratamento da hipotermia enfatiza a importância de realizar uma investigação mais aprofundada, inclusive em estudos in vivo. Portanto, esse modelo pode ser utilizado para estudar o mecanismo molecular da cardioproteção hipotérmica, que pode ter implicações importantes para o desenvolvimento de terapias complementares para uso com hipotermia.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado em parte pela Fundação Nacional de Ciência Natural da China (81970265, 81900281,81700288), a Fundação de Pós-Doutorado da China (2019M651904); e o Programa Nacional de Pesquisa e Desenvolvimento da China (2016YFC1101001, 2017YFC1308105).
Materiais
| Name | Company | Catalog Number | Comments |
| Annexin V-FITC cell apoptosis detection kit | Bio-Technology,China | C1062M | |
| Cardiac myocyte growth supplement | Sciencell,USA | 6252 | |
| Caspase 3 activity assay kit | Bio-Technology,China | C1115 | |
| Caspase 8 activity assay kit | Bio-Technology,China | C1151 | |
| DMEM, no glucose | Gibco,USA | 11966025 | |
| Dulbecco's modified eagle medium | Gibco,USA | 11960044 | |
| Fetal bovine serum | Gibco,USA | 16140071 | |
| Flow cytometry | CytoFLEX,USA | B49007AF | |
| Human myocardial cells | BLUEFBIO,China | BFN60808678 | |
| Mitochondrial membrane potential assay kit with JC-1 | Bio-Technology,China | C2006 | |
| Penicillin/Streptomycin solution | Gibco,USA | 10378016 | |
| Reactive oxygen species assay kit | Bio-Technology,China | S0033S | |
| Three-gas incubator | Memmert,Germany | ICO50 | |
| Trypsin-EDTA (0.25%) | Gibco,USA | 25200056 |
Referências
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. Journal of Cardiovascular Translational Research. 9 (3), 230-238 (2016).
- Klein, P., et al. Less invasive ventricular reconstruction for ischaemic heart failure. EUROPEAN JOURNAL OF HEART FAILURE. 21 (12), 1638-1650 (2019).
- Otto, K. A. Therapeutic hypothermia applicable to cardiac surgery. VETERINARY ANAESTHESIA AND ANALGESIA. 42 (6), 559-569 (2015).
- Wang, X., et al. Safety of Hypothermic Circulatory Arrest During Unilateral Antegrade Cerebral Perfusion for Aortic Arch Surgery. CANADIAN JOURNAL OF CARDIOLOGY. 35 (11), 1483-1490 (2019).
- Leshnower, B. G., et al. Moderate Versus Deep Hypothermia With Unilateral Selective Antegrade Cerebral Perfusion for Acute Type A Dissection. ANNALS OF THORACIC SURGERY. 100 (5), 1563-1568 (2015).
- Vallabhajosyula, P., et al. Moderate versus deep hypothermic circulatory arrest for elective aortic transverse hemiarch reconstruction. ANNALS OF THORACIC SURGERY. 99 (5), 1511-1517 (2015).
- Keeling, W. B., et al. Safety of Moderate Hypothermia With Antegrade Cerebral Perfusion in Total Aortic Arch Replacement. ANNALS OF THORACIC SURGERY. 105 (1), 54-61 (2018).
- Yan, T. D., et al. Consensus on hypothermia in aortic arch surgery. Annals of Cardiothoracic Surgery. 2 (2), 163-168 (2013).
- Zhou, J., Empey, P. E., Bies, R. R., Kochanek, P. M., Poloyac, S. M. Cardiac arrest and therapeutic hypothermia decrease isoform-specific cytochrome P450 drug metabolism. DRUG METABOLISM AND DISPOSITION. 39 (12), 2209-2218 (2011).
- Sharp, W. W., et al. Inhibition of the mitochondrial fission protein dynamin-related protein 1 improves survival in a murine cardiac arrest model. CRITICAL CARE MEDICINE. 43 (2), 38-47 (2015).
- Zhu, W. S., et al. Hsp90aa1: a novel target gene of miR-1 in cardiac ischemia/reperfusion injury. Sci Rep. 6, 24498 (2016).
- Castedo, E., et al. Influence of hypothermia on right atrial cardiomyocyte apoptosis in patients undergoing aortic valve replacement. Journal of Cardiothoracic Surgery. 2, 7 (2007).
- Krech, J., et al. Moderate therapeutic hypothermia induces multimodal protective effects in oxygen-glucose deprivation/reperfusion injured cardiomyocytes. Mitochondrion. 35, 1-10 (2017).
- Cooper, W. A., et al. Hypothermic circulatory arrest causes multisystem vascular endothelial dysfunction and apoptosis. ANNALS OF THORACIC SURGERY. 69 (3), 696-702 (2000).
- Kajimoto, M., et al. Selective cerebral perfusion prevents abnormalities in glutamate cycling and neuronal apoptosis in a model of infant deep hypothermic circulatory arrest and reperfusion. JOURNAL OF CEREBRAL BLOOD FLOW AND METABOLISM. 36 (11), 1992-2004 (2016).
- Liu, Y., et al. Deep Hypothermic Circulatory Arrest Does Not Show Better Protection for Vital Organs Compared with Moderate Hypothermic Circulatory Arrest in Pig Model. Biomed Research International. 2019, 1420216 (2019).
- Davidson, M. M., et al. Novel cell lines derived from adult human ventricular cardiomyocytes. JOURNAL OF MOLECULAR AND CELLULAR CARDIOLOGY. 39 (1), 133-147 (2005).
- Khan, K., Makhoul, G., Yu, B., Schwertani, A., Cecere, R. The cytoprotective impact of yes-associated protein 1 after ischemia-reperfusion injury in AC16 human cardiomyocytes. EXPERIMENTAL BIOLOGY AND MEDICINE. 244 (10), 802-812 (2019).
- Pan, J. A., et al. miR-146a attenuates apoptosis and modulates autophagy by targeting TAF9b/P53 pathway in doxorubicin-induced cardiotoxicity. Cell Death Discovery. 10 (9), 668 (2019).
- Schmitt, K. R., et al. S100B modulates IL-6 release and cytotoxicity from hypothermic brain cells and inhibits hypothermia-induced axonal outgrowth. NEUROSCIENCE RESEARCH. 59 (1), 68-73 (2007).
- Tong, G., et al. Deep hypothermia therapy attenuates LPS-induced microglia neuroinflammation via the STAT3 pathway. Neuroscience. 358, 201-210 (2017).
- Yu, Z. P., et al. Troxerutin attenuates oxygenglucose deprivation and reoxygenationinduced oxidative stress and inflammation by enhancing the PI3K/AKT/HIF1alpha signaling pathway in H9C2 cardiomyocytes. Molecular Medicine Reports. 22 (2), 1351-1361 (2020).
- Drescher, C., Diestel, A., Wollersheim, S., Berger, F., Schmitt, K. R. How does hypothermia protect cardiomyocytes during cardioplegic ischemia. European journal of cardiothoracic surgery. 40 (2), 352-359 (2011).
- Diestel, A., Drescher, C., Miera, O., Berger, F., Schmitt, K. R. Hypothermia protects H9c2 cardiomyocytes from H2O2 induced apoptosis. Cryobiology. 62 (1), 53-61 (2011).
- Zhang, Y., et al. HIF-1alpha/BNIP3 signaling pathway-induced-autophagy plays protective role during myocardial ischemia-reperfusion injury. BIOMEDICINE & PHARMACOTHERAPY. 120, 109464 (2019).
- An, W., et al. Exogenous IL-19 attenuates acute ischaemic injury and improves survival in male mice with myocardial infarction. BRITISH JOURNAL OF PHARMACOLOGY. 176 (5), 699-710 (2019).
- Han, Y. S., Schaible, N., Tveita, T., Sieck, G. Discontinued stimulation of cardiomyocytes provides protection against hypothermia-rewarming-induced disruption of excitation-contraction coupling. EXPERIMENTAL PHYSIOLOGY. 103 (6), 819-826 (2018).
- Yarbrough, W. M., et al. Caspase inhibition attenuates contractile dysfunction following cardioplegic arrest and rewarming in the setting of left ventricular failure. Journal of cardiovascular pharmacology. 44 (6), 645-650 (2004).
- Egorov, Y. V., Glukhov, A. V., Efimov, I. R., Rosenshtraukh, L. V. Hypothermia-induced spatially discordant action potential duration alternans and arrhythmogenesis in nonhibernating versus hibernating mammals. AMERICAN JOURNAL OF PHYSIOLOGY-HEART AND CIRCULATORY PHYSIOLOGY. 303 (8), 1035-1046 (2012).
- Bobi, J., et al. Moderate Hypothermia Modifies Coronary Hemodynamics and Endothelium-Dependent Vasodilation in a Porcine Model of Temperature Management. Journal of the American Heart Association. 9 (3), 014035 (2020).
- Dietrichs, E. S., Tveita, T., Myles, R., Smith, G. A novel ECG-biomarker for cardiac arrest during hypothermia. Scandinavian Journal of Trauma Resuscitation & Emergency Medicine. 28 (1), 27 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados