Method Article
אין ויטרו הערכה של הגנה שריר הלב בעקבות היפותרמיה-תנאים מקדים במודל מיוציטים לב אנושי
In This Article
Summary
ההשפעות המובהק של דרגות שונות של היפותרמיה על הגנה שריר הלב לא הוערכו ביסודיות. מטרת המחקר הנוכחי הייתה לכמת את רמות המוות התאי בעקבות טיפולי היפותרמיה שונים במודל מבוסס קרדיומיוציטים אנושיים, ולהניח את היסודות למחקר מולקולרי מעמיק בעתיד.
Abstract
איסכמיה/רפרופוזיה נגזר תפקוד שריר הלב הוא תרחיש קליני נפוץ בחולים לאחר ניתוח לב. בפרט, הרגישות של קרדיומיוציטים לפגיעה איסכמית גבוהה יותר מזו של אוכלוסיות תאים אחרות. כיום, היפותרמיה מעניקה הגנה ניכרת מפני עלבון איסכמי צפוי. עם זאת, חקירות של שינויים מולקולריים מורכבים הנגרמים על ידי היפותרמיה נשארות מוגבלות. לכן, חיוני לזהות מצב תרבותי דומה תנאי vivo שיכול לגרום נזק דומה לזה שנצפה במצב הקליני באופן לשחזור. כדי לחקות תנאים דמויי איסכמיה במבחנה, התאים במודלים אלה טופלו על ידי מחסור בחמצן / גלוקוז (OGD). בנוסף, יישמנו פרוטוקול טמפרטורת זמן סטנדרטי המשמש במהלך ניתוח לב. יתר על כן, אנו מציעים גישה להשתמש בשיטה פשוטה אך מקיפה לניתוח כמותי של פגיעה בשריר הלב. אפופטוזיס ורמות ביטוי של חלבונים הקשורים אפופטוזיס הוערכו על ידי cytometry זרימה באמצעות ערכת ELISA. במודל זה, בדקנו השערה לגבי ההשפעות של תנאי טמפרטורה שונים על אפופטוזיס קרדיומיוציטים במבחנה. האמינות של מודל זה תלויה בבקרת טמפרטורה קפדנית, הליכי ניסוי הניתנים לשליטה ותוצאות ניסיוניות יציבות. בנוסף, מודל זה יכול לשמש כדי ללמוד את המנגנון המולקולרי של cardioprotection היפותרמית, אשר עשויות להיות השלכות חשובות על התפתחות טיפולים משלימים לשימוש עם היפותרמיה.
Introduction
איסכמיה/reperfusion נגזר תפקוד שריר הלב הוא תרחיש קליני נפוץ בחולים לאחר ניתוח לב1,2. במהלך זריעת זרימה נמוכה nonpulsatile ותקופות של מעצר במחזור הדם הכולל, נזק מעורבים כל סוגי תאי הלב עדיין מתרחשת. בפרט, הרגישות של קרדיומיוציטים לפגיעה איסכמית גבוהה יותר מזו של אוכלוסיות תאים אחרות. כיום, היפותרמיה טיפולית (TH) מעניקה הגנה משמעותית מפני עלבון איסכמי צפוי בחולים שעברו ניתוח לב3,4. TH מוגדר כטמפרטורת גוף ליבה של 14-34 מעלות צלזיוס, אם כי אין קונצנזוס לגבי הגדרה שלקירורבמהלך ניתוח לב 5,6,7. בשנת 2013, פאנל בינלאומי של מומחים הציע מערכת דיווח סטנדרטית כדי לסווג טווחי טמפרטורה שונים של מעצר היפותרמי מערכתי במחזור הדם8. בהתבסס על מחקרי אלקטרואנצפלוגרפיה ומטבוליזם של המוח, הם חילקו היפותרמיה לארבע רמות: היפותרמיה עמוקה (≤ 14 מעלות צלזיוס), היפותרמיה עמוקה (14.1-20 מעלות צלזיוס), היפותרמיה מתונה (20.1-28 מעלות צלזיוס) והיפותרמיה קלה (28.1-34 מעלות צלזיוס). הקונצנזוס המומחה סיפק סיווג ברור ואחיד, המאפשר למחקרים להיות דומים יותר ולספק תוצאות רלוונטיות יותר מבחינה קלינית. הגנה זו הניתנת על ידי TH מבוססת על יכולתה להפחית את הפעילות המטבולית של תאים, להגביל עוד יותר את קצב צריכת הפוספטים באנרגיה גבוהה9,10. עם זאת, התפקיד של TH בהגנה שריר הלב הוא שנוי במחלוקת, עשוי להיות השפעות מרובות בהתאם למידת ההיפותרמיה.
שריר הלב I /R ידוע להיות מלווה apoptisis תאמוגברת 11. דיווחים אחרונים הבחינו כי מוות קרדיומיוציטים מתוכנת עולה במהלך ניתוח לב פתוח, ועלול לחפוף עם נמק, ובכך להגדיל את מספר תאי שריר הלב המתים12. לכן, הפחתת אפופטוזיס קרדיומיוציטים היא גישה טיפולית שימושית בפרקטיקה הקלינית. במודל קרדיומיוציטים פרוזדוריים לעכבר HL-1, היפותרמיה טיפולית הוצגה כדי להפחית את שחרור המיטוכונדריה של ציטוכרום c וגורם גרימת אפופטוזיס (AIF) במהלך רפרופוזיה13. עם זאת, ההשפעה של הטמפרטורה בוויסות אפופטוזיס שנוי במחלוקת ונראה תלוי במידת ההיפותרמיה. קופר ועמיתיו הבחינו כי בהשוואה לקבוצת ביקורת מעקף לב-ריאה נורמותרמית, שיעור האפופטוזיס של רקמת שריר הלב מחזירים עם מעצר מחזור הדם ההיפותרמי העמוק הוגדל14. בנוסף, התוצאות של מספר מחקרים הראו כי היפותרמיה עמוקה עשויה להפעיל את מסלול האפופטוזיס, בעוד היפותרמיה פחות אגרסיבית מופיעה כדי לעכב את המסלול12,15,16. הסיבה לתוצאה זו עשויה להיות בשל השפעות מבלבלות הקשורות לפציעה איסכמית וחוסר הבנה של המנגנונים שבאמצעותם הטמפרטורה משפיעה על רקמת שריר הלב. לכן, גבולות הטמפרטורה שבהם אפופטוזיס משופר או מוחלש צריך להיות מוגדר במדויק.
כדי להשיג הבנה טובה יותר של המנגנונים הקשורים ליעילות של היפותרמיה ולספק בסיס רציונלי ליישומה בבני אדם, חיוני לזהות מצב תרבותי דומה לתנאי vivo שיכולים לייצר נזק דומה לזה שנצפה למצב הקליני באופן לשחזור. צעד חיוני להשגת מטרה זו הוא לקבוע את התנאים האופטימליים לגרימת אפופטוזיס קרדיומיוציטים. בהתאם לכך, במחקר הנוכחי חקרנו את הפרטים המתודולוגיים לגבי ניסויים בחסך חמצן-גלוקוז עם תאים מתורבתים, מודל במבחנה של איסכמיה-רפרופוזיה. יתר על כן, הערכנו את ההשפעה של זמנים היפוקסיים-איסכמיים שונים על אפופטוזיס קרדיומיוציטים, ואימתנו את ההשערה שלנו לגבי ההשפעה של תנאי טמפרטורה שונים על אפופטוזיס התא במבחנה.
Protocol
מידע על ריאגנטים ומכשירים מסחריים מפורט בטבלת החומרים.
קו התאים הקרדיומיוציטים האנושי AC16 נגזר מההיתוך של תאים ראשוניים מרקמת לב חדרית בוגרת עם פיברובלסטים אנושיים שעברו טרנספורמציה SV4017, שנרכשו מ- BLUEFBIO (שנגחאי, סין). קו התאים מפתח תכונות ביוכימיות ומורפולוגיות רבות האופייניות לקרדיומיוציטים. בנוסף, קו התא נמצא בשימוש נרחב כדי להעריך נזק שריר הלב ותפקוד שריר הלב במבחנה18,19.
1. תרבות התאים
הערה: מדיום תרבות הבסיס מורכב בינוני של הנשר שונה של Dulbecco בסרום (DMEM), 10% סרום שור עוברי (FBS), 1% תוסף צמיחה מיוציטים לב, ו 1% פניצילין / סטרפטומיצין פתרון. יש לאחסן את המדיום ב-4°C וקדם-מלחמה עד 37°C לפני השימוש.
- הסר את תאי הקרדיומיוציטים האנושיים ההקפאה (HCM) מחנקן נוזלי והפשיר אותם באמבט מים ב-37 מעלות צלזיוס.
- בעדינות לנער את הבקבוקון (<1 דקה) באמבט מים 37 מעלות צלזיוס עד רק חתיכת קרח קטנה נשאר בקבוקון.
- מעבירים את הבקבוקון למכסה המנוע הסטרילי של הזרימה הלמינארית. לנגב את החלק החיצוני של הבקבוקון עם כדור צמר גפן טבול 70% אלכוהול.
- העבר 4 מ"ל של מדיום צמיחה מלאה מראש dropwise לתוך צינור צנטריפוגה המכיל את התאים מופשרים.
- צנטריפוגה השעיית התא ב 200 × g במשך 10 דקות. לאחר צנטריפוגה, להשליך את supernatant ו resuspend גלולה ב 5 מ"ל של מדיום שלם.
- לשמור על התאים ב 37 °C (69 °F) באינקובטור לח תחת אטמוספרה עם 95% אוויר ו 5% CO2.
הערה: לפני קצירת התאים לניסויים, התאים רשאים לגדול עד להגיע לערך 60-70% מפגש.
2. הקמת מודל מניעת גלוקוז בחמצן (OGD)
הערה: שעתיים לפני תקופת המחקר, להחליף את מדיום הצמיחה עם מדיום ללא סרום, ואת התאים היו reincubated באינקובטור לח במשך 2 שעות ב 37 °C (69 °F) תחת אטמוספרה עם 5% CO2.
- שאפו את המדיום מצלחת של 6 בארות ושטפו בעדינות את התאים שלוש פעמים עם מלוחים עם אגירת פוספט (PBS).
- הוסיפו 2 מ"ל של DMEM טרי ללא סוכר לבאר.
- תרבות התאים בטמפרטורה קבועה באינקובטור שלושה גזים תחת אטמוספרה עם תערובת של 95% N2, 5% CO2, ו 0.1% O2 ב 37 °C (60 °F) עבור 1, 2, 4, 8, 12, או 16 שעות.
- לאחר הטיפול היפוקסיה, לשאוף את המדיום מצלחת 6-well ולשטוף את התאים עם PBS (pH 7.4) שלוש פעמים.
- הוסף 2 מ"ל של DMEM מלא לבאר.
- לשמור על התאים ב 37 °C (69 °F) באינקובטור לח תחת אטמוספרה עם 95% אוויר ו 5% CO2.
3. פרוטוקול טמפרטורת זמן
הערה: פרוטוקול טמפרטורת זמן סטנדרטי משמש במהלך ניתוח לב, כפי שתואר בעבר על ידי אחרים20,21. טיפול ב- HCMs בהתאם לפרוטוקול הבא (איור 1): נקודת זמן 1 (T1) מציינת את סוף האינדוקציה, נקודת זמן 2 (T2) מציינת את סוף התחזוקה ונקודת זמן 3 (T3) מציינת את סוף החינום מחדש. לנתח תאי בקרה המתוחזקים בתנאים נורמותרמיים רציפים (37 °C (67 °F). תנאי הטמפרטורה נוצרים באמצעות חממה תלת-גזית, המאפשרת ויסות טמפרטורה מדויק.
- שעתיים לפני הניסויים, שאפו את מדיום התרבות מצלחת של 6 בארות והוסיפו 2 מ"ל של DMEM טרי ללא סרום לבאר.
- דגירה מחדש של התאים באינקובטור לח במשך 2 שעות ב 37 °C (69 °F) תחת אטמוספרה עם 5% CO2.
- לאחר 2 שעות, לשאוף את המדיום מצלחת 6-well ולשטוף את התאים עם PBS (pH 7.4) שלוש פעמים.
- הוסיפו 2 מ"ל של DMEM טרי ללא סרום לבאר.
- צנרור מחדש את התאים באינקובטור התלת-גז.
הערה: החלף את המדיום כדי להסיר תאים ופסולת לא מחוברים. - מיד לשנות את הטמפרטורה על ידי הצבת מנות התרבות חממה שלושה גז.
- לאחר שעה של קירור, שאפו במהירות את המדיום מצלחת ה-6 בארות והוסיפו 2 מ"ל של DMEM טרי ללא סוכר לבאר.
- תרבות התאים באינקובטור תלת-גז תחת אטמוספרה הכוללת 95% N2, 5% CO2, ו 0.1% O2 ב 37 °C (70 °F) עבור 12 שעות להקים היפוקסיה.
- הגדר את הטמפרטורה כמתואר להלן.
הערה: הפרוטוקול מתחיל עם 10 שעות של טיפול בטמפרטורה נמוכה, ואחריו שלב חנוכה מחדש עבור 2 שעות עד 37 מעלות צלזיוס, ו 24 שעות של נורמותרמיה (37 °C (37 °F). בכל נקודת זמן, שלוש מנות פטרי מוסרות לניתוח. - לאחר טיפול בטמפרטורה נמוכה, לשאוף את המדיום מצלחת 6-well ולשטוף עם PBS (pH 7.4) שלוש פעמים.
- הוסף 2 מ"ל של DMEM מלא לבאר.
- לשמור על התאים ב 37 °C (69 °F) באינקובטור לח תחת אטמוספרה עם 95% אוויר ו 5% CO2.
4. CCK-8 מבחני הכדאיות
- לחמם את 0.25% טריפסין-אתילנדיאמינטי חומצה טראצטית (EDTA) פתרון PBS כדי 37 °C (70 °F) לפני השימוש.
- לשאוף את המדיום, לשטוף את התאים עם 1 מ"ל של PBS ולאחר מכן להוסיף 0.5 מ"ל של 0.25% טריפסין לאורך הקיר של הבאר. דגירה ב 37 מעלות צלזיוס עד כמעט כל HCMs מנותקים (כ 1 דקות).
- הוסף 1 מ"ל של מדיום שלם DMEM לבארות כדי לנטרל את טריפסין.
- להעביר את ההשעיה התא צינור צנטריפוגה 15 מ"ל גלולה HCMs על ידי צנטריפוגה ב 500 × גרם במשך 3 דקות. לשאוף את supernatant מבלי להפריע גלולה.
- לוותר על 100 μL aliquots של השעיית התא (5000 תאים / טוב) לתוך צלחת 96-well. קדם-צנרור של הצלחת למשך 24 שעות באינקובטור לח (ב-37 מעלות צלזיוס).
- השתמש בתאים התרבותיים בצלחות 96-באר כדי ליצור קבוצות טיפול שונות.
- הדגירה את הצלחת לאורך זמן מתאים (16 שעות) באינקובטור.
- הוסף 10 μL של פתרון CCK-8 לכל באר של הצלחת.
- דגירה את הצלחת במשך שעה באינקובטור.
- למדוד את הספיגה ב 450 ננומטר באמצעות קורא microplate.
התראה: היזהר לא להציג בועות לבארות, כפי שהם מפריעים מדידות קריאת OD.
5. ציטומטריית זרימה לניתוח אפופטוזיס
- בצע את שלבי הנסיון והצנטריפוגה על-ידי ביצוע שלבים 4.2-4.4.
הערה: תאים נקצרים עם טריפסין ללא EDTA. כדי להעריך אפופטוזיס, תאים צפים ודבקים נאספים. - צנטריפוגה התאים במשך 5 דקות ב 1000 × גרם. השלך את supernatant ו resuspend גלולה ב 1 מ"ל של PBS.
- לספור את התאים באמצעות המוציטרומטר. באמצעות פיפטה, להעביר 100 μL של השעיית תאים שטופלו כחול Trypan להמוציטרומטר. באמצעות מונה ספירת ידיים, לספור את התאים חיים, מוכתמים בערכה אחת של 16 ריבועים ולאחר מכן להשתמש PBS כדי ליצור השעיית תא ב 1×107 תאים / מיליליטר.
- להשיג 200 μL של השעיית התא (5 × 105 -1 × 106 תאים).
- צנטריפוגה במשך 5 דקות ב 1000 × גרם ו resuspend גלולה בנספח V-FITC פתרון מחייב.
- הוסף 5 μL של נספח V-FITC לצבוע את התאים.
- הוסף 10 μL של פרופידיום יודיד לתוך ההשעיה התא.
- מערבבים בעדינות את התאים ומדגירה אותם במשך 20 דקות בטמפרטורת החדר בחושך.
הערה: התאים מנוצלים מחדש 2-3 פעמים במהלך הדגירה כדי לשפר את הכתם. - הפעל את ציטומטר הזרימה וודא שהתוכנה פועלת כראוי.
- פתח שני חלונות התוויית נקודות בתוכנת ציטומטריית הזרימה.
- בחר אור מפוזר קדימה (FSC) על ציר X ואור מפוזר בצד (SSC) על ציר Y כדי לא לכלול פסולת תא ו / או גושים במונחים של גודלם וצפיפותם, בהתאמה.
- בחר את ערוץ הזיהוי PE (590 מ"מ) ואת FITC (530 מ"מ), המשמש למדידת עוצמת הפלואורסצנטיות של התאים.
- מקם את הצינור לדוגמה ריק (HCMs שלא נצבעו) על ציטומטר הזרימה.
- לחץ על רשומה כדי לאסוף חלקיקים מן ההשעיה בצינור מדגם ריק ולאחר מכן שער אוכלוסיית התא לניתוח נוסף בחלקת הנקודה הראשונה.
- מניחים את הדגימות המוכתמות על זרוע התמיכה בצינור. לחץ על רשומה כדי לאסוף חלקיקים מההשעיה ולאחר מכן שער אוכלוסיית התא לניתוח נוסף בחלקת הנקודה הראשונה.
- לאסוף את HCMs בצינורות מדגם אחרים לייעל את המדידה על ידי התאמת המתחים של ערוצי פלואורסצנטיות.
הערה: דגימות לא מוכתמות ומוכתמות בודדות משמשות כפקדי פיצוי במהלך הניסוי. - הצג את הסטטיסטיקה של כל צינור מדגם וחשב את קצב האפופטוזיס של כל דגימה.
6. הערכת דה-פולריזציה מיטוכונדרית
- בצע טריפסיניזציה וצנטריפוגה על-ידי ביצוע שלבים 4.2-4.4.
- resuspend התאים ב 500 μL של מדיום מלא, ולאחר מכן להתאים את צפיפות התא מותאם 1 × 105 - 6 × 106 תאים
- הוסף 0.5 מ"ל של פתרון עבודה JC-1 לכל צינור.
- דגירה התאים באינקובטור התא ב 37 °C (69 °F) במשך 20 דקות.
הערה: במהלך תקופת הדגירה, להוסיף 1 מ"ל של 5× JC-1 חיץ כתמים ל 4 מ"ל של מים מזוקקים כדי להכין את חיץ הכתמים JC-1. - לאחר הדגירה, צנטריפוגה התאים ב 600 × גרם במשך 3 דקות ב 4 מעלות צלזיוס.
- השלך את supernatant ו resuspend גלולה ב 1 מ"ל של JC-1 חיץ כתמים.
- חזור על שלבים 6.5 עד 6.6 שלוש פעמים.
- לשים מחדש את HCMs ב 1 מ"ל של חיץ כתמים קר כקרח בצינור צנטריפוגה 1.5 מ"ל ולהשתמש בתאים לניתוח בתוך 30 דקות.
- בחר בערוץ הזיהוי PE (590 ננומטר) וב- FITC (530 ננומטר) כדי למדוד את עוצמת הפלואורסצנטיות של צבע JC-1 בתאים.
הערה: הגדר את סיטומטר הזרימה על-ידי ביצוע שלבים 5.10-5.17.
7. מבחני חמצן תגובתי
- בצע טריפסיניזציה וצנטריפוגה על-ידי ביצוע שלבים 4.2-4.4.
- הכתים את התאים במדיום תרבות עם 10 מיקרומטר DCFDA ולהתאים את צפיפות התא ל 1 × 106 - 1 × 107 תאים
- דגירה במשך 30 דקות ב 37 מעלות צלזיוס.
- בעדינות פיפטה התאים למעלה / למטה כל 3-5 דקות.
- לאחר הדגירה, לשטוף את התאים שלוש פעמים עם מדיום תרבות התא ללא סרום.
- לנתח את התאים על cytometer זרימה על ידי ביצוע שלבים 5.10-5.17.
הערה: DCF מתרגש ב-488 ננומטר ועוצמת הפליטה נמדדת ב-530 ננומטר.
8. מדידה של Caspase 3 / Caspase 8 פעילות
- בצע נסיון על-ידי ביצוע שלבים 4.2-4.4.
- לאסוף את התאים על ידי צנטריפוגה ב 600 × גרם ב 4 מעלות צלזיוס במשך 5 דקות.
- הוסף 100 μL של מאגר ליזלת לכל 2 × 106 תאים.
- ליס התאים במשך 15 דקות על קרח.
- לאחר הדגירה במשך 15 דקות באמבט קרח, צנטריפוגה המדגם ב 1.6 × 10 4 xגרם ב 4 מעלות צלזיוס במשך 15 דקות.
- מעבירים את הסופרנט לצינור צנטריפוגות קר כקרח לשימוש.
הערה: ריכוז החלבון במדגם צריך להיות לפחות 1-3 מ"ג / מ"ל. - הסר Ac-DEVD-pNA (2 mM) ומניחים אותו על אמבט קרח לשימוש.
- להוסיף במדויק 40 μL של פתרון חיץ לצלחת שכותרתו אנזים, להוסיף 80 μL של המדגם, ולבסוף להוסיף 10 μL של Ac-DEVD-pNA (2 מ"מ).
- דגירה את המדגם ב 37 °C (69 °F) במשך 120 דקות.
- מדד את ערך A405 בקורא מיקרופלאט בהתאם להוראות היצרן.
הערה: הספיגה המיוצרת על-ידי pNA שנוצר על-ידי caspase-3/caspase-8 מחושבת על-ידי חיסור ערך A405 של הפקד הריק מזה של המדגם.
תוצאות
ההשפעה של חשיפה OGD על הכדאיות של HCMs נקבע על ידי CCK-8 assay. בהשוואה לזה שנצפה בקבוצת הביקורת, הכדאיות של התאים פחתה באופן משמעותי באופן תלוי זמן (איור 2A). שיעורי האפופטוזיס של HCMs בזמנים שונים לאחר ההיתוך הראו מגמה ספציפית, שבה מ-0 ל-16 שעות, שיעורי האפופטוזיס עלו בהדרגה והגיעו לקצב המקסימלי בנקודת הזמן של 16 שעות (איור 2B). כמו OGD עבור 12 h מופחת פעילות התא על ידי ~ 50%, OGD 12 h שימש כדי לגרום נזק לתאים בניסויים הבאים.
לאחר מכן בדקנו את השפעת הטמפרטורה על תהליך האפופטוזיס. בהשוואה לזה שנצפה בקבוצת OGD, אחוז התאים הקיימים היה גבוה יותר בשלוש הקבוצות שטופלו בהיפותרמיה (איור 3B). בנוסף, תאים בקבוצת ההיפותרמיה העמוקה היו בעלי הכדאיות הגבוהה ביותר (>92%), פי 2.1 מזו שנצפתה בקבוצת OGD. בנוסף, תוצאות ציטומטריית הזרימה הראו כי היפותרמיה מנעה אפופטוזיס של HCMs בתנאי OGD (איור 3A&3C). בגלל תפקוד לקוי של המיטוכונדריה קשורה אפופטוזיס, השגנו נתונים נוספים כדי להעריך הפרעות מיטוכונדריות. רמות ROS תאיים נקבעו באמצעות בדיקת DCFH-DA. בהשוואה לזה שנצפה בקבוצת OGD, הטיפול בהיפותרמיה הפחית את רמות ROS תאיים ב HCMs (איור 4A). בנוסף, פוטנציאל קרום המיטוכונדריה זוהה עם כתמי JC-1. לאחר טיפול OGD, הפלואורסצנטיות האדומה של JC-1 הופחתה באופן משמעותי, והפלואורסצנטיות הירוקה גדלה באופן משמעותי. לעומת זאת, טיפול היפותרמיה עיכב באופן משמעותי את האפקט שנגרם על ידי OGD והגדיל את היחס האדום לירוק בהפרש גדול (איור 4B). יתר על כן, הירידה של caspase 3/caspase-8 נצפתה גם בתאים שטופלו בטיפולי היפותרמיה (איור 4C,4D)
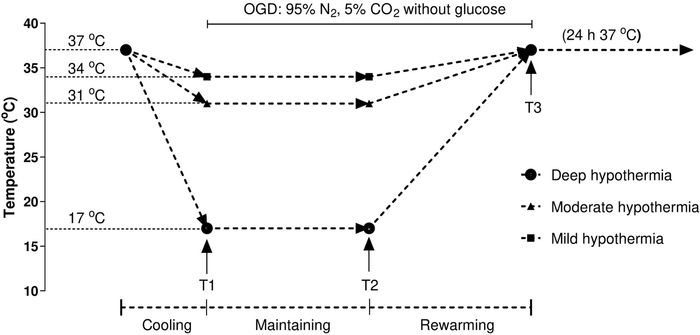
איור 1: תרשים זרימה של ההליך הניסיוני. HCMs טופלו על פי הפרוטוקול הבא: נקודת זמן 1 (T1) מציינת את סוף האינדוקציה (קירור למשך שעתיים); נקודת זמן 2 (T2) מציינת את סיום התחזוקה (היפותרמיה למשך 10 שעות בטמפרטורה הרצויה); ונקודת זמן 3 (T3) מציינת את סוף החנוך מחדש (חנוך מחדש עבור שתי שעות עד 37 °C (69 °F). הטמפרטורה נשמרה בטמפרטורה הרצויה: 34 °C (60 °F) עבור היפותרמיה קלה, 31 °C (60 °F) עבור היפותרמיה מתונה, ו 17 °C (69 °F) עבור היפותרמיה חמורה. תאי בקרה המתוחזקים בתנאים נורמותרמיים רציפים (37 °C (67 °F) נותחו. תנאי הטמפרטורה נוצרו באמצעות חממת שלושה גזים, המאפשרת ויסות טמפרטורה מדויק. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הערכת הכדאיות והאפופטוזיס של התאים על-ידי מבחני CCK-8 ו-Annexin V/PI. (א) הכדאיות של התא נמדדה באמצעות בדיקת כדאיות תאים. (ב) אפופטוזיס נותח על ידי ציטומטריית זרימה. *p < 0.05,***p < 0.001 לעומת קבוצה רגילה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
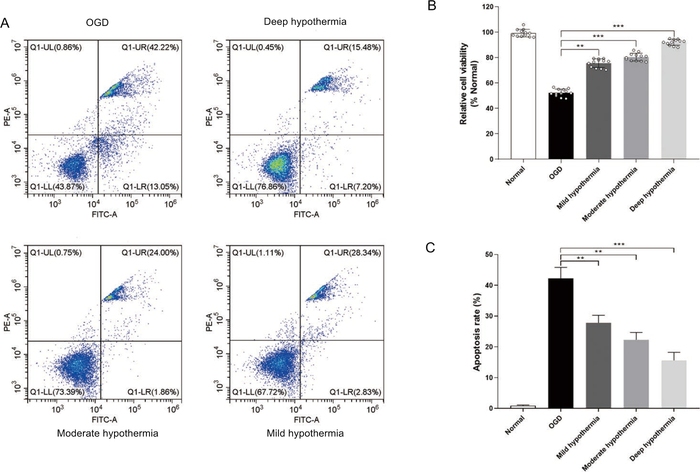
איור 3: הערכת כדאיות התא ואפופטוזיס בעקבות טיפולי היפותרמיה. (A)אפופטוזיס של התא זוהה על ידי ציטומטריית זרימה. (B)ניתוח כמותי של אפופטוזיס. (C) הכדאיות של התא נמדדה באמצעות בדיקת כדאיות של תאים. **p < 0.01,***p < 0.001 לעומת קבוצה רגילה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: ניתוח של תפקוד המיטוכונדריה ופעילות caspase-3 caspase-8. רמות ROS תאיים. כימות B של פוטנציאל קרום המיטוכונדריה. (C&D) הפעילות caspase-8/caspase-3 הוערך באמצעות ערכת ELISA. *p < 0.05, **p < 0.01, ***p < 0.001 לעומת קבוצת OGD. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
המורכבות של בעלי חיים שלמים, כולל האינטראקציות בין סוגים שונים של תאים, מונעת לעתים קרובות מחקרים מפורטים של רכיבים ספציפיים של פגיעה ב- I/R. לכן, יש צורך להקים מודל תא במבחנה שיכול לשקף במדויק את השינויים המולקולריים לאחר איסכמיה ב vivo. מחקר על מודלים OGD דווח בעבר13,22, ושיטות מתוחכמות רבות הוקמו23,24. תהליך ההכנה של מודלים OGD כולל שני שלבים מרכזיים: מחסור בחמצן וחוסר גלוקוז. במחקר הנוכחי, מניעת גלוקוז בוצעה על ידי תא culturing במדיום ללא גלוקוז, וחוסר חמצן הושג על ידי החלפה עם חנקן, אשר כיום שיטה מבוססת היטב להכין מודלים OGD25,26. עם זאת, בהתאם לסוג התא, יש לקחת בחשבון שני גורמים, כולל:1) צפיפות זריעת תאים ו-2) משך החשיפה ל-OGD. ככל שמספר התאים המחוברים גדול יותר, כך ההתנגדות ללחץ OGD חזקה יותר, כך שמשך הזריעה לפני OGD הוא קריטי. HCMs (2 × 105 תאים / בארות) נזרעו בצלחת 6-באר במשך 30-34 שעות לפני OGD, שבו התאים היו כ 65% confluent. צפיפות תאים גבוהה יותר תפחית את ההשפעה של OGD על תאים. בנוסף, חיוני כדי למזער את הפוטנציאל של אובדן התאים במהלך שלבי הכביסה. ההשפעה של משך החשיפה OGD הוא גורם חשוב נוסף בהערכת היעילות של מודל OGD. לדוגמה, כדי ללמוד את ההשפעות המגנות של תרופות, ראוי לבחור משך שגורם 40-50% מוות תאי ללא טיפול. אם מוות תאי הוא קיצוני מדי, למשל, 80%, אז זה יהיה מאתגר לכמת את ההשפעה המגנה של ריאגנט להיות מנותח. עבור HCMs, חשיפה OGD במשך 12 שעות הביא 42% מוות תאי. לכן, בניסויים הבאים, טיפול OGD 12 שעות שימש כדי לגרום נזק לתאים.
בשל ההבדל בקינטיקה היפותרמית בין סביבות in vivo ו- in vitro, הגישה האופטימלית והמנגנונים של אינדוקציה היפותרמיה לדגם קרדיומיוציטים עדיין אינם ברורים. בעשורים האחרונים פותחו מספר מודלים במבחנה לחקר קרדיומיוציטים בטמפרטורות נמוכות. לדוגמה, Jana Krech et al. הקימה מודל תא היפותרמיה מתון כדי לחקור את השפעת הטמפרטורה על אפופטוזיס שריר הלב לאחר איסכמיה-reperfusion13. למרות שמחקרים רבים התמקדו בהשפעות הפיזיולוגיות של הקירור, יש גם מספר רב של תופעות לוואי מזיקות המתרחשות במהלך חנוכת מחדש27. התוצאות של מחקרים קודמים הראו כי חנוכה מחדש יכולה לגרום לבעיות בתפקוד הכווץ בקרדיומיוציטים המבודדים27,28. לכן, הטמפרטורה והמהירות של התחדשות היא חיונית במיוחד. כדי לשלוט בקפדנות על השפעת הטמפרטורה, יישמנו את פרוטוקול טמפרטורת הזמן הסטנדרטי המשמש במהלך ניתוח לב, כאמור20,21. במודל זה, הטמפרטורה נשלטת במדויק בטווח הטמפרטורות הנדרש, כולל שלושה שלבים: 1) תקופת הקירור (1 שעות); 2) הטמפרטורה שמירה על תקופה (10 שעות); ו -3) תקופת החינון מחדש של הטמפרטורה (2 שעות). בנוסף, הטמפרטורות המשמשות במחקר זה אופייניות מתון (34 ° C), מתון (31 מעלות צלזיוס), ו חמור (17 מעלות צלזיוס) טמפרטורות נמוכות, דומה לאלה המשמשים פרסומיםקודמים 29,30,31. לבסוף, בדקנו גם את ההשערה שלנו לגבי ההשפעות של תנאי טמפרטורה שונים על אפופטוזיס קרדיומיוציטים במבחנה. כצפוי, התוצאות הראו כי הטמפרטורה הפחיתה באופן משמעותי את רמות ROS, MMP משוחזר, ירד caspase-8 / caspase-3 פעילות.
אנו מודעים לכך שמחקר זה בוצע הן באמצעות קו תאים שאינו התכווצות והן באמצעות מודל במבחנה, שלא הושפע מנוזלי גוף כלשהם. למרות מגבלות אלה, השיפור המשמעותי באפופטוזיס התא הנובע מטיפול היפותרמיה מדגיש את החשיבות של ביצוע חקירה נוספת, כולל במחקרי vivo. לכן, מודל זה יכול לשמש כדי ללמוד את המנגנון המולקולרי של היפותרמית cardioprotection, אשר עשויות להיות השלכות חשובות על התפתחות טיפולים משלימים לשימוש עם היפותרמיה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה בחלקה על ידי הקרן הלאומית למדעי הטבע של סין (81970265, 81900281,81700288), הקרן הלאומית למדע פוסט דוקטורט בסין (2019M651904); ותוכנית המחקר והפיתוח הלאומית של סין (2016YFC1101001, 2017YFC1308105).
Materials
| Name | Company | Catalog Number | Comments |
| Annexin V-FITC cell apoptosis detection kit | Bio-Technology,China | C1062M | |
| Cardiac myocyte growth supplement | Sciencell,USA | 6252 | |
| Caspase 3 activity assay kit | Bio-Technology,China | C1115 | |
| Caspase 8 activity assay kit | Bio-Technology,China | C1151 | |
| DMEM, no glucose | Gibco,USA | 11966025 | |
| Dulbecco's modified eagle medium | Gibco,USA | 11960044 | |
| Fetal bovine serum | Gibco,USA | 16140071 | |
| Flow cytometry | CytoFLEX,USA | B49007AF | |
| Human myocardial cells | BLUEFBIO,China | BFN60808678 | |
| Mitochondrial membrane potential assay kit with JC-1 | Bio-Technology,China | C2006 | |
| Penicillin/Streptomycin solution | Gibco,USA | 10378016 | |
| Reactive oxygen species assay kit | Bio-Technology,China | S0033S | |
| Three-gas incubator | Memmert,Germany | ICO50 | |
| Trypsin-EDTA (0.25%) | Gibco,USA | 25200056 |
References
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. Journal of Cardiovascular Translational Research. 9 (3), 230-238 (2016).
- Klein, P., et al. Less invasive ventricular reconstruction for ischaemic heart failure. EUROPEAN JOURNAL OF HEART FAILURE. 21 (12), 1638-1650 (2019).
- Otto, K. A. Therapeutic hypothermia applicable to cardiac surgery. VETERINARY ANAESTHESIA AND ANALGESIA. 42 (6), 559-569 (2015).
- Wang, X., et al. Safety of Hypothermic Circulatory Arrest During Unilateral Antegrade Cerebral Perfusion for Aortic Arch Surgery. CANADIAN JOURNAL OF CARDIOLOGY. 35 (11), 1483-1490 (2019).
- Leshnower, B. G., et al. Moderate Versus Deep Hypothermia With Unilateral Selective Antegrade Cerebral Perfusion for Acute Type A Dissection. ANNALS OF THORACIC SURGERY. 100 (5), 1563-1568 (2015).
- Vallabhajosyula, P., et al. Moderate versus deep hypothermic circulatory arrest for elective aortic transverse hemiarch reconstruction. ANNALS OF THORACIC SURGERY. 99 (5), 1511-1517 (2015).
- Keeling, W. B., et al. Safety of Moderate Hypothermia With Antegrade Cerebral Perfusion in Total Aortic Arch Replacement. ANNALS OF THORACIC SURGERY. 105 (1), 54-61 (2018).
- Yan, T. D., et al. Consensus on hypothermia in aortic arch surgery. Annals of Cardiothoracic Surgery. 2 (2), 163-168 (2013).
- Zhou, J., Empey, P. E., Bies, R. R., Kochanek, P. M., Poloyac, S. M. Cardiac arrest and therapeutic hypothermia decrease isoform-specific cytochrome P450 drug metabolism. DRUG METABOLISM AND DISPOSITION. 39 (12), 2209-2218 (2011).
- Sharp, W. W., et al. Inhibition of the mitochondrial fission protein dynamin-related protein 1 improves survival in a murine cardiac arrest model. CRITICAL CARE MEDICINE. 43 (2), 38-47 (2015).
- Zhu, W. S., et al. Hsp90aa1: a novel target gene of miR-1 in cardiac ischemia/reperfusion injury. Sci Rep. 6, 24498 (2016).
- Castedo, E., et al. Influence of hypothermia on right atrial cardiomyocyte apoptosis in patients undergoing aortic valve replacement. Journal of Cardiothoracic Surgery. 2, 7 (2007).
- Krech, J., et al. Moderate therapeutic hypothermia induces multimodal protective effects in oxygen-glucose deprivation/reperfusion injured cardiomyocytes. Mitochondrion. 35, 1-10 (2017).
- Cooper, W. A., et al. Hypothermic circulatory arrest causes multisystem vascular endothelial dysfunction and apoptosis. ANNALS OF THORACIC SURGERY. 69 (3), 696-702 (2000).
- Kajimoto, M., et al. Selective cerebral perfusion prevents abnormalities in glutamate cycling and neuronal apoptosis in a model of infant deep hypothermic circulatory arrest and reperfusion. JOURNAL OF CEREBRAL BLOOD FLOW AND METABOLISM. 36 (11), 1992-2004 (2016).
- Liu, Y., et al. Deep Hypothermic Circulatory Arrest Does Not Show Better Protection for Vital Organs Compared with Moderate Hypothermic Circulatory Arrest in Pig Model. Biomed Research International. 2019, 1420216 (2019).
- Davidson, M. M., et al. Novel cell lines derived from adult human ventricular cardiomyocytes. JOURNAL OF MOLECULAR AND CELLULAR CARDIOLOGY. 39 (1), 133-147 (2005).
- Khan, K., Makhoul, G., Yu, B., Schwertani, A., Cecere, R. The cytoprotective impact of yes-associated protein 1 after ischemia-reperfusion injury in AC16 human cardiomyocytes. EXPERIMENTAL BIOLOGY AND MEDICINE. 244 (10), 802-812 (2019).
- Pan, J. A., et al. miR-146a attenuates apoptosis and modulates autophagy by targeting TAF9b/P53 pathway in doxorubicin-induced cardiotoxicity. Cell Death Discovery. 10 (9), 668 (2019).
- Schmitt, K. R., et al. S100B modulates IL-6 release and cytotoxicity from hypothermic brain cells and inhibits hypothermia-induced axonal outgrowth. NEUROSCIENCE RESEARCH. 59 (1), 68-73 (2007).
- Tong, G., et al. Deep hypothermia therapy attenuates LPS-induced microglia neuroinflammation via the STAT3 pathway. Neuroscience. 358, 201-210 (2017).
- Yu, Z. P., et al. Troxerutin attenuates oxygenglucose deprivation and reoxygenationinduced oxidative stress and inflammation by enhancing the PI3K/AKT/HIF1alpha signaling pathway in H9C2 cardiomyocytes. Molecular Medicine Reports. 22 (2), 1351-1361 (2020).
- Drescher, C., Diestel, A., Wollersheim, S., Berger, F., Schmitt, K. R. How does hypothermia protect cardiomyocytes during cardioplegic ischemia. European journal of cardiothoracic surgery. 40 (2), 352-359 (2011).
- Diestel, A., Drescher, C., Miera, O., Berger, F., Schmitt, K. R. Hypothermia protects H9c2 cardiomyocytes from H2O2 induced apoptosis. Cryobiology. 62 (1), 53-61 (2011).
- Zhang, Y., et al. HIF-1alpha/BNIP3 signaling pathway-induced-autophagy plays protective role during myocardial ischemia-reperfusion injury. BIOMEDICINE & PHARMACOTHERAPY. 120, 109464 (2019).
- An, W., et al. Exogenous IL-19 attenuates acute ischaemic injury and improves survival in male mice with myocardial infarction. BRITISH JOURNAL OF PHARMACOLOGY. 176 (5), 699-710 (2019).
- Han, Y. S., Schaible, N., Tveita, T., Sieck, G. Discontinued stimulation of cardiomyocytes provides protection against hypothermia-rewarming-induced disruption of excitation-contraction coupling. EXPERIMENTAL PHYSIOLOGY. 103 (6), 819-826 (2018).
- Yarbrough, W. M., et al. Caspase inhibition attenuates contractile dysfunction following cardioplegic arrest and rewarming in the setting of left ventricular failure. Journal of cardiovascular pharmacology. 44 (6), 645-650 (2004).
- Egorov, Y. V., Glukhov, A. V., Efimov, I. R., Rosenshtraukh, L. V. Hypothermia-induced spatially discordant action potential duration alternans and arrhythmogenesis in nonhibernating versus hibernating mammals. AMERICAN JOURNAL OF PHYSIOLOGY-HEART AND CIRCULATORY PHYSIOLOGY. 303 (8), 1035-1046 (2012).
- Bobi, J., et al. Moderate Hypothermia Modifies Coronary Hemodynamics and Endothelium-Dependent Vasodilation in a Porcine Model of Temperature Management. Journal of the American Heart Association. 9 (3), 014035 (2020).
- Dietrichs, E. S., Tveita, T., Myles, R., Smith, G. A novel ECG-biomarker for cardiac arrest during hypothermia. Scandinavian Journal of Trauma Resuscitation & Emergency Medicine. 28 (1), 27 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved