Method Article
人类心脏肌细胞模型中体温过低预科后心肌保护体外评估
摘要
不同程度的体温过低对心肌保护的明显影响尚未得到彻底评估。本研究的目标是量化人类心肌细胞基模型中不同体温过低治疗后细胞死亡水平,为未来深入的分子研究奠定基础。
摘要
缺血/输液衍生心肌功能障碍是心脏手术后患者常见的临床方案。特别是,心肌细胞对缺血性损伤的敏感性高于其他细胞群体。目前,体温过低为预期的缺血性侮辱提供了相当大的保护。然而,对复杂的体温过低引起的分子变化的调查仍然有限。因此,必须确定一种类似于体内条件的文化条件,这种病症可以诱发类似于临床状况中以可重复的方式观察到的损伤。为了模拟体外类似缺血的条件,这些模型中的细胞通过缺氧/葡萄糖剥夺(OGD)进行治疗。此外,我们还应用了心脏手术中使用的标准时间温度协议。此外,我们提出了一种方法,使用简单但全面的方法对心肌损伤进行定量分析。通过流动细胞测量和使用 ELISA 套件对凋亡相关蛋白质的凋亡和表达水平进行评估。在这个模型中,我们测试了一个关于不同温度条件对体外心肌细胞凋亡的影响的假设。该模型的可靠性取决于严格的温度控制、可控的实验程序和稳定的实验结果。此外,该模型还可用于研究体温过低心脏保护的分子机制,这可能对开发用于体温过低的补充疗法有重要影响。
引言
缺血/输液衍生心肌功能障碍是患者心脏手术后常见的临床方案1,2。在非脉动低流量灌注和总循环阻滞期间,仍发生涉及所有类型心脏细胞的损伤。特别是,心肌细胞对缺血性损伤的敏感性高于其他细胞群体。目前,治疗性体温过低(TH)为接受心脏手术的病人提供了实质性的保护,防止预期的缺血性侮辱。TH 被定义为 14-34 °C 的核心体温,尽管对于心脏手术5、6、7期间冷却的定义没有共识。2013年,一个国际专家小组提出了一个标准化的报告系统,对系统性低温循环抑制8的各种温度范围进行分类。根据脑电图和大脑的新陈代谢研究,他们把体温过低分为四个层次:深度体温过低(≤14°C)、深度体温过低(14.1-20°C)、中度体温过低(20.1-28°C)和轻度体温过低(28.1-34°C)。专家共识提供了一个明确和统一的分类,使研究更具可比性,并提供更临床相关的结果。TH提供的这种保护是基于其降低细胞代谢活性的能力,进一步限制了细胞高能磷酸盐消耗9、10的速率。然而,TH在心肌保护中的作用是有争议的,并可能具有多种影响,这取决于体温过低的程度。
心肌 I/R 是众所周知的伴随着增加的细胞凋亡11.最近的报告观察到,在开放心脏手术期间,计划心肌细胞死亡增加,并可能与坏死同时发生,从而增加死亡心肌细胞的数量12。因此,减少心肌细胞凋亡是临床实践中一种有用的治疗方法。在小鼠心房HL-1心肌细胞模型中,治疗性体温过低被证明可减少13年输液期间细胞色素c和凋亡诱导因子(AIF)的线粒体释放。然而,温度在调节凋亡方面的影响是有争议的,似乎取决于体温过低的程度。Cooper及其同事观察到,与正常热心肺旁路对照组相比,患有深温低循环阻滞的猪心肌组织凋亡率提高了14。此外,一些研究结果表明,深度体温过低可能激活凋亡通路,而不太积极的体温过低似乎抑制通路12,15,16。造成这一结果的原因可能是与缺血性损伤相关的混淆效应和对温度影响心肌组织的机制缺乏了解。因此,应准确定义增强或衰减凋亡的温度限制。
为了更好地了解与体温过低的疗效相关的机制,并为在人类中实施这种机制提供合理的基础,必须确定一种类似于体内疾病的文化状况,这种状况能够产生类似于以可重复方式观察到的临床状况的损害。实现这一目标的一个重要步骤是建立诱导心肌细胞凋亡的最佳条件。因此,在本研究中,我们探索了有关培养细胞的缺氧-葡萄糖剥夺实验的方法细节,这是缺血-输液的一种外体模型。此外,我们评估了不同缺氧时间对心肌细胞凋亡的影响,并验证了我们关于不同温度条件对体外细胞凋亡影响的假设。
研究方案
有关商业试剂和仪器的信息列在 材料表中。
AC16人类心肌细胞系源自成人心室心脏组织的主要细胞与SV40转化的人类成纤维细胞17的融合,这些细胞是从BLEFBI(中国上海)购买的。细胞系具有心肌细胞的许多生化和形态特征。此外,细胞系被广泛用于评估心肌损伤和心肌功能体外18,19。
1. 细胞培养
注:基础培养介质由无血清杜尔贝科改良鹰介质(DMEM)、10%胎儿牛血清(FBS)、1%心脏肌细胞生长补充剂和1%青霉素/链霉素溶液组成。在使用前将介质存储在 4 °C 和预热至 37 °C。
- 从液氮中取出低温保存的人类心肌细胞(HCM),并在37°C的水浴中解冻。
- 在 37 °C 的水浴中轻轻摇动小瓶(+lt:1 分钟),直到小瓶中仅剩一小块冰。
- 将小瓶转移到无菌层流罩中。用浸入 70% 酒精的棉球擦拭小瓶的外部。
- 将4mL预热完全生长中下垂到含有解冻细胞的离心机管中。
- 将细胞悬浮在200×g下10分钟。 离心后,丢弃超自然物,用5mL的全中等介质重新喷射颗粒。
- 将细胞保持在37°C的潮湿孵化器下,空气为95%,二氧化碳为5%。
注意:在采集细胞进行实验之前,细胞可以生长,直到达到大约60-70%的汇流。
2. 建立缺氧(OGD)模型
注:在研究期前两小时,用无血清介质取代生长介质,细胞在潮湿的孵化器中再孵化2小时,在37°C的大气中含有5%的二氧化碳。
- 从6井板中吸气介质,用磷酸盐缓冲盐水(PBS)轻轻清洗细胞三次。
- 每口井添加 2 mL 的新鲜无糖 DMEM。
- 在大气层下的三气体孵化器中以恒定温度培养细胞,混合温度为 95% N2、5%CO2和 0.1% O2, 温度为 37 °C,持续 1、2、4、8、12 或 16 小时。
- 缺氧治疗后,从6井板吸气介质,用PBS(pH 7.4)清洗细胞三次。
- 每口井添加2毫升完整的DMEM。
- 将细胞保持在37°C的潮湿孵化器下,空气为95%,二氧化碳为5%。
3. 时间温度协议
注:在心脏手术中使用标准的时间温度协议,如其他人之前描述的20,21。根据以下协议(图 1) 处理 HCM : 时间点 1 (T1) 表示感应结束,时间点 2 (T2) 表示维护结束,时间点 3 (T3) 表示回暖结束。分析在连续正常热条件下保持的控制单元(37 °C)。温度条件使用三气体孵化器创建,从而允许精确的温度调节。
- 在实验前两小时,从6井板中吸气培养介质,每口井添加2毫升的新鲜无血清DMEM。
- 在37°C的大气中以5%的二氧化碳在潮湿的孵化器中重新孵化细胞2小时。
- 2小时后,从6井板吸气介质,用PBS(pH 7.4)清洗细胞三次。
- 每口井添加 2 mL 的新鲜无血清 DMEM。
- 在三气体孵化器中重新孵化细胞。
注意:更换介质以去除未连接的单元和碎屑。 - 立即将培养皿放入三气孵化器,从而改变温度。
- 冷却 1 小时后,快速从 6 井板中吸气介质,每口井添加 2 mL 的新鲜无糖 DMEM。
- 培养大气下三气体孵化器中的细胞,包括95%N 2、5%CO2和0.1%O2,在37°C下12小时建立缺氧。
- 设置下面描述的温度。
注:协议从10小时的低温治疗开始,然后是2小时至37°C的回暖阶段和24小时的正常热度(37°C)。在每个时间点,三个培养皿被移除进行分析。 - 经过低温处理后,从6井板吸气介质,用PBS(pH 7.4)洗三次。
- 每口井添加2毫升完整的DMEM。
- 将细胞保持在37°C的潮湿孵化器下,空气为95%,二氧化碳为5%。
4. CCK-8 可行性测定
- 使用前将 0.25% 的三聚氰胺-乙酰胺乙酰氨基酸 (EDTA) 溶液和 PBS 加热至 37 °C。
- 吸气介质,用 1 mL 的 PBS 冲洗细胞,然后沿井壁加入 0.5 mL 的 0.25% trypsin。孵化在37°C,直到几乎所有的HCM分离(约1分钟)。
- 将 1 mL 的 DMEM 完整介质添加到井中,以中和肌氨脂。
- 将细胞悬架转移到 15 mL 离心机管中,通过离心机在 500 × g 下颗粒 HCM 3 分钟。在不干扰颗粒的情况下吸气超自然人。
- 将细胞悬架(5000 个细胞/井)的 100 μL 等离子分配到 96 井板中。在加湿的孵化器中预孵化板 24 小时(在 37 °C.)
- 使用 96 井板中的培养细胞生成不同的治疗组。
- 在孵化器中孵化板的适当时间长度(16 h)。
- 在板的每个井中加入 10 μL 的 CCK-8 溶液。
- 在孵化器中孵化盘子1小时。
- 使用微板读卡器测量 450 nm 的吸收度。
注意:小心不要将气泡引入井中,因为它们会干扰OD读数测量。
5. 用于凋亡分析的流动细胞测量
- 按照步骤 4.2-4.4 执行尝试化和离心步骤。
注:细胞在没有EDTA的情况下用肌氨辛收获。为了评估凋亡,收集浮动细胞和粘附细胞。 - 在1000×克时将细胞离心5分钟。丢弃超自然物,在 1 mL 的 PBS 中重新喷射颗粒。
- 使用血细胞计数数细胞。使用移液器,将 100 μL 的 Trypan 蓝色处理细胞悬架转移到血细胞计中。使用手计数计数计数器,在一组 16 平方中计算活的未受污染的细胞,然后使用 PBS 以 1×107 细胞/毫升生成细胞悬架。
- 获得 200 μL 的细胞悬浮(5 × 105 -1 × 106 细胞)。
- 离心机在 1000 × g 下 5 分钟,并在附件 V-FITC 绑定解决方案中重新注入颗粒。
- 加入 5μL 的附件 V-FITC 来染色细胞。
- 在细胞悬架中加入 10 μL 的碘化物丙酸。
- 在黑暗中的室温下轻轻混合细胞并孵育20分钟。
注意:细胞在孵化过程中被再吸收2-3次,以改善染色。 - 启动流量细胞仪,并确保软件正常工作。
- 打开流细胞测量软件中的两个点图窗口。
- 选择 Y 轴 X 轴上的向前散射光 (FSC) 和侧散光 (SSC),分别从大小和粒度上排除细胞碎片和/或团块。
- 选择 PE (590 mm) 检测通道和 FITC (530 mm),用于测量细胞的荧光强度。
- 将空白(未染色的HCM)样品管放在流动细胞仪上。
- 单击 "记录" 从空白样品管中的悬浮物中收集粒子,然后对细胞群进行门控,以便在第一个点图中进行进一步分析。
- 将单染色样品放在管支撑臂上。单击 "记录" 从悬架中收集粒子,然后对细胞群进行门控,以便在第一个点图中进行进一步分析。
- 收集其他样品管中的丙肝,并通过调整荧光通道的电压来优化测量。
注:在实验过程中,未染色和单染色样品用作补偿控制。 - 显示每个样本管的统计数据,并计算每个样本的凋亡率。
6. 线粒体去极化评估
- 按照步骤 4.2-4.4 执行尝试式脱脂和离心。
- 将细胞在 500 μL 的完整介质中恢复,然后调整到 1 × 105 - 6 × 106 个单元格的细胞密度
- 为每个管添加 0.5 mL 的 JC-1 工作解决方案。
- 在37°C的细胞孵化器中孵化细胞20分钟。
注意:在孵化期间,将 1 mL 的 5 × JC-1 染色缓冲器添加到 4 mL 蒸馏水中,以准备 JC-1 染色缓冲。 - 孵化后,在4°C下以600×克的离心机3分钟。
- 丢弃超自然物,在 JC-1 染色缓冲器的 1 mL 中重新吸收颗粒。
- 重复步骤 6.5 到 6.6 三次。
- 在 1.5 mL 离心管中将高温计重新注入 1 mL 的冰冷染色缓冲器中,并在 30 分钟内使用电池进行分析。
- 选择 PE (590 nm) 检测通道和 FITC (530 nm) 来测量细胞中 JC-1 染料的荧光强度。
注意:按照步骤 5.10-5.17 设置流量细胞计。
7. 活性氧物种检测
- 按照步骤 4.2-4.4 执行尝试式脱脂和离心。
- 用 10μM DCFDA 在培养介质中染色细胞,并将细胞密度调整为 1 × 106 - 1 × 107 细胞
- 在37°C孵育30分钟。
- 每 3-5 分钟轻轻将细胞向上/向下移液。
- 孵育后,用无血清细胞培养介质清洗细胞三次。
- 按照步骤 5.10-5.17 分析流动细胞仪上的细胞。
注:DCF 在 488 nm 时兴奋不已,排放强度为 530 nm。
8. 测量卡斯帕斯 3/ 卡斯帕斯 8 活动
- 按照步骤 4.2-4.4 执行尝试个性化。
- 通过离心收集细胞,在 600 ×克,在 4 °C 5 分钟。
- 每 2 个× 106 个细胞添加 100 μL 的利萨特缓冲器。
- 在冰上将细胞酶化15分钟。
- 在冰浴中孵育 15 分钟后,将样品在 1.6 × 104 x g 在 4 °C 下浸泡 15 分钟。
- 将超母体转移到冰冷离心管中使用。
注:样品中的蛋白质浓度应至少为1-3毫克/升。 - 取出交流-DEVD-pNA(2 mM),并将其放在冰浴中使用。
- 准确地将 40 μL 的缓冲溶液添加到酶标记板中,加入 80 μL 的样品,最后添加 10 μL 的 Ac-DEVD-pNA (2 mM)。
- 在 37 °C 下孵化样品 120 分钟。
- 根据制造商的说明测量微板读卡器上的 A405 值。
注:通过从样品中减去空白控制的 A405 值来计算 caspase-3/caspase-8 产生的 pNA 产生的吸收。
结果
OGD 暴露对高致公箱生存能力的影响由 CCK-8 检测决定。与对照组观察到的细胞存活率相比,细胞存活率在时间依赖性方面显著降低(图2A)。输液后不同时间的氟氯化物凋亡率呈特定趋势,从0至16小时,凋亡率逐渐升高,达到16小时时点的最高率(图2B)。由于OGD 12小时将细胞活性降低约50%,12 h OGD在随后的实验中用于诱导细胞损伤。
随后,我们检查了温度对凋亡过程的影响。与OGD组观察到的相比,在接受体温过低治疗的三组(图3B)中,存活细胞的百分比更高。此外,深体温过低组的细胞的存活率最高(+92%),比OGD组高2.1倍。此外,流动细胞测量结果表明,体温过低可防止OGD条件下的氟氯烃凋亡(图3A&3C)。由于线粒体功能障碍与凋亡有关,我们获得了评估线粒体疾病的其他数据。细胞内 ROS 级别是使用 DCFH-DA 检测确定的。与OGD组观察到的相比,体温过低治疗降低了高血糖体中的细胞内ROS水平(图4A)。此外,通过 JC-1 染色检测到线粒体膜潜力。OGD治疗后,JC-1的红色荧光显著降低,绿色荧光显著增加。相比之下,体温过低治疗显著抑制了OGD诱发的效果,使红色与绿色的比例大大增加(图4B)。此外,在接受体温过低治疗的细胞中也观察到3/caspase-8的减少(图4C,4D)
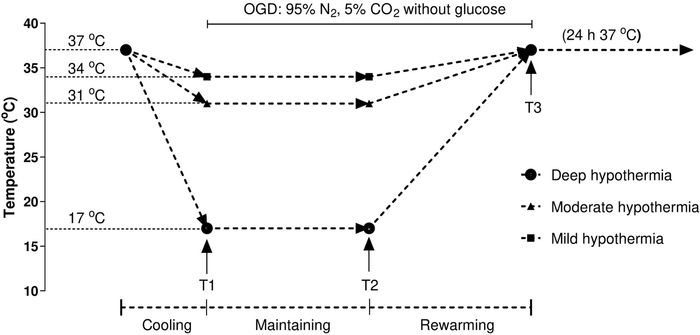
图1:实验过程的流程图。根据以下协议对丙肝治疗:时间点1(T1)表示感应结束(冷却2小时):时间点 2 (T2) 表示维护结束(在所需温度下低温 10 小时):和时间点 3 (T3) 表示重新暖和的结束 (重新暖和两小时高达 37 °C).温度保持在所需的温度:34 °C 的轻度体温过低,31°C 的中度体温过低,和 17 °C 的严重体温过低。分析了在连续正常热条件下维持的控制细胞(37 °C)。温度条件是使用三气体孵化器创建的,该孵化器允许精确的温度调节。 请单击此处查看此图的更大版本。

图2:CCK-8和附件V/PI检测对细胞生存能力和凋亡的评估。(A) 细胞生存能力是通过使用细胞生存能力检测来测量的。(B) 通过流动细胞学分析凋亡。*p=0.05,*lt:0.001与正常组。 请单击此处查看此图的更大版本。
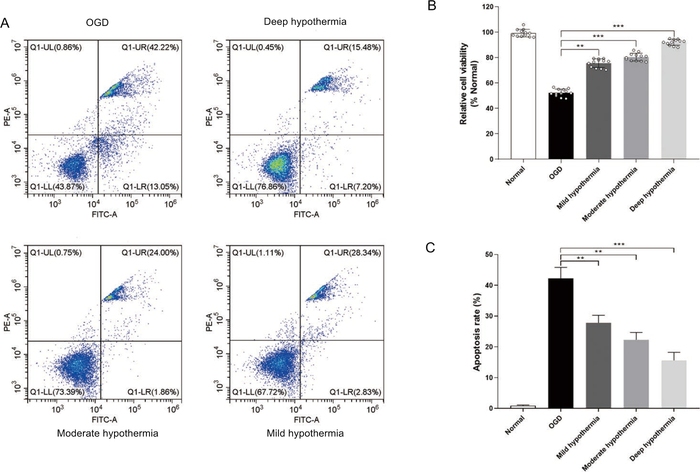
图3:体温过低治疗后细胞生存能力和凋亡评估。(A) 细胞凋亡通过流动细胞测量检测到。(B) 凋亡的定量分析。(C) 细胞生存能力是通过使用细胞生存能力分析来测量的。**p =lt;0.01,与普通组相比,0.001。 请单击此处查看此图的更大版本。

图4:线粒体功能和卡帕塞-3卡帕塞-8活性的分析。细胞内 ROS 级别。B线粒体膜潜力的量化。(C 和D)使用 ELISA 套件估计了卡斯帕塞-8/卡斯帕塞-3 活动。*p与0.05,**p与0.01,***p与0.001与OGD组。请单击此处查看此图的更大版本。
讨论
完整动物的复杂性,包括不同类型的细胞之间的相互作用,往往妨碍对I/R损伤特定成分的详细研究。因此,有必要建立一个体外细胞模型,能够准确反映体内缺血后的分子变化。关于OGD模型的研究已经报告13,22,许多复杂的方法已经建立23,24。OGD 模型的制备过程包括两个关键步骤:缺氧和葡萄糖剥夺。在本研究中,葡萄糖剥夺是由无葡萄糖介质培养细胞进行的,缺氧是通过氮代替实现的,氮气是目前编写OGD模型25、26的成熟方法。但是,根据细胞类型,必须考虑两个因素,包括:1) 细胞播种密度和 2) OGD 暴露的持续时间。附着的细胞数量越多,对OGD应力的抵抗力就越强,因此OGD之前的播种时间至关重要。HCM(2×105个细胞/井)在OGD之前在6井板中播种30-34小时,此时细胞大约是65%的汇合体。更高的细胞密度将减少OGD对细胞的影响。此外,在清洗过程中尽量减少细胞丢失的可能性也至关重要。OGD 暴露持续时间的影响是评估 OGD 模型有效性的另一个重要因素。例如,为了研究药物的保护作用,无需治疗即可选择导致 40-50% 细胞死亡的持续时间。如果细胞死亡过于极端,例如80%,那么量化正在分析试剂的保护作用将是具有挑战性的。对于 HCM,接触OGD 12 小时会导致 42% 的细胞死亡。因此,在随后的实验中,使用了12小时的OGD治疗来诱导细胞损伤。
由于体内和体外环境中体温过低动力学的差异,心肌细胞模型体温过低诱导的最佳方法和机制仍不清楚。在过去的几十年里,已经开发了几种体外模型来研究低温下的心肌细胞。例如,Jana Krech等人建立了一个中度体温过低细胞模型,以研究温度在缺血-输液13后对心肌凋亡的影响。虽然许多研究都集中在冷却的生理影响,也有大量的有害副作用发生在重新暖化27。先前的研究表明,重新暖体可诱发分离性心肌细胞27、28的收缩功能障碍。因此,重新升温的温度和速度尤为重要。为了严格控制温度的影响,我们应用了心脏手术中使用的标准时间温度协议,如前所述的20,21。在这个模型中,温度被精确控制在所需的温度范围内,包括三个阶段:1)冷却期(1小时):2) 温度维持期(10小时):和 3) 温度恢复期 (2 h)。此外,本研究中使用的温度是典型的温和(34°C)、中度(31°C)和严重(17°C)的低温,与之前出版物29、30、31中使用的温度相当。最后,我们还测试了我们对不同温度条件对体外心肌细胞凋亡的影响的假设。不出所料,结果表明,温度显著降低ROS水平,恢复MMP,并减少卡斯帕塞-8/卡斯帕塞-3活动。
我们知道,这项研究是使用非收缩细胞系和体外模型进行的,不受任何体液的影响。尽管有这些限制,但体温过低治疗导致的细胞凋亡显著改善强调了进行进一步研究的重要性,包括体内研究。因此,该模型可用于研究体温过低心脏保护的分子机制,对开发补充疗法与体温过低有重要影响。
披露声明
作者没有什么可透露的。
致谢
这项工作部分由中国国家自然科学基金委员会(81970265,81900281,81700288)、中国博士后科学基金会(2019M651904) 资助:以及中国国家重点研究发展计划(2016年YFC1101001,2017YFC1308105)。
材料
| Name | Company | Catalog Number | Comments |
| Annexin V-FITC cell apoptosis detection kit | Bio-Technology,China | C1062M | |
| Cardiac myocyte growth supplement | Sciencell,USA | 6252 | |
| Caspase 3 activity assay kit | Bio-Technology,China | C1115 | |
| Caspase 8 activity assay kit | Bio-Technology,China | C1151 | |
| DMEM, no glucose | Gibco,USA | 11966025 | |
| Dulbecco's modified eagle medium | Gibco,USA | 11960044 | |
| Fetal bovine serum | Gibco,USA | 16140071 | |
| Flow cytometry | CytoFLEX,USA | B49007AF | |
| Human myocardial cells | BLUEFBIO,China | BFN60808678 | |
| Mitochondrial membrane potential assay kit with JC-1 | Bio-Technology,China | C2006 | |
| Penicillin/Streptomycin solution | Gibco,USA | 10378016 | |
| Reactive oxygen species assay kit | Bio-Technology,China | S0033S | |
| Three-gas incubator | Memmert,Germany | ICO50 | |
| Trypsin-EDTA (0.25%) | Gibco,USA | 25200056 |
参考文献
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. Journal of Cardiovascular Translational Research. 9 (3), 230-238 (2016).
- Klein, P., et al. Less invasive ventricular reconstruction for ischaemic heart failure. EUROPEAN JOURNAL OF HEART FAILURE. 21 (12), 1638-1650 (2019).
- Otto, K. A. Therapeutic hypothermia applicable to cardiac surgery. VETERINARY ANAESTHESIA AND ANALGESIA. 42 (6), 559-569 (2015).
- Wang, X., et al. Safety of Hypothermic Circulatory Arrest During Unilateral Antegrade Cerebral Perfusion for Aortic Arch Surgery. CANADIAN JOURNAL OF CARDIOLOGY. 35 (11), 1483-1490 (2019).
- Leshnower, B. G., et al. Moderate Versus Deep Hypothermia With Unilateral Selective Antegrade Cerebral Perfusion for Acute Type A Dissection. ANNALS OF THORACIC SURGERY. 100 (5), 1563-1568 (2015).
- Vallabhajosyula, P., et al. Moderate versus deep hypothermic circulatory arrest for elective aortic transverse hemiarch reconstruction. ANNALS OF THORACIC SURGERY. 99 (5), 1511-1517 (2015).
- Keeling, W. B., et al. Safety of Moderate Hypothermia With Antegrade Cerebral Perfusion in Total Aortic Arch Replacement. ANNALS OF THORACIC SURGERY. 105 (1), 54-61 (2018).
- Yan, T. D., et al. Consensus on hypothermia in aortic arch surgery. Annals of Cardiothoracic Surgery. 2 (2), 163-168 (2013).
- Zhou, J., Empey, P. E., Bies, R. R., Kochanek, P. M., Poloyac, S. M. Cardiac arrest and therapeutic hypothermia decrease isoform-specific cytochrome P450 drug metabolism. DRUG METABOLISM AND DISPOSITION. 39 (12), 2209-2218 (2011).
- Sharp, W. W., et al. Inhibition of the mitochondrial fission protein dynamin-related protein 1 improves survival in a murine cardiac arrest model. CRITICAL CARE MEDICINE. 43 (2), 38-47 (2015).
- Zhu, W. S., et al. Hsp90aa1: a novel target gene of miR-1 in cardiac ischemia/reperfusion injury. Sci Rep. 6, 24498 (2016).
- Castedo, E., et al. Influence of hypothermia on right atrial cardiomyocyte apoptosis in patients undergoing aortic valve replacement. Journal of Cardiothoracic Surgery. 2, 7 (2007).
- Krech, J., et al. Moderate therapeutic hypothermia induces multimodal protective effects in oxygen-glucose deprivation/reperfusion injured cardiomyocytes. Mitochondrion. 35, 1-10 (2017).
- Cooper, W. A., et al. Hypothermic circulatory arrest causes multisystem vascular endothelial dysfunction and apoptosis. ANNALS OF THORACIC SURGERY. 69 (3), 696-702 (2000).
- Kajimoto, M., et al. Selective cerebral perfusion prevents abnormalities in glutamate cycling and neuronal apoptosis in a model of infant deep hypothermic circulatory arrest and reperfusion. JOURNAL OF CEREBRAL BLOOD FLOW AND METABOLISM. 36 (11), 1992-2004 (2016).
- Liu, Y., et al. Deep Hypothermic Circulatory Arrest Does Not Show Better Protection for Vital Organs Compared with Moderate Hypothermic Circulatory Arrest in Pig Model. Biomed Research International. 2019, 1420216 (2019).
- Davidson, M. M., et al. Novel cell lines derived from adult human ventricular cardiomyocytes. JOURNAL OF MOLECULAR AND CELLULAR CARDIOLOGY. 39 (1), 133-147 (2005).
- Khan, K., Makhoul, G., Yu, B., Schwertani, A., Cecere, R. The cytoprotective impact of yes-associated protein 1 after ischemia-reperfusion injury in AC16 human cardiomyocytes. EXPERIMENTAL BIOLOGY AND MEDICINE. 244 (10), 802-812 (2019).
- Pan, J. A., et al. miR-146a attenuates apoptosis and modulates autophagy by targeting TAF9b/P53 pathway in doxorubicin-induced cardiotoxicity. Cell Death Discovery. 10 (9), 668 (2019).
- Schmitt, K. R., et al. S100B modulates IL-6 release and cytotoxicity from hypothermic brain cells and inhibits hypothermia-induced axonal outgrowth. NEUROSCIENCE RESEARCH. 59 (1), 68-73 (2007).
- Tong, G., et al. Deep hypothermia therapy attenuates LPS-induced microglia neuroinflammation via the STAT3 pathway. Neuroscience. 358, 201-210 (2017).
- Yu, Z. P., et al. Troxerutin attenuates oxygenglucose deprivation and reoxygenationinduced oxidative stress and inflammation by enhancing the PI3K/AKT/HIF1alpha signaling pathway in H9C2 cardiomyocytes. Molecular Medicine Reports. 22 (2), 1351-1361 (2020).
- Drescher, C., Diestel, A., Wollersheim, S., Berger, F., Schmitt, K. R. How does hypothermia protect cardiomyocytes during cardioplegic ischemia. European journal of cardiothoracic surgery. 40 (2), 352-359 (2011).
- Diestel, A., Drescher, C., Miera, O., Berger, F., Schmitt, K. R. Hypothermia protects H9c2 cardiomyocytes from H2O2 induced apoptosis. Cryobiology. 62 (1), 53-61 (2011).
- Zhang, Y., et al. HIF-1alpha/BNIP3 signaling pathway-induced-autophagy plays protective role during myocardial ischemia-reperfusion injury. BIOMEDICINE & PHARMACOTHERAPY. 120, 109464 (2019).
- An, W., et al. Exogenous IL-19 attenuates acute ischaemic injury and improves survival in male mice with myocardial infarction. BRITISH JOURNAL OF PHARMACOLOGY. 176 (5), 699-710 (2019).
- Han, Y. S., Schaible, N., Tveita, T., Sieck, G. Discontinued stimulation of cardiomyocytes provides protection against hypothermia-rewarming-induced disruption of excitation-contraction coupling. EXPERIMENTAL PHYSIOLOGY. 103 (6), 819-826 (2018).
- Yarbrough, W. M., et al. Caspase inhibition attenuates contractile dysfunction following cardioplegic arrest and rewarming in the setting of left ventricular failure. Journal of cardiovascular pharmacology. 44 (6), 645-650 (2004).
- Egorov, Y. V., Glukhov, A. V., Efimov, I. R., Rosenshtraukh, L. V. Hypothermia-induced spatially discordant action potential duration alternans and arrhythmogenesis in nonhibernating versus hibernating mammals. AMERICAN JOURNAL OF PHYSIOLOGY-HEART AND CIRCULATORY PHYSIOLOGY. 303 (8), 1035-1046 (2012).
- Bobi, J., et al. Moderate Hypothermia Modifies Coronary Hemodynamics and Endothelium-Dependent Vasodilation in a Porcine Model of Temperature Management. Journal of the American Heart Association. 9 (3), 014035 (2020).
- Dietrichs, E. S., Tveita, T., Myles, R., Smith, G. A novel ECG-biomarker for cardiac arrest during hypothermia. Scandinavian Journal of Trauma Resuscitation & Emergency Medicine. 28 (1), 27 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。