Method Article
Alimentação e quantificação de sangue derivados de animais e refeições artificiais em mosquitos Aedes aegypti
Neste Artigo
Resumo
O objetivo deste protocolo é entregar refeições de sangue derivadas de animais e artificiais aos mosquitos Aedes aegypti através de um alimentador de membrana artificial e quantificar precisamente o volume de refeições ingeridas.
Resumo
Fêmeas de certas espécies de mosquitos podem espalhar doenças enquanto mordem hospedeiros de vertebrados para obter refeições de sangue ricas em proteínas necessárias para o desenvolvimento de óvulos. Em laboratório, os pesquisadores podem entregar refeições de sangue derivadas de animais e artificiais para mosquitos através de alimentadores de membrana, que permitem a manipulação da composição da refeição. Aqui, apresentamos métodos para alimentar sangue e farelos artificiais de sangue aos mosquitos Aedes aegypti e quantificar o volume consumido por fêmeas individuais.
A alimentação direcionada e a quantificação de refeições artificiais/sanguíneas têm usos amplos, incluindo testar os efeitos dos componentes da refeição no comportamento e na fisiologia dos mosquitos, fornecer compostos farmacológicos sem injeção e infectar mosquitos com patógenos específicos. Adicionar corante de fluoresceína à refeição antes da alimentação permite quantificação subsequente do tamanho da refeição. O volume da refeição consumido pelos mosquitos pode ser medido tanto em peso, se as fêmeas forem usadas posteriormente para experimentos comportamentais, ou homogeneizando fêmeas individuais em placas de 96 poços e medindo níveis de fluorescência usando um leitor de placas como um ensaio de ponto final. A quantificação do tamanho da refeição pode ser usada para determinar se a alteração dos componentes da refeição altera o volume da refeição ingerida ou se o consumo de refeições difere entre as cepas de mosquitos. A quantificação precisa do tamanho da refeição também é fundamental para ensaios a jusante, como aqueles efeitos de medição na atração do hospedeiro ou na fecundidade. Os métodos aqui apresentados podem ser ainda mais adaptados para acompanhar a digestão das refeições ao longo dos dias ou incluir múltiplos marcadores distinguíveis adicionados a diferentes refeições (como néctar e sangue) para quantificar o consumo de cada refeição por um único mosquito.
Esses métodos permitem que os pesquisadores realizem sozinhos medidas de alto rendimento para comparar o volume de refeições consumido por centenas de mosquitos individuais. Essas ferramentas serão, portanto, amplamente úteis à comunidade de pesquisadores de mosquitos para responder a diversas questões biológicas.
Introdução
Apresentamos um protocolo para alimentação de farinhas de sangue modificadas aos mosquitos Aedes aegypti utilizando um alimentador de membrana artificial e medindo precisamente o volume da refeição consumida por cada mosquito individual. Este protocolo pode ser adaptado de forma flexível para alterar o conteúdo da refeição ou para comparar o volume de refeições consumido por diferentes grupos experimentais de mosquitos.
O mosquito A. aegypti ameaça a saúde global espalhando patógenos que causam doenças como febre amarela, dengue, chikungunya e Zika1,2,3,4,5. As fêmeas Ae. aegypti são obrigatórias alimentadores sanguíneos; eles devem consumir sangue vertebrado para obter a proteína necessária para o desenvolvimento de óvulos, e cada embreagem de ovos requer uma refeição sanguínea completa de pelo menos um hospedeiro6,7,8. A fêmea mosquito primeiro morde seu hospedeiro perfurando a pele com seu estilo e saliva injetadora, que contém compostos que desencadeiam a resposta imune do hospedeiro9. Ela então se alimenta bombeando sangue através de seu estote em seu midgut. Ao consumir uma refeição sanguínea de um hospedeiro infectado, ela pode ingerir patógenos transmitidos pelo sangue6,8, que depois migram do meio do mosquito para as glândulas salivares10. Mosquitos fêmeas infectadas dessa forma podem espalhar doenças injetando patógenos junto com saliva ao morder os hospedeiros subsequentes11,12. Compreender e quantificar os mecanismos de comportamento sanguíneo são passos cruciais no controle da transmissão de doenças transmitidas por mosquitos.
Muitos protocolos laboratoriais para criação e experimentação de mosquitos usam animais vivos, incluindo camundongos, cobaias ou humanos como fonte de sangue13,14,15,16. O uso de animais vivos impõe preocupações éticas, bem como requisitos complexos para formação de pessoal, moradia e cuidado de animais e cumprimento das políticas do Comitê Institucional de Cuidados e Uso de Animais (IACUC). Também limita os tipos de compostos que podem ser entregues aos mosquitos, o que restringe os estudos que podem ser realizados17.
Aparelhos artificiais de alimentação sanguínea, que normalmente usam um sistema de membrana para simular a pele hospedeira, são ferramentas úteis para estudar comportamentos de alimentação sanguínea que contornam a necessidade de manutenção de hospedeiros vivos. O sangue inteiro pode ser comprado de vários fornecedores e alimentado com mosquitos usando alimentadores de membrana artificial aquecidos, reveses de água ou dispositivos similares18,19. Neste protocolo, demonstramos o uso de pequenos alimentadores de membrana descartáveis denominados "Glytubes". Este alimentador de membrana, publicado anteriormente por Costa-da-Silva et al. (2013)20, pode ser facilmente montado a partir de equipamentos de laboratório padrão, tornando-se ideal para fornecer refeições de sangue a um número moderado de mosquitos e simples de escalar para testar grupos maiores ou formulações múltiplas de refeições. O Glytube é uma alternativa barata e eficiente para outros alimentadores artificiais comerciais, que podem exigir maiores volumes de refeições e são mais adequados para alimentar grandes grupos de mosquitos em uma única formulação de refeição21.
Este protocolo inclui duas seções: preparar/entregar refeições artificiais e quantificar o consumo. Na primeira seção, os Glytubes são usados como um meio eficiente para fornecer dietas manipuladas. O sangue inteiro pode ser substituído por uma refeição inteiramente artificial para comparar os efeitos dos substitutos sanguíneos em vez de uma refeição de sangue. Uma receita adaptada de Kogan (1990)22 é apresentada aqui, embora várias formulações de refeições artificiais tenham sido desenvolvidas23,24. Além disso, a alimentação é um método menos invasivo e menos trabalhoso para introduzir compostos farmacológicos do que a injeção. Devido ao baixo volume total necessário para cada refeição (1-2 mL), este protocolo fornece um método de entrega atraente para reduzir as quantidades de reagentes caros. As fêmeas Ae. aegypti consomem prontamente refeições sem proteínas de solução salina com adenosina 5′-triphosphate (ATP)25,26, que fornece uma linha de base para medir os efeitos de componentes de refeição única. Por exemplo, o receptor semelhante ao Neuropeptide Y 7 (NPYLR7) no Ae. aegypti é conhecido por mediar a supressão em busca de hospedeiros após uma refeição sanguínea rica em proteínas, e quando os agonistas NPYLR7 são adicionados a uma refeição salina sem proteínas, mosquitos fêmeas exibem supressão em busca de hospedeiros semelhantes às que consumiram sangue inteiro7.
Na segunda seção, são apresentadas etapas para quantificar o volume de cada refeição consumida por um mosquito fêmea individualmente. Este ensaio é baseado em fluorescência e captura o estado de alimentação em maior resolução do que os métodos em que as fêmeas são classificadas como "alimentadas" ou "desapresas" com base apenas na avaliação visual da distensão abdominal. Adicionando fluoresceína à refeição antes da alimentação, os volumes de refeição ingeridos pelos indivíduos podem ser quantificados pela homogeneização de cada mosquito em um prato de 96 poços e medindo a intensidade da fluorescência como leitura. Este ensaio pode medir diferenças no vigor alimentar em resposta a variáveis como a composição da refeição ou o histórico genético dos mosquitos. A quantificação precisa é fundamental para tamanhos intermediários de refeições, por exemplo, quando as fêmeas são oferecidas refeições subótimas contendo impedimentos alimentares ou quando consomem refeições de sacarose de tamanhosvariáveis 27. Se os mosquitos alimentados forem necessários para ensaios comportamentais subsequentes após a quantificação do tamanho da refeição, o tamanho da refeição pode, em vez disso, ser calculado pesando fêmeas anestesiadas em grupos e estimando o aumento médio da massa por indivíduo. Embora menos precisa do que a marcação de fluoresceína, a pesagem ainda fornece uma estimativa agregada do volume da refeição e permite o exame do efeito da refeição em processos a jusante, como fecundidade ou atração subsequente do hospedeiro. Embora o tamanho da refeição sanguínea seja variável e possa ser influenciado por uma miríade de fatores11,28,29, tamanhos de refeição ingeridos medidos com os métodos descritos aqui são consistentes com quantificações anteriores7,30,31.
Protocolo
Os procedimentos de alimentação sanguínea não foram realizados utilizando animais vivos ou hospedeiros humanos e cumpriram as diretrizes estabelecidas pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Rockefeller (IACUC) e pelo Institutional Review Board (IRB).
1. Preparação para refeições
- Preparação do fagostimulante, adenosina 5′-triphosphate
- Prepare uma solução de 25 mM de NaHCO3 aquoso (peso molecular, MW = 84,006 g/mol). Para 100 mL de 25 mM NaHCO3, adicione 210 mg de NaHCO3 a um frasco volumoso e encha com água duplamente destilada (ddH2O) a um volume total de 100 mL. Com uma barra de mexiça magnética, misture completamente a solução até que todo o NaHCO3 seja dissolvido.
- Recrete o hidratado de sal disódico ATP (MW = 551,14 g/mol) no aquoso 25 mM NaHCO3 para uma concentração final de 200 mM ATP. Para um volume total de 10 mL de 200 mM ATP em 25 mM NaHCO3 tampão, adicione 1,1 g de sal de dissódio ATP hidratar a um frasco volumoso e encher com 25 mM NaHCO3 tampão para um volume total de 10 mL. Usando uma barra de agitação magnética, misture completamente a solução até que todo o ATP seja dissolvido.
NOTA: Para minimizar a hidrólise da ATP, ela deve ser tamponada por uma solução de sal como o NaHCO3. - Aliquot a solução ATP e armazene a -20 °C.
NOTA: Esta solução de estoque de ATP é tipicamente feita fresca a cada seis meses e é usada para todas as refeições descritas abaixo. Para evitar a degradação, as alíquotas atp não devem passar por múltiplos ciclos de congelamento ou ser aquecidas juntamente com outros componentes da refeição.
- Preparação da solução de rastreador fluorescente, fluoresceína
- Prepare uma solução de estoque de 2% (w/v) de fluoresceína aquosa. Para um volume total de solução de estoque de 10 mL, misture 0,2 g de sal de disódio fluoresceína com 10 mL de ddH2O em um tubo cônico de 15 mL envolto em papel alumínio à temperatura ambiente. Esta solução de estoque de fluoresceína pode ser usada para diluição em todas as refeições descritas abaixo.
NOTA: Como a fluoresceína é sensível à luz, evite a exposição à luz embrulhando recipientes em papel alumínio.
- Prepare uma solução de estoque de 2% (w/v) de fluoresceína aquosa. Para um volume total de solução de estoque de 10 mL, misture 0,2 g de sal de disódio fluoresceína com 10 mL de ddH2O em um tubo cônico de 15 mL envolto em papel alumínio à temperatura ambiente. Esta solução de estoque de fluoresceína pode ser usada para diluição em todas as refeições descritas abaixo.
- Preparação de refeições de sangue derivadas de animais
- Calcular o número de refeições necessárias para alimentar todos os mosquitos; cada Glytube contém uma refeição de 2 mL e alimenta aproximadamente 25 mosquitos. Prepare uma refeição adicional para calibrar a curva padrão para leituras de fluorescência. A menos que seja declarado o contrário, todas as etapas desta seção descrevem as quantidades de reagente necessárias para preparar uma refeição com um volume final de 2 mL.
- Para refeições sanguíneas derivadas de animais, transfibrie 1,98-2 mL desfibril sangue desfibriado para um tubo cônico de 15 mL (ver passo 3.3 para o volume desejado de sangue).
NOTA: Podem serutilizadasfontes comercialmente desfibriadas de sangue vertebrado, incluindo de ovelhas, cobaias e humanos. Antes de usar, certifique-se de que o sangue adquirido não tenha passado da data de validade e misture-o bem invertendo a garrafa, especialmente se houver separação visível dos componentes sanguíneos. - Para uma alimentação ideal, adicione ATP a uma concentração final de 1-2 mM depois que o sangue das ovelhas tiver sido aquecido a 45 °C em um banho de água. Para uma concentração final de 1 mM ATP, adicione 10 μL da solução de estoque ATP de 200 mM a 1,99 mL de sangue pré-aquecido e mix. Para uma concentração final de 2 mM ATP, adicione 20 μL do estoque atp de 200 mM a 1,98 mL de sangue pré-aquecido e mistura. Se a ATP não for adicionada, aqueça 2 mL de sangue de ovelha desfibriado.
- Se a quantificação baseada em fluorescência do tamanho da refeição for posteriormente realizada, adicione a solução de fluoresceína a uma concentração final de 0,002% (2 μL de 2% de estoque de fluoresceína em 2 mL volume total de refeição). Reduza o volume de sangue pela mesma quantidade que a fluoresceína adicionada. Mantenha 1 mL da formulação final da refeição contendo fluoresceína de 0,002% para gerar a curva padrão de referência. Tratar o volume retido de forma idêntica à refeição que está sendo entregue aos mosquitos; expor-se às mesmas condições de luz e temperatura durante toda a duração do experimento, e posteriormente congelar isso junto com a refeição entregue.
- Preparação de refeições de sangue artificiais
- Calcular o número de refeições necessárias para alimentar todos os mosquitos; cada Glytube contém uma refeição de 2 mL e alimenta aproximadamente 25 mosquitos. Prepare uma refeição adicional para calibrar a curva padrão para leituras de fluorescência. A menos que seja declarado o contrário, todas as etapas desta seção descrevem as quantidades de reagente necessárias para preparar uma refeição de 2 mL.
- Preparar sangue artificial (adaptado de Kogan (1990)22), como na Tabela 1,primeiro faça uma solução de estoque de 400 mM NaHCO3. Para um volume total de 10 mL de 400 mM NaHCO3 (MW = 84,006 g/mol), adicione 336 mg de NaHCO3 a um frasco volumoso e encha com água duplamente destilada (ddH2O) a um volume total de 10 mL. Com uma barra de mexiça magnética, misture completamente a solução até que todo o NaHCO3 seja dissolvido.
- Para os componentes proteicos do sangue artificial, prepare soluções de estoque de 50 mg/mL de γ-globulinas em 400 mM NaHCO3, 35 mg/mL de hemoglobina em ddH2O, e 300 mg/mL de albumina em ddH2O. As soluções de estoque de proteína podem ser armazenadas a 4 °C por até 2 meses. A concentração final de proteínas humanas totais no sangue artificial é de 125 mg/mL. Isso inclui concentrações finais de 15 mg/mL γ-globulinas, hemoglobina de 8 mg/mL e albumina de 102 mg/mL.
- Para cada refeição de 2 mL, combine 600 μL de γ-globulinas, 460 μL de hemoglobina, 680 μL de albumina e 250 μL de ddH2O de soluções de estoque listadas na Tabela 1. Aguarde para adicionar 10 μL de 200 mM atp solução de estoque até depois que a refeição foi aquecida a 45 °C, imediatamente antes de apresentar a refeição.
- Se a quantificação baseada em fluorescência do tamanho da refeição for posteriormente realizada, adicione a solução de fluoresceína a uma concentração final de 0,002% (2 μL de 2% de estoque de fluoresceína em 2 mL volume total de refeição). Reduza o volume de ddH2O na etapa 4.4 pela mesma quantidade que o fluoresceína adicionado. Mantenha pelo menos 1 mL da formulação final da refeição contendo fluoresceína de 0,002% para gerar a curva padrão de referência. Tratar o volume retido de forma idêntica à refeição que está sendo entregue aos mosquitos; expor-se às mesmas condições de luz e temperatura durante toda a duração do experimento, e posteriormente congelar isso junto com a refeição entregue.
- Preparação de opções salinas sem proteínas (adaptadas de Duvall et al. (2019)7)
NOTA: As refeições salinas sem proteína podem ser preparadas de várias maneiras7,27,32. A refeição salina apresentada aqui é uma versão livre de proteínas da receita de sangue artificial descrita acima.- Calcular o número de refeições necessárias para alimentar todos os mosquitos; cada Glytube contém uma refeição de 2 mL e alimenta aproximadamente 25 mosquitos Prepare uma refeição adicional para calibrar a curva padrão para medições de fluorescência. A menos que seja declarado o contrário, todas as etapas desta seção descrevem as quantidades de reagente necessárias para preparar uma refeição de 2 mL.
- Para preparar a refeição salina, faça uma solução de estoque de 400 mM NaHCO3. Para um volume total de 10 mL de 400 mM NaHCO3 (MW = 84,006 g/mol), adicione 336 mg de NaHCO3 a um frasco volumoso e preencha com ddH2O a um volume total de 10 mL. Com uma barra de mexiça magnética, misture completamente a solução até que todo o NaHCO3 seja dissolvido.
- Para cada refeição de 2 mL, misture em um tubo cônico de 15 mL 600 μL de 400 mM NaHCO3 com 1,39 mL de ddH2O. Espere adicionar 10 μL da solução de estoque ATP de 200 mM até depois que a refeição foi aquecida a 45 °C em um banho de água.
- Se a quantificação baseada em fluorescência do tamanho da refeição for posteriormente realizada, adicione a solução de fluoresceína a uma concentração final de 0,002% (2 μL de 2% de estoque de fluoresceína em 2 mL do volume total da refeição). Reduza o volume de ddH2O na etapa 5.3 pela mesma quantidade que o fluoresceína adicionado. Mantenha pelo menos 1 mL da formulação final da refeição contendo fluoresceína de 0,002% para gerar a curva padrão de referência. Tratar o volume retido de forma idêntica à refeição que está sendo entregue aos mosquitos; expor-se às mesmas condições de luz e temperatura durante toda a duração do experimento, e posteriormente congelar isso junto com a refeição entregue.
2. Entrega de refeições para mosquitos
- Criação de recipientes para mosquitos para alimentação
NOTA: Os mosquitos podem ser alimentados em uma variedade de recipientes, desde que os seguintes critérios sejam atendidos. Certifique-se de que o recipiente é grande o suficiente para os mosquitos voarem ao redor, mas não tão grande que será difícil para os mosquitos localizar a superfície da malha e começar a se alimentar. A malha usada para cobrir o recipiente pode variar em material e tamanho do orifício. Os buracos devem ser grandes o suficiente para o estilo do mosquito fêmea perfurar, mas não tão grande que o mosquito possa escapar. Fixar a malha firmemente para que ela fique esticada, e o Glytube pode descansar firmemente em sua superfície durante todo o período de alimentação.- Um recipiente de exemplo (Figura 1) é um balde de plástico de polietileno de alta densidade (HDPE) modificado de 946 mL (32 oz). Para replicar esta configuração, use uma lâmina de barbear para cortar um orifício central de ~10 cm de diâmetro na tampa do balde. Para montar o recipiente para ocupação por mosquitos, fixe um pedaço quadrado de ~400 cm2 quadrados de rede branca de 0,8 mm de mosquito poliéster em cima do balde, empurrando com segurança a tampa perfurada para baixo sobre ele para estalar firmemente.
- Recolher mosquitos fêmeas que estão pelo menos 3 dias após a eclosão para garantir que eles são maduros o suficiente para alimentar o sangue. As taxas de alimentação ideais são observadas após 7 dias33.
- Coloque mosquitos fêmeas no recipiente e cubra com malha. Se o recipiente estiver densamente povoado com mosquitos, aumente o número de Glytubes utilizados. A alimentação ideal é alcançada com ~25 mosquitos/Glytube. Isso reduz a concorrência para o acesso à membrana alimentar.
- Reserve um grupo controle de mosquitos não-equipados que não será oferecido uma refeição. No protocolo de medição de peso, pesar o grupo não alimentado separadamente e usar esse peso para estimar o ganho de peso no grupo experimental que se alimentou de uma refeição. No protocolo de quantificação baseado em fluorescência, adicione o grupo não-cuidado de mosquitos aos poços para os cálculos de curva padrão e para controles negativos. Para combinar a autofluorescência do tecido do mosquito na linha de base no grupo experimental, certifique-se de que a curva padrão e os poços de controle negativos contenham um mosquito não-comido.
- Construindo e montando o Glytube (adaptado de Costa-da-Silva et al. (2013)20)
- Como descrito na Figura 1, para gerar uma fonte de calor, encha um tubo cônico de 50 mL com 40 mL de 100% glicerol. Sele o tubo cônico aberto com um parafilme de 5 cm × 5 cm e repita com uma peça adicional de 5 cm × parafilm de 5 cm para minimizar a chance de vazamento. Opcionalmente, o parafilm pode ser mantido no lugar usando elásticos. Inverta o tubo para garantir que não haja buracos ou lacunas.
- Para criar o dispositivo de entrega de refeições, corte um orifício centralado de 2,5 cm de diâmetro na tampa do parafuso do tubo cônico usando uma lâmina afiada ou, para melhor consistência, um torno. Estique um pedaço de 5 cm × 5 cm de parafilm uniformemente para que ele aproximadamente dobre de tamanho. O parafilm deve ser fino o suficiente para que os mosquitos possam facilmente perfurar através dele, mas não deve haver vazamentos. Vedar sobre a superfície externa da tampa do parafuso para cobrir totalmente o orifício e deixar a tampa de lado.
NOTA: Para aumentar a atração pelo Glytube, antes de esticar o parafilme, perfume-o com odor humano esfregando-o suavemente em um pedaço de pele humana sem cosméticos aplicados, tomando cuidado para que não sejam criados buracos. Isso é recomendado se o experimento não for destinado a investigar as pistas sensoriais necessárias para que os mosquitos se aproximem da refeição. - Aqueça tanto o tubo selado de glicerol quanto a refeição (com todos os componentes, exceto ATP) em um banho de água de 42-45 °C por pelo menos 15 min. Não pré-aqueça ATP; adicioná-lo imediatamente antes de iniciar o experimento.
- Adicione ATP à refeição aquecida e ao vórtice completamente. Pipeta 2 mL da refeição aquecida na câmara interna da tampa do parafuso e coloque delicadamente o tubo cônico de 50 mL invertido, aquecido e cheio de glicerol. Enrosque parcialmente a tampa com a refeição no tubo cheio de glicerol — apenas o suficiente para evitar o vazamento da refeição ou do glicerol.
NOTA: O volume da refeição utilizado pode variar entre 1 mL e 2,5 mL. Volumes mais baixos podem ser especialmente úteis quando as refeições são usadas para fornecer compostos escassos ou caros. É importante trabalhar rapidamente nesta etapa para que a refeição não esfrie até a temperatura ambiente e reduza a probabilidade de alimentação máxima. A taxa de resfriamento dependerá da temperatura ambiente da sala onde essas etapas são conduzidas, mas normalmente devem ser concluídas dentro de 5 min a 25 °C. - Coloque o Glytube montado em cima do recipiente do mosquito e permita que os mosquitos tenham acesso à alimentação por pelo menos 15 minutos para atingir as taxas máximas de alimentação.
- Para uma alimentação ideal, coloque recipientes de mosquitos dentro de uma câmara equipada com uma almofada de CO2, e deixe pelo menos 15 minutos de aclimatação a 25-28 °C e 70-80% de umidade antes de entregar a refeição. A câmara de ensaio usada aqui é uma modificação simples e de baixo custo de uma configuração16publicada anteriormente . Ele usa uma caixa de armazenamento de polipropileno translúcido de tamanho de 36 cm L × 31 cm W × 32 cm H com uma tampa removível. Um orifício de 1,5 cm de diâmetro feito na parede da câmara permite a entrega de CO2 através de tubos de silicone. A almofada de difusão de CO2 é afixada no centro interno da tampa para entrega de ar purificado e CO2 para condicionar a atmosfera da câmara durante o ensaio.
NOTA: Certifique-se de que as pistas de host (calor e CO2, com odor de host opcional16) estejam presentes para que os mosquitos sejam atraídos pelo alimentador de membrana. Se os mosquitos não estiverem se aglomerando sob o Glytube, verifique se o CO2 está devidamente entregue e que a refeição e o Glytube estão suficientemente quentes. Se uma fonte externa de CO2 não estiver disponível, o CO2 pode ser fornecido através de sopros de respiração humana expirada. - Após a alimentação, a tampa do Glytube pode ser descartada como resíduos de risco biológico ou reutilizada após a imersão em uma solução de alvejante de baixa porcentagem e enxaguar completamente na água.
3. Quantificação das refeições consumidas
- Pesando mosquitos para serem usados para outros experimentos
NOTA: A pesagem de mosquitos para quantificar o tamanho da refeição permite que eles sejam usados para mais experimentos ao vivo, mas este método requer medir o peso de um grupo de 5 mosquitos. Como os pesos dos mosquitos individuais são difíceis de medir precisamente usando a maioria dos saldos laboratoriais, a variabilidade no tamanho da refeição individual não pode ser facilmente quantificada pela medição de pesos. A pesagem só é recomendada para situações em que as fêmeas visivelmente engorge na refeição.- Anesthetize mosquitos frios movendo seu recipiente para uma sala fria de 4 °C ou colocando-o no gelo.
- Pesar grupos de 5 fêmeas da coorte não alimentado (ou seja, mosquitos que nunca receberam uma refeição) e calcular seu peso médio como a estimativa do peso "pré-alimentação". O peso médio de um mosquito não-criado depende de condições genótipas, sexo e criação. Mosquitos ae. aegypti fêmeas não medicamentos criados com acesso ad libitum à sacarose normalmente pesam aproximadamente 2 mg cada.
- Da coorte experimental (ou seja, mosquitos que ofereciam uma refeição), classificam as fêmeas em pilhas "alimentadas" e "não alimentadas" com base na distensão abdominal observável pelo olho7. Divida cada uma das pilhas "alimentadas" e "não alimentadas", respectivamente, em grupos de 5 mosquitos para pesagem. Os mosquitos dentro de cada grupo de 5 devem ser derivados da mesma coorte experimental para fazer medições de peso em grupo. Calcule o peso médio por mulher de cada uma das pilhas "alimentadas" e "não alimentadas" do grupo experimental.
- Medição de fluorescência para análise de ponto final7,27,34
NOTA: Para obter medidas precisas de tamanho da refeição de mosquitos individuais que não são mais necessárias para novas experimentações ao vivo, armazene os mosquitos e os 1 mL restantes de refeição contendo fluoresceína de 0,002% a -20 °C imediatamente após a alimentação. O experimento pode ser pausado aqui. Este método é descrito em Figura 2.- Para gerar uma curva padrão de referência, prepare uma diluição serial da mesma refeição contendo fluoresceína de 0,002% oferecida ao grupo experimental de mosquitos. Haverá um total de 8 soluções de curva padrão. Em cada uma dessas soluções, o volume final de refeição contendo fluoresceína de 0,002% será de 5, 2,5, 1,25, 0,625, 0,3125, 0,15625, 0,078125, ou 0 μL, e cada um estará em 1x salina tamponada com fosfato (PBS) para um volume total de 100 μL (por exemplo, 5 μL de refeição contendo 0,002% fluoresceína em 95 μL de 1x PBS).
- Para fazer a primeira solução da curva padrão, adicione 50 μL de refeição contendo fluoresceína de 0,002% a 950 μL de 1x PBS e vórtice completamente (volume final: 5 μL de refeição contendo 0,002% fluoresceína em 95 μL de 1x PBS). Para fazer o resto das soluções de curva padrão, realize uma diluição de 2 vezes para cada passo, tirando 500 μL do tubo anterior e adicionando-o a um novo tubo contendo 500 μL de 1x PBS. Vórtice bem antes de preparar a próxima diluição de 2 vezes.
- Para preparar poços a serem utilizados para gerar uma curva padrão de referência, pipeta 100 μL de cada uma das soluções de curva padrão em cada um dos 8 poços na primeira coluna de uma placa PCR de 96 poços. Adicione 1 mosquito de controle não-comido a cada um dos mesmos 8 poços na primeira coluna da placa. Repita na segunda coluna da placa para uma medição de réplica.
NOTA: Se forem oferecidos grupos experimentais diferentes tipos de refeições, uma curva padrão de referência separada deve ser preparada para cada tipo de refeição. - Adicione 100 μL de 1x PBS em cada poço restante para o controle não cuidado e grupos experimentais. Se o tecido for interrompido em etapas subsequentes usando um homogeneizador ou vórtice do moinho de contas, adicione uma conta de vidro sólido de 3 mm para cada poço.
- Como controle negativo, adicione 1 mosquito não-fácido a cada poço nas próximas 2 colunas da placa. A fluorescência medida neste grupo estabelece um corte na linha de base para explicar a autofluorescência tecidual e será usada para determinar se um mosquito do grupo experimental se alimentou da refeição.
- Adicione 1 mosquito por poço aos poços restantes dos grupos experimentais que foram oferecidos uma refeição.
- Sele a placa cuidadosamente e interrompa o tecido com moagem manual. O abdômen deve ser completamente homogeneizado para liberar a refeição. Os métodos para interromper o tecido incluem o uso de um homogeneizador de moinho de contas com contas de vidro sólido de 3 mm (30 Hz por 30 segundos), misturador de vórtice com contas de vidro sólido de 3 mm borossilicato, ou um moedor de pilão sem contas.
- Centrifugar a placa a 2000 rpm por 1-2 min para coletar o lysate.
- Prepare uma placa preta de 96 poços com 180 μL de 1x PBS em cada poço.
- Transfira 20 μL de lise para cada poço com 180 μL de 1x PBS e misture. Se disponível, use uma pipeta multicanal nesta etapa para maior velocidade e melhor consistência.
- Meça a intensidade de fluorescência de cada poço usando um leitor de placas no canal de excitação/emissão 485/520. Gere a curva padrão de referência plotando o volume conhecido da refeição contra a medição correspondente da intensidade da fluorescência.
- Utilizando a curva padrão de referência gerada, extrapole o volume de refeição ingerido por cada um dos mosquitos do grupo experimental. Subtraia a leitura média da intensidade da fluorescência do grupo de controle negativo de mosquitos não-medicamentos da leitura da intensidade da fluorescência de cada indivíduo experimental para corrigir a autofluorescência do tecido de base.
Resultados
A Figura 1 apresenta um esquema para a montagem do Glytube, enquanto a Figura 2 mostra uma visão geral do design experimental para medir o tamanho da refeição usando o ensaio baseado em fluorescência descrito aqui. A Figura 3 fornece medidas representativas do tamanho da refeição fluoresceína de um experimento de alimentação sanguínea. A Figura 4, Figura 5e Figura 6 ilustram uma amostra de questões biológicas que podem ser abordadas por meio deste protocolo. As aplicações do protocolo são abrangentes e incluem alterar a composição da refeição sanguínea, alimentar compostos farmacológicos, quantificar precisamente refeições sanguíneas sub-ideais ou refeições menores de néctar, e comparar o comportamento alimentar entre os genótipos do mosquito.
Para gerar uma curva padrão para os cálculos do volume da refeição, as leituras de fluorescência são traçadas a partir dos poços de referência designados, cada um contendo um mosquito não pericido e um volume conhecido da refeição com fluoresceína de 0,002%(Figura 3A). As leituras de fluorescência dos demais poços, que contêm mosquitos do grupo controle negativo de mosquitos nãoofados ou do grupo experimental de mosquitos oferecidos por uma refeição, são comparadas a esta curva padrão para quantificar o volume da refeição (μL) consumido por cada mosquito(Figura 3B). Para validar as leituras da linha de base neste ensaio, deve-se confirmar que os mosquitos do grupo de controle negativo não são atribuídos a um valor positivo de μL consumido (Figura 3B, esquerda). Embora todas as fêmeas do grupo experimental tenham sido oferecidas a refeição sanguínea, alguns mosquitos alimentaram(Figura 3B, meio) e alguns não(Figura 3B, à direita). Este resultado demonstra que dois tipos de dados podem ser obtidos a partir deste protocolo: 1) o percentual do total de fêmeas que se alimentam de uma determinada refeição, e 2) o volume ingerido pelas fêmeas que se alimentam de uma determinada refeição.
Este protocolo pode ser usado para entregar e quantificar refeições com várias composições proteicas. Figura 4A,B mostram dados coletados usando refeições com fluoresceína adicionada. A proporção de mosquitos que alimentavam e o volume de refeição que ingeriam, respectivamente, foram calculados a partir das leituras de fluorescência. Essas leituras são altamente sensíveis e permitem quantificação precisa do μL, mas têm a limitação de que os mosquitos não podem ser usados para futuros experimentos ao vivo. A Figura 4C,D mostra dados coletados de um experimento independente com mosquitos que foram marcados como alimentados ou não alimentados por olho depois de serem oferecidos refeições sem fluoresceína. O tamanho da refeição foi calculado como peso médio/fêmea de grupos de 5 mosquitos. Embora essas medidas de peso sejam menos sensíveis do que as medidas de fluorescência, elas permitem que as fêmeas sejam recuperadas e usadas para mais experimentações ao vivo. A proporção de mosquitos que alimentam pode variar em diferentes dias experimentais, como refletido nas Figuras 4A e Figura 4C.
A Figura 5 mostra o volume consumido de refeições contendo drogas que regulam o comportamento de busca de mosquitos. Nesses experimentos, foram oferecidas refeições de sangue, soro fisiológico + ATP, ou soro fisiológico + ATP com 100 μM do agonista do receptor NPY Y2 humano, TM30338. Esta droga altera o comportamento de busca de hospedeiros através da ativação do receptor Ae. aegypti NPY 7. Medir o tamanho das refeições é fundamental para a interpretação dos experimentos para avaliar o efeito desta droga no comportamento pós-alimentação sanguínea, pois permite ao pesquisador calcular a dose consumida por cada fêmea.
Nos exemplos anteriores, as fêmeas eram alimentadas com sangue ou refeições sanguíneas substitutas, todas resultando em refeições de 3 a 5 μL(Figura 3, Figura 4, Figura 5). Este ensaio baseado em fluorescência também pode ser usado para medir tamanhos menores e/ou mais variáveis de refeição que não podem ser discernidos com precisão a partir de medidas médias de peso de grupo. Na Figura 6,o mesmo protocolo de quantificação da fluorescência foi utilizado para medir o comportamento de alimentação de néctar, trocando o Glytube por uma bola de algodão saturada com 10% de sacarose contendo fluoresceína de 0,002%. Os açúcares de néctar não podem ser apresentados no ensaio do Glytube porque as fêmeas não podem detectar a presença de açúcares de néctar com o estilo e não iniciar a alimentação27. Esses dados permitem ao pesquisador determinar que as refeições com açúcar são consistentemente menores do que as refeições de sangue, de acordo com o trabalho anterior34 (Figura 6).

Figura 1: Configuração do método Glytube usado para alimentar refeições com mosquitos. (A) Esquema de um Glytube desconstruído usado para alimentar sangue e outras refeições para mosquitos. (B) Esquema de um Glytube apresentado em cima de um recipiente de mosquitos com tampa de malha. Mosquitos fêmeas podem perfurar a tampa da malha para se alimentar. (C) Fotografias do Glytube (topo) e mosquitos fêmeas do Aedes aegypti antes, durante e depois da alimentação (inferior, da esquerda para a direita) em uma refeição entregue pelo Glytube. Mosquitos são mostrados perfurando através da malha cobrindo seu recipiente para acessar o alimentador de membrana. (D) Fotografias que mostram o aparecimento de mosquitos Ae. aegypti fêmeas que estão descidos (esquerda) e que têm engorgado em uma refeição de sangue artificial (direita, superior) ou uma refeição salina + ATP (direita, inferior). O método Glytube foi publicado anteriormente na Costa da Silva et al. (2013)20. Fotografias em (C) e (D) são cortesia de Alex Wild. Clique aqui para ver uma versão maior desta figura.
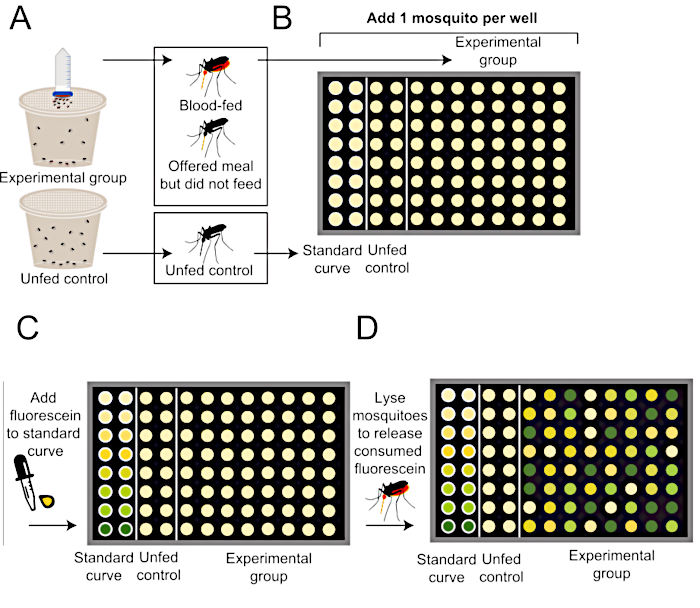
Figura 2: Esquema de como quantificar o tamanho da refeição após o protocolo de alimentação sanguínea do Glytube. (A) Os mosquitos são oferecidos uma refeição com fluoresceína (grupo superior, experimental) ou sem refeição (inferior, grupo de controle negativo não-preparado). (B) Mosquitos individuais são adicionados a uma placa de 96 poços após o término do experimento de alimentação. (C) A curva padrão é gerada utilizando quantidades conhecidas de refeição contendo fluoresceína de 0,002%. (D) Os mosquitos são homogeneizados para liberar qualquer fluoresceína consumida, e os níveis de fluorescência em cada poço são quantificados usando um leitor de placas. Este método de quantificação da fluorescência é modificado a partir de Liesch et al. (2013)34. Clique aqui para ver uma versão maior desta figura.
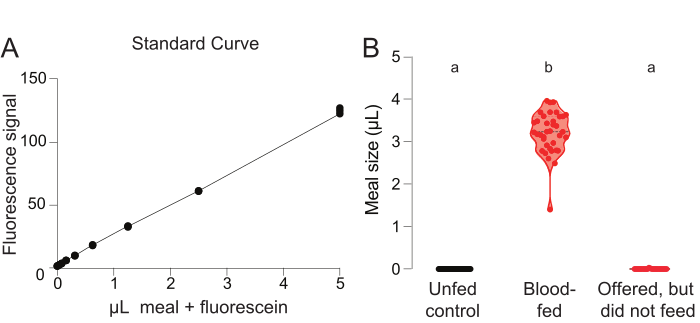
Figura 3: Experimento de alimentação sanguínea do Glytube com quantificação baseada em fluoresceína. (A) Medições de curvas padrão obtidas dos poços onde um mosquito do grupo de controle não-ofuscido foi adicionado a uma quantidade conhecida de refeição contendo fluoresceína de 0,002% (escala de eixo y = unidades arbitrárias). (B) Volume de refeição calculado utilizando leituras de fluorescência para fêmeas no grupo de controle não alimentado (esquerda, preto, n = 40), o grupo experimental que se alimentava de sangue (médio, vermelho, n = 37), e o grupo experimental que não se alimentava de sangue (direita, vermelho, n = 23). Cada ponto representa uma medida de uma fêmea individual. Os dados são mostrados como medianas com intervalo. As letras indicam grupos estatisticamente distintos, teste de Kruskal-Wallis com a comparação múltipla de Dunn, p<0,01. Esses dados foram publicados em Jové et al. (2020)27. Clique aqui para ver uma versão maior desta figura.
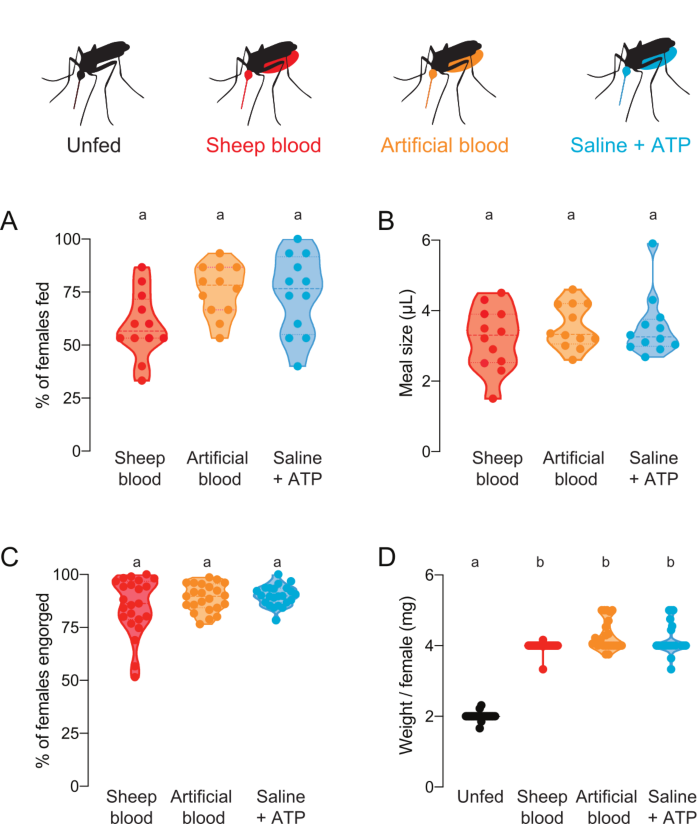
Figura 4: Quantificação de refeições com composição proteica diferente. Foram oferecidas refeições de sangue de ovelha (vermelho), sangue artificial com proteínas sanguíneas humanas (Kogan (1990)22) (laranja), ou soro fisiológico livre de proteínas + refeição ATP (aqua)7. (A) Percentual de fêmeas alimentadas pontuadas com leituras de fluorescência. Cada ponto representa um grupo de 12 a 16 mulheres. Os dados são mostrados como medianas com intervalos, n = 12. (B) Volume de refeição calculado com leituras de fluorescência. Cada ponto representa uma medição de uma fêmea individual em um único ensaio da Figura 4A. Os dados são mostrados como medianas com intervalos, n = 12. (C) Percentual de fêmeas totalmente engorgadas após a alimentação artificial da membrana, pontuada pelo olho. Cada ponto representa a porcentagem de fêmeas engorgadas de grupos de 20 a 30 fêmeas. Os dados são mostrados como medianas com intervalos, n = 23. (D) Tamanhos de refeição pontuados como peso/mulher após o estado de alimentação foi marcado por olho. Os pesos foram calculados como a média de grupos de 5 mosquitos. Os dados são mostrados como medianas com intervalos, n = 23. A–D: As letras indicam grupos estatisticamente distintos, teste de Kruskal-Wallis com a comparação múltipla de Dunn, p<0,05. Clique aqui para ver uma versão maior desta figura.
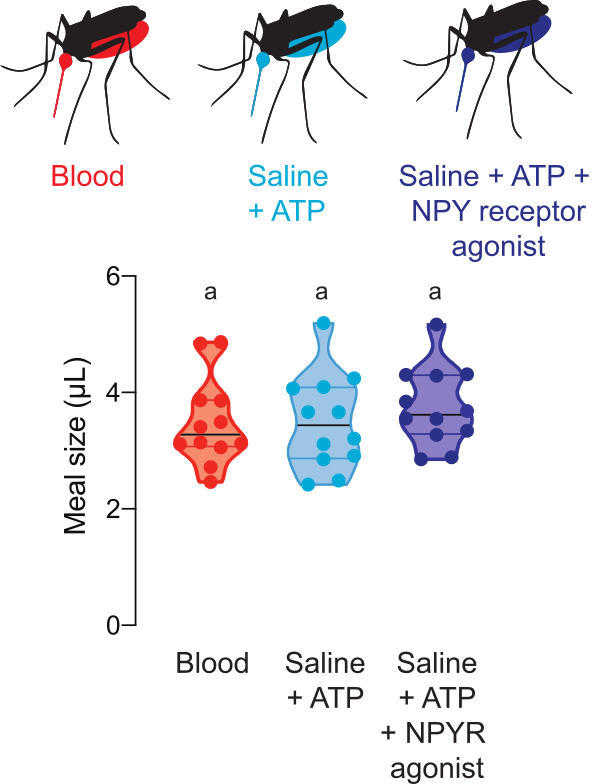
Figura 5: Quantificação de refeições com compostos farmacológicos. As fêmeas consomem refeições do mesmo tamanho de sangue de ovelha (vermelho), soro fisiológico + ATP (aqua) e soro fisiológico + ATP + 100 μM dose de agonista do receptor NPY Y2 humano TM30338 (azul escuro). Volume de refeição calculado com leituras de fluorescência. Cada ponto representa uma medida de uma fêmea individual. Os dados são mostrados como medianas com intervalos, n = 12. As letras indicam grupos estatisticamente distintos, teste de Kruskal-Wallis com a comparação múltipla de Dunn, p<0,05. Clique aqui para ver uma versão maior desta figura.

Figura 6: Quantificação de refeições menores de néctar. (A) Esquema de ensaio de alimentação de néctar. (B) Volume de refeição calculado utilizando leituras de fluorescência para fêmeas do tipo selvagem ofereciam refeições de água (azul, n = 36) ou 10% de sacarose (verde, n = 53), cada uma com fluoresceína de 0,002%, no ensaio de alimentação de néctar. Cada ponto representa uma medida de uma fêmea individual. Os dados são mostrados como medianas com intervalos. As cartas indicam grupos estatisticamente distintos, teste de Mann-Whitney, p<0,05. Esses dados foram publicados em Jové et al. (2020)27. Clique aqui para ver uma versão maior desta figura.
| Farinha de Sangue Artificial | |||
| Concentração de Solução de Estoque (mg/mL) | Volume de Solução de Estoque na Refeição (μL/mL) | Concentração final da refeição (mg/mL) | |
| Componentes proteicos* | |||
| γ-Globulinas | 50 | 300 | 15 |
| Hemoglobina | 35 | 230 | 8 |
| Albumina | 300 | 340 | 102 |
| Proteína Total | - | - | 125 |
| Componentes não proteicos | |||
| Concentração de Solução de Estoque (mM) | Volume de Solução de Estoque na Refeição (μL/mL) | Concentração final da refeição (mM) | |
| Nacl | Em estoque de γ-globulina | - | 5-10 |
| NaHCO3 | Em estoque de γ-globulina | - | 120 |
| Atp | 200 | 5 | 1 |
| Água | - | 125 | - |
| *Os componentes proteicos são preparados em solução de estoque de água duplamente destilada, exceto para γ-Globulinas, que são dissolvidos em 400 mM NaHCO3 e incluem uma quantidade variável de NaCl (2-4%) no produto. | |||
Tabela 1: Receita para preparar refeições de sangue artificiais (adaptadas de Kogan (1990)22). O sangue artificial consiste em componentes proteicos e não proteicos regularmente encontrados no sangue humano e fornece a opção de variar as proporções desses componentes. Mosquitos podem produzir ovos depois de se alimentarem de sangue artificial7,22.
| Refeição salina | |||
| Componente | Concentração de Solução de Estoque (mM) | Volume de Solução de Estoque na Refeição (μL/mL) | Concentração final da refeição (mM) |
| Nacl | - | - | - |
| NaHCO3 | 400 | 300 | 120 |
| Atp | 200 | 5 | 1 |
| Água | - | 695 | - |
Tabela 2: Receita para refeição salina com ATP (adaptado de Duvall et al. (2019)7). As refeições salinas sem proteínas podem ser usadas para fornecer compostos de interesse aos mosquitos enquanto ainda imitam a distensão abdominal que ocorre após a alimentação sanguínea, mas sem desencadear o desenvolvimento de óvulos que ocorre quando as proteínas são ingeridas.
Discussão
Para muitas aplicações de laboratório, os alimentadores de membrana artificial oferecem benefícios distintos em comparação com os hosts vivos, permitindo aos pesquisadores a capacidade de manipular diretamente o conteúdo da refeição. Embora vários métodos estejam disponíveis para alimentação artificial de membrana, o método descrito aqui oferece vantagens em flexibilidade, custo e throughput. Em comparação com outros alimentadores de membrana comercial, o ensaio do Glytube requer um pequeno volume de refeição, tornando-se um mecanismo de entrega eficiente para reagentes caros, incluindo medicamentos ou patógenos, minimizando o volume total necessário7,35. Como tanto o soro fisiológico sem proteínas quanto as refeições artificiais de sangue promovem o engorgador, compostos ou patógenos podem ser adicionados a qualquer refeição como uma alternativa de alta produtividade e não invasiva às injeções. Além disso, cada componente do Glytube pode ser facilmente lavado, substituído ou dimensionado para entregar e quantificar vários tipos de refeições sem contaminação cruzada do aparelho alimentar.
Para quantificar os volumes de refeição consumidos pelos mosquitos, o método baseado em fluorescência permite uma quantificação mais precisa do tamanho da refeição do que pesar os mosquitos antes e depois da alimentação. Deve-se notar que este método é um ensaio de ponto final. Em contraste, a pesagem permite que os mosquitos sejam mantidos vivos para mais experimentos. Usando um leitor de pratos, o método baseado em fluorescência pode ser facilmente dimensionado para quantificação de alta produtividade de refeições consumidas por centenas de fêmeas individuais.
Para alcançar altas taxas de alimentação, uma combinação de pistas suficientes de hospedeiro deve estar presente para ativar o comportamento feminino em busca de hospedeiros e atrair fêmeas para o alimentador. Se os mosquitos não estiverem se aglomerando sob o Glytube, a refeição pode não ser adequadamente aquecida, ou a entrega de CO2 pode não ser suficiente. A adição de odor humano à superfície da membrana aumenta de forma confiável a atratividade da membrana artificial. Se os mosquitos forem observados sob o Glytube, mas não se alimentarem, a composição da refeição pode ser a culpada. As fêmeas não podem se alimentar se a refeição em si não estiver quente, o sangue é muito velho, ou se os aditivos para a refeição são intrinsecamente aversivos ou causam uma reação química indesejável36. ATP adicional também aumenta de forma confiável as taxas de alimentação e pode ser dimensionada até uma concentração final de 2 mM em cada uma das receitas fornecidas. As fêmeas não podem se alimentar se o parafilm não for puxado esticada através da tampa do Glytube; o parafilme deve ser uniformemente transparente e não deve dobrar, pois isso impede que a fêmea seja capaz de efetivamente perfurar o parafilme com seu estomado. Se a refeição vazar através do Glytube na malha, o parafilme pode ter rasgado durante o processo de alongamento e deve ser substituído.
A alteração da composição da refeição também pode permitir que os pesquisadores manipulem o tempo necessário para limpar a refeição do midgut, bem como o comportamento subsequente de busca de hospedeiros. As refeições aqui apresentadas requerem 24-36 h para digestão7 semelhante ao sangue derivado de animais. Depois de se alimentar em qualquer uma dessas refeições, as fêmeas suprimirão a busca de hospedeiros durante a janela de tempo de digestão. Como a refeição salina carece de proteína, as fêmeas voltam à busca de acolhimento após a refeição ser liberada. Se um retorno mais rápido for desejável, os pesquisadores podem escolher refeições salinas alternativas de "limpeza rápida" que são excretadas em aproximadamente 6 h27. Embora a composição da refeição salina aqui apresentada aqui seja combinada com a comparação direta dos resultados com a refeição artificial do sangue, a refeição de "limpeza rápida" corresponde mais de perto aos níveis fisiológicos de sal encontrados no sangue dos vertebrados.
Os métodos aqui descritos têm limitações que devem ser consideradas antes de selecionar o ensaio mais adequado aos objetivos experimentais do pesquisador. As medidas de fluoresceína descritas não permitem que os mosquitos sejam usados novamente para experimentação adicional. No entanto, as medidas de peso podem ser tomadas antes da quantificação do tamanho da refeição usando o ensaio de fluoresceína. Se o peso e o tamanho da refeição forem consistentes em vários ensaios para uma determinada refeição, o peso pode ser usado como proxy em experimentos futuros. Além disso, este protocolo não distingue entre déficits na busca de hospedeiros versus comportamento de alimentação sanguínea; mosquitos que apresentem prejuízos ao encontrar o alimentador de membrana terão uma redução nas taxas de alimentação e/ou tamanho da refeição. Adicionando uma câmera para registrar o comportamento durante todo o ensaio, os pesquisadores podem determinar se as fêmeas não conseguem encontrar o Glytube, ou se encontram o Glytube, mas não se alimentam.
O ensaio aqui descrito pode ser adaptado para explorar muitas questões pendentes relacionadas ao comportamento alimentar em mosquitos. Por exemplo, a contribuição de proteínas sanguíneas específicas pode ser explorada alterando a proporção de proteínas constituintes ou concentração total de proteínas na refeição sanguínea artificial. Para avaliar os tamanhos das refeições de múltiplos eventos de alimentação, corantes com espectros distintos de fluorescência podem ser adicionados para diferenciar refeições de fontes únicas37. Este protocolo também pode ser modificado para estimular separadamente as partes bucais internas que detectam sangue e que são usadas para ingestão (ou seja, mais stylet), e os apêndices que entram em contato com a pele (ou seja, labium, pernas) como o mosquito pousa para iniciar a alimentação sanguínea36. Por exemplo, se os ligantes são adicionados diretamente à refeição, eles não entram em contato com o lábio e as pernas, uma vez que a membrana é perfurada apenas pelo estomado. Se os ligantes forem adicionados à superfície externa do parafilme, eles permanecem separados da refeição e podem ser contatados pelo lábio e pernas36. Finalmente, a cinética detalhada do comportamento de alimentação sanguínea não é bem compreendida e o método aqui apresentado poderia ser modificado para combinar rastreamento de alta resolução com ferramentas de aprendizado de máquina para extrair leituras comportamentais da locomoção, postura e dinâmica alimentar38.
Este protocolo visa ser fácil de usar e econômico, com a capacidade de atender pesquisadores que empregam manipulações farmacológicas e genéticas para estudar a alimentação sanguínea de mosquitos e o comportamento pós-alimentação sanguínea.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Nipun Basrur, Adriana K. Rosas Villegas, Nadav Shai e Trevor Sorrells pelos comentários sobre os manuscritos, e Zhongyan Gong e Kyrollos Barsoum pela assistência técnica. Agradecemos a Alex Wild pelas fotografias usadas na Figura 1. K.V. foi apoiado pela bolsa de doutorado Da Boehringer Ingelheim Fonds. V.J. foi apoiado em parte pelo NIH T32-MH095246. Este trabalho foi apoiado em parte por uma bolsa para a Universidade Rockefeller do Instituto Médico Howard Hughes através do programa James H. Gilliam Fellowships for Advanced Study para V.J. Este material é baseado em trabalho apoiado pelo Programa de Bolsas de Pós-Graduação da Fundação Nacional de Ciência sob o Grant No. NSF DGE-1325261 para V.J. Quaisquer opiniões, achados e conclusões ou recomendações expressas neste material são do autor e não refletem necessariamente as opiniões da Fundação Nacional de Ciência.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | Fisher Scientific | 14-959-70C | |
| 3 mm diameter borosilicate solid-glass bead | MilliporeSigma | Z143928 | For use for bead mill homogenizer; not required if using pellet pestle grinder |
| 32 oz. high-density polyethylene (HDPE) plastic cup | VWR | 89009-668 | Example mosquito container used for feeding assays shown; alternate options can be used |
| 50 mL conical tubes | Fisher Scientific | 14-959-49A | |
| 96-well black polystyrene plate | ThermoFisher | 12-566-09 | |
| 96-well PCR plate sealing film | Bio-Rad | MSB1001 | Alternate options can be used |
| 96-well PCR plates | Bio-Rad | HSP9621 | Alternate options can be used |
| Adenosine 5′-triphosphate (ATP) disodium salt hydrate | MilliporeSigma | A6419 | |
| Albumin (human serum) | MilliporeSigma | A9511 | |
| Aluminum foil | Fisher Scientific | 01-213 | Alternate options can be used to block light entering fluorescein container |
| Balance | Fisher Scientific | 01-911 | Alternate options can be used |
| Bead mill homogenizer | Qiagen | 85300 | Not required if using pellet pestle grinder |
| Cotton ball | Fisher Scientific | 22456880 | For nectar-feeding; alternate options can be used |
| Defibrinated sheep blood | Hemostat Laboratories | DSB100 | Alternate options can be used |
| Drosophila CO2 fly pad | Tritech Research | MINJ-DROS-FP | Alternate options can be used |
| Fluorescein | MilliporeSigma | F6377 | |
| Fluorescence plate-reader | ThermoFisher | VL0000D0 | Alternate options can be used |
| Gamma-globulin (human blood) | MilliporeSigma | H7379 | |
| Glycerol | MilliporeSigma | G7893 | |
| Hemoglobin (human) | MilliporeSigma | G4386 | |
| Laboratory wrapping film - parafilm | Fisher Scientific | 13-374 | |
| Magnetic stirrer | Fisher Scientific | 90-691 | Alternate magnetic stirrers can be used |
| Microcentrifuge for 96-well plate | VWR | 80094-180 | Alternate options can be used |
| Microcentrifuge Tubes | MilliporeSigma | 2236412 | Alternate options can be used |
| Pellet pestle grinder | VWR | KT749521-1500 | Not required if using bead mill homogenizer |
| Phosphate buffered solution (PBS) | Fisher Scientific | BW17-516F | Optional |
| Razor blades | Fisher Scientific | 12-640 | Alternate options can be used, such as a lathe for better consistency of cutting |
| Rubber bands | |||
| Silicone tubing | McMaster Carr | Needed if using a fly pad for CO2 delivery | |
| Sodium bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Sodium chloride (NaCl) | MilliporeSigma | S9888 | |
| Stir bars | Fisher Scientific | 14-512 | Alternate magnetic stir bars can be used |
| Translucent polypropylene storage box with removable lid | Example box used for feeding assays shown | ||
| Vortex mixer | |||
| Water bath | Alternate heating device may be used | ||
| White 0.8 mm polyester mosquito netting | American Home & Habit Inc. | F03A-PONO-MOSQ-M008-WT | Alternate options can be used |
Referências
- Bhatt, S., et al. The global distribution and burden of dengue. Nature. 496 (7446), 504-507 (2014).
- Rogers, D. J., Wilson, A. J., Hay, S. I., Graham, A. J. The global distribution of yellow fever and dengue. Advances in Parasitology. 62 (05), 181-220 (2006).
- Chouin-Carneiro, T., et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus. PLoS Neglected Tropical Diseases. 10 (3), (2016).
- Guerbois, M., et al. Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Amercias. Journal of Infectious Diseases. 214 (9), 1349-1356 (2016).
- Weaver, S. C., et al. Zika virus: history, emergence, biology, and prospects for control. Antiviral Research. 130, 69-80 (2016).
- Attardo, G. M., Hansen, I. A., Raikhel, A. S. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny. Insect Biochemistry and Molecular Biology. 35 (7), 661-675 (2005).
- Duvall, L. B., Ramos-Espiritu, L., Barsoum, K. E., Glickman, J. F., Vosshall, L. B. Small-molecule agonists of Ae. aegypti neuropeptide Y receptor block mosquito biting. Cell. 176 (4), 687-701 (2019).
- Dimond, J. B., Lea, A. O., Hahnert, W. F., DeLong, D. M. The amino acids required for egg production in Aedes aegypti. The Canadian Entomologist. 88 (2), 57-62 (1956).
- Guerrero, D., Cantaert, T., Missé, D. Aedes mosquito salivary components and their effect on the immune response to arboviruses. Frontiers in Cellular and Infection Microbiology. 10, 1-11 (2020).
- Raquin, V., Lambrechts, L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology. 507, 75-81 (2017).
- Farjana, T., Tuno, N. Multiple blood feeding and host-seeking behavior in Aedes aegypti and Aedes albopictus (diptera: Culicidae). Journal of Medical Entomology. 50 (4), 838-846 (2013).
- Scott, T. W., Takken, W. Feeding strategies of anthropophilic mosquitoes result in increased risk of pathogen transmission. Trends in Parasitology. 28 (3), 114-121 (2012).
- Ross, P. A., Lau, M. J., Hoffmann, A. A. Does membrane feeding compromise the quality of Aedes aegypti mosquitoes. PLoS ONE. 14 (11), 1-19 (2019).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with wolbachia. Journal of Visualized Experiments. 2017 (126), 1-8 (2017).
- Briegel, H., Hefti, M., DiMarco, E. Lipid metabolism during sequential gonotrophic cycles in large and small female Aedes aegypti. Journal of Insect Physiology. 48 (5), 547-554 (2002).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A. S., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Pakes, S. P., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Deng, L., Koou, S. Y., Png, A. B., Ng, L. C., Lam-Phua, S. G. A novel mosquito feeding system for routine blood-feeding of Aedes aegypti and Aedes albopictus. Tropical Biomedicine. 29 (1), 169-174 (2012).
- Gunathilaka, N., Ranathunge, T., Udayanga, L., Abeyewickreme, W. Efficacy of blood sources and artificial blood feeding methods in rearing of Aedes aegypti (Diptera: Culicidae) for sterile insect technique and incompatible insect technique approaches in Sri Lanka. BioMed Research International. 2017, 3196924 (2017).
- Costa-da-Silva, A. L., et al. Glytube: a conical tube and parafilm M-based method as a simplified device to artificially blood-feed the Dengue vector mosquito, Aedes aegypti. PLoS ONE. 8 (1), 53816 (2013).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments. 83 (83), 1-10 (2014).
- Kogan, P. H. H. Substitute blood meal for investigating and maintaining Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 27 (4), 1-4 (1990).
- Gonzales, K. K., Hansen, I. A. Artificial diets for mosquitoes. International Journal of Environmental Research and Public Health. 13 (12), (2016).
- Baughman, T., et al. A highly stable blood meal alternative for rearing Aedes and Anopheles mosquitoes. PLoS Neglected Tropical Diseases. 11 (12), 0006142 (2017).
- Galun, R. Feeding stimuli and artificial feeding. Bulletin of the World Health Organization. 36, 590-593 (1967).
- Galun, R. Feeding response in Aedes aegypti: stimulation by adenosine triphosphate. Science. 142, 1674-1675 (1963).
- Jové, V., et al. Sensory Discrimination of Blood and Floral Nectar by Aedes aegypti Mosquitoes. Neuron. 108, 1-18 (2020).
- Petersen, M. T., et al. The impact of the age of first blood meal and Zika virus infection on Aedes aegypti egg production and longevity. PLoS ONE. 13 (7), 1-15 (2018).
- Sissoko, F., et al. Frequent sugar feeding behavior by Aedes aegypti in Bamako, Mali makes them ideal candidates for control with Attractive Toxic Sugar Baits (ATSB). PLoS ONE. 14 (6), 0214170 (2019).
- Houseman, J. G., Downe, A. E. R. Methods of measuring blood meal size and proteinase activity for determining the effects of mated state of digestive processes of female Aedes aegypti (L.) (Diperta: Culicidae). The Canadian Entomologist. 18, 241-248 (1986).
- Redington, B. C., Hockmeyer, W. T. A method for estimating blood meal volume in Aedes aegypti using a radioisotope. Journal of Insect Physiology. 22 (7), 961-966 (1976).
- Gonzales, K. K., et al. The effect of SkitoSnack, an artificial blood meal replacement, on Aedes aegypti life history traits and gut microbiota. Scientific Reports. 8 (1), 1-14 (2018).
- Klowden, M. J. The endogenous regulation of mosquito reproductive behavior. Experientia. 46 (7), 660-670 (1990).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 22486 (2013).
- Frances, S. P., Sithiprasasna, R., Linthicum, K. J. Laboratory evaluation of the response of Aedes aegypti and Aedes albopictus uninfected and infected with Dengue virus to Deet. Journal of Medical Entomology. 48 (2), (2011).
- Dennis, E. J., Goldman, O. V., Vosshall, L. B. Aedes aegypti mosquitoes use their legs to sense DEET on contact. Current Biology. 29 (9), 1551-1556 (2019).
- Harrington, L. C., et al. Heterogeneous feeding patterns of the Dengue vector, Aedes aegypti, on individual human hosts in rural Thailand. PLoS Neglected Tropical Diseases. 8 (8), 3048 (2014).
- Hol, F. J., Lambrechts, L., Prakash, M. BiteOscope, an open platform to study mosquito biting behavior. eLife. 9, 1-24 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados