Method Article
アエデスアエジプティ蚊の動物由来血液と人工食事の摂食と定量化
要約
このプロトコルの目標は、人工膜フィーダーを介して Aedes aegypti 蚊に動物由来および人工血液食事を提供し、摂取される食事の量を正確に定量することです。
要約
特定の蚊種のメスは、卵の発達に必要なタンパク質が豊富な血液食事を得るために脊椎動物の宿主を噛みながら病気を広めることができます。実験室では、研究者は、食事組成の操作を可能にする膜フィーダーを介して蚊に動物由来および人工血液食事を提供することができます。ここでは 、Aedes aegypti 蚊に血液および人工血液食事を供給し、個々の女性が消費する量を定量化する方法を提示する。
人工的/血液食事の標的餌と定量化は、食事成分が蚊の行動や生理学に及ぼす影響のテスト、注射なしで薬理学的化合物を提供すること、蚊を特定の病原体に感染させるなど、幅広い用途を持っています。摂食前にフルオレセイン染料を食事に加えることにより、その後の食事サイズの定量が可能になります。蚊が消費する食事量は、体重、後で女性を行動実験に使用する場合、または96ウェルプレートの個々のメスを均質化し、プレートリーダーをエンドポイントアッセイとして使用して蛍光レベルを測定することによって測定することができます。食事サイズの定量化は、食事成分を変更すると摂取される食事量が変化するか、または食事の消費量が蚊の株によって異なるかどうかを決定するために使用することができます。正確な食事サイズの定量は、宿主の魅力や胎児性に対する影響を測定するような下流アッセイにとっても重要です。ここで提示される方法は、日の経過とともに食事の消化を追跡したり、異なる食事(蜜や血液など)に追加された複数の識別可能なマーカーを含むようにして、各食事の消費量を単一の蚊によって定量化するようにさらに適応することができる。
これらの方法により、研究者は単独でハイスループット測定を行い、何百もの個々の蚊が消費する食事量を比較することができます。したがって、これらのツールは、多様な生物学的質問に答えるために蚊の研究者のコミュニティに広く役立ちます。
概要
人工膜フィーダーを使用して Aedes aegypti 蚊に修飾された血液食事を供給し、個々の蚊が消費する食事量を正確に測定するためのプロトコルを提示します。このプロトコルは、食事の内容を変更したり、蚊の異なる実験群によって消費される食事量を比較するために柔軟に適応することができる。
Ae. aegypti蚊は、黄熱病、デング熱、チクングニア、ジカ1、2、3、4、5などの病気を引き起こす病原体を広めることによって、世界の健康を脅かす。Ae. aegyptiメスは血液供給者を義務付ける。卵の発達に必要なタンパク質を得るために脊椎動物の血液を消費する必要があり、卵の各クラッチは少なくとも1つの宿主6、7、8からの完全な血液の食事を必要とします。メスの蚊は、まず彼女のスタイレットで皮膚を突き刺し、宿主の免疫応答を引き起こす化合物を含む唾液を注入することによって、彼女のホストを噛む9.その後、彼女は彼女のステーレットを通して彼女の中間に血液を送り込んで餌を与えます。感染した宿主から血液の食事を摂取しながら、彼女は血液媒介病原体6、8を摂取し、蚊の中腸から唾液腺10に移動する。この方法で感染した雌の蚊は、その後の宿主11、12を噛むときに唾液と一緒に病原体を注入することによって病気を広めることができる。血液供給行動のメカニズムを理解し、定量化することは、蚊媒介性疾患の伝染を制御する上で重要なステップです。
蚊の飼育と実験のための多くの実験室プロトコルは、マウス、モルモット、またはヒトを含む生きた動物を血液源13、14、15、16として使用する。生きた動物の使用は倫理的な懸念と、人員訓練、動物の住宅とケア、および制度的動物ケア・使用委員会(IACUC)政策の遵守に対する複雑な要件を課しています。また、蚊に送ることができる化合物の種類を制限します,これは、実行することができる研究を制約します 17 .
人工血液供給装置は、通常、宿主の皮膚をシミュレートするために膜システムを使用し、ライブホストの維持の必要性を回避する血液供給行動を研究するための有用なツールである。全血は、ベンダーの数から購入し、加熱された水ジャケット人工膜フィーダーまたは同様のデバイス18、19を使用して蚊に供給することができます。このプロトコルでは、「Glytubes」と呼ばれている小型の使い捨て膜フィーダーの使用を実証する。コスタ・ダ・シルバら(2013)20によって以前に発表されたこの膜フィーダーは、標準的な実験室機器から簡単に組み立てることができ、血液食事を適度な数の蚊に送り込むのに理想的であり、より大きなグループまたは複数の食事製剤をテストするためにスケールアップするのが簡単です。Glytubeは、他の商用人工フィーダーに代わる安価で効率的な代替物であり、食事量が大きい場合があり、単一の食事製剤21上で蚊の大きなグループをバッチ供給するのに適している。
このプロトコルには、人工食事の準備/配達と消費の定量化の2つのセクションが含まれています。最初のセクションでは、Glytubesは、操作された食事を提供するための効率的な手段として使用されています。全血は、血液の代わりに血液置換の効果を比較するために、完全に人工的な食事で置き換えることができます。コーガン(1990)22から適応したレシピがここで提示されていますが、複数の人工食事製剤が23,24に開発されています。さらに、給餌は、注射よりも薬理学的化合物を導入するための侵襲性が低く、手間のかからない方法です。各食事に必要な総容積(1~2 mL)が少ないため、このプロトコルは高価な試薬の量を減らすための魅力的な送達方法を提供します。ae. aegyptiメスは、単一の食事成分の効果を測定するためのベースラインを提供するアデノシン5′三リン酸(ATP)25、26と生理食塩水のタンパク質フリーの食事を容易に消費します。例えば、Ae.aegyptiにおけるニューロペプチドY様受容体7(NPYLR7)は、タンパク質が豊富な血液食事の後に宿主を求める抑制を仲介することが知られており、NPYLR7アゴニストがタンパク質を含まない生理食前の食事に添加されると、雌蚊は全血を消費したものと同様の宿主求めの抑制を示す。
第2のセクションでは、個々のメスの蚊が消費する各食事の量を定量化するためのステップが提示される。このアッセイは蛍光ベースで、腹部の膨満度の視覚的評価に基づいて女性が「供給」または「未供給」に分類される方法よりも高い解像度で摂食状態を捉える。摂食前に食事にフッ素を加えることで、個人が摂取した食事量を96ウェルプレートで均質化し、蛍光強度を読み出しとして測定することで定量化することができます。このアッセイは、食事組成や蚊の遺伝的背景などの変数に応答して、供給活力の違いを測定することができます。正確な定量化は、中間食事のサイズ、例えば女性が摂食抑止力を含む最適でない食事を提供される場合、または可変サイズ27のスクロースミールを消費する場合に重要である。食事サイズの定量化後のその後の行動アッセイに蚊を与える必要がある場合、食事のサイズは、代わりに麻酔薬をグループで計量し、個人あたりの平均増加質量を推定することによって計算することができます。フルオレセインマーキングよりも精度は低いが、計量は依然として食事量の集計推定値を提供し、食事が下流プロセス(例えば、胎児性または後の宿主誘引力)に及ぼす影響を調べることができる。血液の食事のサイズは可変であり、無数の因子11、28、29の影響を受けることができるが、ここで説明する方法で測定された摂取された食事サイズは、以前の定量7、30、31と一致している。
プロトコル
血液供給手順は、生きている動物や人間の宿主を使用して行われなかったし、ロックフェラー大学の制度的動物の世話と使用委員会(IACUC)と機関審査委員会(IRB)によって設定されたガイドラインに準拠しました。
1. 食事の準備
- この貪食刺激剤の調製、アデノシン5′-三リン酸
- 水性NaHCO3(分子量、MW = 84.006 g/mol)の25 mM溶液を調製してください。100 mLの25 mM NaHCO3の場合、210 mgのNaHCO3を体積フラスコに加え、2倍蒸留水(ddH2O)を合計100 mLに充填します。磁気攪拌棒を用いて、NaHCO3が溶解するまで溶液を十分に混合する。
- 25 mM NaHCO3 の水溶液中のATP二ナトリウム塩水和物(MW =551.14 g/mol)を200 mM ATPの最終濃度に再構成する。25 mM NaHCO3 バッファーで 200 mM ATP の合計体積 10 mL の場合、1.1 gの ATP 二ナトリウム塩ハイドレートをボリュームフラスコに加え、25 mM NaHCO3 バッファーを合計 10 mL に充てんします。磁気攪拌棒を使用して、すべてのATPが溶解するまで溶液を十分に混合する。
注:ATPの加水分解を最小限に抑えるには、NaHCO3のような塩溶液によってバッファリングする必要があります。 - ATP溶液をアリコートし、-20°Cで保存します。
注:ATPのこのストックソリューションは、通常、6ヶ月ごとに新鮮に作られ、以下に記載されているすべての食事に使用されます。分解を防ぐために、ATPアリコートは、複数の凍結融解サイクルを経たり、他の食事成分と一緒に加熱したりしてはならない。
- 蛍光トレーサー溶液、フルオレセインの調製
- フルオレセイン水溶液の2%(w/v)ストック溶液を調製する。総ストック液量10mLの場合、0.2gのフルオレセイン二ナトリウム塩を10mLのddH2Oと共に、室温でアルミニウム箔で包んだ15 mLの円錐管に混ぜます。このフルオレセインのストック溶液は、以下に記載されるすべての食事の希釈に使用することができる。
注:フッ素は光に敏感であるため、アルミニウム箔で容器を包むことによって光への暴露を避けてください。
- フルオレセイン水溶液の2%(w/v)ストック溶液を調製する。総ストック液量10mLの場合、0.2gのフルオレセイン二ナトリウム塩を10mLのddH2Oと共に、室温でアルミニウム箔で包んだ15 mLの円錐管に混ぜます。このフルオレセインのストック溶液は、以下に記載されるすべての食事の希釈に使用することができる。
- 動物由来の血液食事の調製
- すべての蚊に餌を与えるために必要な食事の数を計算します。各Glytubeは2mLの食事を持ち、約25個の蚊に餌を与えます。蛍光測定値の標準曲線を較正するために、追加の食事を1回準備します。特に記載がない限り、このセクションのすべてのステップでは、最終容積2 mLで1食を準備するために必要な試薬量について説明します。
- 動物由来の血液食事の場合、1.98〜2mLの脱脂羊の血液を15 mL円錐形チューブに移します(所望の血液量についてはステップ3.3を参照)。
注:羊、モルモット、およびヒトを含む脊椎動物の血液の商業的に除細化された供給源は、13を使用することができる。使用前に、購入した血液が有効期限を過ぎていないことを確認し、特に血液成分の目に見える分離がある場合は、ボトルを反転させることによってそれをよく混ぜます。 - 最適な給餌のために、羊の血液を水浴中で45°Cに温めた後、ATPを1〜2mMの最終濃度に加えます。1 mM ATP の最終濃度の場合、200 mM ATP ストック溶液の 10 μL を 1.99 mL の事前温血と混合に加えます。2 mM ATP の最終濃度の場合、200 mM ATP ストックの 20 μL を 1.98 mL の事前温血に加え、混合します。ATPを添加しない場合は、2mLの除細化された羊の血液を温める。
- その後、食事サイズの蛍光ベース定量を行う場合は、フルオレセイン溶液を0.002%の最終濃度(2μLの2%フルオレセインストックの2μL)に加えて食事総量2mLにします。フッ素を加えた量と同じ量の血液量を減らす。0.002%フルオレセインを含む最終食製剤の1 mLを保持し、基準標準曲線を生成する。蚊に届けられる食事と同じように、保持されたボリュームを扱う。実験の全期間を通して同じ光と温度条件に曝され、その後、配達された食事と一緒にこれを凍結します。
- 人工血液の食事の準備
- すべての蚊に餌を与えるために必要な食事の数を計算します。各Glytubeは2mLの食事を持ち、約25個の蚊に餌を与えます。蛍光測定値の標準曲線を較正するために、追加の食事を1回準備します。特に記載がない限り、このセクションのすべてのステップでは、1つの2 mLの食事を調製するために必要な試薬量について説明します。
- 人工血液(コーガン(1990)22から適応)を調製するために、表1のように、まず400mM NaHCO3のストック溶液を作る。合計体積が400mM NaHCO 3(MW = 84.006 g/mol)の合計体積の場合、336mgのNaHCO3を体積フラスコに加え、2倍蒸留水(ddH2 O)を合計10mLに充てんします。 磁気攪拌棒を用いて、NaHCO3が溶解するまで溶液を十分に混合する。
- 人工血液のタンパク質成分については、400 mM NaHCO3の50mg/mLのγグロブリン、ddH2Oのヘモグロビン35mg/mL、ddH2O.2 O.タンパク質ストック溶液を4°Cで最大2ヶ月間保存できます。人工血液中の全ヒトタンパク質の最終濃度は125mg/mLです。これには、15 mg/mL γグロブリン、8 mg/mLヘモグロビン、および102 mg/mLアルブミンの最終濃度が含まれます。
- 2 mLの食事ごとに、600 μLのγグロブリン、460 μLのヘモグロビン、680 μLのアルブミン、および 250 μL の ddH2O を 表 1に記載されたストックソリューションから組み合わせます。食事を45°Cに温めるまで、200 mM ATPストック液の10 μLを加えてから、食事を提示する直前に待ちます。
- その後、食事サイズの蛍光ベース定量を行う場合は、フルオレセイン溶液を0.002%の最終濃度(2μLの2%フルオレセインストックの2μL)に加えて食事総量2mLにします。ステップ4.4のddH2Oの体積を、フッ素添加と同じ量減らす。0.002%フルオレセインを含む最終食事製剤の少なくとも1 mLを保持し、基準標準曲線を生成する。蚊に届けられる食事と同じように、保持されたボリュームを扱う。実験の全期間を通して同じ光と温度条件に曝され、その後、配達された食事と一緒にこれを凍結します。
- タンパク質フリー食前の調製(デュヴァルらより適応(2019)7)
注:タンパク質フリーの生理食前の食事は、7、27、32の複数の方法で調製することができます。ここで提示される生理食前の食事は、上記の人工血液レシピのタンパク質フリーバージョンです。- すべての蚊に餌を与えるために必要な食事の数を計算します。各Glytubeは2mLの食事を保持し、約25個の蚊に餌を与え、蛍光測定のための標準曲線を較正するために1つの追加の食事を準備する。特に記載がない限り、このセクションのすべてのステップでは、1つの2 mLの食事を調製するために必要な試薬量について説明します。
- 生理食前の食事を準備するには、400 mM NaHCO3のストック溶液を作ります。合計体積が400 mM NaHCO 3(MW = 84.006 g/mol)の合計体積の場合、336 mgのNaHCO3を体積フラスコに加え、ddH2Oで10mLの合計体積に充満します。磁気攪拌棒を用いて、NaHCO3が溶解するまで溶液を十分に混合する。
- 2 mLの食事ごとに、1.39 mLのddH2O.と400 mM NaHCO3の15 mL円錐形チューブ600 μLに組み合わせて、食事が水浴で45°Cに温まるまで200mM ATPストック溶液の10 μLを加えます。
- その後、食事サイズの蛍光ベース定量を行う場合は、フルオレセイン溶液を0.002%の最終濃度(2μLの2%フルオレセインストックの2μL)の食事量合計2mLに加えます。ステップ5.3のddH2Oの体積を、フッ素添加と同じ量減らす。0.002%フルオレセインを含む最終食事製剤の少なくとも1 mLを保持し、基準標準曲線を生成する。蚊に届けられる食事と同じように、保持されたボリュームを扱う。実験の全期間を通して同じ光と温度条件に曝され、その後、配達された食事と一緒にこれを凍結します。
2. 蚊への食事配達
- 餌付け用の蚊容器の設置
注:蚊は、次の基準を満たしている限り、様々な容器に供給することができます。コンテナは蚊が飛び回るのに十分な大きさですが、蚊がメッシュ表面を見つけて餌を与え始めるほど大きくないことを確認してください。コンテナを覆うために使用されるメッシュは、材料や穴のサイズが異なる場合があります。穴は、メスの蚊のススタイリングが突き抜けるのに十分な大きさでなければなりませんが、蚊が逃げるほど大きくはありません。メッシュが張り合いになるようにしっかりと固定し、Glytubeは給餌期間を通して表面に安定して休むことができます。- 例えば容器(図1)は、変性946mL(32オンス)高密度ポリエチレン(HDPE)プラスチックバケットです。このセットアップを再現するには、カミソリの刃を使用して、バケット蓋の直径〜10cmの中央の穴を切断します。蚊による占領のための容器を組み立てるには、バケツの上に白い0.8mmポリエステル蚊網の〜400 cm2 平方片を固定し、穿穿蓋をしっかりと押し下げてしっかりとスナップします。
- 少なくとも3日間のエローション後の雌の蚊を集めて、血液を与えるのに十分な成熟を確保する。最適な供給率は、7日後に33.
- メスの蚊を容器に入れ、メッシュで覆います。コンテナに蚊が密集している場合は、使用するGlytubesの数を増やします。最適な給餌は、〜25個の蚊/Glytubeで達成されます。これにより、供給膜へのアクセスの競争が減少します。
- 食事を提供されない未供給の蚊の対照群を脇に置きます。重量測定プロトコルでは、未供給の群を別々に計量し、この重量を使用して食事に与えた実験群の体重増加を推定する。蛍光ベースの定量プロトコルでは、標準的な曲線計算と陰性制御のために、未供給の蚊群を井戸に追加します。実験群のベースライン蚊組織自己蛍光と一致させるために、標準的な曲線および陰性対照ウェルに未供給の蚊が含まれていることを確認する。
- Glytubeの構築と設定(コスタ・ダ・シルバらから適応(2013)20)
- 図1に示すように、熱源を発生させるため、50mLの円錐チューブを100%グリセロールの40mLで満たします。5 cm×5 cmパラフィルムで開いた円錐形の管を密封し、5 cm×5 cmのパラフィルムの追加部分で漏出の可能性を最小にする。必要に応じて、パラフィルムは、ゴムバンドを使用して所定の位置に保持することができます。穴や隙間がないことを確認するために、チューブを反転します。
- 食事の配達装置を作成するには、鋭いカミソリの刃を使用して円錐管のねじキャップに直径2.5cmの中心の穴を切断するか、より良い一貫性のために、旋回します。5cm×5cmのパラフィルムを均等に伸ばして、サイズが約2倍になるようにします。パラフィルムは、蚊が簡単にそれを突き刺すことができるほど薄くする必要がありますが、漏れはありません。ネジキャップの外面にシールを付けて穴を完全に覆い、キャップを脇に置きます。
注:Glytubeへの魅力を高めるために、パラフィルムを伸ばす前に、化粧品を塗布していない人間の皮膚のパッチに優しくこすり、穴が開かないことに注意して、人間の匂いを香水にします。これは、実験が蚊が食事に近づくのに必要な感覚的手がかりを調査することを目的としていない場合にお勧めします。 - グリセロールの密閉チューブと食事(ATPを除くすべての成分)を42〜45°Cの水浴で少なくとも15分間加熱します。ATP を事前に加熱しないでください。実験を開始する直前に追加してください。
- 温めた食事と渦にATPを徹底的に加えます。ねじキャップの内側の部屋に温めた食事のピペット2 mLを、その中に、逆、温めた、グリセロール充填50 mLの円錐管を穏やかに入れます。グリセロールで満たされたチューブに食事でキャップを部分的にねじ込む - ちょうど食事やグリセロールの漏れを防ぐために十分。
注意:使用される食事量は1 mLから2.5 mLの範囲です。食事が不足しているか高価な化合物を提供するために使用される場合は、より低いボリュームが特に有用である可能性があります。食事が周囲温度に冷やさなくなり、最大摂食の可能性を減らすために、このステップで迅速に作業することが重要です。冷却速度は、これらのステップが実施される部屋の周囲温度に依存しますが、通常は25°Cで5分以内に完了する必要があります。 - 組み立てたGlytubeを蚊の容器の上に置き、蚊が少なくとも15分間餌を与え、最大の給餌率を達成できるようにします。
- 最適な給餌のために、CO2パッドを備えたチャンバー内に蚊容器を入れ、食事を届ける前に25〜28°Cおよび70〜80%の湿度で少なくとも15分の順応を可能にする。ここで使用されるアッセイチャンバーは、以前に公開されたセットアップ16のシンプルで低コストの変更です。それは取り外し可能なふたが付いている36 cm L×31 cm Wの31 cm W×32 cm Hの半透明のポリプロピレンの貯蔵箱を使用する。チャンバー壁に作られた直径1.5 cmの穴はシリコーン管を通してCO2の配達を可能にする。CO2拡散パッドは、試験中にチャンバ雰囲気を条件として浄化空気とCO2の送達のために蓋の内側中央に貼り付けられている。
注:蚊が膜フィーダーに引き付けられるように、ホストキュー(熱とCO2、オプションのホスト臭16)が存在することを確認してください。蚊がGlytubeの下に混雑していない場合は、CO2 が適切に配信され、食事とGlytubeが十分に暖かであることを確認してください。外部CO2 ソースが利用できない場合、CO2 は、吐き出された人間の息のパフを介して送達することができます。 - 給餌後、グリチューブキャップはバイオハザード廃棄物として廃棄するか、低い割合の漂白剤溶液に浸漬し、水に完全にすすい込んだ後に再利用することができます。
3. 消費される食事の定量化
- さらなる実験に使用される蚊の重量を量る
注:食事の大きさを定量化するために蚊の重量を量ることは、彼らがさらなるライブ実験に使用することを可能にしますが、この方法は5蚊のグループから体重測定を行う必要があります。個々の蚊の重さは、ほとんどの実験室のバランスを使用して正確に測定することは困難であるため、個々の食事のサイズの変動は、重量を測定することによって容易に定量することはできません。体重計は、女性が目に見えて食事に夢中になる状況にのみ推奨されます。- 冷たい麻酔は、容器を4°Cの冷たい部屋に移すか、氷の上に置くことによって蚊を麻酔します。
- 未供給のコホート(すなわち、食事を提供されなかった蚊)から5人の女性のグループを計量し、「前食い」体重の推定値としてその平均体重を計算する。未供給の蚊の平均重量は、遺伝子型、性別、および飼育条件に依存する。スクロースへのアドリビタムアクセスで飼育された未供給の雌のAe.aegypti蚊は、通常、それぞれ約2mgの重量を量る。
- 実験コホート(すなわち、食事を提供された蚊)から、雌を「食べ物」に分類し、目7で観察可能な腹部の膨満感に基づいて杭を「与えられない」と「与えられない」。「餌を与えられた」と「供給されていない」杭のそれぞれを、計量のために5つの蚊のグループに分けます。5の各グループ内の蚊は、グループ体重測定を行うのと同じ実験コホートから誘導されるべきである。実験群の「供給」および「供給されない」杭のそれぞれから女性あたりの平均重量を計算する。
- 終点分析のための蛍光測定7,27,34
注:さらなる生きた実験に必要でなくなった個々の蚊から正確な食事サイズの測定を得るために、蚊と0.002%フルオレセインを含む残りの1mLを、授乳直後に-20°Cで保存してください。ここで実験を一時停止できます。この方法の概要は、 図 2.- 基準標準曲線を生成するには、蚊の実験群に提供された0.002%フルオレセインを含む同じ食事の連続希釈を調製する。8つの標準曲線ソリューションの合計があります。これらの各ソリューションでは、0.002%フルオレセインを含む食事の最終量は5になります。 2.5、1.25、0.625、0.3125、0.15625、0.078125、または0 μL、およびそれぞれ1xリン酸緩衝生理食塩分(PBS)で100μL(例えば、0.002%のフルオルセインを含む食事の5μL)になります。
- 標準曲線の最初の溶液を作るために、0.002%のフルオレセインを含む50 μLの食事を950 μLの1x PBSと渦を徹底的に加えます(最終容積:0.002%のフルオレセインを含む5 μLの食事を95 μLの1x PBSで5μL)。標準のカーブソリューションの残りの部分を作るためには、前のチューブから500 μLを取り出し、それを500 μLの1x PBSを含む新しいチューブに加えることによって、各ステップに対して2倍希釈を行います。次の2倍希釈を準備する前にボルテックスをよく。
- 標準曲線の標準曲線を生成するために使用されるウェルを準備するために、96ウェルPCRプレートの第1列の各8つのウェルに標準曲線溶液のピペット100 μLを準備します。プレートの最初の列に同じ8つの井戸のそれぞれに1つの未供給のコントロール蚊を追加します。複製測定のためにプレートの 2 番目の列で繰り返します。
注:実験グループが異なる食事タイプを提供される場合は、食事タイプごとに別の基準標準曲線を用意する必要があります。 - 1x PBSの100 μLを残りの各ウェルに加えて、未供給の制御および実験グループに対して十分に加えます。ビーズミルホモジナイザーまたはボルテックスを使用してその後のステップで組織が破壊される場合は、各ウェルに1つの3mmホウケイ酸ホウケイ酸固体ガラスビーズを加えます。
- 陰性対照として、プレートの次の2列の各井戸に1つの未添加の蚊を加える。このグループで測定された蛍光は、組織の自己蛍光を考慮したベースラインカットオフを設定し、実験群の蚊が食事に餌を与えたかどうかを判断するために使用されます。
- 食事を提供された実験グループの残りの井戸に井戸あたり1蚊を加えます。
- プレートを慎重に密封し、手動研削によって組織を破壊する。腹部は、食事を解放するために完全に均質化する必要があります。組織を破壊する方法には、3mmホウケイ酸固体ガラスビーズ(30秒間30Hz)を用いたビーズミルホモジナイザー、3mmホウケイ酸固体ガラスビーズ付きのボルテックスミキサー、ビーズなしの害虫粉砕機などがあります。
- 2000 rpm でプレートを遠心して、1~2 分間、リセートを回収します。
- 各井戸に180 μLの1x PBSを入した黒い96ウェルプレートを用意します。
- 1x PBS 180 μL で 20 μL の溶液を各ウェルに移し、混合します。可能な場合は、速度を向上させ、一貫性を向上させるため、このステップでマルチチャンネルピペットを使用します。
- 485/520励起/放出チャネルのプレートリーダーを使用して、各ウェルの蛍光強度を測定します。対応する蛍光強度測定に対して既知の食事量をプロットすることにより、基準標準曲線を生成する。
- 生成された基準標準曲線を用いて、各実験群の蚊によって摂取された食事量を推定する。各実験群の個々の蛍光強度読み取りから、未供給の蚊の陰性対照群の平均蛍光強度測定値を差し引いて、ベースライン組織自己蛍光を補正する。
結果
図1 はGlytubeを組み立てる模式図を示し、図 2 は、ここで説明する蛍光ベースのアッセイを用いて食事サイズを測定する実験計画の概要を示している。 図3 は、血液供給実験からの代表的なフルオレセイン食事サイズ測定を提供する。 図 4、 図 5、および 図 6 は、このプロトコルを使用して対処できる生物学的な質問のサンプルを示しています。プロトコルの用途は広範囲に及び、血液食事組成の変化、薬理学的化合物の摂食、最適でない血液食事または小さな蜜食事の正確な定量化、蚊の遺伝子型にわたる摂食行動の比較が含まれる。
食事量計算のための標準曲線を生成するために、蛍光測定値は、それぞれ0.002%フルオレセインを有する未供給の蚊および既知の食事量を含む指定された基準ウェルからプロットされる(図3A)。残りの井戸からの蛍光測定値は、未収蚊の陰性対照群または食事を提供した蚊の実験群のいずれかから蚊を含み、各蚊が消費する食事量(μL)を定量化するためにこの標準曲線と比較される(図3B)。このアッセイのベースライン測定値を検証するには、未供給の陰性対照群の蚊にμL消費の正の値が割り当てられないことを確認する必要があります(図3B、左)。実験群の全ての女性が血液の食事を提供されたが、一部の蚊は餌を与えた(図3B、中間)、いくつかは食べなかった(図3B、右)。この結果は、このプロトコルから2種類のデータを得ることができることを示しています:1)与えられた食事を食べる女性全体の割合と、2)与えられた食事を食べる女性が摂取した体積。
このプロトコルは、様々なタンパク質組成物を含む食事を送達し、定量化するために使用できます。 図4A,Bは、 フッ素を添加した食事を用いて収集したデータを示す。餌を与えた蚊の割合と摂取した食事量は、それぞれ蛍光測定値から計算した。これらの測定値は非常に感度が高く、μLの正確な定量化が可能ですが、蚊は将来のライブ実験には使用できないという制限があります。 図4C,Dは、 フルオレセインなしで食事を提供された後に、蚊に餌を与えられたり、目で食べられないとスコア付けされた蚊を用いた独立した実験から収集されたデータを示している。食事の大きさは、5匹の蚊の群から平均体重/メスとして計算した。これらの重量測定は蛍光測定よりも感度が低いが、女性を回収し、さらなる生実験に使用することを可能にする。蚊の餌を与える割合は、実験日によって異なる可能性があります( 図 4A および 図 4Cに示すように)。
図5 は、蚊の宿主を求める行動を調節する薬物を含む食事の消費量を示す。これらの実験では、女性は、ヒトNPY Y2受容体アゴニストTM30338の100μMを有する血液、生理食類+ATP、または生理食物+ATP食事を提供した。この薬物は 、Ae. aegypti NPY様受容体7の活性化を通じて宿主を求める行動を変える。食事のサイズを測定することは、研究者が各女性が消費する用量を計算することを可能にするので、この薬物が血液後摂食行動に及ぼす影響を評価する実験の解釈にとって重要である。
前の例では、女性は血液または代替血液の食事を与えられ、その結果、3〜5μLの食事が生まれました(図3、図4、図5)。この蛍光ベースのアッセイは、平均グループ体重測定から正確に識別できない、より小さく、より可変的な食事サイズを測定するためにも使用できます。図6では、0.002%フルオレセインを含む10%スクロースで飽和した綿球に対してGlytubeを交換して蜜送り行動を測定するために、同じ蛍光定量プロトコルを使用した。女性はスタイレットで蜜糖の存在を検出できず、摂食を開始しないため、Glytubeアッセイではネクター糖を提示することはできません。これらのデータにより、研究者は、前の研究34(図6)と一致して、砂糖の食事が血液の食事よりも一貫して小さいことを決定することができます。

図1:蚊に食事を与えるために使用されるGlytube法の設定。(A) 蚊に血液やその他の食事を供給するために使用される分解されたGlytubeの模式図。(B) Glytube の模式図は、メッシュの蓋をした蚊の容器の上に提示した。メスの蚊は、餌を与えるためにメッシュ蓋を通して突き刺すことができます。(C)グリチューブ(上)と雌の Aedes aegypti 蚊の写真は、グリチューブが配達した食事の前、中、および後(下、左から右)に餌を与えた後である。蚊は、膜フィーダーにアクセスするために容器を覆うメッシュを通して突き刺さって示されています。(D) 餌を与えず、人工血液の食事(右、上)または生理食費+ATPミール(右、下)のいずれかに夢中になっている雌の Ae.aegypti 蚊の外観を示す写真。Glytube 法は以前にコスタダ・シルバら (2013)20で出版された。写真(C)と(D)はアレックス・ワイルドの礼儀です。 この図の大きなバージョンを表示するには、ここをクリックしてください。
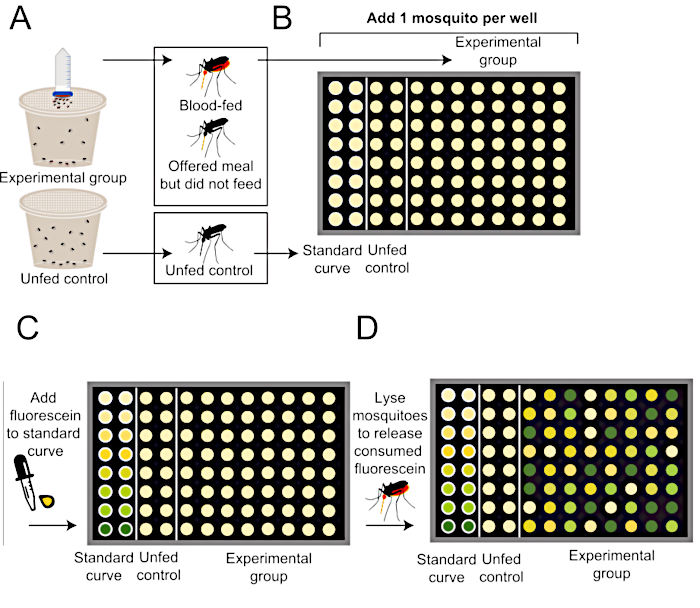
図2:Glytubeの採血プロトコル後の食事サイズを定量化する方法の概略図。(A)蚊はフルオレセイン(上、実験群)または食事なし(下、未供給の陰性対照群)の食事を提供される。(B)餌付け実験を終了した後、96ウェルプレートに個々の蚊を加える。(C)標準曲線は、0.002%フルオレセインを含む既知の量の食事を使用して生成される。(D) 蚊は、消費された蛍光を放出するために均質化され、各ウェルの蛍光レベルはプレートリーダーを用いて定量化される。この蛍光定量法は、Lieschら(2013)34から修飾される。この図の大きなバージョンを表示するには、ここをクリックしてください。
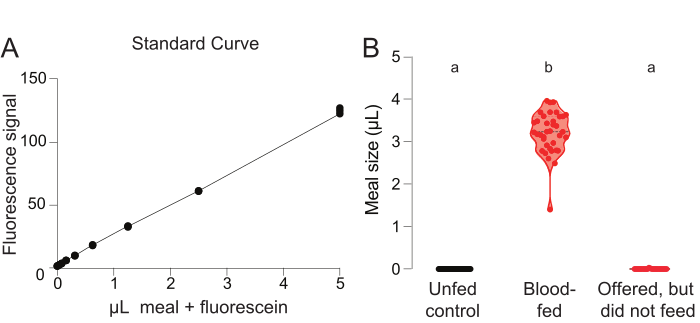
図3:フルオレセインベース定量によるグリチューブ給餌実験(A) 未供給の対照群から得られた、0.002%フルオレセイン(y軸スケール=任意の単位)を含む既知の量の食事に添加された井戸から得られる標準曲線測定。(B)未供給対照群の女性の蛍光測定値(左、黒、n=40)、血液を与えた実験群(中、赤、n=37)、および血液を食べなかった実験群(右、赤、n=23)を用いて計算した食事量。各ポイントは、個々の女性からの測定値を表します。データは、範囲を持つ中央値として表示されます。文字は統計的に異なるグループを示し、クリュスカル・ウォリスはダンの多重比較、p<0.01をテストします。これらのデータは、Jovéら(2020)27で公開されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
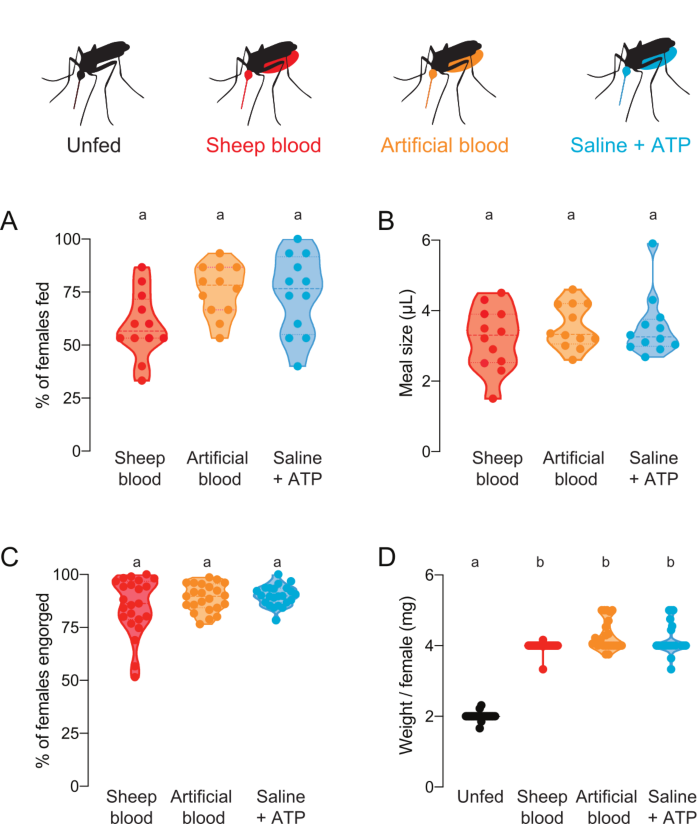
図4:タンパク質組成が異なる食事の定量化女性は、羊の血液(赤)、ヒト血液タンパク質を有する人工血液(コーガン(1990)22)(オレンジ)、またはタンパク質フリーの生理食動物+ATPミール(アクア)7のいずれかの食事を提供した。(A) 蛍光測定値を用いて採点された女性の割合。各ポイントは12~16人の女性のグループを表します。データは、範囲 n = 12 の中央値として表示されます。(B)蛍光測定値を用いて計算した食事量。各ポイントは、図4Aからの単一の試験における個々の女性からの測定値を表します。データは、範囲 n = 12 の中央値として表示されます。(C) 人工膜供給後に完全に充満した女性の割合は、目で採点される。各ポイントは、20~30人の女性のグループから集まった女性の割合を表します。データは、範囲 n = 23 の中央値として表示されます。(D) 給餌状態が目で採点された後、体重/女性として採点された食事サイズ。体重は5つの蚊の群の平均として計算した。データは、範囲 n = 23 の中央値として表示されます。A–D: 文字は統計的に異なるグループを示し、 Kruskal-Wallis 検定とダンの多重比較、 p<0.05.この図の大きなバージョンを表示するには、ここをクリックしてください。
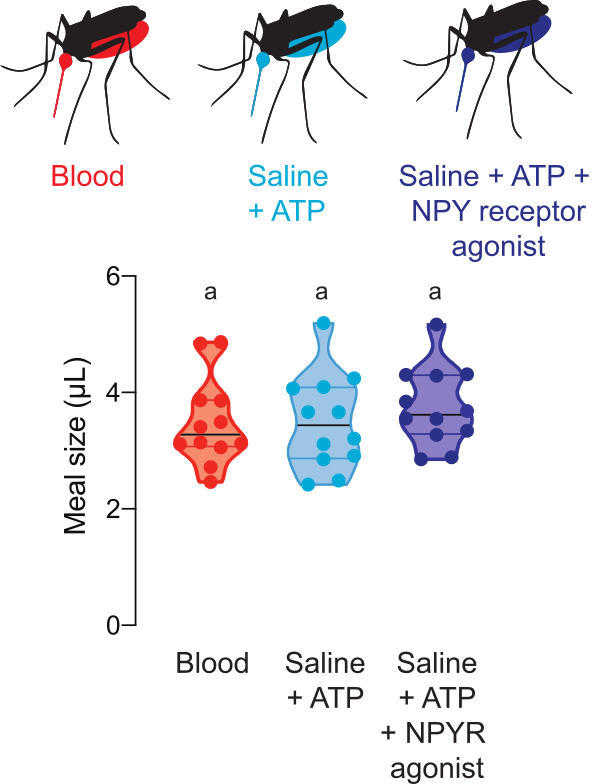
図5:薬理化合物による食事の定量化メスは、同じ大きさの羊の血液(赤)、生理食い+ ATP(アクア)、および生理食類+ATP + 100 μM用量のヒトNPY Y2受容体アゴニストTM30338(ダークブルー)の食事を消費する。蛍光測定値を用いて計算された食事量。各ポイントは、個々の女性からの測定値を表します。データは、範囲 n = 12 の中央値として表示されます。文字は統計的に異なるグループを示し、クリュスカル・ウォリスはダンの多重比較、p<0.05をテストします。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:小さい蜜の食事の定量化。(A) 蜜送りアッセイの概略図。(B)野生型メスの蛍光測定値を用いて計算された食事量は、水(青、n=36)または10%スクロース(緑、n=53)の食事を提供し、それぞれ0.002%フルオレセインを含む、蜜供給アッセイで提供した。各ポイントは、個々の女性からの測定値を表します。データは、範囲を持つ中央値として表示されます。文字は統計的に異なるグループ、マン・ホイットニー検定、p<0.05を示します。これらのデータは、Jovéら(2020)27で公開されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| 人工血液の食事 | |||
| ストック溶液の濃度(mg/mL) | 食事中のストックソリューションの量 (μL/mL) | 最終食事濃度(mg/mL) | |
| タンパク質成分* | |||
| γグロブリン | 50 | 300 | 15 |
| ヘモグロビン | 35 | 230 | 8 |
| アルブミン | 300 | 340 | 102 |
| 総タンパク質 | - | - | 125 |
| 非タンパク質成分 | |||
| ストック溶液の濃度(mM) | 食事中のストックソリューションの量 (μL/mL) | 最終食事濃度(mM) | |
| 塩化 ナトリウム | γグロブリン在庫で | - | 5-10 |
| ナフコ3 | γグロブリン在庫で | - | 120 |
| Atp | 200 | 5 | 1 |
| 水 | - | 125 | - |
| ※タンパク質成分は、400 mM NaHCO3 に溶解し、可変量のNaCl(2-4%)を含むγグロブリンを除き、二重蒸留水のストック溶液に調製される製品に含まれる。 | |||
表1:人工血液の食事を準備するためのレシピ(コーガン(1990)から適応22)。人工血液は、ヒトの血液中に定期的に見られるタンパク質および非タンパク質成分で構成され、これらの成分の比率を変化させるオプションを提供する。蚊は人工血液7、22を食べた後に卵を作り出すことができます。
| 生理食いの食事 | |||
| コンポーネント | ストック溶液の濃度(mM) | 食事中のストックソリューションの量 (μL/mL) | 最終食事濃度(mM) |
| 塩化 ナトリウム | - | - | - |
| ナフコ3 | 400 | 300 | 120 |
| Atp | 200 | 5 | 1 |
| 水 | - | 695 | - |
表2:ATPによる生理食用のレシピ(デュヴァルらから適応(2019)7)。タンパク質フリーの生理食動物の食事は、血液を摂食した後に起こる腹部の膨満を模倣しながら、蚊に関心のある化合物を提供するために使用することができますが、タンパク質を摂取したときに発生する卵の発達を引き起こすことなく。
ディスカッション
多くの実験室の適用のために、人工膜フィーダーは研究者が直接食事の内容を操作する機能を可能にすることによって生きているホストと比較して明確な利点を提供する。人工膜送出には複数の方法が用意されていますが、ここで説明する方法は柔軟性、コスト、スループットの利点があります。他の市販の膜フィーダーと比較して、Glytubeアッセイは、必要な総容積を7、35に抑えることによって、薬物または病原体を含む高価な試薬のための効率的な送達メカニズムを作る、少量の食事量を必要とする。タンパク質フリーの生理食糸と人工血液の食事の両方がエングレーギンメントを促進するので、化合物または病原体は、注射に対するハイスループットおよび非侵襲的な代替手段として、食事に加えることができる。さらに、Glytubeの各成分は、容易に洗浄、交換、またはスケールアップすることができ、給餌装置の交差汚染なしに複数の食事タイプを提供および定量化することができます。
蚊が消費する食事量を定量化するために、蛍光ベースの方法は、摂食の前後に蚊の重量を量るよりも、より正確な食事サイズの定量を可能にする。なお、この方法は終点アッセイである。対照的に、計量は蚊がさらなる実験のために生き続けることを可能にする。プレートリーダーを使用することにより、蛍光ベースの方法を簡単にスケールアップして、何百人もの女性が消費する食事のハイスループット定量化を行うことができます。
高い給餌率を達成するには、女性のホストシーク行動を活性化し、フィーダーに女性を引き付けるのに十分なホストキューが存在する必要があります。蚊がグリチューブの下に混雑していない場合、食事が適切に温められていないか、CO2 の配達が十分でない可能性があります。膜表面に人臭を加えると、人工膜の魅力が確実に高まります。グリチューブの下で蚊が観察されるが、餌を与えることができない場合、食事の組成に欠陥がある可能性があります。女性は、食事自体が暖かくなければ、血液が古すぎる、または食事への添加物が本質的に回避的であるか、または望ましくない化学反応36を引き起こす場合、餌を与えないかもしれない。追加のATPも確実に供給速度を増加させ、提供される各レシピの2 mMの最終濃度にスケールアップすることができる。パラフィルムがGlytubeキャップを横切って引っ張られていない場合、女性は餌を与えることができません。これは女性が効果的に彼女のスタイでパラフィルムを突き刺すことができるのを防ぐので、パラフィルムは均一に透明であるべきであり、バックルすべきではありません。食事がGlytubeを通ってメッシュに漏れた場合、パラフィルムはストレッチプロセス中に破れた可能性があり、交換する必要があります。
食事の組成を変更すると、研究者は、中間腸から食事をクリアするために必要な時間の長さと、その後のホストシーク行動を操作することもできます。ここで提示される食事は、動物由来の血液と同様の消化7 のために24〜36時間を必要とします。これらの食事のいずれかを食べ物を与えた後、女性は消化時間のウィンドウ中に宿主を求めることを抑制します。生理食前の食事にはタンパク質が欠けているため、女性は食事が取り除いた後に宿主を求めて戻ります。より速いリターンが望ましい場合、研究者は約6時間27で排泄される代替の「迅速なクリア」生理食音の食事を選択することができます。ここで提示される生理食塩水の組成は、人工血液食事と直接結果を比較するために一致しているが、"迅速なクリア"食事は、脊椎動物の血液中に見られる生理学的塩分濃度とより密接に一致する。
ここで説明する方法には、研究者の実験目標に最も適したアッセイを選択する前に考慮すべき制限があります。記載されたフルオレセイン測定では、蚊を追加の実験に再び使用することはできません。しかし、体重の測定は、フルオレセインアッセイを用いて食事サイズ定量の前に行うことができる。体重と食事のサイズが特定の食事の複数の試験で一貫している場合、体重は将来の実験で代理として使用することができます。さらに、このプロトコルは、ホストシークと血液供給行動の欠損を区別しません。膜フィーダーを見つけることに障害を示す蚊は、摂食率および/または食事のサイズの減少を持つことになります。アッセイ全体の行動を記録するためにカメラを追加することで、研究者は女性がGlytubeを見つけることができないかどうか、またはGlytubeを見つけるが餌を与えないかどうかを判断することができます。
ここで説明するアッセイは、蚊の摂食行動に関連する多くの顕著な質問を探求するために適応することができる。例えば、特定の血液タンパク質の寄与は、人工血液の食事中の構成タンパク質または総タンパク質濃度の比率を変化させることによって探索することができる。複数の摂食イベントから食事のサイズを評価するために、独特の蛍光スペクトルを有する色素を添加して、食事を独特の供給源37と区別することができる。このプロトコルはまた、血液を検出し、摂取に使用される内部マウスパーツ(すなわち、stylet)と、蚊が血液供給を開始するために着陸する蚊として接触する化学感覚の付属物(すなわち、陰唇、脚)を個別に刺激するように変更することができる。例えば、リガンドを食事に直接加えた場合、膜はスタイレットによってのみ穿孔されるため、陰素と脚に接触しません。代わりにパラフィルムの外表面にリガンドを添加した場合、それらは食事から分離されたままであり、陰唇と脚36によって接触され得る。最後に、血液供給行動の詳細な運動学はよく理解されておらず、ここで提示される方法は、高解像追跡と機械学習ツールを組み合わせて、移動、姿勢、および摂食ダイナミクス38の行動読み出しを抽出するように変更することができる。
このプロトコルは、蚊の採血と摂食後の行動を研究するために薬理学的および遺伝子操作を採用する研究者にサービスを提供する能力を持つ、ユーザーフレンドリーで費用対効果の高いことを目的としています。
開示事項
著者らは開示するものは何もない。
謝辞
ニプン・バスル、アドリアナ・K・ロサス・ヴィルガス、ナダフ・シャイ、トレバー・ソレルズの原稿に関するコメント、中陰ゴングとカイロロス・バルソウムの技術支援に感謝します。 図1で使用されている写真を撮ってくれたアレックス・ワイルドに感謝します。K.V.はベーリンガー・インゲルハイム・フォンズ博士フェローシップによって支えられていました。V.J.はNIH T32-MH095246の一部でサポートされました。この研究の一環として、ハワード・ヒューズ医学研究所からジェームズ・H・ギリアム・フェローシップ・フォー・アドバンスト・スタディ・プログラムを通じてロックフェラー大学への助成金がV.J.に支えられた。この資料は、国立科学財団大学院研究フェローシッププログラムの助成No.の支援を受けた作業に基づいています。NSF DGE-1325261 から V.J.この資料に記載されている意見、調査結果、結論または勧告は著者のものであり、必ずしも国立科学財団の見解を反映しているわけではありません。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | Fisher Scientific | 14-959-70C | |
| 3 mm diameter borosilicate solid-glass bead | MilliporeSigma | Z143928 | For use for bead mill homogenizer; not required if using pellet pestle grinder |
| 32 oz. high-density polyethylene (HDPE) plastic cup | VWR | 89009-668 | Example mosquito container used for feeding assays shown; alternate options can be used |
| 50 mL conical tubes | Fisher Scientific | 14-959-49A | |
| 96-well black polystyrene plate | ThermoFisher | 12-566-09 | |
| 96-well PCR plate sealing film | Bio-Rad | MSB1001 | Alternate options can be used |
| 96-well PCR plates | Bio-Rad | HSP9621 | Alternate options can be used |
| Adenosine 5′-triphosphate (ATP) disodium salt hydrate | MilliporeSigma | A6419 | |
| Albumin (human serum) | MilliporeSigma | A9511 | |
| Aluminum foil | Fisher Scientific | 01-213 | Alternate options can be used to block light entering fluorescein container |
| Balance | Fisher Scientific | 01-911 | Alternate options can be used |
| Bead mill homogenizer | Qiagen | 85300 | Not required if using pellet pestle grinder |
| Cotton ball | Fisher Scientific | 22456880 | For nectar-feeding; alternate options can be used |
| Defibrinated sheep blood | Hemostat Laboratories | DSB100 | Alternate options can be used |
| Drosophila CO2 fly pad | Tritech Research | MINJ-DROS-FP | Alternate options can be used |
| Fluorescein | MilliporeSigma | F6377 | |
| Fluorescence plate-reader | ThermoFisher | VL0000D0 | Alternate options can be used |
| Gamma-globulin (human blood) | MilliporeSigma | H7379 | |
| Glycerol | MilliporeSigma | G7893 | |
| Hemoglobin (human) | MilliporeSigma | G4386 | |
| Laboratory wrapping film - parafilm | Fisher Scientific | 13-374 | |
| Magnetic stirrer | Fisher Scientific | 90-691 | Alternate magnetic stirrers can be used |
| Microcentrifuge for 96-well plate | VWR | 80094-180 | Alternate options can be used |
| Microcentrifuge Tubes | MilliporeSigma | 2236412 | Alternate options can be used |
| Pellet pestle grinder | VWR | KT749521-1500 | Not required if using bead mill homogenizer |
| Phosphate buffered solution (PBS) | Fisher Scientific | BW17-516F | Optional |
| Razor blades | Fisher Scientific | 12-640 | Alternate options can be used, such as a lathe for better consistency of cutting |
| Rubber bands | |||
| Silicone tubing | McMaster Carr | Needed if using a fly pad for CO2 delivery | |
| Sodium bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Sodium chloride (NaCl) | MilliporeSigma | S9888 | |
| Stir bars | Fisher Scientific | 14-512 | Alternate magnetic stir bars can be used |
| Translucent polypropylene storage box with removable lid | Example box used for feeding assays shown | ||
| Vortex mixer | |||
| Water bath | Alternate heating device may be used | ||
| White 0.8 mm polyester mosquito netting | American Home & Habit Inc. | F03A-PONO-MOSQ-M008-WT | Alternate options can be used |
参考文献
- Bhatt, S., et al. The global distribution and burden of dengue. Nature. 496 (7446), 504-507 (2014).
- Rogers, D. J., Wilson, A. J., Hay, S. I., Graham, A. J. The global distribution of yellow fever and dengue. Advances in Parasitology. 62 (05), 181-220 (2006).
- Chouin-Carneiro, T., et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus. PLoS Neglected Tropical Diseases. 10 (3), (2016).
- Guerbois, M., et al. Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Amercias. Journal of Infectious Diseases. 214 (9), 1349-1356 (2016).
- Weaver, S. C., et al. Zika virus: history, emergence, biology, and prospects for control. Antiviral Research. 130, 69-80 (2016).
- Attardo, G. M., Hansen, I. A., Raikhel, A. S. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny. Insect Biochemistry and Molecular Biology. 35 (7), 661-675 (2005).
- Duvall, L. B., Ramos-Espiritu, L., Barsoum, K. E., Glickman, J. F., Vosshall, L. B. Small-molecule agonists of Ae. aegypti neuropeptide Y receptor block mosquito biting. Cell. 176 (4), 687-701 (2019).
- Dimond, J. B., Lea, A. O., Hahnert, W. F., DeLong, D. M. The amino acids required for egg production in Aedes aegypti. The Canadian Entomologist. 88 (2), 57-62 (1956).
- Guerrero, D., Cantaert, T., Missé, D. Aedes mosquito salivary components and their effect on the immune response to arboviruses. Frontiers in Cellular and Infection Microbiology. 10, 1-11 (2020).
- Raquin, V., Lambrechts, L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology. 507, 75-81 (2017).
- Farjana, T., Tuno, N. Multiple blood feeding and host-seeking behavior in Aedes aegypti and Aedes albopictus (diptera: Culicidae). Journal of Medical Entomology. 50 (4), 838-846 (2013).
- Scott, T. W., Takken, W. Feeding strategies of anthropophilic mosquitoes result in increased risk of pathogen transmission. Trends in Parasitology. 28 (3), 114-121 (2012).
- Ross, P. A., Lau, M. J., Hoffmann, A. A. Does membrane feeding compromise the quality of Aedes aegypti mosquitoes. PLoS ONE. 14 (11), 1-19 (2019).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with wolbachia. Journal of Visualized Experiments. 2017 (126), 1-8 (2017).
- Briegel, H., Hefti, M., DiMarco, E. Lipid metabolism during sequential gonotrophic cycles in large and small female Aedes aegypti. Journal of Insect Physiology. 48 (5), 547-554 (2002).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A. S., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Pakes, S. P., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Deng, L., Koou, S. Y., Png, A. B., Ng, L. C., Lam-Phua, S. G. A novel mosquito feeding system for routine blood-feeding of Aedes aegypti and Aedes albopictus. Tropical Biomedicine. 29 (1), 169-174 (2012).
- Gunathilaka, N., Ranathunge, T., Udayanga, L., Abeyewickreme, W. Efficacy of blood sources and artificial blood feeding methods in rearing of Aedes aegypti (Diptera: Culicidae) for sterile insect technique and incompatible insect technique approaches in Sri Lanka. BioMed Research International. 2017, 3196924 (2017).
- Costa-da-Silva, A. L., et al. Glytube: a conical tube and parafilm M-based method as a simplified device to artificially blood-feed the Dengue vector mosquito, Aedes aegypti. PLoS ONE. 8 (1), 53816 (2013).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments. 83 (83), 1-10 (2014).
- Kogan, P. H. H. Substitute blood meal for investigating and maintaining Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 27 (4), 1-4 (1990).
- Gonzales, K. K., Hansen, I. A. Artificial diets for mosquitoes. International Journal of Environmental Research and Public Health. 13 (12), (2016).
- Baughman, T., et al. A highly stable blood meal alternative for rearing Aedes and Anopheles mosquitoes. PLoS Neglected Tropical Diseases. 11 (12), 0006142 (2017).
- Galun, R. Feeding stimuli and artificial feeding. Bulletin of the World Health Organization. 36, 590-593 (1967).
- Galun, R. Feeding response in Aedes aegypti: stimulation by adenosine triphosphate. Science. 142, 1674-1675 (1963).
- Jové, V., et al. Sensory Discrimination of Blood and Floral Nectar by Aedes aegypti Mosquitoes. Neuron. 108, 1-18 (2020).
- Petersen, M. T., et al. The impact of the age of first blood meal and Zika virus infection on Aedes aegypti egg production and longevity. PLoS ONE. 13 (7), 1-15 (2018).
- Sissoko, F., et al. Frequent sugar feeding behavior by Aedes aegypti in Bamako, Mali makes them ideal candidates for control with Attractive Toxic Sugar Baits (ATSB). PLoS ONE. 14 (6), 0214170 (2019).
- Houseman, J. G., Downe, A. E. R. Methods of measuring blood meal size and proteinase activity for determining the effects of mated state of digestive processes of female Aedes aegypti (L.) (Diperta: Culicidae). The Canadian Entomologist. 18, 241-248 (1986).
- Redington, B. C., Hockmeyer, W. T. A method for estimating blood meal volume in Aedes aegypti using a radioisotope. Journal of Insect Physiology. 22 (7), 961-966 (1976).
- Gonzales, K. K., et al. The effect of SkitoSnack, an artificial blood meal replacement, on Aedes aegypti life history traits and gut microbiota. Scientific Reports. 8 (1), 1-14 (2018).
- Klowden, M. J. The endogenous regulation of mosquito reproductive behavior. Experientia. 46 (7), 660-670 (1990).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 22486 (2013).
- Frances, S. P., Sithiprasasna, R., Linthicum, K. J. Laboratory evaluation of the response of Aedes aegypti and Aedes albopictus uninfected and infected with Dengue virus to Deet. Journal of Medical Entomology. 48 (2), (2011).
- Dennis, E. J., Goldman, O. V., Vosshall, L. B. Aedes aegypti mosquitoes use their legs to sense DEET on contact. Current Biology. 29 (9), 1551-1556 (2019).
- Harrington, L. C., et al. Heterogeneous feeding patterns of the Dengue vector, Aedes aegypti, on individual human hosts in rural Thailand. PLoS Neglected Tropical Diseases. 8 (8), 3048 (2014).
- Hol, F. J., Lambrechts, L., Prakash, M. BiteOscope, an open platform to study mosquito biting behavior. eLife. 9, 1-24 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved