Method Article
Fütterung und Quantifizierung von Tierblut und künstlichen Mahlzeiten in Aedes aegypti Mosquitoes
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Ziel dieses Protokolls ist es, tierische und künstliche Blutmahlzeiten an Aedes aegypti Mücken durch einen künstlichen Membran-Feeder zu liefern und das Volumen der aufgenommenen Mahlzeit genau zu quantifizieren.
Zusammenfassung
Weibchen bestimmter Mückenarten können Krankheiten verbreiten, während sie Wirbeltierwirte beißen, um proteinreiche Blutmahlzeiten zu erhalten, die für die Eientwicklung erforderlich sind. Im Labor können Forscher über Membranfeeder tierisch abgeleitete und künstliche Blutmahlzeiten an Mücken liefern, die eine Manipulation der Mehlzusammensetzung ermöglichen. Hier stellen wir Methoden zur Fütterung von Blut- und künstlichen Blutmahlzeiten an Aedes aegypti-Mücken vor und quantifizieren das Volumen, das von einzelnen Weibchen konsumiert wird.
Gezielte Fütterung und Quantifizierung von künstlichen/blutenden Mahlzeiten haben breite Verwendungsmöglichkeiten, einschließlich der Prüfung der Auswirkungen von Mehlbestandteilen auf das Verhalten und die Physiologie von Mücken, die Lieferung pharmakologischer Verbindungen ohne Injektion und die Infektion von Mücken mit spezifischen Krankheitserregern. Die Zugabe von Fluoresceinfarbstoff zur Mahlzeit vor der Fütterung ermöglicht eine anschließende Quantifizierung der Mehlgröße. Die von Mücken verbrauchte Mehlmenge kann entweder nach Gewicht gemessen werden, wenn die Weibchen später für Verhaltensexperimente verwendet werden sollen, oder durch Homogenisierung einzelner Weibchen in 96-Well-Platten und Messung von Fluoreszenzspiegeln mit einem Plattenleser als Endpunkttest. Die Quantifizierung der Mehlgröße kann verwendet werden, um festzustellen, ob die Änderung der Mahlzeitenbestandteile das aufgenommene Essensvolumen verändert oder ob sich der Verzehr von Mehl zwischen Mückenstämmen unterscheidet. Eine genaue Quantifizierung der Größe von Mahlzeiten ist auch für nachgelagerte Assays von entscheidender Bedeutung, z. B. bei der Messung von Auswirkungen auf die Wirtsattraktion oder Fruchtbarkeit. Die hier vorgestellten Methoden können weiter angepasst werden, um die Mahlzeitenverdauung im Laufe der Tage zu verfolgen oder mehrere unterscheidbare Marker, die verschiedenen Mahlzeiten (wie Nektar und Blut) hinzugefügt werden, um den Verzehr jeder Mahlzeit durch eine einzelne Mücke zu quantifizieren.
Diese Methoden ermöglichen es Forschern, im Alleingang Messungen mit hohem Durchsatz durchzuführen, um das von Hunderten von einzelnen Mücken verbrauchte Mehlvolumen zu vergleichen. Diese Instrumente werden daher für die Gemeinschaft der Mückenforscher im Großen und Ganzen nützlich sein, um verschiedene biologische Fragen zu beantworten.
Einleitung
Wir präsentieren ein Protokoll zur Fütterung modifizierter Blutmahlzeiten an Aedes aegypti-Mücken mit einem künstlichen Membran-Feeder und genau zur Messung der Von jeder einzelnen Mücke verbrauchten Mehlmenge. Dieses Protokoll kann flexibel angepasst werden, um den Inhalt der Mahlzeit zu ändern oder die Essensmenge zu vergleichen, die von verschiedenen experimentellen Mückengruppen verbraucht wird.
Die Ae. aegypti Mücke bedroht die globale Gesundheit durch die Verbreitung von Krankheitserregern, die Krankheiten wie Gelbfieber, Dengue-Fieber, Chikungunya und Zika1,2,3,4,5verursachen. Ae. aegypti Weibchen sind verpflichtete Blutfütterer; Sie müssen Wirbeltierblut konsumieren, um das notwendige Protein für die Eientwicklung zu erhalten, und jede Gemengelage von Eiern erfordert eine vollblutende Mahlzeit von mindestens einem Wirt6,7,8. Die weibliche Mücke beißt zuerst ihren Wirt, indem sie die Haut mit ihrem Stylet durchbohrt und Speichel injiziert, der Verbindungen enthält, die die Immunantwort des Wirts auslösen9. Sie ernährt sich dann, indem sie Blut durch ihren Stylet in ihr Mittelgut pumpt. Während sie eine Blutmahlzeit von einem infizierten Wirt konsumiert, kann sie blutübertragene Krankheitserreger6,8, die dann vom Mittelgut der Mücke zu ihren Speicheldrüsen wandern10. Weibliche Mücken, die auf diese Weise infiziert sind, können Krankheiten verbreiten, indem sie Krankheitserreger zusammen mit Speichel injizieren, wenn sie nachfolgende Wirte beißen11,12. Das Verständnis und die Quantifizierung der Mechanismen des Blutfütterungsverhaltens sind entscheidende Schritte bei der Kontrolle der Übertragung von durch Mücken übertragenen Krankheiten.
Viele Laborprotokolle für Diekundung und Experimente verwenden lebende Tiere wie Mäuse, Meerschweinchen oder Menschen als Blutquelle13,14,15,16. Die Verwendung lebender Tiere stellt ethische Bedenken sowie komplexe Anforderungen an die Ausbildung von Personal, die Unterbringung und Pflege von Tieren sowie die Einhaltung der Richtlinien des Institutional Animal Care and Use Committee (IACUC). Es begrenzt auch die Arten von Verbindungen, die an Mücken geliefert werden können, was die Studien einschränkt, die durchgeführt werden können17.
Künstliche Blutfütterungsgeräte, die in der Regel ein Membransystem verwenden, um die Wirtshaut zu simulieren, sind nützliche Werkzeuge zur Untersuchung von Blutfütterungsverhalten, die die Notwendigkeit der Aufrechterhaltung von lebenden Wirten umgehen. Vollblut kann von einer Reihe von Anbietern gekauft und mit beheizten, wasserummantelten künstlichen Membran-Feedern oder ähnlichen Geräten18,19an Mücken verfüttert werden. In diesem Protokoll zeigen wir die Verwendung von kleinen, Einweg-Membran-Feedern, die als "Glytubes" bezeichnet werden. Dieser Membran-Feeder, der zuvor von Costa-da-Silva et al. (2013)20veröffentlicht wurde, kann einfach aus Standard-Laborgeräten zusammengesetzt werden, was ihn ideal für die Lieferung von Blutmahlzeiten an eine moderate Anzahl von Mücken macht und einfach für die Prüfung größerer Gruppen oder mehrerer Mahlzeitenformulierungen skaliert werden kann. Die Glytube ist eine kostengünstige und effiziente Alternative zu anderen kommerziellen künstlichen Feedern, die größere Mehlmengen erfordern können und besser geeignet sind, große Mückengruppen auf einer einzigen Mahlzeit formulierung zu füttern21.
Dieses Protokoll umfasst zwei Abschnitte: Zubereitung/Lieferung künstlicher Mahlzeiten und Quantifizierung des Verbrauchs. Im ersten Abschnitt werden Glytubes als effizientes Mittel zur Bereitstellung manipulierter Diäten eingesetzt. Vollblut kann durch eine vollständig künstliche Mahlzeit ersetzt werden, um die Wirkung von Blutersatzstoffen anstelle einer Blutmahlzeit zu vergleichen. Ein Rezept von Kogan (1990)22 wird hier vorgestellt, obwohl mehrere künstliche Mahlzeit Formulierungen entwickelt wurden23,24. Darüber hinaus ist die Fütterung eine weniger invasive und weniger mühsame Methode, um pharmakologische Verbindungen einzuführen als Injektion. Aufgrund des geringen Gesamtvolumens für jede Mahlzeit (1–2 ml) bietet dieses Protokoll eine attraktive Liefermethode, um die Mengen an teuren Reagenzien zu reduzieren. Ae. aegypti Weibchen konsumieren leicht proteinfreie Mahlzeiten von Salinlösung mit Adenosin 5-Triphosphat (ATP)25,26, die eine Grundlage für die Messung der Auswirkungen von einzelnen Mahlzeiten Komponenten bietet. Zum Beispiel, Neuropeptid Y-like-Rezeptor 7 (NPYLR7) in Ae. aegypti ist dafür bekannt, Wirtssuche Unterdrückung nach einer proteinreichen Blutmahlzeit zu vermitteln, und wenn NPYLR7-Agonisten zu einer proteinfreien Herz-Darm-Mahlzeit hinzugefügt werden, zeigen weibliche Mücken Host-Seeking-Unterdrückung ähnlich denen, die Vollblut konsumiert haben7.
Im zweiten Abschnitt werden Schritte zur Quantifizierung des Volumens jeder Mahlzeit vorgestellt, die von einer einzelnen weiblichen Mücke verzehrt wird. Dieser Test ist fluoreszenzbasiert und erfasst den Fütterungsstatus in einer höheren Auflösung als Methoden, bei denen Frauen als "gefüttert" oder "ungefüttert" eingestuft werden, basierend auf einer visuellen Beurteilung der Abdominaldistension allein. Durch Zugabe von Fluorescein in die Mahlzeit vor der Fütterung können die von Einzelpersonen aufgenommenen Mehlmengen quantifiziert werden, indem jede Mücke in einer 96-Well-Platte homogenisiert und die Fluoreszenzintensität als Auslese gemessen wird. Dieser Test kann Unterschiede in der Fütterungskraft als Reaktion auf Variablen wie die Zusammensetzung des Mehls oder den genetischen Hintergrund der Mücken messen. Eine genaue Quantifizierung ist entscheidend für die mittleren Mahlzeitengrößen, z. B. wenn Frauen suboptimale Mahlzeiten angeboten werden, die Fütterungsabschreckung enthalten, oder wenn sie Saccharosemahlzeiten in variablen Größen27konsumieren. Wenn gefütterte Mücken für nachfolgende Verhaltenstests nach der Quantifizierung der Mahlzeitgröße benötigt werden, kann die Essensgröße stattdessen berechnet werden, indem anästhesierte Weibchen in Gruppen gewogen und die durchschnittliche erhöhte Masse pro Individuum geschätzt wird. Obwohl weniger präzise als die Fluorescein-Kennzeichnung, liefert das Wiegen immer noch eine aggregierte Schätzung des Mehlvolumens und ermöglicht die Untersuchung der Auswirkungen der Mahlzeit auf nachgelagerte Prozesse, wie Z. B. Fruchtbarkeit oder nachfolgende Wirtsattraktion. Während die Größe der Blutmahlzeit variabel ist und durch eine Vielzahl von Faktoren11,28,29beeinflusst werden kann, stimmen die hier beschriebenen Methoden mit den hier beschriebenen Methoden überein.
Protokoll
Blutfütterungsverfahren wurden nicht mit lebenden Tieren oder menschlichen Wirten durchgeführt und entsprachen den Richtlinien des Rockefeller University Institutional Animal Care and Use Committee (IACUC) und des Institutional Review Board (IRB).
1. Zubereitung von Mahlzeiten
- Zubereitung des Phagostimulans, Adenosin 5-Triphosphat
- Bereiten Sie eine 25 mM Lösung aus wässrigeM NaHCO3 (Molekulargewicht, MW = 84.006 g/mol) vor. Für 100 ml von 25 mM NaHCO3210 mg NaHCO3 zu einem volumetrischen Kolben hinzufügen und mit doppeldestilliertem Wasser (ddH2O) auf ein Gesamtvolumen von 100 ml füllen. Mit einem magnetischen Rührstab die Lösung gründlich mischen, bis sich der gesamte NaHCO3 aufgelöst hat.
- ATP-Dinatriumsalzhydrat (MW = 551,14 g/mol) im wässrigen 25 mM NaHCO3 auf eine Endkonzentration von 200 mM ATP rekonstituieren. Bei einem Gesamtvolumen von 10 ml von 200 mM ATP im 25 mM NaHCO3 Puffer 1,1 g ATP-Dinatriumsalzhydrat zu einem Volume-Kolben geben und mit 25 mM NaHCO3 Puffer auf ein Gesamtvolumen von 10 ml füllen. Mischen Sie die Lösung mit einem magnetischen Rührstab gründlich, bis sich der gesamte ATP aufgelöst hat.
HINWEIS: Um die Hydrolyse von ATP zu minimieren, muss es durch eine Salzlösung wie NaHCO3gepuffert werden. - Aliquot die ATP-Lösung und lagern Sie bei -20 °C.
HINWEIS: Diese Vorrat-Lösung von ATP wird in der Regel alle sechs Monate frisch gemacht und wird für alle mahlzeiten wie unten beschrieben verwendet. Um eine Verschlechterung zu verhindern, sollten ATP-Aliquots nicht mehrere Frost-Tau-Zyklen durchlaufen oder zusammen mit anderen Mahlzeitenkomponenten erhitzt werden.
- Vorbereitung der fluoreszierenden Tracerlösung Fluorescein
- Bereiten Sie eine 2% (w/v) Stammlösung aus wässrigem Fluorescein vor. Bei einem Gesamtvolumen der Lagerlösung von 10 ml 0,2 g Fluorescein-Dinatriumsalz mit 10 ml ddH2O in einem 15 ml konischen Rohr, das bei Raumtemperatur in Aluminiumfolie eingewickelt ist, mischen. Diese Vorrat-Lösung aus Fluorescein kann zur Verdünnung in allen unten beschriebenen Mahlzeiten verwendet werden.
HINWEIS: Da Fluorescein lichtempfindlich ist, vermeiden Sie lichtdurchdrungene Druckmittel, indem Sie Behälter in Aluminiumfolie wickeln.
- Bereiten Sie eine 2% (w/v) Stammlösung aus wässrigem Fluorescein vor. Bei einem Gesamtvolumen der Lagerlösung von 10 ml 0,2 g Fluorescein-Dinatriumsalz mit 10 ml ddH2O in einem 15 ml konischen Rohr, das bei Raumtemperatur in Aluminiumfolie eingewickelt ist, mischen. Diese Vorrat-Lösung aus Fluorescein kann zur Verdünnung in allen unten beschriebenen Mahlzeiten verwendet werden.
- Zubereitung von tierisch gewonnenen Blutmahlzeiten
- Berechnen Sie die Anzahl der Mahlzeiten, die benötigt werden, um alle Mücken zu füttern; Jede Glytube hält eine 2 ml Mahlzeit und ernährt sich von ca. 25 Mücken. Bereiten Sie eine zusätzliche Mahlzeit vor, um die Standardkurve für Fluoreszenzwerte zu kalibrieren. Sofern nicht anders angegeben, beschreiben alle Schritte in diesem Abschnitt die Reagenzmengen, die erforderlich sind, um eine Mahlzeit mit einem Endvolumen von 2 ml zuzubereiten.
- Für tierische Blutmahlzeiten 1,98–2 ml entfibriniertes Schafblut in ein 15 ml konisches Rohr (siehe Schritt 3.3 für das gewünschte Blutvolumen).
HINWEIS: Kommerziell defibrinierte Quellen von Wirbeltierblut, auch von Schafen, Meerschweinchen und Menschen, können verwendet werden13. Stellen Sie vor der Verwendung sicher, dass das gekaufte Blut sein Verfallsdatum nicht überschritten hat, und mischen Sie es gut, indem Sie die Flasche umkehren, insbesondere wenn eine sichtbare Trennung der Blutbestandteile vorliegt. - Für eine optimale Fütterung atp zu einer Endkonzentration von 1–2 mM hinzufügen, nachdem das Schafsblut in einem Wasserbad auf 45 °C erwärmt wurde. Für eine Endkonzentration von 1 mM ATP 10 l der 200 mM ATP-Lagerlösung zu 1,99 ml vorgewärmten Blut hinzufügen und mischen. Für eine Endkonzentration von 2 mM ATP 20 l des 200 mM ATP-Bestands auf 1,98 ml vorgewärmtes Blut und Mischen hinzufügen. Wenn ATP nicht hinzugefügt werden soll, 2 ml entblüfmtes Schafblut erwärmen.
- Soll anschließend eine fluoreszenzbasierte Quantifizierung der Mehlgröße durchgeführt werden, so fügen Sie die Fluoresceinlösung zu einer Endkonzentration von 0,002 % hinzu (2 l von 2 % Fluorescein-Bestand in 2 ml Gesamtmehlvolumen). Reduzieren Sie das Blutvolumen um die gleiche Menge wie das fluorescein hinzugefügt. Bewahren Sie 1 ml der endgültigen MahlzeitFormulierung mit 0,002% Fluorescein auf, um die Referenzstandardkurve zu erzeugen. Behandeln Sie das zurückgehaltene Volumen identisch mit der Mahlzeit, die an Mücken geliefert wird; während der gesamten Dauer des Experiments den gleichen Licht- und Temperaturbedingungen ausgesetzt sein und diese anschließend zusammen mit der gelieferten Mahlzeit einfrieren.
- Zubereitung von künstlichen Blutmahlzeiten
- Berechnen Sie die Anzahl der Mahlzeiten, die benötigt werden, um alle Mücken zu füttern; Jede Glytube hält eine 2 ml Mahlzeit und ernährt sich von ca. 25 Mücken. Bereiten Sie eine zusätzliche Mahlzeit vor, um die Standardkurve für Fluoreszenzwerte zu kalibrieren. Sofern nicht anders angegeben, beschreiben alle Schritte in diesem Abschnitt die Reagenzmengen, die für die Zubereitung einer Mahlzeit mit 2 ml erforderlich sind.
- Zur Herstellung von künstlichem Blut (angepasst von Kogan (1990)22), wie in Tabelle 1,machen Sie zunächst eine Lagerlösung von 400 mM NaHCO3. Bei einem Gesamtvolumen von 10 ml von 400 mM NaHCO3 (MW = 84.006 g/mol) 336 mg NaHCO3 zu einem Volumenkolben hinzufügen und mit doppeldestilliertem Wasser (ddH2O) auf ein Gesamtvolumen von 10 ml füllen. Mit einem magnetischen Rührstab die Lösung gründlich mischen, bis sich der gesamte NaHCO3 aufgelöst hat.
- Für die Proteinbestandteile von kunstkünstlichem Blut, bereiten Sie Lagerlösungen von 50 mg/ml γ-Globuline in 400 mM NaHCO3, 35 mg/ml Hämoglobin in ddH2O und 300 mg/ml Albumin in ddH2O. Protein-Stock-Lösungen können bei 4 °C für bis zu 2 Monate gelagert werden. Die Endkonzentration der gesamten menschlichen Proteine im künstlichen Blut beträgt 125 mg/ml. Dazu gehören Endkonzentrationen von 15 mg/ml γ-Globulinen, 8 mg/ml Hämoglobin und 102 mg/ml Albumin.
- Kombinieren Sie für jede Mahlzeit mit 2 ml 600 l γ-Globuline, 460 l Hämoglobin, 680 l Albumin und 250 l ddH2O aus den in Tabelle 1aufgeführten Bestandslösungen. Warten Sie, bis die Lösung mit 10 l 200 mM ATP-Lagerlösung unmittelbar nach dem Aufgewärmt auf 45 °C unmittelbar vor dem Vorbringen der Mahlzeit auf 45 °C aufgebracht wurde.
- Soll anschließend eine fluoreszenzbasierte Quantifizierung der Mehlgröße durchgeführt werden, so fügen Sie die Fluoresceinlösung zu einer Endkonzentration von 0,002 % hinzu (2 l von 2 % Fluorescein-Bestand in 2 ml Gesamtmehlvolumen). Reduzieren Sie das Volumen von ddH2O in Schritt 4.4 um die gleiche Menge wie das fluorescein hinzugefügt. Bewahren Sie mindestens 1 ml der endgültigen Mahlzeitformulierung mit 0,002% Fluorescein auf, um die Referenzstandardkurve zu erzeugen. Behandeln Sie das zurückgehaltene Volumen identisch mit der Mahlzeit, die an Mücken geliefert wird; während der gesamten Dauer des Experiments den gleichen Licht- und Temperaturbedingungen ausgesetzt sein und diese anschließend zusammen mit der gelieferten Mahlzeit einfrieren.
- Zubereitung von beispielhaft proteinfreien Saline-Mahlzeiten (angepasst an Duvall et al. (2019)7)
HINWEIS: Proteinfreie Saline-Mahlzeiten können auf verschiedene Arten zubereitet werden7,27,32. Die hier vorgestellte Kochselinenmahlzeit ist eine proteinfreie Version des oben beschriebenen künstlichen Blutrezepts.- Berechnen Sie die Anzahl der Mahlzeiten, die benötigt werden, um alle Mücken zu füttern; Jede Glytube hält eine 2 ml Mahlzeit und füttert etwa 25 Mücken Bereiten Sie eine zusätzliche Mahlzeit vor, um die Standardkurve für Fluoreszenzmessungen zu kalibrieren. Sofern nicht anders angegeben, beschreiben alle Schritte in diesem Abschnitt die Reagenzmengen, die für die Zubereitung einer Mahlzeit mit 2 ml erforderlich sind.
- Um die Saline-Mahlzeit zuzubereiten, machen Sie eine Lagerlösung von 400 mM NaHCO3. Bei einem Gesamtvolumen von 10 ml von 400 mM NaHCO3 (MW = 84.006 g/mol) 336 mg NaHCO3 zu einem Volumenkolben hinzufügen und mit ddH2O auf ein Gesamtvolumen von 10 ml füllen. Mit einem magnetischen Rührstab die Lösung gründlich mischen, bis sich der gesamte NaHCO3 aufgelöst hat.
- Für jede Mahlzeit von 2 ml in einem 15 ml konischen Rohr 600 l von 400 mM NaHCO3 mit 1,39 ml ddH2O kombinieren. Warten Sie, bis 10 l der 200 mM ATP-Lagerlösung hinzugefügt werden, bis die Mahlzeit in einem Wasserbad auf 45 °C erwärmt wurde.
- Soll anschließend eine fluoreszenzbasierte Quantifizierung der Mehlgröße durchgeführt werden, so fügen Sie die Fluoresceinlösung zu einer Endkonzentration von 0,002 % hinzu (2 l von 2 % Fluoresceinbestand in 2 ml Gesamtmehlvolumen). Reduzieren Sie das Volumen von ddH2O in Schritt 5.3 um die gleiche Menge wie das fluorescein hinzugefügt. Bewahren Sie mindestens 1 ml der endgültigen Mahlzeitformulierung mit 0,002% Fluorescein auf, um die Referenzstandardkurve zu erzeugen. Behandeln Sie das zurückgehaltene Volumen identisch mit der Mahlzeit, die an Mücken geliefert wird; während der gesamten Dauer des Experiments den gleichen Licht- und Temperaturbedingungen ausgesetzt sein und diese anschließend zusammen mit der gelieferten Mahlzeit einfrieren.
2. Essenslieferung an Mücken
- Aufstellen von Mückenbehältern für die Fütterung
HINWEIS: Mücken können in einer Vielzahl von Behältern gefüttert werden, solange die folgenden Kriterien erfüllt sind. Stellen Sie sicher, dass der Behälter groß genug ist, damit Mücken herumfliegen können, aber nicht so groß, dass es für die Mücken schwierig sein wird, die Netzoberfläche zu lokalisieren und mit der Fütterung zu beginnen. Das Netz, das zur Abdeckung des Behälters verwendet wird, kann in Material und Lochgröße variieren. Die Löcher müssen groß genug sein, damit die weibliche Mücke durchdringen kann, aber nicht so groß, dass die Mücke entkommen kann. Sichern Sie das Netz fest, so dass es straff ist, und die Glytube kann während der gesamten Fütterungszeit stabil auf ihrer Oberfläche ruhen.- Ein Beispielbehälter (Abbildung 1) ist ein modifizierter Kunststoffeimer aus Polyethylen hoher Dichte (HDPE) mit hoher Dichte (32 oz). Um dieses Setup zu replizieren, schneiden Sie mit einer Rasierklinge ein zentrales Loch von 10 cm Durchmesser in den Eimerdeckel. Um den Behälter für die Besetzung durch Mücken zu montieren, sichern Sie ein 2-cm-Quadratstück weißer 0,8 mm Polyester-Mückennetz auf dem Eimer und schieben Sie den perforierten Deckel sicher darüber, um ihn fest zu schnappen.
- Sammeln Sie weibliche Mücken, die mindestens 3 Tage nach der Eklat sind, um sicherzustellen, dass sie reif genug sind, um Blut zu füttern. Optimale Fütterungsraten werden nach 7 Tagen33beobachtet.
- Weibliche Mücken in den Behälter geben und mit Mesh bedecken. Wenn der Behälter dicht mit Mücken bevölkert ist, erhöhen Sie die Anzahl der verwendeten Glytubes. Die optimale Fütterung erfolgt mit 25 Mücken/Glytube. Dies reduziert den Wettbewerb um den Zugang zur Zuführmembran.
- Legen Sie eine Kontrollgruppe von ungeernährten Mücken beiseite, die keine Mahlzeit erhalten. Wiegen Sie im Gewichtsmessprotokoll die ungeernährte Gruppe separat und verwenden Sie dieses Gewicht, um die Gewichtszunahme in der Versuchsgruppe zu schätzen, die sich mit einer Mahlzeit ernährt. Fügen Sie im fluoreszenzbasierten Quantifizierungsprotokoll die ungeernährte Mückengruppe für die Standardkurvenberechnungen und für Negativkontrollen zu den Brunnen hinzu. Um die Basis-Mückengewebe-Autofluoreszenz in der experimentellen Gruppe abzugleichen, stellen Sie sicher, dass die Standardkurve und die negativen Kontrollbrunnen eine ungeernährte Mücke enthalten.
- Bau und Aufbau der Glytube (angepasst von Costa-da-Silva et al. (2013)20)
- Wie in Abbildung 1dargestellt, um eine Wärmequelle zu erzeugen, füllen Sie ein 50 ml kegelförmiges Rohr mit 40 ml 100% Glycerin. Versiegeln Sie das offene konische Rohr mit einem 5 cm × 5 cm Parafilm und wiederholen Sie es mit einem zusätzlichen Stück von 5 cm × 5 cm Parafilm, um die Wahrscheinlichkeit von Leckagen zu minimieren. Optional kann der Parafilm mit Gummibändern an Ort und Stelle gehalten werden. Invertieren Sie das Rohr, um sicherzustellen, dass es keine Löcher oder Lücken gibt.
- Um die Mahlabgabevorrichtung zu erstellen, schneiden Sie ein zentriertes Loch von 2,5 cm Durchmesser in den Schraubverschluss des konischen Rohres mit einer scharfen Rasierklinge oder, für eine bessere Konsistenz, eine Drehmaschine. Dehnen Sie eine 5 cm × 5 cm Parafilm gleichmäßig, so dass es sich ungefähr verdoppelt. Der Parafilm sollte so dünn sein, dass Mücken leicht durchsieben können, aber es sollte keine Lecks geben. Versiegeln Sie sich über die Außenfläche des Schraubverschlusses, um das Loch vollständig zu bedecken, und legen Sie die Kappe beiseite.
HINWEIS: Um die Anziehungskraft auf die Glytube zu erhöhen, bevor Sie den Parafilm dehnen, parfümieren Sie ihn mit menschlichem Geruch, indem Sie ihn sanft auf einen Fleck menschlicher Haut reiben, ohne dass Kosmetika aufgetragen werden, wobei darauf zu achten ist, dass keine Löcher entstehen. Dies wird empfohlen, wenn das Experiment nicht darauf abzielt, die sensorischen Hinweise zu untersuchen, die für Mücken erforderlich sind, um sich der Mahlzeit zu nähern. - Erhitzen Sie sowohl das versiegelte Glyzerinrohr als auch die Mahlzeit (mit allen Komponenten außer ATP) in einem 42–45 °C-Wasserbad für mindestens 15 min. ATP nicht vorheizen; fügen Sie es unmittelbar vor Beginn des Experiments hinzu.
- ATP der erwärmten Mahlzeit und dem Wirbel gründlich hinzufügen. 2 ml der erwärmten Mahlzeit in die Innenkammer des Schraubverschlusses geben und das invertierte, erwärmte, mit Glycerin gefüllte 50 ml konische Rohr vorsichtig hineinlegen. Schrauben Sie die Kappe mit der Mahlzeit teilweise auf das mit Glycerin gefüllte Rohr – gerade genug, um ein Auslaufen der Mahlzeit oder des Glycerins zu verhindern.
HINWEIS: Die verwendete Mahlzeit menge kann zwischen 1 ml und 2,5 ml liegen. Geringere Mengen können besonders nützlich sein, wenn Mahlzeiten verwendet werden, um Verbindungen zu liefern, die knapp oder teuer sind. Es ist wichtig, bei diesem Schritt schnell zu arbeiten, damit die Mahlzeit nicht auf Umgebungstemperatur abkühlt und die Wahrscheinlichkeit einer maximalen Fütterung verringert. Die Abkühlgeschwindigkeit hängt von der Umgebungstemperatur des Raumes ab, in dem diese Schritte durchgeführt werden, sollte aber in der Regel innerhalb von 5 min bei 25 °C abgeschlossen werden. - Legen Sie das montierte Glytube auf den Mückenbehälter und ermöglichen Sie den Mücken zugang zu Futter für mindestens 15 min, um maximale Fütterungsraten zu erreichen.
- Für eine optimale Fütterung mückenbehälter in eine Kammer mit einemCO2-Pad legen und mindestens 15 min Akklimatisierung bei 25–28 °C und 70–80% Luftfeuchtigkeit zulassen, bevor die Mahlzeit geliefert wird. Die hier verwendete Assaykammer ist eine einfache und kostengünstige Modifikation eines zuvor veröffentlichtenSetups 16. Es verwendet eine transluzente Polypropylen-Aufbewahrungsbox der Größe 36 cm L × 31 cm W × 32 cm H mit abnehmbarem Deckel. Ein Loch von 1,5 cm Durchmesser in der Kammerwand ermöglicht dieCO2-Abgabe durch Silikonschläuche. DasCO2-Diffusionspad wird an der Innenmitte des Deckels zur Abgabe von gereinigter Luft undCO2 angebracht, um die Kammeratmosphäre während des Versuchs zu konditionieren.
HINWEIS: Stellen Sie sicher, dass Wirtshinweise (Wärme und CO2, mit optionalem Wirtsgeruch16) vorhanden sind, damit die Mücken vom Membranförderer angezogen werden. Wenn Mücken nicht unter der Glytube drängen, überprüfen Sie, ob CO2 richtig geliefert wird und dass die Mahlzeit und Glytube ausreichend warm sind. Wenn keine externeCO2-Quelle verfügbar ist, kann CO2 über Puffs des ausgeatmeten menschlichen Atems abgegeben werden. - Nach der Fütterung kann die Glytube-Kappe als Bioabfall entsorgt oder nach dem Einweichen in eine niedrigprozentige Bleichlösung und dem gründlichen Spülen in Wasser wiederverwendet werden.
3. Quantifizierung der verbrauchten Mahlzeiten
- Wägemücken für weitere Experimente
HINWEIS: Das Wiegen von Mücken zur Quantifizierung der Mehlgröße ermöglicht es ihnen, für weitere Live-Experimente verwendet zu werden, aber diese Methode erfordert Gewichtsmessungen von einer Gruppe von 5 Mücken. Da gewichte einzelner Stechmücken mit den meisten Laborwaagen schwer genau zu messen sind, lässt sich die Variabilität der individuellen Mehlgröße nicht einfach durch Messung von Gewichten quantifizieren. Das Wiegen wird nur für Situationen empfohlen, in denen Weibchen sich sichtbar auf dem Essen veranlassen.- Kalte Anästhesisieren Mücken, indem sie ihren Behälter in einen 4 °C-Kälteraum bewegen oder auf Eis legen.
- Wiegen Sie Gruppen von 5 Weibchen aus der ungeernährten Kohorte (d. h. Mücken, denen nie eine Mahlzeit angeboten wurde) und berechnen Sie ihr Durchschnittsgewicht als Schätzung des "Vorfütterungsgewichts". Das durchschnittliche Gewicht einer ungeernährten Mücke hängt von Genotyp, Geschlecht und Aufzuchtbedingungen ab. Ungeseitte weibliche Ae. aegypti Mücken mit ad libitum Zugang zu Saccharose aufgezogen in der Regel wiegen etwa 2 mg pro.
- Aus der experimentellen Kohorte (d.h. Mücken, denen eine Mahlzeit angeboten wurde) sortieren Weibchen in "gefütterte" und "nicht gefütterte" Pfähle basierend auf der abdominalen Distension, die von Auge 7 beobachtbarist. Teilen Sie jeden der "gefütterten" und "nicht gefütterten" Pfähle bzw. in Gruppen von 5 Mücken zum Wiegen auf. Mücken innerhalb jeder Gruppe von 5 sollten aus derselben experimentellen Kohorte für Gruppengewichtsmessungen abgeleitet werden. Berechnen Sie das durchschnittliche Gewicht pro Frau aus jedem der "gefütterten" und "nicht gefütterten" Pfähle der Versuchsgruppe.
- Fluoreszenzmessung für Endpunktanalyse7,27,34
HINWEIS: Um präzise Messgrößen messungen an einzelnen Mücken zu erhalten, die für weitere Live-Experimente nicht mehr benötigt werden, lagern Sie die Mücken und die restlichen 1 ml Mehl mit 0,002 % Fluorescein bei -20 °C unmittelbar nach der Fütterung auf. Das Experiment kann hier angehalten werden. Diese Methode ist in Abbildung 2.- Um eine Referenzstandardkurve zu erzeugen, bereiten Sie eine serielle Verdünnung derselben Mahlzeit vor, die 0,002 % Fluorescein enthält, die der experimentellen Mückengruppe angeboten wurde. Es wird insgesamt 8 Standard-Kurvenlösungen geben. In jeder dieser Lösungen beträgt das endige Volumen der Mahlzeit, die 0,002% Fluorescein enthält, 5, 2,5, 1,25, 0,625, 0,3125, 0,15625, 0,078125 oder 0 L und jeweils 1x phosphatgepufferte Saline (PBS) für ein Gesamtvolumen von 100 l (z. B. 5 l Mehl mit 0,002 % Fluorescein in 95 l L von 1x PBS).
- Um die erste Lösung der Standardkurve zu machen, fügen Sie 50 l Mehl, das 0,002% Fluorescein enthält, bis 950 l 1x PBS und Wirbel gründlich hinzu (Endvolumen: 5 l Mehl mit 0,002 % Fluorescein in 95 l 1x PBS). Um den Rest der Standard-Kurvenlösungen zu erstellen, führen Sie für jeden Schritt eine 2-fache Verdünnung durch, indem Sie 500 l aus dem vorherigen Rohr nehmen und es zu einem neuen Rohr hinzufügen, das 500 l 1x PBS enthält. Wirbel gut vor der Vorbereitung der nächsten 2-fachverdünnung.
- Zur Vorbereitung von Brunnen, die zur Erzeugung einer Referenzstandardkurve verwendet werden können, wird in jeder der 8 Bohrungen in der ersten Spalte einer 96-Well-PCR-Platte jeweils 100 l pipette 100 l der Standardkurvenlösungen eingebracht. Fügen Sie 1 ungeernährte Kontrollmücke zu jedem der gleichen 8 Brunnen in der ersten Spalte der Platte hinzu. Wiederholen Sie dies in der zweiten Spalte der Platte für eine Replikationsmessung.
HINWEIS: Wenn Versuchsgruppen unterschiedliche Mahlzeiten angeboten werden, muss für jede Mahlzeit eine separate Referenzstandardkurve vorbereitet werden. - Fügen Sie 100 L 1x PBS in jedem verbleibenden Gut für die ungeernährten Kontroll- und Versuchsgruppen hinzu. Soll das Gewebe in den nachfolgenden Schritten mit einem Perlenmühlenhomogenisator oder Wirbel gestört werden, fügen Sie jedem Brunnen eine 3 mm Borosilikat-Festglasperle hinzu.
- Als Negativkontrolle, fügen Sie 1 ungeernährte Mücke zu jedem Brunnen in den nächsten 2 Spalten der Platte. Die in dieser Gruppe gemessene Fluoreszenz legt einen Basis-Cutoff fest, um die Gewebe-Autofluoreszenz zu berücksichtigen, und wird verwendet, um festzustellen, ob eine Mücke in der experimentellen Gruppe die Mahlzeit ernährt.
- Fügen Sie 1 Mücke pro Brunnen zu den verbleibenden Brunnen von den experimentellen Gruppen hinzu, denen eine Mahlzeit angeboten wurde.
- Versiegeln Sie die Platte sorgfältig und stören Sie das Gewebe durch manuelles Schleifen. Der Bauch sollte gründlich homogenisiert werden, um die Mahlzeit freizugeben. Zu den Methoden zur Gewebestörung gehören die Verwendung eines Perlenmühlenhomogenisators mit 3 mm Borosilikat-Festglasperlen (30 Hz für 30 Sekunden), einem Wirbelmischer mit 3 mm Borosilikat-Festglasperlen oder einem Stößelschleifer ohne Perlen.
- Zentrifugieren Sie die Platte bei 2000 U/min für 1-2 min, um das Lysat zu sammeln.
- Bereiten Sie eine schwarze 96-Well-Platte mit 180 l von 1x PBS in jedem Brunnen vor.
- Übertragen Sie 20 l Lysat auf jeden Brunnen mit 180 l 1x PBS und mischen. Wenn verfügbar, verwenden Sie bei diesem Schritt eine Mehrkanalpipette, um die Geschwindigkeit und die Konsistenz zu erhöhen.
- Messen Sie die Fluoreszenzintensität jedes Brunnens mit einem Plattenleser auf dem Anregungs-/Emissionskanal 485/520. Generieren Sie die Referenzstandardkurve, indem Sie das bekannte Mengenvolumen mit der entsprechenden Fluoreszenzintensitätsmessung messen.
- Mit Hilfe der erzeugten Referenzstandardkurve extrapolieren Sie das von jeder der experimentellen Mücken aufgenommene Mahlvolumen. Subtrahieren Sie die durchschnittliche Fluoreszenzintensitätsmessung der negativen Kontrollgruppe von ungeernährten Stechmücken von der Fluoreszenzintensitätsmessung jedes versuchsgreifenden Individuums, um die Basisgewebe-Autofluoreszenz zu korrigieren.
Ergebnisse
Abbildung 1 zeigt einen Schaltplan für die Montage der Glytube, während Abbildung 2 einen Überblick über das experimentelle Design zur Messung der Mehlgröße anhand des hier beschriebenen fluoreszenzbasierten Assays zeigt. Abbildung 3 enthält repräsentative Fluorescein-Messung der Größe von Fluorescein-Mahlzeiten aus einem Blutfütterungsexperiment. Abbildung 4, Abbildung 5und Abbildung 6 veranschaulichen eine Stichprobe biologischer Fragen, die mit diesem Protokoll behandelt werden können. Die Anwendung des Protokolls ist breit gefächert und umfasst die Veränderung der Zusammensetzung der Blutmahlzeiten, die Fütterung pharmakologischer Verbindungen, die präzise Quantifizierung suboptimaler Blutmahlzeiten oder kleinerer Nektarmahlzeiten und den Vergleich des Fütterungsverhaltens zwischen Mückengenotypen.
Um eine Standardkurve für Berechnung des Mahlvolumens zu erzeugen, werden Fluoreszenzwerte aus den ausgewiesenen Referenzbrunnen dargestellt, die jeweils eine ungeertete Mücke und ein bekanntes Volumen der Mahlzeit mit 0,002 % Fluorescein enthalten (Abbildung 3A). Fluoreszenzwerte aus den verbleibenden Brunnen, die Mücken entweder aus der negativ kontrollierten Gruppe der ungeernährten Mücken oder der experimentellen Gruppe von Mücken enthalten, die eine Mahlzeit angeboten haben, werden mit dieser Standardkurve verglichen, um das von jeder Mücke verbrauchte Mehlvolumen (L) zu quantifizieren(Abbildung 3B). Um die Ausgangswerte in diesem Test zu validieren, sollte bestätigt werden, dass Mücken aus der nicht gefütterten negativen Kontrollgruppe kein positiver Wert von -L verbraucht wird (Abbildung 3B, links). Obwohl allen Weibchen in der Versuchsgruppe die Blutmahlzeit angeboten wurde, fütterten einige Mücken (Abbildung 3B, Mitte) und einige nicht (Abbildung 3B, rechts). Dieses Ergebnis zeigt, dass aus diesem Protokoll zwei Arten von Daten gewonnen werden können: 1) der Prozentsatz der Weiblichen, die sich von einer bestimmten Mahlzeit ernähren, und 2) das Volumen, das von den Weibchen aufgenommen wird, die sich von einer bestimmten Mahlzeit ernähren.
Dieses Protokoll kann verwendet werden, um Mahlzeiten mit verschiedenen Proteinzusammensetzungen zu liefern und zu quantifizieren. Abbildung 4A,B zeigt Daten, die mit Mahlzeiten mit zugesetztem Fluorescein erhoben wurden. Der Anteil der gefütterten Mücken und das von ihnen aufgenommene Essensvolumen wurden aus den Fluoreszenzwerten berechnet. Diese Messwerte sind hochsensibel und ermöglichen eine präzise Quantifizierung von L, haben aber die Einschränkung, dass Mücken nicht für zukünftige Live-Experimente verwendet werden können. Abbildung 4C,D zeigt Daten aus einem unabhängigen Experiment mit Mücken, die nach dem Angebot von Mahlzeiten ohne Fluorescein als gefüttert oder nicht vom Auge gefüttert wurden. Die Essensgröße wurde als Durchschnittsgewicht/Weiblich aus Gruppen von 5 Mücken berechnet. Obwohl diese Gewichtsmessungen weniger empfindlich sind als Fluoreszenzmessungen, ermöglichen sie es, die Weibchen zu bergen und für weitere Live-Experimente zu verwenden. Der Anteil der Mücken, die sich ernähren, kann je nach Versuchstag variieren, wie abbildung 4A und Abbildung 4Cwiderspiegeln.
Abbildung 5 zeigt das Volumen der Mahlzeiten, die Medikamente enthalten, die das Verhalten des Mückenwirts regulieren. In diesen Experimenten wurden Den Weibchen Blut-, Saline- + ATP- oder Saline- + ATP-Mahlzeiten mit 100 M des menschlichen NPY Y2-Rezeptor-Agonisten TM30338 angeboten. Dieses Medikament verändert das wirtsuchende Verhalten durch Aktivierung von Ae. aegypti NPY-ähnliche Rezeptor 7. Die Messung der Essensgrößen ist entscheidend für die Interpretation von Experimenten, um die Wirkung dieses Medikaments auf das Verhalten nach dem Blutzuführen zu bewerten, da es dem Forscher ermöglicht, die von jedem Weibchen verbrauchte Dosis zu berechnen.
In den vorherigen Beispielen wurden Frauen entweder mit Blut oder Ersatzblutmahlzeiten gefüttert, die alle zu 3–5 L-Mahlzeiten führten(Abbildung 3, Abbildung 4, Abbildung 5). Dieser fluoreszenzbasierte Assay kann auch verwendet werden, um kleinere und/oder variablere Mehlgrößen zu messen, die nicht genau von den durchschnittlichen Gruppengewichtsmessungen zu unterscheiden sind. In Abbildung 6wurde das gleiche Fluoreszenzquantifizierungsprotokoll verwendet, um das Nektar-Fütterungsverhalten zu messen, indem das Glytube gegen eine mit 10 % Saccharose gesättigte Baumwollkugel mit 0,002% Fluorescein ausgetauscht wurde. Nektarzucker können nicht im Glytube-Test präsentiert werden, da Weibchen das Vorhandensein von Nektarzuckern mit dem Stylet nicht erkennen und keine Fütterung initiieren27. Diese Daten ermöglichen es dem Forscher, festzustellen, dass Zuckermahlzeiten im Einvernehmen mit früheren Arbeiten konstant kleiner sind als Blutmahlzeiten34 (Abbildung 6).

Abbildung 1: Einrichtung der Glytube-Methode zur Fütterung von Mücken. (A) Schemat eines dekonstruierten Glytube, das verwendet wird, um Blut und andere Mahlzeiten an Mücken zu füttern. (B) Schemat eines Glytube präsentiert auf einem Behälter von Mücken mit einem Netzdeckel. Weibliche Mücken können durch den Netzdeckel durchdringen, um sich zu ernähren. (C) Fotos der Glytube (oben) und der weiblichen Aedes aegypti-Mücken vor, während und nach der Fütterung (unten, von links nach rechts) auf einer von Glytube gelieferten Mahlzeit. Moskitos wird gezeigt, wie sie durch das Netz, das ihren Behälter bedeckt, durchdringen, um auf den Membranförderer zuzugreifen. (D) Fotografien, die das Aussehen von weiblichen Ae. aegypti-Mücken zeigen, die nicht gefüttert werden (links) und die sich entweder auf einer künstlichen Blutmahlzeit (rechts, oben) oder einer kochigen + ATP-Mahlzeit (rechts, unten) eingeschlichen haben. Die Glytube-Methode wurde bereits in Costa-da-Silva et al. (2013)20veröffentlicht. Fotos in (C) und (D) sind mit freundlicher Genehmigung von Alex Wild. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
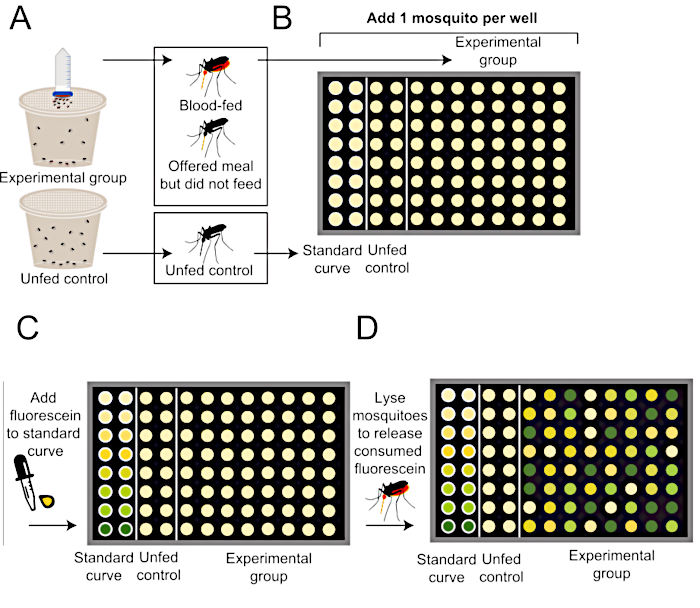
Abbildung 2: Schematische Quantifizierung der Essensgröße nach Glytube-Blutfütterungsprotokoll. (A) Moskitos wird eine Mahlzeit mit Fluorescein (obere, experimentelle Gruppe) oder keine Mahlzeit (untere, ungeernährte negative Kontrollgruppe) angeboten. (B) Einzelne Mücken werden nach Beendigung des Fütterungsexperiments einer 96-Well-Platte zugesetzt. (C) Die Standardkurve wird unter Verwendung bekannter Mengen von Mehl mit 0,002 % Fluorescein erzeugt. (D) Mücken werden homogenisiert, um verbrauchtes Fluorescein freizusetzen, und die Fluoreszenzspiegel in jedem Brunnen werden mit einem Plattenleser quantifiziert. Diese Fluoreszenzquantifizierungsmethode wird von Liesch et al. (2013)34modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
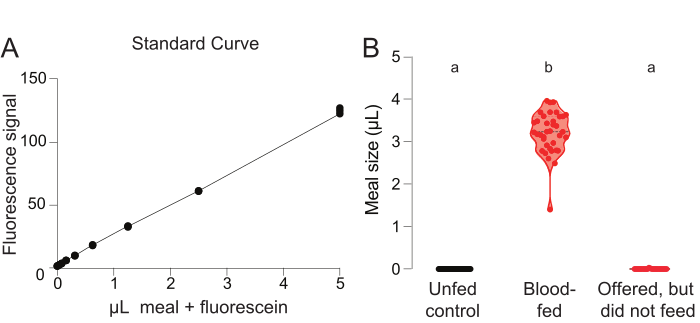
Abbildung 3: Glytube-Blutfütterungsexperiment mit fluoresceinbasierter Quantifizierung. (A) Standardkurvenmessungen aus den Brunnen, in denen eine Mücke aus der nicht gefütterten Kontrollgruppe einer bekannten Menge von Mehl zugesetzt wurde, die 0,002 % Fluorescein enthält (y-Achsenskala = beliebige Einheiten). (B) Das Mitnahmevolumen wurde unter Verwendung von Fluoreszenzwerten für Frauen in der nicht gefütterten Kontrollgruppe (links, schwarz, n = 40), der experimentellen Gruppe, die sich mit Blut ernährte (Mitte, Rot, n = 37), und der experimentellen Gruppe, die sich nicht von Blut ernährte (rechts, rot, n = 23), berechnet. Jeder Punkt stellt eine Messung von einem einzelnen Weibchen dar. Die Daten werden als Median mit Bereich angezeigt. Buchstaben zeigen statistisch unterschiedliche Gruppen an, Kruskal-Wallis-Test mit Dunns Mehrfachvergleich, p<0.01. Diese Daten wurden in Jové et al. (2020)27veröffentlicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
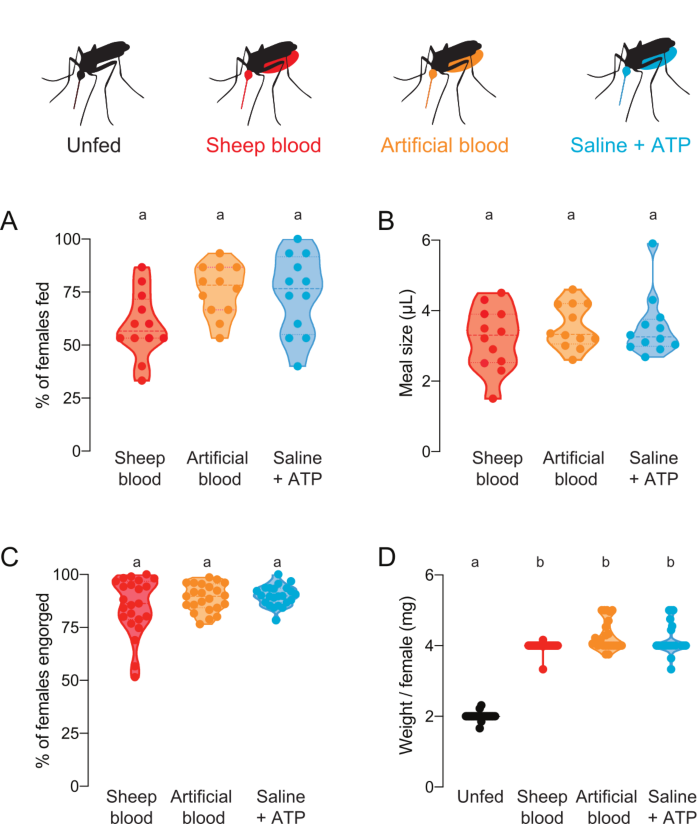
Abbildung 4: Quantifizierung von Mahlzeiten mit unterschiedlicher Proteinzusammensetzung. Den Weibchen wurden Mahlzeiten entweder schafsblut (rot), künstliches Blut mit menschlichen Blutproteinen (Kogan (1990)22) (Orange) oder proteinfreie Saline + ATP-Mahlzeit (Aqua)7angeboten. (A) Der Anteil der mit Fluoreszenzmessungen bewerteten Frauen wurde bewertet. Jeder Punkt stellt eine Gruppe von 12 bis 16 Frauen dar. Die Daten werden als Mediane mit Bereichen n = 12 angezeigt. (B) Das mit Fluoreszenzmessungen berechnete Mahlvolumen. Jeder Punkt stellt eine Messung einer einzelnen Frau in einer einzigen Studie aus Abbildung 4A dar. Die Daten werden als Mediane mit Bereichen n = 12 angezeigt. (C) Anteil der Weibchen vollständig nach künstlicher Membranfütterung, bewertet durch Auge. Jeder Punkt stellt den Prozentsatz der Frauen dar, die aus Gruppen von 20 bis 30 Frauen stammen. Die Daten werden als Mediane mit Bereichen n = 23 angezeigt. (D) Die Als Gewicht/Weiblich bewerteten Mahlzeiten größen wurden nach dem Fütterungsstatus per Auge bewertet. Gewichte wurden als Durchschnitt der Gruppen von 5 Mücken berechnet. Die Daten werden als Mediane mit Bereichen n = 23 angezeigt. A–D: Buchstaben zeigen statistisch unterschiedliche Gruppen an, Kruskal-Wallis-Test mit Dunns Mehrfachvergleich, p<0.05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
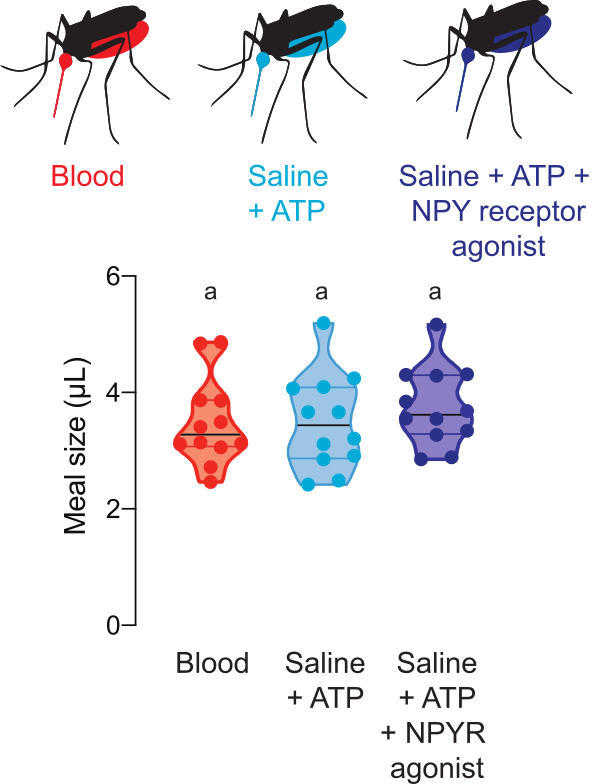
Abbildung 5: Quantifizierung von Mahlzeiten mit pharmakologischen Verbindungen. Weibchen konsumieren Mahlzeiten der gleichen Größe von Schafsblut (rot), Saline + ATP (aqua) und Saline + ATP + 100 M Dosis des menschlichen NPY Y2-Rezeptor-Agonisten TM30338 (dunkelblau). Das Mitnutzen des Mehlvolumens wird anhand von Fluoreszenzwerten berechnet. Jeder Punkt stellt eine Messung von einem einzelnen Weibchen dar. Die Daten werden als Mediane mit Bereichen n = 12 angezeigt. Buchstaben zeigen statistisch unterschiedliche Gruppen an, Kruskal-Wallis-Test mit Dunns Mehrfachvergleich, p<0.05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Quantifizierung kleinerer Nektarmahlzeiten. (A) Schematic des Nektar-Fütterungs-Assays. (B) Das mit Fluoreszenzmessungen berechnete Mahlvolumen für Wildweibchen bot Mahlzeiten entweder mit Wasser (blau, n = 36) oder 10 % Saccharose (grün, n = 53), jeweils mit 0,002 % Fluorescein, im Nektar-Fütterungstest an. Jeder Punkt stellt eine Messung von einem einzelnen Weibchen dar. Daten werden als Mediane mit Bereichen angezeigt. Buchstaben geben statistisch unterschiedliche Gruppen an, Mann-Whitney-Test, p<0.05. Diese Daten wurden in Jové et al. (2020)27veröffentlicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Künstliche Blutmahlzeit | |||
| Konzentration der Lagerlösung (mg/ml) | Volumen der Lagerlösung in Dermahlzeit (L/ml) | Endmahlzeitkonzentration (mg/ml) | |
| Proteinkomponenten* | |||
| γ-Globulins | 50 | 300 | 15 |
| Hämoglobin | 35 | 230 | 8 |
| Albumin | 300 | 340 | 102 |
| Gesamtprotein | - | - | 125 |
| Nicht-Protein-Komponenten | |||
| Konzentration der Lagerlösung (mM) | Volumen der Lagerlösung in Dermahlzeit (L/ml) | Endmahlzeitkonzentration (mM) | |
| Nacl | In γ-Globulin-Bestand | - | 5-10 |
| NaHCO3 | In γ-Globulin-Bestand | - | 120 |
| Atp | 200 | 5 | 1 |
| Wasser | - | 125 | - |
| *Proteinkomponenten werden in Stammlösung aus doppelt destilliertem Wasser hergestellt, mit Ausnahme von γ-Globulinen, die in 400 mM NaHCO3 gelöst werden und eine variable Menge an NaCl (2-4%) enthalten. im Produkt. | |||
Tabelle 1: Rezept für die Zubereitung von künstlichen Blutmahlzeiten (angepasst an Kogan (1990)22). Künstliches Blut besteht aus Protein- und Nicht-Protein-Komponenten, die regelmäßig im menschlichen Blut gefunden werden, und bietet die Möglichkeit, die Verhältnisse dieser Komponenten zu variieren. Mücken können Eier produzieren, nachdem sie sich von künstlichem Blut ernährt haben7,22.
| Saline-Mahlzeit | |||
| Komponente | Konzentration der Lagerlösung (mM) | Volumen der Lagerlösung in Dermahlzeit (L/ml) | Endmahlzeitkonzentration (mM) |
| Nacl | - | - | - |
| NaHCO3 | 400 | 300 | 120 |
| Atp | 200 | 5 | 1 |
| Wasser | - | 695 | - |
Tabelle 2: Rezept für Kochzimmer mit ATP (angepasst von Duvall et al. (2019)7). Proteinfreie Kochchenkönnen können verwendet werden, um Verbindungen von Interesse an Mücken zu liefern, während sie immer noch die Abdominaldistension imitieren, die nach der Blutfütterung auftritt, aber ohne die Eientwicklung auszulösen, die auftritt, wenn Proteine aufgenommen werden.
Diskussion
Für viele Laboranwendungen bieten künstliche Membran-Feeder deutliche Vorteile im Vergleich zu Live-Hosts, da forschern die Möglichkeit bietet, den Inhalt der Mahlzeit direkt zu manipulieren. Obwohl mehrere Methoden für die künstliche Membranzuführung zur Verfügung stehen, bietet das hier beschriebene Verfahren Vorteile in Den usa, kosten, kostenund durchsatz. Im Vergleich zu anderen kommerziellen Membran-Feedern benötigt der Glytube-Assay ein kleines Mehlvolumen, was ihn zu einem effizienten Abgabemechanismus für kostspielige Reagenzien, einschließlich Medikamente oder Krankheitserreger, macht, indem er das erforderliche Gesamtvolumenvon 7,35minimiert. Da sowohl die proteinfreie, aber auch die künstliche Blutszufuhr die Engorgement fördern, können entweder Verbindungen oder Krankheitserreger als hochdurchsatz- und nicht-invasive Alternative zu Injektionen zu einer Mahlzeit hinzugefügt werden. Darüber hinaus kann jede Komponente des Glytube leicht gewaschen, ersetzt oder skaliert werden, um mehrere Mehlarten ohne Kreuzkontamination des Fütterungsgeräts zu liefern und zu quantifizieren.
Um die von Mücken verbrauchten Mehlmengen zu quantifizieren, ermöglicht die fluoreszenzbasierte Methode eine genauere Quantifizierung der Mehlgröße als das Wiegen der Mücken vor und nach der Fütterung. Es sollte beachtet werden, dass diese Methode ein Endpunkt-Assay ist. Im Gegensatz dazu ermöglicht das Wiegen, die Mücken für weitere Experimente am Leben zu erhalten. Durch die Verwendung eines Plattenlesers kann die fluoreszenzbasierte Methode leicht für die Quantifizierung von Mahlzeiten mit hohem Durchsatz skaliert werden, die von Hunderten von einzelnen Frauen konsumiert werden.
Um hohe Fütterungsraten zu erreichen, muss eine Kombination von ausreichenden Wirtshinweisen vorhanden sein, um das verhalten der weiblichen Wirtssuche zu aktivieren und Weibchen zum Feeder zu locken. Wenn mückenbehaftet unter der Glytube nicht vergedoren, wird die Mahlzeit möglicherweise nicht richtig erwärmt, oder dieCO2-Zustellung reicht möglicherweise nicht aus. Die Zugabe von menschlichem Geruch zur Membranoberfläche erhöht zuverlässig die Attraktivität der künstlichen Membran. Wenn Mücken unter dem Glytube beobachtet werden, aber nicht füttern, kann die Zusammensetzung des Essens schuld sein. Weibchen dürfen sich nicht ernähren, wenn die Mahlzeit selbst nicht warm ist, das Blut zu alt ist oder wenn die Zusatzstoffe zur Mahlzeit an sich aversiv sind oder eine unerwünschte chemische Reaktion verursachen36. Zusätzliche ATP erhöht auch zuverlässig die Fütterungsraten und kann in jeder der bereitgestellten Rezepturen auf eine Endkonzentration von 2 mM skaliert werden. Weibchen dürfen nicht füttern, wenn der Parafilm nicht straff über die Glytube-Kappe gezogen wird; Der Parafilm sollte gleichmäßig transparent sein und nicht einknicken, da dies verhindert, dass das Weibchen den Parafilm mit ihrem Stylet effektiv durchbohren kann. Wenn die Mahlzeit durch das Glytube auf das Netz austritt, kann der Parafilm während des Dehnprozesses gerissen sein und sollte ersetzt werden.
Eine Änderung der Essenszusammensetzung kann es den Forschern auch ermöglichen, die Zeit, die benötigt wird, um die Mahlzeit vom Mittelgut zu befreien, sowie das anschließende Wirtssuchverhalten zu manipulieren. Die hier vorgestellten Mahlzeiten benötigen 24–36 h für die Verdauung7 ähnlich wie tierisches Blut. Nach der Fütterung von einer dieser Mahlzeiten, Weibchen werden Host-Suche während der Verdauung Zeitfenster unterdrücken. Da es der Salinemahlzeit an Protein fehlt, kehren die Weibchen nach dem Essen zur Wirtssuche zurück. Wenn eine schnellere Rückkehr wünschenswert ist, können die Forscher alternative "Schnellclearing" Saline-Mahlzeiten wählen, die in etwa 6 h27ausgeschieden werden. Während die Zusammensetzung der hier vorgestellten Kochsalzlösung auf einen direkten Vergleich der Ergebnisse mit der künstlichen Blutmahlzeit abgestimmt ist, entspricht die "Schnelllicht"-Mahlzeit den physiologischen Salzwerten im Wirbeltierblut.
Die hier beschriebenen Methoden haben Einschränkungen, die vor der Auswahl des Assays berücksichtigt werden sollten, der am besten zu den experimentellen Zielen des Forschers geeignet ist. Die beschriebenen Fluoresceinmessungen erlauben es nicht, Mücken erneut für zusätzliche Experimente zu verwenden. Gewichtsmessungen können jedoch vor der Quantifizierung der Größe der Mahlzeit mit dem Fluorescein-Test durchgeführt werden. Wenn Gewicht und Größe der Mahlzeit in mehreren Versuchen für eine bestimmte Mahlzeit konsistent sind, kann das Gewicht als Proxy in zukünftigen Experimenten verwendet werden. Darüber hinaus unterscheidet dieses Protokoll nicht zwischen Defiziten bei der Wirtssuche und dem Blutfütterungsverhalten; Mücken, die Bei der Suche nach dem Membranzubringer Beeinträchtigungen aufweisen, haben eine Verringerung der Fütterungsraten und/oder der Essensgröße. Durch hinzufügen einer Kamera, um das Verhalten während des gesamten Assays aufzuzeichnen, können die Forscher feststellen, ob die Weibchen die Glytube nicht finden können, oder ob sie die Glytube finden, aber nicht füttern.
Der hier beschriebene Test kann angepasst werden, um viele offene Fragen im Zusammenhang mit dem Fütterungsverhalten bei Mücken zu untersuchen. Beispielsweise kann der Beitrag bestimmter Blutproteine untersucht werden, indem das Verhältnis von konstituierenden Proteinen oder die Gesamtproteinkonzentration in der künstlichen Blutmahlzeit verändert wird. Um die Größe der Mahlzeiten aus mehreren Fütterungsereignissen zu bewerten, können Farbstoffe mit ausgeprägten Fluoreszenzspektren hinzugefügt werden, um Mahlzeiten von einzigartigen Quellen zu unterscheiden37. Dieses Protokoll kann auch modifiziert werden, um die inneren Mundpartien, die Blut erkennen und die für die Einnahme verwendet werden (d. h. Stylet), und die chemosensorischen Anhängsel, die Haut (d. h. Labium, Beine) als Mückenland, um mit der Blutfütterung zu beginnen, getrennt zu stimulieren36. Wenn z. B. Liganden direkt zur Mahlzeit hinzugefügt werden, treten sie nicht mit dem Labium und den Beinen in Kontakt, da die Membran nur durch den Stylet durchbohrt wird. Wenn stattdessen Liganden zur Außenfläche des Parafilms hinzugefügt werden, bleiben sie von der Mahlzeit getrennt und können durch das Labium und die Beine36kontaktiert werden. Schließlich ist die detaillierte Kinetik des Blutfütterungsverhaltens nicht gut verstanden und die hier vorgestellte Methode könnte modifiziert werden, um hochauflösendes Tracking mit maschinellen Lernwerkzeugen zu kombinieren, um Verhaltensauslesungen von Fortbewegung, Haltung und Fütterungsdynamik zu extrahieren38.
Dieses Protokoll zielt darauf ab, benutzerfreundlich und kostengünstig zu sein, mit der Fähigkeit, Forschern zu dienen, die pharmakologische und genetische Manipulationen anwenden, um Mückenblutfütterung und Verhalten nach dem Blut zu untersuchen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Nipun Basrur, Adriana K. Rosas Villegas, Nadav Shai und Trevor Sorrells für die Kommentare zu den Manuskripten und Zhongyan Gong und Kyrollos Barsoum für die technische Unterstützung. Wir danken Alex Wild für die Fotos, die in Abbildung 1verwendet werden. Unterstützt wurde K.V. vom Boehringer Ingelheim Fonds PhD Fellowship. V.J. wurde teilweise von NIH T32-MH095246 unterstützt. Diese Arbeit wurde teilweise durch ein Stipendium der Rockefeller University vom Howard Hughes Medical Institute durch das James H. Gilliam Fellowships for Advanced Study Program an V.J. unterstützt. Dieses Material basiert auf Arbeiten, die vom National Science Foundation Graduate Research Fellowship Program unter Grant No. NSF DGE-1325261 zu V.J. Alle Meinungen, Erkenntnisse und Schlussfolgerungen oder Empfehlungen, die in diesem Material zum Ausdruck kommen, sind die des/der Autoren und spiegeln nicht unbedingt die Ansichten der National Science Foundation wider.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | Fisher Scientific | 14-959-70C | |
| 3 mm diameter borosilicate solid-glass bead | MilliporeSigma | Z143928 | For use for bead mill homogenizer; not required if using pellet pestle grinder |
| 32 oz. high-density polyethylene (HDPE) plastic cup | VWR | 89009-668 | Example mosquito container used for feeding assays shown; alternate options can be used |
| 50 mL conical tubes | Fisher Scientific | 14-959-49A | |
| 96-well black polystyrene plate | ThermoFisher | 12-566-09 | |
| 96-well PCR plate sealing film | Bio-Rad | MSB1001 | Alternate options can be used |
| 96-well PCR plates | Bio-Rad | HSP9621 | Alternate options can be used |
| Adenosine 5′-triphosphate (ATP) disodium salt hydrate | MilliporeSigma | A6419 | |
| Albumin (human serum) | MilliporeSigma | A9511 | |
| Aluminum foil | Fisher Scientific | 01-213 | Alternate options can be used to block light entering fluorescein container |
| Balance | Fisher Scientific | 01-911 | Alternate options can be used |
| Bead mill homogenizer | Qiagen | 85300 | Not required if using pellet pestle grinder |
| Cotton ball | Fisher Scientific | 22456880 | For nectar-feeding; alternate options can be used |
| Defibrinated sheep blood | Hemostat Laboratories | DSB100 | Alternate options can be used |
| Drosophila CO2 fly pad | Tritech Research | MINJ-DROS-FP | Alternate options can be used |
| Fluorescein | MilliporeSigma | F6377 | |
| Fluorescence plate-reader | ThermoFisher | VL0000D0 | Alternate options can be used |
| Gamma-globulin (human blood) | MilliporeSigma | H7379 | |
| Glycerol | MilliporeSigma | G7893 | |
| Hemoglobin (human) | MilliporeSigma | G4386 | |
| Laboratory wrapping film - parafilm | Fisher Scientific | 13-374 | |
| Magnetic stirrer | Fisher Scientific | 90-691 | Alternate magnetic stirrers can be used |
| Microcentrifuge for 96-well plate | VWR | 80094-180 | Alternate options can be used |
| Microcentrifuge Tubes | MilliporeSigma | 2236412 | Alternate options can be used |
| Pellet pestle grinder | VWR | KT749521-1500 | Not required if using bead mill homogenizer |
| Phosphate buffered solution (PBS) | Fisher Scientific | BW17-516F | Optional |
| Razor blades | Fisher Scientific | 12-640 | Alternate options can be used, such as a lathe for better consistency of cutting |
| Rubber bands | |||
| Silicone tubing | McMaster Carr | Needed if using a fly pad for CO2 delivery | |
| Sodium bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Sodium chloride (NaCl) | MilliporeSigma | S9888 | |
| Stir bars | Fisher Scientific | 14-512 | Alternate magnetic stir bars can be used |
| Translucent polypropylene storage box with removable lid | Example box used for feeding assays shown | ||
| Vortex mixer | |||
| Water bath | Alternate heating device may be used | ||
| White 0.8 mm polyester mosquito netting | American Home & Habit Inc. | F03A-PONO-MOSQ-M008-WT | Alternate options can be used |
Referenzen
- Bhatt, S., et al. The global distribution and burden of dengue. Nature. 496 (7446), 504-507 (2014).
- Rogers, D. J., Wilson, A. J., Hay, S. I., Graham, A. J. The global distribution of yellow fever and dengue. Advances in Parasitology. 62 (05), 181-220 (2006).
- Chouin-Carneiro, T., et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus. PLoS Neglected Tropical Diseases. 10 (3), (2016).
- Guerbois, M., et al. Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Amercias. Journal of Infectious Diseases. 214 (9), 1349-1356 (2016).
- Weaver, S. C., et al. Zika virus: history, emergence, biology, and prospects for control. Antiviral Research. 130, 69-80 (2016).
- Attardo, G. M., Hansen, I. A., Raikhel, A. S. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny. Insect Biochemistry and Molecular Biology. 35 (7), 661-675 (2005).
- Duvall, L. B., Ramos-Espiritu, L., Barsoum, K. E., Glickman, J. F., Vosshall, L. B. Small-molecule agonists of Ae. aegypti neuropeptide Y receptor block mosquito biting. Cell. 176 (4), 687-701 (2019).
- Dimond, J. B., Lea, A. O., Hahnert, W. F., DeLong, D. M. The amino acids required for egg production in Aedes aegypti. The Canadian Entomologist. 88 (2), 57-62 (1956).
- Guerrero, D., Cantaert, T., Missé, D. Aedes mosquito salivary components and their effect on the immune response to arboviruses. Frontiers in Cellular and Infection Microbiology. 10, 1-11 (2020).
- Raquin, V., Lambrechts, L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology. 507, 75-81 (2017).
- Farjana, T., Tuno, N. Multiple blood feeding and host-seeking behavior in Aedes aegypti and Aedes albopictus (diptera: Culicidae). Journal of Medical Entomology. 50 (4), 838-846 (2013).
- Scott, T. W., Takken, W. Feeding strategies of anthropophilic mosquitoes result in increased risk of pathogen transmission. Trends in Parasitology. 28 (3), 114-121 (2012).
- Ross, P. A., Lau, M. J., Hoffmann, A. A. Does membrane feeding compromise the quality of Aedes aegypti mosquitoes. PLoS ONE. 14 (11), 1-19 (2019).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with wolbachia. Journal of Visualized Experiments. 2017 (126), 1-8 (2017).
- Briegel, H., Hefti, M., DiMarco, E. Lipid metabolism during sequential gonotrophic cycles in large and small female Aedes aegypti. Journal of Insect Physiology. 48 (5), 547-554 (2002).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A. S., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Pakes, S. P., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Deng, L., Koou, S. Y., Png, A. B., Ng, L. C., Lam-Phua, S. G. A novel mosquito feeding system for routine blood-feeding of Aedes aegypti and Aedes albopictus. Tropical Biomedicine. 29 (1), 169-174 (2012).
- Gunathilaka, N., Ranathunge, T., Udayanga, L., Abeyewickreme, W. Efficacy of blood sources and artificial blood feeding methods in rearing of Aedes aegypti (Diptera: Culicidae) for sterile insect technique and incompatible insect technique approaches in Sri Lanka. BioMed Research International. 2017, 3196924 (2017).
- Costa-da-Silva, A. L., et al. Glytube: a conical tube and parafilm M-based method as a simplified device to artificially blood-feed the Dengue vector mosquito, Aedes aegypti. PLoS ONE. 8 (1), 53816 (2013).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments. 83 (83), 1-10 (2014).
- Kogan, P. H. H. Substitute blood meal for investigating and maintaining Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 27 (4), 1-4 (1990).
- Gonzales, K. K., Hansen, I. A. Artificial diets for mosquitoes. International Journal of Environmental Research and Public Health. 13 (12), (2016).
- Baughman, T., et al. A highly stable blood meal alternative for rearing Aedes and Anopheles mosquitoes. PLoS Neglected Tropical Diseases. 11 (12), 0006142 (2017).
- Galun, R. Feeding stimuli and artificial feeding. Bulletin of the World Health Organization. 36, 590-593 (1967).
- Galun, R. Feeding response in Aedes aegypti: stimulation by adenosine triphosphate. Science. 142, 1674-1675 (1963).
- Jové, V., et al. Sensory Discrimination of Blood and Floral Nectar by Aedes aegypti Mosquitoes. Neuron. 108, 1-18 (2020).
- Petersen, M. T., et al. The impact of the age of first blood meal and Zika virus infection on Aedes aegypti egg production and longevity. PLoS ONE. 13 (7), 1-15 (2018).
- Sissoko, F., et al. Frequent sugar feeding behavior by Aedes aegypti in Bamako, Mali makes them ideal candidates for control with Attractive Toxic Sugar Baits (ATSB). PLoS ONE. 14 (6), 0214170 (2019).
- Houseman, J. G., Downe, A. E. R. Methods of measuring blood meal size and proteinase activity for determining the effects of mated state of digestive processes of female Aedes aegypti (L.) (Diperta: Culicidae). The Canadian Entomologist. 18, 241-248 (1986).
- Redington, B. C., Hockmeyer, W. T. A method for estimating blood meal volume in Aedes aegypti using a radioisotope. Journal of Insect Physiology. 22 (7), 961-966 (1976).
- Gonzales, K. K., et al. The effect of SkitoSnack, an artificial blood meal replacement, on Aedes aegypti life history traits and gut microbiota. Scientific Reports. 8 (1), 1-14 (2018).
- Klowden, M. J. The endogenous regulation of mosquito reproductive behavior. Experientia. 46 (7), 660-670 (1990).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 22486 (2013).
- Frances, S. P., Sithiprasasna, R., Linthicum, K. J. Laboratory evaluation of the response of Aedes aegypti and Aedes albopictus uninfected and infected with Dengue virus to Deet. Journal of Medical Entomology. 48 (2), (2011).
- Dennis, E. J., Goldman, O. V., Vosshall, L. B. Aedes aegypti mosquitoes use their legs to sense DEET on contact. Current Biology. 29 (9), 1551-1556 (2019).
- Harrington, L. C., et al. Heterogeneous feeding patterns of the Dengue vector, Aedes aegypti, on individual human hosts in rural Thailand. PLoS Neglected Tropical Diseases. 8 (8), 3048 (2014).
- Hol, F. J., Lambrechts, L., Prakash, M. BiteOscope, an open platform to study mosquito biting behavior. eLife. 9, 1-24 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten