Method Article
Efeitos ecotoxicológicos de microplásticos no desenvolvimento de embriões de aves por eclosão sem casca de ovo
Neste Artigo
Resumo
Este artigo introduz um método de eclosão sem o uso de casca de ovo para estudos toxicológicos de poluentes de partículas, como microplásticos.
Resumo
Os microplásticos são um tipo emergente global de poluentes que representa uma grande ameaça à saúde dos animais devido à sua absorção e translocação em tecidos e órgãos animais. Não são conhecidos os efeitos ecotoxicológicos dos microplásticos no desenvolvimento de embriões de aves. O ovo de pássaro é um sistema completo de desenvolvimento e nutrição, e todo o desenvolvimento de embriões ocorre na casca de ovo. Portanto, um registro direto do desenvolvimento de embriões de aves sob o estresse de poluentes como microplásticos é altamente limitado pela casca de ovo opaca na eclosão tradicional. Neste estudo, os efeitos dos microplásticos no desenvolvimento de embriões de codorna foram monitorados visualmente pela eclosão sem casca de ovo. Os principais passos incluem a limpeza e desinfecção de ovos fertilizados, a incubação antes da exposição, a incubação a curto prazo após a exposição e a extração da amostra. Os resultados mostram que, em comparação com o grupo controle, o peso úmido e o comprimento corporal do grupo exposto aos microplásticos apresentaram uma diferença estatística e a proporção hepática de todo o grupo exposto aumentou significativamente. Além disso, avaliamos fatores externos que afetam a incubação: temperatura, umidade, ângulo de rotação de ovos e outras condições. Este método experimental fornece informações valiosas sobre a ecotoxicologia dos microplásticos e uma nova maneira de estudar os efeitos adversos dos poluentes no desenvolvimento de embriões.
Introdução
A produção de resíduos plásticos foi de cerca de 6.300 Mt em 2015, um décimo dos quais foi reciclado, e o resto foi queimado ou enterrado no subsolo. Estima-se que cerca de 12.000 mt de resíduos plásticos seriam enterrados no subsolo até 20501. Com a atenção da comunidade internacional aos resíduos plásticos, Thompson propôs pela primeira vez o conceito de microplásticos em 20042. Microplásticos (PMs) referem-se a plásticos de partículas de pequeno porte com diâmetro de partícula inferior a 5 mm. Atualmente, pesquisadores detectaram a presença onipresente de PMs no litoral de vários continentes, ilhas atlânticas, lagos do interior, ártico e habitats em alto mar3,4,5,6,7. Por isso, mais pesquisadores começaram a estudar os riscos ambientais dos PMs.
Organismos podem ingerir PMs no ambiente. Os PMs foram encontrados no trato digestivo de 233 organismos marinhos em todo o mundo (incluindo 100% espécies de tartarugas, 36% espécies de focas, 59% espécies de baleias, 59% espécies de aves marinhas, 92 tipos de peixes marinhos e 6 tipos de invertebrados)8. Além disso, os PMs podem bloquear o sistema digestivo dos organismos, acumular e migrar em seus bobies9. Verificou-se que os PMs podem ser transferidos através da cadeia alimentar, e sua ingestão difere com as mudanças de habitat, estágio de crescimento, hábitos alimentares e fontes de alimentos10. Alguns pesquisadores relataram a existência de PMs nas fezes das aves marinhas11, o que significa que as aves marinhas atuam como portadoras de PMs. Além disso, a ingestão de PMs pode afetar a saúde de alguns organismos. Por exemplo, os PMs podem ser emaranhados no trato gastrointestinal, aumentando assim a mortalidade dos cetáceos12.
Só os PMs têm efeitos tóxicos nos organismos, bem como efeitos tóxicos articulares em organismos com outros poluentes. A ingestão de concentrações ambientais de detritos plásticos pode perturbar a função do sistema endócrino de peixes adultos13. O tamanho dos microplásticos é um dos fatores importantes que afetam sua absorção e acumulação por organismos14,15. Os plásticos de pequeno porte, especialmente os plásticos nanosize, são propensos à interação com células e organismos com alta toxicidade16,17,18,19. Embora os efeitos nocivos dos microplásticos de tamanho nanopartículas em organismos excedam o nível atual de pesquisa, a detecção e quantificação de microplásticos com tamanhos inferiores a vários micrômetros, especialmente o submicron/nanoplásticos no ambiente, ainda é um grande desafio. Além disso, nanoplásticos também têm alguns efeitos sobre embriões. O poliestireno pode prejudicar o desenvolvimento de embriões de ouriço-do-mar regulando proteínas e perfis genéticos20.
Para explorar o impacto potencial dos PMs nos organismos, realizamos este estudo. Devido à semelhança entre embriões de aves e embriões humanos, eles geralmente são usados em pesquisas de biologia do desenvolvimento21, incluindo angiogênese e antiangiogênese, engenharia de tecidos, implante biomaterial e tumores cerebrais22,23,24. Os embriões de aves têm as vantagens do baixo custo, um ciclo de cultura curto e fácil operação25,26. Por isso, escolhemos embriões de codorna com um curto ciclo de crescimento como animal experimental neste estudo. Simultaneamente, podemos observar diretamente as alterações morfológicas dos embriões de codorna expostos aos PMs durante o estágio de desenvolvimento embrionário usando uma tecnologia de eclosão livre de casca de ovo. Os materiais experimentais utilizados foram polipropileno (PP) e poliestireno (PS). Como o PP e o PS27 são responsáveis pela maior proporção de tipos de polímeros obtidos em sedimentos e corpos d'água em todo o mundo, os tipos de polímeros mais comuns extraídos de organismos marinhos capturados são o etileno e o propileno28. Este protocolo experimental descreve todo o processo de avaliação visual dos efeitos toxicológicos dos PMs em embriões de codorna expostos aos PMs. Podemos facilmente estender este método para examinar a toxicidade de outros poluentes para o desenvolvimento de embriões de outros animais oviparas.
Protocolo
1. Preparação antes da exposição
- Selecione ovos de codorna fertilizados nascidos no mesmo dia para o teste de exposição.
- Selecione ovos de codorna com pesos semelhantes. Cada ovo de codorna fertilizado é de cerca de 10-12 g.
- Limpe totalmente todos os ovos de codorna fertilizados de fezes externas e outros detritos.
- Esterilize cada ovo de codorna fertilizado pré-eclodido e os ovos a serem usados (Escolha ovos com forma de casca semelhante, especialmente a ponta do ovo) com uma solução antibiótica (penicilina e estreptomicina, 1:1000, temperatura ambiente). Esterilize a incubadora com 75% de etanol.
- Abra os ovos com a extremidade sem corte de uma broca dentária, deixando a casca de ovo na ponta para uso posterior. Antes de transferir os óvulos fertilizados, o conteúdo dos ovos é derramado. Isto é para manter a umidade da casca de ovo. O diâmetro de abertura do ovo foi de cerca de 3 cm.
NOTA: Para reduzir o dano ao embrião de codorna, use uma broca dentária para abrir a extremidade contundente do ovo e deixar a rachadura o mais lisa possível. - Após a esterilização, coloque os ovos de codorna fertilizados em uma incubadora de 38 °C com 60% de umidade para 24-48 h. Certifique-se de que a extremidade cega do ovo de codorna se destrua.
- Durante a incubação de ovos de codorna fertilizados, esterilize as ferramentas necessárias nos experimentos subsequentes em um pote de esterilização. Essas ferramentas incluem plástico, um béquer, água estéril, pontas de pipeta, tesoura reta cirúrgica, pinças e uma colher.
NOTA: Use um filme com tolerância à temperatura alta o suficiente para evitar problemas com a esterilização de alta temperatura.
2. Chocar o ovo de codorna sem casca
- Transfira os ovos de codorna fertilizados pré-eclodidos da incubadora para um banco limpo e coloque-os no recipiente para estabilizá-los por cerca de 1-2 min.
- Use uma tesoura (tesoura reta cirúrgica de 12,5 cm) para fazer um pequeno orifício (diâmetro de 3 mm) no eixo central dos ovos de codorna fertilizados pré-eclodidos e cortar 1-2 cm de abertura pequena. Transfira cuidadosamente a clara de ovo e a gema dos ovos de codorna fertilizados para a casca de ovo cortada.
NOTA: Ao cortar uma pequena abertura com uma tesoura, evite tocar a gema de ovos de codorna. - Adicione a solução de controle (sem MPs) e a solução exposta de diferentes massas (0,1, 0,2 e 0,3 mg) de microplásticos com três tamanhos de partículas (100, 200 e 500 nm) ao conteúdo do ovo por pipeta. Ao mesmo tempo, adicione 1 gota de penicilina e 1 gota de estreptomicina com uma seringa de 1 mL.
- Cubra a abertura da casca de ovo com o filme esterilizado (passo 1.6).
- De acordo com a etapa 2.1-2.4, trate todos os ovos de codorna fertilizados.
- Coloque os embriões de codorna transferidos na incubadora de 38 °C com 60% de umidade durante o período necessário. Neste experimento, use um ângulo de rotação de ovos de ±30°. Vire os ovos uma vez por hora.
NOTA: A transferência deve ser o mais rápida possível, o que requer mais prática na fase inicial.
3. Coleta de amostras
- Após sete dias de cultura, remova embriões bem desenvolvidos observados a olho nu da gema e lave com solução tamponada de fosfato (PBS).
- Seque a solução excedente fora do embrião limpo com papel absorvente e pese em uma placa de Petri limpa.
- Abra toda a cavidade torácica, separe o fígado e o coração das vísceras com alicates de nariz de agulha, e coloque em tubos de centrífuga de 1,5 mL imediatamente após a clareira.
- Registoso o peso em um equilíbrio eletrônico e calcule o índice hepatossomático (HIS = peso hepático / peso corporal x 100). Meça o comprimento do esterno e do corpo.
- Com base nos indicadores acima, avalie o impacto dos PMs no desenvolvimento embrionário.
NOTA: A qualidade do embrião aqui refere-se à qualidade da remoção da gema.
4. Análise de dados
- Relatar os dados experimentais na forma de erro padrão de ± média (SEM).
- Use a análise de variância de fator único para comparar os meios de múltiplos grupos de amostras. O valor de diferença significativo foi α = 0,05.
Resultados
Para a análise dos dados experimentais, comparamos o peso úmido, o comprimento do corpo, o comprimento do esterno e a mudança do índice hepatosomático entre o grupo controle e os 6 grupos experimentais, medindo e refletindo o crescimento e o desenvolvimento dos embriões de codorna a partir de uma perspectiva macro. Detectamos seis embriões normais de codorna em cada grupo. Cada embrião atingiu a etapa necessária de Hambúrguer e Hamilton (HH).
Na Figura 1,transferimos o conteúdo de ovos de codorna fertilizados pré-eclodidos para as cascas de ovos hemisféricos e os colocamos na incubadora. Em seguida, registramos o desenvolvimento de embriões no período médio de incubação por três dias. Como mostrado na Figura 2, A-A2 é o grupo controle, e B-B2 é um grupo de tratamento. Do ponto de vista do desenvolvimento de embriões macroscópicos, os embriões desenvolveram-se normalmente sem os efeitos adversos dos microplásticos.
A Tabela 1 e a Tabela 2 são as ± médias SEM de peso molhado, comprimento corporal e comprimento de esterno de embrião de codorna após uma semana de exposição. As tabelas mostram que o peso úmido e o comprimento do corpo mudam significativamente em diferentes grupos de exposição. O peso e o comprimento corporal dos grupos tratados com 0,1 mg, 0,3 mg, 100 nm e 500 nm MPs diminuíram ligeiramente. O peso corporal e o comprimento corporal de 0,2 mg de 200 nm de grupos tratados microplásticos aumentaram ligeiramente (P < 0,05).
O índice hepatossomático (HIS) mostra a proporção de fígado no embrião de codorna, que é um sinal importante para julgar o grau de desenvolvimento hepático. Além disso, o HSI desempenha um papel importante na patogênese da lesão da membrana hepática e infiltração inflamatória. Como mostrado na Figura 3 e Figura 4, em comparação com o grupo controle, a proporção de fígado em todo o grupo de tratamento aumentou significativamente após a exposição a microplásticos. No entanto, não houve diferença significativa entre os 0,2 mg e 0,3 mg dos 100 nm MPs e o grupo controle.

Figura 1: Chocar ovos de codorna sem casca. Clique aqui para ver uma versão maior desta figura.

Figura 2: O desenvolvimento de codorna no 6º, 7º e 8º dia no estágio médio da eclosão sem casca de ovo. O arqueiro verde aponta para os olhos; a seta azul aponta para os membros. Clique aqui para ver uma versão maior desta figura.

Figura 3: Índice hepatosomático de embriões de codorna após exposição a MPs (nm) por 7 dias. Diferenças significativas entre grupos de controle e tratamento são indicadas por * P < 0,05. Clique aqui para ver uma versão maior desta figura.
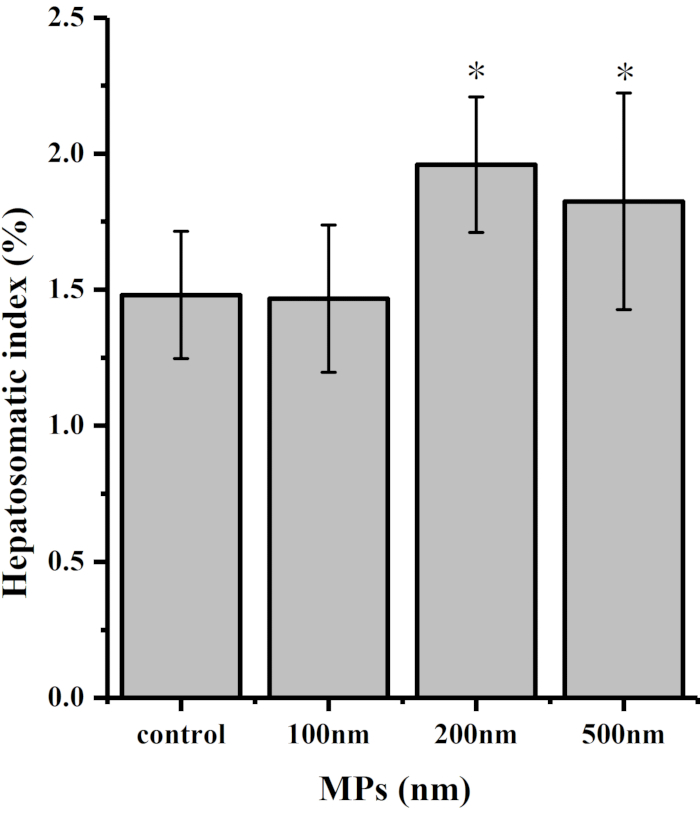
Figura 4: Índice hepatosomático de embriões de codorna após exposição a PMs (μm) por 7 dias. Diferenças significativas entre grupos de controle e tratamento são indicadas por * P < 0,05. Clique aqui para ver uma versão maior desta figura.
| Tratamento de PMs | Peso (g) | Comprimento (cm) | Comprimento do esterno |
| Controle | 2.509±0.324 | 5.425±0.477 | 1.025±0.094 |
| 100 nm | 1.812±0.155* | 4.632±0.315* | 0,950±0.152 |
| 200 nm | 2.272±0.368 | 5.297±0.268 | 1.025±0.076 |
| 500 nm | 1.785±0.127* | 4.892±0.154* | 1.017±0.082 |
Tabela 1: Peso molhado, comprimento do corpo e comprimento do esterno de embriões de codorna após exposição a MPs (nm) por 7 dias
| Tratamento | Peso (g) | Comprimento (cm) | Comprimento do esterno |
| Controle | 2.161±0.166 | 5.23±0.26 | 1.10±0.04 |
| 0,1 mg | 1.960±0.338* | 4.82±0,75* | 1.04±0.04 |
| 0,2 mg | 2.410±0.366* | 5.25±0.26 | 1.07±0.10 |
| 0,3 mg | 1.901±0.759 | 4.95±0.15* | 1.02±0.09 |
Tabela 2: Peso molhado, comprimento do corpo e comprimento do esterno de embriões de codorna após exposição a MPs (μm) por 7 dias. Em comparação com o grupo controle, * indica P < 0,05, ** indica P < 0,01.
Discussão
Este artigo fornece um esquema experimental eficaz para avaliar o desenvolvimento de embriões de codorna, detectando os índices básicos de desenvolvimento. No entanto, ainda há algumas limitações para este experimento.
Primeiro, a mortalidade de embriões de codorna no estágio posterior da eclosão é maior por causa da eclosão sem casca. Há fatores artificialmente incontroláveis, como a destruição da razão proteica normal no processo experimental. Limitamos o tempo de exposição dos embriões para garantir a precisão do experimento. A pesquisa da embriocxicidade só pode ocorrer nos estágios inicial e médio do desenvolvimento de embriões. Em segundo lugar, o estudo dos PMs sobre o desenvolvimento de embriões de codorna só ocorre no nível básico de análise morfológica. Assim, as conclusões são relativamente simples e podem existir defeitos. Ao mesmo tempo, os requisitos para condições experimentais e operação são relativamente elevados no processo deste experimento. Portanto, alguns pontos notáveis estão listados da seguinte forma:
É muito importante desinfetar e esterilizar ovos de codorna fertilizados no trabalho preparatório devido aos microrganismos patogênicos prejudiciais na superfície dos ovos de codorna fertilizados. Se desinfetados, os micróbios podem se intrometer nos ovos de codorna fertilizados durante a incubação, resultando na morte dos embriões de codorna. Mesmo que a transferência seja bem sucedida, a taxa de mortalidade será maior. Portanto, um bom trabalho deve ser feito na desinfecção e esterilização para reduzir a mortalidade experimental.
Quando as aves chocam ovos, muitas vezes mudam a posição dos ovos e mantêm a circulação do ar para manter uma temperatura constante para os ovos e a posição correta para o feto. Este experimento usou filme para selar a casca de ovo. Se o ângulo de rotação do ovo for muito grande, então a clara de ovo fluirá para fora. Se for muito pequeno, então a adesão entre o filme de embrião e o filme de casca de ovo pode ocorrer, resultando em embriões mortos. Portanto, defina o ângulo de rotação de acordo com a situação real.
Durante a transferência de embriões de codorna, os ovos de codorna pré-fertilizados são colocados horizontalmente e depois cortados no meio da casca de ovo. Desta forma, uma pequena parte da clara de ovo flui facilmente para fora, o que destrói a proporção normal e distribuição da branca de ovo grossa e fina. Isso faz com que a gema, que deveria estar no topo, se incline para um lado, fazendo com que o embrião morra. Portanto, tome cuidado para fazer todo o ovo branco fluir para a nova casca de ovo hemisférica para garantir a proporção e distribuição normal durante a transferência.
Após a transferência bem sucedida, o experimentador deve ter cuidado para não deixar cair o líquido diretamente. O líquido deve contar com a parede de casca de ovo para fazê-lo fluir lentamente durante a adição de poluentes e antibióticos.
Além dos quatro pontos mencionados acima, controle rigorosamente as condições de incubação. Coordene o equilíbrio de temperatura, umidade e ventilação. Mantenha o laboratório de incubação silencioso e escuro para alcançar o melhor ambiente de incubação.
Em conclusão, este experimento fornece um protocolo básico para estudar os efeitos dos poluentes ambientais no desenvolvimento de embriões de codorna. Há também outros tipos de indicadores no estudo de crescimento e desenvolvimento embrionário, incluindo desenvolvimento vascular, estresse oxidativo e danos celulares. O experimento acima é apenas uma simples avaliação macroscópica do desenvolvimento embrionário a partir do aspecto morfológico. Finalmente, a melhor ideia de pesquisa e o protocolo no futuro poderia fornecer um novo método para o estudo toxicológico do crescimento e desenvolvimento de embriões.
Divulgações
Os autores não têm nada a revelar. Todos os autores declaram que não têm interesses financeiros concorrentes ou relações pessoais que possam ter aparecido para influenciar o trabalho deste artigo.
Agradecimentos
Este trabalho foi apoiado por projetos-chave de pesquisa e desenvolvimento na Região Autônoma de Xinjiang Uygur (2017B03014, 2017B03014-1, 2017B03014-2, 2017B03014-3).
Materiais
| Name | Company | Catalog Number | Comments |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd. | Tissuelyser-24 | Grind large-sized plastics into small-sized ones at low temperature |
| Electronic balance | OHAUS corporation | PR Series Precision | Used for weighing |
| Fertilized quail eggs | Guangzhou Cangmu Agricultural Development Co., Ltd. | Quail eggs for hatching without shell | |
| Fluorescent polypropylene particles | Foshan Juliang Optical Material Co., Ltd. | Types of plastics selected for the experiment | |
| Incubator | Shandong, Bangda Incubation Equipment Co., Ltd. | 264 pc | Provide a place for embryo growth and development |
| Nanometer-scale polystyrene microspheres | Xi’an Ruixi Biological Technology Co., Ltd. | 100 nm, 200 nm, 500 nm | Types of plastics selected for the experiment |
| Steel ruler | Deli Group | 20 cm | Used to measure length |
| Vertical heating pressure steam sterilizer | Shanghai Shenan Medical Instrument Factory | LDZM-80KCS-II | Sterilize the experimental articles |
Referências
- Geyer, R., Jambeck, J. R., Law, K. L. Production, use, and fate of all plastics ever made. Science Advances. 3 (7), 5(2017).
- Thompson, R. C., et al. Lost at sea: Where is all the plastic. Science. 304 (5672), 838-838 (2004).
- Barletta, M., Lima, A. R. A., Costa, M. F. Distribution, sources and consequences of nutrients, persistent organic pollutants, metals and microplastics in South American estuaries. Science of the Total Environment. 651, 1199-1218 (2019).
- Eriksson, C., Burton, H., Fitch, S., Schulz, M., vanden Hoff, J. Daily accumulation rates of marine debris on sub-Antarctic island beaches. Marine Pollution Bulletin. 66 (1-2), 199-208 (2013).
- Zhang, C. F., et al. Microplastics in offshore sediment in the Yellow Sea and East China Sea, China. Environmental Pollution. 244, 827-833 (2019).
- Obbard, R. W., et al. Global warming releases microplastic legacy frozen in Arctic Sea ice. Earths Future. 2 (6), 315-320 (2014).
- Van Cauwenberghe, L., Vanreusel, A., Mees, J., Janssen, C. R. Microplastic pollution in deep-sea sediments. Environmental Pollution. 182, 495-499 (2013).
- Wilcox, C., Van Sebille, E., Hardesty, B. D. Threat of plastic pollution to seabirds is global, pervasive, and increasing. Proceedings of the National Academy of Sciences of the United States of America. 112 (38), 11899-11904 (2015).
- Wright, S. L., Thompson, R. C., Galloway, T. S. The physical impacts of microplastics on marine organisms: A review. Environmental Pollution. 178, 483-492 (2013).
- Ferreira, G. V. B., Barletta, M., Lima, A. R. A. Use of estuarine resources by top predator fishes. How do ecological patterns affect rates of contamination by microplastics. Science of the Total Environment. 655, 292-304 (2019).
- Provencher, J. F., Vermaire, J. C., Avery-Gomm, S., Braune, B. M., Mallory, M. L. Garbage in guano? Microplastic debris found in faecal precursors of seabirds known to ingest plastics. Science of the Total Environment. 644, 1477-1484 (2018).
- Baulch, S., Perry, C. Evaluating the impacts of marine debris on cetaceans. Marine Pollution Bulletin. 80 (1-2), 210-221 (2014).
- Rochman, C. M., Kurobe, T., Flores, I., Teh, S. J. Early warning signs of endocrine disruption in adult fish from the ingestion of polyethylene with and without sorbed chemical pollutants from the marine environment. Science of the Total Environment. 493, 656-661 (2014).
- Mattsson, K., et al. Brain damage and behavioural disorders in fish induced by plastic nanoparticles delivered through the food chain. Scientific Reports. 7, 7(2017).
- Brown, D. M., Wilson, M. R., MacNee, W., Stone, V., Donaldson, K. Size-dependent proinflammatory effects of ultrafine polystyrene particles: A role for surface area and oxidative stress in the enhanced activity of ultrafines. Toxicology and Applied Pharmacology. 175 (3), 191-199 (2001).
- Salvati, A., et al. Experimental and theoretical comparison of intracellular import of polymeric nanoparticles and small molecules: toward models of uptake kinetics. Nanomedicine-Nanotechnology Biology and Medicine. 7 (6), 818-826 (2011).
- Frohlich, E., et al. Action of polystyrene nanoparticles of different sizes on lysosomal function and integrity. Particle and Fibre Toxicology. 9, 13(2012).
- Bexiga, M. G., Kelly, C., Dawson, K. A., Simpson, J. C. RNAi-mediated inhibition of apoptosis fails to prevent cationic nanoparticle-induced cell death in cultured cells. Nanomedicine. 9 (11), 1651-1664 (2014).
- Lehner, R., Weder, C., Petri-Fink, A., Rothen-Rutishauser, B. Emergence of Nanoplastic in the Environment and Possible Impact on Human Health. Environmental Science, Technology. 53 (4), 1748-1765 (2019).
- Pinsino, A., et al. Amino-modified polystyrene nanoparticles affect signalling pathways of the sea urchin (Paracentrotus lividus) embryos. Nanotoxicology. 11 (2), 201-209 (2017).
- El-Ghali, N., Rabadi, M., Ezin, A. M., De Bellard, M. E. New Methods for Chicken Embryo Manipulations. Microscopy Research and Technique. 73 (1), 58-66 (2010).
- Rashidi, H., Sottile, V. The chick embryo: hatching a model for contemporary biomedical research. Bioessays. 31 (4), 459-465 (2009).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo characterization of ultrasound contrast agents: microbubble spectroscopy in a chicken embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yamamoto, F. Y., Neto, F. F., Freitas, P. F., Ribeiro, C. A. O., Ortolani-Machado, C. F. Cadmium effects on early development of chick embryos. Environmental Toxicology and Pharmacology. 34 (2), 548-555 (2012).
- Li, X. D., et al. Caffeine interferes embryonic development through over-stimulating serotonergic system in chicken embryo. Food and Chemical Toxicology. 50 (6), 1848-1853 (2012).
- Lokman, N. A., Elder, A. S. F., Ricciardelli, C., Oehler, M. K. Chick Chorioallantoic Membrane (CAM) Assay as an In Vivo Model to Study the Effect of Newly Identified Molecules on Ovarian Cancer Invasion and Metastasis. International Journal of Molecular Sciences. 13 (8), 9959-9970 (2012).
- Burns, E. E., Boxall, A. B. A. Microplastics in the aquatic environment: Evidence for or against adverse impacts and major knowledge gaps. Environmental Toxicology and Chemistry. 37 (11), 2776-2796 (2018).
- Alejo-Plata, M. D., Herrera-Galindo, E., Cruz-Gonzalez, D. G. Description of buoyant fibers adhering to Argonauta nouryi (Cephalopoda: Argonautidae) collected from the stomach contents of three top predators in the Mexican South Pacific. Marine Pollution Bulletin. 142, 504-509 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados