Method Article
Effets écotoxicologiques des microplastiques sur le développement des embryons d’oiseaux par éclosion sans coquille d’œuf
Dans cet article
Résumé
Cet article présente une méthode d’éclosion sans utiliser de coquille d’œuf pour les études toxicologiques des polluants particulaires tels que les microplastiques.
Résumé
Les microplastiques sont un type de polluant mondial émergent qui représente une grande menace pour la santé des animaux en raison de leur absorption et de leur translocation dans les tissus et organes animaux. Les effets écotoxicologiques des microplastiques sur le développement des embryons d’oiseaux ne sont pas connus. L’œuf d’oiseau est un système complet de développement et de nutrition, et tout le développement de l’embryon se produit dans la coquille de l’œuf. Par conséquent, un enregistrement direct du développement d’embryons d’oiseaux sous le stress de polluants tels que les microplastiques est fortement limité par la coquille d’œuf opaque dans l’éclosion traditionnelle. Dans cette étude, les effets des microplastiques sur le développement des embryons de caille ont été surveillés visuellement par éclosion sans coquille d’œuf. Les principales étapes comprennent le nettoyage et la désinfection des œufs fécondés, l’incubation avant l’exposition, l’incubation à court terme après l’exposition et l’extraction de l’échantillon. Les résultats montrent que par rapport au groupe témoin, le poids humide et la longueur du corps du groupe exposé aux microplastiques présentaient une différence statistique et la proportion hépatique de l’ensemble du groupe exposé augmentait considérablement. De plus, nous avons évalué les facteurs externes qui affectent l’incubation : température, humidité, angle de rotation des œufs et autres conditions. Cette méthode expérimentale fournit des informations précieuses sur l’écotoxicologie des microplastiques et une nouvelle façon d’étudier les effets nocifs des polluants sur le développement des embryons.
Introduction
La production de déchets plastiques était d’environ 6300 Mt en 2015, dont un dixième a été recyclé, et le reste a été brûlé ou enterré sous terre. On estime qu’environ 12 000 Mt de déchets plastiques seraient enfouis sous terre d’ici 20501. Avec l’attention de la communauté internationale sur les déchets plastiques, Thompson a proposé pour la première fois le concept de microplastiques en 20042. Les microplastiques (MPs) désignent les plastiques à petites particules d’un diamètre de particules inférieur à 5 mm. À l’heure actuelle, les chercheurs ont détecté la présence omniprésente de députés sur le littoral de divers continents, les îles de l’Atlantique, les lacs intérieurs, l’Arctique et les habitats des grands fonds3,4,5,6,7. Par conséquent, de plus en plus de chercheurs ont commencé à étudier les dangers environnementaux des députés.
Des organismes pourraient ingérer des députés dans l’environnement. Des MPs ont été trouvés dans le tube digestif de 233 organismes marins dans le monde entier (y compris 100% d’espèces de tortues, 36% d’espèces de phoques, 59% d’espèces de baleines, 59% d’espèces d’oiseaux de mer, 92 types de poissons de mer et 6 types d’invertébrés)8. De plus, les députés peuvent bloquer le système digestif des organismes, s’accumuler et migrer dans leurs bobies9. Il a été constaté que les députés peuvent être transférés via la chaîne alimentaire et que leur apport diffère en termes de changements dans l’habitat, le stade de croissance, les habitudes alimentaires et les sources de nourriture10. Certains chercheurs ont signalé l’existence de députés dans les excréments d’oiseaux de mer11, ce qui signifie que les oiseaux de mer agissent comme porteurs de députés. De plus, l’ingestion de MPs peut affecter la santé de certains organismes. Par exemple, les députés peuvent être empêtrés dans le tractus gastro-intestinal, augmentant ainsi la mortalité des cétacés12.
Les parlementaires à eux seuls ont des effets toxiques sur les organismes ainsi que des effets toxiques conjoints sur les organismes ayant d’autres polluants. L’ingestion de concentrations de débris plastiques dans l’environnement peut perturber le fonctionnement du système endocrinien des poissons adultes13. La taille des microplastiques est l’un des facteurs importants qui affectent leur absorption et leur accumulation par les organismes14,15. Les plastiques de petite taille, en particulier les plastiques de taille nanométrique, sont sujets à l’interaction avec des cellules et des organismes à haute toxicité16,17,18,19. Bien que les effets nocifs des microplastiques de taille nanoparticulale sur les organismes dépassent le niveau de recherche actuel, la détection et la quantification des microplastiques de taille inférieure à plusieurs micromètres, en particulier les submicron/nanoplastiques dans l’environnement, reste un grand défi. En outre, les nanoplastiques ont également des effets sur les embryons. Le polystyrène peut nuire au développement des embryons d’oursins en régulant les profils protéiques etgénétiques 20.
Afin d’explorer l’impact potentiel des députés sur les organismes, nous avons mené cette étude. En raison de la similitude entre les embryons d’oiseaux et les embryons humains, ils sont généralement utilisés dans la recherche en biologie du développement21, y compris l’angiogenèse et l’antiangiogenèse, l’ingénierie tissulaire, l’implant de biomatériaux et les tumeurs cérébrales22,23,24. Les embryons d’oiseaux ont les avantages d’un faible coût, d’un cycle de culture court et d’une utilisation facile25,26. Par conséquent, nous avons choisi des embryons de caille avec un cycle de croissance court comme animal expérimental dans cette étude. Simultanément, nous pouvons observer directement les changements morphologiques des embryons de cailles exposés aux députés au cours de la phase de développement embryonnaire à l’aide d’une technologie d’éclosion sans coquille d’œuf. Les matériaux expérimentaux utilisés étaient le polypropylène (PP) et le polystyrène (PS). Étant donné que le PP et le PS27 représentent la plus grande proportion des types de polymères obtenus dans les sédiments et les plans d’eau dans le monde entier, les types de polymères les plus courants extraits des organismes marins capturés sont l’éthylène et le propylène28. Ce protocole expérimental décrit l’ensemble du processus d’évaluation visuelle des effets toxicologiques des MPs sur les embryons de caille exposés aux MPs. Nous pouvons facilement étendre cette méthode pour examiner la toxicité d’autres polluants pour le développement embryonnaire d’autres animaux ovipares.
Protocole
1. Préparation avant l’exposition
- Sélectionnez des œufs de caille fécondés nés le même jour pour l’essai d’exposition.
- Sélectionnez des œufs de caille avec des poids similaires. Chaque œuf de caille fécondé est d’environ 10-12 g.
- Nettoyez complètement tous les œufs de caille fertilisés des matières fécales externes et d’autres débris.
- Stérilisez chaque œuf de caille fécondé pré-éclos et les œufs à utiliser (Choisissez des œufs de forme de coquille similaire, en particulier la pointe de l’œuf) avec une solution antibiotique (pénicilline et streptomycine, 1:1000, température ambiante). Stérilisez l’incubateur avec de l’éthanol à 75%.
- Ouvrez les œufs avec l’extrémité émoussé d’une perceuse dentaire, en laissant la coquille d’œuf à la pointe pour une utilisation ultérieure. Avant de transférer les œufs fécondés, le contenu des œufs est versé. C’est pour garder l’humidité de la coquille d’œuf. Le diamètre d’ouverture de l’œuf était d’environ 3 cm.
REMARQUE: Pour réduire les dommages à l’embryon de caille, utilisez une perceuse dentaire pour ouvrir l’extrémité émoussé de l’œuf et rendre la fissure aussi lisse que possible. - Après stérilisation, placez les œufs de caille fécondés dans un incubateur à 38 °C avec 60% d’humidité pendant 24-48 h. Assurez-vous que l’extrémité émoussé de l’œuf de caille fait face vers le haut.
- Pendant l’incubation des œufs de caille fécondés, stérilisez les outils nécessaires aux expériences ultérieures dans un pot de stérilisation. Ces outils comprennent une pellicule de plastique, un bécher, de l’eau stérile, des pointes de pipette, des ciseaux droits chirurgicaux, une pince à épiler et une cuillère.
REMARQUE: Utilisez un film avec une tolérance de température suffisamment élevée pour éviter les problèmes de stérilisation à haute température.
2. Faire éclore l’œuf de caille sans coquille
- Transférer les œufs de caille fertilisés pré-éclos de l’incubateur vers un banc propre et les déposer à plat sur le récipient pour les stabiliser pendant environ 1-2 min.
- Utilisez des ciseaux (ciseaux droits chirurgicaux de 12,5 cm) pour percer un petit trou (diamètre 3 mm) dans l’axe central des œufs de caille fertilisés pré-éclos et pour couper 1-2 cm de petite ouverture. Transférer soigneusement le blanc d’œuf et le jaune des œufs de caille fécondés dans la coquille d’œuf coupée.
REMARQUE: Lorsque vous coupez une petite ouverture avec des ciseaux, évitez de toucher le jaune des œufs de caille. - Ajouter la solution témoin (sans MPs) et la solution exposée de différentes masses (0,1, 0,2 et 0,3 mg) de microplastiques à trois tailles de particules (100, 200 et 500 nm) à la teneur en œufs par pipette. Dans le même temps, ajoutez 1 goutte de pénicilline et 1 goutte de streptomycine avec une seringue de 1 mL.
- Couvrir l’ouverture de la coquille de l’œuf avec le film stérilisé (étape 1.6).
- Selon les étapes 2.1-2.4, traitez tous les œufs de caille fécondés.
- Placez les embryons de caille transférés dans l’incubateur à 38 °C avec 60% d’humidité pendant la période nécessaire. Dans cette expérience, utilisez un angle de rotation des œufs de ±30°. Tournez les œufs une fois par heure.
REMARQUE: Le transfert doit être aussi rapide que possible, ce qui nécessite plus de pratique au stade précoce.
3. Prélèvement d’échantillons
- Après sept jours de culture, retirer du jaune les embryons bien développés observés à l’œil nu et les laver avec une solution tamponnée au phosphate (PBS).
- Séchez la solution excédentaire à l’extérieur de l’embryon nettoyé avec du papier absorbant et pesez dans une boîte de Pétri propre.
- Ouvrez toute la cavité thoracique, séparez le foie et le cœur des viscères à l’avec une pince aiguille-nez et placez-les dans des tubes à centrifuger de 1,5 mL immédiatement après le dégagement.
- Enregistrer rapidement le poids sur un balance électronique et calculer l’indice hépatomatique (HIS = poids du foie / poids corporel x 100). Mesurez la longueur du sternum et du corps.
- Sur la base des indicateurs ci-dessus, évaluer l’impact des parlementaires sur le développement embryonnaire.
REMARQUE: La qualité de l’embryon fait ici référence à la qualité de l’élimination du jaune.
4. Analyse des données
- Déclarer les données expérimentales sous forme de moyenne ± d’erreur type (SEM).
- Utilisez l’analyse monofactorielle de la variance pour comparer les moyennes de plusieurs groupes d’échantillons. La valeur de la différence significative était α = 0,05.
Résultats
Pour l’analyse des données expérimentales, nous avons comparé le poids humide, la longueur du corps, la longueur du sternum et le changement de l’indice hépatosomatique entre le groupe témoin et les 6 groupes expérimentaux, mesurant et reflétant la croissance et le développement des embryons de caille d’un point de vue macro. Nous avons détecté six embryons normaux de caille dans chaque groupe. Chaque embryon a atteint le stade requis de Hamburger et Hamilton (HH).
Dans la figure 1, nous avons transféré le contenu des œufs de caille fertilisés pré-éclos dans les coquilles d’œufs hémisphériques et les avons mis dans l’incubateur. Ensuite, nous avons enregistré le développement d’embryons au milieu de la période d’incubation pendant trois jours. Comme le montre la figure 2,A-A2 est le groupe témoin et B-B2 est un groupe de traitement. Du point de vue du développement macroscopique de l’embryon, les embryons se sont développés normalement sans les effets néfastes des microplastiques.
Les tableaux 1 et 2 sont la moyenne ± MEB du poids humide, de la longueur du corps et de la longueur du sternum de l’embryon de caille après une exposition d’une semaine. Les tableaux montrent que le poids humide et la longueur du corps changent considérablement dans différents groupes d’exposition. Le poids et la longueur de corps des groupes traités avec mg 0.1, mg 0.3, 100 nanomètre, et 500 nanomètres ont diminué légèrement. Le poids corporel et la longueur de corps de mg 0.2 des groupes traités par microplastique de 200 nanomètre ont augmenté légèrement (P < 0,05).
L’indice hépatosomatique (HIS) montre la proportion de foie dans l’embryon de caille, ce qui est un signe important pour juger du degré de développement du foie. D’ailleurs, HSI joue un rôle important dans la pathogénie des dommages de membrane de cellules de foie et de l’infiltration inflammatoire. Comme le montrent les figures 3 et 4,comparativement au groupe témoin, la proportion de foie dans l’ensemble du groupe traité a augmenté de façon significative après l’exposition aux microplastiques. Cependant, il n’y avait aucune différence significative entre mg 0,2 et mg 0,3 des groupes de traitement de 100 nm MPs et le groupe témoin.

Figure 1: Œufs de caille à couver sans coquille. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Le développement embryonnaire de la caille le 6ème, 7ème et 8ème jour au stade intermédiaire de l’éclosion sans coquille d’œuf. La flèche verte pointe vers les yeux; la flèche bleue pointe vers les membres. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Indice hépatomatique des embryons de cailles après exposition aux MPs (nm) pendant 7 jours. Les différences significatives entre le groupe témoin et le groupe de traitement sont indiquées par * P < 0,05. Veuillez cliquer ici pour voir une version plus grande de cette figure.
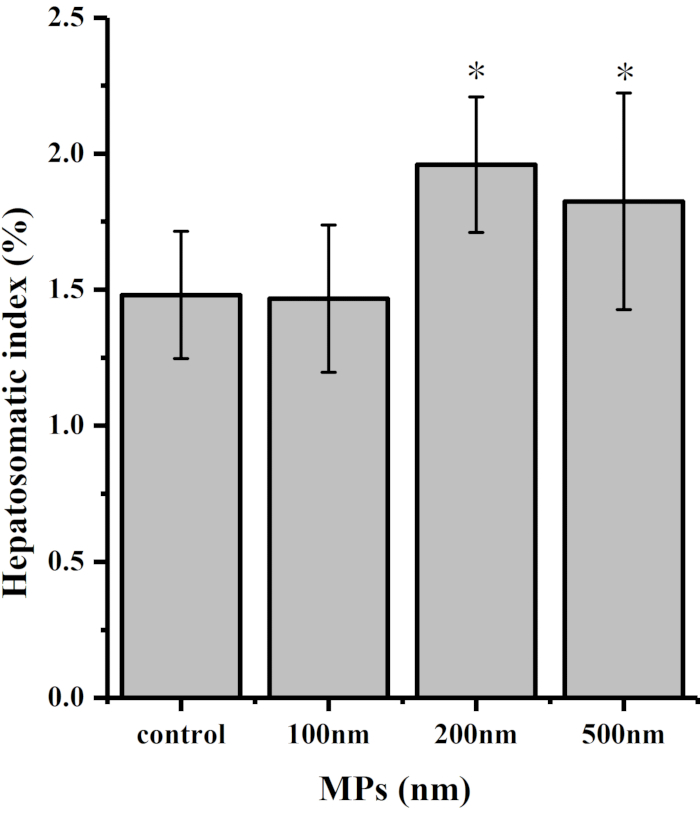
Figure 4: Indice hépatomatique des embryons de cailles après exposition aux MPs (μm) pendant 7 jours. Les différences significatives entre le groupe témoin et le groupe de traitement sont indiquées par * P < 0,05. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Traitement des députés | Poids (g) | Longueur (cm) | Longueur du sternum |
| Contrôle | 2.509±0.324 | 5,425 ±0,477 | 1,025±0,094 |
| 100 nm | 1,812 ±0,155* | 4,632±0,315* | 0,950±0,152 |
| 200 nm | 2,272 ±0,368 | 5,297 ±0,268 | 1,025 ±0,076 |
| 500 nm | 1,785±0,127* | 4,892±0,154* | 1.017±0.082 |
Tableau 1 : Poids humide, longueur du corps et longueur du sternum des embryons de cailles après exposition aux MPs (nm) pendant 7 jours
| Traitement | Poids (g) | Longueur (cm) | Longueur du sternum |
| Contrôle | 2,161±0,166 | 5.23±0.26 | 1.10±0.04 |
| 0,1 mg | 1,960±0,338* | 4,82±0,75* | 1.04±0.04 |
| 0,2 mg | 2,410±0,366* | 5.25±0.26 | 1.07±0.10 |
| 0,3 mg | 1,901 ± 0,759 | 4,95±0,15* | 1.02±0.09 |
Tableau 2 : Poids humide, longueur du corps et longueur du sternum des embryons de cailles après exposition aux MPs (μm) pendant 7 jours. Par rapport au groupe témoin, * indique P < 0,05, ** indique P < 0,01.
Discussion
Cet article fournit un schéma expérimental efficace pour évaluer le développement de l’embryon de caille en détectant les indices de développement de base. Cependant, il y a encore quelques limites à cette expérience.
Tout d’abord, la mortalité des embryons de cailles au stade avancé de l’éclosion est plus élevée en raison de l’éclosion sans coquille. Il existe des facteurs artificiellement incontrôlables tels que la destruction du rapport protéique normal dans le processus expérimental. Nous avons limité le temps d’exposition des embryons pour assurer la précision de l’expérience. La recherche sur l’embryotoxicité ne peut avoir lieu qu’aux premiers et moyens stades du développement de l’embryon. Deuxièmement, l’étude des députés sur le développement de l’embryon de cailles n’a lieu qu’au niveau de l’analyse morphologique de base. Ainsi, les conclusions sont relativement simples et des défauts peuvent exister. Dans le même temps, les exigences en matière de conditions expérimentales et de fonctionnement sont relativement élevées dans le processus de cette expérience. Par conséquent, certains points dignes de mention sont énumérés comme suit :
Il est très important de désinfecter et de stériliser les œufs de caille fécondés dans les travaux préparatoires en raison des micro-organismes pathogènes nocifs à la surface des œufs de caille fécondés. S’ils sont désinfectés, les microbes peuvent s’immiscer dans les œufs de caille fécondés pendant l’incubation, entraînant la mort des embryons de caille. Même si le transfert est réussi, le taux de mortalité sera plus élevé. Par conséquent, un bon travail doit être fait dans la désinfection et la stérilisation pour réduire la mortalité expérimentale.
Lorsque les oiseaux éclosent des œufs, ils changent souvent la position des œufs et maintiennent la circulation de l’air pour maintenir une température constante pour les œufs et la position correcte pour le fœtus. Cette expérience a utilisé un film pour sceller la coquille d’œuf. Si l’angle de rotation des œufs est trop grand, le blanc d’œuf s’écoulera. S’il est trop petit, l’adhérence entre le film embryonnaire et le film de coquille d’œuf peut se produire, entraînant la mort d’embryons. Par conséquent, définissez l’angle de rotation en fonction de la situation réelle.
Lors du transfert d’embryons de caille, les œufs de caille pré-fécondés sont placés horizontalement, puis coupés au milieu de la coquille de l’œuf. De cette façon, une petite partie du blanc d’œuf s’écoule facilement, ce qui détruit la proportion et la distribution normales du blanc d’œuf épais et mince. Cela fait que le jaune, qui aurait dû être sur le dessus, se penche d’un côté, provoquant la mort de l’embryon. Par conséquent, prenez soin de faire circuler tout le blanc d’œuf dans la nouvelle coquille d’œuf hémisphérique pour assurer la proportion et la distribution normales pendant le transfert.
Après le transfert réussi, l’expérimentateur doit faire attention à ne pas laisser tomber le liquide directement. Le liquide doit compter sur la paroi de la coquille d’œuf pour le faire couler lentement lors de l’ajout de polluants et d’antibiotiques.
En plus des quatre points mentionnés ci-dessus, contrôler strictement les conditions d’incubation. Coordonner l’équilibre de la température, de l’humidité et de la ventilation. Gardez le laboratoire d’incubation calme et sombre pour obtenir le meilleur environnement d’incubation.
En conclusion, cette expérience fournit un protocole de base pour l’étude des effets des polluants environnementaux sur le développement des embryons de cailles. Il existe également d’autres types d’indicateurs dans l’étude de la croissance et du développement embryonnaires, y compris le développement vasculaire, le stress oxydatif et les dommages cellulaires. L’expérience ci-dessus n’est qu’une simple évaluation macroscopique du développement embryonnaire de l’aspect morphologique. Enfin, l’idée et le protocole de recherche améliorés à l’avenir pourraient fournir une nouvelle méthode pour l’étude toxicologique de la croissance et du développement des embryons.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer. Tous les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu avoir l’air d’influencer les travaux du présent document.
Remerciements
Ce travail a été soutenu par des projets clés de recherche et développement dans la région autonome ouïgour du Xinjiang (2017B03014, 2017B03014-1, 2017B03014-2, 2017B03014-3).
matériels
| Name | Company | Catalog Number | Comments |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd. | Tissuelyser-24 | Grind large-sized plastics into small-sized ones at low temperature |
| Electronic balance | OHAUS corporation | PR Series Precision | Used for weighing |
| Fertilized quail eggs | Guangzhou Cangmu Agricultural Development Co., Ltd. | Quail eggs for hatching without shell | |
| Fluorescent polypropylene particles | Foshan Juliang Optical Material Co., Ltd. | Types of plastics selected for the experiment | |
| Incubator | Shandong, Bangda Incubation Equipment Co., Ltd. | 264 pc | Provide a place for embryo growth and development |
| Nanometer-scale polystyrene microspheres | Xi’an Ruixi Biological Technology Co., Ltd. | 100 nm, 200 nm, 500 nm | Types of plastics selected for the experiment |
| Steel ruler | Deli Group | 20 cm | Used to measure length |
| Vertical heating pressure steam sterilizer | Shanghai Shenan Medical Instrument Factory | LDZM-80KCS-II | Sterilize the experimental articles |
Références
- Geyer, R., Jambeck, J. R., Law, K. L. Production, use, and fate of all plastics ever made. Science Advances. 3 (7), 5(2017).
- Thompson, R. C., et al. Lost at sea: Where is all the plastic. Science. 304 (5672), 838-838 (2004).
- Barletta, M., Lima, A. R. A., Costa, M. F. Distribution, sources and consequences of nutrients, persistent organic pollutants, metals and microplastics in South American estuaries. Science of the Total Environment. 651, 1199-1218 (2019).
- Eriksson, C., Burton, H., Fitch, S., Schulz, M., vanden Hoff, J. Daily accumulation rates of marine debris on sub-Antarctic island beaches. Marine Pollution Bulletin. 66 (1-2), 199-208 (2013).
- Zhang, C. F., et al. Microplastics in offshore sediment in the Yellow Sea and East China Sea, China. Environmental Pollution. 244, 827-833 (2019).
- Obbard, R. W., et al. Global warming releases microplastic legacy frozen in Arctic Sea ice. Earths Future. 2 (6), 315-320 (2014).
- Van Cauwenberghe, L., Vanreusel, A., Mees, J., Janssen, C. R. Microplastic pollution in deep-sea sediments. Environmental Pollution. 182, 495-499 (2013).
- Wilcox, C., Van Sebille, E., Hardesty, B. D. Threat of plastic pollution to seabirds is global, pervasive, and increasing. Proceedings of the National Academy of Sciences of the United States of America. 112 (38), 11899-11904 (2015).
- Wright, S. L., Thompson, R. C., Galloway, T. S. The physical impacts of microplastics on marine organisms: A review. Environmental Pollution. 178, 483-492 (2013).
- Ferreira, G. V. B., Barletta, M., Lima, A. R. A. Use of estuarine resources by top predator fishes. How do ecological patterns affect rates of contamination by microplastics. Science of the Total Environment. 655, 292-304 (2019).
- Provencher, J. F., Vermaire, J. C., Avery-Gomm, S., Braune, B. M., Mallory, M. L. Garbage in guano? Microplastic debris found in faecal precursors of seabirds known to ingest plastics. Science of the Total Environment. 644, 1477-1484 (2018).
- Baulch, S., Perry, C. Evaluating the impacts of marine debris on cetaceans. Marine Pollution Bulletin. 80 (1-2), 210-221 (2014).
- Rochman, C. M., Kurobe, T., Flores, I., Teh, S. J. Early warning signs of endocrine disruption in adult fish from the ingestion of polyethylene with and without sorbed chemical pollutants from the marine environment. Science of the Total Environment. 493, 656-661 (2014).
- Mattsson, K., et al. Brain damage and behavioural disorders in fish induced by plastic nanoparticles delivered through the food chain. Scientific Reports. 7, 7(2017).
- Brown, D. M., Wilson, M. R., MacNee, W., Stone, V., Donaldson, K. Size-dependent proinflammatory effects of ultrafine polystyrene particles: A role for surface area and oxidative stress in the enhanced activity of ultrafines. Toxicology and Applied Pharmacology. 175 (3), 191-199 (2001).
- Salvati, A., et al. Experimental and theoretical comparison of intracellular import of polymeric nanoparticles and small molecules: toward models of uptake kinetics. Nanomedicine-Nanotechnology Biology and Medicine. 7 (6), 818-826 (2011).
- Frohlich, E., et al. Action of polystyrene nanoparticles of different sizes on lysosomal function and integrity. Particle and Fibre Toxicology. 9, 13(2012).
- Bexiga, M. G., Kelly, C., Dawson, K. A., Simpson, J. C. RNAi-mediated inhibition of apoptosis fails to prevent cationic nanoparticle-induced cell death in cultured cells. Nanomedicine. 9 (11), 1651-1664 (2014).
- Lehner, R., Weder, C., Petri-Fink, A., Rothen-Rutishauser, B. Emergence of Nanoplastic in the Environment and Possible Impact on Human Health. Environmental Science, Technology. 53 (4), 1748-1765 (2019).
- Pinsino, A., et al. Amino-modified polystyrene nanoparticles affect signalling pathways of the sea urchin (Paracentrotus lividus) embryos. Nanotoxicology. 11 (2), 201-209 (2017).
- El-Ghali, N., Rabadi, M., Ezin, A. M., De Bellard, M. E. New Methods for Chicken Embryo Manipulations. Microscopy Research and Technique. 73 (1), 58-66 (2010).
- Rashidi, H., Sottile, V. The chick embryo: hatching a model for contemporary biomedical research. Bioessays. 31 (4), 459-465 (2009).
- Faez, T., Skachkov, I., Versluis, M., Kooiman, K., de Jong, N. In vivo characterization of ultrasound contrast agents: microbubble spectroscopy in a chicken embryo. Ultrasound in Medicine and Biology. 38 (9), 1608-1617 (2012).
- Yamamoto, F. Y., Neto, F. F., Freitas, P. F., Ribeiro, C. A. O., Ortolani-Machado, C. F. Cadmium effects on early development of chick embryos. Environmental Toxicology and Pharmacology. 34 (2), 548-555 (2012).
- Li, X. D., et al. Caffeine interferes embryonic development through over-stimulating serotonergic system in chicken embryo. Food and Chemical Toxicology. 50 (6), 1848-1853 (2012).
- Lokman, N. A., Elder, A. S. F., Ricciardelli, C., Oehler, M. K. Chick Chorioallantoic Membrane (CAM) Assay as an In Vivo Model to Study the Effect of Newly Identified Molecules on Ovarian Cancer Invasion and Metastasis. International Journal of Molecular Sciences. 13 (8), 9959-9970 (2012).
- Burns, E. E., Boxall, A. B. A. Microplastics in the aquatic environment: Evidence for or against adverse impacts and major knowledge gaps. Environmental Toxicology and Chemistry. 37 (11), 2776-2796 (2018).
- Alejo-Plata, M. D., Herrera-Galindo, E., Cruz-Gonzalez, D. G. Description of buoyant fibers adhering to Argonauta nouryi (Cephalopoda: Argonautidae) collected from the stomach contents of three top predators in the Mexican South Pacific. Marine Pollution Bulletin. 142, 504-509 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon