Method Article
Uso de neurônios hipocampais primários para estudar a montagem de segmentos iniciais de Axon
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para estudar quantitativamente a montagem e estrutura dos segmentos iniciais de axônio (AIS) de neurônios hipocampais que carecem de AIS pré-montada devido à ausência de um anquilírin-G gigante.
Resumo
Os segmentos iniciais do axônio neuronal (AIS) são locais de iniciação de potenciais de ação e têm sido extensivamente estudados para sua estrutura molecular, montagem e plasticidade dependente da atividade. Ankyrin-G gigante, o principal organizador do AIS, associa-se diretamente com os canais de adesão de tensão de tensão de membrana (VSVG) e canais de potássio (KCNQ2/3), bem como neurofascina de 186 kDa, uma molécula de adesão celular L1CAM. Ankyrin-G gigante também se liga e recruta moléculas citoplasmáticas de AIS, incluindo beta-4-spectrin, e as proteínas de ligação de microtúbulos, EB1/EB3 e Ndel1. Anquilo-G gigante é suficiente para resgatar a formação de AIS em neurônios deficientes de ankyrin-G. Ankyrin-G também inclui um isoform menor de 190 kDa localizado em espinhos dendráticos em vez da AIS, que é incapaz de atingir a AIS ou resgatar o AIS em neurônios deficientes de ankyrin-G. Aqui, descrevemos um protocolo usando neurônios hipocampais cultivados de camundongos ANK3-E22/23-flox, que, quando transfectados com Cre-BFP exibem perda de toda a isóforme de ankyrina-G e prejudicam a formação de AIS. Combinado um sistema de co-cultura Banker glia/neuron modificado, desenvolvemos um método para transfetar neurônios anquilino-G nulos com um plasmídeo ankyrin-G-GFP de 480 kDa, o que é suficiente para resgatar a formação de AIS. Utilizamos ainda um método de quantificação, desenvolvido por Salzer e colegas para lidar com a variação da distância AIS dos corpos de células neuronais que ocorre nas culturas de neurônios hipocampais. Este protocolo permite estudos quantitativos da montagem de novo e comportamento dinâmico da AIS.
Introdução
O segmento inicial do axônio está localizado no axônio proximal na maioria dos neurônios vertebrados. Funcionalmente, a AIS é onde os potenciais de ação são iniciados devido à alta densidade de canais de sódio fechados por tensão nesta região. AIS de alguns neurônios excitatórios também são alvo de interneurônios inibitórios através da formação de sinapses GABAérgicas1,2,3. Portanto, a AIS é um local crítico para integrar a sinalização celular e modular a excitabilidade dos neurônios. A IS tem normalmente 20-60 μm de comprimento e está localizada dentro de 20 μm do corpo celular. O comprimento e a posição da AIS variam em neurônios entre regiões cerebrais, bem como em diferentes estágios de desenvolvimento do mesmo neurônio4,5. Evidências acumuladas sugerem que a composição e a posição da AIS são dinâmicas na resposta à mudança da atividade neuronal4,5,6,7.
480 kDa ankyrin-G é o principal organizador da AIS. 480 kDa ankyrin-G é uma proteína adaptadora associada à membrana que se liga diretamente aos canais de sódio fechados de tensão, bem como outras proteínas AIS importantes, incluindo beta4-spectrina, KCNQ2/3 canais que modulam a atividade do canal de sódio8,9e 186 kDa neurofascina, uma L1CAM que direciona as sínteses GABAergic para o AIS2,10. 480 kDa ankyrin-G compartilha domínios de ankyrina canônica encontrados na pequena isoforma ankyrin-G de 190 kDa (se repete ANK, domínio vinculante de espectros, domínio regulatório), mas são distinguidos por uma exon gigante que é encontrada apenas em vertebrados e é expressa especificamente em neurônios(Figura 1A)11,12. O domínio específico do neurônio ankyrin-G de 480 kDa (NSD) é necessário para a formação AIS12. O ankyrin-G de 190 kDa não promove a montagem AIS ou o alvo AIS em neurônios ankyrin-G-null12. No entanto, 190 kDa ankyrin-G está concentrado na AIS contendo 480 kDa ankyrin-G12. Esta habilidade do ankyrin-G de 190 kDa para atingir a AIS pré-montada de neurônios do tipo selvagem tem sido uma fonte de confusão na literatura e retardou a apreciação das funções especializadas críticas do ankyrin-G de 480 kDa na montagem AIS. Portanto, é fundamental estudar a montagem da AIS em neurônios anquilo-G-nulos que carecem de uma AIS pré-montada.
Aqui, apresentamos um método para estudar a montagem e estrutura do AIS utilizando neurônios hipocampais cultivados de camundongos ANK3-E22/23-flox que elimina todas as isoformas de ankyrin-G13 (Figura 1B). Ao transfetar neurônios com uma construção Cre-BFP antes da AIS ser montada, geramos neurônios deficientes ankyrin-G completamente sem uma AIS (Figura 1B, Figura 2). A montagem da AIS é totalmente resgatada após a co-transfecção de 480 kDa ankyrin-G-GFP plasmid com um plasmídeo Cre-BFP. Este método fornece uma maneira de estudar a montagem AIS em um ambiente AIS não pré-montado. Também modificamos o sistema de cocultura glia-neurônio de Gary Banker sem o uso de antibióticos, previamente projetado para o dia 18 neurônios embrionários, para aplicação aos neurônios do camundongo pós-natal e adaptamos um método de quantitação AIS para medições médias de AIS de múltiplos neurônios para normalizar a variação de AIS14,15.
Protocolo
NOTA: Este método de cultura de neurônios hipocampais de camundongos pós-natal ank3-E22/23f/f é adaptado do sistema de cocultura glia/neurônio de Gary Banker. Por isso, é fundamental realizar todas as etapas após a dissecção em um capô limpo usando ferramentas esterilizadas. Este protocolo leva até 1 mês. O fluxo de trabalho é exibido na Figura 3. O protocolo segue as diretrizes animais da Universidade Duke.
1. Preparação de tampas e pratos de revestimento neuronal
- Pelo menos uma semana antes do dia da cultura, a carga cobre as manchas no rack de deslizamento de tampas e mergulhá-lo em ácido nítrico (70% W/W) durante a noite (pode ser estendido por dias).
- Lave as tampas tratadas com ácido nítrico com água destilada em um shaker de baixa velocidade em um frasco de vidro 2 vezes, 1 hora cada.
- Incubar tampas em KOH saturado dissolvido em 100% etanol durante a noite. Adicione KOH ao etanol até que ele não seja mais dissolvido.
- Repita o passo de lavagem com água destilada. As tampas de enxágüe com 100% de etanol uma vez por 10 minutos.
- Transferir tampas do rack para um béquer de vidro. Cubra o béquer com papel alumínio. Asse assar tampas em forno de 225 °C durante a noite para esterilizar as tampas. (As manchas podem ser armazenadas no béquer por semanas).
- Coloque as tampas em uma placa de Petri e, em seguida, aplique 3-4 pontos de cera no deslizamento de cobertura para servir como pés. Use uma pipeta Pasteur para mergulhar em cera fervida em uma garrafa de vidro. Em seguida, toque rapidamente no deslizamento de cobertura para criar um ponto. Uma placa de Petri de 60 mm pode conter 4 tampas. Uma placa de Petri de 10 mm pode conter ~10 tampas.
- 2 dias antes do dia da cultura, as tampas do casaco (o lado com os pontos de cera) com filtro esterilizado 1 mg/mL de poli-l-lisina em 0,1 M de ácido bórico (pH 8,5) por um mínimo de 6 horas e enxágüe com água 2 vezes, 1 hora cada vez. Os coverlips permanecem na mesma placa de Petri.
- Adicione meio de revestimento (MEM suplementado com glicose 0,6% (wt/vol) e 10% (vol/vol) serum de cavalo) às placas lentamente sem deslizamentos perturbadores. Coloque placas na incubadora até o dia da cultura para os neurônios de sementes.
2. Preparando pratos alimentador de células glia (2 semanas antes do dia da cultura)
- Disseque o córtex de um cérebro de camundongos pós-natal de 1 dia e retire as meninges.
- Pique o tecido do córtex o mais fino possível com uma tesoura limpa em uma placa de Petri limpa em um banco limpo.
- Transfira o tecido picado em 12 mL de HBSS e adicione 1,5 mL de trippsina de 2,5% e 1% (wt/vol) DNase. Incubar em um banho de água de 37 °C por 15 minutos, gire a cada 5 minutos. Tecido bem digerido fica pegajoso e forma um grande aglomerado. Triturar 10-15 vezes com uma pipeta de 10 mL para quebrar o tecido e obter melhor digestão.
- Triturar o tecido bem digerido 10-15 vezes com uma pipeta de 5 mL até que a maioria dos pedaços desapareça e o meio fique nublado. Passe por um coador de células para remover os pedaços restantes e adicione 15 mL de glia média (Meio Essencial Mínimo (MEM) suplementado com glicose (0,6% wt/vol), 10% (vol/vol) serum de cavalo e penicilina-estreptomicina (1x) para parar a digestão.
- Centrifugar as células a 120 x g por 5 minutos e aspirar o supernasce. Resuspend a pelota celular com glia fresca média e semente em pratos de cultura celular (cerca de 105 células/cm2).
- Substitua o meio por meio glia fresco no dia seguinte para remover células nãoectadas.
- Alimente os pratos glia a cada 3-4 dias com meio glia fresco. Bata o frasco 5-10 vezes com uma mão para desalojar células frouxamente ligadas antes de mudar de meio.
- Após 10 dias de cultura, as células glia devem ser quase confluentes. Desprender células glia com 0,25% de trippsin-EDTA e sementes cerca de 105 células em um novo prato de cultura celular de 60 mm. As células remanescentes podem ser congeladas para uso futuro.
- 3 dias antes do dia da cultura, mude o meio de cultura média glia para o neurônio (Neurobasal-A Medium com 1x GlutaMAX-I e 1x suplemento B27).
3. Cultura de neurônios hipocampais
NOTA: Todas as etapas são realizadas em temperatura ambiente.
- Disseque 6-8 hipocampi de filhotes pós-natais de 1 dia de idade de ratos ANK3-E22/23f/f com meio HBSS em uma placa de Petri na sala temperada. Pique o hipocampi com uma tesoura de dissecção em pedaços menores. Transfira hipocampi da placa de Petri para um tubo de 15 mL.
- Lave hipocampi 2x com 5 mL de HBSS no tubo. Deixe o hipocampi em 4,5 mL de 1x HBSS após a lavagem.
- Adicione 0,5 mL de trippsina de 2,5% em 4,5 mL de HBSS e incubar em um banho de água de 37 °C por 15 minutos. Inverta o tubo a cada 5 minutos. Hipocampi bem digerido deve ficar pegajoso e formar um aglomerado. Se necessário, amplie a digestão por mais 5 minutos.
- Lave o hipocampi com HBSS 3 vezes por 5 minutos cada. Não use um vácuo para remover o HBSS. É muito fácil remover o hipocampi.
- Adicione 2 mL de HBSS após a lavagem e pipeta o hipocampi para cima e para baixo com uma pipeta Pasteur 15 vezes.
- Triturar o tecido com uma pipeta Pasteur polida com fogo (o diâmetro do aberto é reduzido pela metade) 10 vezes. Não vá além de 10 vezes, mesmo que ainda haja pedaços restantes. A sobressalagem mata neurônios.
- Descanse o tubo por 5 minutos até que todos os pedaços fiquem no fundo. Use suavemente uma ponta de pipeta de 1 mL para transferir o supernasciante contendo os neurônios dissociados para pratos de revestimento (105 células/60 mm de prato). Adicione-o diretamente ao meio de chapeamento pré-incubado e agite a placa suavemente.
- Repita o passo 3.6-3.7 com os pedaços restantes até que a maioria dos pedaços tenham desaparecido.
- 2-4 horas após a semeadura, verifique os pratos de revestimento com um microscópio leve. A maioria dos neurônios deveria ter ligado ao deslizamento. As células anexadas são redondas e brilhantes. Deslizes de flip usando uma ponta fina fórceps para os pratos alimentador de células glia com meio de cultura neuronal pré-condicionado com os pontos de cera de lado voltados para baixo.
- Os neurônios podem crescer nos pratos alimentador de células glia por até 1 mês. Alimentar neurônios a cada 7 dias com 1 mL de meio de cultura neuronal fresca.
- Passo opcional: 1 semana após a semeadura, adicione citose arabinoside (1-β-D-arabinofuranosylcytosine) a uma concentração final de 5 μM para conter a proliferação glial.
4. Interrupção da AIS por Nocaute de Ankyrin-G em estágio anterior do desenvolvimento de neurônios
- Em 3 div (dia in vitro),vire as tampas com pontos de cera de lado voltados para um prato alimentador de células glia com meio de cultura neuronal condicionada.
- Misture 0,25 μg de DNA Cre-BFP com 0,5 μg de DNA ankyrin-G-GFP (WT/mutante) em um tubo de 1,7 mL para transfectar 4 tampas (~ 2:1 proporção do número de cópia de DNA). Adicione 100 μL de meio de cultura (por exemplo, Opti-MEM), misture e descanse em um rack. Se apenas o Cre-BFP for transfeinado, a espinha dorsal plasmida GFP é usada para corresponder à quantidade total de DNA.
- Misture 3 μL de reagente de transfecção (por exemplo, Lipofectamina 2000) (~ 3 vezes de DNA) com 100 μL de cultura média em um novo tubo de 1,7 mL. Incubar por 5 minutos na RT.
- Misture 100 μL de solução de DNA a partir da etapa 4.2 com 100 μL de reagente de transfecção a partir da etapa 4.3. Descanse por 5-10 minutos em um rack.
- Adicione 50 μL de mistura de DNA a partir da etapa 4.4 em cima de cada mancha de cobertura, inserindo a ponta logo abaixo do meio sem tocar nas tampas. Pipeta lentamente para evitar a propagação da mistura de DNA.
- Leve lentamente o prato de volta para a incubadora e incubar por 30-45 minutos.
- Vire as tampas de volta para o prato alimentador de glia caseiro com pontos de cera de lado voltado para baixo e coloque o prato de volta para a incubadora.
5. Quantificação do segmento inicial do axônio
- Fixar neurônios em 7-10 div e manchar com marcador AIS seguindo o protocolo padrão de imunocitoquímica para a proteína de interessante.
- Colete imagens fluorescentes com microscopia desejada.
- Pegue seções da série Z para coletar o sinal de toda a AIS. Mantenha a mesma profundidade Z para todas as fotos.
- Ajuste a intensidade do laser para atingir o melhor alcance dinâmico de intensidade de pixel.
- Certifique-se de que todas as fotos AIS sejam tiradas na mesma configuração de microscópio.
- Verifique sempre o sinal de Cre-BFP.
- Quantificação AIS
- Imagem aberta com Fiji (https://fiji.sc).
- Gere projeção máxima de imagens da série Z.
- Subtraia o sinal de fundo de deslizamento de tampas vazio da imagem.
- Desenhe uma linha ao longo da AIS. A largura da linha deve cobrir totalmente o AIS. Inicie a linha antes que o sinal AIS seja levantado acima do plano de fundo e pare depois que ele cair para o fundo.
- Meça a intensidade média do pixel sozinha a linha e exporte para uma planilha (~10-15 AISs são necessárias).
- Gere a curva média de intensidade da AIS usando o script MATLAB adaptado de Berger et al.15.
- Para cada experimento, inclua apenas cre e Cre mais wildtype 480 kDa neurônios transfectados como controles negativos e positivos para garantir que o nocaute da AIS seja eficiência e o resgate seja bem sucedido.
Resultados
Um conjunto completo de experimentos deve incluir apenas a transfecção cre-BFP como controle negativo, Cre-BFP mais 480 kDa co-transfecção ankyrin-G como controle positivo e uma condição não transfectada como controle técnico. No controle somente do Cre-BFP, os neurônios transfectados não possuem o acúmulo de marcadores AIS, incluindo ankyrin-G (ankG), beta4-spectrin (β4), neurofascina (Nf) e canais de sódio fechados de tensão (VSVG)(Figura 4A)16. Em contraste, os neurônios co-transfecidos Cre e 480 kDa ankyrin-G montaram totalmente a AIS revelada pelo presente dos marcadores AIS(Figura 4B). É importante confirmar a qualidade da cultura comparando-se com os pratos não transfectados. Neurônios insalubres tendem a apresentar estrutura AIS anormal, como AIS descontinuada ou ectópica(Figura 4C).
Em seguida, mostramos um exemplo de avaliação de como uma mutação da desordem neurodesenvolvimentista humana anquilina-G (ankG-K2864N) afeta o montagem da AIS(Figura 5). 3 div ANK3-E22/23f/f neurônios foram transfectados com Cre-BFP e wildtype 480 kDa ankyrin-G (ankG-WT) ou 480 kDa ankyrin-G que barram mutação humana (ankG-K2864). Os neurônios foram fixados em div7 e manchados para ankyrin-G. As imagens foram coletadas de 10-15 neurônios transfetados e 10-15 neurônios de controle nas mesmas tampas e processados com projeção de intensidade máxima. Em seguida, desenhamos uma linha na AIS como mostrado e medimos a intensidade média através da linha. Depois de uma média da intensidade de AIS, traçamos a intensidade de AIS da soma para o axônio distal. A proteína enriquecida AIS normalmente mostrou um rápido aumento de sinal do axônio proximal e uma lenta diminuição do sinal para o axônio distal. AIS montado por anquilo-G com mutante humano mostrou um aumento e diminuição do sinal. Mas quando alinhada com a AIS não transfectada, a curva mutante é mais larga, e o pico da curva é menor sugerindo uma mudança de estrutura da AIS. O anquilo-G do tipo selvagem montou AIS intimamente alinhado com o não transfectado.
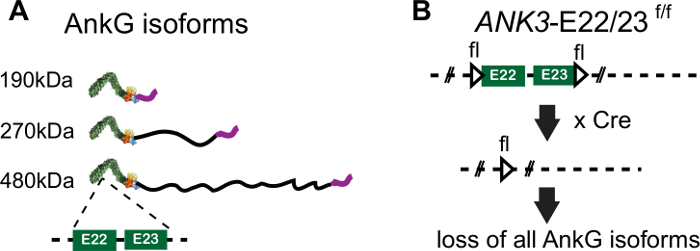
Figura 1: A edição genômica de ANK3-E22/23-flox. (A) Representação esquemática de domínios proteicos para isoformas ankyrin-G. A localização das regiões codificadas exon 22 e 23 em domínio canônico é apontada pela linha de traço. (B) A posição dos locais loxP em camundongos ANK3-E22/23-flox é indicada por triângulo. No presente da Cre recombinase, o exon 22 e 23 é excluído e causa perda da expressão de todos os 3 isoformes de anquilina-G. Clique aqui para ver uma versão maior desta figura.

Figura 2: Perda de AIS em neurônios ANK3-E22/23-flox no presente de Cre recombinase. Um diagrama mostra o período de tempo da expressão anquilina-G e do conjunto AIS em neurônios do tipo selvagem versus em neurônios ANK3-E22/23f/f com transfecção de Cre em 3 div. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: Fluxo de trabalho do protocolo. Clique aqui para ver uma versão maior desta figura.
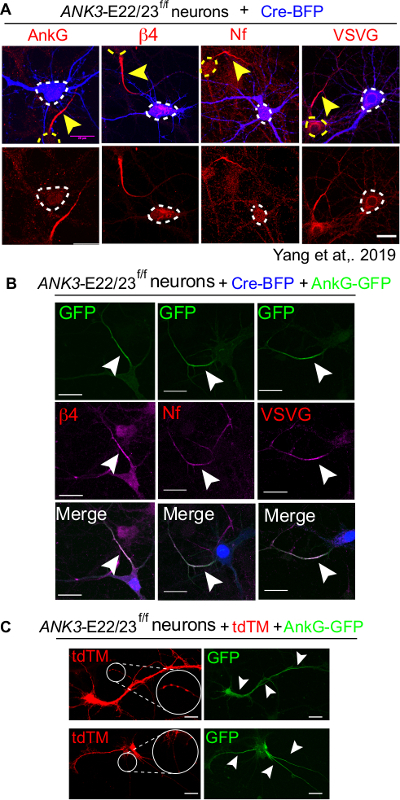
Figura 4: Um resgate completo de AIS por 480kDa AnkG em neurônios ANK3-E22/23-flox transfectados com Cre. 3 neurônios div de camundongos ANK3-E22/23f/f foram transfectados com Cre-BFP (A) ou com um Cre-BFP e tipo selvagem 480 kDa ankyrin-G-GFP (B). Os neurônios foram fixados em 7 div e manchados para ankyrin-G (ankG), β4-spectrin (β4), neurofascina (Nf) e canais de sódio fechados de tensão (VSVG). A cabeça da seta branca aponta para a AIS de um neurônio transfectado. A barra de escala é de 20 μm. Este número foi adaptado de Yang et al16. (C) Dois neurônios insalubres transfectados com tdTM e 480 kDa ankyrin-G-GFP foram mostrados. A formação de agregados (circulados em branco e ampliados) é um sinal de neurônios insalubres. Topo: 480 kDa ankyrin-G aparece na região não-AIS (apontada por cabeças de seta branca. Inferior: O neurônio formou 3 AIS e acúmulo ectópico de ankyrin-G na soma. A barra de escala é de 20 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Quantificação da mudança estrutural da AIS. os neurônios div3 dos camundongos ANK3-E22/23f/f foram transfectados com Cre-BFP e tipo selvagem 480 kDa ankyrin-G ou 480 kDa ankyrin-G-K2864N. Às 7 div, os neurônios foram fixados e manchados para ankyrin-G. Imagens representativas mostram o sinal anquilo-G na AIS. A linha verde e a linha amarela indicam onde a linha para medição de intensidade de AIS foi desenhada. A linha de traço branco circulou o corpo celular do neurônio transfectado. A barra de escala é de 20 μm. A intensidade média da AIS para ambas as condições é traçada sozinha à distância e alinhada com células não transfectadas (n=10). Clique aqui para ver uma versão maior desta figura.
Discussão
A montagem da AIS é organizada por 480 kDa ankyrin-G. No entanto, ankyrin-G tem isóformes mais curtos que podem atingir a AIS de neurônios tipo selvagem, o que pode levar à dificuldade de interpretação das análises estrutura-função do conjunto AIS. Aqui apresentamos um método utilizando neurônios de camundongos ANK3-E22/23-flox que permite o estudo da montagem de novo da AIS. Transfeciando com Cre-BFP em 3 div, eliminamos todas as isoformas endógenas de ankyrin-G. Também poderíamos co-transfeito 480 kDa ankyrin-G para resgatar a formação de AIS. Isso permite o estudo da formação de AIS em um sistema limpo. Ao adotar ainda mais o sistema de cultura Banker que melhora a viabilidade sem complicações do excesso de crescimento celular glial, poderíamos alcançar uma alta eficiência de transfecção, que nos fornece neurônios suficientes para a medição quantitativa das dimensões da AIS.
Há várias etapas críticas neste protocolo. O primeiro passo crítico é considerar a melhor janela de tempo para fazer a transfecção, que precisa ser precoce o suficiente para evitar a montagem de AIS e tarde o suficiente para alcançar a maior eficiência de transfecção. Tentamos 0 transfecção de eletroporação div, que deu cerca de 10% de eficiência de transfecção apenas com Cre-BFP, mas nunca fomos capazes de transfectar 480 kDa Ankyrin-G em 0 div. Suspeitamos que seja devido ao grande tamanho do plasmídeo (cerca de 20 kb). Neurônios hipocampais cultivados primários têm uma janela estreita para transfecção, que é entre 3-5 dias. O acúmulo de ankyrin-G na AIS começa a partir de 3 div. Quando transfectamos Cre-BFP em 3 div, nenhuma formação de AIS foi vista em neurônios transfectados(Figura 4A). Poderíamos obter 10-20 neurônios transfectados com 480 kDa ankyrin-G de um deslizamento de cobertura de 18 mm. Além disso, para o experimento de resgate de co-transfecção, todo o DNA deve ser gerado sob o mesmo promotor e a razão de Cre-BFP e 480 kDa ankyrin-G-GFP deve ser combinada. Neste experimento, usamos o promotor de beta-actina de frango.
Outro passo crítico é a modificação da cultura do Banqueiro. A cultura banker foi desenvolvida para cultivar neurônios de ratos embrionários. Para apoiar melhor o neurônio hipocampal pós-natal do rato mais sensível, incluímos um passo de cortar hipocampi em pedaços menores para melhorar a eficiência de trippsinização. A adição do tratamento KOH após o tratamento do ácido nítrico reduziu ainda mais a toxicidade das tampas de vidro, que ajudam os neurônios a se prenderem e crescerem melhor.
Um desafio restante é como controlar o nível de expressão de ankyrin-G. Uma tela de dosagem ajudou a determinar a quantidade ideal de plasmídeo usado para transfecção. Daqui para frente, é melhor usar um promotor específico de neurônios para controlar o nível de expressão. A análise dos dados atuais não mediu a posição da AIS. Esta função deve ser incluída no futuro.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ao Dr. Gary Banker por sugestão sobre o protocolo de cultura neuronal. Este trabalho é apoiado pelo Howard Hughes Medical Institute, uma bolsa do NIH, e um professor dotado de George Barth Geller (V.B.).
Materiais
| Name | Company | Catalog Number | Comments |
| 10xHBSS | Thermo Fisher Scientific | 14065-056 | |
| 18mm coverglass (1.5D) | Fisher Scientific | 12-545-84-1D | |
| 190kDa ankyrin-G-GFP | Addgene | #31059 | |
| 2.5% Tripsin without phenol red | Thermo Fisher Scientific | 14065-056 | |
| 480kDa ankyrin-G-GFP | lab made | Provide upon request | |
| ANK3-E22/23f/f mice | JAX | Stock No: 029797 | B6.129-Ank3tm2.1Bnt/J; |
| B27 serum-free supplement | Thermo Fisher Scientific | A3582801 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cell strainer with 70-mm mesh | BD Biosciences | 352350 | |
| Ceramic coverslip-staining rack | Thomas Scientific | 8542E40 | |
| Cre-BFP | Addgene | #128174 | |
| D-Glucose | Sigma-Aldrich | G7021 | |
| DMEM | Thermo Fisher Scientific | 11995073 | |
| GlutaMAX-I supplement | Thermo Fisher Scientific | A1286001 | |
| Lipofectamine 2000 | Thermo Fisher Scientific | 11668030 | |
| MEM with Earle’s salts and L-glutamine | Thermo Fisher Scientific | 11095-080 | |
| Neurobasal Medium | Thermo Fisher Scientific | 21103-049 | |
| Nitric acid 70% | Sigma-Aldrich | 225711 | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific | 31985062 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin-streptomycin | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrochloride | Sigma-Aldrich | 26124-78-7 | |
| Potassium hydroxide | Sigma-Aldrich | 1310-58-3 |
Referências
- Nelson, A. D., et al. Correction: Ankyrin-G regulates forebrain connectivity and network synchronization via interaction with GABARAP. Molecular Psychiatry. , (2019).
- Tseng, W. C., Jenkins, P. M., Tanaka, M., Mooney, R., Bennett, V. Giant ankyrin-G stabilizes somatodendritic GABAergic synapses through opposing endocytosis of GABAA receptors. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 1214-1219 (2015).
- Tai, Y., Gallo, N. B., Wang, M., Yu, J. R., Van Aelst, L. Axo-axonic Innervation of Neocortical Pyramidal Neurons by GABAergic Chandelier Cells Requires AnkyrinG-Associated L1CAM. Neuron. 102 (2), 358-372 (2019).
- Hofflin, F., et al. Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex. Frontiers in Cellular Neuroscience. 11, 332 (2017).
- Schluter, A., et al. Structural Plasticity of Synaptopodin in the Axon Initial Segment during Visual Cortex Development. Cerebral Cortex. 27 (9), 4662-4675 (2017).
- Kuba, H., Oichi, Y., Ohmori, H. Presynaptic activity regulates Na(+) channel distribution at the axon initial segment. Nature. 465 (7301), 1075-1078 (2010).
- Grubb, M. S., Burrone, J. Activity-dependent relocation of the axon initial segment fine-tunes neuronal excitability. Nature. 465 (7301), 1070-1074 (2010).
- Pan, Z., et al. A common ankyrin-G-based mechanism retains KCNQ and NaV channels at electrically active domains of the axon. Journal of Neuroscience. 26 (10), 2599-2613 (2006).
- Cooper, E. C. Made for "anchorin": Kv7.2/7.3 (KCNQ2/KCNQ3) channels and the modulation of neuronal excitability in vertebrate axons. Seminars in Cell & Developmental Biology. 22 (2), 185-192 (2011).
- Zhou, D., et al. AnkyrinG is required for clustering of voltage-gated Na channels at axon initial segments and for normal action potential firing. The Journal of Cell Biology. 143 (5), 1295-1304 (1998).
- Kordeli, E., Lambert, S., Bennett, V. AnkyrinG. A new ankyrin gene with neural-specific isoforms localized at the axonal initial segment and node of Ranvier. Journal of Biological Chemistry. 270 (5), 2352-2359 (1995).
- Jenkins, P. M., et al. Giant ankyrin-G: a critical innovation in vertebrate evolution of fast and integrated neuronal signaling. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 957-964 (2015).
- Jenkins, P. M., et al. E-cadherin polarity is determined by a multifunction motif mediating lateral membrane retention through ankyrin-G and apical-lateral transcytosis through clathrin. Journal of Biological Chemistry. 288 (20), 14018-14031 (2013).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1 (5), 2406-2415 (2006).
- Berger, S. L., et al. Localized Myosin II Activity Regulates Assembly and Plasticity of the Axon Initial Segment. Neuron. 97 (3), 555-570 (2018).
- Yang, R., et al. Neurodevelopmental mutation of giant ankyrin-G disrupts a core mechanism for axon initial segment assembly. Proceedings of the National Academy of Sciences of the U S A. 116 (39), 19717-19726 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados