Method Article
축 사 초기 세그먼트의 조립을 공부 하는 기본 배양 된 해마 뉴런의 사용
요약
여기서, 우리는 거대한 ankyrin-G의 부재로 인해 사전 조립된 AIS가 부족한 해마 뉴런의 축삭 초기 세그먼트(AIS)의 조립 및 구조를 정량적으로 연구하는 프로토콜을 기술하였다.
초록
신경 축 축 하 초기 세그먼트 (AIS) 행동 잠재력의 개시의 사이트 이며 광범위 하 게 그들의 분자 구조대 한 연구 되었습니다., 조립 및 활동 의존가성 가소성. AIS의 마스터 오거나이저인 거대 앙키린-G는 멤브레인 스패닝 전압 게이트 나트륨(VSVG) 및 칼륨 채널(KCNQ2/3)과 L1CAM 세포 접착 분자인 186 kDa neurofascin과 직접 연결됩니다. 거대한 ankyrin-G는 또한 베타-4-spectrin및 microtubule 결합 단백질, EB1/EB3 및 Ndel1을 포함하여 세포질 AIS 분자를 결합하고 모집합니다. 거대한 ankyrin-G는 ankyrin-G 결핍 뉴런에서 AIS 형성을 구출하기에 충분합니다. Ankyrin-G는 또한 AIS를 대상으로 하거나 ankyrin-G-결핍 뉴런에서 AIS를 구출할 수 없는 AIS 대신 수지상 척추에 위치한 작은 190 kDa 이소형을 포함합니다. 여기서, 우리는 ANK3-E22/23-flox마우스에서 배양 해마 뉴런을 사용하여 프로토콜을 설명했는데, 이는 Cre-BFP로 감염될 때 안키린-G의 모든 동위체의 손실을 나타내고 AIS의 형성을 손상시킵니다. 수정된 뱅커 글리아/뉴런 공동 배양 시스템을 결합하여, AIS의 형성을 구출하기에 충분한 480kDa ankyrin-GFP 플라스미드로 안키린-G널 뉴런을 횡단하는 방법을 개발했습니다. 우리는 또한 해마 뉴런 배양에서 발생하는 신경 세포 체로부터AIS 거리의 변화를 처리하기 위해 Salzer와 동료에 의해 개발 된 정량화 방법을 사용합니다. 이 프로토콜을 사용하면 de novo 어셈블리의 정량적 연구와 AIS의 동적 동작을 허용합니다.
서문
축 사 초기 세그먼트는 대부분의 척추 동물 뉴런에서 근위 축 축 에 위치. 기능적으로 AIS는 이 지역의 전압 게이트 나트륨 채널의 고밀도로 인해 작업 전위가 시작되는 곳입니다. 일부 흥분 성 뉴런의 AIS는 또한 GABAergic 시냅스1,2,3형성을통해 억제 인터뉴런에 의해 표적화된다. 따라서 AIS는 세포 신호를 통합하고 뉴런의 흥분성을 조절하는 중요한 사이트입니다. AIS는 일반적으로 길이가 20-60 μm이며 세포 체체의 20 μm 내에 있습니다. AIS의 길이와 위치는 뇌 영역을 통해 뉴런뿐만 아니라 동일한 뉴런4,5의다른 발달 단계에서 다릅니다. 축적된 증거는 AIS의 조성및 위치가 뉴런 활동의 변화에 반응하는데 역동적인 것으로 나타났다4,5,6,7.
480 kDa ankyrin-G는 AIS의 마스터 오거나이저입니다. 480 kDa ankyrin-G는 전압 게이트 나트륨 채널뿐만 아니라 베타4-스펙트린, KCNQ2/3 채널을 포함한 다른 주요 AIS 단백질에 직접 결합하는 멤브레인 관련 어댑터 단백질로 나트륨 채널 활성8,9,및 186 kDa neurofascin, GABAergicssic을 직접 하는 L1CAM입니다. 480 kDa ankyrin-G는 짧은 190 kDa ankyrin-G isoform (ANK 반복, 스펙트럼 결합 도메인, 규제 도메인)에서 발견되는 표준 앙키린 도메인을 공유하지만 척추 동물에서만 발견되며 뉴런(그림 1A)11,12에서구체적으로 표현되는 거대한 엑소로 구별됩니다. 480 kDa ankyrin-G 뉴런 특이 도메인(NSD)은 AIS형성(12)에필요하다. 190 kDa ankyrin-G는 ankyrin-G-null뉴런(12)에서AIS 어셈블리 또는 타겟 AIS를 촉진하지 않는다. 그러나, 190 kDa ankyrin-G는 480 kDa ankyrin-G12를포함하는 AIS에 집중된다. 190kDa ankyrin-G의 이러한 능력은 야생형 뉴런의 사전 조립된 AIS를 표적으로 하는 것이 문헌의 혼란의 원천이었으며 AIS 어셈블리에서 480kDa ankyrin-G의 중요한 전문 기능에 대한 인식을 늦추고 있다. 따라서 사전 조립된 AIS가 부족한 안키린-G-null 뉴런에서 AIS 어셈블리를 연구하는 것이 중요합니다.
여기서, 안키린-G13(도 1B)의모든 등색을 제거하는 ANK3-E22/23-flox 마우스로부터 배양된 해마 뉴런을 사용하여 AIS의 조립 및 구조를 연구하는 방법을 제시한다. AIS가 조립되기 전에 Cre-BFP 구조로 뉴런을 변형시킴으로써, 우리는 완전히 AIS(도 1B, 도 2)가부족한 ankyrin-G-결핍 뉴런을 생성했습니다. AIS의 조립은 Cre-BFP 플라스미드와 480 kDa ankyrin-G-GFP 플라스미드의 공동 변환에 따라 완전히 구출된다. 이 방법은 사전 조립되지 않은 AIS 환경에서 AIS 어셈블리를 연구하는 방법을 제공합니다. 또한 이전에 배아일 18뉴런을 위해 설계된 항생제를 사용하지 않고 게리 뱅커로부터 글리아-뉴런 공동 배양 시스템을 수정하여 산후 마우스 뉴런에 적용하고 AIS14,15의변이를 정상화하기 위해 여러 뉴런으로부터 AIS 측정을 평균하는 AIS 수량 방법을 적용하였다.
프로토콜
참고: 산후 0일 ANK3-E22/23f/f 마우스에서 해마 뉴런의 이 배양 방법은 게리 뱅커의 glia/neuron 공동 배양 시스템에서 채택된다. 따라서 멸균 도구를 사용하여 깨끗한 후드에서 해부 후 모든 단계를 수행하는 것이 중요합니다. 이 프로토콜은 최대 1개월이 소요됩니다. 워크플로가 그림 3에표시됩니다. 이 프로토콜은 듀크 대학의 동물 지침을 따릅니다.
1. 커버립 및 뉴런 도금 접시 준비
- 문화일 최소 1주일 전에 커버슬립 랙에 덮개를 적재하고 하룻밤 사이에 질산(70%W/W)에 담급니다(며칠 동안 연장될 수 있음).
- 질산 처리 커버립을 유리 항아리에 있는 저속 셰이커에 증류수로 입술을 2회, 1시간 씩 세척합니다.
- 포화 KOH의 커버립을 포화 된 KOH로 하룻밤 사이에 100 % 에탄올로 용해. KOH를 에탄올에 추가하면 더 이상 용해되지 않습니다.
- 증류수로 세척 단계를 반복합니다. 10분 동안 100% 에탄올로 커버립을 헹구고 있습니다.
- 랙에서 유리 비커로 커버립을 옮기. 비커를 알루미늄 호일로 덮습니다. 커버립을 밤새 225°C 오븐에 굽고 커버립을 살균합니다. (커버립은 몇 주 동안 비커에 보관할 수 있습니다.).
- 페트리 접시에 커버립을 놓고 커버슬립에 3-4 왁스 점을 바르면 발역할을 합니다. 파스퇴르 파이펫을 사용하여 유리 병에 삶은 왁스에 담급드세요. 그런 다음 빠르게 커버슬립을 터치하여 점을 만듭니다. 60mm 페트리 디쉬가 커버립 4개수. 10mm 페트리 디쉬가 ~10개의 커버립을 담을 수 있습니다.
- 문화일 2일 전, 필터 살균 1 mg/mL 폴리-L-리신을 0.1M boric acid(pH 8.5)로 살균한 코트 커버립(왁스 도트 사이드)은 최소 6시간 동안 물로 2회, 1시간 씩 헹구고 있다. 커버립은 페트리 요리에 남아 있습니다.
- 도금 매체(포도당 0.6%(wt/vol)와 10%(vol/vol) 말 세럼으로 보충된 MEM을 커버립을 방해하지 않고 천천히 접시에 넣습니다. 배양의 날까지 인큐베이터에 플레이트를 넣고 뉴런을 종자합니다.
2. 글리아 세포 피더 요리 준비 (문화일 2 주 전)
- 산후 1 일 된 마우스 뇌에서 피질을 해부하고 수막을 벗겨냅니다.
- 깨끗한 벤치에 깨끗한 페트리 접시에 깨끗한 가위로 피질 조직을 가능한 한 잘게 자릅니다.
- 다진 조직을 HBSS 12mL로 옮기고 1.5mL의 트립신과 1%(wt/vol) DNase를 추가합니다. 37°C 수조에서 15분 동안 배양하고 5분마다 스윙합니다. 잘 소화 된 조직은 끈적해지고 큰 클러스터를 형성합니다. 조직을 분해하고 더 나은 소화를 얻기 위해 10 mL 파이펫으로 10-15 번 트리투레이.
- 대부분의 덩어리가 사라지고 중간이 흐려질 때까지 잘 소화된 조직을 5mL 파이펫으로 10-15번 트리투레이합니다. 남은 덩어리를 제거하고 15mL의 글리아 배지(최소 필수 매체(MEM)를 포도당(0.6% wt/vol), 10%(vol/vol) 말 혈청 및 페니실린-스트렙토마이신(1x)으로 첨가하여 소화를 막습니다.
- 세포를 120 x g에서 5분간 원심분리하고 수퍼나탄을 흡인시합니다. 세포 배양 접시에 신선한 glia 매체와 종자 셀 펠릿을 다시 중단 (약 105 세포/cm2).
- 부착되지 않은 세포를 제거하기 위해 다음 날 신선한 신경교 매개체로 배지를 대체하십시오.
- 신선한 glia 매체로 3-4 일마다 glia 접시를 먹입니다. 플라스크를 손으로 5-10번 때려 느슨하게 부착된 세포를 빼내게 한 후 배지를 변경합니다.
- 문화의 10 일 후에, glia 세포는 거의 confluent되어야 합니다. 0.25% 트립신-EDTA를 가진 분리된 glia 세포 및 새로운 60 mm 세포 배양 접시에 있는 대략105 개의 세포를 종자. 남은 세포는 향후 사용을 위해 동결될 수 있습니다.
- 문화일 3일 전, 신경 배양 배지로 글리아 배지를 변경합니다(글루타맥스-I 1x 및 B27 보충제를 곁들인 신경병대-A 배지).
3. 문화 해마 뉴런
참고: 모든 단계는 실온에서 수행됩니다.
- 방 온대에서 페트리 접시에 HBSS 배지와 ANK3-E22/23f / f 마우스에서 산후 1 일 된 새끼에서 6-8 해마를 해부. 해부 가위로 해마를 작은 조각으로 자릅니다. 페트리 접시에서 15mL 튜브로 해마를 옮는다.
- 튜브에 5mL의 HBSS로 해마 2x를 씻으십시오. 세척 후 1x HBSS의 4.5mL에 해마를 둡니다.
- HBSS의 4.5mL에 2.5%의 트립신의 0.5mL를 추가하고 15 분 동안 37 ° C 수조에 인큐베이션하십시오. 5분마다 튜브를 반전시면 됩니다. 잘 소화 된 해마는 끈적거리고 클러스터를 형성해야합니다. 필요한 경우 소화를 5분 더 연장합니다.
- HBSS로 해마를 각각 5분간 3회 세척합니다. 진공을 사용하여 HBSS를 제거하지 마십시오. 해마를 제거하는 것은 매우 쉽습니다.
- 세척 후 HBSS 2mL을 추가하고 파스퇴르 파이펫으로 해마를 위아래로 15 번 넣습니다.
- 불을 연마한 파스퇴르 파이펫(개방의 직경이 절반으로 좁혀져 있음)으로 조직을 10회 트리투레이합니다. 여전히 덩어리가 남아 있더라도 10 배를 넘지 마십시오. 과열은 뉴런을 죽인다.
- 모든 덩어리가 바닥으로 설정될 때까지 튜브를 5분간 쉬게 합니다. 부드럽게 1mL 파이펫 팁을 사용하여 분리된 뉴런을 함유한 상체를 도금 접시(105셀/60mm 접시)로 옮길 수 있습니다. 사전 배양 된 도금 매체에 직접 추가하고 접시를 부드럽게 흔들어 줍니다.
- 대부분의 청크가 사라질 때까지 나머지 청크와 함께 3.6-3.7 단계를 반복합니다.
- 파종 후 2-4시간 후에는 가벼운 현미경으로 도금 접시를 확인하십시오. 뉴런의 대부분은 커버 슬립에 부착해야합니다. 부착 된 셀은 둥글고 밝습니다. 왁스 점 측이 아래쪽을 향하고 있는 사전 조건화된 뉴런 배양 배지를 사용하여 미세 팁 집게를 사용하여 커버립을 뒤집습니다.
- 뉴런은 최대 1개월 동안 glia 세포 피더 접시에서 자랄 수 있습니다. 신선한 신경 배양 배지의 1 mL로 7 일마다 뉴런을 공급하십시오.
- 선택적 단계: 시토신 아라비노사이드(1-β-D-아라비노실시토신)를 5μM의 최종 농도에 추가하여 교아세포의 확산을 억제합니다.
4. 뉴런 개발의 초기 단계에서 Ankyrin-G의 녹아웃에 의해 AIS의 중단
- 3 div (체외에서)커버립을 왁스 도트 측으로 조절 된 신경 배양 배지가있는 glia 세포 피더 접시까지 향합니다.
- Cre-BFP DNA의 0.25 μg와 ankyrin-G-GFP(WT/돌연변이) DNA를 1.7mL 튜브에 혼합하여 4개의 커버립(DNA 카피 번호의 2:1 비율)을 변환합니다. 배양 매체(예: Opti-MEM)의 100μL을 넣고 랙에 혼합하고 휴식을 취합니다. Cre-BFP만 전염되는 경우, GFP 플라스미드 백본은 총 DNA 양과 일치하도록 사용된다.
- 새로운 1.7mL 튜브에 100 μL 배양 배지와 함께 3 μL의 형질 전환 시약(예를 들어, Lipofectamine 2000)(DNA의 3배)을 혼합한다. RT에서 5분간 배양하세요.
- 4.2단계에서 DNA 용액 100 μL을 4.3단계에서 100 μL의 트랜스페트 시약과 혼합합니다. 랙에서 5-10분 간 휴식을 취하십시오.
- 커버립을 건드리지 않고 중간 크기 바로 아래에 팁을 삽입하여 각 커버슬립 의 상단에 4.4 단계에서 50 μL의 DNA 믹스를 추가합니다. 피펫은 DNA 혼합의 확산을 피하기 위해 천천히.
- 접시를 인큐베이터로 천천히 가져와 서 30-45 분 동안 배양하십시오.
- 커버립을 왁스 도트 측이 내려다보고 접시를 인큐베이터에 다시 넣은 홈 글리아 피더 접시에 다시 플립합니다.
5. 축축기 초기 세그먼트의 정량화
- 흥미로운 단백질에 대한 표준 면역 세포화학 프로토콜에 따라 AIS 마커로 7-10 div 및 얼룩에 뉴런을 수정합니다.
- 원하는 현미경 검사법과 형광 사진을 수집합니다.
- Z 시리즈 섹션을 사용하여 전체 AIS의 신호를 수집합니다. 모든 사진에 대해 동일한 Z 깊이를 유지합니다.
- 레이저 강도를 조정하여 최상의 픽셀 강도 동적 범위에 도달합니다.
- 모든 AIS 사진이 동일한 현미경 설정에서 촬영되는지 확인합니다.
- 항상 Cre-BFP의 신호를 확인합니다.
- AIS 정량화
- 피지 (https://fiji.sc)와 함께 사진을 엽니 다.
- Z 시리즈 이미지의 최대 투영을 생성합니다.
- 이미지에서 빈 커버 슬립 배경 신호를 뺍니다.
- AIS를 따라 선을 그립니다. 선의 너비는 AIS를 완전히 커버해야 합니다. AIS 신호가 배경 위로 올라오기 전에 선을 시작하고 배경으로 떨어뜨린 후 중지합니다.
- 평균 픽셀 강도를 단독으로 측정하고 스프레드시트로 내보냅니다(~10-15개의 AI가 필요합니다).
- Berger등에서조정된 MATLAB 스크립트를 사용하여 AIS의 평균 강도 곡선을 생성합니다.
- 각 실험에 대해, Cre 전용 및 Cre 플러스 야생형 480 kDa ankyrin-G 를 음수 및 양성 제어로 트랜스감염시킨 뉴런을 포함하여 AIS의 녹아웃이 효율이고 구조가 성공했는지 확인합니다.
결과
실험의 완전한 세트는 음성 제어로 Cre-BFP 만 트랜스페션을 포함해야, Cre-BFP 플러스 480 kDa ankyrin-G 는 양성 제어로 공동 트랜스페이션및 기술 제어로 비 이상 감염 상태를 포함한다. Cre-BFP 전용 대조군에서, 전감염된 뉴런은 ankyrin-G(ankG), 베타4-스펙트린(β4), 신경파신(Nf) 및 전압 게이트 나트륨 채널(VSVG)(도 4A)16을포함한 AIS 마커의 축적이 부족하다. 대조적으로, Cre 및 480 kDa ankyrin-G 공동 트랜스감염 뉴런은 AIS마커(도 4B)의현재에 의해 밝혀진 AIS를 완전히 조립하였다. 비감염 된 요리와 비교하여 문화의 질을 확인하는 것이 중요합니다. 건강에 해로운 뉴런은 단종 또는 자궁 외 AIS(도 4C)와같은 비정상적인 AIS 구조를 표시하는 경향이 있습니다.
그런 다음 안키린-G 인간 신경발달 장애 돌연변이(ankG-K2864N)가 AIS 어셈블리(도5)에어떻게 영향을 미치는지 평가하는 예를 보여주었다. 3 div ANK3-E22/23f/f 뉴런은 Cre-BFP 및 야생형 480 kDa ankyrin-G(ankG-WT) 또는 480kDa ankyrin-G 바링 인간 돌연변이(ankG-K2864)로 전염되었다. 뉴런은 div7에서 고정되어 ankyrin-G에 얼룩졌습니다. 이미지는 동일한 커버립에 10-15 개의 전과 된 뉴런과 10-15 제어 뉴런에서 수집되었으며 최대 강도 프로젝션으로 처리되었습니다. 그런 다음 표시된 대로 AIS에서 선을 그리고 선 전체의 평균 강도를 측정합니다. AIS 강도를 평균화 한 후, 우리는 축축한 축하에 소마에서 AIS 강도를 플롯. AIS 농축 단백질은 일반적으로 근위 축축에서 신호의 빠른 증가와 해축 축하에 신호의 느린 감소를 보여주었다. 인간 돌연변이와 ankyrin-G에 의해 조립 된 AIS는 신호의 증가 및 감소를 보였다. 그러나 비트랜스감염된 AIS와 정렬될 때 돌연변이 곡선이 더 넓고 곡선의 피크가 낮아 AIS의 구조 변화를 암시합니다. 야생형 앙키린-G는 AIS를 비트랜스감염된 것과 밀접하게 정렬하여 조립했다.
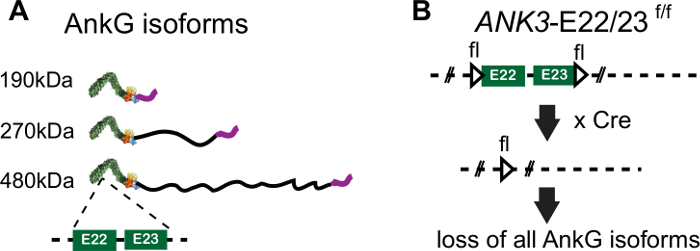
그림 1: ANK3-E22/23-flox의 게놈 편집. (A) 3 안키린-G 동위형성에 대한 단백질 도메인의 회로도 표현. 표준 도메인에서 엑슨 22 및 23 인코딩 된 영역의 위치는 대시 라인에 의해 지적된다. (B) ANK3-E22/23-플록스마우스내 LoxP 부위의 위치는 삼각형으로 표시된다. Cre 재조합의 현재에서, 엑슨(22)과 23은 삭제되고 안키린-G의 모든 3개 동소형태의 발현을 상실하게 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: CRE 재조합의 현재ANK3-E22/23-flox 뉴런에서 AIS의 손실. 다이어그램은 3div에서 Cre transfection와 ANK3-E22/23f /f 뉴런에 비해 야생 형 뉴런에서 ankyrin-G 발현 및 AIS 어셈블리의 시간 프레임을 보여줍니다.

그림 3: 프로토콜 워크플로우입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
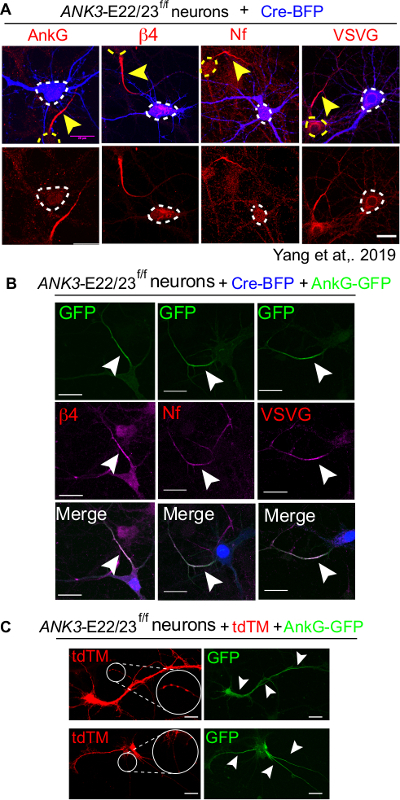
그림 4: ANK3-E22/23-플록스 뉴런에서 480kDa AnkG에 의한 AIS의 완전한 구조는 Cre로 감염되었다. ANK3-E22/23f/f 마우스의 3개의 디브 뉴런은 Cre-BFP(A) 또는 Cre-BFP 및 야생형 480kDa ankyrin-G-GFP(B)로 전염되었다. 뉴런은 7디브에서 고정되어 앙키린-G(ankG), β4-스펙트린(β4), 신경파신(Nf), 전압 계각 나트륨 채널(VSVG)에 대해 염색하였다. 백색 화살표 머리는 전염된 뉴런의 AIS를 가리킵니다. 스케일 바는 20 μm입니다. 이 수치는 양 외16에서적응되었다. (C) tdTM및 480 kDa ankyrin-G-GFP로 감염된 2개의 건강에 해로운 뉴런이 나타났다. 골재의 형성 (흰색과 확대에 동그라미) 건강에 해로운 뉴런의 표시입니다. 상단: 480 kDa ankyrin-G는 비 AIS 영역(흰색 화살표 헤드로 가리켜 서 있다)에 표시됩니다. 아래쪽: 뉴런형성 3 AIS 및 소마에 ankyrin-G의 자궁 내 축적. 스케일 바는 20 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: AIS 구조 변화의 정량화. ANK3-E22/23f/f 마우스의 div3뉴런은 Cre-BFP 및 야생형 480kDa ankyrin-G 또는 480kDa ankyrin-G-K-K2864N으로 전염되었다. 7 div에서, 뉴런은 안키린-G를 위해 고정되고 얼룩졌습니다. 대표적인 이미지는 AIS에서 ankyrin-G 신호를 보여줍니다. 녹색 선과 노란색 선은 AIS 강도 측정을 위한 선이 그려진 위치를 나타냅니다. 백색 대시 선은 전염된 뉴런의 세포 본체를 동그라미로 했습니다. 스케일 바는 20 μm입니다. 두 조건에 대한 평균 AIS 강도는 단독으로 거리를 플로팅하고 비트랜스감염 된 세포 (n =10)와 정렬됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
AIS의 조립은 480 kDa ankyrin-G에 의해 조직된다. 그러나, ankyrin-G는 AIS 어셈블리의 구조 기능 분석의 해석에 어려움을 초래할 수 있는 야생형 뉴런의 AIS를 표적으로 할 수 있는 짧은 동소형을 갖는다. 여기서 우리는 AIS의 드 노보 조립의 연구를 허용하는 ANK3-E22/23-flox 마우스에서 뉴런을 사용하는 방법을 제시한다. 3 div에서 Cre-BFP와 변형함으로써, 우리는 ankyrin-G의 모든 내인성 동소형을 제거합니다. 우리는 또한 AIS의 형성을 구출하기 위해 480 kDa ankyrin-G를 공동 변환 할 수 있습니다. 이를 통해 깨끗한 시스템에서 AIS 형성을 연구할 수 있습니다. 신경교 세포 과잉 성장의 합병증없이 생존력을 향상시키는 뱅커 배양 시스템을 추가로 채택함으로써, 우리는 AIS 차원의 정량적 측정을위한 충분한 뉴런을 제공하는 높은 형질 효율에 도달 할 수 있습니다.
이 프로토콜에는 몇 가지 중요한 단계가 있습니다. 첫 번째 중요한 단계는 AIS의 조립을 방지하고 가장 높은 트랜스펙트 효율에 도달할 만큼 충분히 늦아야 하는 트랜스페션을 수행하는 가장 좋은 시간 창을 고려하는 것입니다. 우리는 0 div 전기 화 환포를 시도했는데, 이는 Cre-BFP만으로 약 10 %의 트랜스페션 효율을 제공했지만 0 div에서 480 kDa Ankyrin-G를 횡단 할 수는 없었습니다. 우리는 플라스미드 (약 20 kb)의 큰 크기 때문이라고 의심합니다. 1 차 배양 해마 뉴런은 3-5 일 사이에 있는 형질 전환에 대한 좁은 창이 있습니다. AIS에서 ankyrin-G의 축적은 3 div에서 시작됩니다. 우리가 3 div에서 Cre-BFP를 변형할 때, 어떤 AIS 형성도 전염된 뉴런에서 보이지 않았다(도 4A). 우리는 18mm 커버슬립에서 480 kDa ankyrin-G로 감염된 10-20 개의 뉴런을 얻을 수 있었습니다. 또한, 동시 경질 구조 실험을 위해서는 모든 DNA가 동일한 프로모터하에서 생성되어야 하며 Cre-BFP 및 480 kDa ankyrin-G-GFP의 비율은 일치해야 한다. 이 실험에서, 우리는 치킨 베타 액틴 프로모터를 사용했다.
또 다른 중요한 단계는 은행 문화를 수정하는 것입니다. 은행 배양은 배아 쥐 뉴런을 배양하기 위해 개발되었다. 더 민감한 마우스 산후 해마 뉴런을 지원하기 위해, 우리는 트립시화 효율을 개선하기 위해 작은 조각으로 해마를 자르는 단계를 포함한다. 질산 치료 후 KOH 치료를 추가하면 유리 커버립의 독성이 더욱 감소하여 뉴런이 더 잘 부착되고 성장하는 데 도움이 됩니다.
남은 과제는 안키린-G의 발현 수준을 제어하는 방법입니다. 복용량 화면 은 트랜스 포 에 사용 하는 플라스미드의 최적의 금액을 결정 하는 데 도움이. 앞으로, 발현의 수준을 제어 하기 위해 신경 특정 프로모터를 사용 하 여 하는 것이 좋습니다. 현재 데이터 분석은 AIS의 위치를 측정하지 못했습니다. 이 기능은 나중에 포함되어야 합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 신경 배양 프로토콜에 대한 제안에 대한 박사 게리 뱅커 에게 감사드립니다. 이 작품은 하워드 휴즈 의학 연구소에 의해 지원됩니다, NIH에서 보조금, 조지 바스 겔러는 교수를 부여 (V.B.).
자료
| Name | Company | Catalog Number | Comments |
| 10xHBSS | Thermo Fisher Scientific | 14065-056 | |
| 18mm coverglass (1.5D) | Fisher Scientific | 12-545-84-1D | |
| 190kDa ankyrin-G-GFP | Addgene | #31059 | |
| 2.5% Tripsin without phenol red | Thermo Fisher Scientific | 14065-056 | |
| 480kDa ankyrin-G-GFP | lab made | Provide upon request | |
| ANK3-E22/23f/f mice | JAX | Stock No: 029797 | B6.129-Ank3tm2.1Bnt/J; |
| B27 serum-free supplement | Thermo Fisher Scientific | A3582801 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cell strainer with 70-mm mesh | BD Biosciences | 352350 | |
| Ceramic coverslip-staining rack | Thomas Scientific | 8542E40 | |
| Cre-BFP | Addgene | #128174 | |
| D-Glucose | Sigma-Aldrich | G7021 | |
| DMEM | Thermo Fisher Scientific | 11995073 | |
| GlutaMAX-I supplement | Thermo Fisher Scientific | A1286001 | |
| Lipofectamine 2000 | Thermo Fisher Scientific | 11668030 | |
| MEM with Earle’s salts and L-glutamine | Thermo Fisher Scientific | 11095-080 | |
| Neurobasal Medium | Thermo Fisher Scientific | 21103-049 | |
| Nitric acid 70% | Sigma-Aldrich | 225711 | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific | 31985062 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin-streptomycin | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrochloride | Sigma-Aldrich | 26124-78-7 | |
| Potassium hydroxide | Sigma-Aldrich | 1310-58-3 |
참고문헌
- Nelson, A. D., et al. Correction: Ankyrin-G regulates forebrain connectivity and network synchronization via interaction with GABARAP. Molecular Psychiatry. , (2019).
- Tseng, W. C., Jenkins, P. M., Tanaka, M., Mooney, R., Bennett, V. Giant ankyrin-G stabilizes somatodendritic GABAergic synapses through opposing endocytosis of GABAA receptors. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 1214-1219 (2015).
- Tai, Y., Gallo, N. B., Wang, M., Yu, J. R., Van Aelst, L. Axo-axonic Innervation of Neocortical Pyramidal Neurons by GABAergic Chandelier Cells Requires AnkyrinG-Associated L1CAM. Neuron. 102 (2), 358-372 (2019).
- Hofflin, F., et al. Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex. Frontiers in Cellular Neuroscience. 11, 332 (2017).
- Schluter, A., et al. Structural Plasticity of Synaptopodin in the Axon Initial Segment during Visual Cortex Development. Cerebral Cortex. 27 (9), 4662-4675 (2017).
- Kuba, H., Oichi, Y., Ohmori, H. Presynaptic activity regulates Na(+) channel distribution at the axon initial segment. Nature. 465 (7301), 1075-1078 (2010).
- Grubb, M. S., Burrone, J. Activity-dependent relocation of the axon initial segment fine-tunes neuronal excitability. Nature. 465 (7301), 1070-1074 (2010).
- Pan, Z., et al. A common ankyrin-G-based mechanism retains KCNQ and NaV channels at electrically active domains of the axon. Journal of Neuroscience. 26 (10), 2599-2613 (2006).
- Cooper, E. C. Made for "anchorin": Kv7.2/7.3 (KCNQ2/KCNQ3) channels and the modulation of neuronal excitability in vertebrate axons. Seminars in Cell & Developmental Biology. 22 (2), 185-192 (2011).
- Zhou, D., et al. AnkyrinG is required for clustering of voltage-gated Na channels at axon initial segments and for normal action potential firing. The Journal of Cell Biology. 143 (5), 1295-1304 (1998).
- Kordeli, E., Lambert, S., Bennett, V. AnkyrinG. A new ankyrin gene with neural-specific isoforms localized at the axonal initial segment and node of Ranvier. Journal of Biological Chemistry. 270 (5), 2352-2359 (1995).
- Jenkins, P. M., et al. Giant ankyrin-G: a critical innovation in vertebrate evolution of fast and integrated neuronal signaling. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 957-964 (2015).
- Jenkins, P. M., et al. E-cadherin polarity is determined by a multifunction motif mediating lateral membrane retention through ankyrin-G and apical-lateral transcytosis through clathrin. Journal of Biological Chemistry. 288 (20), 14018-14031 (2013).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1 (5), 2406-2415 (2006).
- Berger, S. L., et al. Localized Myosin II Activity Regulates Assembly and Plasticity of the Axon Initial Segment. Neuron. 97 (3), 555-570 (2018).
- Yang, R., et al. Neurodevelopmental mutation of giant ankyrin-G disrupts a core mechanism for axon initial segment assembly. Proceedings of the National Academy of Sciences of the U S A. 116 (39), 19717-19726 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유