Method Article
שימוש בנוירונים ראשוניים בהיפוקמפוס כדי לחקור את ההרכבה של מקטעים ראשוניים של אקסון
In This Article
Summary
כאן, תיארנו פרוטוקול כדי לחקור כמותית את ההרכבה והמבנה של קטעים ראשוניים אקסון (AIS) של נוירונים היפוקמפוס חסר AIS מורכב מראש בשל היעדר ankyrin-G ענק.
Abstract
מקטעים ראשוניים של אקסון עצבי (AIS) הם אתרים של ייזום פוטנציאל פעולה ונחקרו בהרחבה עבור המבנה המולקולרי שלהם, הרכבה פלסטיות תלוית פעילות. ענק ankyrin-G, המארגן הראשי של AIS, ישירות מקשר עם מתח פורש ממברנה מגודר נתרן (VSVG) וערוצי אשלגן (KCNQ2/3), כמו גם 186 kDa נוירופסין, מולקולת הידבקות בתא L1CAM. ענק ankyrin-G גם נקשר ומגייס מולקולות AIS ציטופלזמי כולל בטא-4-spectrin, ואת החלבונים מחייב microtubule, EB1/EB3 ו Ndel1. Ankyrin-G ענק מספיק כדי להציל היווצרות AIS בנוירונים לקויים ankyrin-G. Ankyrin-G כולל גם איזופורם קטן יותר של 190 kDa הממוקם בקוצים דנדריטיים במקום AIS, אשר אינו מסוגל למקד את AIS או להציל את AIS בנוירונים ankyrin-G לקוי. כאן, תיארנו פרוטוקול באמצעות נוירונים היפוקמפוס מתורבתים מעכברי ANK3-E22/23-flox, אשר, כאשר מודבק עם Cre-BFP להפגין אובדן של כל איזופורם של ankyrin-G ולפגוע בהיווצרות של AIS. בשילוב מערכת תרבות משותפת של בנקר גליה/נוירון שונה, פיתחנו שיטה להחדיר נוירונים ריקים ankyrin-G עם 480 kDa ankyrin-G-GFP plasmid, וזה מספיק כדי להציל את היווצרות של AIS. בנוסף, אנו משתמשים בשיטת כימות, שפותחה על ידי סלצר ועמיתיו כדי להתמודד עם שונות במרחק AIS מגופי התאים העצביים המתרחשת בתרבויות נוירונים בהיפוקמפוס. פרוטוקול זה מאפשר מחקרים כמותיים של הרכבת דה נובו והתנהגות דינמית של AIS.
Introduction
הקטע הראשוני של האקסון ממוקם באקסון הפרוקסימלי ברוב הנוירונים החולייתנים. מבחינה פונקציונלית, AIS הוא המקום שבו פוטנציאל הפעולה הם יזמו בשל צפיפות גבוהה של ערוצי נתרן מגודר מתח באזור זה. AIS של כמה נוירונים סינאפסות הם גם ממוקדים על ידי interneurons מעכבות באמצעות יצירת סינפסות GABAergic1,2,3. לכן, AIS הוא אתר קריטי כדי לשלב איתות התא לווסת את ההתרגשות של נוירונים. AIS הוא בדרך כלל 20-60 מיקרומטר אורך וממוקם בתוך 20 מיקרומטר של גוף התא. האורך והמיקום של AIS משתנה בנוירונים על פני אזורי המוח, כמו גם בשלבים התפתחותיים שונים של אותו נוירון4,5. ראיות מצטברות הראו כי הרכב ומיקום של AIS הם דינמיים בתגובה לשינוי של פעילות עצבית4,5,6,7.
480 kDa אנקירין-G הוא המארגן הראשי של AIS. 480 kDa ankyrin-G הוא חלבון מתאם הקשור לקרום שנקשר ישירות לערוצי נתרן מגודרים במתח, כמו גם לחלבוני AIS מרכזיים אחרים כולל בטא4-ספקטרין, KCNQ2/3 ערוצים לווסת פעילות ערוץ נתרן8,9, ו 186 kDa נוירופצין, L1CAM שמכוון סינפסות GABAergic ל AIS2,10. 480 kDa ankyrin-G מניות ankyrin קנונית תחומים שנמצאו קצר 190 kDa ankyrin-G isoform (ANK חוזר, תחום מחייב spectrin, תחום רגולטורי), אבל הם נבדלים על ידי אקסון ענק שנמצא רק בעלי חוליות ומתבטא במיוחד נוירונים (איור 1A)11,12. 480 kDa ankyrin-G נוירון ספציפי תחום (NSD) נדרש עבור היווצרות AIS12. 190 kDa ankyrin-G אינו מקדם הרכבה AIS או יעד AIS בנוירונים ankyrin-G-null12. עם זאת, 190 kDa ankyrin-G מרוכז ב- AIS המכיל 480 kDa אנקירין-G12. יכולת זו של 190 kDa ankyrin-G למקד AIS מורכב מראש של נוירונים wildtype כבר מקור לבלבול בספרות האטה את ההערכה של פונקציות מיוחדות קריטיות של 480 kDa ankyrin-G בהרכבה AIS. לכן, זה קריטי ללמוד הרכבה AIS בנוירונים ankyrin-G-null כי חסר AIS מורכב מראש.
כאן, אנו מציגים שיטה לחקר ההרכבה והמבנה של ה- AIS באמצעות נוירונים היפוקמפוסים מתורבתים מעכברי ANK3-E22/23-flox המבטלת את כל האיזופורמות של ankyrin-G13 (איור 1B). על ידי חציית נוירונים עם מבנה Cre-BFP לפני הרכבת AIS, יצרנו נוירונים נטולי אנקירין-G שחסרים לחלוטין AIS(איור 1B, איור 2). ההרכבה של AIS הוא הציל באופן מלא לאחר שיתוף transfection של 480 kDa ankyrin-G-GFP פלסמיד עם פלסמיד Cre-BFP. שיטה זו מספקת דרך ללמוד את הרכבת AIS בסביבת AIS שאינה מורכבת מראש. כמו כן, שינינו את מערכת התרבות המשותפת גליה-נוירון מגארי בנקר מבלי להשתמש באנטיביוטיקה, שתוכננה בעבר עבור נוירונים של יום עוברי 18, ליישום לנוירונים של עכבר לאחר הלידה והתאמנו שיטת כמויות AIS למדידות AIS ממוצעות מתאי עצב מרובים כדי לנרמל את הווריאציה של AIS14,15.
Protocol
הערה: שיטת תרבות זו של נוירונים בהיפוקמפוס מעכברי ANK3-E22/23f/f שלאחר הלידה מותאמת ממערכת התרבות המשותפת של גארי בנקר/ נוירון. לכן, זה קריטי לבצע את כל השלבים לאחר ניתוח במכסה המנוע נקי באמצעות כלים מעוקרים. פרוטוקול זה אורך עד חודש. זרימת העבודה מוצגת באיור 3. הפרוטוקול פועל בהתאם להנחיות בעלי החיים של אוניברסיטת דיוק.
1. הכנת כיסויים ומנות ציפוי עצביות
- לפחות שבוע לפני יום התרבות, לטעון coverslips על מתלה coverslip ולהשרות אותו חומצה חנקתית (70% W / W) לילה (ניתן להאריך במשך ימים).
- לשטוף חומצה חנקתית מטפל coverslips עם מים מזוקקים על שייקר במהירות נמוכה בצנצנת זכוכית 2 פעמים, 1 שעה כל אחד.
- מכסה דגירה ב KOH רווי מומס 100% אתנול לילה. מוסיפים KOH לאתנול עד שהוא כבר לא מומס.
- חזור על שלב הכביסה עם מים מזוקקים. לשטוף coverslips עם 100% אתנול פעם אחת במשך 10 דקות.
- מעבירים כיסויים מהמתלה לזכוכית. מכסים את הכף בנייר אלומיניום. אופים כיסויים בתנור של 225 מעלות צלזיוס למשך הלילה כדי לעקר את הכיסויים. (Coverslips יכול להיות מאוחסן ב כיס במשך שבועות).
- מניחים כיסויים בצלחת פטרי ולאחר מכן להחיל 3-4 נקודות שעווה על כריכה לשמש כפות רגליים. השתמש פיפטה פסטר לטבול לתוך שעווה מבושלת בבקבוק זכוכית. לאחר מכן גע במהירות ב- coverslip כדי ליצור נקודה. צלחת פטרי 60 מ"מ יכולה להכיל 4 כריכות. צלחת פטרי 10 מ"מ יכול להכיל ~ 10 coverslips.
- 2 ימים לפני יום התרבות, מעיל coverslips (הצד עם נקודות שעווה) עם מסנן מעוקר 1 מ"ג / מ"ל פולי-L-ליצין ב 0.1 M חומצה בורית (pH 8.5) במשך מינימום של 6 שעות ולשטוף עם מים 2 פעמים, 1 שעה בכל פעם. כיסויים נשארים באותה צלחת פטרי.
- מוסיפים מדיום ציפוי (MEM בתוספת גלוקוז 0.6% (wt/vol) ו 10% (vol / vol) סרום סוס) לצלחות לאט מבלי להפריע coverslips. שים צלחות באינקובטור עד יום התרבות כדי לזרוע נוירונים.
2. הכנת מנות מאכילות תאי גליה (שבועיים לפני יום התרבות)
- לנתח את קליפת המוח ממוח עכברים בן יום אחד לאחר הלידה ולקלף את קרום המוח.
- קוצצים את רקמת קליפת המוח דק ככל האפשר עם מספריים נקיים בצלחת פטרי נקייה בספסל נקי.
- מעבירים את הרקמה הקצוצה ל-12 מ"ל של HBSS ומוסיפים 1.5 מ"ל של 2.5% טריפסין ו-1% (wt/vol) DNase. דגירה באמבט מים 37 מעלות צלזיוס במשך 15 דקות, נדנדה כל 5 דקות. רקמה מתעכלת היטב הופכת לדביקה ויוצרת אשכול גדול. Triturate 10-15 פעמים עם פיפטה 10 מ"ל לשבור את הרקמה למטה ולקבל עיכול טוב יותר.
- Triturate הרקמה מתעכל היטב 10-15 פעמים עם פיפטה 5 מ"ל עד רוב הגושים נעלמים המדיום הופך מעונן. עוברים דרך מסננת תאים כדי להסיר נתחים שנותרו ומוסיפים 15 מ"ל של גליה בינונית (מדיום חיוני מינימלי (MEM) בתוספת גלוקוז (0.6% wt /vol), 10% (vol / vol) סרום סוס פניצילין-סטרפטומיצין (1x) כדי לעצור את העיכול.
- צנטריפוגה התאים ב 120 x g במשך 5 דקות לשאוף את supernatant. מוציאים מחדש את גלולת התא עם מדיום גליה טרי וזרעים במנות תרבות התא (כ -105 תאים / ס"מ2).
- החלף מדיום במדיום גליה טרי למחרת כדי להסיר תאים לא מחוברים.
- להאכיל את מנות גליה כל 3-4 ימים עם מדיום גליה טרי. סטירה הבקבוק 5-10 פעמים עם יד כדי לעקור תאים מחוברים באופן רופף לפני שינוי בינוני.
- לאחר 10 ימים של תרבות, תאי גליה צריכים להיות כמעט משולבים. נתק תאי גליה עם 0.25% טריפסין-EDTA וזרע כ 105 תאים בצלחת חדשה 60 מ"מ תרבית התא. תאים שנותרו יכולים להיות קפואים לשימוש עתידי.
- 3 ימים לפני יום התרבות, לשנות את המדיום גליה למדיום תרבות עצבית (Neurobasal-A בינוני עם 1x GlutaMAX-I ו 1x B27 תוספת).
3. נוירונים היפוקמפוס תרבות
הערה: כל השלבים מבוצעים בטמפרטורת החדר.
- לנתח 6-8 היפוקמפי מן הגורים לאחר הלידה 1 יום אחד מ ANK3-E22/f עכברים עם מדיום HBSS בצלחת פטרי בחדר ממוזג. קוצצים את ההיפוקמפי במספריים מנותבים לחתיכות קטנות יותר. מעבירים את ההיפוקמפי מתבשיל הפטרי לצינור של 15 מ"ל.
- לשטוף היפוקמפי 2x עם 5 מ"ל של HBSS בצינור. השאירו את ההיפוקמפי ב 4.5 מ"ל של 1x HBSS לאחר הכביסה.
- יש להוסיף 0.5 מ"ל של 2.5% טריפסין ל-4.5 מ"ל של HBSS ולהדגיר באמבט מים ב-37 מעלות צלזיוס למשך 15 דקות. הפוך את הצינור כל 5 דקות. היפוקמפי מתעכל היטב צריך להיות דביק וליצור אשכול. במידת הצורך, להאריך את העיכול במשך 5 דקות נוספות.
- לשטוף היפוקמפי עם HBSS 3 פעמים במשך 5 דקות כל אחד. אל תשתמש בוואקום כדי להסיר את HBSS. קל מאוד להסיר את ההיפוקמפי.
- הוסף 2 מ"ל של HBSS לאחר לשטוף פיפט ההיפוקמפי למעלה ולמטה עם פיפטה פסטר 15 פעמים.
- טריטורים את הרקמה עם פיפטה פסטר מלוטש אש (קוטר של פתוח מצטמצם בחצי) 10 פעמים. אל תלך מעבר 10 פעמים גם אם יש עדיין גושים שנותרו. השתלטות יתר הורגת נוירונים.
- מניחים את הצינור במשך 5 דקות עד שכל הגושים נקבעים לתחתית. השתמש בעדינות טיפ פיפטה 1 מ"ל להעביר את supernatant המכיל את הנוירונים מנותקים מנות ציפוי (105 תאים / 60 מ"מ צלחת). מוסיפים אותו ישירות למדיום הציפוי המדגר מראש ומנערים את הצלחת בעדינות.
- חזור על שלב 3.6-3.7 עם הנתחים הנותרים עד שרוב הגושים נעלמו.
- 2-4 שעות לאחר הזריעה, בדוק את מנות הציפוי במיקרוסקופ קל. רוב הנוירונים היו צריכים להיצמד לכיסוי. התאים המחוברים עגולים ובהירים. פליפ מכסה באמצעות מלקחיים קצה דק מנות מאכיל תא גליה עם מדיום תרבות עצבית מותנה מראש עם הצד נקודות שעווה פונה כלפי מטה.
- נוירונים יכולים לגדול במנות מאכיל תאי גליה עד חודש. להאכיל נוירונים כל 7 ימים עם 1 מ"ל של מדיום תרבות עצבית טרי.
- צעד אופציונלי: שבוע לאחר הזריעה, להוסיף ציטוסין arabinoside (1-β-D-arabinofuranosylcytosine) לריכוז הסופי של 5 מיקרומטר כדי לרסן את התפשטות גליה.
4. שיבוש של AIS על ידי נוקאאוט של Ankyrin-G בשלב מוקדם יותר של התפתחות נוירון
- ב 3 div (יום במבחנה),להפוך את coverslips עם נקודות שעווה בצד פונה עד צלחת מאכיל תא גליה עם מדיום תרבות עצבית מותנית.
- מערבבים 0.25 מיקרוגרם של דנ"א Cre-BFP עם 0.5 מיקרוגרם של DNA ankyrin-G-GFP (WT/מוטציה) בצינור 1.7 מ"ל כדי transfect 4 coverslips (~ 2:1 יחס של מספר עותק DNA). הוסף 100 μL של מדיום תרבות (למשל, Opti-MEM), לערבב ולנוח על ארון תקשורת. אם רק Cre-BFP הוא חצץ, עמוד השדרה פלסמיד GFP משמש כדי להתאים את הכמות הכוללת של ה-DNA.
- מערבבים 3 μL של מגיב transfection (למשל, Lipofectamine 2000) (~ 3 פעמים של DNA) עם 100 μL תרבות מדיום בצינור חדש 1.7 מ"ל. דגירה במשך 5 דקות ב RT.
- מערבבים 100 μL של פתרון DNA משלב 4.2 עם 100 μL של מגיב transfection משלב 4.3. לנוח במשך 5-10 דקות על מתלה.
- הוסף 50 μL של תערובת DNA משלב 4.4 ממש על גבי כל כיסוי על ידי החדרת הקצה ממש מתחת למדיום מבלי לגעת coverslips. פיפטה לאט כדי למנוע התפשטות של תערובת DNA.
- לאט לאט מחזירים את המנה לאינקובטור והדגירה למשך 30-45 דקות.
- הופכים את הכיסויים בחזרה לצלחת מאכילת גליה הביתית עם נקודות שעווה בצד הפונה כלפי מטה ומחזירים את הצלחת לאינקובטור.
5. כימות של קטע ראשוני אקסון
- לתקן נוירונים על 7-10 div וכתם עם סמן AIS בעקבות פרוטוקול immunocytochemistry סטנדרטי עבור החלבון של מעניין.
- לאסוף תמונות פלואורסצנטיות עם מיקרוסקופיה הרצויה.
- קח מקטעים מסדרת Z כדי לאסוף את האות של ה- AIS כולו. שמור את אותו עומק Z עבור כל התמונות.
- כוונן את עוצמת הלייזר כדי להגיע לטווח הדינמי הטוב ביותר בעוצמת הפיקסלים.
- ודא שכל תמונות AIS צולמו באותה הגדרת מיקרוסקופ.
- תמיד לבדוק את האות של Cre-BFP.
- כימות AIS
- פתח תמונה עם פיג'י (https://fiji.sc).
- צור הקרנה מרבית של תמונות מסדרת Z.
- הפחת את אות הרקע הריק של כריכת הכיסוי מהתמונה.
- צייר קו לאורך ה- AIS. רוחב הקו אמור לכסות באופן מלא את ה- AIS. הפעל את הקו לפני שאות ה- AIS מופעל מעל הרקע והפסק לאחר שהוא יורד לרקע.
- מדוד את עוצמת הפיקסל הממוצעת לבדה את הקו וייצא לגיליון אלקטרוני (יש צורך ב- AISs ~ 10-15).
- צור את עקומת העוצמה הממוצעת של AIS באמצעות סקריפט MATLAB מותאם ברגר ואח'15.
- עבור כל ניסוי, כוללים Cre בלבד ו Cre בתוספת wildtype 480 kDa ankyrin-G נוירונים transfected כמו פקדים שליליים וחיוביים כדי לוודא כי הנוקאאוט של AIS הוא יעילות ההצלה היא מוצלחת.
תוצאות
סט שלם של ניסוי צריך לכלול Cre-BFP רק transfection כשליטה שלילית, Cre-BFP בתוספת 480 kDa ankyrin-G שיתוף transfection כמו שליטה חיובית ומצב שאינו transfected כמו בקרת טכניקה. בשליטה של Cre-BFP בלבד, נוירונים מוחצנים חסרים הצטברות של סמני AIS, כולל ankyrin-G (ankG), בטא4-ספקטרין (β4), נוירופסין (Nf) וערוצי נתרן מגודר מתח (VSVG) (איור 4A)16. לעומת זאת, Cre ו-480 kDa ankyrin-G התאספו במלואם על ידי AIS שהתגלה על ידי ההווה של סמני AIS (איור 4B). חשוב לאשר את איכות התרבות על ידי השוואה עם מנות שאינן מודבקות. נוירונים לא בריאים נוטים להראות מבנה AIS לא תקין, כמו AIS שהופסק או חוץ רחמי (איור 4C).
לאחר מכן הראינו דוגמה להערכת האופן שבו מוטציה בהפרעה נוירו-התפתחותית אנושית ankyrin-G (ankG-K2864N) משפיעה על הרכבת AIS (איור 5). 3 div ANK3-E22/23f/f נוירונים היו transected עם Cre-BFP ו wildtype 480 kDa ankyrin-G (ankG-WT) או 480 kDa ankyrin-G חושף מוטציה אנושית (ankG-K2864). נוירונים תוקנו ב div7 ומוכתמים עבור ankyrin-G. תמונות נאספו מ 10-15 נוירונים transfected ו 10-15 נוירונים שליטה על אותם coverslips ומעובדים עם הקרנת עוצמה מקסימלית. לאחר מכן אנו מציירים קו ב- AIS כפי שמוצג ומודדים את העוצמה הממוצעת מעבר לקו. לאחר חישוב ממוצע של עוצמת ה- AIS, אנו מתווה את עוצמת ה- AIS מהסומא לאקסון הדיסטלי. חלבון מועשר AIS הראה בדרך כלל עלייה מהירה של אות מהאקסון הפרוקסימלי וירידה איטית של האות לאקסון הדיסטלי. AIS שהורכב על ידי ankyrin-G עם מוטציה אנושית הראה עלייה וירידה של אות. אך כאשר הוא מיושר עם ה- AIS שאינו מודבק, עקומת המוטנטים רחבה יותר, ושיא העקומה נמוך יותר ומציע שינוי מבנה של AIS. סוג הפרא ankyrin-G אסף AIS מיושר באופן הדוק עם אחד שאינו מודבק.
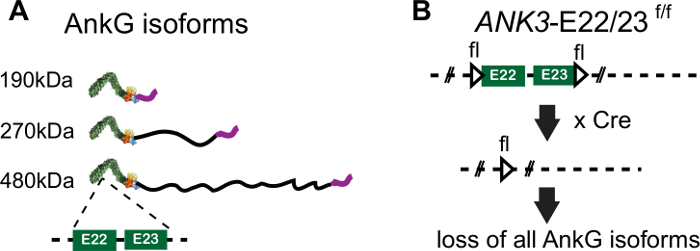
איור 1: העריכה הגנומית של ANK3-E22/23-flox. (א) ייצוג סכמטי של תחומי חלבון עבור 3 isoforms ankyrin-G. המיקום של exon 22 ו 23 אזורים מקודדים בתחום הקנוני הוא הצביע על ידי קו המקף. (ב) המיקום של אתרי LoxP ב- ANK3-E22/23-flox עכברים מסומן על ידי משולש. בהווה של Cre recombinase, exon 22 ו 23 נמחק וגורם לאובדן הביטוי של כל 3 isoforms של ankyrin-G. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: אובדן AIS בנוירונים ANK3-E22/23-flox בהווה של קר רקומבינאז. דיאגרמה מציגה את מסגרת הזמן של ביטוי ankyrin-G ואת הרכבת AIS בנוירונים מסוג פראי לעומת ANK3-E22/23f/f נוירונים עם Transfection Cre ב 3 div. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: זרימת עבודה של פרוטוקול. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
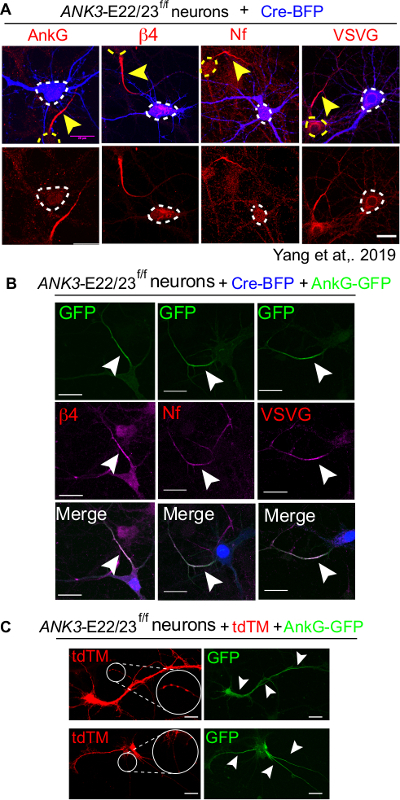
איור 4: הצלה מלאה של AIS על ידי 480kDa AnkG בתאי עצב ANK3-E22/23-flox שהודבקו עם Cre. 3 נוירונים div של ANK3-E22/23f/f עכברים היו transected עם Cre-BFP (A) או עם Cre-BFP וסוג פראי 480 kDa ankyrin-G-GFP (B). נוירונים תוקנו ב 7 div ומוכתמים עבור ankyrin-G (ankG), β4-spectrin (β4), נוירופאסין (Nf) וערוצי נתרן מגודר מתח (VSVG). ראש חץ לבן מצביע על AIS של נוירון מודבק. סרגל קנה המידה הוא 20 מיקרומטר. נתון זה הותאם מיאנג ואח '16. (ג) שני נוירונים לא בריאים עם tdTM ו 480 kDa ankyrin-G-GFP הוצגו. היווצרות אגרגטים (בעיגול לבן ומוגדל) היא סימן לנוירונים לא בריאים. למעלה: 480 kDa ankyrin-G מופיע באזור שאינו AIS (הצביע על ידי ראשי חצים לבנים. למטה: נוירון נוצר 3 AIS הצטברות חוץ רחמית של ankyrin-G על סומה. סרגל קנה המידה הוא 20 מיקרומטר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: כימות השינוי המבני של AIS. div3 נוירונים של ANK3-E22/23f/f עכברים היו transfected עם Cre-BFP וסוג פראי 480 kDa ankyrin-G או 480 kDa ankyrin-G-K2864N. בגיל 7 div, נוירונים תוקנו ומוכתמים עבור ankyrin-G. תמונות מייצגות מראות את אות האנקירין-G ב- AIS. הקו הירוק והקו הצהוב מציינים היכן נמשך הקו למדידת עוצמת AIS. קו מקף לבן הקיף את גוף התא של הנוירון החצוי. סרגל קנה המידה הוא 20 מיקרומטר. עוצמת AIS ממוצעת עבור שני התנאים מותווה מרחק לבד ומיושרת עם תאים שאינם נגועים (n = 10). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
ההרכבה של AIS מאורגנת על ידי 480 kDa ankyrin-G. עם זאת, ankyrin-G יש איזופורמים קצרים יותר שיכולים למקד את AIS של נוירונים wildtype, אשר עלול להוביל לקושי בפרשנות של ניתוחים מבנה פונקציה של הרכבת AIS. כאן אנו מציגים שיטה באמצעות נוירונים מעכברי ANK3-E22/23-flox המאפשרת מחקר של הרכבה דה נובו של AIS. על ידי הצטלבת עם Cre-BFP ב 3 div, אנו לחסל את כל isoforms אנדוגני של ankyrin-G. אנחנו יכולים גם שיתוף transfect 480 kDa ankyrin-G כדי להציל את היווצרותו של AIS. זה מאפשר מחקר של היווצרות AIS במערכת נקייה. על ידי אימוץ נוסף של מערכת התרבות הבנקאית המשפרת את הכדאיות ללא סיבוכים של צמיחת יתר של תאי גליה, אנו יכולים להגיע ליעילות גבוהה של התפשטות, המספקת לנו מספיק נוירונים למדידה כמותית של ממדי AIS.
קיימים מספר שלבים קריטיים בפרוטוקול זה. הצעד הקריטי הראשון הוא לשקול את חלון הזמן הטוב ביותר לעשות את transfection, אשר צריך להיות מוקדם מספיק כדי למנוע את ההרכבה של AIS ומאוחר מספיק כדי להגיע ליעילות transfection הגבוה ביותר. ניסינו 0 div electroporation transfection, אשר נתן על 10% יעילות transfection עם Cre-BFP בלבד, אבל אנחנו אף פעם לא הצלחנו transfect 480 kDa Ankyrin-G ב 0 div. אנו חושדים שזה בגלל הגודל הגדול של פלסמיד (כ 20 kb). נוירונים היפוקמפוס תרבותיים ראשוניים יש חלון צר עבור transfection, אשר בין 3-5 ימים. הצטברות של ankyrin-G ב- AIS מתחיל מ 3 div. כאשר אנו חוצה Cre-BFP ב 3 div, לא היווצרות AIS נראתה נוירונים transfected(איור 4A). אנחנו יכולים לקבל 10-20 נוירונים מודבקים עם 480 kDa ankyrin-G מכיסוי אחד 18 מ"מ. כמו כן, עבור ניסוי הצלת transfection משותף, כל ה-DNA חייב להיווצר תחת אותו מקדם ואת היחס של Cre-BFP ו 480 kDa ankyrin-G-GFP חייב להיות תואם. בניסוי זה, השתמשנו באמרגן בטא-אקטין עוף.
צעד קריטי נוסף הוא השינוי בתרבות הבנקאית. תרבות הבנקאי פותחה עבור culturing נוירונים עכברוש עוברי. כדי לתמוך טוב יותר בנוירון ההיפוקמפוס הרגיש יותר של העכבר לאחר הלידה, אנו כוללים צעד של חיתוך היפוקמפי לחתיכות קטנות יותר כדי לשפר את יעילות הנסיון. הוספת טיפול KOH לאחר הטיפול בחומצה החנקתית הפחיתה עוד יותר את הרעילות מכיסויי הזכוכית, המסייעים לנוירונים לצרף ולגדול טוב יותר.
האתגר שנותר הוא כיצד לשלוט ברמת הביטוי של ankyrin-G. מסך המינון עזר לקבוע את הכמות האופטימלית של פלסמיד המשמש transfection. בהמשך, עדיף להשתמש במקדם ספציפי לנוירונים כדי לשלוט ברמת הביטוי. ניתוח הנתונים הנוכחי לא מדד את המיקום של AIS. פונקציה זו צריכה להיכלל בעתיד.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לד"ר גארי בנקר על ההצעה לפרוטוקול התרבות העצבית. עבודה זו נתמכת על ידי המכון הרפואי הווארד יוז, מענק מ- NIH, וג'ורג ' בארת גלר העניק פרופסור (V.B.).
Materials
| Name | Company | Catalog Number | Comments |
| 10xHBSS | Thermo Fisher Scientific | 14065-056 | |
| 18mm coverglass (1.5D) | Fisher Scientific | 12-545-84-1D | |
| 190kDa ankyrin-G-GFP | Addgene | #31059 | |
| 2.5% Tripsin without phenol red | Thermo Fisher Scientific | 14065-056 | |
| 480kDa ankyrin-G-GFP | lab made | Provide upon request | |
| ANK3-E22/23f/f mice | JAX | Stock No: 029797 | B6.129-Ank3tm2.1Bnt/J; |
| B27 serum-free supplement | Thermo Fisher Scientific | A3582801 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cell strainer with 70-mm mesh | BD Biosciences | 352350 | |
| Ceramic coverslip-staining rack | Thomas Scientific | 8542E40 | |
| Cre-BFP | Addgene | #128174 | |
| D-Glucose | Sigma-Aldrich | G7021 | |
| DMEM | Thermo Fisher Scientific | 11995073 | |
| GlutaMAX-I supplement | Thermo Fisher Scientific | A1286001 | |
| Lipofectamine 2000 | Thermo Fisher Scientific | 11668030 | |
| MEM with Earle’s salts and L-glutamine | Thermo Fisher Scientific | 11095-080 | |
| Neurobasal Medium | Thermo Fisher Scientific | 21103-049 | |
| Nitric acid 70% | Sigma-Aldrich | 225711 | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific | 31985062 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin-streptomycin | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrochloride | Sigma-Aldrich | 26124-78-7 | |
| Potassium hydroxide | Sigma-Aldrich | 1310-58-3 |
References
- Nelson, A. D., et al. Correction: Ankyrin-G regulates forebrain connectivity and network synchronization via interaction with GABARAP. Molecular Psychiatry. , (2019).
- Tseng, W. C., Jenkins, P. M., Tanaka, M., Mooney, R., Bennett, V. Giant ankyrin-G stabilizes somatodendritic GABAergic synapses through opposing endocytosis of GABAA receptors. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 1214-1219 (2015).
- Tai, Y., Gallo, N. B., Wang, M., Yu, J. R., Van Aelst, L. Axo-axonic Innervation of Neocortical Pyramidal Neurons by GABAergic Chandelier Cells Requires AnkyrinG-Associated L1CAM. Neuron. 102 (2), 358-372 (2019).
- Hofflin, F., et al. Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex. Frontiers in Cellular Neuroscience. 11, 332 (2017).
- Schluter, A., et al. Structural Plasticity of Synaptopodin in the Axon Initial Segment during Visual Cortex Development. Cerebral Cortex. 27 (9), 4662-4675 (2017).
- Kuba, H., Oichi, Y., Ohmori, H. Presynaptic activity regulates Na(+) channel distribution at the axon initial segment. Nature. 465 (7301), 1075-1078 (2010).
- Grubb, M. S., Burrone, J. Activity-dependent relocation of the axon initial segment fine-tunes neuronal excitability. Nature. 465 (7301), 1070-1074 (2010).
- Pan, Z., et al. A common ankyrin-G-based mechanism retains KCNQ and NaV channels at electrically active domains of the axon. Journal of Neuroscience. 26 (10), 2599-2613 (2006).
- Cooper, E. C. Made for "anchorin": Kv7.2/7.3 (KCNQ2/KCNQ3) channels and the modulation of neuronal excitability in vertebrate axons. Seminars in Cell & Developmental Biology. 22 (2), 185-192 (2011).
- Zhou, D., et al. AnkyrinG is required for clustering of voltage-gated Na channels at axon initial segments and for normal action potential firing. The Journal of Cell Biology. 143 (5), 1295-1304 (1998).
- Kordeli, E., Lambert, S., Bennett, V. AnkyrinG. A new ankyrin gene with neural-specific isoforms localized at the axonal initial segment and node of Ranvier. Journal of Biological Chemistry. 270 (5), 2352-2359 (1995).
- Jenkins, P. M., et al. Giant ankyrin-G: a critical innovation in vertebrate evolution of fast and integrated neuronal signaling. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 957-964 (2015).
- Jenkins, P. M., et al. E-cadherin polarity is determined by a multifunction motif mediating lateral membrane retention through ankyrin-G and apical-lateral transcytosis through clathrin. Journal of Biological Chemistry. 288 (20), 14018-14031 (2013).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1 (5), 2406-2415 (2006).
- Berger, S. L., et al. Localized Myosin II Activity Regulates Assembly and Plasticity of the Axon Initial Segment. Neuron. 97 (3), 555-570 (2018).
- Yang, R., et al. Neurodevelopmental mutation of giant ankyrin-G disrupts a core mechanism for axon initial segment assembly. Proceedings of the National Academy of Sciences of the U S A. 116 (39), 19717-19726 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved