Method Article
Criando pares de modelos derivados do paciente in vivo/in vitro de PDX e Organoides Derivados de PDX para pesquisa de farmacologia do câncer
Neste Artigo
Resumo
Um método é descrito para criar organoides usando xenoenxertos derivados do paciente (PDX) para triagem in vitro, resultando em pares combinados de modelos in vivo/in vitro. Os tumores PDX foram colhidos/processados em pequenos pedaços mecanicamente ou enzimáticamente, seguidos pelo método dos Clevers para cultivar organoides tumorais que foram passagem, criopreservados e caracterizados contra o PDX original.
Resumo
Os xenoenxertos tumorais derivados do paciente (PDXs) são considerados os modelos pré-clínicos mais preditivos, em grande parte acredita-se que sejam impulsionados por células-tronco cancerígenas (CSC) para avaliação convencional de medicamentos contra o câncer. Uma grande biblioteca de PDXs reflete a diversidade das populações de pacientes e, portanto, permite ensaios pré-clínicos baseados na população ("Ensaios clínicos de camundongos semelhantes à fase II"); no entanto, o PDX tem limitações práticas de baixo rendimento, custos elevados e longa duração. Os organoides tumorais, também sendo modelos derivados do CSC derivados do paciente, podem ser considerados como o equivalente in vitro do PDX, superando certas limitações de PDX para lidar com grandes bibliotecas de organoides ou compostos. Este estudo descreve um método para criar organoides derivados do PDX (PDXO), resultando assim em modelos emparelhados para pesquisa de farmacologia in vitro e in vivo. Tumores PDX-CR2110 transplantados subcutâneos foram coletados de camundongos portadores de tumor quando os tumores atingiram 200-800 mm3, por um procedimento de autópsia aprovado, seguido pela remoção dos tecidos não tumorais adjacentes e dissociação em pequenos fragmentos tumorais. Os pequenos fragmentos tumorais foram lavados e passaram por um coador de células de 100 μm para remover os detritos. Os agrupamentos celulares foram coletados e suspensos na solução de extrato de membrana do porão (BME) e banhados em uma placa de 6 poços como uma gotícula sólida com mídia líquida circundante para crescimento em uma incubadora de CO2. O crescimento organoide foi monitorado duas vezes por semana sob microscopia leve e registrado pela fotografia, seguido por variação média líquida 2 ou 3 vezes por semana. Os organoides cultivados foram ainda mais aprovados (7 dias depois) em uma proporção de 1:2, interrompendo os organoides incorporados da BME usando tesoura mecânica, auxiliados pela adição de trippsina e a adição de 10 μM Y-27632. Os organoides foram criopreservados em crio-tubos para armazenamento a longo prazo, após a liberação da BME por centrifugação, e também amostrados (por exemplo, DNA, RNA e bloco FFPE) para caracterização posterior.
Introdução
Os cânceres são uma coleção de diversos distúrbios genéticos e imunológicos. O desenvolvimento bem-sucedido de tratamentos eficazes é altamente dependente de modelos experimentais que efetivamente predizem resultados clínicos. Grandes bibliotecas de xenoenxertos bem caracterizados pelo paciente (PDX) têm sido vistas há muito tempo como o sistema translacional in vivo de escolha para testar terapias de quimioterapia e/ou direcionadas devido à sua capacidade de recapitular características tumorais do paciente, heterogeneidade e resposta a medicamentos para pacientes1, permitindo assim que os ensaios clínicos do camundongo da Fase II melhorem o sucesso clínico2,3. Os PDXs são geralmente considerados como doenças cancerígenas, apresentando estabilidade genética, em contraste com os xenoenxertos derivados da linha celular2. Nas últimas décadas, grandes coleções de PDXs foram criadas em todo o mundo, tornando-se o cavalo de trabalho do desenvolvimento de medicamentos contra o câncer hoje. Embora amplamente utilizados e com grande valor translacional, esses modelos animais são intrinsecamente caros, demorados e de baixa produtividade, portanto inadequados para a triagem em larga escala. PDX também são indesejáveis para testes de imuno-oncologia (IO) devido a uma natureza imunocompensado4. Portanto, é impraticável aproveitar ao máximo a grande biblioteca disponível dos PDXs.
Descobertas recentes, pioneiras pelo laboratório Hans Clevers5,levaram ao estabelecimento de culturas in vitro de organoides gerados a partir de células-tronco adultas na maioria dos órgãos humanos de origem epitelial5. Esses protocolos foram ainda mais refinados para permitir o crescimento de organoides de CSCs assumidos em carcinomas humanos de várias indicações6,7. Estes organoides derivados do paciente (PDOs) são genomicamente estáveis8,9 e têm se mostrado altamente preditivos dos desfechos do tratamento clínico10,11,12. Além disso, a natureza in vitro dos PDOs permite a triagem de alto rendimento (HTS)13, potencialmente oferecendo uma vantagem sobre modelos in vivo e aproveitando grandes bibliotecas organoides como substituto da população paciente. Os PDOs estão prontos para se tornar uma importante plataforma de descoberta e tradução, superando as muitas limitações dos PDXs descritos acima.
Tanto o PDO quanto o PDX são modelos derivados do paciente e orientados pelo CSC, com a capacidade de avaliar terapêuticas no contexto de tratamento personalizado ou formato de ensaio clínico. As grandes bibliotecas existentes de PDXs, como a coleção proprietária de >3000 PDXs14,15,16,17, são, portanto, adequadas para a rápida geração de bibliotecas de organoides tumorais (organoides derivados do PDX, ou PDXO), resultando em uma biblioteca combinada de modelos PDX e PDXO emparelhados. Este relatório descreve o procedimento para criar e caracterizar o câncer colorretal PDXO-CR2110 em relação ao seu PDX-CR2110 parental modelo16.
Protocolo
Todos os protocolos e alterações ou procedimentos envolvendo o cuidado e o uso de animais foram revisados e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Crown Bioscience (IACUC) antes da realização dos estudos. O cuidado e o uso de animais foram realizados de acordo com a AAALAC (Associação para Avaliação e Acreditação de Cuidados Com Animais laboratoriais) Diretrizes internacionais conforme relatado no Guia de Cuidado e Uso de Animais de Laboratório, Conselho Nacional de Pesquisa (2011). Todos os procedimentos experimentais animais estavam em condições estéreis em instalações da SPF (especificamente livres de patógenos) e conduzidos em estrita conformidade com o Guia de Cuidado e Uso de Animais de Laboratório de diferentes instituições governamentais (por exemplo, Institutos Nacionais de Saúde). Os protocolos foram aprovados pela Comissão de Ética em Experimentos Com Animais na instituição (por exemplo, Comitê Institucional do IACUC).
1. Preparação para transplante de tumores
-
Habitação animal
- Casa Balb/c ratos nus (n=5) em gaiolas ventiladas individuais, a 20-26 °C, 30-70% de umidade, e um ciclo de iluminação de 12-h luz /12-h escuro, com roupa de cama de espiga de milho alterada semanalmente, e irradiação esterilizada granulo seco alimento mais água potável estéril adtum libi.
-
Preparação do fragmento do tumor doador
- Monitore de perto os camundongos doadores portadores de tumores para o peso corporal (BW, via equilíbrio de pesagem) e o volume do tumor (TV, por medição de pinça).
- Quando a TV atinge 800-1000 mm3,eutanize os animais portadores de tumor em um capô de risco biológico.
- Coloque ratos em uma câmara de eutanásia com uma tampa que fornece gás CO2 na câmara. Descarga de gás na câmara a uma vazão que produz inconsciência rápida com o mínimo de angústia para o animal. A taxa de fluxo ideal para CO2 é em torno de 2-2.5 Lpm.
- Garanta a eutanásia observando que os animais não recuperam a consciência.
- Após morte clínica aparente, mantenha o fluxo de gás por > 1 min para minimizar a possibilidade de que um animal possa se recuperar.
- Esterilize a pele ao redor do tumor usando cotonetes iodophor. Colete tumores removendo tecidos não tumorais adjacentes e colocando em uma placa de Petri contendo 20 mL de PBS, pré-refrigerado (4 °C) antes da eutanásia.
- Lave os tumores com PBS em outra placa de Petri para remover componentes sanguíneos seguidos de corte ao meio e remoção de qualquer pele extra, vasos sanguíneos, calcificação e/ou necrose.
- Coloque apenas pedaços de tumor intactos em um tubo de centrífuga de 50 mL estéril com 20 mL de PBS, antes de transportar para uma sala de animais separada para transplante.
2. Crescimento do tumor subcutâneo
-
Inoculação subcutânea de peça tumoral em camundongos imunocomprometidos
- Corte o tumor PDX em pedaços de 2 mm com um bisturi, e coloque cada um em trocars para implantação subcutânea (SC).
- Anestesiar os animais receptores com 5% de isoflurane (mantido por um cone de nariz em 1%). Os animais relaxam, perdendo o reflexo de direito e eventualmente ficando imóveis, até não responderem à dor. Fixar os camundongos anestesiados em uma placa de experimento na posição lateral direita e esterilizar com cotonetes iodophor, particularmente as áreas ao redor do local da inoculação tumoral.
- Na pele do flanco esquerdo apenas cranial ao quadril, faça uma incisão de 0,5 cm com um bisturi e crie um túnel sob a pele em direção ao membro dianteiro, 2-3 cm, usando fórceps contundentes.
- Transfira asepticamente um cubo de fragmento tumoral por local de inoculação a partir do meio e coloque no fundo do túnel subcutâneo. Confirme visualmente a posição do fragmento antes do fechamento da ferida com clipes de ferida.
- Monitore os camundongos implantados pelo tumor (5) até que eles se tornem conscientes para manter a recumbência severa, e depois devolvê-los à gaiola somente após sua recuperação completa da anestesia.
-
Monitoramento de saúde de camundongos portadores de tumores
- Verifique o consumo diário de água e alimentos e regise o peso corporal semanalmente.
- Verifique os ratos durante o monitoramento de rotina. Registos sobre mobilidade, respiração, limpeza e aparência geral, consumo de alimentos e água, ganho/perda de BW, ascites, etc.
- Medir a TV duas vezes por semana usando pinças e expresso em mm3 por: TV = 0,5 a × b2, onde a e b são o comprimento e largura do tumor, respectivamente.
- Sacrificar animais para coletar amostras quando algum dos seguintes sinais aparecer: perda de BW >20%; mobilidade prejudicada (não capaz de comer ou beber); incapaz de se mover normalmente devido a ascites significativas ou abdômen aumentado; esforço na respiração; morte.
3. Necropsia e colheita de tumores
- Quando o volume do tumor atingiu 200-800 mm3, eutanize camundongos por protocolos aprovados (ver passo 1.2.2).
- Coletar tecidos tumorais removendo tecidos não tumorais adjacentes, seguido por colocar o tecido em um tubo plástico de 50 mL com AD+++ (no gelo) antes da dissociação.
4. Preparação para a cultura organoide derivada do PDX
NOTA: Todas as etapas a seguir foram realizadas dentro de um gabinete de biossegurança por diretrizes padrão de cultura de tecido. Mantenha os estoques pré-aquecidos de placas de 96, 24 e 6 poços em uma incubadora de 37 °C antes de usar.
- Preparações de reagentes
- Prepare a solução de extrato de membrana de porão (BME) (fator de crescimento reduzido, sem fenol vermelho). Mantenha 10 mL de BME em uma geladeira de 4 °C durante a noite. Uma vez descongelado, gire a garrafa BME para garantir a dispersão.
- Prepare a mídia base/o buffer de lavagem AD+++. Adicione 5 mL de 200 mM L-glutamina, 1 M HEPES e Caneta/Estreptococos à mídia Avançada DMEM/F12 por tubulação com uma pipeta de 5 mL.
- Prepare o meio organoide do cólon, como descrito por Sato et al.18 através da suplementação de mídia base com N-Ac (1 mM), A83-01 (500 nM), B27 (1x), EGF (50 ng/mL), Noggin (100 ng/mL), Nicotinamida (10 mM), SD202190 (10 nM), R-spondin (500 ng/mL), L-glutamina (2 mM), HEPES (10 μM), penicilina-estreptomicina (1x) e Y-27623 (10 μM)19.
- Prepare o meio AD+++Digestion: 10 mL de mídia de cultura organoide 1x com 500 μL de colagenase tipo II (20 mg/mL) e 10 μL de RhoKI Y-27632 (10 mM).
- Dissociação do Tumor20
- Transfira o tumor em um tubo plástico de 50 mL para uma placa de Petri de 10 cm. Tire uma fotografia macroscópica ao lado de uma régua e regista-se uma descrição de suas condições (ou seja, tamanho, tecidos gordos, vascularização, necrose, etc.).
- Remova o excesso de AD+++ por aspiração, e corte o tecido tumoral em pequenos pedaços por tesoura, seguido de transferência de 1-2 pedaços em um microtubo de 2 mL para encaixe de congelamento em gelo seco. Armazene a -80 °C para traçar perfis genômicos. Pique as peças restantes em pedaços mais finos por tesoura antes de transferral para um tubo plástico de 50 mL usando AD+++.
- Lave o tecido picado 2-3 vezes por 35 mL de AD+++, seguido pela adição de 10 mL de meio de digestão (ver passo 4.1.4) e colocação em um agitador orbital a 4 x g por 1 h a 37 °C.
- Homogeneize o tecido digerido por pipetação para cima e para baixo usando uma pipeta plástica estéril de 5 mL, seguida pela adição de 20 mL de AD+++ e filtração por 100 μm de coador celular.
- Lave o pass-through duas vezes com AD+++ (gire a 450 x g por 5 min), seguido de resuspensão no BME (adicione 4x de volume de BME à pelota para suspensão) e mantenha no gelo19.
- Preparação da cultura organoide
- Adicione a suspensão da célula BME em placa de 6 poços em múltiplas gotas a um total de 200 μL por poço.
- Transfira a placa para uma incubadora de 37 °C. Depois de 30 min, o gel cai solidificar.
- Adicione 2 mL de mídia organoide a cada poço, com as gotas representativas registradas pela fotografia microscópica antes de transferir para uma incubadora (37 °C e 5% de CO2).
- Manter as culturas organoides com mudança média a cada 3-4 dias, e passagem a uma razão de 1:2 a cada 7 dias ou dependendo de seu crescimento e densidade.
5. Análise histopatologia e sequenciamento de próxima geração (NGS)
- histopatologia
- Coletar organoides do poço com o meio existente utilizando uma pipeta P1000, seguida de centrifugação (giro a 450 x g por 5 min), lavagem com PBS e fixação em 10% de formalina por 1h.
- Coloque os organoides fixos em 100% gelatina na parte inferior do tubo cônico de 50 mL, seguido de processamento e incorporação de tecidos de rotina.
- Realize a coloração de hematoxilina-eosina (H&E) usando protocolos padrão em seções de parafina de 4 mm.
- RNAseq e sequenciamento exome inteiro
- Coletar organoides do poço com o meio de cultura existente usando uma pipeta P1000, seguida de centrifugação usando uma microcentrifuge em velocidade máxima (12.000 x g) por 5 min a 4 °C.
- Colete a pelota removendo o supernanato médio para garantir que não haja BME visível, seguido de congelamento de encaixe em um microtubo (gelo seco) e, em seguida, transfira para um congelador de -80 °C.
- Extrair RNA ou DNA utilizando procedimento padrão dos fabricantes e realizar análises de NGS tanto para RNAseq quanto para sequenciamento de exome inteiro (WES).
6. IC50 ensaio20
- Sementes organoides em placa de 384 poços para ensaio IC50
- Organoides dissociado em BME cai de cada poço (digerindo BME) adicionando 20 μL de solução de dispase de 100x a cada poço (placa de 6 poços), que continha 2 mL de meio organoide, seguido por 10 minutos de incubação a 37 °C.
- Organoides digeridos pipeta de todos os poços através de um filtro de 70 μm em um tubo plástico de 50 mL para coletar os organoides.
- Conte os organoides sob microscopia para a determinação da concentração organoide. Suspenda os organoides usando meio de cultura, antes de adicionar BME para atingir concentração final de 5% (v/v) no gelo.
- Adicione 50 μL da suspensão organoide em cada placa de 384 poços com o distribuidor líquido, de acordo com o mapa da placa com uma densidade de semeadura de 200 PDXOs CR2110 por poço no meio de cultura organoide correspondente.
- Tratamento cisplatina e irinotecano
- Use cisplatina (com a maior concentração de 100 μM) e "irinotecan" (com a maior concentração de 10 μM). Adicione o SN-38 (um metabólito de irinotecano, ao contrário do irinotecano que geralmente é usado para estudos in vivo) a cada poço de acordo com o esquema de diluição de medicamentos para 9 doses, em diluição serial por dispener digital.
- Crie o mapa de placas usando a ferramenta de software de distribuidor digital. Inclua um veículo de controle negativo com viabilidade 100% e controle postivo de 5 μM starurosporine, que mostrou 0% de viabilidade.
- Coloque as placas de 384 poços tratadas com drogas de volta em uma incubadora de 37 °C.
- Determinação da viabilidade celular organoide após tratamento medicamentoso
- Ao final dos 5 dias de tratamento medicamentoso, determine a viabilidade das células organoides usando reagentes de viabilidade celular luminescente, conforme procedimento recomendado pelo fabricante. Adicione reagente luminescente em cada poço com o dispener líquido e misture por 5 minutos em um agitador de pratos, seguido de uma incubação de 30 minutos à temperatura ambiente no escuro.
- Regisso sinal luminescente em um leitor de placas multi-bem de luminescência.
- Calcule as viabilidades normalizadas de cada poço usando as leituras brutas do leitor de placas e crie uma curva dose-resposta e valores IC50 por encaixe de curva não linear.
Resultados
Morfologia de PDXOs, típico de organoides sob microcopia leve, e consistente com pdx parental por mancha de H&E
Sob microscopia leve, pdxo-CR2110 demonstra morfologia cística típica (Figura 1A),como descrito anteriormente para organoides derivados do paciente (PDO), evidências que sustentam a semelhança entre PDXO e PDO sob as mesmas condições culturais.
O exame histopatológico por manchas de H&E revela que as estruturas teciduais e os tipos celulares de PDXO-CR2110 (Figura 1B) refletem o PDX-CR2110 original (Figura 1C),apoiando que o PDX e o PDXO foram desenvolvidos a partir da mesma origem: CR2110. Esta observação fornece evidências histopatologias para apoiar a similaridade do PDXO com seu PDX parental.
A expressão transcriptome e o sequenciamento de exome inteiro demonstram alta correlação entre PDXO-CR2110 e o PDX-CR2110 parental
Os tumores PDX-CR2110 foram previamente perfilados por meio de sequenciamento de transcriptome (RNAseq, mRNA)16 e exome inteiro (WES, DNA). Agora, temos o perfil correspondente do PDXO-CR2110 correspondente. As comparações genômicas de perfil dos correspondentes PDX e PDXO (Figura 2) demonstram uma alta correlação de 94,92% na expressão transcriptome (mRNA) (epigenética) e uma alta concordância de 97,67% das mutações de DNA (WES) (genética), sugerindo uma semelhança genômica global entre este par de modelos.
Semelhanças observadas para as propriedades farmacológicas entre in vitro PDXO-CR2110 e in vivo PDX-CR2110
Ensaios de sensibilidade à droga foram realizados em PDXO-CR2110 em placas de 384 poços, com resultados mostrados na Figura 3A. PDXO-CR2110 era sensível ao irinotecano e resistente à cisplatina, consistente com os resultados do tratamento PDX (Figura 3B) onde TGI (inibição do crescimento tumoral) nos níveis de dose de 100 mg/kg, i.p., Q3Dx3 para irinotecano e 5 mg/kg, i.p., Q4Dx4 para cisplatina é de 84,63% e 6,61% respectivamente. Esta consistência de farmacologia observada suporta a equivalência potencialmente biológica de ambos os modelos, podendo ser usada para estudos complementares de farmacologia in vitro e in vivo.
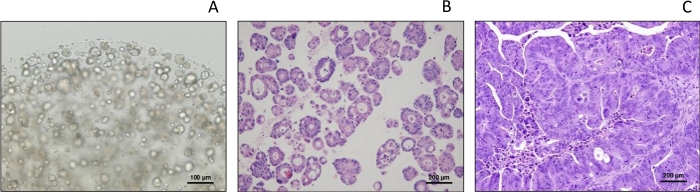
Figura 1: Morfologia de PDXO-CR2110. (A) Morfologia sob microscopia leve (tipo cístico). (B,C) Histopatologia de PDXO-CR2110 e PDX-CR2110, respectivamente. Clique aqui para ver uma versão maior desta figura.

Figura 2: Perfis genômicos de PDXO-CR2110 vs. PDX-CR2110, WES e RNAseq. Painel superior: correlação global de expressão mRNA entre PDX-CR2110 e PDXO-CR2110 por RNAseq. Painel inferior: tabela de ambas as correlações de expressão mRNA por RNAseq e concordância de mutação de DNA por WES: PDX- vs PDXO-CR2110. Clique aqui para ver uma versão maior desta figura.
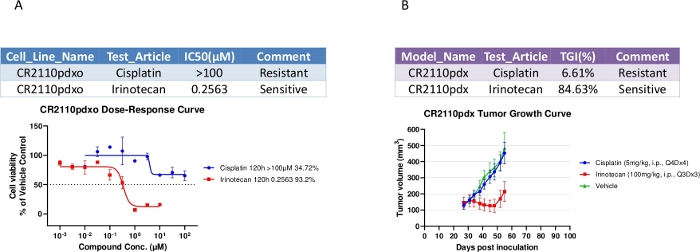
Figura 3: Propriedades farmacológicas tanto do PDXO-CR2110 in vitro quanto do SC PDX-CR2110 in vivo. (A) PDXO-CR2110 em dose-resposta in vitro aos compostos de teste. (B) Inibição do crescimento tumoral induzida pelos mesmos compostos de teste em CR2110 in vivo. Clique aqui para ver uma versão maior desta figura.
Discussão
Os dados preliminares do PDX-/PDXO-CR2110 neste relatório suportam a equivalência biológica entre pdx e seu derivado, PDXO, no que diz respeito à genômica, histopatologia e farmacologia, uma vez que ambos os modelos representam as formas da doença derivadas do CSC original do paciente. Ambos os modelos são modelos de doenças derivadas do paciente, potencialmente preditivos da resposta clínica dos pacientes10,11,12,21. O par combinado de modelos in vitro e in vivo pode se complementar para triagem in vitro e validação in vivo, melhorando a taxa de sucesso da descoberta de medicamentos e potencialmente reduzindo as taxas de atrito no desenvolvimento clínico. Vale ressaltar que o PDXO agora pode permitir que o HTS aproveite as grandes bibliotecas organoides derivadas do paciente, onde os PDXs falham devido aos altos custos in vivo e prazos mais longos. Desnecessário dizer que uma biblioteca PDX-PDXO combinada provavelmente se tornaria a plataforma escolhida para apoiar a descoberta de drogas e a pesquisa translacional em um futuro próximo.
Converter a biblioteca existente de modelos PDX anotados pode ser uma abordagem rápida e produtiva para a construção de uma biblioteca organoide prática, empregando um processo industrial. Este relatório converteu um PDX em PDXO para explorar a viabilidade de tal processo, e o método utilizado poderia ser uma base para apoiar um processo em larga escala para construir uma extensa biblioteca PDXO. Na prática, os métodos para criar o PDXO são geralmente semelhantes ao método amplamente descrito para a geração de PDO18,com exceção da fonte do tecido do paciente ser camundongos.
Existem medidas críticas para garantir que os PDXOs sejam criados com sucesso: 1) os tumores PDX frescos são fragmentados em pequenos pedaços; 2) as condições culturais descritas para a cultura organoide, conforme descrito por Clevers e colegas, são fielmente implementadas18,22, mas podem ser ajustadas para diferentes organoides; 3) diferentes organoides têm diferentes taxas de crescimento, impactando a duração da cultura e saúde organoides, bem como a duração do tratamento medicamentoso; 4) um ensaio eficaz para determinar o conteúdo do mouse versus o conteúdo humano é absolutamente crítico para garantir que as culturas sejam em grande parte organoides humanos, uma vez que algumas culturas podem inevitavelmente ter contaminação persistente do tecido/célula do rato (no caso relatado aqui, há uma contaminação mínima do tecido do rato, dados não mostrados). A contaminação do mouse pode ser uma das limitações importantes na criação de biobancos PDXO se métodos eficazes de detecção e remoção não forem usados.
Divulgações
Todos os autores são os atuais funcionários em tempo integral da Crown Bioscience, Inc.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Jody Barbeau, Federica Parisi e Rajendra Kumari pela leitura crítica e edição do manuscrito. Os autores também gostariam de agradecer à Crown Bioscience Oncology in vitro e equipe in vivo por seus grandes esforços técnicos.
Materiais
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Life Technologies | 12634028 | Base medium |
| DMEM | Hyclone | SH30243.01 | Washing medium |
| Collagenese type II | Invitrogen | 17101015 | Digest tumor |
| Matrigel | Corning | 356231 | Organoid culture matrix (Basement Membrane Extract, growth factor reduced) |
| N-Ac | Sigma | A9165 | Organoid culture medium |
| A83-01 | Tocris | 2939 | Organoid culture medium |
| B27 | Life Technologies | 17504044 | Organoid culture medium |
| EGF | Peprotech | AF-100-15 | Organoid culture medium |
| Noggin | Peprotech | 120-10C | Organoid culture medium |
| Nicotinamide | Sigma | N0636 | Organoid culture medium |
| SB202190 | Sigma | S7076 | Organoid culture medium |
| Gastrin | Sigma | G9145 | Organoid culture medium |
| Rspondin | Peprotech | 120-38-1000 | Organoid culture medium |
| L-glutamine | Life Technologies | 35050038 | Organoid culture medium |
| Hepes | Life Technologies | 15630056 | Organoid culture medium |
| penicillin-streptomycin | Life Technologies | 15140122 | Organoid culture medium |
| Y-27632 | Abmole | M1817 | Organoid culture medium |
| Dispase | Life Technologies | 17105041 | Screening assay |
| CellTiter-Glo 3D | Promega | G9683 | Screening assay (luminescent ATP indicator) |
| Multidrop dispenser | Thermo Fisher | Multidrop combi | Plating organoids/CellTiter-Glo 3D addition |
| Digital dispener | Tecan | D300e | Compound addition |
| Envision Plate reader | Perkin Elmer | 2104 | Luminescence reading |
| Balb/c nude mice | Beijing HFK Bio-Technology Co | ||
| RNAeasy Mini kit | Qiagen | 74104 | tRNA purification kit |
| DNAeasy Blood & Tissue Kit | Qiagen | 69506 | DNA purification kit |
| Histogel | Thermo Fisher | HG-4000-012 | Organoid embedding |
Referências
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nature Reviews Clinical Oncology. 9 (6), 338-350 (2012).
- Gao, H., et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response. Nature Medicine. 21 (11), 1318-1325 (2015).
- Yang, M., et al. Overcoming erlotinib resistance with tailored treatment regimen in patient-derived xenografts from naive Asian NSCLC patients. International Journal of Cancer. 132 (2), 74-84 (2013).
- Li, Q. X., Feuer, G., Ouyang, X., An, X. Experimental animal modeling for immuno-oncology. Pharmacology & Therapeutics. 173, 34-46 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Drost, J., Clevers, H. Organoids in Cancer Researchearch. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Muthuswamy, S. K. Organoid Models of Cancer Explode with Possibilities. Cell Stem Cell. 22 (3), 290-291 (2018).
- Sachs, N., et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Weeber, F., et al. Preserved genetic diversity in organoids cultured from biopsies of human colorectal cancer metastases. Proceedings of the National Academy of Sciences of the United States of America. 112 (43), 13308-13311 (2015).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yao, Y., et al. Patient-Derived Organoids Predict Chemoradiation Responses of Locally Advanced Rectal Cancer. Cell Stem Cell. 26 (1), 17-26 (2020).
- Ganesh, K., et al. A rectal cancer organoid platform to study individual responses to chemoradiation. Nature Medicine. 25 (10), 1607-1614 (2019).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Yang, J. P., et al. A novel RNAi library based on partially randomized consensus sequences of nuclear receptors: identifying the receptors involved in amyloid beta degradation. Genomics. 88 (3), 282-292 (2006).
- Zhang, L., et al. A subset of gastric cancers with EGFR amplification and overexpression respond to cetuximab therapy. Scientific Reports. 3, 2992 (2013).
- Chen, D., et al. A set of defined oncogenic mutation alleles seems to better predict the response to cetuximab in CRC patient-derived xenograft than KRAS 12/13 mutations. Oncotarget. 6 (38), 40815-40821 (2015).
- Guo, S., et al. Molecular Pathology of Patient Tumors, Patient-Derived Xenografts, and Cancer Cell Lines. Cancer Research. 76 (16), 4619-4626 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tiriac, H., French, R., Lowy, A. M. Isolation and Characterization of Patient-derived Pancreatic Ductal Adenocarcinoma Organoid Models. Journal of Visualized Experiments. (155), (2020).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nature Medicine. 25 (5), 838-849 (2019).
- Corcoran, R. B., et al. Combined BRAF and MEK Inhibition With Dabrafenib and Trametinib in BRAF V600-Mutant Colorectal Cancer. Journal of Clinical Oncology. , (2015).
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados