Method Article
Mapeamento quantitativo de ventilação específica no pulmão humano usando ressonância magnética de prótons e oxigênio como agente de contraste
Neste Artigo
Resumo
A imagem latente específica da ventilação é uma técnica funcional da imagem latente de ressonância magnética que permita a quantificação da ventilação específica regional no pulmão humano, usando o oxigênio inalado como um agente do contraste. Aqui, apresentamos um protocolo para coletar e analisar dados específicos de imagens de ventilação.
Resumo
A imagem latente específica da ventilação (SVI) é uma técnica funcional da imagem latente de ressonância magnética capaz de quantificar a ventilação específica ― a relação do gás fresco que entra em uma região do pulmão dividida pelo volume final expiratório da região ― no pulmão humano, usando somente oxigênio inalado como um agente de contraste. A quantificação regional da ventilação específica tem o potencial ajudar a identificar áreas da função patológica do pulmão. O oxigênio na solução no tecido encurta o tempo longitudinal do abrandamento do tecido (T1), e assim uma mudança no oxigenação do tecido pode ser detectada como uma mudança no sinal de T1-weighted com uma imagem adquirida recuperação da inversão. Após uma mudança abrupta entre duas concentrações de oxigênio inspirado, a taxa em que o tecido pulmonar dentro de um VOXEL equilibrou a um novo estado estacionário reflete a taxa em que o gás residente está sendo substituído pelo gás inalado. Esta taxa é determinada pela ventilação específica. Para provocar esta mudança repentina na oxigenação, os indivíduos respiram alternadamente 20 blocos da respiração do ar (oxigênio de 21%) e oxigênio de 100% quando no varredor de MRI. Uma mudança Stepwise na fração inspirada do oxigênio é conseguida com o uso de um sistema tridimensional (3D)-impresso feito encomenda do desvio do fluxo com um interruptor manual durante uma preensão final-expiratória curta da respiração. Para detectar a mudança correspondente em T1, um pulso global da inversão seguido por uma única seqüência rápida do eco da rotação do tiro foi usado para adquirir imagens bidimensionais de t1-weighted em um varredor de 1,5 t MRI, usando uma bobina do torso do oito-elemento. A única fatia e a imagem latente da multi-fatia são possíveis, com parâmetros ligeiramente diferentes da imagem latente. A quantificação da ventilação específica é conseguida correlacionando o tempo-curso da intensidade do sinal para cada voxel do pulmão com uma biblioteca de respostas simuladas ao estímulo do ar/oxigênio. As estimativas de SVI da heterogeneidade específica da ventilação foram validadas de encontro ao washout múltiplo da respiração e provaram determinar exatamente a heterogeneidade da distribuição específica da ventilação.
Introdução
O objetivo geral da imagem latente específica da ventilação (SVI) ― uma técnica da imagem latente de ressonância magnética do Proton (MRI) que use o oxigênio como um agente do contraste1 ― é para mapear quantitativamente a ventilação específica no pulmão humano. A ventilação específica é a proporção de gás fresco entregue a uma região pulmonar em uma respiração dividida pelo volume expiratório final da mesma região pulmonar1. Em conjunto com medições da densidade pulmonar local, a ventilação específica pode ser usada para computar a ventilação regional2. Medidas de ventilação local e heterogeneidade de ventilação que são fornecidas pelo SVI têm o potencial de enriquecer a compreensão de como as funções pulmonares, tanto normalmente como anormalmente3,4.
A imagem latente específica da ventilação é uma extensão do teste Classical da fisiologia, washout múltiplo da respiração (MBW), uma técnica introduzida primeiramente nos 1950s5,6. Ambas as técnicas usam Washin/washout do gás para medir a heterogeneidade da ventilação específica, mas o SVI fornece a informação spatially-localizada quando o MBW fornece somente medidas globais da heterogeneidade. Em MBW, um espectrómetro de massa é usado para medir a concentração expirada misturada de um gás insolúvel (nitrogênio, hélio, hexafluoreto do enxôfre, etc.) sobre muitas respiras durante um washout desse gás, como representado em Figura 1. Junto com o volume expirado por a respiração durante o período do washout, esta informação pode ser usada para computar a distribuição total da ventilação específica no pulmão. Em SVI, um varredor de MRI é usado para medir o sinal de T1-weighted ― que é um substituto para a quantidade de oxigênio na solução no tecido pulmonar, um indicador direto da concentração local do oxigênio ― em cada voxel do pulmão sobre muitas respirações durante diversos Washin/washouts de oxigénio. De uma forma que é diretamente análoga ao MBW, essa informação nos permite computar a ventilação específica de cada voxel pulmonar. Em outras palavras, a técnica realiza milhares de experimentos paralelos do tipo MBW, um para cada voxel, durante um experimento do SVI. De fato, os mapas espaciais de ventilação específica assim produzidos podem ser compilados para recuperar a saída específica de heterogeneidade de ventilação da MBW. Um estudo de validação7 mostrou que as duas metodologias produziram resultados comparáveis quando realizadas em série sobre os mesmos sujeitos.
Existem outras modalidades de imagem que, como a SVI, fornecem medidas espaciais de heterogeneidade ventilatória. Tomografia por emissão de pósitrons (PET)8,9, tomografia computadorizada de emissão de fóton único (SPECT)10,11e gás hiperpolarizado ressonância magnética12,13 técnicas têm sido usadas para criar um corpo substancial da literatura a respeito do teste padrão espacial da ventilação em assuntos saudáveis e anormais. Em geral, essas técnicas têm pelo menos uma vantagem distinta sobre o SVI, em que sua relação sinal-ruído é caracteristicamente maior. No entanto, cada técnica também tem uma desvantagem característica: PET e SPECT envolvem exposição à radiação ionizante, e ressonância magnética hiperpolarizada requer o uso de gás hiperpolarizado altamente especializado e um scanner de RM com hardware multi-core não padronizado.
SVI, uma técnica de prótons-RM, normalmente usa 1,5 Tesla MR hardware com oxigênio inalado como um agente de contraste (ambos os elementos estão prontamente disponíveis na saúde), tornando-o potencialmente mais generalizável para o ambiente clínico. O SVI aproveita o fato de que o oxigênio encurta o tempo de relaxamento longitudinal (T1) dos tecidos pulmonares1, que por sua vez se traduz em uma mudança na intensidade do sinal em uma imagem ponderada em T1. Assim, as mudanças na concentração de oxigênio inspirado induzem a mudança na intensidade do sinal de imagens apropriadamente cronometradas de MRI. A taxa desta mudança que segue uma mudança abrupta na concentração inspirada do oxigênio, tipicamente ar e 100% oxigênio, reflete a taxa em que o gás residente é substituído pelo gás inalado. Esta taxa de substituição é determinada por ventilação específica.
Como SVI não envolve nenhuma radiação ionizante, não tem contra-indicações para estudos longitudinais e intervencionais que seguem pacientes ao longo do tempo. Assim, é serido idealmente estudando a progressão da doença ou avaliando como os pacientes individuais respondem ao tratamento. Devido à sua facilidade relativa e repetibilidade segura, a imagem de ventilação específica é, em geral, uma técnica ideal para aqueles que desejam estudar grandes efeitos e/ou um grande número de pessoas ao longo do tempo ou em vários locais clínicos diferentes.
Após a publicação original descrevendo a técnica1, a imagem de ventilação específica (SVI) tem sido utilizada em estudos focados no efeito da infusão salina rápida, postura, exercício e broncoconstrição2,3 , 4. º , 14 anos de , a habilidade da técnica 15. The de estimar a heterogeneidade inteira do pulmão da ventilação específica foi validada usando o teste múltiplo bem estabelecido do washout da respiração7 e mais recentemente, uma validação cruzada regional foi executada, por comparando SVI e a imagem latente de ventilação específica da respiração múltipla do gás hyperpolarizado16. Essa técnica confiável e prontamente implantável, capaz de mapear quantitativamente a ventilação específica no pulmão humano, tem o potencial de contribuir significativamente para a detecção precoce e o diagnóstico da doença respiratória. Também apresenta novas oportunidades para quantificar anormalidades pulmonares regionais e acompanhar as alterações induzidas pela terapia. Essas alterações na função pulmonar específica da região, que a SVI nos permite mensurar pela primeira vez, têm o potencial de se tornarem biomarcadores para avaliar o impacto das drogas e das terapias inalatórias, podendo ser uma ferramenta extremamente útil em ensaios clínicos.
O objetivo deste artigo é apresentar a metodologia de imagem de ventilação específica em detalhe e em forma visual, contribuindo assim para a disseminação da técnica para mais centros.
Protocolo
A Universidade da Califórnia, programa de proteção de pesquisa humana de San Diego aprovou este protocolo.
1. segurança e formação de sujeitos
- Obter o consentimento escrito e informado do assunto. Descreva os riscos potenciais apresentados pela exposição a campos magnéticos em rápida mutação, e o desconforto potencial de usar máscara facial e respirar o gás seco.
- Assegure-se de que o assunto possa submeter-se com segurança a varredura do Sr, utilizando o questionário localmente aprovado da seleção da segurança MRI.
- Se o assunto é uma fêmea da idade fértil, e incerto de seu status da gravidez, peça-a para self-administrar um teste de gravidez over-the-counter. Se o sujeito estiver grávido, exclua o assunto do restante do estudo.
- Medir o peso do sujeito. Os parâmetros de segurança do scanner que limitam a quantidade de energia de radiofrequência (RF) entregue ao sujeito requerem entrada dessa característica. Verifique se o peso do sujeito está abaixo do limite máximo de peso da tabela de RM (neste caso, 136 kg).
- Treinar o assunto para respirar no tempo com a seqüência de digitalização MR. De preferência, reproduzir uma gravação de áudio de uma varredura anterior e instruir o sujeito a respirar normalmente e completar uma respiração a cada 5 s, usando as pistas de áudio do scanner como guia; respirar junto com o assunto para fins de formação.
- Determine o tamanho da máscara facial (tamanhos variam de Petite a extra grande [XL]) que melhor se adapta ao assunto medindo as dimensões do nariz para o queixo do sujeito. Uma máscara apropriadamente-feita medida caberá confortavelmente contudo impedirá que o ar escape entre a máscara e a pele do assunto a qualquer momento. Tente em outros tamanhos, se necessário.
- Verifique se os bolsos e roupas do sujeito estão livres de cartões de crédito magnéticos e peças metálicas contendo ferro. Se necessário, tenha a mudança do assunto no vestido médico fornecido pela facilidade de MRI.
Nota: O metal pode ser perigoso no ambiente de MRI, e os objetos metálicos tais como grampos (tipicamente nos sutiãs), anéis do metal (sutiãs e Hoodies), tecla do metal ou zíperes (camisas, camisolas), extensão do cabelo e perucas têm o potencial criar Artifacts da imagem latente.
2. preparação do ambiente de ressonância magnética
- Permita somente o pessoal treinado na segurança de MRI aos padrões da facilidade da imagem latente entrar na sala do varredor ou ajudar em executar esta experimentação.
- Configure o scanner MR para uso com uma bobina de tronco conectando a bobina ao conector apropriado na tabela do scanner.
- Prepare a tabela do varredor com folhas, almofadas, e descansos de modo que o assunto seja confortável por pelo menos 30 minutos durante a imagem latente.
-
Montar o sistema de entrega de oxigénio.
Nota: um diagrama esquemático do tubo é apresentado na Figura 2.- Coloque uma válvula de comutação de dois/três vias ao alcance do operador do scanner ou da pessoa que executa o experimento SVI.
- Conecte o tanque do oxigênio médico (fora da sala do varredor) ou a fonte da parede do oxigênio (se disponível) a uma entrada da válvula de switching usando a tubulação plástica de 1/4-inch.
- Conecte a tomada da válvula de interruptor situada na sala de controle ao 8 m (comprimento suficiente para o varredor) tubulação plástica de 1/4-inch. Alimente a tubulação através da passagem, da sala de controle à sala do varredor, e assegure-se de que alcangue o meio do furo do varredor.
Nota: A tubulação plástica que conecta a tomada da válvula de comutação à máscara do fluxo-desvio incluiu um passo acima no diâmetro nos últimos 2 m, de 1/4 de polegada a 3/8 polegadas a 1/2 polegadas, a fim diminuir o ruído produzido pelo ar que flui no sistema do desvio do fluxo. - Conecte a extremidade de 1/2 polegadas da tubulação ao acessório da máscara do fluxo-desvio.
- Fixe o acessório do fluxo-desvio à máscara protectora que cabe o assunto.
- Ajuste a pressão no regulador do tanque de gás ou da tomada de parede a um valor que produza um fluxo do oxigênio maior do que o fluxo inspiratória máximo esperado. A pressão necessária depende da natureza do estudo (repouso, exercício, etc.) e da resistência global do sistema de fornecimento de gás (tipicamente ~ 70 psi para o sistema de entrega descrito na etapa 2.4.3 para estudos em repouso).
- Teste a válvula de interruptor ativando o fluxo do oxigênio, certificando-se de que o fluxo adequado está atual na tomada do acessório do fluxo-desvio e que nenhum escape está atual na tubulação plástica.
3. instrumentando e preparando o assunto para a imagem latente
- Tenha o sujeito deitado na mesa de ressonância magnética. Certifique-se que a parte superior do elemento da baixo-bobina fornece a cobertura adequada dos apices do pulmão, certificando-se que a parte superior do elemento da baixo-bobina é mais elevada do que os ombros do assunto.
- Ter o assunto inserir tampões de ouvido e verificar se o som está sendo bloqueado.
- Tape a bola de aperto (ou um mecanismo de segurança alternativo) para o pulso do sujeito para que ele possa ser facilmente acessado.
- Fixe a máscara e o sistema de bypass de fluxo à face do sujeito. Obstrua momentaneamente o lado expiratório do acessório do fluxo-desvio e peça o assunto para tentar uma inspiração e uma expiração normais para verific para ver se há escapes.
- Coloque o objeto no scanner, usando a ferramenta de centralização de luz para se certificar de que a bobina do tronco ocupa o centro do furo.
- Conecte a linha de bypass de fluxo ao acessório de máscara de bypass de fluxo impresso em 3D usando a porca de latão com encaixe apertado na entrada.
4. imagem latente de MRI
-
Selecione o local anatômico para fatias de imagem.
- Adquira uma sequência de localizador para obter um mapa anatômico que será usado para prescrever o restante do exame.
- Selecione até 4 fatias de pulmão sagital a serem estudadas clicando e arrastando a fatia de imagem para o local desejado usando a interface gráfica do usuário do scanner. Normalmente, o campo de visão é definido como 40 x 40 cm e espessura de fatia para 1,5 cm. Selecione fatias centralizadas no campo pulmonar visando a região de interesse para o estudo, tipicamente minimizando a intrusão de grandes vasos pulmonares medialmente e parede torácica lateralmente para maximizar o volume pulmonar amostrado.
Nota: A seleção de fatias pode ser feita em qualquer plano; podem ser selecionadas até 4 fatias. Para fins de demonstração, uma fatia será adquirida. - Anote a localização das fatias de imagem em relação à localização da coluna vertebral para que o mesmo volume possa ser reimaged para estudos longitudinais.
-
Imagens de ventilação específicas
Nota: uma lista de parâmetros típicos de RM é apresentada na tabela 1.- Defina o tempo de inversão no computador MR para a fatia mais medial para 1.100 ms para maximizar o contraste do ar-oxigênio17.
- Definir os parâmetros de aquisição (tabela 1) para aquisição de imagens. Para a aquisição de várias fatias, cada fatia adicional é adquirida após a primeira, em intervalos de 235 MS (1.335 MS, 1.570 MS, 1.805 MS).
Nota: Após o pulso de recuperação de inversão e um intervalo de tempo (descrito pelo tempo de inversão), cada imagem de fatia é adquirida usando um Half-Fourier Turbo spin-Echo (HASTE), em 128 x 128 resolução (70-linhas de k-espaço amostrado); as imagens são reconstruídas para 256 x 256 de resolução. - Defina o número de repetições para 220 e o tempo de repetição (TR) para 5 s. Isso resultará na repetição 4.2.1 e 4.2.2 para um total de 220 respirs consecutivos, 5 s separados. Peça ao sujeito que voluntariamente porta sua respiração a tempo com a aquisição da imagem.
Nota: As imagens são adquiridas no fim de uma expiração normal em uma interrupção de respiração voluntária curta na capacidade residual funcional (FRC). É importante que um volume pulmonar semelhante seja atingido consistentemente durante cada uma dessas aquisições consecutivas. - Monitore a consistência do volume pulmonar do sujeito (expiração final) durante as aquisições subsequentes e forneça feedback para melhorar a qualidade, se necessário. Aumente o TR (o intervalo de tempo entre aquisições sucessivas) se o sujeito achar difícil atingir um volume pulmonar consistente a cada 5 s.
- Mude a mistura inspirada do gás do assunto cada 20 respirs (durante a preensão da respiração da aquisição para o conforto do assunto), alternando entre o ar do quarto e o oxigênio médico. Anote quando os interruptores ocorreram, e os intervalos durante os quais o sujeito respirava cada gás. Permita que o sujeito respire 100% de oxigênio por 40 respiros consecutivos em algum momento do experimento (tipicamente respira 20-60 ou 180-220) para aumentar a sensibilidade a regiões pulmonares de baixa ventilação.
- Verifique regularmente a frequência cardíaca (40 − 80 para indivíduos normais em repouso) e a saturação de oxigênio (tipicamente 98 − 100%) observando o oxímetro de pulso (Figura 2); desvios da norma podem sinalizar angústia ou ansiedade.
- Converse com o assunto com freqüência, pressionando o teclado do scanner Push-to-talk botão, dando atualizações regulares de tempo restante.
- Após a respiração 220, a imagem latente é completa. Devolva o assunto ao ar do quarto e retire-o do scanner.
5. criando um mapa de ventilação específico de uma série temporal de imagens
- Verifique se uma pilha de 220 imagens consecutivas de MR para cada fatia de pulmão foi adquirida.
- Importe as imagens para o registro no software de análise de imagem (por exemplo, MATLAB).
- Das 220 imagens, escolha, por inspeção visual de toda a pilha de imagens, para cada fatia uma que melhor represente a capacidade residual funcional. A capacidade residual funcional é identificada como o "modo" dos volumes pulmonares na pilha.
- Usando a imagem "Mode" como referência, use o registro projetivo ou afim para registrar todas as imagens na referência de capacidade residual funcional.
Nota: O registro é normalmente realizado usando um algoritmo desenvolvido na casa18 ou um algoritmo de ponto mais próximo iterativo de Bootstrap generalizado-Dual disponível publicamente (gdb-ICP19). - Use a saída do algoritmo de registro para calcular a mudança de área de cada imagem. Descarte as imagens cuja etapa de registro exigiu > 10% de alteração de área da pilha de imagens e trate-as como dados ausentes20.
- Quantificar a ventilação específica no pulmão a partir da pilha registrada usando um algoritmo desenvolvido na casa1,7. Realizar a quantificação comparando a resposta do tempo de cada voxel à série de Washin e washout consecutivos de oxigênio, a uma biblioteca de 50 simulado, sem ruído, respostas, correspondendo a ventilações específicas variando de 0, 1 a 10, em incrementos de 15%. Cada voxel recebe um valor de ventilação específica correspondente à ventilação específica do ideal simulado apresentando correlação máxima com a série temporal de cada voxel, como originalmente apresentado em1.
- A saída da etapa anterior é um mapa de ventilação específica. Criar um histograma da distribuição, e calcular a largura da distribuição de ventilação específica, uma medida da heterogeneidade de ventilação específica, independente do volume corrente.
6. combinando ventilação específica e mapas de densidade para calcular a ventilação alveolar regional
- Além do SVI, adquira imagens de densidade de prótons pulmonares21, como descrito em um estudo anterior22 (seções 4,4 e 5,1 na referência22). Obter as imagens de densidade de prótons na mesma fatia (s) de pulmão, no mesmo volume pulmonar (FRC, fim de uma expiração normal); definir a resolução para 64 x 64, correspondendo a um tamanho de VOXEL de ~ 6,3 mm x 6,3 mm x 15 mm (~ 0,6 cm3).
-
Alinhe imagens específicas de ventilação e densidade de prótons.
- Alise as imagens específicas de ventilação e densidade de prótons usando um filtro Gaussian com um tamanho de kernel de ~ 1 cm3.
- Realize o registro rígido (tradução e rotação) entre o mapa de ventilação específica e o mapa de densidade usando um algoritmo mútuo baseado em informações.
-
Calcule a ventilação alveolar de dados de ventilação específica e densidade de prótons coregistrados.
- Calcule um mapa de (1-densidade), que é a fração de ar no volume amostrado no final de uma expiração normal, assumindo que o pulmão é composto de ar e tecido e que a densidade do tecido é ~ 1 g/cm3.
- Calcule um mapa de ventilação regional como o produto (1-density) x SV (unidades naturais). Multiplique este produto pelo volume de um VOXEL (ou outra região de interesse) e a frequência respiratória (imposta, tipicamente 12 respirs/min), para obter um mapa de ventilação nas unidades mais familiares de ml/min.
Nota: Para cada região pulmonar, SV = ΔV/V0 e (1 – densidade) ≈ v0. Assim, o produto (1-densidade) x SV = ventilação regional, expressa em unidades naturais.
Resultados
Única fatia SVI em um assunto saudável
A imagem latente específica da ventilação produz mapas quantitativos da ventilação específica como mostrado na Figura 3a, que descreve uma única fatia no pulmão direito de uma fêmea saudável dos anos de idade 39. Observe a presença do gradiente vertical esperado em ventilação específica; a porção dependente do pulmão apresenta maior ventilação específica do que a porção não dependente do pulmão. Um histograma dos valores de ventilação específicos mapeados é apresentado (Figura 3B, círculos preenchidos), juntamente com uma função de distribuição de probabilidade log-normal de melhor ajuste (linha pontilhada). A largura da distribuição de melhor ajuste pode ser usada como uma métrica de heterogeneidade de ventilação específica7, 23. A Figura 1 mostra um washout múltiplo da respiração adquirido no mesmo assunto, na mesma postura. A Figura 1a mostra o registro temporal da concentração de nitrogênio medido na boca após uma mudança de ar inspirado para inspirar 100% de oxigênio. A Figura 1b apresenta a distribuição de ventilação específica, como estimada a partir do washout. Para ambos os SVI e MBW, a variável relevante é a largura da distribuição, medida aqui pela largura de uma distribuição normal do registro ajustada aos dados (linha pontilhada), foi encontrado para ser 0,41, usando SVI e 0,42 usando o MBW dentro da escala normal saudável. A validação da heterogeneidade de ventilação específica estimada por SVI em comparação com o MBW foi realizada em 10 indivíduos e a diferença entre as técnicas foi menor que a variabilidade interteste do MBW7. Uma comparação espacial com uma imagem latente de ventilação específica da respiração múltipla do gás hyperpolarizado16 igualmente mostrou estimativas de grupo de confiança da heterogeneidade específica da ventilação (a largura da distribuição específica da ventilação sobre os 8 assuntos estudados foram 0,28 ± 0, 8 e 0,27 ± 0,10 para hiperpolarizada 3He e imagens de ventilação específica, respectivamente), apesar da maior variabilidade intragrupo esperada (o desvio padrão das diferenças individuais de largura foi de 0,13)16.
Mapas de ventilação específicos também podem ser usados em conjunto com mapas de densidade pulmonar para calcular a ventilação alveolar regional. Para gerar mapas de ventilação alveolar, imagens específicas de ventilação e densidade devem ser suavizados espacialmente para minimizar os possíveis desalinhamentos menores entre as duas modalidades.
Resposta ao desafio do metacolina em um assunto asmático
O SVI pode ser usado para medir as respostas pulmonares e regionais a intervenções como o exercício4, a postura2ou a medicação3. Como exemplo, a Figura 4 retrata mapas de fatia única do pulmão de um indivíduo asmático leve no início do estudo (figura 4a), após broncoconstrição com Metacolina (Figura 4B), e após a recuperação assistida por Albuterol ( Figura 4C). Anote a heterogeneidade específica aumentada da ventilação durante o evento induzido da asma, e a presença de grandes remendos de pouco a nenhuma ventilação específica (regiões do azul escuro na parcela dependente do pulmão). Além disso, observe que a ventilação aumentou paradoxalmente em algumas regiões durante a broncoconstrição (regiões verde-avermelhadas).
Multi-fatia SVI
Até seis (tipicamente quatro), contíguas, fatias do pulmão de 15 milímetros podem simultaneamente ser imaged com o SVI. A Figura 5 retrata quatro fatias de pulmão direito contíguo, cobrindo ~ 70% do pulmão direito, em um sujeito masculino asmático moderado que havia sido retirado de seus medicamentos para asma por 24 horas.
Mapa de ventilação
Desde que a informação da densidade do pulmão foi adquirida na mesma fatia, e a freqüência de respiração é sabida, um mapa de ventilação inteiramente quantitativo pode ser computado nas unidades de mL/min/mL. Um exemplo de um mapa de ventilação é mostrado na Figura 6.
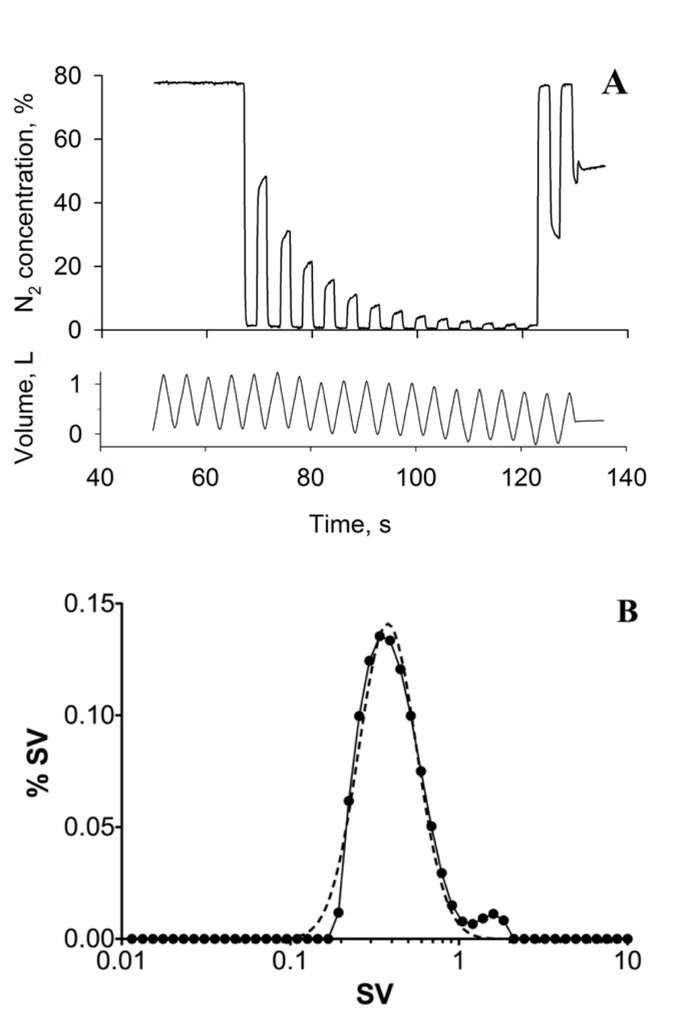
Figura 1: lavagem de respiração múltipla. (A) traçado típico de MBW mostrando concentração expirada de nitrogênio (N2) (superior) e volume corrente (inferior) ao longo do tempo (segundos, s). Os dados foram adquiridos na postura supina; o assunto era uma fêmea saudável dos anos de idade 39. (B) histograma representando a distribuição de ventilação específica (SV) calculada a partir do experimento MBW utilizando o método proposto por Lewis et al.23 (linha sólida). A linha tracejada representa o melhor ajuste de log (Gaussian) para a distribuição de ventilação específica. A heterogeneidade da ventilação específica, o desfecho-chave, é medida como a largura da distribuição de melhor ajuste, neste caso 0,42. Esta figura foi reimpressa com permissão da referência7. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: diagrama do sistema de canalização e instrumentação. A imagem latente específica da ventilação exige o oxigênio médico de 100%, do tanque de gás comprimido (como desenhado) ou de uma tomada de parede. A fonte de oxigênio é conectada a uma válvula de comutação (sala de controle), que por sua vez é conectada, através da passagem de MRI, ao sistema de bypass de fluxo impresso em 3D24, anexado a um facemask (sala de scanner). O lado esquerdo do desenho corresponde à sala de controle de ressonância magnética, o lado direito da sala do scanner. A tubulação plástica que conecta o tanque ao interruptor é 1/4 polegadas no diâmetro. A tubulação da tomada da válvula do interruptor ao sistema do desvio do fluxo é igualmente 1/4 dentro. Os últimos 2m incluem um passo acima no diâmetro, de 1/4 de polegada a 3/8 polegadas, e então a 1/2 polegadas, a fim diminuir o ruído produzido pelo fluxo do ar24. Um oxímetro de pulso é usado para monitorar os níveis de frequência cardíaca (FC) e saturação de oxigênio (SAT) do sujeito. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: imagem de ventilação específica. (A) mapa típico da ventilação específica (cor), sobreposta a uma imagem anatômica de MRI do mesmo assunto supino (escala cinzenta). A ventilação específica varia de valores muito baixos (azul) a SV = 1,0 (vermelho). O sujeito, voluntário saudável de 39 anos (mesmo sujeito como na Figura 1) foi imaged na postura supina. Anote o gradiente vertical em ventilação específica. Um fantasma da característica conhecida do Sr. usado para a calibração da densidade absoluta foi coloc na parede torácica anterior. Os Phantoms não são exigidos para a quantificação de SVI. (B) histograma da distribuição de ventilação específica (círculos preenchidos) compilados a partir do mapa de ventilação específico. A largura da distribuição representa a heterogeneidade da ventilação específica na fatia pulmonar estudada. Neste exemplo, a distribuição é unimodal e a largura da distribuição ajustada Gaussian do registro (linha pontilhada) era 0,41; Isso é comparável à distribuição de ventilação específica de pulmão de MBW, apresentada na Figura 1b, para o mesmo sujeito e postura, onde a largura da distribuição) foi de 0,42. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: mapas de broncoconstrição e broncodilatação em um asmático leve. Ventilação específica medida em um assunto asmático leve (fêmea, idade 24) na linha de base (a), apósainalação de 1 mg/ml de metacolina (B) e após a inalação de Albuterol (C). Observe as mudanças significativas na distribuição da ventilação específica após a indução de um evento semelhante à asma usando metacolina (painel B), com grandes regiões do pulmão dependente mostrando ventilação específica muito baixa. Observe também a recuperação após a administração do broncodilatador (painel C). Como na Figura 3, os mapas de ventilação específicos foram sobrepostos em uma ressonância magnética anatômica. A largura da distribuição de ventilação específica foi de 0,31 no início do estudo, 0,94 pós-metacolina e 0,28 pós-Albuterol. Por favor clique aqui para ver uma versão maior desta figura.
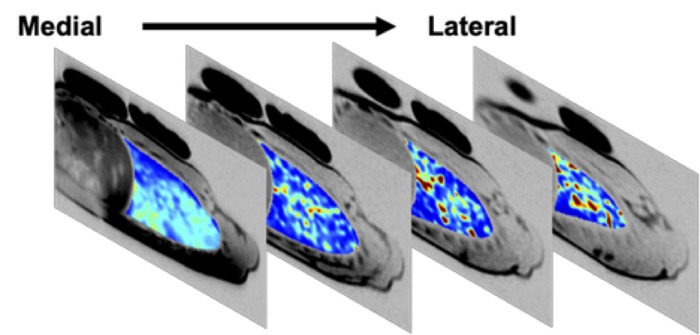
Figura 5: mapa de ventilação específico de várias fatias em uma retirada de medicação asmática moderada após 24 h. Mapa específico da ventilação de 4 fatias contíguas do pulmão no pulmão direito, adquirida em um asmático moderado masculino dos anos de idade 25 após a retirada de 24 h de medicamentações diárias da asma. As 4 fatias mostradas cobrem ~ 70% do pulmão direito do sujeito. As regiões de baixa ventilação específica (azul escuro) estão presentes em todas as fatias. No início do estudo, o FEV1 foi 84% previsto. Após 24 h de retirada de medicamentos diários, o FEV1 do sujeito foi de 69% do previsto; pós-imagem, o sujeito utilizou seu inalador de resgate e o FEV1 recuperou para 83% do previsto. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: exemplo de mapa de ventilação mostrando ventilação (ml/min/ml) adquirido em um indivíduo saudável de 27 anos de idade. Os mapas de ventilação foram gerados conforme descrito na seção 6, utilizando um mapa SV juntamente com um mapa de densidade de prótons pulmonares na mesma fatia. Neste exemplo, ambos os mapas SV e densidade foram suavizados usando um log de kernel Gaussian com uma largura total ao meio máximo de 5 voxels, resultando em uma escala espacial de ~ 0,64 cm2 no plano. Por favor clique aqui para ver uma versão maior desta figura.
| Parâmetros de ressonância magnética | Svi | Notas |
| Tempo de eco (TE) | 21,6 ms (fatia única) | |
| 18,2 ms (fatia multi) | ||
| Tempo de repetição (TR) | 5 s | Qualquer valor > 4 s |
| Ajuste para o conforto do paciente | ||
| Tempo de inversão (TI) | 1,100 s (fatia única) | Para a multi fatia, TI da fatia n |
| 1,100, 1,335, 1,570, 1,805 s (4 fatias) | TI (n) = 1.100 s + 0.235 * (n-1) | |
| Matriz | 256 x 128 (fatia única) | |
| 128 x 128 (fatia multi) | ||
| Campo de visão | 40 centímetros | 32-44 centímetros |
| Banda | 125 kHz |
Tabela 1: lista de parâmetros típicos de RM utilizados para aquisição de imagens de ventilação específicas.
Discussão
A imagem latente específica da ventilação permite o traço quantitativo da distribuição espacial da ventilação específica no pulmão humano. Alternativas ao SVI existem, mas são limitadas de alguma maneira: o washout múltiplo da respiração fornece uma medida da heterogeneidade mas falta a informação spatial23. Os métodos alternativos da imagem latente expõem pacientes à radiação ionizante (por exemplo, SPECT, animal de estimação, CT, Scintigraphy da gama) ou não são extensamente-disponíveis (imagem latente hyperpolarizada do gás usando MRI). A imagem latente específica da ventilação fornece a informação espacial e pode ser executada usando um varredor clínico padrão e o oxigênio inalado como a fonte de contraste, e assim pode ser traduzido a quase todo o ajuste da pesquisa clínica. O fato de que o SVI não requer o uso de radiação ou de agentes de contraste o torna bem adequado para estudos de repetição ou longitudinais que avaliem quantitativamente as respostas regionais à medicação, terapia ou intervenções. Este tipo de informação quantitativa regional sobre o impacto da terapia pode ser especialmente útil no contexto da entrega de medicamentos inalados.
As desvantagens de SVI são que tem uma relação sinal-à-ruído relativamente baixa (tipicamente 4-7), ele exige ~ 18 minutos a adquirir e que é um tanto trabalhoso para o assunto e o analista dos dados. O treinamento do sujeito é essencial para a aquisição de dados de ventilação específicos confiáveis. O assunto é treinado tipicamente, usando uma trilha sonora gravada dos ruídos do varredor, antes da sessão da imagem latente, de modo que ou possa alcangar um volume reprodutível (FRC) para cada uma das 220 imagens da preensão da respiração. Idealmente, isto é conseguido ao respirar em um volume maré normal, confortável sem hyperventilating. As retenções de respiração imprecisas devem ser contabilizadas no pós-processamento pelo analista de dados, que deve usar o software de registro de imagem para ter em conta as diferenças no volume pulmonar (seção 5,3 acima).
Desde a publicação original da técnica1, o SVI sofreu uma modificação para agilizar sua implementação. Um sistema de derivação de fluxo compatível com o Sr. 3D, impresso24 , permitiu uma comutação instantânea entre a entrega do ar e o oxigénio do quarto ao assunto. Este sistema diminui significativamente a complexidade da configuração original, que se assemelhava à configuração de entrega de gás descrita anteriormente em um papel de JoVE relacionado à imagem latente de perfusão22. Isso, juntamente com o desenvolvimento contínuo de técnicas de aquisição de respiração livre, tornará a técnica mais próxima da aplicabilidade da pesquisa clínica.
Como apresentado aqui, o SVI tem 2 limitações principais: 1) as quatro fatias (tipicamente) do pulmão direito que são adquiridos representam somente ~ 70% do pulmão direito-em sua aplicação atual, não mais de seis fatias podem ser adquiridas em 1.5 T devido ao depósito do RF que conduz ao tecido que ating o aquecimento tecidual aumenta em pontos fortes de campo, limitando ainda mais a aquisição de várias fatias na 3T; e 2) o SVI toma ~ 18 minutos para adquirir, e assim o mapa da ventilação específica reflete a ventilação específica tempo-média de cada voxel sobre este intervalo.
Entretanto, a cobertura completa do pulmão pode ser alcançada repetindo o procedimento ou degradando a definição espacial, e o tempo da varredura pode ser reduzido à custa da exatidão na quantificação específica da ventilação. A técnica é, em geral, os compromissos de aquisição versáteis e diferentes são possíveis, cada um ideal para diferentes aplicações. Por exemplo, em um estudo de recuperação dinâmica de um evento de asma25, os dados do SVI foram analisados em uma resolução temporal maior (~ 7 min vs. ~ 18 min) e a mesma resolução espacial, ao custo de um aumento de ~ 30% na incerteza da ventilação específica (estimativa de simulações de Monte Carlo). Um estudo de modelagem recente26 procurou quantificar o impacto de diversas limitações menores da técnica de SVI, a saber 1) que o volume imaged não abrange o pulmão direito inteiro, 2) que os desalinhamentos pequenos entre imagens sucessivas podem existir mesmo depois registro, e 3) que as veias pulmonares, transportando sangue de outras partes do pulmão para uma região imaged, podem acrescentar um sinal de confusão que reflita a ventilação na região onde esse sangue foi originalmente oxigenado e não na região em que está sendo Fotografada. O estudo26 constatou que 1) em indivíduos saudáveis, uma imagem de fatia única (que abrange apenas 8% do pulmão total) estima o gradiente vertical de ventilação específica dentro de 10% do seu verdadeiro valor, 2) análise de SVI realizada em dados modelados propositadamente desalinhado, em média, em 9% (um cenário de pior caso, agravada por não descartar imagens com desalinhamentos > 10%) resultou em uma subestimação de ~ 20% da ventilação específica média, uma subestimação provavelmente impulsionada pelo fato de que a mistura de unidades equilibrantes rápidas e lentas provavelmente irá resultar em um viés para os mais lentos, baixos de ventilação específica, e 3) venoso pulmonar o sinal conduz à superestimativa sistemática da ventilação específica por menos de 10%.
A capacidade de produzir imagens funcionais do pulmão humano-ao contrário de inferir a função das alterações anatômicas-tem o potencial de contribuir para o diagnóstico precoce e aumentar a compreensão do pulmão em saúde e doença. Em particular, a capacidade de produzir mapas regionais repetíveis e quantitativos de ventilação permite estudos longitudinais de progressão da doença e permite a quantificação do efeito de intervenções, tais como medicamentos inalatórios de asma. Combinando a imagem latente específica da ventilação com as duas técnicas de MRI para medir a densidade do pulmão21 e a perfusão pulmonaa (apresentada previamente nesta revista22), os mapas da relação da ventilação-perfusão na saúde e na doença podem ser gerados 2. como a incompatibilidade entre ventilação e perfusão é uma das principais causas de hipóxia e hipercapnia, a informação regional sobre a relação de perfusão ventilatória em saúde e doença pode fornecer mais informações sobre o impacto da doença pulmonar.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional do coração, pulmão e sangue (NHLBI) (concede R01 HL-080203, R01 HL-081171, R01 HL-104118 e R01-HL119263) e o Instituto Nacional de pesquisa biomédica do espaço (National Aeronautics and Space Administration concede NCC 9-58). E.T. Geier foi apoiado pelo NHLBI Grant F30 HL127980.
Materiais
| Name | Company | Catalog Number | Comments |
| 3D-printed flow bypass system | |||
| Face mask | Hans Rudolph | 7400 series Oro-nasal mask, different sizes | |
| Gas/oxygen regulator | |||
| Mask head set | Hans Rudolph | 7400 compatible head set | |
| Matlab | Mathworks | analysis software developed locally | |
| Medical oxygen | Air Liquide/Linde | Oxygen to be delivered to the subject | |
| MRI | GE healthcare | 1.5 T GE HDx Excite twin-speed scanner | |
| Plastic tubing | ¼”, 3/8” and 1/2” tubing and connectors | ||
| Pulse oximeter | Nonin | 7500 FO (MR compatible) | |
| Switch valve | |||
| Torso coil | GE healthcare | High gain torso coil for GE scanner |
Referências
- Sá, R. C., et al. Vertical distribution of specific ventilation in normal supine humans measured by oxygen-enhanced proton MRI. Journal of Applied Physiology. 109 (6), 1950-1959 (2010).
- Henderson, A. C., et al. The gravitational distribution of ventilation-perfusion ratio is more uniform in prone than supine posture in the normal human lung. Journal of Applied Physiology. 115 (3), 313-324 (2013).
- Geier, E. T., Neuhart, I., Theilmann, R. J., Prisk, G. K., Sá, R. C. Spatial persistence of reduced specific ventilation following methacholine challenge in the healthy human lung. Journal of Applied Physiology. 124 (5), 1222-1232 (2018).
- Tedjasaputra, V., et al. The heterogeneity of regional specific ventilation is unchanged following heavy exercise in athletes. Journal of Applied Physiology. 115 (1), 126-135 (2013).
- Fowler, W. S. Lung Function Studies. III. Uneven Pulmonary Ventilation in Normal Subjects and in Patients with Pulmonary Disease. Journal of Applied Physiology. 2 (6), 283-299 (1949).
- Robertson, J. S., Siri, W. E., Jones, H. B. Lung ventilation patterns determined by analysis of nitrogen elimination rates; use of mass spectrometer as a continuous gas analyzer. Journal of Clinical Investigation. 29 (5), 577-590 (1950).
- Sá, R. C., Asadi, A. K., Theilmann, R. J., Hopkins, S. R., Prisk, G. K., Darquenne, C. Validating the distribution of specific ventilation in healthy humans measured using proton MR imaging. Journal of Applied Physiology. 116 (8), 1048-1056 (2014).
- Musch, G., et al. Topographical distribution of pulmonary perfusion and ventilation, assessed by PET in supine and prone humans. Journal of Applied Physiology. 93 (5), 1841-1851 (2002).
- Venegas, J. G., Schroeder, T., Harris, R. S., Winkler, R. T., Melo, M. F. V. The distribution of ventilation during bronchoconstriction is patchy and bimodal: a PET imaging study. Respiratory Physiology & Neurobiology. 148 (1-2), 57-64 (2005).
- Orphanidou, D., Hughes, J. M., Myers, M. J., Al-Suhali, A. R., Henderson, B. Tomography of regional ventilation and perfusion using krypton 81m in normal subjects and asthmatic patients. Thorax. 41 (7), 542-551 (1986).
- King, G. G., Eberl, S., Salome, C. M., Meikle, S. R., Woolcock, A. J. Airway closure measured by a technegas bolus and SPECT. American Journal of Respiratory and Critical Care Medicine. 155 (2), 682-688 (1997).
- Horn, F. C., Deppe, M. H., Marshall, H., Parra-Robles, J., Wild, J. M. Quantification of regional fractional ventilation in human subjects by measurement of hyperpolarized 3He washout with 2D and 3D MRI. Journal of Applied Physiology. 116 (2), 129-139 (2014).
- Hamedani, H., et al. A hybrid multibreath wash-in wash-out lung function quantification scheme in human subjects using hyperpolarized 3 He MRI for simultaneous assessment of specific ventilation, alveolar oxygen tension, oxygen uptake, and air trapping. Magnetic Resonance in Medicine. 78 (2), 611-624 (2017).
- Hall, E. T., et al. The effect of supine exercise on the distribution of regional pulmonary blood flow measured using proton MRI. Journal of Applied Physiology. 116 (4), 451-461 (2014).
- Henderson, A. C., Sá, R. C., Barash, I. A., Holverda, S., Buxton, R. B., Prisk, G. K. Rapid intravenous infusion of 20mL/kg saline alters the distribution of perfusion in healthy supine humans. Respiratory Physiology & Neurobiology. 180 (2-3), 331-341 (2012).
- Arai, T. J., et al. Comparison of quantitative multiple-breath specific ventilation imaging using colocalized 2D oxygen-enhanced MRI and hyperpolarized 3He MRI. Journal of Applied Physiology. 125 (5), 1526-1535 (2018).
- Chen, Q., Jakob, P. M., Griswold, M. A., Levin, D. L., Hatabu, H., Edelman, R. R. Oxygen enhanced MR ventilation imaging of the lung. Magma: Magnetic Resonance Materials in Physics, Biology, and Medicine. 7 (3), 153-161 (1998).
- Arai, T. J., Asadi, A. K., Sá, R. C. Deforminator: Projective transformation to register small scale Lung deformation. , Available from: https://github.com/UCSDPulmonaryImaging/Deforminator (2019).
- Yang, G., Stewart, C. V., Sofka, M., Tsai, C. -L. Registration of Challenging Image Pairs: Initialization, Estimation, and Decision. IEEE Transactions on Pattern Analysis and Machine Intelligence. 29 (11), 1973-1989 (2007).
- Arai, T. J., Villongco, C. T., Villongco, M. T., Hopkins, S. R., Theilmann, R. J. Affine transformation registers small scale lung deformation. Conf Proc IEEE Eng Med Biol Soc. 2012, 5298-5301 (2012).
- Theilmann, R. J., et al. Quantitative MRI measurement of lung density must account for the change in T(2) (*) with lung inflation. Journal of Magnetic Resonance Imaging. 30 (2), 527-534 (2009).
- Arai, T. J., et al. Magnetic Resonance Imaging Quantification of Pulmonary Perfusion using Calibrated Arterial Spin Labeling. Journal of Visualized Experiments. 51 (51), e2712(2011).
- Lewis, S. M., Evans, J. W., Jalowayski, A. A. Continuous Distributions of Specific Ventilation Recovered From Inert-Gas Washout. Journal of Applied Physiology. 44 (3), 416-423 (1978).
- Cook, F. R., Geier, E. T., Asadi, A. K., Sá, R. C., Prisk, G. K. Rapid Prototyping of Inspired Gas Delivery System for Pulmonary MRI Research. 3D Printing and Additive Manufacturing. 2 (4), 196-203 (2015).
- Zapol, W. M., et al. Pulmonary Delivery of Therapeutic and Diagnostic Gases. Journal of Aerosol Medicine and Pulmonary Drug Delivery. 31 (2), 78-87 (2018).
- Kang, W., et al. In silico modeling of oxygen-enhanced MRI of specific ventilation. Physiological Reports. 6 (7), e13659(2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados