Method Article
Mappatura quantitativa della ventilazione specifica nel polmone umano utilizzando l'imaging a risonanza magnetica protonica e l'ossigeno come agente di contrasto
In questo articolo
Riepilogo
L'imaging di ventilazione specifica è una tecnica di risonanza magnetica funzionale che consente la quantificazione della ventilazione specifica regionale nel polmone umano, utilizzando l'ossigeno inalato come agente di contrasto. Qui presentiamo un protocollo per raccogliere e analizzare specifici dati di imaging di ventilazione.
Abstract
L'imaging di ventilazione specifica (SVI) è una tecnica di risonanza magnetica funzionale in grado di quantificare la ventilazione specifica ― il rapporto tra il gas fresco che entra in una regione polmonare divisa per il volume finale espiratorio della regione ― nel polmone umano, utilizzando solo ossigeno inalato come agente di contrasto. La quantificazione regionale di ventilazione specifica ha il potenziale per aiutare a identificare le aree di funzione polmonare patologica. L'ossigeno in soluzione nel tessuto riduce il tempo di rilassamento longitudinale del tessuto (T1), e quindi un cambiamento nell'ossigenazione tissutale può essere rilevato come un cambiamento nel segnale ponderato di T1con un'immagine acquisita recupero di inversione. A seguito di un brusco cambiamento tra due concentrazioni di ossigeno ispirato, il tasso al quale il tessuto polmonare all'interno di un voxel equilibra un nuovo stato stazionario riflette la velocità con cui il gas residente viene sostituito da gas inalato. Questo tasso è determinato da ventilazione specifica. Per suscitare questo improvviso cambiamento nell'ossigenazione, i soggetti respirano alternativamente 20-respiro blocchi di aria (21% di ossigeno) e 100% di ossigeno mentre nello scanner MRI. Un cambiamento graduale nella frazione di ossigeno ispirato si ottiene attraverso l'uso di un sistema di bypass di flusso a stampa tridimensionale (3D) personalizzato con un interruttore manuale durante una breve attesa espiratoria finale. Per rilevare la variazione corrispondente in T1, è stato utilizzato un impulso di inversione globale seguito da una sequenza di Eco Spin veloce a scatto singolo per acquisire immagini bidimensionali t1ponderate in uno scanner MRI 1,5 t, utilizzando una bobina di torso a otto elementi. Sono possibili sia l'imaging a sezione singola che la multi-slice, con parametri di imaging leggermente diversi. La quantificazione della ventilazione specifica è ottenuta correlando il tempo-corso di intensità del segnale per ogni voxel polmonare con una libreria di risposte simulate allo stimolo aria/ossigeno. Le stime SVI di specifica eterogeneità di ventilazione sono state convalidate contro il lavaggio multiplo del respiro e hanno dimostrato di determinare accuratamente l'eterogeneità della distribuzione specifica della ventilazione.
Introduzione
L'obiettivo generale dell'imaging di ventilazione specifico (SVI) ― una tecnica di risonanza magnetica protonica (MRI) che utilizza l'ossigeno come agente di contrasto1 ― è quello di mappare quantitativamente la ventilazione specifica nel polmone umano. La ventilazione specifica è il rapporto tra il gas fresco consegnato in una regione polmonare in un respiro diviso per il volume espiratorio finale della stessa regione polmonare1. In combinazione con le misurazioni della densità polmonare locale, la ventilazione specifica può essere utilizzata per calcolare la ventilazione regionale2. Le misurazioni della ventilazione locale e l'eterogeneità di ventilazione che sono fornite da svi hanno il potenziale per arricchire la comprensione di come le funzioni polmonari, sia normalmente che anormalmente3,4.
L'imaging specifico per la ventilazione è un'estensione del test di fisiologia classica, il washout multiplo di respiro (MBW), una tecnica introdotta per la prima volta nel 19505,6. Entrambe le tecniche utilizzano il lavaggio/washout a gas per misurare l'eterogeneità della ventilazione specifica, ma SVI fornisce informazioni spazialmente localizzate mentre MBW fornisce solo misure globali di eterogeneità. In MBW, uno spettrometro di massa viene utilizzato per misurare la concentrazione mista scaduta di un gas insolubile (azoto, Elio, esafluoruro di zolfo, ecc.) su molti responi durante un washout di quel gas, come illustrato nella Figura 1. Insieme al volume scaduto per respiro durante il periodo di washout, queste informazioni possono essere utilizzate per calcolare la distribuzione complessiva di ventilazione specifica nel polmone. In SVI, uno scanner MRI viene utilizzato per misurare il segnale ponderato di T1― che è un surrogato per la quantità di ossigeno in soluzione nel tessuto polmonare, un indicatore diretto della concentrazione locale di ossigeno ― in ogni voxel polmonare su molti respodi durante diversi Washin/washouts di ossigeno. In un modo che è direttamente analogo a MBW, queste informazioni ci permettono di calcolare la ventilazione specifica di ogni voxel polmonare. In altre parole, la tecnica esegue migliaia di esperimenti di tipo MBW paralleli, uno per ogni voxel, durante un esperimento SVI. Infatti, le mappe spaziali di ventilazione specifica così prodotte possono essere compilate per recuperare l'eterogeneità di ventilazione specifica uscita di MBW. Uno studio di convalida7 ha mostrato che le due metodologie hanno prodotto risultati comparabili se eseguite in serie sugli stessi soggetti.
Esistono altre modalità di imaging che, come SVI, forniscono misure spaziali di eterogeneità di ventilazione. Tomografia a emissione di positroni (PET)8,9, tomografia computerizzata con emissione a singolo fotone (SPECT)10,11e MRI a gas iperpolarizzato12,13 tecniche sono state utilizzate per creare un corpus sostanziale di letteratura per quanto riguarda il modello spaziale di ventilazione in soggetti sani e anormali. In generale, queste tecniche hanno almeno un vantaggio distinto rispetto a SVI, in quanto il loro rapporto segnale-rumore è caratteristicamente superiore. Tuttavia, ogni tecnica ha anche uno svantaggio caratteristico: PET e SPECT comportano l'esposizione a radiazioni ionizzanti, e la risonanza magnetica iperpolarizzata richiede l'uso di gas iperpolarizzato altamente specializzato e uno scanner MR con hardware multi-nucleo non standard.
SVI, una tecnica Proton-MRI, utilizza tipicamente 1,5 Tesla MR hardware con ossigeno inalato come un agente di contrasto (entrambi gli elementi sono prontamente disponibili nel settore sanitario), rendendolo potenzialmente più generalizzabile all'ambiente clinico. SVI sfrutta il fatto che l'ossigeno accorcia il tempo di rilassamento longitudinale (T1) dei tessuti polmonari1, che a sua volta si traduce in un cambiamento di intensità del segnale in un'immagine ponderata T1. Pertanto, i cambiamenti nella concentrazione di ossigeno ispirato inducono cambiamento nell'intensità del segnale di immagini MRI opportunamente temporizzate. Il tasso di questa variazione a seguito di un brusco cambiamento nella concentrazione di ossigeno ispirato, tipicamente aria e 100% di ossigeno, riflette la velocità con cui il gas residente viene sostituito dal gas inalato. Questo tasso di sostituzione è determinato da ventilazione specifica.
Poiché SVI non comporta radiazioni ionizzanti, non ha controindicazioni per gli studi longitudinali e interventistici che seguono i pazienti nel corso del tempo. Pertanto, è ideale per studiare la progressione della malattia o valutare come i singoli pazienti rispondono al trattamento. Grazie alla sua relativa facilità e ripetibilità di sicurezza, l'imaging di ventilazione specifica è, in generale, una tecnica ideale per coloro che desiderano studiare grandi effetti e/o un gran numero di persone nel tempo o in diversi luoghi clinici diversi.
A seguito della pubblicazione originale che descrive la tecnica1, l'imaging specifico per ventilazione (SVI) è stato utilizzato in studi incentrati sull'effetto di infusione salina rapida, postura, esercizio e broncocostrizione2,3 , 4 , 14 anni di , 15. la capacità della tecnica di stimare l'eterogeneità polmonare intera di ventilazione specifica è stata convalidata utilizzando il test di washout multiplo ben consolidato7 e più di recente, una regionale una convalida incrociata è stata eseguita, da confrontando il SVI e l'imaging di ventilazione specifica per respiro multiplo a gas iperpolarizzato16. Questa tecnica affidabile e prontamente distribuibile, in grado di mappare quantitativamente la ventilazione specifica nel polmone umano, ha il potenziale per contribuire significativamente alla diagnosi precoce e alla diagnostica delle malattie respiratorie. Presenta inoltre nuove opportunità per quantificare le anomalie polmonari regionali e seguire i cambiamenti indotti dalla terapia. Questi cambiamenti nella funzione polmonare specifica della regione, che il SVI ci permette di misurare per la prima volta, hanno il potenziale per diventare biomarcatori per valutare l'impatto dei farmaci e delle terapie inalate, e potrebbe essere uno strumento estremamente utile negli studi clinici.
Lo scopo di questo articolo è quello di presentare la metodologia di imaging specifico di ventilazione in dettaglio e in forma visiva, contribuendo così alla diffusione della tecnica a più centri.
Protocollo
L'Università della California, il programma di protezione della ricerca umana di San Diego ha approvato questo protocollo.
1. sicurezza e formazione dei soggetti
- Ottenere il consenso scritto e informato dal soggetto. Descrivere i potenziali rischi presentati dall'esposizione a campi magnetici in rapida evoluzione, e il potenziale disagio di utilizzare la maschera facciale e respirare il gas secco.
- Assicurarsi che il soggetto possa sottoporsi in sicurezza alla scansione MR, utilizzando il questionario di screening di sicurezza MRI approvato localmente.
- Se il soggetto è una femmina in età fertile, e incerto del suo stato di gravidanza, Chiedili di autoamministrare un test di gravidanza non quotato in porta. Se il soggetto è in stato di gravidanza, escludere il soggetto dal resto dello studio.
- Misurare il peso del soggetto. I parametri di sicurezza dello scanner che limitano la quantità di energia di radiofrequenza (RF) erogata al soggetto richiedono l'immissione di questa caratteristica. Verificare che il peso del soggetto sia inferiore al limite massimo di peso della tabella MRI (in questo caso, 136 kg).
- Addestrare il soggetto a respirare nel tempo con la sequenza di scansione MR. Preferibilmente, riprodurre una registrazione audio di una scansione precedente e istruire il soggetto a respirare normalmente e completare un respiro ogni 5 s, utilizzando i segnali audio dallo scanner come guida; respirare insieme al soggetto ai fini della formazione.
- Determinare le dimensioni della maschera del viso (dimensioni variano da Petite a extra-large [XL]) che meglio si adatta al soggetto misurando le dimensioni naso-mento del soggetto. Una maschera opportunamente dimensionata si adatta comodamente ma impedirà all'aria di fuoriuscire tra la maschera e la pelle del soggetto in qualsiasi punto. Se necessario, provare altre misure.
- Verificare che le tasche e gli indumenti del soggetto siano privi di carte di credito a base magnetica e di pezzi metallici contenenti ferro. Se necessario, il soggetto cambia nell'abito medico fornito dalla struttura MRI.
Nota: Il metallo può essere pericoloso nell'ambiente MRI, e oggetti metallici come clip (tipicamente in reggiseni), anelli metallici (reggiseni e Felpe), bottoni metallici o cerniere (camicie, maglioni), estensione dei capelli e parrucche hanno il potenziale per creare artefatti di imaging.
2. preparazione dell'ambiente MRI
- Consentire al personale addestrato in sicurezza MRI agli standard della struttura di imaging di entrare nella stanza dello scanner o assistere nell'esecuzione di questo esperimento.
- Configurare lo scanner MR per l'uso con una bobina del torso collegando la bobina al connettore appropriato nella tabella dello scanner.
- Preparare il tavolo dello scanner con fogli, pastiglie e cuscini in modo che il soggetto sarà comodo per almeno 30 minuti durante l'imaging.
-
Assemblare il sistema di erogazione dell'ossigeno.
Nota: un diagramma schematico del tubo è presentato in Figura 2.- Posizionare una valvola di commutazione a due/tre vie alla portata dell'operatore dello scanner o della persona che esegue l'esperimento SVI.
- Collegare il serbatoio di ossigeno medicale (al di fuori della stanza dello scanner) o l'alimentazione a parete di ossigeno (se disponibile) ad una presa della valvola di commutazione utilizzando tubi di plastica da 1/4 di pollice.
- Collegare l'uscita della valvola di commutazione situata nella sala di controllo a 8 m (lunghezza sufficiente per lo scanner) tubi di plastica da 1/4 di pollice. Alimentare il tubo attraverso il pass-through, dalla sala di controllo alla stanza dello scanner, e assicurarsi che raggiunga il centro del foro dello scanner.
Nota: Il tubo di plastica che collega l'uscita della valvola di commutazione alla maschera di bypass di flusso includeva un gradino in diametro negli ultimi 2 m, da 1/4 pollici a 3/8 pollici a 1/2 pollici, al fine di diminuire il rumore prodotto dall'aria che scorre nel sistema di bypass di flusso. - Collegare l'estremità di 1/2 pollici del tubo all'attacco della maschera di bypass di flusso.
- Fissare l'attacco di bypass di flusso alla maschera facciale che si adatta al soggetto.
- Impostare la pressione sul regolatore del serbatoio del gas o della presa a muro su un valore che produca un flusso di ossigeno maggiore del flusso inspiratorio di picco atteso. La pressione necessaria dipende dalla natura dello studio (riposo, esercizio fisico, ecc.) e dalla resistenza complessiva del sistema di erogazione del gas (tipicamente ~ 70 PSI per il sistema di consegna descritto al punto 2.4.3 per gli studi a riposo).
- Testare la valvola di commutazione attivando il flusso di ossigeno, assicurandosi che sia presente un flusso adeguato all'uscita dell'attacco di bypass di flusso e che non siano presenti perdite nel tubo di plastica.
3. instrumentare e preparare l'oggetto per l'imaging
- Il soggetto si trova sul tavolo MRI. Assicurarsi che la parte superiore dell'elemento della bobina inferiore fornisca una copertura adeguata degli apici polmonari, assicurandosi che la parte superiore dell'elemento della bobina inferiore sia superiore alle spalle del soggetto.
- Avere il soggetto inserire tappi per le orecchie e verificare che il suono è in fase di blocco.
- Nastro la palla stretta (o un meccanismo di sicurezza alternativo) al polso del soggetto in modo che possa essere facilmente accessibile.
- Attaccare la maschera e il sistema di bypass di flusso al volto del soggetto. Occludere brevemente il lato espiratorio dell'attacco di bypass di flusso e chiedere al soggetto di tentare una normale ispirazione e scadenza per controllare le perdite.
- Collocare il soggetto nello scanner, utilizzando lo strumento di centraggio della luce per assicurarsi che la bobina del busto occupa il centro del foro.
- Collegare la linea di bypass di flusso all'attacco della maschera di bypass di flusso stampato in 3D utilizzando il dado in ottone aderente all'ingresso.
4. Imaging MRI
-
Selezionare la posizione anatomica per le sezioni di imaging.
- Acquisisci una sequenza di localizzatori per ottenere una mappa anatomica che verrà utilizzata per prescrivere il resto dell'esame.
- Selezionare fino a 4 fette polmonari sagittali da studiare facendo clic e trascinando la sezione di imaging nella posizione desiderata utilizzando l'interfaccia utente grafica dello scanner. Tipicamente, il campo visivo è impostato su 40 x 40 cm e lo spessore della fetta a 1,5 cm. Selezionare le sezioni centrate nel campo polmonare che mirano alla regione di interesse per lo studio, in genere minimizzando l'intrusione di grandi vasi polmonari medialmente e la parete toracica lateralmente per massimizzare il volume polmonare campionato.
Nota: La selezione delle porzioni può essere eseguita in qualsiasi piano; è possibile selezionare fino a 4 fette. Ai fini della dimostrazione, verrà acquisita una fetta. - Prendere nota della posizione delle fette di imaging rispetto alla posizione della colonna vertebrale in modo che lo stesso volume possa essere ricreato per gli studi longitudinali.
-
Imaging di ventilazione specifico
Nota: nella tabella 1è presentato un elenco dei parametri tipici della risonanza magnetica.- Impostare il tempo di inversione nel computer MR per la fetta più mediale a 1.100 ms per massimizzare il contrasto aria-ossigeno17.
- Impostare i parametri di acquisizione (tabella 1) per l'acquisizione di immagini. Per l'acquisizione di più sezioni, ogni fetta aggiuntiva viene acquisita dopo la prima, ad intervalli di 235 MS (1.335 MS, 1.570 MS, 1.805 MS).
Nota: Dopo l'inversione di impulso di recupero e un intervallo di tempo (descritto dal tempo di inversione), ogni fetta immagine viene acquisita utilizzando un Half-Fourier turbo spin-echo (HASTE), a 128 x 128 risoluzione (70-linee di k-spazio campionato); le immagini vengono ricostruite a 256 x 256 risoluzione. - Impostare il numero di ripetizioni su 220 e il tempo di ripetizione (TR) a 5 s. Ciò comporterà la ripetizione di 4.2.1 e 4.2.2 per un totale di 220 respon consecutivi, 5 s di distanza. Chiedere al soggetto di cancello volontariamente il suo respiro nel tempo con l'acquisizione di immagini.
Nota: Le immagini vengono acquisite al termine di una normale scadenza in una breve interruzione volontaria della respirazione a capacità residua funzionale (FRC). È importante che un volume polmonare simile venga raggiunto coerentemente durante ognuna di queste acquisizioni consecutive. - Monitorare la consistenza del volume polmonare del soggetto (scadenza finale) durante le successive acquisizioni e fornire feedback per migliorare la qualità, se necessario. Aumentare TR (l'intervallo di tempo tra le acquisizioni successive) se il soggetto trova difficile raggiungere un volume polmonare costante ogni 5 s.
- Cambia la miscela di gas ispirata del soggetto ogni 20 respiri (durante l'acquisizione del respiro per il comfort del soggetto), alternando aria ambiente e ossigeno medicale. Prendere nota di quando gli interruttori si sono verificati, e gli intervalli durante i quali il soggetto respirava ogni gas. Permettere al soggetto di respirare 100% di ossigeno per 40 respiri consecutivi a un certo punto dell'esperimento (tipicamente respira 20-60 o 180-220) per aumentare la sensibilità alle regioni polmonari a bassa ventilazione.
- Verificare regolarmente la frequenza cardiaca (40 − 80 per i soggetti normali a riposo) e la saturazione di ossigeno (tipicamente 98 − 100%) guardando il pulsossimetro (Figura 2); deviazioni dalla norma possono segnalare angoscia o ansia.
- Parlate frequentemente con il soggetto premendo il pulsante di invio della tastiera dello scanner, fornendo aggiornamenti periodici del tempo rimanente.
- Dopo il respiro 220, l'imaging è completo. Riportare l'oggetto all'aria dell'ambiente e rimuoverlo dallo scanner.
5. creazione di una mappa di ventilazione specifica da una serie temporale di immagini
- Verificare che sia stata acquisita una pila di 220 immagini RM consecutive per ogni porzione polmonare.
- Importare le immagini per la registrazione nel software di analisi delle immagini (ad esempio, MATLAB).
- Delle immagini 220, scegliere, mediante ispezione visiva dell'intera pila di immagini, per ogni slice uno che meglio rappresenta la capacità residua funzionale. La capacità residua funzionale è identificata come la "modalità" dei volumi polmonari nello stack.
- Utilizzando l'immagine "Mode" come riferimento, utilizzare la registrazione proiettiva o affine per registrare tutte le immagini al riferimento di capacità residua funzionale.
Nota: La registrazione viene in genere eseguita utilizzando un algoritmo sviluppato in House18 o un algoritmo di punto più vicino iterativo di bootstrap (gdb-ICP19) pubblicamente disponibile. - Utilizzare l'output dell'algoritmo di registrazione per calcolare la modifica dell'area di ogni immagine. Eliminare le immagini il cui passaggio di registrazione richiesto > il 10% dell'area di variazione dalla pila di immagini e trattarli come dati mancanti20.
- Quantificare la ventilazione specifica nel polmone dalla pila registrata utilizzando un algoritmo sviluppato in House1,7. Eseguire la quantificazione confrontando la risposta temporale di ogni voxel alla serie di Washin e washout dell'ossigeno consecutiva, a una libreria di 50 simulazioni simulate, prive di rumore, corrispondenti a ventilazioni specifiche che vanno da 0,01 a 10, con incrementi del 15%. Ad ogni voxel viene assegnato un valore di ventilazione specifica corrispondente alla ventilazione specifica dell'ideale simulato che presenta la massima correlazione con le serie temporali di ogni voxel, come originariamente presentato in1.
- L'output del passaggio precedente è una mappa di ventilazione specifica. Creare un istogramma della distribuzione e calcolare la larghezza della distribuzione di ventilazione specifica, una misura della specifica eterogeneità di ventilazione, indipendente dal volume di marea.
6. combinando specifiche mappe di ventilazione e densità per calcolare la ventilazione alveolare regionale
- Oltre a SVI, acquisire immagini di densità protonica polmonare21, come descritto in uno studio precedente22 (sezioni 4,4 e 5,1 in riferimento22). Ottenere le immagini di densità protonica nella stessa fetta polmonare (s), allo stesso volume polmonare (FRC, fine di una scadenza normale); impostare la risoluzione su 64 x 64, corrispondente a una dimensione di voxel di ~ 6,3 mm x 6,3 mm x 15 mm (~ 0,6 cm3).
-
Allinea specifiche immagini di ventilazione e densità protonica.
- Liscia sia le immagini specifiche di ventilazione e di densità protonica utilizzando un filtro gaussiano con una dimensione del kernel di ~ 1 cm3.
- Eseguire la registrazione rigida (traslazione e rotazione) tra la mappa di ventilazione specifica e la mappa di densità utilizzando un algoritmo basato su informazioni reciproche.
-
Calcola la ventilazione alveolare da dati di ventilazione specifici co-registrati e densità protonica.
- Calcolare una mappa di (1-densità), che è la frazione di aria nel volume campionato alla fine di una normale scadenza, supponendo che il polmone è composto di aria e tessuto e che la densità del tessuto è ~ 1 g/cm3.
- Calcola una mappa di ventilazione regionale come prodotto (1-densità) x SV (unità naturali). Moltiplicare questo prodotto per il volume di un voxel (o di un'altra regione di interesse) e la frequenza respiratoria (imposta, tipicamente 12 respiri/min), per ottenere una mappa di ventilazione nelle unità più familiari di ml/min.
Nota: Per ogni regione polmonare, SV = ΔV/V0 e (1 – densità) ≈ v0. Così, il prodotto (1-densità) x SV = ventilazione regionale, espressa in unità naturali.
Risultati
SVI a fetta singola in un soggetto sano
L'imaging di ventilazione specifica produce mappe quantitative di ventilazione specifica, come mostrato nella Figura 3A, che raffigura una singola fetta nel polmone destro di una femmina sana di 39 anni. Si noti la presenza del gradiente verticale previsto in ventilazione specifica; la porzione dipendente del polmone presenta una ventilazione specifica più elevata rispetto alla porzione non dipendente del polmone. Viene presentato un istogramma dei valori di ventilazione specifici mappati (Figura 3B, cerchi riempiti) insieme a una funzione di distribuzione della probabilità di log-Normal di migliore adattamento (linea tratteggiata). La larghezza della distribuzione più adatta può essere utilizzata come metrica di specifica eterogeneità di ventilazione7, 23. La Figura 1 Mostra un lavaggio a respiro multiplo acquisito nello stesso soggetto, nella stessa postura. La Figura 1a Mostra la registrazione temporale della concentrazione di azoto misurata alla bocca dopo un passaggio dall'aria ispirata all'inspirazione 100% di ossigeno. La Figura 1B presenta la distribuzione di ventilazione specifica, come stimato dal washout. Per SVI e MBW, la variabile pertinente è la larghezza della distribuzione, come misurato qui per la larghezza di una distribuzione normale log montato ai dati (linea punteggiata), è stato trovato per essere 0,41, utilizzando SVI e 0,42 utilizzando MBW all'interno dell'intervallo normale sano. La convalida dell'eterogeneità di ventilazione specifica stimata in base a SVI rispetto alla MBW è stata eseguita in 10 soggetti e la differenza tra le tecniche è risultata inferiore alla variabilità inter-test di MBW7. Un confronto spaziale con un'immagine di ventilazione specifica per respiro multiplo a gas iperpolarizzato16 ha anche mostrato stime affidabili di gruppo di specifica eterogeneità di ventilazione (la larghezza della distribuzione specifica di ventilazione negli 8 soggetti studiati sono stati 0,28 ± 0,08 e 0,27 ± 0,10 per iperpolarizzato 3he e specifico imaging di ventilazione, rispettivamente), nonostante la variabilità intra-soggetto superiore al previsto (la deviazione standard delle differenze individuali in larghezza era 0,13)16.
Specifiche mappe di ventilazione possono essere utilizzate anche in combinazione con mappe di densità polmonare per calcolare la ventilazione alveolare regionale. Per generare mappe di ventilazione alveolare, specifiche immagini di ventilazione e densità devono essere smussate spazialmente per minimizzare i potenziali disallineamenti minori tra le due modalità.
Risposta alla sfida di metacolina in un soggetto asmatico
SVI può essere utilizzato per misurare le risposte sia a livello polmonare che regionale ad interventi come l'esercizio4, la postura2o il farmaco3. Ad esempio, la Figura 4 illustra le mappe a sezione singola dal polmone di un soggetto femminile asmatico lieve al basale (Figura 4a), dopo la broncocostrizione con Metacholina (Figura 4B) e dopo il recupero assistito da albuterolo ( Figura 4C). Si noti la maggiore eterogeneità di ventilazione specifica durante l'evento di asma indotto, e la presenza di grandi macchie di poca o nessuna ventilazione specifica (regioni blu scuro nella porzione dipendente del polmone). Inoltre, si noti che la ventilazione è aumentata paradossalmente in alcune regioni durante la broncocostrizione (regioni verde-rosse).
SVI a sezione multipla
Fino a sei (tipicamente quattro), contigue, le fette polmonari da 15 mm possono essere simultaneamente imvecchie con SVI. La Figura 5 raffigura quattro fette polmonari destro contigui, che coprono ~ 70% del polmone destro, in un soggetto maschile asmatico moderato che era stato ritirato dai suoi farmaci per l'asma per 24 ore.
Mappa di ventilazione
Fornito informazioni sulla densità polmonare è stato acquisito nella stessa fetta, e la frequenza respiratoria è noto, una mappa di ventilazione completamente quantitativa può essere calcolata in unità di mL/min/mL. Un esempio di una mappa di ventilazione è mostrato in Figura 6.
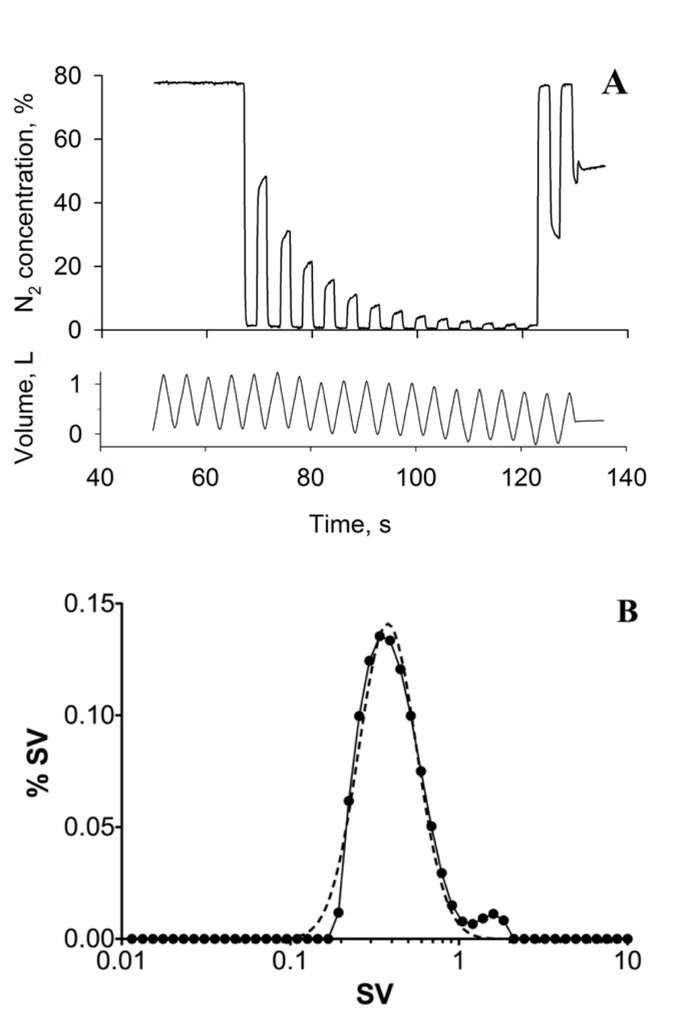
Figura 1: respiro multiplo. (A) tipica traccia MBW che mostra la concentrazione di azoto (N2) scaduta (in alto) e il volume di marea (in basso) nel tempo (secondi, s). I dati sono stati acquisiti nella postura supina; il soggetto era una donna sana di 39 anni. (B) istogramma raffigurante la distribuzione di ventilazione specifica (SV) calcolata dall'esperimento MBW utilizzando il metodo proposto da Lewis et al.23 (linea solida). La linea tratteggiata rappresenta il log (Gaussian) più adatto alla distribuzione di ventilazione specifica. L'eterogeneità di ventilazione specifica, il risultato chiave, è misurata come la larghezza della distribuzione migliore vestibilità, in questo caso 0,42. Questa cifra è stata ristampata con il permesso dal riferimento7. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 2: diagramma del sistema idraulico e della strumentazione. L'imaging di ventilazione specifica richiede 100% di ossigeno medicale, sia dal serbatoio del gas compresso (come disegnato) che da una presa a muro. La sorgente di ossigeno è collegata a una valvola di commutazione (sala di controllo), che a sua volta è collegata, attraverso il pass-through MRI, al sistema di bypass di flusso stampato in 3D24, attaccato ad una maschera (stanza dello scanner). Il lato sinistro del disegno corrisponde alla sala di controllo MRI, al lato destro della stanza dello scanner. Il tubo di plastica che collega il serbatoio all'interruttore è di 1/4 pollici di diametro. Anche il tubo dall'uscita della valvola di commutazione al sistema di bypass di flusso è 1/4 in. Gli ultimi 2m includono un gradino in diametro, da 1/4 pollici a 3/8 pollici, e poi a 1/2 pollici, al fine di diminuire il rumore prodotto dal flusso di aria24. Un pulsossimetro viene utilizzato per monitorare i livelli di frequenza cardiaca (HR) e saturazione di ossigeno (SAT) del soggetto. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 3: Imaging di ventilazione specifico. (A) mappa tipica di ventilazione specifica (colore), sovrapposta a un'immagine RM anatomica dello stesso soggetto Supino (scala di grigi). La ventilazione specifica varia da valori molto bassi (blu) a SV = 1,0 (rosso). Il soggetto, volontario sano di 39 anni (stesso soggetto come nella Figura 1) è stato immaturato nella postura supina. Notare il gradiente verticale in ventilazione specifica. Un fantasma di nota caratteristica MR utilizzato per la calibrazione della densità assoluta è stato collocato nella parete toracica anteriore. I fantasmi non sono necessari per la quantificazione SVI. (B) istogramma della distribuzione di ventilazione specifica (cerchi riempiti) compilato dalla specifica mappa di ventilazione. La larghezza della distribuzione rappresenta l'eterogeneità della ventilazione specifica nella fetta polmonare studiata. In questo esempio, la distribuzione è unimodal e la larghezza del registro Gaussian distribuzione montato (linea punteggiata) era 0,41; Questo è paragonabile alla distribuzione specifica di ventilazione del polmone intero MBW presentato nella Figura 1B, per lo stesso soggetto e la postura, dove la larghezza della distribuzione) era 0,42. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 4: mappe broncocostrizione e broncodilatazione in un lieve asmatico. Ventilazione specifica misurata in un soggetto asmatico lieve (femmina, Età 24) al basale (a), dopo inalazione di 1 mg/ml di metacholina (B) e dopo inalazione di albuterolo (C). Si noti i cambiamenti significativi nella distribuzione di ventilazione specifica dopo l'induzione di un evento simile ad asma utilizzando la metacholina (pannello B), con grandi regioni del polmone dipendente mostrando ventilazione specifica molto bassa. Si noti inoltre il recupero dopo somministrazione broncodilatatore (pannello C). Come nella Figura 3, le mappe di ventilazione specifiche sono state sovrapposte in una risonanza magnetica anatomica. La larghezza della distribuzione di ventilazione specifica era 0,31 al basale, 0,94 post methacholine, e 0,28 post Albuterol. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
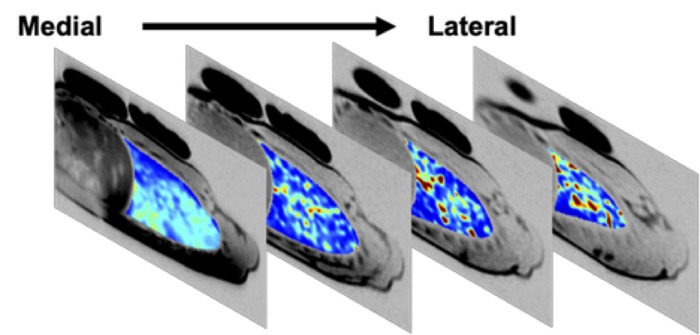
Figura 5: mappa di ventilazione specifica multi slice in un moderato asmatico dopo il ritiro del farmaco 24-h. Mappa di ventilazione specifica di 4 fette polmonari contigue nel polmone destro, acquisita in un maschio di 25 anni moderato asmatico dopo 24 h di ritiro dei farmaci di asma giornalieri. Le 4 fette mostrate coprono ~ 70% del polmone destro del soggetto. Regioni di bassa ventilazione specifica (blu scuro) sono presenti in tutte le fette. Al basale, FEV1 era 84% previsto. Dopo 24 h ritiro dei farmaci quotidiani, FEV1 di questo soggetto era 69% del previsto; Post-Imaging, il soggetto ha utilizzato il suo inalatore di salvataggio e il FEV1 recuperato al 83% del previsto. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 6: esempio di mappa di ventilazione che mostra la ventilazione (ml/min/ml) acquisita in un sano soggetto di 27 anni di età maschile. Le mappe di ventilazione sono state generate come descritto nella sezione 6, utilizzando una mappa SV insieme a una mappa della densità dei protoni polmonari nella stessa fetta. In questo esempio, sia la SV e mappe di densità sono state levigate utilizzando un kernel Gaussian log con una larghezza completa a metà massimo di 5 voxels, risultante in una scala spaziale di ~ 0,64 cm2 in piano. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
| Parametri MRI | SVI | Note |
| Tempo di eco (TE) | 21,6 ms (fetta singola) | |
| 18,2 ms (multi slice) | ||
| Tempo di ripetizione (TR) | 5 s di | Qualsiasi valore > 4 s |
| Regolare per il comfort del paziente | ||
| Tempo di inversione (TI) | 1,100 s (fetta singola) | Per multi slice, TI di Slice n |
| 1,100, 1,335, 1,570, 1,805 s (4 fette) | TI (n) = 1.100 s + 0.235 * (n-1) | |
| matrice f | 256 x 128 (singola fetta) | |
| 128 x 128 (multi slice) | ||
| Campo visivo | 40 cm di altezza | 32-44 cm di altezza |
| larghezza di banda | 125 kHz |
Tabella 1: elenco dei parametri MRI tipici utilizzati per l'acquisizione di specifiche immagini di ventilazione.
Discussione
L'imaging di ventilazione specifica consente la mappatura quantitativa della distribuzione spaziale di ventilazione specifica nel polmone umano. Le alternative al SVI esistono ma sono limitate in qualche modo: il lavaggio multiplo del respiro fornisce una misura di eterogeneità ma manca di informazioni spaziali23. I metodi di imaging alternativi espongono i pazienti a radiazioni ionizzanti (ad es., SPECT, PET, CT, scintigrafia gamma) o non sono ampiamente disponibili (imaging a gas iperpolarizzato con RM). L'imaging di ventilazione specifica fornisce informazioni spaziali e può essere eseguito utilizzando uno scanner clinico standard e ossigeno inalato come fonte di contrasto, e quindi può essere tradotto in quasi qualsiasi impostazione di ricerca clinica. Il fatto che SVI non richieda l'uso di radiazioni o agenti di contrasto lo rende particolarmente adatto per studi ripetuti o longitudinali che valutano quantitativamente le risposte regionali a farmaci, terapie o interventi. Questo tipo di informazioni quantitative regionali sull'impatto della terapia può essere particolarmente utile nel contesto della somministrazione di farmaci inalati.
Gli svantaggi di SVI sono che ha un rapporto segnale-rumore relativamente basso (tipicamente 4-7), richiede ~ 18 minuti per acquisire e che è un po' laborioso per il soggetto e l'analista dei dati. La formazione del soggetto è essenziale per l'acquisizione di dati di ventilazione specifici affidabili. Il soggetto è in genere addestrato, utilizzando una colonna sonora registrata dei rumori dello scanner, prima della sessione di imaging, in modo che possa raggiungere un volume riproducibile (FRC) per ognuna delle 220 immagini in attesa di respiro. Idealmente, questo si ottiene durante la respirazione ad un normale, confortevole volume di marea senza iperventilazione. Le sospensioni imprecise devono essere contabilizzate nella post-elaborazione da parte dell'analista dei dati, che deve utilizzare il software di registrazione delle immagini per tenere conto delle differenze nel volume polmonare (sezione 5,3 sopra).
Dal momento che la pubblicazione originale della tecnica1, svi ha subito una modifica per razionalizzare la sua attuazione. Un sistema di bypass di flusso compatibile con la stampa 3D MR24 abilitato commutazione quasi istantanea tra la consegna di aria ambiente e ossigeno al soggetto. Questo sistema riduce significativamente la complessità della configurazione originale, che assomigliava all'impostazione di erogazione del gas descritta in precedenza in una carta JoVE relativa all'imaging di perfusione22. Questo, insieme con lo sviluppo continuo di tecniche di acquisizione di respirazione libera, farà muovere la tecnica più vicino alla ricerca clinica applicabilità.
Come presentato qui, SVI ha 2 limitazioni principali: 1) le quattro fette (tipicamente) del polmone destro che vengono acquisiti rappresentano solo ~ 70% del polmone destro-nella sua attuazione attuale, non più di sei fette possono essere acquisite a 1,5 T a causa di deposizione RF che porta al tessuto che ating il riscaldamento dei tessuti aumenta a punti di forza più elevati, limitando ulteriormente l'acquisizione multi-fetta a 3T; e 2) SVI prende ~ 18 minuti per acquisire, e quindi la mappa di ventilazione specifica riflette ogni voxel ' s tempo-media ventilazione specifica su questo intervallo.
Tuttavia, la copertura polmonare completa può essere raggiunta ripetendo la procedura o degradando la risoluzione spaziale, e il tempo di scansione può essere ridotto a scapito della precisione in una specifica quantificazione di ventilazione. La tecnica è, in generale, versatile e diversi compromessi di acquisizione sono possibili, ciascuno ottimale per le diverse applicazioni. Ad esempio, in uno studio di recupero dinamico da un evento di asma25, dati svi sono stati analizzati a una risoluzione temporale più elevata (~ 7 min vs ~ 18 min) e la stessa risoluzione spaziale, al costo di un aumento ~ 30% dell'incertezza di ventilazione specifica (stimato simulazioni Monte Carlo). Un recente studio di modellazione26 ha cercato di quantificare l'impatto di diverse limitazioni minori della tecnica svi, vale a dire 1) che il volume immagine non comprende l'intero polmone destro, 2) che i piccoli disallineamenti tra immagini successive possono esistere anche dopo registrazione, e 3) che le vene polmonari, trasportando sangue da altrove nel polmone in una regione iminvecchiata, possono aggiungere un segnale di conFondazione che riflette la ventilazione nella regione in cui il sangue è stato originariamente ossigenato e non nella regione in cui è stato Imaged. Lo Studio26 ha trovato che 1) in soggetti sani, un'immagine a singola fetta (che comprende solo l'8% del polmone totale) stima il gradiente verticale di ventilazione specifica entro il 10% del suo vero valore, 2) analisi svi eseguita su dati modellati intenzionalmente disallineato, in media, del 9% (uno scenario peggiore, peggiorato non scartando le immagini con disallineamenti > 10%) ha provocato una sottovalutazione di ~ 20% della ventilazione media specifica, una sottovalutazione probabilmente guidata dal fatto che la miscelazione di unità equilibrare veloci e lente probabilmente si traduce in una polarizzazione verso i più lenti, bassa ventilazione specifici, e 3) venosa polmonare del segnale porta a una sovrastima sistematica della ventilazione specifica di meno del 10%.
La capacità di produrre immagini funzionali del polmone umano-al contrario di inferire la funzione dai cambiamenti anatomici-ha il potenziale per contribuire alla diagnosi precoce e aumentare la comprensione del polmone in salute e malattia. In particolare, la capacità di produrre mappe regionali ripetibili e quantitative di ventilazione consente studi longitudinali della progressione della malattia e consente la quantificazione dell'effetto degli interventi, come i farmaci per l'asma inalato. Combinando una specifica Imaging di ventilazione con due tecniche di risonanza magnetica per misurare la densità polmonare21 e la perfusione polmonare (precedentemente presentata in questa rivista22), è possibile generare mappe del rapporto di ventilazione-perfusione in salute e malattia 2. come mancata corrispondenza tra ventilazione e perfusione è una delle principali cause di ipossia e ipercapnia, informazioni regionali sul rapporto di perfusione di ventilazione in salute e malattia possono fornire ulteriori approfondimenti sull'impatto della malattia polmonare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Heart, Lung e Blood Institute (NHLBI) (sovvenzioni R01 HL-080203, R01 HL-081171, R01 HL-104118 e R01-HL119263) e dall'Istituto nazionale di ricerca biomedica (National Aeronautics and Space Administration Grant NCC 9-58). l'As Geier è stato supportato da NHLBI Grant F30 HL127980.
Materiali
| Name | Company | Catalog Number | Comments |
| 3D-printed flow bypass system | |||
| Face mask | Hans Rudolph | 7400 series Oro-nasal mask, different sizes | |
| Gas/oxygen regulator | |||
| Mask head set | Hans Rudolph | 7400 compatible head set | |
| Matlab | Mathworks | analysis software developed locally | |
| Medical oxygen | Air Liquide/Linde | Oxygen to be delivered to the subject | |
| MRI | GE healthcare | 1.5 T GE HDx Excite twin-speed scanner | |
| Plastic tubing | ¼”, 3/8” and 1/2” tubing and connectors | ||
| Pulse oximeter | Nonin | 7500 FO (MR compatible) | |
| Switch valve | |||
| Torso coil | GE healthcare | High gain torso coil for GE scanner |
Riferimenti
- Sá, R. C., et al. Vertical distribution of specific ventilation in normal supine humans measured by oxygen-enhanced proton MRI. Journal of Applied Physiology. 109 (6), 1950-1959 (2010).
- Henderson, A. C., et al. The gravitational distribution of ventilation-perfusion ratio is more uniform in prone than supine posture in the normal human lung. Journal of Applied Physiology. 115 (3), 313-324 (2013).
- Geier, E. T., Neuhart, I., Theilmann, R. J., Prisk, G. K., Sá, R. C. Spatial persistence of reduced specific ventilation following methacholine challenge in the healthy human lung. Journal of Applied Physiology. 124 (5), 1222-1232 (2018).
- Tedjasaputra, V., et al. The heterogeneity of regional specific ventilation is unchanged following heavy exercise in athletes. Journal of Applied Physiology. 115 (1), 126-135 (2013).
- Fowler, W. S. Lung Function Studies. III. Uneven Pulmonary Ventilation in Normal Subjects and in Patients with Pulmonary Disease. Journal of Applied Physiology. 2 (6), 283-299 (1949).
- Robertson, J. S., Siri, W. E., Jones, H. B. Lung ventilation patterns determined by analysis of nitrogen elimination rates; use of mass spectrometer as a continuous gas analyzer. Journal of Clinical Investigation. 29 (5), 577-590 (1950).
- Sá, R. C., Asadi, A. K., Theilmann, R. J., Hopkins, S. R., Prisk, G. K., Darquenne, C. Validating the distribution of specific ventilation in healthy humans measured using proton MR imaging. Journal of Applied Physiology. 116 (8), 1048-1056 (2014).
- Musch, G., et al. Topographical distribution of pulmonary perfusion and ventilation, assessed by PET in supine and prone humans. Journal of Applied Physiology. 93 (5), 1841-1851 (2002).
- Venegas, J. G., Schroeder, T., Harris, R. S., Winkler, R. T., Melo, M. F. V. The distribution of ventilation during bronchoconstriction is patchy and bimodal: a PET imaging study. Respiratory Physiology & Neurobiology. 148 (1-2), 57-64 (2005).
- Orphanidou, D., Hughes, J. M., Myers, M. J., Al-Suhali, A. R., Henderson, B. Tomography of regional ventilation and perfusion using krypton 81m in normal subjects and asthmatic patients. Thorax. 41 (7), 542-551 (1986).
- King, G. G., Eberl, S., Salome, C. M., Meikle, S. R., Woolcock, A. J. Airway closure measured by a technegas bolus and SPECT. American Journal of Respiratory and Critical Care Medicine. 155 (2), 682-688 (1997).
- Horn, F. C., Deppe, M. H., Marshall, H., Parra-Robles, J., Wild, J. M. Quantification of regional fractional ventilation in human subjects by measurement of hyperpolarized 3He washout with 2D and 3D MRI. Journal of Applied Physiology. 116 (2), 129-139 (2014).
- Hamedani, H., et al. A hybrid multibreath wash-in wash-out lung function quantification scheme in human subjects using hyperpolarized 3 He MRI for simultaneous assessment of specific ventilation, alveolar oxygen tension, oxygen uptake, and air trapping. Magnetic Resonance in Medicine. 78 (2), 611-624 (2017).
- Hall, E. T., et al. The effect of supine exercise on the distribution of regional pulmonary blood flow measured using proton MRI. Journal of Applied Physiology. 116 (4), 451-461 (2014).
- Henderson, A. C., Sá, R. C., Barash, I. A., Holverda, S., Buxton, R. B., Prisk, G. K. Rapid intravenous infusion of 20mL/kg saline alters the distribution of perfusion in healthy supine humans. Respiratory Physiology & Neurobiology. 180 (2-3), 331-341 (2012).
- Arai, T. J., et al. Comparison of quantitative multiple-breath specific ventilation imaging using colocalized 2D oxygen-enhanced MRI and hyperpolarized 3He MRI. Journal of Applied Physiology. 125 (5), 1526-1535 (2018).
- Chen, Q., Jakob, P. M., Griswold, M. A., Levin, D. L., Hatabu, H., Edelman, R. R. Oxygen enhanced MR ventilation imaging of the lung. Magma: Magnetic Resonance Materials in Physics, Biology, and Medicine. 7 (3), 153-161 (1998).
- Arai, T. J., Asadi, A. K., Sá, R. C. Deforminator: Projective transformation to register small scale Lung deformation. , Available from: https://github.com/UCSDPulmonaryImaging/Deforminator (2019).
- Yang, G., Stewart, C. V., Sofka, M., Tsai, C. -L. Registration of Challenging Image Pairs: Initialization, Estimation, and Decision. IEEE Transactions on Pattern Analysis and Machine Intelligence. 29 (11), 1973-1989 (2007).
- Arai, T. J., Villongco, C. T., Villongco, M. T., Hopkins, S. R., Theilmann, R. J. Affine transformation registers small scale lung deformation. Conf Proc IEEE Eng Med Biol Soc. 2012, 5298-5301 (2012).
- Theilmann, R. J., et al. Quantitative MRI measurement of lung density must account for the change in T(2) (*) with lung inflation. Journal of Magnetic Resonance Imaging. 30 (2), 527-534 (2009).
- Arai, T. J., et al. Magnetic Resonance Imaging Quantification of Pulmonary Perfusion using Calibrated Arterial Spin Labeling. Journal of Visualized Experiments. 51 (51), e2712(2011).
- Lewis, S. M., Evans, J. W., Jalowayski, A. A. Continuous Distributions of Specific Ventilation Recovered From Inert-Gas Washout. Journal of Applied Physiology. 44 (3), 416-423 (1978).
- Cook, F. R., Geier, E. T., Asadi, A. K., Sá, R. C., Prisk, G. K. Rapid Prototyping of Inspired Gas Delivery System for Pulmonary MRI Research. 3D Printing and Additive Manufacturing. 2 (4), 196-203 (2015).
- Zapol, W. M., et al. Pulmonary Delivery of Therapeutic and Diagnostic Gases. Journal of Aerosol Medicine and Pulmonary Drug Delivery. 31 (2), 78-87 (2018).
- Kang, W., et al. In silico modeling of oxygen-enhanced MRI of specific ventilation. Physiological Reports. 6 (7), e13659(2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon