Method Article
Methionine Funcionalizou o bloco biocompatible copolímeros para a entrega alvejada do ADN do plasmid
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este trabalho apresenta a preparação de copolímeros de blocos biocompatíveis (mBG) funcionalizados com metionina através do método de transferência reversível da cadeia de fragmentação de adição (RAFT). A habilidade complexantes do DNA do plasmídeo do MBG obtido e sua eficiência do transfection foram investigadas igualmente. O método da JANGADA é muito benéfico para os monómeros de polimerização que contêm grupos funcionais especiais.
Resumo
A polimerização reversível da transferência chain da adição-fragmentação (JANGADA) integra as vantagens da polimerização radical e da polimerização viva. Este trabalho apresenta a preparação de copolímeros de bloco biocompatível funcionalizados com metionina via polimerização de JANGADA. Primeiramente, n, n-bis(2-Hydroxyethyl) methacrylamide-b-n-(3-AMINOPROPYL) methacrylamide (bnhema-b-APMA, BA) foi sintetizado através da polimerização da jangada usando 4, 4 '-AZOBIS (ácido 4-cyanovaleric) (ACVA) como Agente de iniciação e dithiobenzoate do ácido 4-cyanopentanoic (CTP) como o agente de transferência Chain. Subseqüentemente, n, n-bis(2-Hydroxyethyl) methacrylamide-b-n-(3-guanidinopropyl) methacrylamide (metionina enxertada bnhema-b-gpma, MBG) foi preparada modificando grupos de amina em APMA com metionina e guanidina Grupos. Três tipos de polímeros de bloco, mBG1, mBG2 e mBG3, foram sintetizados para comparação. Uma reação de ninidrina foi usada para quantificar o índice de APMA; mBG1, mBG2 e mBG3 tiveram 21%, 37% e 52% de APMA, respectivamente. Os resultados da cromatografia de permeação de gel (GPC) mostraram que os copolímeros da BA possuem pesos moleculares de 16.200 (BA1), 20900 (BA2) e 27200 (BA3) g/mol. A habilidade complexantes do ADN do plasmídeo (PDNA) dos portadores do gene obtido do copolímero do bloco foi investigada igualmente. Os rácios de carga (N/P) foram 8, 16 e 4 quando o pDNA foi complexado completamente com mBG1, mBG2, mBG3, respectivamente. Quando a relação N/P de poliplexes mBG/pDNA foi superior a 1, o potencial zeta de mBG foi positivo. Em uma relação de N/P entre 16 e 32, o tamanho de partícula médio de maioria de MBG/PDNA era entre 100-200 nanômetro. Globalmente, este trabalho ilustra um protocolo simples e conveniente para a síntese do portador do copolímero do bloco.
Introdução
Nos últimos anos, a terapia gênica surgiu para a entrega terapêutica de ácidos nucleicos como drogas para tratar todos os tipos de doenças1. O desenvolvimento de drogas genéticas, incluindo DNA plasmídeo (pDNA) e RNA interferente pequeno (siRNA), depende da estabilidade e eficiência do sistema de distribuição de fármacos (DDS)2. Entre todos os DDS, os portadores de polímero catiônico têm as vantagens de boa estabilidade, baixa imunogenicidade e preparo e modificação facile, que conferem às transportadoras de polímeros catiônicos amplas perspectivas de aplicação3,4. Para aplicações práticas em biomedicina, os pesquisadores devem encontrar um portador de polímero catiônico com alta eficiência, baixa toxicidade e boa capacidade de segmentação5. Entre todos os portadores de polímero, os copolímeros de blocos são um dos sistemas de entrega de drogas mais amplamente utilizados. Os copolímeros de blocos são intensamente estudados para sua propriedade e habilidades de automontagem para formar micelas, microesferas e nanopartículas na entrega de fármacos5. Os copolímeros do bloco podem ser sintetizados através da polimerização viva ou de métodos da química do clique.
Em 1956, Szwarc et al. elevaram o tema da polimerização viva, definindo-o como uma reação sem reações de quebra de cadeia6,7. Desde então, várias técnicas foram desenvolvidas para sintetizar polímeros utilizando este método; assim, a polimerização viva é vista como um marco da ciência do polímero8. A polimerização viva pode ser classificada na polimerização aniónica viva, na polimerização catiônica viva, e na polimerização radical reversível da desactivação (RDRP)9. As polimerizações ANIÓNICAS/catiônicas vivas têm um âmbito de aplicação limitado devido às suas condições de reacção rigorosas10. A polimerização controlada/viva do radical (CRP) tem condições de reação suaves, disposição conveniente, e bom rendimento e foi assim um foco principal da pesquisa nos últimos anos11. Na PCR, as cadeias de propagação ativas são passivadas reversivelmente em dormentes para reduzir a concentração de radicais livres e evitar a reação bimoleculares de propagação de radicais da cadeia. A polimerização da adição pode continuar somente se as correntes de propagação dormentes inativas são animadas reversivelmente em radicais Chain. Como uma das formas mais promissoras de polimerização radical viva, a polimerização reversível de transferência de cadeia de adição-fragmentação (RAFT) é um método aplicável a polímeros de blocos de produção com peso molecular e estrutura controlados, peso molecular estreito distribuição, e carregando grupos funcionais12. A chave à polimerização bem sucedida da JANGADA é o efeito de agentes de transferência Chain, geralmente dithioesters, que possuem constante de transferência Chain muito elevada.
Neste papel, um método da polimerização da JANGADA foi projetado preparar o polímero do bloco de BNHEMA-b-APMA, tomando 4, 4 '-azobis (ácido 4-cyanovaleric) (ACVA) como um agente de início e um dithiobenzoate do ácido 4-cyanopentanoic (CTP) como um agente de transferência Chain A polimerização do RAFT foi usada duas vezes para introduzir o BNHEMA nos portadores do polímero catiônico. Subseqüentemente, os grupos da amina na corrente de APMA foram modificados com metionina e o cloridrato 1-amidinopyrazole do reagente do guanidinylation. Fazendo o uso das cargas positivas do reagente do guanidinylation e da estrutura de esqueleto do polímero do metacrilamida, a eficiência celular da captação dos portadores do polímero do bloco obtido foi melhorada.
Protocolo
1. síntese de BNHEMA polímero (PBNHEMA)
- Dissolver 1,87 g de n, n-bis(2-Hydroxyethyl) METHACRYLAMIDE (bnhema) em 1 ml de água destilada em um frasco de polimerização.
Nota: a garrafa de polimerização é um balão de fundo redondo com uma rolha de borracha e um agitador magnético. - Dissolver 0, 3 g de 4-ácido cianopentanóico dithiobenzoato (CTP) e 0, 2 g de 4, 4 '-azobis (4-cyanovalericacid) (ACVA) em 0,5 mL de 1,4-dioxano em uma taça de 5 mL. Em seguida, adicione a solução CTP e ACVA à garrafa de polimerização da etapa 1,1.
- Ventilar o sistema de reacção no frasco de polimerização com azoto através de três ciclos de congelação-bomba-descongelamento.
- Em detalhe, congele a solução no frasco da polimerização usando uma armadilha condensada, fixe a garrafa da polimerização ao apoio do ferro, e Aspire e injete o nitrogênio na mistura da reação através de um conduíte derrubado com uma agulha (#9 agulha, diâmetro interno 0,65 milímetros, diâmetro exterior 0,9 mm). Selar a garrafa de polimerização e descongelar a solução à temperatura ambiente durante 30 min.
- Repita os ciclos de congelamento-bomba-degelo três vezes.
- Põr o frasco da polimerização em um banho de óleo do ° c 70 e deixe a solução reagir por 24 h a atmosfera do nitrogênio.
- Resfrie a garrafa de polimerização a 0 ° c e abra a rolha de borracha para finalizar o processo de polimerização.
- Precool acetona em a-20 ° c geladeira para 2 h e depois misturá-lo com a solução de reação da etapa 1,5 em 50:1 (v/v). Depois disso, centrifugue a 8.200 x g por 10 min para remover a acetona e recolher o precipitado.
- Para purificar a PBNHEMA sintetizada, dissolver o precipitado coletado em 2 mL de água pura e depois misturá-lo com 100 mL de acetona pré-arrefecida, na proporção de 1:50 (v/v). Centrifugue a solução em 8.200 x g por 10 min e colete o precipitado. Repita este processo três vezes.
- Seque o PBNHEMA produzido usando um secador de vácuo de 50 ° c. Uma vez secas, pesar o pó com um equilíbrio. Calcule a taxa de rendimento de acordo com a equação 1.
 1
1
Nota: neste experimento, o rendimento obtido foi de 77,2%.
2. síntese de BNHEMA-b-APMA polímero (BA)
- Dissolver 0,96 g de N-(3-aminopropilo) cloridrato de metacrilamida (APMA) e 0,93 g PBNHEMA em 5 ml de água destilada em um copo de 10 ml.
- Dissolver 0, 1 g de 4, 4 '-azobis (ácido 4-cianovalérico) (ACVA) em 0,5 mL de 1,4-dioxano e misturar com a solução APMA-PBNHEMA da parte 2,1.
- Transferir a mistura para uma garrafa de polimerização e ventilar com nitrogênio seco por 1 h.
- Põr o frasco da polimerização em um banho de óleo do ° c 70 e deixe-o reagir por 24 h a atmosfera do nitrogênio.
- Resfrie a garrafa de polimerização a 0 ° c e abra a rolha de borracha para finalizar o processo de polimerização.
- Transfira a solução para a acetona refrigerada da etapa 1,6 e, em seguida, centrifugue a solução em 8.200 x g por 10 min para PRECIPIR o Ba.
- Dissolva o BA em 2 mL de água destilada e precipeie o polímero em acetona refrigerada. Repita três vezes.
- Seque o BA produzido em um secador de vácuo de 50 ° c e pesar o pó obtido. Calcule a taxa de rendimento de acordo com a equação 2.

Nota: neste experimento, a taxa de rendimento foi calculada para ser de 82,0%.
3. Determine o por cento da toupeira de APMA no copolímero do Ba através do método do ninidrina
Nota: a espectrofotometria é utilizada para determinar o conteúdo de aminoácidos multicomponentes. O princípio é uma reação de cor de ninidrina e aminoácido, onde a absorvência é correlacionada com o teor de aminoácidos em certa medida13,14.
- Dissolver 5 g de ninidrina em 125 ml de água destilada a ferver. Além disso, dissolver 5 g de vitamina C em 250 mL de água destilada quente. Adicione o 250 ml de solução de vitamina C gota gota à solução de ninidrina agitação magnética. Continue a mexer durante 15 min e depois Chill a solução de reacção num frigorífico de 4 ° c.
- Tire a solução da geladeira e filtre por sucção usando um funil Buchner para obter uma ninidrina reduzida. Colete o precipitado e preservá-lo em um desidratador de pentóxido de fósforo.
- Dissolver 85 mg de ninidrina e 15 mg de ninidrina reduzida em 10 ml de etileno glicol monometil éter para preparar a solução de coloração ninidrina.
Nota: Ninhydrin-coloração solução pode reagir com α-amino no APMA e formam um composto violeta com uma estrutura como descrito em um estudo anterior15. - Diluir 1 mL de 0, 1, 10, 100, 1.000 mg/mL soluções de monômero APMA com 1 mL de tampão de acetato (2 M, pH 5,4) e, em seguida, adicionar 1 mL de solução de coloração Ninhydrin, respectivamente.
- Aqueça as misturas por 15 min em um banho de água fervente e, em seguida, resfriá-los usando água corrente. Deixe as soluções sentar-se para 5-10 min e diluir-los com 3 mL de álcool etílico 60% e misturá-los completamente. Meça a absorvância a 570 nm usando um espectrofotômetro e desenhe a curva padrão (equação 3).

Nota: a equação 3 foi derivada do encaixe linear da absorvância em 570 nm versus a concentração de APMA. - Dissolver 0, 1 g de BA em 1 mL de água destilada; Adicionar 1 mL de tampão de acetato (2 M, pH 5,4) e 1 mL de solução de coloração Ninhydrin. Calcule o conteúdo molar de APMA de acordo com a absorvância em 570 nm.

 5
5
Nota: as fórmulas de cálculo são as seguintes (equações 3-6).
4. síntese de polímero de BA de metionina enxertada (mBA)
- Dissolva 8,9 mg de FOMC-metionina em 5 mL de DMSO em um balão de recuperação.
- Adicionar 6,92 mg de 1-etil-3-(3-dimetilaminopropilo) carbodiimida cloridrato (EDCl) e 4,86 mg de 1-hidroxibenzotriazol (HOBT) para o frasco de recuperação e reagir a 0 ° c para 0,5 h.
- Dissolver 2,59 g de BA em 5 mL de solução de DMSO e, em seguida, adicionar 50 μL de trimetilamina; Adicione esta solução gota gota ao balão da recuperação (etapa 4,2) e deixe a solução reagir para 0,5 h na temperatura ambiente.
- Dialyze para remover DMSO e trimetilamina da solução do Ba na etapa 4,3 usando um saco da diálise (MWCO 10 kDa) em um copo de 2 litros por 24 h; Substitua a água deionizada a cada 6 h.
- Congelar-secar o mBA obtido e pesar para calcular a taxa de rendimento de acordo com a equação 7.
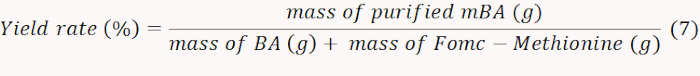
Nota: neste caso, a taxa de rendimento foi determinada como sendo 71%. - Quantificar o NH2 contendo mBA medindo a absorvância em 570 nm para calcular a quantidade de metionina enxertada. Calcule o conteúdo molar da metionina de acordo com a equação 8.

5. síntese do polímero de BNHEMA-b-APMA conjugado com guanidinated e metionina (MBG)
Nota: três diferentes mBA1, mBA2 e mBA3 copolímero foram sintetizados. mBA3 copolímero é usado como um exemplo nas etapas a seguir.
- Dissolver mBA3 contendo 60 μmol de grupo amino em 5 mL de água pura.
Nota: o conteúdo do grupo amino foi quantificado utilizando o método ninidrina, conforme descrito na etapa 3,5. - Dissolva 40,6 mg (300 μmol) de reagente de guanidinilação 1-amidinopyrazole hydrochloride em soluções de mBA.
- Ajuste o pH para 9,0 com a solução saturada de carbonato de sódio e deixe-o estabilizar por 24 h à temperatura ambiente.
- Dialyze o produto mBG com água deionizada usando um saco de diálise em uma taça (MWCO 10 kDa, 2 L) e preservá-lo a forma de um pó liofilizado.
A percentagem de rendimento foi calculada para 85% através da equação 8.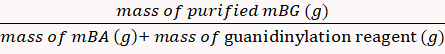 8
8 - Dissolver o pó de mBG em D2o nos tubos de RMN e caracterizá-lo usando 1h espectroscopia de ressonância magnética nuclear (1h RMN)16.
6. preparação e caracterização de poliplexes mBG/pDNA
- Dissolver 50 μg de pDNA em 50 μL de água RNase/DNase livre.
- Dissolver 1 mg de copolímeros de mBG em 1 mL de água livre de RNase/DNase.
- Adicione a solução de copolímeros mBG diretamente na solução pDNA de acordo com diferentes proporções de alimentação, ou seja, diferentes relações N/P (1:1, 4:1, 8:1, 16:1 e 32:1).
Nota: a relação N/P é definida como a razão molar do grupo guanidina no polímero e o grupo fosfato em pDNA, ou seja, a razão molar da cadeia GPMA no polímero e o mononucleotídeo em pDNA. A relação N/P é calculada de acordo com os pesos moleculares do aminonitrogênio (N) no mBG e no grupo fosfato (P) no pDNA. - Misture as soluções com um misturador Vortex e deixe-os ficar por 30 min à temperatura ambiente. Depois disso, dispersar a mistura em solução tampão fosfato (PBS, pH 7,4) e preservar os poliplexes mBG/pDNA obtidos a 4 ° c para os experimentos de acompanhamento.
Nota: o tamanho médio das partículas e o potencial zeta de mBG e os complexos foram detectados usando dispersão de luz dinâmica (DLS)17. - Diluir 10 μL das soluções de poliplex mBG/pDNA com 1 mL de PBS (pH 7,4) nas células de amostra potenciais DLS e Zeta.
Nota: o tamanho das partículas e a detecção do potencial zeta foram realizados três vezes e uma média dos três valores foi tomada.
7. experimento de retardamento eletroforético de poliplexes mBG/pDNA
Nota: foi conduzido um experimento de retardamento eletroforético para determinar a razão de carga mínima.
- Tomar cinco grupos de poliplexes mBG/pDNA com diferentes proporções de N/P (1:1, 4:1, 8:1, 16:1 e 32:1) contendo 50 μg de pDNA.
- Adicione o amortecedor de carregamento 6x às amostras do Polyplex de mBG/pDNA a uma concentração final de 1x.
- Adicione as soluções para os géis de agarose 1,5% e execute o gel em 90 mV por 15 min, usando pDNA como controle.
- Tire fotos dos géis usando uma Imager gel.
8. citotoxicidade de poliplexes de mBG/pDNA
- Semente MCF-7 pilhas nas placas 96-well em uma densidade de 104 pilhas por bem. Em seguida, a cultura das células para 12 h usando meio DMEM (10% FBS e 1% antibiótico) em uma incubadora humidificada 37 ° c fornecido com 5% CO2.
- Substitua o meio de cultura por meios de cultura DMEM sem antibióticos contendo 10% de soro bovino fetal (FBS) e poliplexes mBG/pDNA de diferentes proporções de carga (N/P 4, 8, 16 e 32, n = 6) por 6 h, levando as células adicionadas com volumes iguais de solução de PBS como controle. Em seguida, substitua o meio de cultura por 150 μL de meio fresco 1640 e promova a cultura das células por 24 h.
- Adicionar 5 mg/mL 3-(4, 5-dimethylthiazole-2-yl)-2,5-brometo de difeniltetrazólio (MTT) solução (20 μL/poço) para o 96-bem placas e cultura mais as células para 4 h.
- Retire a solução e adicione 150 μL de DMSO a cada poço e agite as placas 96-well 30 seg.
- Meça a densidade ótica (OD) em 490 nanômetro com um leitor do microplate para mostrar a viabilidade da pilha. Calcule a porcentagem de viabilidade celular de acordo com a equação 9.
Viabilidade celular% = (9)
(9)
9. eficiência do transfection de maioria de MBG/GFP-PDNA
- Dissolver 50 μg de pDNA contendo o repórter gene Green fluorescente protein (GFP) pDNA (GFP-pDNA) em 50 μL de água RNase/DNase livre. Em seguida, dissolva 1 mg de copolímeros de mBG em 1 mL de água livre de RNase/DNase. Misture a solução de pDNA e de mBG em uma relação da carga (N/P) de 1:1, de 4:1, de 8:1, de 16:1, e de 32:1 e de incubar por 30 minutos na temperatura ambiente. Dispersar a solução de poliplexes mBG/GFP-pDNA usando ondas Ultrassônicas (30 s) e armazenar a 4 ° c para os experimentos de acompanhamento.
Nota: a relação N/P é calculada de acordo com os pesos moleculares do aminonitrogênio (N) no mBG e no grupo fosfato (P) no pDNA. - Semente MCF-7 células em uma densidade de 2 × 105 células por poço em uma placa de 6 poços e cultura-los em 37 ° c e 5% co2 em uma incubadora humidificada para 12 h.
- Substitua o meio de cultura pelo meio de cultura fresco contendo poliplexes mBG/GFP-pDNA de diferentes proporções de N/P (4, 8, 16 e 32) por 6 h.
- Substitua o meio com 2 mL de meio fresco RPMI1640 e cultura para 48 h.
- Colete as células e detecte a fluorescência verde com um citometro de fluxo.
Resultados
O BNHEMA foi alimentado de acordo com o grau objetivo de polimerização mostrado na tabela 1; o procedimento de síntese de mBG é mostrado na Figura 1. Firstly, o homopolímero de BNHEMA foi preparado através do método reversível da transferência chain da adição-fragmentação (JANGADA) no sistema da água-dioxane, usando o dithiobenzoate do ácido 4-cyanopentanoic como um agente de transferência Chain. Em segundo lugar, PBNHEMA foi usado como um agente de transferência Chain para preparar o polímero do bloco de BNHEMA-b-APMA. O monômero APMA foi alimentado de acordo com o grau objetivo de polimerização mostrado na tabela 1. A cromatografia de permeação de gel (GPC) foi realizada para detectar o peso molecular da BA com diferentes proporções de alimentação (tabela 1). O conteúdo molar real das cadeias APMA em Ba com diferentes proporções de alimentação foi detectado por meio do método ninidrina (tabela 1). De acordo com nosso estudo mais adiantado5, nós usamos mBG3 no presente estudo porque tem o índice o mais elevado de APMA. Finalmente, a metionina foi enxertada na cadeia APMA e os grupos residuais de amina foram completamente guanidinylated para preparar mBG. A Figura 2 é os dados de RMN de 1H de MBG. O tamanho médio das partículas e o potencial zeta dos poliplexos mBG/pDNA foram de 124 nm e + 15,7 mV, respectivamente, na relação N/P de 16 (Figura 3).
A retardação electrophoretic é uma técnica rápida e simples que envolva a separação de pDNA não acoplado e de Polyplex de copolímero/pDNA baseado em diferenças em suas mobilidades electrophoretic em géis do agarose. A banda de pDNA não acoplada pode se mover no gel de agarose a ação do campo elétrico. No experimento de retardo eletroforético (Figura 4), o PDNA (com uma relação N/P de 0) pode se movimentar sem contenção no gel de agarose e foi observado como uma listra no gerador de gel. Quando o pDNA é complexado com mBG, o movimento de pDNA é retardado e, subsequentemente, o brilho da banda é reduzido. A Figura 4 mostra que o MBG pode completamente complexo o PDNA quando N/P é maior do que 4.
A citotoxicidade dos poliplexos mBG/pDNA foi mensurada por meio do teste padrão de MTT (Figura 5). Os resultados mostram que os poliplexes mBG/pDNA têm, obviamente, menor citotoxicidade do que os poliplexes PEI/pDNA nas proporções de N/P de 4, 8, 16 e 32 na linha celular MCF-7 (P < 0,05, N = 3, ANOVA unidirecional). Além disso, a citotoxicidade dos poliplexes de mBG/pDNA aumenta com a relação N/P aumentada. O aumento da citotoxicidade de poliplexes de mBG/pDNA com um aumento de N/P é resultado do componente GPMA carregado positivamente. os poliplexes de MBG/PDNA mostraram menos citotoxicidade do que os maioria de Pei/PDNA, que podem ser atribuídos à presença de bnhema nos copolímeros que protegem a carga de superfície de polímeros catiônicos.
A relação N/P utilizada no experimento de transfecção do pDNA foi selecionada de acordo com os resultados da citotoxicidade. Como mostrado na Figura 6, as habilidades de transfecção de MBG1, MBG2 e mBG3 foram comparadas medindo-se a intensidade da fluorescência do GFP e os resultados mostraram que mBG3 é o portador de gene ideal. Embora os maioria de Pei/PDNA com uma relação de N/P de 8 tenham a eficiência similar do transfection como mBG3/PDNA maioria com uma relação de n/P de 32, Pei tem a citotoxicidade mais elevada e não tem nenhuma função tal como a carga da droga, que restringe sua aplicação no campo biomédico. Os resultados revelaram que o aumento do conteúdo de AMPA é fundamental para melhorar a eficiência de transfecção do copolímero de mBG. Como mencionamos em um estudo anterior5, peptídeos penetrantes de células (CPPs) são 9-35 Mer peptídeos catiônicos ou anfípticos com a capacidade de penetrar na membrana celular. O grupo guanidina é uma CPP catiônica que pode ser conjugada em um polímero para melhorar a transfecção do poliplex polímero/pDNA através de uma via transmembrana independente de proteínas. Portanto, o copolímero mBG integra vantagens relacionadas aos grupos guanidina para a penetração celular e o componente BNHEMA para blindagem, demonstrando grande potencial para a efetiva entrega do gene.
| Amostra | BHEMA-b-APMA | Mw | Pdi | |
| Valor teórico do conteúdo de APMA (%) | Valor real do conteúdo APMA (%) | |||
| BNHEMA90-b-APMA30(BA1) | 25 | 21 | 16200 | 1,25 |
| BNHEMA90-b-APMA60(Ba2) | 40% de | 37% de | 20900 | 1,21 |
| BNHEMA90-b-APMA90(Ba3) | 50% de | 52% de | 27200 | 1,25 |
Tabela 1: composição de BNHEMA-b-APMA por polimerização de jangada.

Figura 1: procedimento de síntese esquemática do mBG. Por favor clique aqui para ver uma versão maior desta figura.
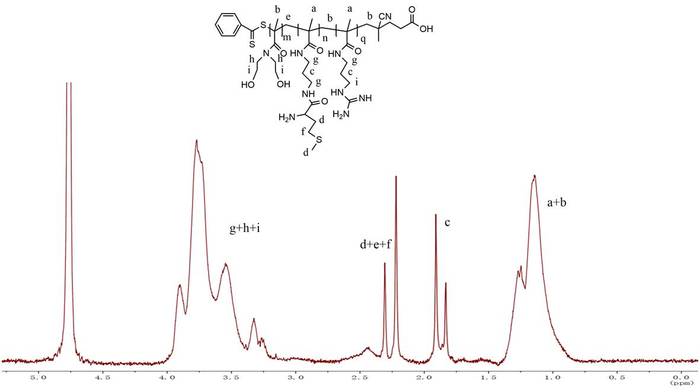
Figura 2: espectros de RMN de 1H de MBG em D2O. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: tamanho das partículas e potencial zeta dos poliplexes.
(A) o tamanho das partículas de Ba/PDNA. B) o tamanho das partículas do MBG/PDNA. (C) potencial zeta de Ba/PDNA. (D) potencial zeta do MBG/PDNA. Por favor clique aqui para ver uma versão maior desta figura.
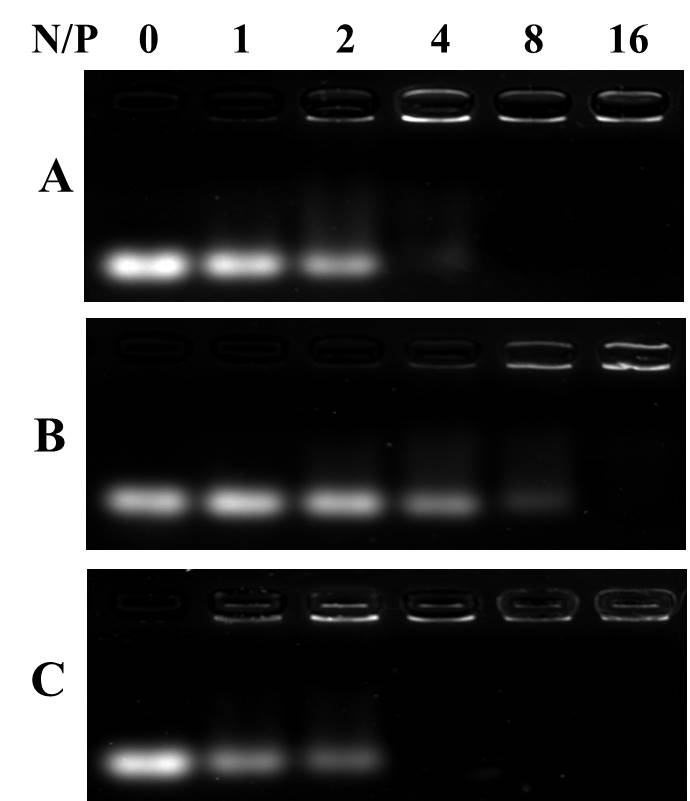
Figura 4: imagens de eletroforese em gel de agarose de BA3
(a) , mBA3 (b) e mBG3 (c) poliplexes em diferentes rácios de carga.

Figura 5: citotoxicidade de poliplexes de mBG/pDNA em relação N/P diferente na linha celular de MCF7.
O Polyplex de PEI/pDNA foi usado como o controle. Os dados foram mostrados como média ± DP (n = 3). * indica p < 0,05 em comparação com o grupo PEI. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: a eficiência do transfection de maioria de MBG/PDNA na relação de N/P de 4, 8, 16 e 32 foi medida pelo cytometer do fluxo.
Os dados foram mostrados como média ± DP (n = 3). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este estudo introduziu uma série de portadores do gene catiônicos do polímero do bloco de bnhema-b-APMA. Estes polímeros do bloco foram sintetizados através do método reversível da transferência chain da adição-fragmentação (JANGADA). O segmento hidrofílico BNHEMA foi introduzido para melhorar a solubilidade. Os grupos de metionina e guanidina foram modificados para melhorar a capacidade alvo e a eficiência de transfecção5. O conteúdo da cadeia de APMA aumentou e a guanidinilação no copolímero de mBG reduziu o tamanho das partículas dos poliplexes mBG/pDNA. O tamanho de partícula e o potencial de superfície fazem o complexo fácil através da membrana de pilha e aplicável ao transfection. Os pontos críticos no experimento encontram-se estritamente controlando a razão molar do monômero BNHEMA e CTP para 45:1, a razão molar de CTP e ACVA para 2:1, e a temperatura para 70 ° c. Durante o processo de purificação, a proporção de volume de acetona pré-arrefecida e solução de polímero deve ser superior a 50:1.
Com o mesmo valor de N/P, juntamente com o aumento da proporção da cadeia APMA, diminui o tamanho das partículas dos poliplexes mBG/pDNA. Estes resultados indicam que o aumento do conteúdo da cadeia APMA e a guanidinilação podem reduzir o tamanho das partículas. O tamanho de partícula e o potencial de superfície fazem o complexo fácil transportar através da membrana de pilha e aplicável ao transfection. A eletroforese em gel foi utilizada para investigar a relação entre complexação e relação N/P e os dados mostraram que o N/P mínimo é 4. Este estudo fornecerá dados básicos valiosos para o estudo mais adicional de portadores do gene catiônico. No entanto, BNHEMA-b-APMA não é facilmente degradado e seu processo de metabolismo in vivo não é suficientemente claro. Conseqüentemente, a aplicação clínica é ainda um grande desafio para portadores do gene do polímero catiônico.
A eficiência elevada e a baixa toxicidade de portadores do gene são as condições necessárias para seu uso clínico. Os vetores do gene do polímero catiônico têm vantagens da boa estabilidade e de nenhuma imunogenicidade e podem ser preparados e modificados facilmente.
A polimerização da JANGADA é amplamente utilizada na polimerização dos monómeros que incluem o estireno, o methacrylate, o acrylonitrile, e o acrylamide. Este tipo do processo da polimerização pode ser realizado na baixa temperatura. Além disso, a polimerização RAFT pode ser usada para sintetizar polímeros de estruturas finas. A polimerização de JANGADA descrita neste protocolo é considerada um dos métodos potenciais mais promissores para a preparação de polímeros biomédicos.
Divulgações
Os autores certificam que não há conflito de interesses com qualquer organização financeira em relação ao material discutido neste artigo.
Agradecimentos
Esta pesquisa foi apoiada pelo programa de pesquisa e desenvolvimento chave nacional da China (no. 2016YFC0905900), Fundação Nacional de ciência natural da China (nos. 81801827, 81872365), programa de pesquisa básica da província de Jiangsu (Fundação de ciências naturais, não. BK20181086), e Jiangsu Cancer hospital fundo de investigação científica (no. ZK201605).
Materiais
| Name | Company | Catalog Number | Comments |
| 1-hydroxybenzotriazole | Macklin Biochemical Co., Ltd,China | H810970 | ≥97.0% |
| 1,4-dioxane | Sinopharm chemical reagent Co., Ltd, China | 10008918 | AR |
| 1-amidinopyrazole Hydrochloride | Aladdin Co., Ltd., China | A107935 | 98% |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Aladdin Co., Ltd., China | E106172 | AR |
| 4,4’-azobis(4-cyanovaleric acid) | Aladdin Co., Ltd., China | A106307 | Analytical reagent (AR) |
| 4-cyano-4-(phenylcarbonothioylthio)pentanoic Acid | Aladdin Co., Ltd., China | C132316 | >97%(HPLC) |
| Acetate | Sinopharm chemical reagent Co., Ltd, China | 81014818 | AR |
| Acetone | Sinopharm chemical reagent Co., Ltd, China | 10000418 | AR |
| Agarose | Aladdin Co., Ltd., China | A118881 | High resolution |
| Ascorbic acid | Aladdin Co., Ltd., China | A103533 | AR |
| DMSO | Aladdin Co., Ltd., China | D103272 | AR |
| Ethylene glycol | Aladdin Co., Ltd., China | E103319 | AR |
| N-(3-aminopropyl)methacrylamide hydrochloride | Aladdin Co., Ltd., China | N129096 | ≥98.0%(HPLC) |
| N,N-bis(2-hydroxyethyl)methacrylamide | ZaiQi Bio-Tech Co.,Ltd, China | CF259748 | ≥98.0%(HPLC) |
| Ninhydrin | Aladdin Co., Ltd., China | N105629 | AR |
| PBS buffer | Aladdin Co., Ltd., China | P196986 | pH 7.4 |
| Plasmid DNA | BIOGOT Co., Ltd, China | pDNA-EGFP | pDNA-EGFP |
| Plasmid DNA | BIOGOT Co., Ltd, China | Pdna | pDNA |
| Sodium carbonate decahydrate | Aladdin Co., Ltd., China | S112589 | AR |
| Trimethylamine | Aladdin Co., Ltd., China | T103285 | AR |
Referências
- Flotte, T. R. Gene and Cell Therapy in 2018: A Look Ahead. Human Gene Therapy. 29, 1-1 (2018).
- Huang, W., et al. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs. Advanced Drug Delivery Reviews. 115, 82-97 (2017).
- Wu, Y., et al. Reversing of multidrug resistance breast cancer by co-delivery of P-gp siRNA and doxorubicin via folic acid-modified core-shell nanomicelles. Colloids & Surfaces B Biointerfaces. 138, 60-69 (2016).
- Quader, S., Kataoka, K. Nanomaterial-Enabled Cancer Therapy. Molecular Therapy. 25, 1501-1513 (2017).
- Wu, Y., et al. Multivalent methionine-functionalized biocompatible block copolymers for targeted siRNA delivery and subsequent reversal effect on adriamycin resistance in human breast cancer cell line MCF-7/ADR. Journal of Gene Medicine. 19, e2969 (2017).
- Szwarc, M. ‘Living’ Polymers. Nature. 178, 168-169 (1956).
- Szwarc, M., Rembaum, A. Polymerization of methyl methacrylate initiated by an electron transfer to the monomer. Journal of Polymer Science. 22 (100), 189-191 (1956).
- Mukhopadhyay, R. D., Ajayaghosh, A. Living supramolecular polymerization. Science. 349, 241 (2015).
- Ozkose, U. U., Altinkok, C., Yilmaz, O., Alpturk, O., Tasdelen, M. A. In-situ preparation of poly(2-ethyl-2-oxazoline)/clay nanocomposites via living cationic ring-opening polymerization. European Polymer Journal. 88, 586-593 (2017).
- Wu, W., Wang, W., Li, J. Star polymers: Advances in biomedical applications. Progress in Polymer Science. 46, 55-85 (2015).
- Boyer, C., et al. Copper-Mediated Living Radical Polymerization (Atom Transfer Radical Polymerization and Copper(0) Mediated Polymerization): From Fundamentals to Bioapplications. Chemical Reviews. 116, 1803-1949 (2016).
- Keddie, D. J. A guide to the synthesis of block copolymers using reversible-addition fragmentation chain transfer (RAFT) polymerization. Chemical Society Reviews. 43, 496-505 (2014).
- Wu, Y., et al. Guanidinylated 3-gluconamidopropyl methacrylamide-s-3-aminopropyl methacrylamide copolymer as siRNA carriers for inhibiting human telomerase reverse transcriptase expression. Drug Delivery. 20, 296-305 (2013).
- Qin, Z., Liu, W., Guo, L., Li, X. Studies on Guanidinated N-3-Aminopropyl Methacrylamide-N-2-Hydroxypropyl Methacrylamide Co-polymers as Gene Delivery Carrier. Journal of Biomaterials Science, Polymer Edition. 23, 1-4 (2012).
- Friedman, M. Applications of the Ninhydrin Reaction for Analysis of Amino Acids, Peptides, and Proteins to Agricultural and Biomedical Sciences. Journal of Agricultural and Food Chemistry. 52, 385-406 (2004).
- Habuchi, S., Yamamoto, T., Tezuka, Y. Synthesis of Cyclic Polymers and Characterization of Their Diffusive Motion in the Melt State at the Single Molecule Level. Journal of Visualized Experiments. (115), 1-9 (2016).
- Rao, D. A., Nguyen, D. X., Mishra, G. P., Doddapaneni, B. S., Alani, A. W. Preparation and Characterization of Individual and Multi-drug Loaded Physically Entrapped Polymeric Micelles. Journal of Visualized Experiments. 102, 1-5 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados