Method Article
Copolímeros de bloque sin capacidad de ejecución funcionalización de metionina para la entrega de ADN de plásmido dirigido
* Estos autores han contribuido por igual
En este artículo
Resumen
Este trabajo presenta la preparación de copolímeros de bloque biocompatibles funcionalizados de metionina (mBG) a través del método reversible de transferencia de cadena de adición-fragmentación (RAFT). También se investigó la capacidad de complejidad del ADN plásmido del mBG obtenido y su eficiencia de transfección. El método RAFT es muy beneficioso para la polimerización de monómeros que contienen grupos funcionales especiales.
Resumen
La polimerización reversible de la transferencia de cadena de fragmentación de adición (RAFT) integra las ventajas de la polimerización radical y la polimerización viva. Este trabajo presenta la preparación de copolímeros de bloque biocompatible funcionalizados de metionina a través de la polimerización RAFT. En primer lugar, N,N-bis(2-hidroxietilo)metacrilamida-b-N-(3-aminopropyl)metacrilamida (BNHEMA-b-APMA, BA) se sintetizó a través de la polimerización RAFT utilizando 4,4'-azobis(4-ácido cianovalórico) (ACVA) como un agente iniciador y ditiobenzoato de ácido 4-cianopentanoico (CTP) como agente de transferencia de cadena. Posteriormente, N,N-bis(2-hidroxietilo)methacrilamida-b-N-(3-guanidinopropyl)metacrilamida (metionina injertada BNHEMA-b-GPMA, mBG) se preparó modificando grupos de aminas en APMA con metionina y guanidina Grupos. Se sintetizaron tres tipos de polímeros de bloque, mBG1, mBG2 y mBG3, para la comparación. Se utilizó una reacción de ninhydrin para cuantificar el contenido de APMA; mBG1, mBG2 y mBG3 tenían 21%, 37% y 52% de APMA, respectivamente. Los resultados de la cromatografía por permeación en gel (GPC) mostraron que los copolímeros BA poseen pesos moleculares de 16.200 (BA1), 20.900 (BA2) y 27.200(BA3) g/mol. También se investigó la capacidad de complejo del ADN plásmido (ADNp) de los portadores del gen del copolímero de bloque obtenido. Las relaciones de carga (N/P) eran 8, 16 y 4 cuando pDNA se complejoba completamente con mBG1, mBG2, mBG3, respectivamente. Cuando la relación N/P de los polipleplexs mBG/pDNA fue superior a 1, el potencial Zeta de mBG fue positivo. En una relación N/P entre 16 y 32, el tamaño medio de partícula de los poliplexos mBG/pDNA estaba entre 100-200 nm. En general, este trabajo ilustra un protocolo simple y conveniente para la síntesis portadora de copolímero de bloque.
Introducción
En los últimos años, la terapia génica ha surgido para la entrega terapéutica de ácidos nucleicos como fármacos para tratar todo tipo de enfermedades1. El desarrollo de fármacos genéticos, como el ADN plásmido (PDNA) y el pequeño ARN interferente (SIRNA), se basa en la estabilidad y eficiencia del sistema de administración de fármacos (DDS)2. Entre todos los DDS, los portadores de polímeros catiónicos tienen las ventajas de una buena estabilidad, baja inmunogenicidad, y fácil preparación y modificación, que dan a los portadores de polímeros catiónicos amplias perspectivas de aplicación3,4. Para aplicaciones prácticas en biomedicina, los investigadores deben encontrar un portador de polímero catiónico con alta eficiencia, baja toxicidad y buena capacidad de focalización5. Entre todos los portadores de polímeros, los copolímeros de bloque sin hogar son uno de los sistemas de administración de medicamentos más utilizados. Los copolímeros de bloque se estudian intensamente por sus propiedades de autoensamblaje y sus capacidadespara formar micelas, microesferas y nanopartículas en la administración de fármacos 5. Los copolímeros de bloque se pueden sintetizar a través de métodos de polimerización viva o de química de clics.
En 1956, Szwarc y otros plantearon el tema de la polimerización viva, definiéndolo como una reacción sin reacciones de ruptura en cadena6,7. Desde entonces, se habían desarrollado múltiples técnicas para sintetizar polímeros utilizando este método; por lo tanto, la polimerización viva es vista como un hito de la ciencia de polímeros8. La polimerización viva se puede clasificar en polimerización aniónica viva, polimerización catiónica viva y polimerización radical de desactivación reversible (RDRP)9. Las polimerizaciones aniónicas/catiónicas vivas tienen un alcance limitado de aplicación debido a sus estrictas condiciones de reacción10. La polimerización radical controlada/viva (CRP) tiene condiciones de reacción leves, disposición conveniente y buen rendimiento y, por lo tanto, ha sido un foco de investigación importante en los últimos años11. En la PCC, las cadenas de propagación activas se pasivan reversiblemente en las inactivas para reducir la concentración de radicales libres y evitar la reacción bimolecular de propagar los radicales de la cadena. La polimerización adicional sólo puede continuar si las cadenas de propagación latentes inactivas se animan reversiblemente en radicales de cadena. Como una de las formas más prometedoras de polimerización radical viva, la polimerización reversible de la transferencia de cadena de fragmentación de adición (RAFT) es un método aplicable para producir polímeros de bloque sin peso y estructura molecular controlados, peso molecular estrecho distribución y transporte de grupos funcionales12. La clave para el éxito de la polimerización RAFT es el efecto de los agentes de transferencia de cadena, generalmente ditioestras, que poseen una constante de transferencia de cadena muy alta.
En este artículo, se diseñó un método de polimerización RAFT para preparar el polímero de bloque BNHEMA-b-APMA, tomando 4,4'-azobis(4-ácido cianoovalico) (ACVA) como agente iniciador y 4-cianopentanoico ácido dithiobenzoato (CTP) como agente de transferencia de cadena. La polimerización RAFT se utilizó dos veces para introducir BNHEMA en los portadores de polímeros catiónicos. Posteriormente, los grupos de aminas en la cadena APMA fueron modificados con metionina y el reactivo de guanidinilación 1-amidinopyrazol clorhidrato. Haciendo uso de las cargas positivas del reactivo de guanidinilación y la estructura del esqueleto del polímero de metacrilamida, se mejoró la eficiencia de admisión celular de los portadores de polímeros de bloque obtenidos.
Protocolo
1. Síntesis del polímero BNHEMA (PBNHEMA)
- Disolver 1,87 g de N, N-bis(2-hidroxietilo)metacrilamida (BNHEMA) en 1 ml de agua destilada en una botella de polimerización.
NOTA: La botella de polimerización es un matraz de fondo redondo con un tapón de goma y un agitador magnético. - Disolver 0,03 g de ditiobenzoato de ácido 4-cianopentanoico (CTP) y 0,02 g de 4,4'-azobis (4-cianoovalericácido) (ACVA) en 0,5 ml de 1,4 dioxanos en un vaso de precipitados de 5 ml. A continuación, agregue la solución CTP y ACVA a la botella de polimerización del paso 1.1.
- Ventile el sistema de reacción en la botella de polimerización con nitrógeno a través de tres ciclos de congelación-bomba-descongelación.
- En detalle, congelar la solución en el frasco de polimerización utilizando una trampa de condensado, fijar la botella de polimerización al soporte de hierro, y aspirar e inyectar nitrógeno en la mezcla de reacción a través de un conducto inclinado con una aguja (#9 aguja, diámetro interior 0,65 mm, diámetro exterior 0,9 mm). Selle la botella de polimerización y descontece la solución a temperatura ambiente durante 30 min.
- Repita los ciclos de congelación-bomba-descongelación tres veces.
- Poner la botella de polimerización en un baño de aceite de 70oC y dejar que la solución reaccione durante 24 horas bajo la atmósfera de nitrógeno.
- Enfríe la botella de polimerización a 0 oC y abra el tapón de goma para terminar el proceso de polimerización.
- Preenfríe la acetona en un refrigerador de -20 oC durante 2 h y luego mezcle con la solución de reacción del paso 1.5 a 50:1 (v/v). Después de eso, centrífuga a 8.200 x g durante 10 minutos para eliminar la acetona y recoger el precipitado.
- Para purificar el PBNHEMA sintetizado, disolver el precipitado recogido en 2 ml de agua pura y luego mezclarlo con 100 ml de acetona preenfriada, en la proporción de 1:50 (v/v). Centrifugar la solución a 8.200 x g durante 10 min y recoger el precipitado. Repita este proceso tres veces.
- Seque el PBNHEMA producido con un secador de vacío de 50 oC. Una vez secado, pesar el polvo con una balanza. Calcule la tasa de rendimiento de acuerdo con la Ecuación 1.
 (1)
(1)
NOTA: En este experimento, el rendimiento obtenido fue del 77,2%.
2. Síntesis del polímero BNHEMA-b-APMA (BA)
- Disolver 0,96 g de N-(3-aminopropyl)clorhidrato de metacrilamida (APMA) y 0,93 g PBNHEMA en 5 ml de agua destilada en un vaso de precipitados de 10 ml.
- Disolver 0,01 g de 4,4'-azobis (4-ácido cianoovalrico) (ACVA) en 0,5 ml de 1,4-dioxano y mezclar con la solución APMA-PBNHEMA de la parte 2.1.
- Transfiera la mezcla a una botella de polimerización y ventile con nitrógeno seco durante 1 h.
- Poner la botella de polimerización en un baño de aceite de 70oC y dejar que reaccione durante 24 h bajo la atmósfera de nitrógeno.
- Enfríe la botella de polimerización a 0 oC y abra el tapón de goma para terminar el proceso de polimerización.
- Transfiera la solución a la acetona refrigerada desde el paso 1.6, y luego centrifugar la solución a 8.200 x g durante 10 minutos para precipitar el BA.
- Disolver el BA en 2 ml de agua destilada y precipitar el polímero en acetona refrigerada. Repita tres veces.
- Seque el BA producido en un secador al vacío de 50oC y pese el polvo obtenido. Calcular la tasa de rendimiento de acuerdo con la ecuación 2.

NOTA: En este experimento, la tasa de rendimiento se calculó en 82,0%.
3. Determinar el porcentaje de lunar de APMA en copolímero BA a través del método ninhydrin
NOTA: La espectrofotometría se utiliza para determinar el contenido de aminoácidos multicomponente. El principio es una reacción de color de ninhydrin y aminoácidos donde la absorbancia está correlacionada con el contenido de aminoácidos hasta cierto punto13,14.
- Disolver 5 g de ninhydrin en 125 ml de agua destilada hirviendo. Además, disolver 5 g de vitamina C en 250 ml de agua destilada tibia. Añadir los 250 ml de solución de vitamina C en gota a la solución de ninhydrin bajo agitación magnética. Continúe revolviendo durante 15 minutos y luego enfríe la solución de reacción en un refrigerador de 4 oC.
- Saque la solución de la nevera y filtre mediante succión utilizando un embudo Buchner para obtener ninhydrin reducido. Recoger el precipitado y preservarlo en un deshidratador de pentóxido de fósforo.
- Disolver 85 mg de ninhydrin y 15 mg de ninhydrin reducido en 10 ml de éter monometil etilenglicol para preparar la solución colorante de ninhydrin.
NOTA: La solución colorante de Ninhydrin puede reaccionar con el aminoácido en el APMA y formar un compuesto violeta con una estructura como se describe en un estudio anterior15. - Diluir 1 ml de soluciones de monómero APMA de 0, 1, 10, 100, 1.000 mg/ml con 1 ml de tampón de acetato (2 M, pH 5.4) y, a continuación, añadir 1 ml de solución colorante de ninhidrina, respectivamente.
- Calienta las mezclas durante 15 minutos en un baño de agua hirviendo y luego enfríalas con agua corriente. Deje que las soluciones se sientan durante 5-10 min y diluya con 3 ml de alcohol etílico al 60% y mezcle bien. Mida la absorbancia a 570 nm utilizando un espectrofotómetro y dibuje la curva estándar (Ecuación 3).

NOTA: La ecuación 3 se deriva del ajuste lineal de la absorbancia a 570 nm frente a la concentración de APMA. - Disolver 0,01 g de BA en 1 ml de agua destilada; añadir 1 ml de tampón de acetato (2 M, pH 5.4) y 1 ml de solución para colorear ninhydrin. Calcular el contenido molar de APMA según la absorbancia a 570 nm.

 (5)
(5)
NOTA: Las fórmulas de cálculo son las siguientes (Ecuaciones 3-6).
4. Síntesis del polímero BA injertado de metionina (mBA)
- Disolver 8,9 mg de Fomc-Metionina en 5 ml de DMSO en un matraz de recuperación.
- Añadir 6,92 mg de 1-etil-3-(3-dimetilaminopropil) clorhidrato de carbodiimida (EDCl) y 4,86 mg de 1-hidroxibenzotriazol (HOBT) al matraz de recuperación y reaccionar a 0 oC durante 0,5 h.
- Disolver 2,59 g de BA en 5 ml de solución de DMSO y luego añadir 50 ml de trimetilamina; añadir esta solución gota al matraz de recuperación (paso 4.2) y dejar que la solución reaccione durante 0,5 h a temperatura ambiente.
- Dialyze para eliminar DMSO y trimetilamina de la solución ba en el paso 4.3 utilizando una bolsa de diálisis (MWCO 10 kDa) en un vaso de precipitados de 2 L durante 24 h; reemplazar el agua desionizada cada 6 h.
- Secar con gel de mBA obtenido y pesar para calcular la tasa de rendimiento de acuerdo con la Ecuación7.
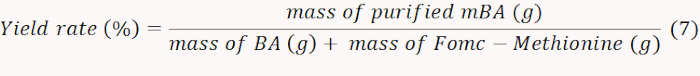
NOTA: En este caso, se determinó que la tasa de rendimiento era del 71%. - Cuantificar el NH2 que contiene mBA midiendo la absorbancia a 570 nm para calcular la cantidad de metionina injertada. Calcular el contenido molar de metionina de acuerdo con la ecuación 8.

5. Síntesis de polímero conjugado de guanidinated y metionina BNHEMA-b-APMA (mBG)
NOTA: Se sintetizaron tres copolímeros mBA1, mBA2 y mBA3 diferentes. El copolímero mBA3 se utiliza como ejemplo en los pasos siguientes.
- Disolver mBA3 que contiene 60 émol de grupo amino en 5 ml de agua pura.
NOTA: El contenido del grupo amino se cuantificó utilizando el método ninhydrin como se describe en el paso 3.5. - Disolver 40,6 mg (300 omol) de reactivo de guanidinilación 1-amidinopirazol clorhidrato en soluciones mBA.
- Ajuste el pH a 9,0 con la solución saturada de carbonato sódico y déjelo estabilizar durante 24 horas a temperatura ambiente.
- Dializar el producto mBG con agua desionizada utilizando una bolsa de diálisis en un vaso de precipitados (MWCO 10 kDa, 2 L) y conservarlo en forma de polvo liofilizado.
El porcentaje de rendimiento se calculó en 85% a través de la Ecuación 8.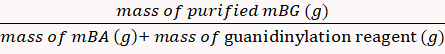 (8)
(8) - Disolver el polvo mBG en D2O en los tubos de RMN y caracterizarlo utilizando espectroscopia de resonancia magnética nuclear de 1H (1H RmN)16.
6. Preparación y caracterización de polipleplexs mBG/pDNA
- Disolver 50 g de PDNA en 50 ml de agua libre de RNase/DNase.
- Disolver 1 mg de copolímeros mBG en 1 ml de agua libre de RNase/DNase.
- Agregue la solución de copolímeros mBG directamente en la solución de pDNA de acuerdo con diferentes proporciones de alimentación, es decir, diferentes relaciones N/P (1:1, 4:1, 8:1, 16:1 y 32:1).
NOTA: La relación N/P se define como la relación molar del grupo de guanidina en el polímero y el grupo fosfato en pDNA, a saber, la relación molar de la cadena GPMA en el polímero y el mononucleótido en pDNA. La relación N/P se calcula de acuerdo con los pesos moleculares del nitrógeno amino (N) en mBG y el grupo de fosfato (P) en pDNA. - Mezcle las soluciones con un mezclador de vórtice y permítalas reposar durante 30 minutos a temperatura ambiente. Después de eso, disperse la mezcla en la solución tampón de fosfato (PBS, pH 7.4) y conserve los poliplexos mBG/pDNA obtenidos a 4 oC para los experimentos de seguimiento.
NOTA: El tamaño medio de las partículas y el potencial Zeta de mBG y los complejos se detectaron mediante la dispersión dinámica de la luz (DLS)17. - Diluir 10 l de las soluciones poliplex mBG/pDNA con 1 ml de PBS (pH 7.4) en las células de muestra potenciales de DLS y Zeta.
NOTA: El tamaño de las partículas y la detección del potencial de Zeta se realizaron tres veces y se tomó un promedio de los tres valores.
7. Experimento de retardo electroforético de polipleplexs mBG/pDNA
NOTA: Se llevó a cabo un experimento de retardo electroforético para determinar la relación de carga mínima.
- Tome cinco grupos de los polipleplexs mBG/pDNA con diferentes relaciones N/P (1:1, 4:1, 8:1, 16:1 y 32:1) que contienen 50 g de pDNA .
- Añadir búfer de carga de 6x a las muestras de poliplex mBG/pDNA a una concentración final de 1x.
- Añadir las soluciones a los geles de agarosa del 1,5% y ejecutar el gel a 90 mV durante 15 min, utilizando pDNA como control.
- Tome fotos de los geles usando un imager de gel.
8. Citotoxicidad de los poliplexos mBG/pDNA
- Seed MCF-7 células en las placas de 96 pocillos a una densidad de 104 células por pozo. A continuación, el cultivo de las células durante 12 h utilizando medio DMEM (10% FBS y1% antibiótico) en una incubadora humidificada de 37 oC suministrada con 5% de CO2.
- Sustituya el medio de cultivo por medios de cultivo DMEM libres de antibióticos que contengan un 10% de suero bovino fetal (FBS) y polipleplexs mBG/pDNA de diferentes relaciones de carga (N/P 4, 8, 16 y 32, n-6) durante 6 h, tomando las células añadidas con volúmenes iguales de solución de PBS como control. A continuación, sustituya el medio de cultivo por 150 ml de medio fresco 1640 y vuelva a cultivar las células durante 24 h.
- Añadir 5 mg/mL 3-(4,5-dimethylthiazol-2-yl)-2,5-difenittrazolium bromuro (MTT) solución (20 l /pozo) a las placas de 96 pocillos y seguir cultivando las células durante 4 h.
- Retire la solución y agregue 150 s de DMSO a cada poca y agite las placas de 96 pocillos 30 s.
- Mida la densidad óptica (OD) a 490 nm con un lector de microplacas para mostrar la viabilidad celular. Calcule el porcentaje de viabilidad de la celda de acuerdo con la Ecuación 9.
Viabilidad celular % s (9)
s (9)
9. Eficiencia de transfección de los poliplexos mBG/GFP-pDNA
- Disolver 50 g de PDNA que contiene el gen reportero proteína fluorescente verde (GFP) pDNA (GFP-pDNA) en 50 l de agua libre de RNase/DNase. A continuación, disolver 1 mg de copolímeros mBG en 1 ml de agua libre de RNase/DNase. Mezclar la solución pDNA y mBG a una relación de carga (N/P) de 1:1, 4:1, 8:1, 16:1 y 32:1 e incubar durante 30 min a temperatura ambiente. Disperse la solución de poliplexes mBG/GFP-pDNA utilizando ondas ultrasónicas (30 s) y guárdela a 4 oC para los experimentos de seguimiento.
NOTA: La relación N/P se calcula de acuerdo con los pesos moleculares del nitrógeno amino (N) en mBG y el grupo de fosfato (P) en pDNA . - Células de semilla MCF-7 a una densidad de 2 x 105 células por pocido en una placa de 6 pocillos y cultivarlas a 37 oC y 5% de CO2 en una incubadora humidificada durante 12 h.
- Sustituya el medio de cultivo por el medio de cultivo fresco que contiene poliplejeses mBG/GFP-pDNA de diferentes relaciones N/P (4, 8, 16 y 32) durante 6 h.
- Sustituya el medio por 2 ml de medio fresco RPMI1640 y cultivo por 48 h.
- Recoger las células y detectar la fluorescencia verde con un citómetro de flujo.
Resultados
El BNHEMA se alimentó de acuerdo con el grado objetivo de polimerización que se muestra en el Cuadro1; el procedimiento de síntesis de mBG se muestra en la Figura1. En primer lugar, el homopolímero BNHEMA se preparó a través del método reversible de transferencia de cadena de fragmentación de adición (RAFT) en el sistema de dioxano de agua, utilizando el ditiobenzoato de ácido 4-cianopentanoico como agente de transferencia de cadena. En segundo lugar, PBNHEMA se utilizó como agente de transferencia de cadena para preparar polímero de bloque BNHEMA-b-APMA. El monómero APMA se alimenta de acuerdo con el grado objetivo de polimerización mostrado en la Tabla1. Se llevó a cabo cromatografía de permeación en gel (GPC) para detectar el peso molecular de BA con diferentes proporciones de alimentación (Tabla 1). El contenido molar real de las cadenas APMA en BA con diferentes proporciones de alimentación se detectó mediante el método ninhydrin (Tabla 1). Según nuestro estudio anterior5, utilizamos mBG3 en el presente estudio porque tiene el contenido más alto de APMA. Finalmente, la metionina fue injertada en la cadena APMA y los grupos residuales de amina fueron completamente guanidinilados para preparar mBG. La Figura 2 es el dato de 1H NMR de mBG. El tamaño medio de partícula y el potencial Zeta de los polipleplexs mBG/pDNA fueron de 124 nmy +15,7 mV, respectivamente, en una relación N/P de 16 (Figura 3).
El retardo electroforético es una técnica rápida y sencilla que implica la separación de pDNA sin ataduras y el poliplex de copolímero/pDNA basado en diferencias en sus movilidades electroforéticas en geles de agarosa. La banda pDNA sin atar puede moverse en el gel de agarosa bajo la acción del campo eléctrico. En el experimento de retardoelectroforético (Figura 4), pDNA (con una relación N/P de 0) puede moverse sin restricciones en el gel de agarosa y se observó como una franja en el imager de gel. Cuando pDNA se complejo con mBG, el movimiento de pDNA se retrasa y posteriormente, el brillo de la banda se reduce. La Figura 4 muestra que mBG puede complejo completamente el pDNA cuando N/P es mayor que 4.
La citotoxicidad de los poliplexos mBG/pDNA se midió utilizando el ensayo MTT estándar (Figura5). Los resultados muestran que los polipleplexs mBG/pDNA tienen obviamente una citotoxicidad más baja que los polipleplexs PEI/pDNA en las relaciones N/P de 4, 8, 16 y 32 en la línea celular MCF-7 (p<0.05, n-3, ANOVA unidireccional). Además, la citotoxicidad de los poliplexos mBG/pDNA aumenta con un aumento de la relación N/P. El aumento de la citotoxicidad de los poliplexos mBG/pDNA con un aumento de N/P es el resultado del componente GPMA cargado positivamente. los polipleplexs mBG/pDNA mostraron menos citotoxicidad que los polipleplexs PEI/pDNA, que pueden atribuirse a la presencia de BNHEMA en los copolímeros que protegen la carga superficial de polímeros catiónicos.
La relación N/P utilizada en el experimento de transfección pDNA se seleccionó de acuerdo con los resultados de la citotoxicidad. Como se muestra en la Figura 6, las capacidades de transfección de mBG1, mBG2 y mBG3 se compararon midiendo la intensidad de la fluorescencia GFP y los resultados mostraron que mBG3 es el portador óptimo del gen. Aunque los polipleplexs PEI/pDNA con una relación N/P de 8 tienen una eficiencia de transfección similar a los poliplejes de mBG3/pDNA con una relación N/P de 32, PEI tiene mayor citotoxicidad y no tiene funciones como la carga de fármacos, lo que restringe su aplicación en el campo biomédico. Los resultados revelaron que el aumento del contenido de AMPA es clave para mejorar la eficiencia de transfección del copolímero mBG. Como mencionamos en unestudio anterior 5, los péptidos penetrantes celulares (CCP) son 9-35 péptidos mezcánicos o anfipáticos con una capacidad para penetrar la membrana celular. El grupo de guanidina es un CPP catiónico que se puede conjugar en un polímero para mejorar la transfección de polímero/pDNA poliplex a través de una vía transmembrana independiente de proteínas. Por lo tanto, el copolímero mBG integra ventajas relacionadas con los grupos de guanidina para la penetración celular y el componente BNHEMA para el blindaje, mostrando un gran potencial para la entrega eficaz de genes.
| Muestra | BHEMA -b-APMA | Mw | Pdi | |
| Valor teórico del contenido APMA (%) | Valor real del contenido de APMA (%) | |||
| BNHEMA90-b-APMA30(BA1) | 25% | 21% | 16200 | 1.25 |
| BNHEMA90-b-APMA60(BA2) | 40% | 37% | 20900 | 1.21 |
| BNHEMA90-b-APMA90(BA3) | 50% | 52% | 27200 | 1.25 |
Tabla 1: La composición de BNHEMA-b-APMA por polimerización RAFT.

Figura 1: Procedimiento de síntesis esquemática de mBG. Haga clic aquí para ver una versión más grande de esta figura.
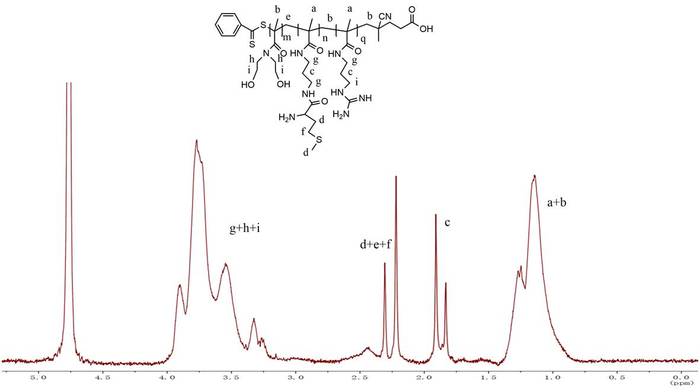
Figura 2: 1espectros de RMN H de mBG en D2O. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Tamaño de partícula y potencial Zeta de los poliplexos.
(A) El tamaño de partícula de BA/pDNA. (B) El tamaño de partícula de mBG/pDNA. (C) Potencial Zeta de BA/pDNA. (D) Potencial Zeta de mBG/pDNA. Haga clic aquí para ver una versión más grande de esta figura.
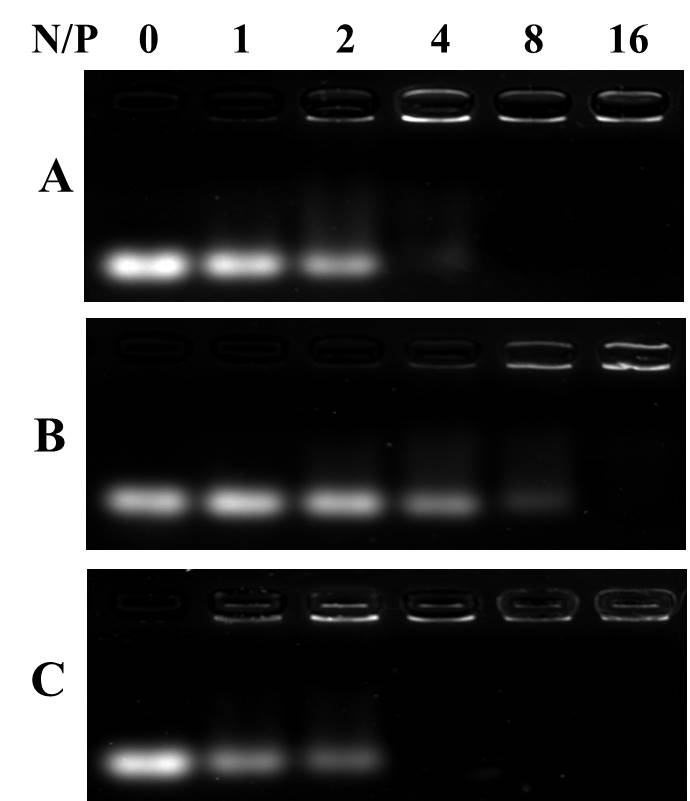
Figura 4: Imágenes de electroforesis de gel de agarosa de BA3
(a ) , mBA3 (b) y mBG3 (c) polipleplexes con diferentes relaciones de carga.

Figura 5: Citotoxicidad de los poliplexos mBG/pDNA en diferentes relaciones N/P en la línea celular MCF7.
PEI/pDNA polyplex se utilizó como control. Los datos se mostraron como medias - SD (n.o 3). * indica p<0.05 en comparación con el grupo PEI. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: La eficiencia de transfección de los poliplexos mBG/pDNA a una relación N/P de 4, 8, 16 y 32 se midió por el citómetro de flujo.
Los datos se mostraron como medias de SD (n.o 3). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este estudio introdujo una serie de portadores de genes catiónicos de polímero de bloque BNHEMA-b-APMA. Estos polímeros de bloque se sintetizaron a través del método reversible de transferencia de cadena de adición-fragmentación (RAFT). El segmento hidrófilo BNHEMA se introdujo para mejorar la solubilidad. Se modificaron los grupos de metionina y guanidina paramejorar la capacidad objetivo y la eficiencia de transfección 5. El contenido de la cadena APMA aumentó y la guanidinilación en copolímero mBG redujo el tamaño de partícula de los poliplexos mBG/pDNA. El tamaño de las partículas y el potencial de superficie hacen que el complejo sea fácil de atravesar la membrana celular y aplicable a la transfección. Los puntos críticos en el experimento radican en controlar estrictamente la relación molar del monómero BNHEMA y CTP a 45:1, la relación molar de CTP y ACVA a 2:1, y la temperatura a 70 oC. Durante el proceso de purificación, la relación de volumen de la acetona preenfriada y la solución de polímero debe ser superior a 50:1.
Con el mismo valor N/P, junto con el aumento de la proporción de la cadena APMA, el tamaño de partícula de los poliplexos mBG/pDNA disminuye. Estos resultados indican que el aumento del contenido de la cadena APMA y la guanidinilación pueden reducir el tamaño de las partículas. El tamaño de las partículas y el potencial de superficie hacen que el complejo sea fácil de transportar a través de la membrana celular y aplicable a la transfección. La electroforesis de gel se utilizó para investigar la relación entre la complejidad y la relación N/P y los datos mostraron que el N/P mínimo es 4. Este estudio proporcionará valiosos datos básicos para el estudio posterior de los portadores de genes catiónicos. Sin embargo, BNHEMA-b-APMA no se degrada fácilmente y su proceso de metabolismo in vivo no es lo suficientemente claro. Por lo tanto, la aplicación clínica sigue siendo un gran desafío para los portadores de genes de polímerocaticos.
Alta eficiencia y baja toxicidad de los portadores de genes son las condiciones necesarias para su uso clínico. Los vectores genéticos de polímero catiónicos tienen ventajas de buena estabilidad y sin inmunogenicidad y se pueden preparar y modificar fácilmente.
La polimerización RAFT se utiliza ampliamente en la polimerización de monómeros incluyendo estireno, metacrilato, acrilonitrilo y acrilamida. Este tipo de proceso de polimerización se puede llevar a cabo a baja temperatura. Además, la polimerización RAFT se puede utilizar para sintetizar polímeros de estructuras finas. La polimerización RAFT descrita en este protocolo se considera uno de los métodos potenciales más prometedores para la preparación de polímeros biomédicos.
Divulgaciones
Los autores certifican que no hay conflicto de intereses con ninguna organización financiera con respecto al material discutido en este artículo.
Agradecimientos
Esta investigación fue apoyada por el Programa Nacional De Investigación y Desarrollo Clave de China (No. 2016YFC0905900), National Natural Science Foundation of China (Nos. 81801827, 81872365), Basic Research Program of Jiangsu Province (Fundación de Ciencias Naturales, No. BK20181086), y el Fondo de Investigación Científica del Hospital del Cáncer de Jiangsu (No. ZK201605).
Materiales
| Name | Company | Catalog Number | Comments |
| 1-hydroxybenzotriazole | Macklin Biochemical Co., Ltd,China | H810970 | ≥97.0% |
| 1,4-dioxane | Sinopharm chemical reagent Co., Ltd, China | 10008918 | AR |
| 1-amidinopyrazole Hydrochloride | Aladdin Co., Ltd., China | A107935 | 98% |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Aladdin Co., Ltd., China | E106172 | AR |
| 4,4’-azobis(4-cyanovaleric acid) | Aladdin Co., Ltd., China | A106307 | Analytical reagent (AR) |
| 4-cyano-4-(phenylcarbonothioylthio)pentanoic Acid | Aladdin Co., Ltd., China | C132316 | >97%(HPLC) |
| Acetate | Sinopharm chemical reagent Co., Ltd, China | 81014818 | AR |
| Acetone | Sinopharm chemical reagent Co., Ltd, China | 10000418 | AR |
| Agarose | Aladdin Co., Ltd., China | A118881 | High resolution |
| Ascorbic acid | Aladdin Co., Ltd., China | A103533 | AR |
| DMSO | Aladdin Co., Ltd., China | D103272 | AR |
| Ethylene glycol | Aladdin Co., Ltd., China | E103319 | AR |
| N-(3-aminopropyl)methacrylamide hydrochloride | Aladdin Co., Ltd., China | N129096 | ≥98.0%(HPLC) |
| N,N-bis(2-hydroxyethyl)methacrylamide | ZaiQi Bio-Tech Co.,Ltd, China | CF259748 | ≥98.0%(HPLC) |
| Ninhydrin | Aladdin Co., Ltd., China | N105629 | AR |
| PBS buffer | Aladdin Co., Ltd., China | P196986 | pH 7.4 |
| Plasmid DNA | BIOGOT Co., Ltd, China | pDNA-EGFP | pDNA-EGFP |
| Plasmid DNA | BIOGOT Co., Ltd, China | Pdna | pDNA |
| Sodium carbonate decahydrate | Aladdin Co., Ltd., China | S112589 | AR |
| Trimethylamine | Aladdin Co., Ltd., China | T103285 | AR |
Referencias
- Flotte, T. R. Gene and Cell Therapy in 2018: A Look Ahead. Human Gene Therapy. 29, 1-1 (2018).
- Huang, W., et al. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs. Advanced Drug Delivery Reviews. 115, 82-97 (2017).
- Wu, Y., et al. Reversing of multidrug resistance breast cancer by co-delivery of P-gp siRNA and doxorubicin via folic acid-modified core-shell nanomicelles. Colloids & Surfaces B Biointerfaces. 138, 60-69 (2016).
- Quader, S., Kataoka, K. Nanomaterial-Enabled Cancer Therapy. Molecular Therapy. 25, 1501-1513 (2017).
- Wu, Y., et al. Multivalent methionine-functionalized biocompatible block copolymers for targeted siRNA delivery and subsequent reversal effect on adriamycin resistance in human breast cancer cell line MCF-7/ADR. Journal of Gene Medicine. 19, e2969 (2017).
- Szwarc, M. ‘Living’ Polymers. Nature. 178, 168-169 (1956).
- Szwarc, M., Rembaum, A. Polymerization of methyl methacrylate initiated by an electron transfer to the monomer. Journal of Polymer Science. 22 (100), 189-191 (1956).
- Mukhopadhyay, R. D., Ajayaghosh, A. Living supramolecular polymerization. Science. 349, 241 (2015).
- Ozkose, U. U., Altinkok, C., Yilmaz, O., Alpturk, O., Tasdelen, M. A. In-situ preparation of poly(2-ethyl-2-oxazoline)/clay nanocomposites via living cationic ring-opening polymerization. European Polymer Journal. 88, 586-593 (2017).
- Wu, W., Wang, W., Li, J. Star polymers: Advances in biomedical applications. Progress in Polymer Science. 46, 55-85 (2015).
- Boyer, C., et al. Copper-Mediated Living Radical Polymerization (Atom Transfer Radical Polymerization and Copper(0) Mediated Polymerization): From Fundamentals to Bioapplications. Chemical Reviews. 116, 1803-1949 (2016).
- Keddie, D. J. A guide to the synthesis of block copolymers using reversible-addition fragmentation chain transfer (RAFT) polymerization. Chemical Society Reviews. 43, 496-505 (2014).
- Wu, Y., et al. Guanidinylated 3-gluconamidopropyl methacrylamide-s-3-aminopropyl methacrylamide copolymer as siRNA carriers for inhibiting human telomerase reverse transcriptase expression. Drug Delivery. 20, 296-305 (2013).
- Qin, Z., Liu, W., Guo, L., Li, X. Studies on Guanidinated N-3-Aminopropyl Methacrylamide-N-2-Hydroxypropyl Methacrylamide Co-polymers as Gene Delivery Carrier. Journal of Biomaterials Science, Polymer Edition. 23, 1-4 (2012).
- Friedman, M. Applications of the Ninhydrin Reaction for Analysis of Amino Acids, Peptides, and Proteins to Agricultural and Biomedical Sciences. Journal of Agricultural and Food Chemistry. 52, 385-406 (2004).
- Habuchi, S., Yamamoto, T., Tezuka, Y. Synthesis of Cyclic Polymers and Characterization of Their Diffusive Motion in the Melt State at the Single Molecule Level. Journal of Visualized Experiments. (115), 1-9 (2016).
- Rao, D. A., Nguyen, D. X., Mishra, G. P., Doddapaneni, B. S., Alani, A. W. Preparation and Characterization of Individual and Multi-drug Loaded Physically Entrapped Polymeric Micelles. Journal of Visualized Experiments. 102, 1-5 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados