Method Article
Meticolosina Sistemi colatori di blocchi biocompatibili per la consegna mirata del DNA plasmide
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo lavoro presenta la preparazione di copolimeri a blocchi biocompatibili funzionalizzati di methionina (mBG) tramite il metodo RAFT (reversibile addometto-frammentazione a catena di trasferimento). Sono state studiate anche la capacità di complessire il DNA plasmide del mBG ottenuto e la loro efficienza di trasfezione. Il metodo RAFT è molto utile per polimerizzare i monomeri contenenti gruppi funzionali speciali.
Abstract
La polimerizzazione reversibile della catena di addizione (RAFT) integra i vantaggi della polimerizzazione radicale e della polimerizzazione vivente. Questo lavoro presenta la preparazione di copolimeri a blocchi biocompatibili funzionalizzati di methionina tramite la polimerizzazione RAFT. In primo luogo, N,N-bis(2-idxyethyl)methacrylamide-b-N-(3-aminopropyl)methacrylamide (BNHEMA-b-APMA, BA) è stato sintetizzato tramite la polimerizzazione RAFT utilizzando 4,4'-azobis(4-cyanovaleric acid) (ACVA) come l'agente di incapacità e il dithiobenzoate (CTP) dell'acido a catena (CTP) come agente di trasferimento a catena. Successivamente, N,N-bis(2-hydroxyethyl)methacrylamide-b-N-(3-guanididinopropyl)methacrylamide (methionina innegio BNHEMA-b-GPMA, mBG) è stato preparato modificando i gruppi di ammine in APMA con methionina e guanidine Gruppi. Tre tipi di polimeri a blocchi, mBG1, mBG2 e mBG3, sono stati sintetizzati per il confronto. Una reazione ninhydrin è stata utilizzata per quantificare il contenuto di APMA; mBG1, mBG2 e mBG3 avevano rispettivamente il 21%, il 37% e il 52% di APMA. I risultati della cromatografia permeazione del gel (GPC) hanno mostrato che i copolimeri BA possiedono pesi molecolari di 16.200 (BA1), 20.900 (BA2) e 27.200 (BA3) g/mol. È stata studiata anche la capacità complessa del DNA plasmide (pDNA) dei portatori genici del copolimero del blocco ottenuto. I rapporti di carica (N/P) erano rispettivamente 8, 16 e 4 quando il pDNA era completamente complesso con mBG1, mBG2, mBG3. Quando il rapporto N/P dei polimes mBG/pDNA era superiore a 1, il potenziale di mBG era positivo. Con un rapporto N/P compreso tra 16 e 32, la dimensione media delle particelle dei poliplex mBG/pDNA era compresa tra 100-200 nm. Nel complesso, questo lavoro illustra un protocollo semplice e conveniente per la sintesi del vettore di copolimeri a blocchi.
Introduzione
Negli ultimi anni, la terapia genica è emersa per la somministrazione terapeutica di acidi nucleici come farmaci per trattare tutti i tipi di malattie1. Lo sviluppo di farmaci genici, tra cui DNA plasmide (pDNA) e piccolo RNA interferente (siRNA) si basa sulla stabilità e l'efficienza del sistema di somministrazione di farmaci (DDS)2. Tra tutti i DDS, i portatori di polimeri cationici hanno i vantaggi di una buona stabilità, bassa immunogenicità e facile preparazione e modifica, che danno ai vettori polimerici cationici ampie prospettive di applicazione3,4. Per le applicazioni pratiche in biomedicina, i ricercatori devono trovare un vettore di polimeri cationici con alta efficienza, bassa tossicità e buona capacità di targeting5. Tra tutti i portatori di polimeri, i copolimeri a blocchi sono uno dei sistemi di somministrazione di farmaci più utilizzati. I copolimeri a blocchi sono studiati intensamente per la loro proprietà di auto-assemblaggio e le capacità di formare micelle, microsfere e nanoparticelle nella somministrazione di farmaci5. I copolimeri a blocchi possono essere sintetizzati tramite polimerizzazione vivente o metodi chimici click.
Nel 1956, Szwarc ealtri. Da allora, sono state sviluppate più tecniche per sintetizzare polimeri utilizzando questo metodo; così, la polimerizzazione vivente è vista come una pietra miliare della scienza dei polimeri8. La polimerizzazione vivente può essere classificata in polimerizzazione anionica vivente, polimerizzazione cationica vivente e polimerizzazione radicale di disattivazione reversibile (RDRP)9. Le polimerizzazioni anionica/cationica viventi hanno una portata di applicazione limitata a causa delle loro rigide condizioni di reazione10. La polimerizzazione radicale controllata/vivente (CRP) ha condizioni di reazione mite, disposizione conveniente e buona resa ed è stata quindi un importante centro di ricerca negli ultimi anni11. Nella CRP, le catene di propagazione attiva sono reversibilmente passivate in quelle dorate per ridurre la concentrazione di radicali liberi ed evitare la reazione bimolecolare della propagazione dei radicali a catena. La polimerizzazione di addizione può continuare solo se le catene di propagazione dormienti inattive sono animate reversibilmente in radicali a catena. Essendo una delle forme più promettenti di polimerizzazione radicale vivente, la polimerizzazione reversibile della catena di addizione-frammentazione (RAFT) è un metodo applicabile ai polimeri a blocchi con peso molecolare controllato e struttura, peso molecolare ridotto distribuzione e il trasporto di gruppi funzionali12. La chiave per una polimerizzazione RAFT di successo è l'effetto degli agenti di trasferimento a catena, di solito dithioesters, che possiedono una costante di trasferimento a catena molto alta.
In questo documento, un metodo di polimerizzazione RAFT è stato progettato per preparare il polimero a blocchi BNHEMA-b-APMA, prendendo 4,4'-azobis (4-cyanovaleric acid) (ACVA) come agente di lancio della catena e 4-cianopentanoico dithiobenzoate (CTP) come agente di trasferimento a catena. La polimerizzazione RAFT è stata usata due volte per introdurre BNHEMA nei portatori di polimeri cationici. Successivamente, i gruppi di ammine nella catena APMA sono stati modificati con la methionina e il reagente di guanidinylation 1-amidinopyrazole idroclororuro. Facendo l'uso delle cariche positive del reagente di guanidinylation e della struttura scheletro di polimeri methacrilimide, l'efficienza di assorbimento cellulare dei portatori di polimeri a blocchi ottenuti è stata migliorata.
Protocollo
1. Sintesi del polimero BNHEMA (PBNHEMA)
- Sciogliere 1,87 g di N, N-bis(2-hydroxyethyl)methacrylamide (BNHEMA) in 1 mL di acqua distillata in una bottiglia di polimerizzazione.
NOTA: La bottiglia di polimerizzazione è una boraltà dal fondo rotondo con un tappo di gomma e un agitatore magnetico. - Sciogliere 0,03 g di 4-cianopentanoico dithiobenzoate (CTP) e 0,02 g di 4,4'-azobis (4-cyanovalericacid ) (ACVA) in 0,5 mL di 1,4-dioxane in un becher 5 mL. Quindi, aggiungere la soluzione CTP e ACVA alla bottiglia di polimerizzazione dal passaggio 1.1.
- Ventilate il sistema di reazione nella bottiglia di polimerizzazione con azoto attraverso tre cicli di congelamento-pompa-scongelamento.
- Nel dettaglio, congelare la soluzione nella bottiglia di polimerizzazione utilizzando una trappola a condensa, fissare la bottiglia di polimerizzazione al supporto di ferro e aspirare e iniettare azoto nella miscela di reazione tramite un condotto con una punta con ago (#9 ago, diametro interno 0,65 mm, diametro esterno 0,9 mm). Sigillare la bottiglia di polimerizzazione e scongelare la soluzione a temperatura ambiente per 30 min.
- Ripetere i cicli di congelamento-pompa-scongelamento tre volte.
- Mettere la bottiglia di polimerizzazione in un bagno d'olio da 70 gradi centigradi e lasciare che la soluzione reagisca per 24 ore sotto l'atmosfera di azoto.
- Raffreddare la bottiglia di polimerizzazione a 0 gradi centigradi e aprire il tappo di gomma per terminare il processo di polimerizzazione.
- Precool acetone in un frigorifero -20 gradi C per 2 h e poi mescolare con la soluzione di reazione del passo 1.5 a 50:1 (v/v). Dopo di che, centrifugare a 8.200 x g per 10 min per rimuovere l'acetone e raccogliere il precipitato.
- Per purificare il PBNHEMA sintetizzato, sciogliere il precipitato raccolto in 2 mL di acqua pura e mescolare con 100 mL di acetone preraffreddato, al rapporto di 1:50 (v/v). Centrifugare la soluzione a 8.200 x g per 10 min e raccogliere il precipitato. Ripetere questo processo tre volte.
- Asciugare il PBNHEMA prodotto utilizzando un essiccatore a vuoto da 50 c. Una volta essiccata, pesare la polvere con un equilibrio. Calcolare il tasso di rendimento in base all'equazione 1.
 (1)
(1)
NOTA: In questo esperimento, il rendimento ottenuto è stato del 77,2%.
2. Sintesi del polimero BNHEMA-b-APMA (BA)
- Sciogliere 0,96 g di N-(3-aminopropyl)methacrylamide cloruro (APMA) e 0,93 g di PBNHEMA in 5 mL di acqua distillata in un becher da 10 mL.
- Sciogliere 0,01 g di 4,4 azobis (4-acido cianovalerico) (ACVA) in 0,5 mL di 1,4 dioxane e mescolare con la soluzione APMA-PBNHEMA dalla parte 2.1.
- Trasferire la miscela in una bottiglia di polimerizzazione e ventilare con azoto secco per 1 h.
- Mettere la bottiglia di polimerizzazione in un bagno d'olio di 70 gradi centigradi e lasciarla reagire per 24 ore sotto l'atmosfera di azoto.
- Raffreddare la bottiglia di polimerizzazione a 0 gradi centigradi e aprire il tappo di gomma per terminare il processo di polimerizzazione.
- Trasferire la soluzione nell'acetone refrigerato dal punto 1.6, quindi centrifugare la soluzione a 8.200 x g per 10 min per far precipitare il BA.
- Sciogliere il BA in 2 mL di acqua distillata e far precipitare il polimero in acetone refrigerato. Ripetere tre volte.
- Asciugare il BA prodotto in un aspirapolvere a 50 gradi centigradi e pesare la polvere ottenuta. Calcolare il tasso di rendimento in base all'equazione 2.

NOTA: In questo esperimento, il tasso di rendimento è stato calcolato all'82,0%.
3. Determinare la percentuale di talpa di APMA nel copolimero BA tramite il metodo ninhydrin
NOTA: La spettrofotometria viene utilizzata per determinare il contenuto degli amminoacidi multicomponente. Il principio è una reazione di colore di ninhydrin e aminoacidi dove l'assorbimento è correlata con il contenuto di aminoacidi in una certa misura13,14.
- Sciogliere 5 g di ninhydrin in 125 mL di acqua distillata bollente. Inoltre, sciogliere 5 g di vitamina C in 250 mL di acqua distillata calda. Aggiungere i 250 mL di soluzione di vitamina C gocciola sulla soluzione ninhydrin sotto agitazione magnetica. Continuare a mescolare per 15 min e poi raffreddare la soluzione di reazione in un frigorifero di 4 gradi centigradi.
- Togliere la soluzione dal frigorifero e filtrare per aspirazione utilizzando un imbuto Buchner per ottenere una riduzione del ninhydrin. Raccogliere il precipitato e conservarlo in un disidratore di penossido di fosforo.
- Sciogliere 85 mg di ninhydrin e 15 mg di ninhydrin ridotto in 10 mL di etere monometile di legalene etilene per preparare la soluzione di colorazione ninhydrin.
NOTA: La soluzione di colorazione Ninhydrin può reagire con l'ammastro di z nell'APMA e formare un composto viola con una struttura come descritto in uno studio precedente15. - Diluire 1 mL di 0, 1, 10, 100, 1.000 soluzioni monomeriche APMA mg/mL con 1 mL di buffer di acetato (2 M, pH 5.4), quindi aggiungere 1 mL di soluzione di colorazione ninhydrin, rispettivamente.
- Riscaldare le miscele per 15 minuti in un bagno d'acqua bollente e poi raffreddarle con acqua corrente. Lasciare che le soluzioni si siedano per 5-10 min e diluirle con 3 mL di alcool etilico del 60% e mescolarle accuratamente. Misurare l'assorbimento a 570 nm utilizzando uno spettrometro e disegnare la curva standard (Equazione 3).

NOTA: L'equazione 3 è stata derivata dal raccordo lineare dell'assorbimento a 570 nm rispetto alla concentrazione APMA. - Sciogliere 0,01 g di BA in 1 mL di acqua distillata; aggiungere 1 mL di buffer di acetato (2 M, pH 5.4) e 1 mL di soluzione colorante ninhydrin. Calcolare il contenuto molare di APMA in base all'assorbimento a 570 nm.

 (5)
(5)
NOTA: le formule di calcolo sono le seguenti (Equazioni 3-6).
4. Sintesi di methionina innesto ba polimero (mBA)
- Sciogliere 8,9 mg di Fomc-Methionine in 5 mL di DMSO in una fiaschetta di recupero.
- Aggiungere 6,92 mg di 1-ethyl-3-(3-dimethylaminopropyl ) carbodiimide hydrocloride (EDCl) e 4,86 mg di 1-idrossibenzotriazolo (HOBT) al pallone di recupero e reagire a 0 gradi centigradi per 0,5 h.
- Sciogliere 2,59 g di BA in 5 mL di soluzione DMSO e quindi aggiungere 50 -L di trimetilamina; aggiungere questa soluzione dropwise al pallone di recupero (passaggio 4.2) e lasciare che la soluzione reagisca per 0,5 h a temperatura ambiente.
- Dialyze per rimuovere DMSO e trimethylamine dalla soluzione BA nel passaggio 4.3 utilizzando un sacchetto di dialisi (MWCO 10 kDa) in un becher 2 L per 24 h; sostituire l'acqua deionizzata ogni 6 h.
- Congelare l'mBA ottenuto e pesare per calcolare il tasso di resa secondo l'equazione 7.
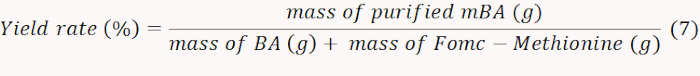
NOTA: In questo caso, il tasso di rendimento è stato determinato come 71%. - Quantificare l'NH2 contenente mBA misurando l'assorbimento a 570 nm per calcolare la quantità di methionina innestata. Calcolare il contenuto molare della methionina in base all'equazione 8.

5. Sintesi di guanidinata e mecredea coniugata BNHEMA-b-APMA polimero (mBG)
NOTA: sono stati sintetizzati tre diversi copolimeri mBA1, mBA2 e mBA3. Il polimero mBA3 viene utilizzato come esempio nei passaggi seguenti.
- Sciogliere mBA3 contenente 60 mol di aminoiniere in 5 mL di acqua pura.
NOTA: il contenuto dell'amminogruppo è stato quantificato utilizzando il metodo ninhydrin come descritto nel passaggio 3.5. - Sciogliere 40,6 mg (300 mmol) di guanidinylation reagente 1-amidinopyrazole cloruro nelle soluzioni mBA.
- Regolare il pH a 9,0 con la soluzione satura di carbonato di sodio e lasciarlo stabilizzare per 24 ore a temperatura ambiente.
- Diallyze il prodotto mBG con acqua deionizzata utilizzando un sacchetto di dialisi in un becher (MWCO 10 kDa, 2 L) e conservarlo sotto forma di polvere liofilizzata.
La percentuale di rendimento è stata calcolata all'85% tramite l'equazione 8.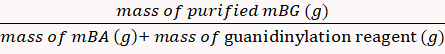 (8)
(8) - Sciogliere la polvere di mBG in D2O nei tubi NMR e caratterizzarla utilizzando laspettroscopia a risonanza magnetica nucleare 1 H (1H NMR)16.
6. Preparazione e caratterizzazione dei polimeghi mBG/pDNA
- Sciogliere 50 g di pDNA in 50 -L di acqua priva di RNase/DNase.
- Sciogliere 1 mg di copolimeri mBG in 1 mL di acqua senza RNase/DNase.
- Aggiungere la soluzione di copolimeri mBG direttamente nella soluzione pDNA in base a diversi rapporti di alimentazione, ovvero rapporti N/P diversi (1:1, 4:1, 8:1, 16:1 e 32:1).
NOTA: Il rapporto N/P è definito come il rapporto molare del gruppo di guanidina nel polimero e nel gruppo fosfato nel pDNA, vale a dire il rapporto molare della catena GPMA nel polimero e il mononucleotide nel pDNA. Il rapporto N/P è calcolato in base ai pesi molecolari dell'amminonitrogeno (N) nel gruppo mBG e fosfato (P) nel pDNA . - Mescolare le soluzioni con un miscelatore vortice e lasciarle riposare per 30 min a temperatura ambiente. Successivamente, disperdere la miscela in soluzione di buffer di fosfato (PBS, pH 7.4) e conservare i poliplex mBG/pDNA ottenuti a 4 gradi centigradi per gli esperimenti di follow-up.
NOTA: La dimensione media delle particelle e il potenziale di zeta di mBG e dei complessi sono stati rilevati utilizzando la dispersione dinamica della luce (DLS)17. - Diluire 10 l delle soluzioni mBG/pDNA polyplex con 1 mL di PBS (pH 7.4) nelle cellule campione di dLS e zeta.
NOTA: le dimensioni delle particelle e il rilevamento del potenziale di zeta sono stati eseguiti tre volte ed è stata presa una media dei tre valori.
7. Esperimento di ritardo elettroforetico di poliloro mBG/pDNA
NOTA: è stato condotto un esperimento di ritardo elettroforetico per determinare il rapporto di carica minimo.
- Prendere cinque gruppi di poliplex mBG/pDNA con diversi rapporti N/P (1:1, 4:1, 8:1, 16:1 e 32:1) contenenti 50 g di pDNA.
- Aggiungere il buffer di carico 6x ai campioni mBG/pDNA polyplex ad una concentrazione finale di 1x.
- Aggiungere le soluzioni ai gel di agarose 1.5% ed eseguire il gel a 90 mV per 15 min, utilizzando pDNA come controllo .
- Scattare foto dei gel utilizzando un imager gel.
8. Citotossicità dei polipi mBG/pDNA
- Seme MCF-7 cellule nelle piastre 96-pozzo ad una densità di 104 cellule per pozzo. Quindi, colture le cellule per 12 h utilizzando il mezzo DMEM (10% FBS e 1% antibiotico) in un'incubatrice umidizzata 37 C fornita con 5% di CO2.
- Sostituire il mezzo di coltura con mezzi di coltura DMEM senza antibiotici contenenti 10% siero bovino fetale (FBS) e poliplex mBG/pDNA con diversi rapporti di carica (N/P 4, 8, 16 e 32, n-6) per 6 h, prendendo cellule aggiunte con pari volumi di soluzione PBS come controllo. Quindi, sostituire il mezzo di coltura con 150 l di fresco 1640 medio e ulteriore coltura le cellule per 24 h.
- Aggiungere 5 mg/mL 3-(4,5-dimetilthiazole-2-yl)-2-5-diphenyltetrazolium bromuro (MTT) soluzione (20 l/po) alle piastre 96-pozze e ulteriore coltura le cellule per 4 h.
- Togliere la soluzione e aggiungere 150 l di DMSO ad ogni pozzo e agitare le piastre da 96 pozze 30 secondi.
- Misurare la densità ottica (OD) a 490 nm con un lettore di microplacino per mostrare la vitalità cellulare. Calcolare la percentuale di vitalità della cella in base all'equazione 9.
% di fattibilità cellulare (9)
(9)
9. Efficienza di trasfezione dei poliplex mBG/ GFP-pDNA
- Sciogliere 50 g di pDNA contenenti il gene reporter proteina fluorescente verde (GFP) pDNA (GFP-pDNA) in 50 -L di acqua senza RNase/DNase. Quindi sciogliere 1 mg di copolimeri mBG in 1 mL di acqua senza RNase/DNase. Mescolare la soluzione pDNA e mBG ad un rapporto di carica (N/P) di 1:1, 4:1, 8:1, 16:1 e 32:1 e incubare per 30 min a temperatura ambiente. Disperdere la soluzione di poliplex mBG/GFP-pDNA utilizzando onde ultrasoniche (30 s) e conservare a 4 gradi centigradi per gli esperimenti di follow-up.
NOTA: Il rapporto N/P è calcolato in base ai pesi molecolari dell'amminoato (N) nel gruppo mBG e fosfato (P) nel pDNA . - Seme MCF-7 cellule ad una densità di 2 x 105 cellule per pozzo in una piastra 6-po e coltura a 37 c e 5% CO2 in un'incubatrice umidificata per 12 h.
- Sostituire il mezzo di coltura con il nuovo mezzo di coltura contenente poliplex mBG/GFP-pDNA di diversi rapporti N/P (4, 8, 16 e 32) per 6 h.
- Sostituire il supporto con 2 mL di nuovo RPMI1640 medio e coltura per 48 h.
- Raccogliere le cellule e rilevare la fluorescenza verde con un citometro di flusso.
Risultati
La BNHEMA è stata alimentata in base al grado oggettivo di polimerizzazione mostrato nella tabella 1; la procedura di sintesi di mBG è illustrata nella Figura 1. In primo luogo, l'omopolimero BNHEMA è stato preparato tramite il metodo di trasferimento a catena reversibile di aggiunta-frammentazione (RAFT) nel sistema della diossiae ad acqua, utilizzando il dithiobenzoate a cotonico acido cianopen come agente di trasferimento a catena. In secondo luogo, PBNHEMA è stato utilizzato come agente di trasferimento a catena per preparare il polimero a blocchi BNHEMA-b-APMA. Il monomero APMA è stato alimentato in base al grado oggettivo di polimerizzazione mostrato nella Tabella 1. La cromatografia della permeazione del gel (GPC) è stata effettuata per rilevare il peso molecolare del BA con diversi rapporti di alimentazione (Tabella 1). L'effettivo contenuto molare delle catene APMA in BA con diversi rapporti di alimentazione è stato rilevato tramite il metodo ninhydrin (Tabella 1). Secondo il nostro studio precedente5, abbiamo usato mBG3 nel presente studio perché ha il più alto contenuto di APMA. Infine, la methionina è stata innestata nella catena APMA e i gruppi di amine residui sono stati completamente guanidinylati per preparare mBG. Figura 2 sono i dati NMR 1H di mBG. La dimensione media delle particelle e il potenziale di zeta dei poliplex mBG/pDNA erano rispettivamente di 124 nm e 15,7 mV, con un rapporto N/P di 16 (Figura 3).
Il ritardo elettroforetico è una tecnica rapida e semplice che prevede la separazione di pDNA non legato e polimero copolimer/pDNA in base alle differenze nelle loro mobilitazioni elettroforetiche nei gel di agarose. La fascia pDNA non legata può muoversi nel gel di agarose sotto l'azione del campo elettrico. Nell'esperimento di ritardo elettroforetico (Figura 4), il pDNA (con un rapporto N/P pari a 0) può muoversi senza moderazione nel gel di agarose ed è stato osservato come una striscia nell'imager gel. Quando il pDNA è complesso con mBG, il movimento del pDNA viene ritardato e successivamente, la luminosità della banda viene ridotta. La figura 4 mostra che mBG può complesso completamente il pDNA quando N/P è superiore a 4.
La citotossicità dei poliplex mBG/pDNA è stata misurata utilizzando l'analisi Standard MTT (Figura 5). I risultati mostrano che i polimesti mBG/pDNA hanno ovviamente una citotossicità inferiore rispetto ai polimesti PEI/pDNA ai rapporti N/P di 4, 8, 16 e 32 nella linea cellulare MCF-7 (p<0.05, n-3, ANOVA a senso unico). Inoltre, la citotossicità dei poliplex mBG/pDNA aumenta con un aumento del rapporto N/P. L'aumento della citotossicità dei poliplex mBG/pDNA con un aumento di N/P è il risultato del componente GPMA caricato positivamente. I poliplex mBG/pDNA hanno mostrato una minore citotossicità rispetto ai polimeschi PEI/pDNA, che possono essere attribuiti alla presenza di BNHEMA nei copolimeri che proteggono la carica superficiale dei polimeri cationici.
Il rapporto N/P utilizzato nell'esperimento di trasfezione pDNA è stato selezionato in base ai risultati della citotossicità. Come mostrato nella Figura 6, le capacità di trasfezione di mBG1, mBG2 e mBG3 sono state confrontate misurando l'intensità di fluorescenza GFP e i risultati hanno mostrato che mBG3 è il vettore genico ottimale. Anche se i polimesti PEI/pDNA con un rapporto N/P pari a 8 hanno un'efficienza di trasfezione simile a quella dei poliplex mBG3/pDNA con un rapporto N/P pari a 32, il PEI ha una maggiore citotossicità e non ha funzioni come il caricamento di farmaci, che limita la sua applicazione nel campo biomedico. I risultati hanno rivelato che l'aumento del contenuto di AMPA è fondamentale per migliorare l'efficienza della trasfezione del copolimero mBG. Come abbiamo detto in uno studio precedente5, peptidi penetranti cellulari (CpCP) sono 9-35 peptidi mer cationici o anfipati con la capacità di penetrare la membrana cellulare. Il gruppo di guanidina è un CPP cationico che può essere coniugato in un polimero per migliorare la trasfezione del polimero/pDNA poliplex attraverso un percorso transmembrana indipendente dalle proteine. Pertanto, il copolimero mBG integra vantaggi relativi ai gruppi di guanidina per la penetrazione delle cellule e al componente BNHEMA per la schermatura, mostrando un grande potenziale per una fornitura efficace del gene.
| campione | BHEMA -b-APMA | Mw | PDI | |
| Valore teorico del contenuto APMA (%) | Valore effettivo del contenuto APMA (%) | |||
| BNHEMA90-b-APMA30(BA1) | 25% | 21% | 16200 | 1.25 |
| BNHEMA90-b-APMA60(BA2) | 40% | 37% | 20900 | 1.21 |
| BNHEMA90-b-APMA90(BA3) | 50% | 52% | 27200 | 1.25 |
Tabella 1: La composizione di BNHEMA-b-APMA di polimerizzazione RAFT.

Figura 1: procedura di sintesi schematica di mBG. Fare clic qui per visualizzare una versione più grande di questa figura.
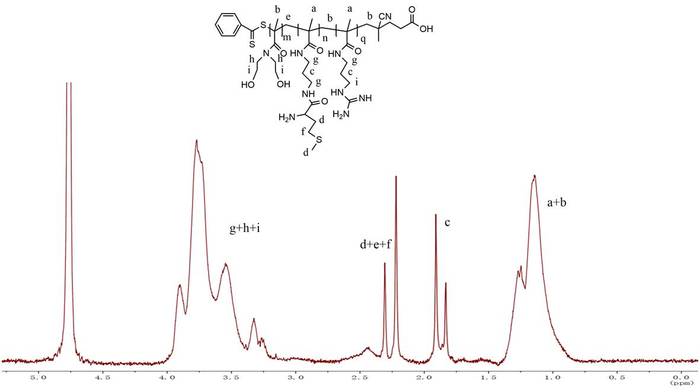
Figura 2: 1H spettri NMR di mBG in D2O. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Dimensioni delle particelle e potenziale zeta dei polimesti.
(A) La dimensione delle particelle di BA/pDNA. (B) La dimensione delle particelle di mBG/pDNA. (C) Potenziale di BA/pDNA. (( D) Potenziale di mBG/pDNA. Fare clic qui per visualizzare una versione più grande di questa figura.
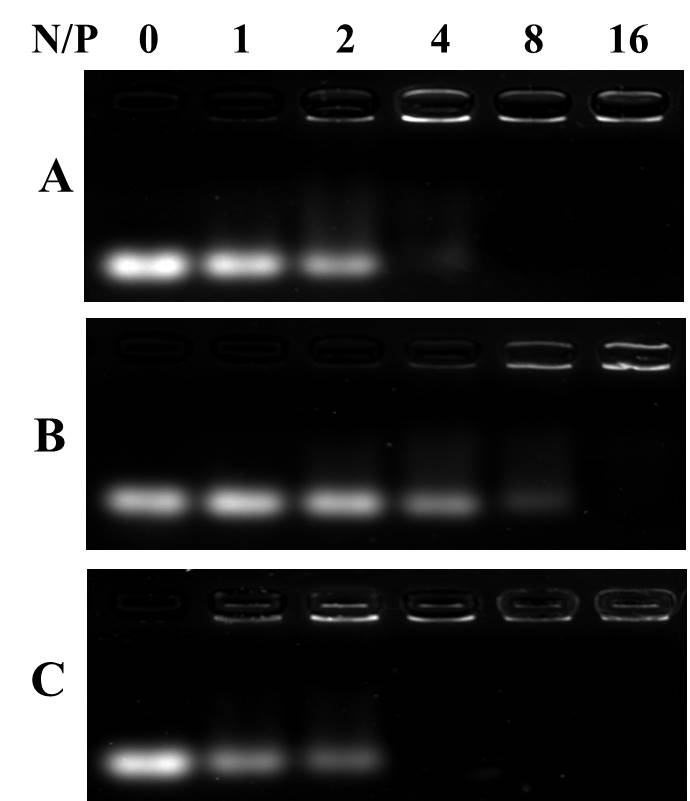
Figura 4: Immagini di elettroforesi gel Agarose di BA3
(a) , mBA3 (b) e mBG3 (c) poliplex con rapporti di carica diversi.

Figura 5: Citotossicità dei polipi mBG/pDNA a diverso rapporto N/P nella linea cellulare MCF7.
PEI/pDNA polyplex è stato utilizzato come controllo. I dati sono stati visualizzati come media : SD (n. 3). : indica p<0,05 rispetto al gruppo PEI. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: L'efficienza di trasfezione dei poliplex mBG/pDNA al rapporto N/P di 4, 8, 16 e 32 sono state misurate in base al citometro di flusso.
I dati sono stati mostrati come media : SD (n. 3). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo studio ha introdotto una serie di portatori genici polimerici a blocchi BNHEMA-b-APMA. Questi polimeri a blocchi sono stati sintetizzati tramite il metodo di trasferimento reversibile della catena di aggiunta-frammentazione (RAFT). Il segmento idrofilo BNHEMA è stato introdotto per migliorare la solubilità. I gruppi di methionina e guanidina sono stati modificati per migliorare l'abilità di destinazione e l'efficienza della trasfezione5. Il contenuto della catena APMA è aumentato e la guanidinylation nel copolimero mBG ha ridotto le dimensioni delle particelle dei poliplex mBG/pDNA. Le dimensioni delle particelle e il potenziale della superficie rendono il complesso facile da attraversare la membrana cellulare e applicabile alla trasfezione. I punti critici dell'esperimento si trovano nel controllare rigorosamente il rapporto molare del monomero BNHEMA e della CTP a 45:1, il rapporto molare di CTP e ACVA a 2:1 e la temperatura a 70 gradi centigradi. Durante il processo di purificazione, il rapporto di volume della soluzione preraffreddata di acetone e polimero deve essere superiore a 50:1.
Con lo stesso valore N/P, insieme all'aumento della proporzione della catena APMA, diminuisce la dimensione delle particelle dei poliplex mBG/pDNA. Questi risultati indicano che il contenuto della catena APMA aumenta e la guanidininazione può ridurre le dimensioni delle particelle. Le dimensioni delle particelle e il potenziale della superficie rendono il complesso facile da trasportare attraverso la membrana cellulare e applicabile alla trasfezione. L'elettroforesi gel è stata utilizzata per studiare la relazione tra il complesso e il rapporto N/P e i dati hanno mostrato che l'N/P minimo è 4. Questo studio fornirà preziosi dati di base per un ulteriore studio dei portatori genici cationici. Tuttavia, BNHEMA-b-APMA non è facilmente degradato e il suo processo di metabolismo in vivo non è abbastanza chiaro. Pertanto, l'applicazione clinica è ancora una grande sfida per i portatori di geni polimerici cationici.
L'elevata efficienza e la bassa tossicità dei portatori genici sono le condizioni necessarie per il loro uso clinico. I vettori genici dei polimeri cationici hanno vantaggi di una buona stabilità e nessuna immunogenicità e possono essere preparati e modificati facilmente.
La polimerizzazione RAFT è ampiamente utilizzata nella polimerizzazione di monomeri tra cui stirene, methacritla, acrilonitrile e acrilammide. Questo tipo di processo di polimerizzazione può essere effettuato a bassa temperatura. Inoltre, la polimerizzazione RAFT può essere utilizzata per sintetizzare polimeri di strutture fini. La polimerizzazione RAFT descritta in questo protocollo è considerata uno dei metodi potenziali più promettenti per la preparazione di polimeri biomedici.
Divulgazioni
Gli autori certificano che non vi è alcun conflitto di interessi con alcuna organizzazione finanziaria per quanto riguarda il materiale discusso in questo articolo.
Riconoscimenti
Questa ricerca è stata sostenuta dal National Key Research and Development Program of China (N. 2016YFC0905900), National Natural Science Foundation of China (N. 81801827, 81872365), Basic Research Program of Jiangsu Province (Natural Science Foundation, No. BK20181086), e Jiangsu Cancer Hospital Scientific Research Fund (n. K201605).
Materiali
| Name | Company | Catalog Number | Comments |
| 1-hydroxybenzotriazole | Macklin Biochemical Co., Ltd,China | H810970 | ≥97.0% |
| 1,4-dioxane | Sinopharm chemical reagent Co., Ltd, China | 10008918 | AR |
| 1-amidinopyrazole Hydrochloride | Aladdin Co., Ltd., China | A107935 | 98% |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Aladdin Co., Ltd., China | E106172 | AR |
| 4,4’-azobis(4-cyanovaleric acid) | Aladdin Co., Ltd., China | A106307 | Analytical reagent (AR) |
| 4-cyano-4-(phenylcarbonothioylthio)pentanoic Acid | Aladdin Co., Ltd., China | C132316 | >97%(HPLC) |
| Acetate | Sinopharm chemical reagent Co., Ltd, China | 81014818 | AR |
| Acetone | Sinopharm chemical reagent Co., Ltd, China | 10000418 | AR |
| Agarose | Aladdin Co., Ltd., China | A118881 | High resolution |
| Ascorbic acid | Aladdin Co., Ltd., China | A103533 | AR |
| DMSO | Aladdin Co., Ltd., China | D103272 | AR |
| Ethylene glycol | Aladdin Co., Ltd., China | E103319 | AR |
| N-(3-aminopropyl)methacrylamide hydrochloride | Aladdin Co., Ltd., China | N129096 | ≥98.0%(HPLC) |
| N,N-bis(2-hydroxyethyl)methacrylamide | ZaiQi Bio-Tech Co.,Ltd, China | CF259748 | ≥98.0%(HPLC) |
| Ninhydrin | Aladdin Co., Ltd., China | N105629 | AR |
| PBS buffer | Aladdin Co., Ltd., China | P196986 | pH 7.4 |
| Plasmid DNA | BIOGOT Co., Ltd, China | pDNA-EGFP | pDNA-EGFP |
| Plasmid DNA | BIOGOT Co., Ltd, China | Pdna | pDNA |
| Sodium carbonate decahydrate | Aladdin Co., Ltd., China | S112589 | AR |
| Trimethylamine | Aladdin Co., Ltd., China | T103285 | AR |
Riferimenti
- Flotte, T. R. Gene and Cell Therapy in 2018: A Look Ahead. Human Gene Therapy. 29, 1-1 (2018).
- Huang, W., et al. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs. Advanced Drug Delivery Reviews. 115, 82-97 (2017).
- Wu, Y., et al. Reversing of multidrug resistance breast cancer by co-delivery of P-gp siRNA and doxorubicin via folic acid-modified core-shell nanomicelles. Colloids & Surfaces B Biointerfaces. 138, 60-69 (2016).
- Quader, S., Kataoka, K. Nanomaterial-Enabled Cancer Therapy. Molecular Therapy. 25, 1501-1513 (2017).
- Wu, Y., et al. Multivalent methionine-functionalized biocompatible block copolymers for targeted siRNA delivery and subsequent reversal effect on adriamycin resistance in human breast cancer cell line MCF-7/ADR. Journal of Gene Medicine. 19, e2969 (2017).
- Szwarc, M. ‘Living’ Polymers. Nature. 178, 168-169 (1956).
- Szwarc, M., Rembaum, A. Polymerization of methyl methacrylate initiated by an electron transfer to the monomer. Journal of Polymer Science. 22 (100), 189-191 (1956).
- Mukhopadhyay, R. D., Ajayaghosh, A. Living supramolecular polymerization. Science. 349, 241 (2015).
- Ozkose, U. U., Altinkok, C., Yilmaz, O., Alpturk, O., Tasdelen, M. A. In-situ preparation of poly(2-ethyl-2-oxazoline)/clay nanocomposites via living cationic ring-opening polymerization. European Polymer Journal. 88, 586-593 (2017).
- Wu, W., Wang, W., Li, J. Star polymers: Advances in biomedical applications. Progress in Polymer Science. 46, 55-85 (2015).
- Boyer, C., et al. Copper-Mediated Living Radical Polymerization (Atom Transfer Radical Polymerization and Copper(0) Mediated Polymerization): From Fundamentals to Bioapplications. Chemical Reviews. 116, 1803-1949 (2016).
- Keddie, D. J. A guide to the synthesis of block copolymers using reversible-addition fragmentation chain transfer (RAFT) polymerization. Chemical Society Reviews. 43, 496-505 (2014).
- Wu, Y., et al. Guanidinylated 3-gluconamidopropyl methacrylamide-s-3-aminopropyl methacrylamide copolymer as siRNA carriers for inhibiting human telomerase reverse transcriptase expression. Drug Delivery. 20, 296-305 (2013).
- Qin, Z., Liu, W., Guo, L., Li, X. Studies on Guanidinated N-3-Aminopropyl Methacrylamide-N-2-Hydroxypropyl Methacrylamide Co-polymers as Gene Delivery Carrier. Journal of Biomaterials Science, Polymer Edition. 23, 1-4 (2012).
- Friedman, M. Applications of the Ninhydrin Reaction for Analysis of Amino Acids, Peptides, and Proteins to Agricultural and Biomedical Sciences. Journal of Agricultural and Food Chemistry. 52, 385-406 (2004).
- Habuchi, S., Yamamoto, T., Tezuka, Y. Synthesis of Cyclic Polymers and Characterization of Their Diffusive Motion in the Melt State at the Single Molecule Level. Journal of Visualized Experiments. (115), 1-9 (2016).
- Rao, D. A., Nguyen, D. X., Mishra, G. P., Doddapaneni, B. S., Alani, A. W. Preparation and Characterization of Individual and Multi-drug Loaded Physically Entrapped Polymeric Micelles. Journal of Visualized Experiments. 102, 1-5 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon