Method Article
Imunização do adulto Zebrafish para o rastreio pré-clínica de vacinas baseadas em DNA
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui descrevemos um protocolo para a imunização do adulto peixe-zebra (Danio rerio) com uma vacina baseada em DNA e demonstrar a validação de um evento de sucesso da vacinação. Este método é adequado para o rastreio pré-clínico de candidatos vacinais em vários modelos de infecção.
Resumo
O interesse na vacinação baseada em DNA aumentou durante as últimas duas décadas. Vacinação de DNA baseia-se sobre a clonagem de uma sequência de um antígeno selecionado ou uma combinação de antígenos em um plasmídeo, que permite que um projeto sob medido e seguro. A administração de vacinas de DNA em células hospedeiras conduz à expressão de antígenos que estimulam respostas de imune humorais e celular mediada. Este relatório descreve um protocolo para a clonagem de sequências de antígeno no plasmídeo pCMV-EGFP, a imunização de adultos do zebrafish com os candidatos de vacina por microinjeção intramuscular e o subsequente electroporation para melhorar a ingestão. Os antígenos da vacina são expressos como proteína verde fluorescente (GFP)-proteínas da fusão, que permite a confirmação da expressão do antígeno sob luz de peixes vivos e a quantificação dos níveis de expressão da proteína de fusão com ELISA, também como UV sua detecção com uma análise ocidental do borrão. O efeito protetor dos candidatos a vacina é testado por infectar os peixes com Mycobacterium marinum postvaccination de cinco semanas, seguido pela quantificação das bactérias com qPCR quatro semanas mais tarde. Em relação aos modelos de rastreio pré-clínico mamíferos, este método fornece um método de baixo custo para o rastreio preliminar dos candidatos de romance vacina baseada em DNA contra uma infecção micobacteriana. O método pode ser aplicado mais de triagem baseado em DNA vacinas contra várias doenças bacterianas e virais.
Introdução
Os primeiros estudos de vacina de DNA foram realizados na década de 19901, e desde então, as vacinas de DNA foram testadas contra várias doenças infecciosas, câncer, auto-imunidade e alergia2. Nos mamíferos, uma vacina de DNA contra o vírus do Nilo Ocidental em cavalos e uma vacina contra o câncer terapêutico para melanoma oral canino ter sido licenciado, mas estas não estão atualmente em uso clínico2. Além do interesse evocado por estudos de mamíferos, vacinação de DNA se revelou para ser uma maneira conveniente para imunizar contra doenças virais os peixes de viveiro. Uma vacina contra o vírus de peixes necrose hematopoiética infecciosa (IHN) esteve em uso comercial desde 2005, e uma vacina contra o vírus da necrose pancreática infecciosa (IPNV) foi recentemente licenciado3. Além disso, várias vacinas de DNA contra patógenos de peixes estão sendo desenvolvidas.
Como vacinas tradicionais muitas vezes contêm patógenos atenuados inactivados ou ao vivo, eles representam um risco potencial de transmissão da doença2. Vacinas de DNA, por sua vez, evitaram este risco, como eles baseiam-se na administração do plasmídeo codificação antígenos virais ou bacterianos, ao invés do patógeno inteiro em si2,4. Vacinas de DNA são produzidas com técnicas de recombinação de DNA, que permite que o projeto preciso de antígenos da vacina e a formulação flexível de combinações de antígeno e adjuvantes em uma única vacina construção5. Além disso, a produção de vacinas de DNA é mais rápido, mais fácil e mais eficiente do que a de vacinas recombinantes à base de proteína, que é uma grande vantagem para o candidato de vacina fins de triagem, mas também, por exemplo, no caso de surtos de pandemia 2.
Nos peixes, as vias de administração mais comuns para as vacinas de DNA são intraperitoneal, intramuscular e oral3,6,7, enquanto nos mamíferos, subcutâneo e intradérmicas rotas são opções adicionais2. Após uma injeção intramuscular, os Plasmideos DNA administrados digite as células no local da administração (ex., na sua maioria miócitos, mas também células apresentadoras residentes [APCs]). A proporção de células transfectadas pode ser significativamente aumentada por eletroporação2,8. Depois de entrar na célula, um plasmídeo entra no núcleo, onde os genes codificados pelo plasmídeo são transcritos2. Neste protocolo, nós utilizamos o plasmídeo de pCMV-EGFP que tem um forte promotor onipresente otimizado para expressão eucarióticos9. Nesta construção, os antígenos são traduzidos como uma proteína de fusão com a GFP. O GFP permite a confirmação de uma vacinação bem sucedida e o produto correto do antígeno pelo simples visualização da expressão do antígeno com um microscópio de fluorescência em peixes vivos.
Nos mamíferos, as vacinas de DNA foram mostradas para estimular diferentes tipos de respostas imunes, dependendo os tipos de células transfectadas2,5. Miócitos transfectados secretam antígenos no espaço extracelular ou soltá-los em cima de morte celular, e os antígenos tragados por APCs, posteriormente, apresentam-se em moléculas II de complexo principal de histocompatibilidade2. Isso desencadeia respostas de células CD4 e CD8 T, especialmente, além de respostas de células B2,5,10. Em peixes, linfócitos T e B, bem como as células dendríticas (DCs), foram identificadas, mas sua divisão do trabalho na apresentação de antigénios é menos bem compreendida11. Zebrafish DCs, no entanto, foram mostrados para compartilhar características fenotípicas e funcionais conservadas com suas contrapartes mamíferos12. Além disso, a vacinação de DNA tem sido mostrada para eliciar respostas semelhantes de imune em peixes e em mamíferos, incluindo T e células B respostas6,13,14,15,16 .
Tanto as larvas e adulto zebrafish são amplamente utilizados para diferentes doenças infecciosas de modelo, como o modelo de infecção de M. marinum peixe de tuberculose, usado no presente protocolo17,18,19,20 ,21,22. Em comparação com os organismos modelo de mamíferos, as vantagens do zebrafish incluem seu tamanho pequeno, rápida reprodutibilidade e despesas23de habitação de baixa. Estes aspectos fazem o zebrafish ideal modelo animal para estudos de triagem pré-clínicos em larga escala de vacinas novas e compostos farmacêuticos23,24,25.
Neste protocolo, descrevemos como romance do antígeno de vacina candidatos contra micobacteriose podem ser avaliados pela vacinação baseada em DNA de adultos do zebrafish. Primeiro, descrevemos como antígenos são clonados no plasmídeo de expressão pCMV-EGFP, seguido por um protocolo detalhado para a injeção intramuscular de plasmídeos de vacina e o electroporation subsequente em músculo. A expressão de cada antígeno é confirmada pelo postimmunization de uma semana de microscopia de fluorescência. A eficácia dos candidatos do antígeno é então testada experimentalmente infectando peixes vacinados com M. marinum.
Protocolo
Experimentos incluindo adulto zebrafish requerem uma permissão a experimentação animal para a vacinação e os estudos subsequentes com o modelo de infecção. Todos os métodos e experimentos descritos aqui são aprovados pelo Animal experimento Board da Finlândia (ESAVI) e os estudos são realizados em conformidade com a Directiva 2010/63/UE.
1. clonagem de antígenos de vacinas de DNA
- Selecione um plasmídeo de expressão otimizado para a expressão eucariótica dos ou os antigénios ou de interesse no âmbito de um promotor forte, constitutivo, como promotor de início imediato o citomegalovírus (CMV). Para habilitar a verificação na vivo da expressão do antígeno, selecione um plasmídeo de vacina que codifica uma etiqueta fluorescente, como o plasmídeo pCMV-EGFP9 utilizados neste protocolo.
- Use ferramentas baseadas na web e bioinformatic apropriadas para selecionar uma sequência potencialmente imune-protetora do antígeno (ou várias sequências) de aproximadamente 90 – 600 nt (30 – 200 aa)26 os genes-de-interesse do patógeno que será usado na modelo de infecção subsequente.
- Use o software disponível, ou manualmente, projetar primers para amplificar os genes antígeno do genoma de organismos patogénicos e clonar o antígeno sequence(s) no site do múltiplo-clonagem do plasmídeo de expressão. Certifique-se de preservar o quadro de leitura correta quando selecionando o antígeno.
- Inclua uma sequência (CCACC) de Kozak27 e um códon de início (ATG) em 5' primer. Para preservar a tag EGFP C-terminal, evite intermediárias códons de parada (TAA, TAG, TGA) em sequência o antígeno e o 3' primer. Também, certifique-se que a tag GFP permanece no mesmo quadro de leitura com o antígeno de interesse.
- Use o RNA ou DNA extraído do patógeno, como um modelo para gerar uma quantidade adequada de produto PCR com primers a clonagem. De preferência, use uma correcção DNA polimerase para preservar a sequência correta do antígeno.
- Purificar o produto do PCR e verifique o tamanho correto do produto por electroforese em gel. Digerir e ligate produto da PCR com o plasmídeo digerido vacina.
- Transforme a mistura de ligadura em células bacterianas competentes de acordo com um protocolo adequado. Use uma seleção de antibiótica apropriada para colônias positivas e produção do plasmídeo em Escherichia coli; o plasmídeo pCMV-EGFP, por exemplo, contém um gene de resistência de ampicilina para isto.
- Use Sanger sequenciamento para confirmar a inserção da sequência correta de antígeno. As primeiras demão seguintes podem ser usadas para os antígenos de sequenciamento no plasmídeo pCMV-EGFP: CMV encaminhar 5'-CGCAAATGGGCGGTAGGCGTG-3 'e EGFP-N reverse 5' CGTCGCCGTCCAGCTCGACCAG-3'.
- Produzir e purificar uma quantidade suficiente de construção de vacina. Dissolver ou Eluir o plasmídeo em água estéril. Certifique-se que o DNA do plasmídeo produzida é de alta qualidade e a concentração é no mínimo 0,72 µM ou 2.000 ng / µ l.
2. puxar as agulhas Microinjection
- Agulhas de microinjeção prepare com antecedência. Use os capilares de vidro de aluminossilicato de 10 cm. Observe que o capilares de vidro de borosilicato são muito frágeis para injetar o peixe adulto.
- Puxe as agulhas com um micropipeta-agulha-fabricação do dispositivo.
Nota: As agulhas devem ser semelhantes ao apresentado na Figura 1. Com o dispositivo utilizado no presente protocolo (Tabela de materiais), as seguintes configurações de resultam no tipo desejado de agulhas:- Defina o vidro capilar no V-sulco na barra de puxador e aperte o botão de aperto levemente.
- Mova o titular ao lado do filamento e empurre suavemente o capilar através do filamento na barra do extrator do outro lado do filamento. Evite tocar o filamento com o capilar.
- Aperte os botões de fixação, pousa o vidro de segurança e pressione o botão de puxar.
Atenção: O filamento é quente.
- Coloque as agulhas em um pedaço de adesivo reutilizável no interior de uma placa de Petri 15 cm para proteger as pontas da agulha. Mantenha o prato coberto para manter as agulhas limpas.
3. as agulhas de micropipeta de enchimento
- Prepare a mistura de vacina. Use de 0,5 – 12 µ g do plasmídeo por dose. Se combinar vários plasmídeos diferentes na mistura de uma vacinação, use uma concentração de DNA total máxima de 12 µ g por peixe.
- Calcule o volume da vacina "mestre mix", de acordo com o número de peixes em cada grupo (veja abaixo). Adicione 1 µ l de filtrado estéril vermelho de fenol para cada dose de injeção para aliviar tanto o enchimento das agulhas capilares e a observação da injeção. Adicionar 1 estéril x PBS até um volume máximo total de 5 – 7 µ l em injeção de uma dose de8.
Nota: Injecção de volumes superiores a 7 µ l pode ocasionar o vazamento ocasional da solução de injeção e deve, portanto, ser evitada. - Coloque um pedaço de fita adesiva, cola para cima, sobre um suporte adequado, por exemplo, do lado de uma caixa vazia de ponta. Delicadamente, anexe as agulhas capilares para a fita.
- Pipetar um máximo de 7 µ l da mistura vacina em um pedaço de filme de laboratório. Utilize uma ponta de carregamento, transferi a vacina do filme para a agulha. Pipeta lentamente e com cuidado, evitar pipetagem bolhas de ar para a agulha.
- Deixe as agulhas se contentar com 15 a 30 min retirar possíveis bolhas de ar pequeno restante.
4. definir o Microinjector e Electroporator para imunização
- Defina o micromanipulador e uma fonte de luz em posição correta. Mude a torneira de pressão de ar para a posição aberta.
- Ajustar os parâmetros para os pneumáticos da bomba (ver também Figura 2) como segue.
- Coloque o botão de ventilação na porta de ejeção para segurar para evitar que o aterramento da pipeta por ação capilar. Como a tubulação da porta de ejeção da micropipeta. Não use a porta de vácuo neste protocolo.
- Ajustar o comprimento do pulso: usar o modo o tempo limite, onde um temporizador eletrônico controla a duração do tempo o solenoide de pressão fica aberto. Verifique se a lâmpada verde ao lado do manômetro Eject acende-se quando o solenoide de pressão é aberto (energizado).
- Defina o pulso gama 10 s; com essa configuração, os pulsos podem ser ainda mais definidos de 100 ms para uso s. 10.1 o período 10-gira de discagem para ajustar o comprimento do pulso — cada volta do mostrador é 1.0 s. Se necessário, este também pode ser ajustada durante a injeção.
- Use o iniciador de pulso ("botão Iniciar") no painel frontal da bomba pneumática, ou um remoto interruptor de pé (recomendado). Isto está ligado ao painel frontal da bomba pneumática.
- Defina a agulha para o titular de micropipeta do micromanipulador. Corte a ponta da agulha com uma pinça para que o líquido pode ser empurrado para fora e usar o microscópio para visualizar a posição correta. Pressione o interruptor de pé uma vez para ver que um pulso 1-s empurra uma gota pequena fora a agulha.
- Use as seguintes configurações para o electroporator: tensão = 40 V; comprimento do pulso = 50 ms, número de pulsos = 6. Conecte a pinça para o electroporator. Vê-se que a tensão real e comprimento de pulso exibido no monitor não diferem significativamente as configurações.
5. injeção da vacina de DNA e eletroporação
- Para a imunização de acordo com este protocolo, uso saudável, 6 a 12 meses de idade e adultos zebrafish. Manter o peixe em um sistema de passagem com um ciclo de luz/escuridão h 14/10, com um máximo de sete peixes por 1 L de água.
- Prepare-se para anestesiar o peixe280.02% 3-aminobenzoico ácido etil éster (tricaina) solução (pH 7) em água do aquário. Use um prato de Petri de 10 cm ou algo semelhante.
- Prepare um tanque de recuperação, enchendo um copo de 5 L com 3 L de água do sistema limpo.
- Prepare uma vacinação de enchimento para manter os peixes em uma posição fixa durante a vacinação. Pegue um pedaço de2 de 5 x 7 cm de um 2 a 3 cm de espessura esponja. Corte um sulco na esponja com uma lâmina de bisturi ou tesoura em ponto.
Nota: O mesmo preenchimento de vacinação pode ser usado em vários experimentos. Desinfectar a esponja entre as experiências de imersão em álcool etílico a 70% e deixar para secar. - Completamente, mergulhe a esponja na água sistema e definir a esponja sobre uma placa de Petri.
- Rapidamente o peixe 24 h antes da vacinação.
- Anestesia um zebrafish, colocando-o em um prato de Petri contendo metanosulfonato de 0,02%. Espere até que o peixe não responder ao toque estimulação e enquanto não houver nenhum movimento das brânquias. Anestesia um único peixe de cada vez.
- Usando uma colher de plástico, transferir o zebrafish anestesiado sobre a esponja molhada e defina o lado ventral do peixe para baixo na ranhura. Na posição correcta, certifique-se de que a cabeça e a maioria do corpo do peixe estão dentro do sulco e a barbatana dorsal e a cauda são salientes para fora da ranhura.
- Sob o microscópio, coloque cuidadosamente a agulha em um ângulo de 45° aproximadamente perto músculo dorsal do zebrafish, usando os eixos x e y fine-tuning rodas sobre o micromanipulador.
- Encontre a pequena mancha sem escalas na frente da nadadeira dorsal, onde empurrando a agulha não exige força. Se sentir resistência, tente um local adjacente. Evite ferir as escalas, nadadeira dorsal ou coluna vertebral.
Nota: Se a agulha dobra enquanto empurra, encurte a agulha ligeiramente por cima. - Use o interruptor de pé para injetar a solução vacina gradualmente o músculo. Observar a injeção através do microscópio: vermelho de fenol é visível como ele entra no tecido muscular. Se necessário, ajuste a duração do pulso.
Nota: Como alternativa, use o botão de iniciador do pulso no painel frontal da bomba pneumática para a injeção. No entanto, o uso de um interruptor de pé remoto permite usando a outra mão para ajustar o comprimento do pulso pela roda de discagem 10-gira. Evite injetando a solução muito rápida, pois pode causar dano tecidual excessivo. Certifique-se não injetar o ar. - Electroporate o peixe imediatamente após a injeção. Certifique-se que o peixe ainda está sob anestesia. Mantenha o peixe sobre a esponja e definir o peixe entre eletrodos tipo pinça, para que os eletrodos estão localizados em cada lado do local da injeção. Não pressione as pinças de eletrodo muito apertado, mas manter os dois eletrodos em contato com o peixe.
- Pressione o botão iniciar no electroporator dar seis 40 V, 50 ms pulsos.
- Suavemente, transferi os peixes no tanque de recuperação.
- Limpe os eléctrodos após cada electroporation swiping-los com etanol a 70%.
Nota: Monitore cuidadosamente o bem-estar dos peixes após a vacinação. Eutanásia em qualquer peixe mostrando sinais de desconforto (uma lenta recuperação da anestesia, aberrante natação, ofegante) em metanosulfonato de 0,04%. Após a recuperação, transferir os peixes para a unidade de escoamento e alimentá-lo normalmente.
6. visualização e imagem da expressão do antígeno
- Anestesiar o peixe tricaina 0,02% 2-7 dias após a imunização e usar uma luz UV para ver a expressão de EGFP perto do local da injeção.
Nota: Inspeção Visual, sob a luz UV é uma operação fácil e não-invasivo que é apropriada para a verificação de rotina de vacinação bem sucedida, também em experimentos em grande escala. Se não há imagens dos peixes são necessárias, esta etapa também pode ser realizada em tanques de peixe normal sem a necessidade de anestesia ou mover o peixe. - Para capturar imagens, use um microscópio de fluorescência para visualizar a expressão EGFP a injeção local8. Use uma lente de objectivo 2 X e selecione o filtro correto para visualizar a fluorescência ou vistas de luz visíveis.
- Mantenha o peixe anestesiado ainda pressionando a barbatana ventral delicadamente com uma pinça em direção a um fundo de prato de Petri. Com imagens tanto luz-microscópio e fluorescência da mesma área.
- Mescle as imagens de microscópio de luz e fluorescência usando o software apropriado29. Adicione uma barra de escala.
7. quantificação do nível de expressão e o tamanho dos antígenos
- Eutanásia o peixe metanosulfonato de 0,04%. Disse a parte fluorescente da musculatura dorsal com um bisturi e uma pinça sob luz UV. Extrai as proteínas de amostras8.
- Verifique se o tamanho correto do in vivo-produzido de proteínas com uma análise ocidental do borrão, usando uma peroxidase de rábano (HRP)-anticorpo conjugado de GFP (ou similar)8. Inclua um controlo negativo (peixes vivem) para excluir quaisquer sinais de fundo e vinculação inespecíficas, juntamente com um controle expressando EGFP sem um antígeno fundido.
Nota: Para a análise ocidental do borrão, o tamanho esperado das proteínas antígeno-fusão (em kDa) pode ser calculado, por exemplo, pela equação:
Peso molecular (MW) de dsDNA = (número de nucleotídeos x 607.4) + 157,9; ou usando ferramentas baseadas na web. - Quantificar a expressão de cada antígeno usando um GFP-ELISA8 (opcional).
8. combinando o protocolo de vacinação, com um modelo de infecção de M. marinum
- Determinar o tamanho de grupo necessário para a determinação confiável da eficácia de uma candidata a vacina romance no modelo de infecção e o ensaio utilizado (ver, por exemplo, Myllymaki et al. 24 e Cesar e Kantharia30). Realize os cálculos de potência adequada ao planejamento de experimentos.
- Para avaliar a eficácia de candidatos vacinais, infectar o postimmunization de 5 semanas de peixe. Use uma infecção intraperitoneal com aproximadamente 30 unidades de formadoras de Colônia (UFC) de M. marinum, que leva a uma infecção latente na maioria de peixe8,20,31.
Nota: Quando usar M. marinum, seguem um protocolo de segurança BSL2. A preparação da bactéria ou vírus depende do patógeno. - Quantificar o número de agentes patogénicos em cada peixe. Eutanásia em postinfection de 4 semanas a peixes e determinar a carga bacteriana em cada peixe de DNA extraído com qPCR utilizando primers específicos para M. marinum20,24.
Nota: Certifique-se de incluir um grupo de controle apropriado e usar os métodos corretos de estatísticos para analisar os resultados. Geralmente, um grupo de peixes imunizadas com o plasmídeo vazio pCMV-EGFP é um adequado controlo negativo. - Confirme os resultados positivos com antígenos sem a tag GFP. Clonar os antígenos, conforme descrito na etapa 1 e repita a experiência de vacinação.
Resultados
As etapas envolvidas no protocolo de vacinação de DNA de zebrafish adulto são ilustradas na Figura 3. Em primeiro lugar, as sequências de antígeno selecionados são clonadas em um plasmídeo pCMV-EGFP e Plasmídeo é produzido e purificado24 (Figura 3). Candidatos vacinais são então injetados por via intramuscular com um microinjector e o local da injeção é electroporated para melhorar a ingestão do plasmídeo em células (Figura 3). A dose de vacinação usado foi otimizada por injetar quantidades diferentes do plasmídeo pCMV-EGFP e medição da expressão de GFP com ELISA (Supplementary Figura 1). Dois postvaccination de sete dias, a expressão da proteína de fusão é detectado sob a luz UV e visualizado com microscopia de fluorescência (Figura 3 e Figura 4). Os níveis de expressão de antígenos diferentes podem variar de muito intensivo (antígeno 1) para uma expressão fraco (Figura 4). Além disso, a expressão de GFP pode ser observado através do músculo dorsal (antígeno 1), ou em uma área mais limitada (antígeno 2) (Figura 4). No entanto, se nenhuma fluorescência é detectada no prazo de 10 dias, é recomendável para certificar-se que existem sem erros no projeto de clonagem ou primer de antígeno. Para confirmar que a proteína de fusão expressa é do tamanho correto, proteínas podem ser extraídas do tecido do músculo em torno do local da injeção e utilizadas para uma análise ocidental do borrão.
O efeito dos candidatos a vacina é avaliado por desafiar o peixe com uma dose baixa de M. marinum por uma injeção intraperitoneal (Figura 5). Postinfection de quatro a cinco semanas, as contagens bacterianas são determinadas com qPCR e comparado com cargas bacterianas no grupo controle (Figura 5). Além disso, a eficácia dos candidatos mais promissores vacina pode ser testada pelo monitoramento a sobrevivência após uma dose elevada de M. marinum infecção(,Figura 5). No entanto, além de dar um resultado quantitativo na progressão da infecção, em vez de meramente um status de vivo ou morto, a quantificação de qPCR-baseado cfu requer menos tempo e tamanhos de grupo menores e é, portanto, uma abordagem mais ética para um principal tela. Em geral, este protocolo facilita a triagem da eficácia dos antígenos da vacina romance dentro de 12 semanas (Figura 5).

Figura 1: Close-up (12 X) de aluminossilicato agulhas usadas em injeções intra muscular adulto zebrafish. A dica abaixo foi cortada com uma pinça e está pronta para ser usado para alevinos. Esta figura foi adaptada da Oksanen35. Clique aqui para ver uma versão maior desta figura.

Figura 2: instalação e equipamento de Microinjection. Os componentes principais do equipamento necessário para a vacinação de DNA de zebrafish adulto são destacados em negrito. Os ajustes críticos são indicados. Clique aqui para ver uma versão maior desta figura.

Figura 3: preparando os plasmídeos de vacina de DNA e o processo de imunização. (1) Selected antígenos são clonados adjacente à marca de GFP no plasmídeo pCMV-EGFP. Construção (2), a vacina é produzida microbiologicamente, concentrada e purificada. (3), 12 µ g do plasmídeo é injetado no músculo dorsal de um zebrafish adulto anestesiado com uma microinjector, e o local da injeção é posteriormente electroporated com seis pulsos de 40 V, 50-ms. (4) postvaccination de dois a sete dias, a expressão de GFP da proteína de fusão do antígeno-GFP é visualizada com um microscópio de fluorescência. (5), o fluorescente parte do músculo dorsal pode ser dissecado e utilizado para a extração de proteínas. O tamanho da proteína de fusão é confirmado com uma análise ocidental do Borrão e o nível de expressão com GFP-ELISA. Clique aqui para ver uma versão maior desta figura.

Figura 4: visualizando a expressão da proteína de fusão do antígeno-EGFP. Zebrafish adulto anestesiado são vacinados com 12 µ g de antígenos da vacina experimental (antígeno 1 – 3) e o local da injeção é electroporated, posteriormente, com seis 40 V, pulsos de 50 ms. Dois postvaccination de sete dias, o local da injeção é fotografada com um microscópio. A expressão de GFP é detectada pela primeira vez, sob um microscópio de fluorescência. A área é inspecionada usando um objectivo de magnitude 2 X e cuja imagem e salva no formato. TIFF. A imagem do microscópio de luz da mesma área é mesclada com a imagem de fluorescência usando o software ImageJ. A quantidade e a posição da expressão do antígeno podem variar entre antígenos e peixe individual. Por exemplo, a expressão do antígeno 1 é observado em todo o músculo dorsal e a expressão do antígeno 2 é visto como pequenas manchas, Considerando que o antígeno 3 é fortemente expressos em uma área mais limitada. Clique aqui para ver uma versão maior desta figura.
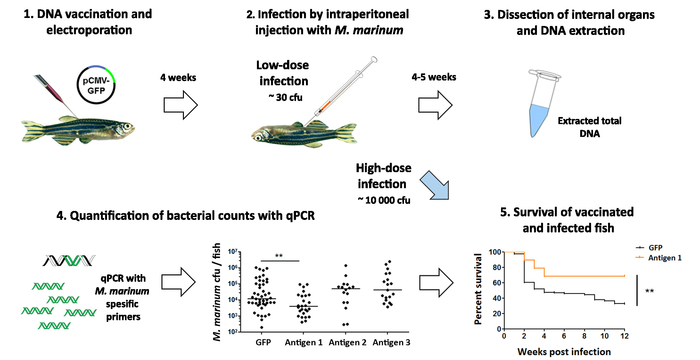
Figura 5: testar a eficácia de candidatos vacinais contra uma infecção micobacteriana. (1) adulto zebrafish são vacinados com vacinas de DNA experimentais contra micobacteriose. (2) postvaccination de cinco semanas, os peixes são infectados com uma dose baixa de Mycobacterium marinum (~ 30 cfu). (3), quatro semanas mais tarde, o internas órgãos são dissecados e utilizados para a extração de DNA. (4), a contagem bacteriana em cada peixe é quantificada com qPCR usando M. marinum-primers específicos. Imunização com antígeno 1 levou a uma diminuição significativa nas contagens bacterianas (p < 0,01, ANOVA de duas vias), enquanto antígenos 2 e 3 não teve efeito. Efeito (5), o protetor do candidato mais promissor da vacina (antígeno 1) é mais avaliado em um experimento de sobrevivência, onde peixes estão infectados com uma dose alta (~ 10.000 cfu) de bactérias e sua sobrevivência é monitorada por 12 semanas. Consistentes com a diminuição da carga bacteriana observada no painel 4, vacinação com antígeno 1 também melhorou a sobrevivência dos peixes após uma infecção de M. marinum (p < 0,01), sugerindo que este antígeno pode ser um promissor candidato para uma nova vacina contra a tuberculose. Clique aqui para ver uma versão maior desta figura.

Complementar Figura 1: afeta a quantidade de ADN do plasmídeo derivado do plasmídeo de expressão EGFP no zebrafish adulto. Grupos de peixes (n = 5 em cada grupo) foram injetados com 0,5 – 20 μg de pCMV-EGFP, e eletroporação (seis pulsos de 50 V) foi usada para realçar o transfeccao. Peixe de controle (CTRL) foram injetados com 2 μg do plasmídeo vazio pCMV não contendo o gene EGFP. GFP-ELISA foi realizada 3 dias postinjection para definir a expressão relativa de EGFP em peixes homogenates. P-valores: *p < 0,03, * *p < 0,004. As barras de erro representam desvios-padrão. NS = não significativo. Esta figura foi adaptada da Oksanen35. Clique aqui para ver uma versão maior desta figura.
Discussão
O procedimento de imunizar adulto zebrafish com vacinas baseadas em DNA requer alguns conhecimentos técnicos. Mesmo para um pesquisador experiente, vacinar um único peixe leva cerca de 3 min, excluindo os preparativos. Assim, um máximo de cerca de 100 peixes pode ser imunizado dentro de um dia. Se mais de 100 peixes são necessários para o experimento, as imunizações podem ser divididas entre até 3 dias. Além da qualidade da experiência, formação suficiente do investigador para lidar com os peixes e realizar a imunização é essencial para o bem-estar dos peixes. Certifique-se de seguir as orientações e regras de bem-estar animal e jurídica local quando se trata de habitação o peixe, as experiências e as qualificações requeridas para o pessoal de realizar as experiências de planejamento.
Em resumo, há vários passos críticos para evitar complicações no protocolo de imunização. Para a imunização bem-sucedida, certifique-se que 1) o peixe para ser imunizado é suficientes e saudáveis em idade e tamanho (a imunização de mais juvenis pode exigir para baixo-escala, o volume de vacina e as configurações de eletroporação); 2) os peixes são devidamente anestesiados com não mais forte do que 0,02% 3-aminobenzoico ácido etil ester, e eles permanecem anestesiados durante todo o procedimento (anestesia deve ser mantida tão curta quanto possível garantir a recuperação dos peixes); 3) a almofada de esponja é devidamente ensopada; 4) líquido é injetado em cada pulso da bomba pneumática e, se não, o comprimento do pulso é ajustado (puxando a agulha levemente para trás ao longo do eixo y pode ajudar); 5) há nenhuma bolha de ar com a solução de vacina; 6) as configurações de eletroporação e a tensão de pulso real e comprimento estão corretas; 7) os eléctrodos não causam danos à pele no site electroporation (durante a eletroporação, manter os eletrodos em suave em contato com o peixe e libertar os peixes imediatamente para o tanque de recuperação após a eletroporação).
É importante para monitorar os peixes após a eletroporação no tanque de recuperação e a eutanásia em qualquer peixe mostrando sinais de desconforto. Além disso, é necessário praticar o procedimento antes de iniciar um experimento em grande escala, para assegurar um fluxo de trabalho fluente. Se possível, pedi ajuda com as agulhas e a eletroporação de enchimento um colega suficientemente treinado.
O método de vacinação de DNA permite que o projeto sob medido de antígenos da vacina. É possível clonar o antígeno todo ou, de preferência, selecionar partes do antígeno com base no celular localização e imunogenicidade24. Além disso, o método permite combinar vários antígenos ou adjuvantes na construção de uma vacina ou injetando vários plasmídeos separados no mesmo tempo2. Incluindo um códon de parada após a sequência de antígeno ou excisão do gene EGFP o plasmídeo, é possível utilizar o mesmo vetor do plasmídeo também para expressar o antígeno sem a marca N-terminal GFP subsequente. Isto pode ser razoável em confirmar os resultados do rastreio positivo, como o tamanho relativamente grande de GFP pode afetar a dobradura do antígeno e, assim, restringir respostas humorais potencial evocadas pela vacinação.
Uma maior expressão do antígeno tem sido associada a de imunogenicidade de vacina de DNA2. Electroporation após a injeção, assim, foi incluído no presente protocolo, como tem sido mostrado para aumentar a expressão de antígenos ou genes repórter de quatro vezes em dez vezes no zebrafish32. Além disso, eletroporação como uma técnica provoca lesão tecidual moderada, induzindo assim a inflamação local que mais promove as respostas de imune induzida pela vacina2. Por outro lado, eletroporação é geralmente bem tolerada. Com o equipamento usado aqui, praticamente 100% dos adultos do zebrafish irá se recuperar bem os seis pulsos de 40 V, usado no presente protocolo35.
Além de eletroporação para realçar a entrada do plasmídeo a vacina dentro das células, utilizamos um forte promotor onipresente no plasmídeo de vacina e uma cauda polyA na extremidade 3' do antígeno para melhorar a expressão do antígeno nas células transfectadas peixe. Em alguns casos, se o uso de códon do patógeno alvo difere significativamente da espécie vacinada, otimização de códon foi encontrada útil em mais aumento de expressão de gene alvo2. Neste modelo de zebrafish -M. marinum , no entanto, otimização de códon não teve nenhum efeito significativo sobre os níveis de expressão de dois genes modelo micobacteriana, ESAT-6 e 10-PCP e, assim, considerou-se desnecessário neste modelo35 .
Perfis de expressão de gene alvo tem alguma variação temporal entre os antígenos, dependendo, por exemplo, o tamanho e a estrutura dos antígenos em questão. No entanto, a expressão do antígeno é geralmente semelhante dentro de um grupo de peixes imunizados com a mesma vacina. Normalmente, a mais brilhante expressão EGFP observa-se quatro dias para postvaccination de uma semana, mas numa escala de 2-10 dias é possível. É recomendável para validar a expressão da proteína de fusão cada antígeno-EGFP em um pequeno grupo de peixes (2 – 3) antes de incluir o antígeno em um experimento em grande escala. Se nenhuma expressão de GFP é observada em qualquer ponto 2 – 10 dias após a imunização, certifique-se de que 1) o protocolo de imunização foi seguido com atenção. Sempre tem um grupo de peixes imunizadas com o plasmídeo vazio pCMV-EGFP como um controle positivo e certifique-se de que 2) o antígeno design e clonagem molecular foi realizada corretamente (projeto da primeira demão adequada; o antígeno e a tag EGFP estão ambos na mesma frame de leitura e não códons de parada intermediárias estão incluídos). Em alguns casos, apesar do design correto do antígeno, GFP não pode ser detectado. Isto pode ser devido à incorrecta ou avaria rápida da proteína de fusão. Nestas circunstâncias, pode ser necessário redesenhar o antígeno.
Nas vacinas que são usadas para imunizar os peixes de viveiro, a dose de plasmídeo utilizada é tipicamente 1 µ g ou menos de33,7,34. No zebrafish, expressão do gene repórter também pode ser detectado após pelo menos uma injeção de plasmídeo de 0,5 µ g seguindo electroporation; no entanto, a expressão do gene alvo relativa aumenta significativamente com uma maior quantidade de plasmídeo por peixe (complementar a Figura 1). Em peixes injetados com o plasmídeo do repórter pCMV-EGFP, uma injeção com 5-20 µ g de plasmídeo resultou em quatro a oito vezes maior EGFP níveis em comparação com peixe injetado com 0,5 µ g. Portanto, para garantir uma expressão do gene alvo alto o suficiente, ainda têm volumes de injeção que são pequeno o suficiente (≤7 µ l) para evitar qualquer dano de tecido em excesso ou vazamento de vacina, escolhemos usar 5 a 12 µ g por peixe para os fins do exame preliminar. Além de imunogenicidade da vacina, uma alta suficiente expressão do gene alvo é necessário para detectar a expressão do gene repórter, com um microscópio de fluorescência e com o borrão ocidental, que é necessário para a seleção de efeitos para confirmar o correto na vivo Tradução do antígeno alvo. No entanto, doses menor plasmídeo (0,5 – 1 µ g) pode ser útil para outros tipos de usos experimentais.
Em conclusão, este protocolo para a imunização de adultos do zebrafish com um plasmídeo de DNA pode ser usado em testes pré-clínicos de candidatos romance vacina contra várias infecções bacterianas ou virais. A expressão do antígeno de vacina como uma proteína GFP-fusão permite a visualização de uma expressão de evento e antígeno de imunização bem-sucedida. Nós aplicamos esse método para o rastreio pré-clínico de candidatos de antígeno de nova vacina contra a tuberculose. Por isso, nós infectar o postvaccination de cinco semanas de zebrafish e determinar que o bacteriano conta em cada peixe com qPCR20,24.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores agradecem aos membros do grupo de pesquisa de Imunologia Experimental, e especialmente a Leena Mäkinen e Hannaleena Piippo, por todo o trabalho que fizeram no desenvolvimento e otimizando o protocolo de vacinação e a ajuda em experiências reais usando o protocolo.
Este trabalho foi apoiado pela Jane ja Aatos Erkon Säätiö (Jane e Aatos Erkko Foundation; a M.R.), Sigrid Juséliuksen Säätiö (Sigrid Juselius Foundation; para M.R.), a pesquisa de estado competitiva financiamento da área de responsabilidade do especialista da Universidade de Tampere Hospital (M.R.), Tampereen Tuberkuloosisäätiö (Fundação de tuberculose de Tampere; para M.R., hm e M.N.), Suomen Kulttuurirahasto (Fundação Cultural finlandesa; para H.M), Suomen Tuberkuloosin Vastustamisyhdistyksen Säätiö (finlandês anti-tuberculose Fundação; a H.M), Väinö ja Laina Kiven säätiö (Väinö e Laina Kivi Foundation; de M.N.) e a Fundação de ciência de cidade de Tampere (a M.N.).
Materiais
| Name | Company | Catalog Number | Comments |
| pCMV-GFP plasmid | Addgene | #11153 | |
| 2-propanol | Sigma-Aldrich | 278475-2L | DNA extraction |
| Ampicillin sodium salt | Sigma-Aldrich | A0166-5G | |
| Chloroform | Merck | 1.02445.2500 | DNA extraction |
| ECM Electro Square Porator | BTX Harvard apparatus | BTX ECM 830 | |
| FastPrep-24 5G | MP Biomedicals | 116005500 | homogenizer |
| Flaming/brown micropipette puller | Sutter Instrument Co. | P-97 | Pulling of needles |
| GeneJet PCR Purification kit | ThermoFischer Scientific | K0701 | |
| GFP ELISA kit | Cell Biolabs, Inc. | AKR-121 | |
| Guanidine thiocyanate (FW 118.2) | Sigma-Aldrich | G9277-500G | DNA extraction |
| ImageJ2 | imagej.net/Downloads | freely available software | |
| LB Agar | Sigma | L2897-1kg | |
| LB Broth (Miller) | Sigma | L3522-1kg | |
| Micromanipulator | Narishige | MA-153 | |
| Microscope | Nikon | AZ100 | fluorescense microscope |
| Microscope | Olympus | ZS61 | |
| Nightsea Full adapter system w/Royal Blue Color light head | Electron Microscopy Sciences | SFA-RB | |
| PBS tablets | VWR Chemicals | E404-200TABL. | |
| Phenol red sodium salt | Sigma-Aldrich | 114537-5G | |
| PV830 Phneumatic Pico Pump | WPI | SYS-PV830 | |
| QIAGEN Plasmid Maxi kit | Qiagen | ID:12163 | plasmid extraction |
| Sodium citrate (FW294.1) | VWR Chemicals | 27833.294 | DNA extraction |
| Tri Reagent | Molecular Research Center, Inc. | TR 118 | DNA extraction |
| Tricaine (ethyl 3-aminobenzoate methanesulfonate salt) | Sigma | A5040-100g | anestesia and euthanasia solution |
| Tris (free base) (FW121.14) | VWR Life Science | 0497-500G | DNA extraction |
| Tweezertrodes Electrodes (7mm) Kits | BTX Harvard apparatus | BTX 450165 | tweezer type electrodes |
| 2.8 mmCeramic beads | Omni International | 19-646-3 | DNA extraction |
| 2ml Tough tubes with caps | Omni International | 19-649 | DNA extraction |
| Aluminosilicate capillaries | Harvard apparatus | 30-0108 | |
| Microloader 20 µl | eppendorf | 5242956.003 | loading tips |
| Petri dishes, 16 mm | Sarsted | 82.1473 | |
| Scalpels | Swan Morton | 0501 | |
| Parafilm | Bemis | laboratory film | |
| Pins | |||
| Plastic spoon | |||
| Spatula | |||
| Sponge | |||
| Styrofoam workbench | |||
| Tweezers |
Referências
- Tang, D. C., DeVit, M., Johnston, S. A. Genetic immunization is a simple method for eliciting an immune response. Nature. 356 (6365), 152-154 (1992).
- Tregoning, J. S., Kinnear, E. Using Plasmids as DNA Vaccines for Infectious Diseases. Microbiology Spectrum. 2 (6), (2014).
- Evensen, O., Leong, J. A. DNA vaccines against viral diseases of farmed fish. Fish Shellfish Immunology. 35 (6), 1751-1758 (2013).
- Sommerset, I., Lorenzen, E., Lorenzen, N., Bleie, H., Nerland, A. H. A DNA vaccine directed against a rainbow trout rhabdovirus induces early protection against a nodavirus challenge in turbot. Vaccine. 21 (32), 4661-4667 (2003).
- Li, L., Petrovsky, N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Review of Vaccines. 15 (3), 313-329 (2016).
- Embregts, C. W. E., et al. Intramuscular DNA Vaccination of Juvenile Carp against Spring Viremia of Carp Virus Induces Full Protection and Establishes a Virus-Specific B and T Cell Response. Frontiers in Immunology. 8, 1340 (2017).
- Lorenzen, N., LaPatra, S. E. DNA vaccines for aquacultured fish. Revue scientifique et technique (International Office of Epizootics). 24 (1), 201-213 (2005).
- Oksanen, K. E., et al. An adult zebrafish model for preclinical tuberculosis vaccine development. Vaccine. 31 (45), 5202-5209 (2013).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proceedings of the National Academy of Sciences of the United States of America. 101 (1), (2004).
- Cho, J. H., Youn, J. W., Sung, Y. C. Cross-priming as a predominant mechanism for inducing CD8(+) T cell responses in gene gun DNA immunization. The Journal of Immunology. 167 (10), 5549-5557 (2001).
- Lewis, K. L., Del Cid, N., Traver, D. Perspectives on antigen presenting cells in zebrafish. Developmental & Comparative Immunology. 46 (1), 63-73 (2014).
- Shao, T., et al. Characterization of surface phenotypic molecules of teleost dendritic cells. Developmental & Comparative Immunology. 49 (1), 38-43 (2015).
- Utke, K., et al. Cell-mediated immune responses in rainbow trout after DNA immunization against the viral hemorrhagic septicemia virus. Developmental & Comparative Immunology. 32 (3), 239-252 (2008).
- Cuesta, A., et al. An active DNA vaccine against infectious pancreatic necrosis virus (IPNV) with a different mode of action than fish rhabdovirus DNA vaccines. Vaccine. 28 (19), 3291-3300 (2010).
- Castro, R., et al. DNA vaccination against a fish rhabdovirus promotes an early chemokine-related recruitment of B cells to the muscle. Vaccine. 32 (10), (2014).
- Iwanami, N. Zebrafish as a model for understanding the evolution of the vertebrate immune system and human primary immunodeficiency. Experimental Hematology. 42 (8), 697-706 (2014).
- Patterson, H., et al. Adult zebrafish model of bacterial meningitis in Streptococcus agalactiae infection. Developmental & Comparative Immunology. 38 (3), 447-455 (2012).
- Cronan, M. R., Tobin, D. M. Fit for consumption: zebrafish as a model for tuberculosis. Disease Model & Mechanisms. 7 (7), 777-784 (2014).
- Tobin, D. M., Ramakrishnan, L. Comparative pathogenesis of Mycobacterium marinum and Mycobacterium tuberculosis. Cellular Microbiology. 10 (5), 1027-1039 (2008).
- Parikka, M., et al. Mycobacterium marinum causes a latent infection that can be reactivated by gamma irradiation in adult zebrafish. PLoS Pathogens. 8 (9), e1002944 (2012).
- Rounioja, S., et al. Defense of zebrafish embryos against Streptococcus pneumoniae infection is dependent on the phagocytic activity of leukocytes. Developmental & Comparative Immunology. 36 (2), 342-348 (2012).
- Myllymaki, H., Bauerlein, C. A., Ramet, M. The Zebrafish Breathes New Life into the Study of Tuberculosis. Frontiers in Immunology. 7, 196 (2016).
- Myllymaki, H., Niskanen, M., Oksanen, K. E., Ramet, M. Animal models in tuberculosis research - where is the beef?. Expert Opinion on Drug Discovery. 10 (8), 871-883 (2015).
- Myllymaki, H., et al. Identification of novel antigen candidates for a tuberculosis vaccine in the adult zebrafish (Danio rerio). PLoS One. 12 (7), e0181942 (2017).
- Myllymaki, H., Niskanen, M., Luukinen, H., Parikka, M., Ramet, M. Identification of protective postexposure mycobacterial vaccine antigens using an immunosuppression-based reactivation model in the zebrafish. Disease Model & Mechanisms. 11 (3), (2018).
- Ingolotti, M., Kawalekar, O., Shedlock, D. J., Muthumani, K., Weiner, D. B. DNA vaccines for targeting bacterial infections. Expert Review of Vaccines. 9 (7), 747-763 (2010).
- Kozak, M. Recognition of AUG and alternative initiator codons is augmented by G in position +4 but is not generally affected by the nucleotides in positions +5 and +6. The EMBO Journal. 16 (9), 2482-2492 (1997).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies?. Journal of Pharmacology and Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Hammaren, M. M., et al. Adequate Th2-type response associates with restricted bacterial growth in latent mycobacterial infection of zebrafish. PLoS Pathogens. 10 (6), e1004190 (2014).
- Rao, N. M., Rambabu, K. M., Rao, S. H. Electroporation of adult zebrafish. Methods in Molecular Biology. 423, 289-298 (2008).
- McCaffrey, J., Donnelly, R. F., McCarthy, H. O. Microneedles: an innovative platform for gene delivery. Drug Delivery and Translational Research. 5 (4), 424-437 (2015).
- Lorenzen, E., Lorenzen, N., Einer-Jensen, K., Brudeseth, B., Evensen, O. Time course study of in situ expression of antigens following DNA-vaccination against VHS in rainbow trout (Oncorhynchus mykiss Walbaum) fry. Fish and Shellfish Immunology. 19 (1), 27-41 (2005).
- Oksanen, K. Adult Zebrafish Model for Studying DNA-based Vaccination against Mycobacterial Disease. Tampereen yliopisto. , (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados