Method Article
Vaccination de poisson-zèbre adulte pour la projection préclinique des vaccins basés sur l’ADN
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons ici un protocole pour la vaccination de l’adulte poisson zèbre (Danio rerio) avec un vaccin à base d’ADN et de démontrer la validation d’un événement de vaccination réussie. Cette méthode convient pour la projection préclinique de vaccins candidats dans divers modèles d’infection.
Résumé
L’intérêt pour la vaccination de base d’ADN a augmenté au cours des deux dernières décennies. La vaccination ADN est basée sur le clonage d’une séquence d’un antigène sélectionné ou une combinaison d’antigènes dans un plasmide, qui permet une conception sur mesure et en toute sécuritaire. L’administration de vaccins à ADN dans les cellules hôtes conduit à l’expression des antigènes qui stimulent la réponse immunitaire humorale et à médiation cellulaire. Ce rapport décrit un protocole de clonage des séquences d’antigène dans le plasmide CMVp-EGFP, la vaccination des adulte poisson zèbre avec les vaccins potentiels par microinjection intramusculaire et l’électroporation ultérieure afin d’améliorer l’apport. Les antigènes sont exprimés sous forme de la protéine fluorescente verte (GFP)-protéines de fusion, qui permet la confirmation de l’expression de l’antigène sous ultraviolets de poissons vivants et la quantification des niveaux d’expression de la protéine de fusion avec ELISA, ainsi que leur détection avec une analyse par western blot. L’effet protecteur des candidats vaccins est testé en infectant les poissons avec après la vaccination Mycobacterium marinum cinq semaines, suivie de la quantification de la bactérie avec le qPCR quatre semaines plus tard. Par rapport aux modèles de dépistage préclinique chez les mammifères, cette méthode fournit une méthode rentable pour la présélection des candidats nouveaux vaccins basés sur l’ADN contre une infection mycobactérienne. La méthode peut être appliquée plus de dépistage basées sur l’ADN vaccins contre diverses maladies bactériennes et virales.
Introduction
Les premières études de vaccin ADN ont été effectuées dans les années 19901, et depuis lors, les vaccins à ADN ont été testés contre diverses maladies infectieuses, le cancer, l’auto-immunité et allergie2. Chez les mammifères, un vaccin à ADN contre le virus du Nil occidental chez les chevaux et un vaccin contre le cancer thérapeutique contre le mélanome orale canin ont été licenciés, mais ce ne sont pas actuellement en usage clinique2. Outre l’intérêt évoquée par des études chez les mammifères, la vaccination ADN a avéré pour être un moyen pratique d’immuniser contre les maladies virales, les poissons d’élevage. Un vaccin contre le virus de poissons la nécrose hématopoïétique infectieuse (NHI) a été en usage commercial depuis 2005, et un vaccin contre le virus de la nécrose pancréatique infectieuse (VNPI) a été récemment autorisé3. En outre, plusieurs vaccins à ADN contre les pathogènes de poissons sont développées.
Comme les vaccins traditionnels contiennent souvent inactivés ou vivants pathogènes atténués, ils posent un risque potentiel de transmission de la maladie2. Vaccins à ADN, à son tour, d’éviter ce risque, puisqu’elles sont basées sur l’administration de plasmide codant des antigènes bactériens ou virus, plutôt que de tout pathogène lui-même2,4. Vaccins à ADN sont produites avec les techniques de recombinaison d’ADN, qui permet la conception précise des antigènes vaccinaux et la formulation souple de combinaisons antigène et adjuvants dans un seul vaccin construct5. En outre, la production de vaccins à ADN est plus rapide, plus facile et plus rentable que celle des vaccins recombinants basées sur les protéines, ce qui est un atout majeur pour le candidat vaccin fins de sélection, mais aussi, par exemple, en cas de pandémie flambées 2.
Chez les poissons, les voies d’administration plus courantes pour les vaccins à ADN sont intrapéritonéale, intramusculaire et orale3,6,7, tandis que chez les mammifères, sous-cutanée et intradermiques itinéraires sont des options supplémentaires2. Après une injection intramusculaire, les plasmides d’ADN administrés entrer dans les cellules au site d’administration (p. ex.., principalement les myocytes, mais aussi les résidents cellules présentatrices d’antigène [CPA]). La proportion de cellules transfectées peut être considérablement augmentée par électroporation2,8. Après être entré dans la cellule, certains l’ADN de plasmide pénètre dans le noyau, où les gènes codés par le plasmide sont transcrit2. Dans ce protocole, nous utilisons le plasmide CMVp-EGFP disposant d’un puissant promoteur omniprésent optimisé pour expression eucaryote9. Dans cette construction, les antigènes sont traduits comme une protéine de fusion avec un GFP. La GFP permet la confirmation d’une vaccination réussie et le produit correct de l’antigène par la simple visualisation d’expression de l’antigène avec un microscope à fluorescence de poissons vivants.
Chez les mammifères, les vaccins à ADN ont démontré pour stimuler les différents types de réponses immunitaires selon le types de cellules transfectées2,5. Les myocytes transfectées sécrètent des antigènes dans l’espace extracellulaire ou libérez-les sur la mort cellulaire, et les antigènes engloutis par les APC sont, par la suite, présentés sur les molécules d’II du complexe majeur d’histocompatibilité2. Cela déclenche des lymphocytes CD4 et CD8 T, en particulier, en plus de lymphocytes B réponses2,5,10. Chez les poissons, les lymphocytes T et B, ainsi que les cellules dendritiques (CD), ont été identifiés, mais leur division du travail dans la présentation des antigènes est moins bien compris11. DCs de poisson-zèbre, toutefois, ont démontré que partagent des caractéristiques phénotypiques et fonctionnelles conservés avec leurs homologues mammifères12. En outre, vaccination ADN a été montrée pour induire des réponses immunitaires similaires chez les poissons et chez les mammifères, y compris les T et les lymphocytes B réponses6,13,14,15,16 .
Les larves et les adulte poisson zèbre sont largement utilisés pour différentes maladies infectieuses modèle, tel que le modèle d’infection M. marinum poisson de la tuberculose utilisé dans ce protocole17,18,19,20 ,21,22. En comparaison avec des organismes modèles chez les mammifères, les avantages du poisson-zèbre comprennent leur petite taille, la reproductibilité rapide et faible logement frais23. Ces aspects font le poisson-zèbre, un modèle animal idéal pour des études précliniques à grande échelle de vaccins innovants et des composés pharmaceutiques23,24,25.
Dans ce protocole, nous décrivons comment roman antigène vaccinal candidats contre Mycobactériose peuvent être évaluées par la vaccination basées sur l’ADN des poissons zèbres adultes. Tout d’abord, nous décrivons comment les antigènes sont clonés dans le plasmide d’expression CMVp-EGFP, suivi d’un protocole détaillé pour l’injection intramusculaire de plasmides de vaccin et l’électroporation ultérieure dans le muscle. L’expression de chaque antigène est confirmée par les sérologies d’une semaine la microscopie par fluorescence. L’efficacité des candidats antigène est ensuite testée par infecter expérimentalement des poissons vaccinés avec M. marinum.
Protocole
Expériences, y compris le poisson-zèbre adulte nécessitent une autorisation à l’expérimentation animale pour la vaccination et les études ultérieures avec le modèle d’infection. Toutes les méthodes et les expériences décrites ici sont approuvés par l’expérience des animaux de Finlande (ESAVI) et les études sont réalisées conformément à la directive 2010/63/UE.
1. clonage d’ADN antigènes
- Sélectionnez un plasmide d’expression optimisé pour l’expression eucaryote des antigènes d’intérêt sous un promoteur fort, constitutif, tels que le promoteur début immédiat du cytomégalovirus (CMV). Pour activer la vérification in vivo de l’expression de l’antigène, sélectionnez un plasmide de vaccin qui encode un marqueur fluorescent, comme le plasmide de CMVp-EGFP9 utilisés dans le présent protocole.
- Utiliser des outils appropriés de web et bioinformatiques pour sélectionner une séquence potentiellement protection immunitaire antigène (ou plusieurs séquences) d’environ 90 – 600 nt (30 – 200 aa)26 dans l’ou les gènes-de-intérêt de l’agent pathogène qui est utilisé dans le modèle d’infection ultérieure.
- Utiliser un logiciel disponible ou concevoir manuellement des amorces pour amplifier les gènes de l’antigène du génome de l’agent pathogène et de cloner la découverte de l’antigène dans le site multiple du clonage du plasmide expression. Assurez-vous de préserver le cadre de lecture correct lors du choix de l’antigène.
- Inscrire un Kozak séquence (CCACC)27 et un codon de début (ATG) dans le primaire 5'. Afin de préserver la balise C-terminal EGFP, éviter les intermédiaires codons stop (TAG, TAA, TGA) dans la séquence de l’antigène et l’amorce de 3'. En outre, assurez-vous que la balise GFP reste dans le même cadre de lecture avec l’antigène d’intérêt.
- Utiliser ARN ou ADN extrait de l’agent pathogène comme modèle pour générer une quantité suffisante de produit de PCR avec des amorces pour les clonage. Utilisez de préférence, une relecture ADN polymérase pour conserver la séquence correcte d’antigène.
- Purifier le produit PCR et vérifier la taille correcte du produit par électrophorèse sur gel. Digérer et ligaturer le produit PCR avec le plasmide digéré vaccin.
- Transformer le mélange de ligation dans des cellules bactériennes compétentes selon un protocole adapté. Utiliser une sélection antibiotique appropriée pour les colonies positives et production de plasmides chez e. coli; le plasmide CMVp-EGFP, par exemple, contient un gène de résistance ampicilline pour cela.
- Utilisez Sanger séquençage pour confirmer l’insertion de la séquence correcte d’antigène. Les amorces suivants peuvent être utilisés pour les antigènes de séquençage dans le plasmide CMVp-EGFP : CMV avant 5'-CGCAAATGGGCGGTAGGCGTG-3 'et EGFP-N arrière 5' CGTCGCCGTCCAGCTCGACCAG-3'.
- Produire et purifier une quantité suffisante de la construction du vaccin. Dissoudre ou éluer le plasmide dans de l’eau stérile. Assurez-vous que l’ADN de plasmide produite est de haute qualité et la concentration est au moins 0,72 µM ou 2 000 ng/µL.
2. tirer les aiguilles de Microinjection
- Préparer à l’avance les aiguilles de microinjection. Utilisez des capillaires en verre aluminosilicate de 10 cm. Notez que les capillaires en verre de borosilicate sont trop fragiles pour injecter des poissons adultes.
- Tirer les aiguilles avec un dispositif de micropipette-aiguille-fabrication.
NOTE : Les aiguilles doivent être similaires à celle présentée dans la Figure 1. Le dispositif utilisé dans le présent protocole (Table des matières), les paramètres suivants se produisent dans le genre souhaité des aiguilles :- Définissez le verre capillaire dans la rainure en V dans la barre de l’extracteur et serrez le bouton de serrage légèrement.
- Le porte-à côté du filament et poussez doucement le tube capillaire par le filament dans la barre de l’extracteur de l’autre côté du filament. Évitez de toucher le filament avec le tube capillaire.
- Serrez les boutons de serrage, la valeur vers le bas de la vitre de sécurité et appuyez sur le bouton d’extraction.
ATTENTION : Le filament est chaud.
- Placer les aiguilles sur un morceau d’adhésif réutilisable à l’intérieur d’une plaque de 15 cm boîte de Pétri pour protéger les pointes d’aiguille. Garder le plat couvert pour nettoyer les aiguilles.
3. remplir les aiguilles Micropipette
- Préparer le mélange de vaccin. Utiliser 0,5 – 12 µg de plasmide par dose. Si vous associez plusieurs plasmides différents dans le mélange d’une vaccination, utiliser une concentration maximale de l’ADN totale de 12 µg par poisson.
- Calculer le volume du vaccin « master mix » selon le nombre de poissons dans chaque groupe (voir ci-dessous). Ajouter 1 µl de rouge de phénol stérile filtrée à chaque dose d’injection pour faciliter aussi bien le remplissage des aiguilles capillaires et l’observation de l’injection. Ajouter stérile 1 x PBS jusqu'à un volume total maximal de 5 – 7 µl en une seule injection dose8.
NOTE : Volumes d’Injection supérieures à 7 µL peuvent entraîner des fuites occasionnelles de la solution injectable et devraient, par conséquent, être évités. - Placez un morceau de ruban adhésif, colle vers le haut, sur un support approprié, par exemple, le côté d’une boîte vide de pointe. Attachez délicatement les aiguilles capillaires sur la bande.
- Distribuer un maximum de 7 µL du mélange vaccin sur un morceau de film de laboratoire. En utilisant un embout de chargement, transvaser le vaccin du film dans l’aiguille. Pipette lentement et avec précaution, évitez de pipetage bulles d’air dans l’aiguille.
- Laisser les aiguilles se contenter de 15 à 30 min éliminer les possibles autres petites bulles d’air.
4. réglage de la Microinjector et l’électroporateur pour la vaccination
- Définissez le micromanipulateur et une source de lumière dans la bonne position. Passer la prise de pression d’air à la position ouverte.
- Ajustez les paramètres pour le pneumatique pompe (voir aussi la Figure 2) comme suit.
- Programmez la ventilation sur le port d’éjection de tenir pour empêcher le renvoi de la pipette par capillarité. Définir la tubulure du port d’éjection à la micropipette. N’utilisez pas le port vide dans le présent protocole.
- Ajuster la durée d’impulsion: utiliser le timed mode, où une minuterie électronique contrôle la durée du temps l’électrovanne de pression reste ouvert. Vérifiez que le voyant vert à côté de la jauge de pression d’éjection s’allume lorsque le solénoïde de pression est ouvert (sous tension).
- La valeur du pouls gamme 10 s ; avec ce paramètre, les impulsions peuvent être davantage mises 100 ms à usage s. 10.1 la période 10-tour de cadran pour ajuster la longueur de l’impulsion — chaque tour du cadran est 1.0 s. Le cas échéant, cela peut également être ajusté pendant l’injection.
- Utilisez le générateur d’impulsions (bouton « Démarrer ») sur le panneau avant de la pompe pneumatique, ou une distance pédale (recommandé). Cela est lié à la face avant de la pompe pneumatique.
- Mettre l’aiguille sur le support d’une micropipette du micromanipulateur. Couper la pointe de l’aiguille avec la pince à épiler afin que le liquide peut être expulsé et le microscope permet d’afficher la position correcte. Appuyez sur la pédale de commande une fois de voir qu’une impulsion 1-s pousse une petite goutte de l’aiguille.
- Utilisez les paramètres suivants pour électroporateur: tension = 40 V ; durée d’impulsion = 50 ms, nombre d’impulsions = 6. Connecter les pinces à l’électroporateur. Voir que la tension réelle et la durée d’impulsion affiché sur l’écran ne diffèrent pas significativement les paramètres.
5. injection du vaccin à ADN et électroporation
- Pour les vaccinations selon ce protocole, utilisation saine, 6 à 12 mois adulte poisson zèbre. Garder le poisson dans un système d’écoulement avec un cycle lumière/obscurité de 14/10 h, avec un maximum de sept poissons par 1 L d’eau.
- Préparer une solution d’ester (tricaïne) des éthylique de l’acide de 3-aminobenzoïque 0,02 % (pH 7) dans le réservoir d’eau pour anesthésier les poissons28. Utilisez un plat de Pétri de 10 cm ou quelque chose de similaire.
- Préparer un réservoir de récupération en remplissant un bécher de 5 L avec 3 L d’eau propre système.
- Préparer une vaccination rembourrage pour garder le poisson dans une position fixe pendant la vaccination. Prenez un morceau de2 cm 5 x 7 d’un 2 à 3 cm d’épaisseur éponge. Une rainure dans l’éponge avec une lame de bistouri ou tranchants ciseaux.
Remarque : Le rembourrage même de vaccination peut être utilisé dans des expériences multiples. Désinfecter l’éponge entre les expériences il tremper dans de l’alcool éthylique 70 % et laisser pour sécher. - Bien faire tremper l’éponge dans l’eau du système et définir l’éponge sur une boîte de Pétri.
- Rapidement le poisson 24 h avant les vaccinations.
- Anesthésier un poisson zèbre en le plaçant sur une boîte de Pétri contenant de tricaïne 0,02 %. Attendez jusqu'à ce que le poisson ne réagit pas au toucher stimulation et jusqu'à ce qu’il n’y a aucun mouvement des branchies. Anesthésier un seul poisson à la fois.
- À l’aide d’une cuillère en plastique, transférer le poisson-zèbre anesthésié sur l’éponge humide et déposez la face ventrale du poisson dans la rainure. Dans la position correcte, s’assurer que la tête et du corps des poissons, la plupart est à l’intérieur de la rainure et la nageoire dorsale et la queue sont en saillie de la rainure.
- Sous le microscope, placez délicatement l’aiguille à un angle d’environ 45° à proximité de muscle dorsal de la poisson-zèbre, en utilisant les axes x et y affiner roues sur le micromanipulateur.
- Trouver la petite tache sans écailles devant la nageoire dorsale, où pousse l’aiguille n’exige pas de force. Si une résistance est ressentie, essayez un endroit adjacent. Ne pas blesser la colonne vertébrale, la nageoire dorsale ou les échelles.
Remarque : Si l’aiguille se penche tout en poussant, raccourcir l’aiguille légèrement en le coupant. - Utilisez le commutateur de pied progressivement d’injecter la solution de vaccin dans le muscle. Observer l’injection au microscope : rouge de phénol est visible comme elle pénètre dans les tissus musculaires. Régler la durée de l’impulsion si nécessaire.
NOTE : Également utiliser le bouton d’initiateur de pulse sur le panneau avant de la pompe pneumatique pour l’injection. Cependant, l’utilisation d’une pédale à distance permet à l’aide de l’autre main pour ajuster la longueur de l’impulsion de la roue de cadran 10 de tour. Éviter d’injecter la solution trop vite, car cela peut entraîner des lésions tissulaires excessive. Veillez à ne pas injecter de l’air. - Electroporate le poisson immédiatement après l’injection. S’assurer que le poisson est toujours sous anesthésie. Garder le poisson sur l’éponge et mettre le poisson entre les électrodes de type pince à épiler, pour que les électrodes sont situés de chaque côté du point d’injection. N’appuyez pas sur la pince à épiler électrode trop serré mais garder les deux électrodes en contact avec le poisson.
- Appuyez sur le bouton start sur l’électroporateur de donner six 40 V, impulsions de 50 ms.
- Doucement transférer les poissons dans le réservoir de récupération.
- Nettoyer les électrodes après chaque électroporation en les glissant avec l’éthanol à 70 %.
Remarque : Surveillez attentivement le bien-être du poisson après la vaccination. Euthanasier tout poisson montre des signes d’inconfort (une lente reprise de l’anesthésie, aberrant natation, haletant) de tricaïne 0,04 %. Après récupération, transférer le poisson vers l’unité intermédiaire et le nourrir normalement.
6. visualisation et l’imagerie de l’Expression de l’antigène
- Anesthésier les poissons de tricaïne 0,02 % 2 à 7 jours après la vaccination et une lumière UV permet de voir l’expression EGFP près du site d’injection.
NOTE : Inspection visuelle sous une lumière UV est une opération simple et non invasif qui convient à la vérification systématique de la vaccination réussie, aussi dans les expériences à grande échelle. Si aucune image du poisson n’est requis, cette étape aussi peut être réalisée que dans des réservoirs de poissons régulièrement sans avoir à anesthésier ou déplacer le poisson. - Pour capturer des images, utiliser un microscope à fluorescence pour visualiser expression EGFP à l’injection site8. Utilisez un objectif de 2 X et choisir le bon filtre pour visualiser la fluorescence ou vues de lumière visibles.
- Garder les poissons anesthésiés toujours en appuyant sur la nageoire ventrale délicatement avec la pince à épiler vers le fond de la boîte de Pétri. Prendre des images de microscopie et de fluorescence de la même région.
- Fusionner les images de microscopie et de fluorescence en utilisant le logiciel approprié29. Ajouter une barre d’échelle.
7. quantification du niveau d’Expression et de la taille des antigènes
- Euthanasier le poisson de tricaïne 0,04 %. Disséquer la partie fluorescente du muscle dorsal avec un bistouri et pince à épiler sous lumière UV. Extrait de protéines de l' échantillons8.
- Vérifier la taille correcte de in vivo-produit des protéines avec une analyse par transfert western, à l’aide d’une peroxydase de raifort (HRP)-anticorps conjugué de GFP (ou similaire)8. Inclure un contrôle négatif (poisson non immunisés) afin d’exclure toute les signaux de fond et de la liaison non-spécifique, ainsi qu’un contrôle exprimant EGFP sans un antigène fusionné.
Remarque : Pour l’analyse par western blot, la taille attendue (en kDa), l’antigène-des protéines de fusion peut être calculée, par exemple, par l’équation :
Poids moléculaire (MW) d’ADN double brin = (nombre de nucléotides x 607.4) + 157,9 ; ou en utilisant des outils basés sur le web. - Quantifier l’expression de chaque antigène utilisant un GFP-ELISA8 (facultatif).
8. combiner le protocole de Vaccination avec un modèle d’Infection de M. marinum
- Déterminer la taille de groupe nécessaire à la détermination fiable de l’efficacité d’un candidat vaccin novateur dans le modèle de l’infection et le test utilisé (voir, par exemple, Myllymaki et coll.. 24 et Charan et Kantharia30). Effectuer les calculs de puissance appropriée tout en planifiant les expériences.
- Pour évaluer l’efficacité des vaccins expérimentaux, infecter les sérologies de 5 semaines de poisson. Utilisez une infection intrapéritonéale avec environ 30 unités formant colonie (UFC) de M. marinum, qui conduit à une infection latente dans la plupart des poissons8,20,31.
Remarque : Lorsque vous utilisez M. marinum, suivre un protocole de sécurité BSL2. La préparation de la bactérie ou le virus dépend de l’agent pathogène. - Quantifier le nombre d’agents pathogènes dans chaque poisson. Euthanasier l’après l’infection poisson 4semaines et déterminer la charge bactérienne dans chaque poisson de l’extrait d’ADN avec le qPCR en utilisant des amorces spécifiques pour M. marinum20,24.
Remarque : N’oubliez pas d’inclure un groupe de contrôle approprié et utilisez les méthodes correctes de statistiques pour analyser les résultats. En règle générale, un groupe de poissons vaccinés avec le plasmide vide CMVp-EGFP est un contrôle négatif approprié. - Confirmer les résultats positifs avec des antigènes sans l’étiquette de GFP. Cloner les antigènes tel que décrit à l’étape 1 et répétez l’expérience de la vaccination.
Résultats
Les étapes à suivre pour le protocole de vaccination ADN du poisson-zèbre adulte sont illustrées à la Figure 3. Dans un premier temps, les séquences sélectionnées de l’antigène sont clonés dans un plasmide CMVp-EGFP et l’ADN plasmidique est produit et purifié24 (Figure 3). Vaccins candidats sont ensuite injectées par voie intramusculaire avec un microinjector et le site d’injection est électroporation pour améliorer l’absorption du plasmide dans les cellules (Figure 3). La dose de vaccination utilisés a été optimisée en injectant des quantités différentes du plasmide CMVp-EGFP et mesurer l’expression de la GFP par ELISA (supplémentaire Figure 1). Deux après la vaccination sept jours, l’expression de la protéine de fusion est détecté sous la lumière UV et visualisé à l’aide de la microscopie de fluorescence (Figure 3 et Figure 4). Les niveaux d’expression des antigènes différents peuvent varier de très forte intensité (antigène 1) à une expression faible (Figure 4). En outre, expression de la GFP peut être observée à travers le muscle dorsal (antigène 1), ou dans une zone plus limitée (antigène 2) (Figure 4). Toutefois, si aucune fluorescence n’est détectée dans les 10 jours, il est recommandé de s’assurer qu’il n’y a pas d’erreurs dans la conception de clonage ou d’apprêt antigène. Pour confirmer que la protéine de fusion exprimée est de taille correcte, protéines peuvent être extraite du tissu musculaire autour du site d’injection et utilisés pour une analyse par western blot.
L’effet des candidats vaccins est évaluée en contestant le poisson avec une faible dose de M. marinum par injection intrapéritonéale (Figure 5). Quatre à cinq semaines après l’infection, le nombre de bactéries est déterminé avec le qPCR et par rapport aux charges bactériennes dans le groupe témoin (Figure 5). En outre, l’efficacité des candidats plus prometteurs de vaccin peut être testée en surveillant la survie après une forte dose de M. marinum infection()Figure 5). Cependant, en plus de donner un résultat quantitatif sur la progression de l’infection, au lieu de simplement un statut de vivants ou morts, la quantification axée sur le qPCR UFC nécessite moins de temps et groupe de plus petites tailles et est, par conséquent, une approche plus éthique pour un primaire écran. Dans l’ensemble, ce protocole facilite le contrôle de l’efficacité de nouveaux antigènes dans les 12 semaines (Figure 5).

Figure 1 : Gros plan (X 12) des aiguilles aluminosilicate utilisé dans les injections intra musculaire de poisson-zèbre adulte. L’astuce ci-dessous a été coupée avec des pincettes et est prêt à être utilisé pour des microinjections. Ce chiffre a été adapté de Oksanen35. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : équipement de Microinjection et set-up. Les principales composantes de l’équipement requis pour la vaccination de l’ADN des poissons zèbres adultes sont mis en évidence en caractères gras. Les ajustements critiques sont indiqués. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : préparer les plasmides de vaccin ADN ainsi que la procédure de vaccination. (1) certains antigènes sont clonés adjacent à la balise GFP dans le plasmide CMVp-EGFP. Construction (2), le vaccin est produite microbiologiquement, concentrée et purifiée. (3) 12 µg de plasmide est injecté dans le muscle dorsal d’un poisson-zèbre adulte anesthésié avec un microinjector, et le site d’injection est ensuite électroporation avec six impulsions de 40-V, 50-ms. (4) après la vaccination de deux à sept jours, l’expression de la GFP de la protéine de fusion de GFP-antigène est visualisée à l’aide d’un microscope à fluorescence. (5), le fluorescent partie du muscle dorsal peut être disséquée et utilisé pour l’extraction de protéines. La taille de la protéine de fusion est confirmée par une analyse par western blot et le niveau d’expression avec GFP-ELISA. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : visualiser l’expression de la protéine de fusion d’antigène-EGFP. Poisson-zèbre adulte anesthésié sont vaccinés avec 12 µg d’antigènes de vaccin expérimental (antigène 1 – 3) et le site d’injection est électroporation, par la suite, avec six 40 V, ms 50 impulsions. Deux après la vaccination sept jours, le site d’injection est photographié avec un microscope. Tout d’abord, l’expression de la GFP est détectée sous un microscope à fluorescence. La zone est inspectée à l’aide d’un objectif de grandeur 2 X et imagé et sauvegardé sous forme de .tiff. L’image au microscope photonique de la même région est fusionnée avec l’image de fluorescence en utilisant le logiciel ImageJ. La quantité et la position de l’expression de l’antigène peuvent varier entre les antigènes et les poissons. Par exemple, l’expression de l’antigène 1 est observée à travers le muscle dorsal et l’expression de l’antigène 2 est considérée comme de petites taches, alors qu’antigène 3 est fortement exprimé dans une zone plus limitée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
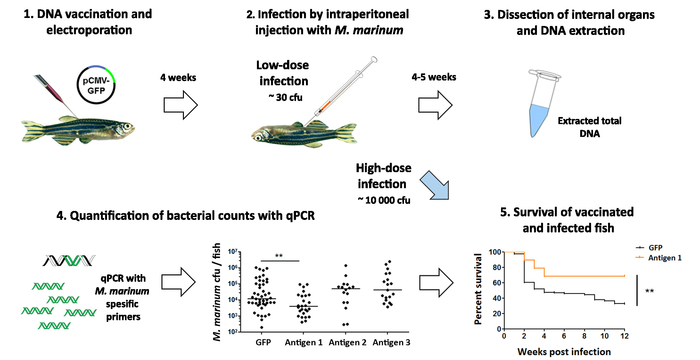
Figure 5 : analyse de l’efficacité des vaccins expérimentaux contre une infection mycobactérienne. Le poisson-zèbre (1) adulte sont vaccinés avec des vaccins ADN expérimentaux contre Mycobactériose. Après la vaccination (2) cinq semaines, les poissons sont infectés par une faible dose de Mycobacterium marinum (~ 30 UFC). (3), quatre semaines plus tard, l’internes organes sont disséqués et utilisés pour l’extraction de l’ADN. (4), la teneur en bactéries dans chaque poisson est quantifiée avec qPCR à l’aide de M. marinum-amorces spécifiques. La vaccination avec l’antigène 1 conduit à une diminution significative de la numération bactérienne (p < 0,01, ANOVA double sens), tandis que les antigènes 2 et 3 reste sans effet. Effet (5) la protection du candidat-vaccin plus prometteur (antigène 1) est également évaluée dans une expérience de survie, où les poissons sont infectées avec une dose élevée (~ 10 000 UFC) des bactéries et leur survie est surveillée pendant 12 semaines. En accord avec la diminution de la charge bactérienne observée dans le groupe 4, vaccination avec l’antigène 1 a également amélioré la survie des poissons après une infection de M. marinum (p < 0,01), ce qui suggère cet antigène pourrait être prometteur candidat pour un nouveau vaccin contre la tuberculose. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Supplémentaire Figure 1 : quantité d’ADN plasmidique influe sur l’expression de EGFP dérivée d’un plasmide chez le poisson zèbre adulte. Groupes de poissons (n = 5 dans chaque groupe) ont reçu une injection de 0,5 à 20 μg de CMVp-EGFP, électroporation (six impulsions de 50 V) a été utilisée pour améliorer la transfection. Poisson de contrôle (CTRL) ont été injectés avec 2 μg du plasmide CMVp vide ne contenant ne pas le gène EGFP. GFP-ELISA a été réalisée 3 jours après l’injection pour définir l’expression EGFP relative dans des homogénats de poissons. P-values : *p < 0,03, **p < 0,004. Les barres d’erreur représentent des écarts-types. NS = non significatif. Ce chiffre a été adapté de Oksanen35. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La procédure de vaccination des adulte poisson zèbre avec vaccins ADN nécessite une expertise technique. Même pour un chercheur expérimenté, vacciner un seul poisson prend environ 3 min, à l’exclusion des préparations. Ainsi, un maximum de poissons environ 100 peut être immunisé en une journée. Si plus de 100 poissons sont nécessaires pour l’expérience, les vaccinations peuvent être divisées entre jusqu'à 3 jours. Outre la qualité de l’expérience, une formation suffisante des chercheurs pour manipulation du poisson et l’exécution de la vaccination est essentielle pour le bien-être des poissons. Assurez vous de suivre les lignes directrices et règles locales légales et de bien-être animal en ce qui concerne les poissons, les expériences et les qualités requises pour le personnel effectuant les expériences de planification du logement.
En résumé, il y a plusieurs étapes cruciales pour éviter des complications dans le protocole de vaccination. Pour la vaccination réussie, vérifiez que 1) le poisson soient vaccinés est sains et suffisamment en âge et en taille (la vaccination de plus juvéniles peut exigez échelle vers le bas le volume de vaccin et les paramètres d’électroporation) ; 2) les poissons sont correctement anesthésiés avec non plus fort que 0,02 % 3-aminobenzoïque acide éthyl ester, et ils restent anesthésiés pendant toute la procédure (anesthésie doit être conservé aussi courte que possible pour assurer la récupération du poisson) ; 3) le plateau en mousse est bien trempé ; 4) liquide est injecté dans chaque impulsion de la pompe pneumatique et, sinon, la durée d’impulsion est ajustée (tirant l’aiguille légèrement en arrière le long de l’axe y peut aider) ; 5) il n’y a pas de bulles d’air avec la solution de vaccin ; 6) les paramètres de l’électroporation et la tension d’impulsion réelle et la longueur sont corrects ; 7) les électrodes ne causent pas de dommages à la peau sur le site d’électroporation (au cours de l’électroporation, gardez les électrodes dans douce en contact avec le poisson et libérer le poisson immédiatement dans le réservoir de récupération après électroporation).
Il est important de surveiller le poisson après l’électroporation dans le réservoir de récupération et d’euthanasier les poissons montrent des signes d’inconfort. En outre, il est nécessaire de pratiquer la procédure avant de commencer une expérience à grande échelle, afin d’assurer un flux de travail courant. Si possible, demandez à un collègue suffisamment formé pour l’assistance avec les aiguilles et l’électroporation de remplissage.
La méthode de vaccination ADN permet de concevoir sur mesure des antigènes vaccinaux. Il est possible de cloner l’antigène entier ou, préférablement, sélectionner des parties de l’antigène basés sur la localisation et l’immunogénicité cellulaire24. En outre, la méthode permet combiner plusieurs antigènes ou adjuvants en construction un vaccin ou injecter plusieurs plasmides distincts dans le même temps2. En incluant un codon d’arrêt après la séquence de l’antigène ou en retranchant les gènes EGFP du plasmide, il est possible d’utiliser le même vecteur plasmidique aussi pour exprimer l’antigène sans l’étiquette de N-terminal GFP ultérieur. Cela peut être raisonnable pour confirmer les résultats de dépistage positifs, comme la taille relativement grande de GFP peut affecter le pliage de l’antigène et, ainsi, de limiter les réponses humorales potentiellement induites par la vaccination.
Une expression de l’antigène plus élevée a été liée à l’ADN d’immunogénicité du vaccin2. Électroporation après injection ainsi, a été incluse dans le présent protocole, comme il a été montré pour augmenter l’expression des antigènes ou des gènes rapporteurs de quatre à dix fois dans le poisson-zèbre,32. Par ailleurs, électroporation comme technique provoque des lésions modérées, induisant ainsi une inflammation locale qui favorise davantage le vaccin a induit des réponses immunitaires2. En revanche, l’électroporation est généralement bien tolérée. Avec le matériel utilisé ici, pratiquement 100 % du poisson-zèbre adulte va récupérer bien partir les six impulsions de 40 V utilisée dans ce protocole35.
Outre l’utilisation d’électroporation pour améliorer l’entrée du plasmide vaccin dans les cellules, nous utilisons un ardent promoteur omniprésent dans le plasmide de vaccin et une queue polyA à l’extrémité 3' de l’antigène pour améliorer l’expression de l’antigène dans les cellules transfectées de poissons. Dans certains cas, si l’utilisation de codon de l’agent pathogène cible diffère considérablement de l’espèce vaccinés, optimisation de codons a été trouvée utile pour renforcer encore la cible gene expression2. Dans ce modèle de poisson-zèbre -M. marinum , cependant, optimisation de codons n’eu aucun effet significatif sur les niveaux d’expression de deux gènes modèle mycobactériennes, ESAT-6 et CFP-10 et a, ainsi, été considérées comme nécessaire dans ce modèle35 .
Profils d’expression des gènes cible ont des variations temporelles entre les antigènes, selon, par exemple, la taille et la structure des antigènes en cause. Cependant, l’expression de l’antigène est généralement similaire au sein d’un groupe de poissons vaccinés avec le vaccin même. En règle générale, la plus brillante expression EGFP est observée quatre jours, une semaine après la vaccination, mais une échelle de 2 à 10 jours est possible. Il est recommandé de valider l’expression de chaque protéine de fusion d’antigène-EGFP dans un petit groupe de poissons (2 – 3) avant d’inclure l’antigène dans une expérience à grande échelle. Si aucune expression de la GFP n’est observée à n’importe quel point 2 – 10 jours après la vaccination, assurez-vous que 1) le protocole de vaccination a été bien suivi. Toujours avoir un groupe de poissons vaccinés avec le plasmide vide CMVp-EGFP comme témoin positif et s’assurer que 2) la conception de l’antigène et le clonage moléculaire a été effectué correctement (conception d’amorce adéquate ; l’antigène et la balise EGFP sont à la fois dans la même trame de lecture et aucune intervention codons stop sont inclus). Dans certains cas, malgré la conception correcte de l’antigène, GFP ne peuvent pas être détecté. Cela peut être causée par un mauvais pliage ou la rapide dégradation de la protéine de fusion. Dans ces circonstances, il peut être nécessaire de revoir l’antigène.
Dans les vaccins permettant d’immuniser des poissons d’élevage, la dose de plasmide utilisée est généralement de 1 µg ou moins7,33,34. Chez le poisson zèbre, expression du gène rapporteur peut également être détectée après au moins une injection de plasmide 0,5 µg après électroporation ; Toutefois, l’expression du gène cible relative augmente de manière significative avec un montant plus élevé du plasmide par poisson (supplémentaire Figure 1). Chez les poissons injectés avec le plasmide de journaliste CMVp-EGFP, une injection de 5 à 20 µg de plasmide a entraîné quatre à huit fois supérieur EGFP niveaux par rapport aux poissons injecté avec 0,5 µg. Par conséquent, pour assurer une expression du gène cible suffisamment élevée, tout en ayant des volumes d’injection qui sont assez petit (≤7 µL) pour empêcher tout endommagement des tissus en excès ou fuite de vaccin, nous avons choisi utiliser 5 à 12 µg / poisson à des fins de présélection. En plus de l’immunogénicité des vaccins, un haut assez l’expression des gènes cible est nécessaire pour détecter l’expression du gène rapporteur avec un microscope à fluorescence et tache occidentale, qui est nécessaire pour les fins de confirmer la bonne in vivo de la présélection traduction de l’antigène cible. Cependant, le plasmide plus faible doses (0,5 à 1 µg) peut être utile pour d’autres types d’utilisations expérimentales.
En conclusion, le présent protocole pour la vaccination des adulte poisson zèbre avec un plasmide d’ADN peut être utilisé dans les essais précliniques de nouveaux vaccins candidats contre diverses infections bactériennes ou virales. L’expression de l’antigène vaccinal comme une protéine GFP-fusion permet la visualisation d’une expression d’événement et l’antigène de vaccination réussie. Nous appliquons cette méthode de dépistage préclinique des candidats de l’antigène du nouveau vaccin contre la tuberculose. Pour ce faire, nous infecter l’après la vaccination cinq semaines poisson-zèbre et déterminer que les bactéries compte dans chaque poisson avec qPCR20,24.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs sont reconnaissants aux membres du groupe de recherche immunologie expérimentales, et surtout à Leena Mäkinen et Hannaleena Piippo, pour tout le travail qu’ils ont accompli dans l’élaboration et l’optimisation du protocole de vaccination et leur aide dans des expériences réelles en utilisant le protocole.
Ce travail a été soutenu par Jane ja Aatos Erkon Säätiö (Jane et Aatos Erkko Foundation ; à M.R.), Sigrid Juséliuksen Säätiö (Fondation Juselius Sigrid ; pour M.R.), la concurrence recherche financement par l’état de la zone de responsabilité de l’Expert de l’Université de Tampere L’hôpital (M.R.), Tampereen Tuberkuloosisäätiö (Tampere tuberculose Foundation ; pour M.R., H.M. et M.N.), Suomen Kulttuurirahasto (Fondation culturelle finlandaise ; pour H.M.), Suomen Tuberkuloosin Vastustamisyhdistyksen Säätiö (finlandaise contre la tuberculose Fondation ; à H.M.), Väinö ja säätiö de Laina Kiven (Väinö et Laina Kivi Foundation ; à M.N.) et la ville de Tampere Science Foundation (à M.N.).
matériels
| Name | Company | Catalog Number | Comments |
| pCMV-GFP plasmid | Addgene | #11153 | |
| 2-propanol | Sigma-Aldrich | 278475-2L | DNA extraction |
| Ampicillin sodium salt | Sigma-Aldrich | A0166-5G | |
| Chloroform | Merck | 1.02445.2500 | DNA extraction |
| ECM Electro Square Porator | BTX Harvard apparatus | BTX ECM 830 | |
| FastPrep-24 5G | MP Biomedicals | 116005500 | homogenizer |
| Flaming/brown micropipette puller | Sutter Instrument Co. | P-97 | Pulling of needles |
| GeneJet PCR Purification kit | ThermoFischer Scientific | K0701 | |
| GFP ELISA kit | Cell Biolabs, Inc. | AKR-121 | |
| Guanidine thiocyanate (FW 118.2) | Sigma-Aldrich | G9277-500G | DNA extraction |
| ImageJ2 | imagej.net/Downloads | freely available software | |
| LB Agar | Sigma | L2897-1kg | |
| LB Broth (Miller) | Sigma | L3522-1kg | |
| Micromanipulator | Narishige | MA-153 | |
| Microscope | Nikon | AZ100 | fluorescense microscope |
| Microscope | Olympus | ZS61 | |
| Nightsea Full adapter system w/Royal Blue Color light head | Electron Microscopy Sciences | SFA-RB | |
| PBS tablets | VWR Chemicals | E404-200TABL. | |
| Phenol red sodium salt | Sigma-Aldrich | 114537-5G | |
| PV830 Phneumatic Pico Pump | WPI | SYS-PV830 | |
| QIAGEN Plasmid Maxi kit | Qiagen | ID:12163 | plasmid extraction |
| Sodium citrate (FW294.1) | VWR Chemicals | 27833.294 | DNA extraction |
| Tri Reagent | Molecular Research Center, Inc. | TR 118 | DNA extraction |
| Tricaine (ethyl 3-aminobenzoate methanesulfonate salt) | Sigma | A5040-100g | anestesia and euthanasia solution |
| Tris (free base) (FW121.14) | VWR Life Science | 0497-500G | DNA extraction |
| Tweezertrodes Electrodes (7mm) Kits | BTX Harvard apparatus | BTX 450165 | tweezer type electrodes |
| 2.8 mmCeramic beads | Omni International | 19-646-3 | DNA extraction |
| 2ml Tough tubes with caps | Omni International | 19-649 | DNA extraction |
| Aluminosilicate capillaries | Harvard apparatus | 30-0108 | |
| Microloader 20 µl | eppendorf | 5242956.003 | loading tips |
| Petri dishes, 16 mm | Sarsted | 82.1473 | |
| Scalpels | Swan Morton | 0501 | |
| Parafilm | Bemis | laboratory film | |
| Pins | |||
| Plastic spoon | |||
| Spatula | |||
| Sponge | |||
| Styrofoam workbench | |||
| Tweezers |
Références
- Tang, D. C., DeVit, M., Johnston, S. A. Genetic immunization is a simple method for eliciting an immune response. Nature. 356 (6365), 152-154 (1992).
- Tregoning, J. S., Kinnear, E. Using Plasmids as DNA Vaccines for Infectious Diseases. Microbiology Spectrum. 2 (6), (2014).
- Evensen, O., Leong, J. A. DNA vaccines against viral diseases of farmed fish. Fish Shellfish Immunology. 35 (6), 1751-1758 (2013).
- Sommerset, I., Lorenzen, E., Lorenzen, N., Bleie, H., Nerland, A. H. A DNA vaccine directed against a rainbow trout rhabdovirus induces early protection against a nodavirus challenge in turbot. Vaccine. 21 (32), 4661-4667 (2003).
- Li, L., Petrovsky, N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Review of Vaccines. 15 (3), 313-329 (2016).
- Embregts, C. W. E., et al. Intramuscular DNA Vaccination of Juvenile Carp against Spring Viremia of Carp Virus Induces Full Protection and Establishes a Virus-Specific B and T Cell Response. Frontiers in Immunology. 8, 1340 (2017).
- Lorenzen, N., LaPatra, S. E. DNA vaccines for aquacultured fish. Revue scientifique et technique (International Office of Epizootics). 24 (1), 201-213 (2005).
- Oksanen, K. E., et al. An adult zebrafish model for preclinical tuberculosis vaccine development. Vaccine. 31 (45), 5202-5209 (2013).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proceedings of the National Academy of Sciences of the United States of America. 101 (1), (2004).
- Cho, J. H., Youn, J. W., Sung, Y. C. Cross-priming as a predominant mechanism for inducing CD8(+) T cell responses in gene gun DNA immunization. The Journal of Immunology. 167 (10), 5549-5557 (2001).
- Lewis, K. L., Del Cid, N., Traver, D. Perspectives on antigen presenting cells in zebrafish. Developmental & Comparative Immunology. 46 (1), 63-73 (2014).
- Shao, T., et al. Characterization of surface phenotypic molecules of teleost dendritic cells. Developmental & Comparative Immunology. 49 (1), 38-43 (2015).
- Utke, K., et al. Cell-mediated immune responses in rainbow trout after DNA immunization against the viral hemorrhagic septicemia virus. Developmental & Comparative Immunology. 32 (3), 239-252 (2008).
- Cuesta, A., et al. An active DNA vaccine against infectious pancreatic necrosis virus (IPNV) with a different mode of action than fish rhabdovirus DNA vaccines. Vaccine. 28 (19), 3291-3300 (2010).
- Castro, R., et al. DNA vaccination against a fish rhabdovirus promotes an early chemokine-related recruitment of B cells to the muscle. Vaccine. 32 (10), (2014).
- Iwanami, N. Zebrafish as a model for understanding the evolution of the vertebrate immune system and human primary immunodeficiency. Experimental Hematology. 42 (8), 697-706 (2014).
- Patterson, H., et al. Adult zebrafish model of bacterial meningitis in Streptococcus agalactiae infection. Developmental & Comparative Immunology. 38 (3), 447-455 (2012).
- Cronan, M. R., Tobin, D. M. Fit for consumption: zebrafish as a model for tuberculosis. Disease Model & Mechanisms. 7 (7), 777-784 (2014).
- Tobin, D. M., Ramakrishnan, L. Comparative pathogenesis of Mycobacterium marinum and Mycobacterium tuberculosis. Cellular Microbiology. 10 (5), 1027-1039 (2008).
- Parikka, M., et al. Mycobacterium marinum causes a latent infection that can be reactivated by gamma irradiation in adult zebrafish. PLoS Pathogens. 8 (9), e1002944 (2012).
- Rounioja, S., et al. Defense of zebrafish embryos against Streptococcus pneumoniae infection is dependent on the phagocytic activity of leukocytes. Developmental & Comparative Immunology. 36 (2), 342-348 (2012).
- Myllymaki, H., Bauerlein, C. A., Ramet, M. The Zebrafish Breathes New Life into the Study of Tuberculosis. Frontiers in Immunology. 7, 196 (2016).
- Myllymaki, H., Niskanen, M., Oksanen, K. E., Ramet, M. Animal models in tuberculosis research - where is the beef?. Expert Opinion on Drug Discovery. 10 (8), 871-883 (2015).
- Myllymaki, H., et al. Identification of novel antigen candidates for a tuberculosis vaccine in the adult zebrafish (Danio rerio). PLoS One. 12 (7), e0181942 (2017).
- Myllymaki, H., Niskanen, M., Luukinen, H., Parikka, M., Ramet, M. Identification of protective postexposure mycobacterial vaccine antigens using an immunosuppression-based reactivation model in the zebrafish. Disease Model & Mechanisms. 11 (3), (2018).
- Ingolotti, M., Kawalekar, O., Shedlock, D. J., Muthumani, K., Weiner, D. B. DNA vaccines for targeting bacterial infections. Expert Review of Vaccines. 9 (7), 747-763 (2010).
- Kozak, M. Recognition of AUG and alternative initiator codons is augmented by G in position +4 but is not generally affected by the nucleotides in positions +5 and +6. The EMBO Journal. 16 (9), 2482-2492 (1997).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies?. Journal of Pharmacology and Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Hammaren, M. M., et al. Adequate Th2-type response associates with restricted bacterial growth in latent mycobacterial infection of zebrafish. PLoS Pathogens. 10 (6), e1004190 (2014).
- Rao, N. M., Rambabu, K. M., Rao, S. H. Electroporation of adult zebrafish. Methods in Molecular Biology. 423, 289-298 (2008).
- McCaffrey, J., Donnelly, R. F., McCarthy, H. O. Microneedles: an innovative platform for gene delivery. Drug Delivery and Translational Research. 5 (4), 424-437 (2015).
- Lorenzen, E., Lorenzen, N., Einer-Jensen, K., Brudeseth, B., Evensen, O. Time course study of in situ expression of antigens following DNA-vaccination against VHS in rainbow trout (Oncorhynchus mykiss Walbaum) fry. Fish and Shellfish Immunology. 19 (1), 27-41 (2005).
- Oksanen, K. Adult Zebrafish Model for Studying DNA-based Vaccination against Mycobacterial Disease. Tampereen yliopisto. , (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon