Method Article
Atingir pressões moderadas em vasos selados usando gelo seco como uma sólido CO2 fonte
Neste Artigo
Resumo
Aqui nós apresentamos um protocolo para a realização de reações em vasos simples reação sob pressões de baixa a moderada de CO2. As reações podem ser executadas em uma variedade de navios simplesmente através da administração de dióxido de carbono na forma de gelo seco, sem a necessidade de equipamento caro ou elaborado ou set-ups.
Resumo
Neste documento é apresentada uma estratégia geral para realizar reações sob ligeira a moderada CO2 pressões com gelo seco. Esta técnica elimina a necessidade de equipamento especializado alcançar pressões modestas e ainda pode ser usada para atingir altas pressões em equipamentos mais especializados e mais resistentes navios de reação. No final da reação, os frascos podem facilmente ser despressurizados pela abertura à temperatura ambiente. No presente exemplo CO2 serve como um putativo grupo diretor, bem como uma maneira de passivate substratos de amina, evitando a oxidação durante a reação de organometálica. Além de ser facilmente adicionados, o grupo diretor é removido também sob vácuo, obviating a necessidade para a purificação extensiva remover o grupo diretor. Esta estratégia permite a facile γ-C(sp3)-H arylation de aminas alifáticas e tem potencial para ser aplicado a uma variedade de outras reações baseadas em amina.
Introdução
O uso de compostos gasosos em reações químicas, normalmente, requer equipamento especializado e procedimentos1,2. Em escala de bancada, alguns gases podem ser adicionados diretamente a partir de um tanque usando um regulador de alta pressão3. Um método alternativo é condensar o gás sob condições criogênicas4,5. Embora úteis, essas estratégias requerem o uso de reatores de pressão especializados com válvulas, que podem ser o custo proibitivo para a execução de diversas reações em paralelo. Isto pode, portanto, extremamente lento a taxa na qual reação pode proceder triagem. Como resultado, os químicos encontrado desejável introduzir estes compostos usando métodos alternativos. Amônia pode ser adicionada a reações utilizando sais de amónio diferentes carboxilato, aproveitando-se do fraco equilíbrio entre estes sais e amônia livre6. Hidrogenação de transferência é uma importante estratégia para reações de redução de olefinas, carbonila e grupos nitro que contorna o uso do gás de hidrogênio inflamável com compostos como formiato de amônio ou hidrazina como portadores de H27. Um outro gás de interesse nesta área é o monóxido de carbono8 – CO pode ser gerado em situ pela libertação de metal carbonilo complexos9,10, ou como alternativa que pode ser gerado pelo decarbonylation de fontes como formatos e formamides11,12,13 ou clorofórmio14,15.
Um gás que não tem tido um desenvolvimento significativo a este respeito é o dióxido de carbono,16. Uma razão para isso é que muitas transformações que envolvem CO2 também requerem altas temperaturas e pressões e assim, automaticamente são relegadas para reatores especializados17,18. Recentes esforços para desenvolver catalisadores mais reativos, no entanto, ter facilitado executando muitas destas reações sob pressão atmosférica de CO219,20,21,22. Recentemente, descobri que uma reação em que o dióxido de carbono poderia ser usado para mediar a γ-C (sp3) – H arylation de aminas alifáticas23. Esta estratégia era esperada para combinar os benefícios de uma abordagem de grupo diretor estático incluindo Amida24,25,26,,27,28, sulfonamida 29 , 30 , 31 , 32, thiocarbonyl33,34ou hidrazona35-baseado dirigindo grupos (robusticidade químico), com a facilidade de um grupo diretor transitório (diminuição da etapa economia)36, 37,38,39.
Embora a reação poderia ocorrer sob pressão atmosférica de CO2, a necessidade de uma armadilha de Schlenk para reações de tela provou ser proibitivamente lento. Além disso, aumentando a pressão ligeiramente levada a melhorou o rendimento da reação, mas pode não ser facilmente conseguido usando uma linha de Schlenk. Procuramos, portanto, uma estratégia alternativa, e posteriormente identificado esse gelo seco pode ser facilmente usado como uma fonte sólida de CO2 , que pode ser adicionado a uma variedade dos vasos de reação para introduzir a quantidade necessária de dióxido de carbono para atingir moderada pressões (Figura 1). Embora subutilizados em síntese, uma estratégia semelhante é bastante comum, como um método para gerar o líquido de CO2 para cromatografia e extração aplicações40,41,42,43, 44. Utilizar esta estratégia permitiu que o nosso grupo para rapidamente tela um grande número de reações em paralelo, enquanto a capacidade de acesso moderado CO2 pressões de entre 2-20 atmosferas foram fundamental para melhorar o rendimento das reações. Sob estas condições, tanto primárias (1°) e aminas secundárias (2°) podem ser arylated com elétrons ricos e haletos de arila pobre do elétron.
Protocolo
Atenção: 1) os seguintes protocolos têm sido considerados seguros através de ensaios repetidos. No entanto, o cuidado deve ser exercitado quando selar frascos, em toda a reação, e especialmente ao abrir as reações, como homogeneidade na reação de frascos podem levar a falha do equipamento. Os frascos devem ser inspecionados para usar antes da defeitos físicos. Os frascos devem ser colocados atrás de alguma forma de viseira ou faixa capô imediatamente após selagem para evitar incidentes deve os frascos falhar. 2) apesar de haver pouca chance para asfixia devido as pequenas quantidades de CO2 usado, reações devem ser armação bem como aberta em um local bem ventilado ou em uma coifa. 3) o gelo seco é um cryogen e podem causar dano tecidual grave. Deve, portanto, ser cuidado enquanto manipulação para evitar queimaduras, como limitar o contato direto ou usar luvas criogênicas. 4) gelo seco irá condensar o vapor de água, significando que, antes da utilização, o gelo seco deve ser mecanicamente esfoliado, para garantir que a massa é de CO2 (s) apenas. Isto pode ser conseguido simplesmente esfregando o gelo seco entre os dedos, ou com mais segurança, esfregando-o entre os dedos com uma camada protectora como uma luva ou uma toalha.
1. a reação em um frasco de 7,5 mL (ar não excluído)
- Adicione uma barra de agitação para um frasco seco 7,5 mL.
- Adicione o acetato de paládio (6,7 mg, 0.03 mmol) para o frasco.
- Adicione contra-íons prata (99,9 mg, 0.45 mmol) para o frasco.
- Adicione iodeto de fenil (92,3 mg, 0.45 mmol) para o frasco.
- Adicionar tert-amina amílico (26,3 mg, 0.30 mmol) para o frasco.
- Adicione o ácido acético (1,0 mL) no frasco.
Nota: A relação do volume de solução para o frasco tamanho é importante, como a sublimação imediata de CO2 , após adição de gelo seco pode deslocar mecanicamente solvente se demais é usado em relação ao tamanho da embarcação da reação. - Adicione água desionizada (21,7 μL, 12.1 mmol) para o frasco.
- Gelo seco (26,3 mg, 0,60 mmol) de pesar, e imediatamente adicionar gelo seco para o frasco, garantindo a vedação também imediatamente o frasco com uma tampa de PTFE-alinhado.
Nota: Toda a operação deve ser realizada em aproximadamente 5 segundos para evitar a fuga da pequena quantidade de CO2 adicionado e sublimação (isto é retardado pela formação de congelados ácido acético em torno do gelo seco). A quantidade de CO2 adicionado será um valor aproximado, e em nossas mãos um desvio de alguns mg é admissível. - Agite o frasco de reação selado durante 15 minutos à temperatura ambiente.
- A embarcação da reação de transferência para um prato pré-aquecido a 110 ° C e mexa por 14 horas antes de permitir que arrefecer.
- Em cima de refrigerar, abra cuidadosamente o frasco para exalar CO2.
- Remova todos os compostos voláteis no vácuo.
Nota: Esta operação pode ser executada no frasco, ou a solução pode ser transferida para um balão de fundo redondo maior. - Adicionar 1,2 M HCl(aq) (6 mL) a mistura de reacção e mexa aberta ao ar durante 15 minutos.
- Transferir a fração aquosa para um funil de separação, lavar com adicional 1.2 M HCl (4 mL) e o extrato com uma mistura 1:1. o éter dietílico/hexanos (3 x 8 mL).
Nota: Esta lavagem orgânica contém o iodeto de fenil em excesso e outros subprodutos neutros e pode ser eliminada. - Neutralizar e fazer a solução aquosa básica por adição de saturada NH4OH(aq) (10ml é um bom ponto de partida).
- Extraia a fase aquosa com diclorometano (2 x 10 mL).
- Seque as frações orgânicas combinadas sobre at2para que4e, em seguida, filtro em uma amostra de tarada frasco.
- Evapore o solvente sob vácuo, confere ao produto (2-metil-4-fenil-butanamine), como um óleo amarelo.
2. a reação em um frasco de 7,5 mL (purga condições – ar excluído)
- Adicione uma barra de agitação para um frasco seco 7,5 mL.
- Adicione o acetato de paládio (6,7 mg, 0.03 mmol) para o frasco.
- Adicione contra-íons prata (99,9 mg, 0.45 mmol) para o frasco.
- Adicione iodeto de fenil (92,3 mg, 0.45 mmol) para o frasco.
- Adicionar tert-amina amílico (26,3 mg, 0.30 mmol) para o frasco.
- Adicione o ácido acético (1,0 mL) no frasco.
Nota: A relação do volume de solução para o frasco tamanho é importante, como a sublimação imediata de CO2 , após adição de gelo seco pode deslocar mecanicamente solvente se demais é usado em relação ao tamanho da embarcação da reação. - Adicione água desionizada (21,7 μL, 12.1 mmol) para o frasco.
- Tare o frasco em um equilíbrio, adicionar aproximadamente 98 mg de gelo seco e então permitir que o CO2 sublimar fora até que seja alcançada uma massa final de aproximadamente 26 mg, seguido imediatamente da selagem do frasco com uma tampa de PTFE-alinhado.
Nota: Se desejável, esta etapa pode ser executada com uma maior massa de gelo seco para excluir ainda mais ar do frasco. Vale ressaltar que esta pode introduzir água e assim pode não ser a estratégia mais eficaz para água reações sensíveis. - Agite o frasco de reação selado durante 15 minutos à temperatura ambiente.
- A embarcação da reação de transferência para um prato pré-aquecido a 110 ° C e mexa por 14 horas antes de permitir que arrefecer.
- Em cima de refrigerar, abra cuidadosamente o frasco para exalar CO2.
- Remova todos os compostos voláteis no vácuo.
Nota: Esta operação pode ser executada no frasco, ou a solução pode ser transferida para um balão de fundo redondo maior. - Adicionar 1,2 M HCl(aq) (6 mL) a mistura de reacção e mexa aberta ao ar por 15 minutos.
- Transferir a fração aquosa para um funil de separação, lavar com adicional 1.2 M HCl (4 mL) e o extrato com uma mistura 1:1. o éter dietílico/hexanos (3 x 8 mL).
Nota: Esta lavagem orgânica contém o iodeto de fenil em excesso e outros subprodutos neutros e pode ser eliminada. - Neutralizar e fazer a solução aquosa básica por adição de saturada NH4OH(aq) (10ml é um bom ponto de partida).
- Extraia a fase aquosa com diclorometano (2 x 10 mL).
- Seque as frações orgânicas combinadas sobre at2para que4e, em seguida, filtro em uma amostra de tarada frasco.
- Evapore o solvente sob vácuo, confere ao produto (2-metil-4-fenil-butanamine), como um óleo amarelo.
3. a reação em um frasco de 40 mL (ar não excluído)
- Adicione uma barra de agitação para um frasco seco 40 mL.
- Adicione o acetato de paládio (33,5 mg, 0,15 mmol) para o frasco.
- Adicione contra-íons prata (499,5 mg, 2.25 mmol) para o frasco.
- Adicione iodeto de fenil (mg 461,5, 2.25 mmol) para o frasco.
- Adicione amina terc-Amil (131,5 mg, 1,5 mmol) para o frasco.
- Adicione o ácido acético (5,0 mL) no frasco.
Nota: A relação do volume de solução para o frasco tamanho é importante, como a sublimação imediata de CO2 , após adição de gelo seco pode deslocar mecanicamente solvente se demais é usado em relação ao tamanho da embarcação da reação. - Adicione água desionizada (108.5 μL, 6.02 mmol) para o frasco.
- Gelo seco (131,5 mg, 3.0 mmol) de pesar e imediatamente adicionar gelo seco para o frasco, garantindo para selar também imediatamente o frasco com uma tampa de PTFE-alinhado.
Nota: Toda a operação deve ser realizada em aproximadamente 5 segundos para evitar a fuga da pequena quantidade de CO2 adicionado e sublimação (isto é retardado pela formação de congelados ácido acético em torno do gelo seco). A quantidade de CO2 adicionado será um valor aproximado, e em nossas mãos um desvio de alguns mg é admissível. - Agite o frasco de reação selado durante 15 minutos à temperatura ambiente.
- A embarcação da reação de transferência para um prato pré-aquecido a 110 ° C e mexa por 14 horas antes de permitir que arrefecer.
- Em cima de refrigerar, abra cuidadosamente o frasco para exalar CO2.
- Remova todos os compostos voláteis no vácuo.
Nota: Esta operação pode ser executada no frasco, ou a solução pode ser transferida para um balão de fundo redondo maior. - Adicionar 1,2 M HCl(aq) (30 mL) para a mistura de reação e mexa aberta ao ar durante 15 minutos.
- Transferir a fração aquosa para um funil de separação, lavar com adicional 1.2 M HCl (20 mL) e o extrato com uma mistura 1:1. o éter dietílico/hexanos (3 x 8 mL).
Nota: Esta lavagem orgânica contém o iodeto de fenil em excesso e outros subprodutos neutros e pode ser eliminada. - Neutralizar e fazer a solução aquosa básica por adição de saturada NH4OH(aq) (10ml é um bom ponto de partida).
- Extraia a fase aquosa com diclorometano (2 x 20 mL).
- Seque as frações orgânicas combinadas sobre at2para que4e, em seguida, filtro em uma amostra de tarada frasco.
- Evapore o solvente sob vácuo, confere ao produto (2-metil-4-fenil-butanamine), como um óleo amarelo.
4. a reação em um tubo de pressão (ar não excluído) de 35 mL
- Adicione uma barra de agitação para um tubo de pressão seca 35 mL.
- Adicione o acetato de paládio (6,7 mg, 0.03 mmol) para o tubo de pressão.
- Adicione contra-íons prata (132,5 mg, 0,6 mmol) para o tubo de pressão.
- Adicione iodeto de fenil (183,6 mg, 0.9 mmol) para o tubo de pressão.
- Adicionar 2-metil -N-(3-methylbenzyl) butan-2-amina (57,4 mg, 0,3 mmol), para o tubo de pressão.
- Adicionar o ácido acético (1,0 mL) no frasco, seguido por 1,1,1,3,3,3,-hexafluoroisopropanol (1,0 mL).
Nota: A relação do volume de solução para o frasco tamanho é importante, como a sublimação imediata de CO2 , após adição de gelo seco pode deslocar mecanicamente solvente se demais é usado em relação ao tamanho da embarcação da reação. - Adicione água desionizada (21,7 μL, 1,2 mmol) para o tubo de pressão.
- Gelo seco (1,32 g, 30 mmol) de pesar, e imediatamente adicionar gelo seco para o tubo de pressão, garantindo a vedação também imediatamente o tubo de pressão com a tampa de rosca de Teflon apropriado.
Nota: Toda a operação deve ser realizada em aproximadamente 5 segundos para evitar a fuga da pequena quantidade de CO2 adicionado e sublimação (isto é retardado pela formação de congelados ácido acético em torno do gelo seco). A quantidade de CO2 adicionado será um valor aproximado, e em nossas mãos um desvio de alguns mg é admissível. - Mexa o recipiente de reação selado por 15 minutos à temperatura ambiente.
- Transferir o recipiente de reação para um prato pré-aquecido a 90 ° C e agitar durante 24 horas antes de permitir que arrefecer.
- Em cima de refrigerar, coloque uma toalha ou uma luva acolchoada sobre a tampa e abra cuidadosamente o tubo de pressão para deixar sair o CO2.
- Remova todos os compostos voláteis no vácuo.
Nota: Esta operação pode ser executada no tubo de pressão com um adaptador adequado, ou a solução pode ser transferida para um balão de fundo redondo maior. - Adicionar 1,2 M HCl(aq) (12ml) a mistura de reacção e mexa aberta ao ar durante 15 minutos.
- Transferir a fração aquosa para um funil de separação, lavar com adicional 1.2 M HCl (8 mL) e o extrato com uma mistura 1:1. o éter dietílico/hexanos (3 x 8 mL).
Nota: Esta lavagem orgânica contém o iodeto de fenil em excesso e outros subprodutos neutros e pode ser eliminada. - Neutralizar e fazer a solução aquosa básica por adição de saturada NH4OH(aq) (10ml é um bom ponto de partida).
- Extraia a fase aquosa com diclorometano (2 x 10 mL).
- Seque as frações orgânicas combinadas sobre at2para que4e, em seguida, filtro em uma amostra de tarada frasco.
- Evaporar o solvente sob vácuo, confere ao produto (2-Methyl-N-(3-methylbenzyl)-4-phenylbutan-2-amine) como um óleo amarelo.
Resultados
Na sequência destes protocolos, é possível carregar um frasco de reação com uma quantidade adequada de dióxido de carbono para atingir as reações químicas que requerem CO2 atmosferas. A pressão conseguida na etapa 1 é calculada para ser aproximadamente 3 atmosferas (veja a discussão para determinação desse valor), embora devido à solvatação parcial, a pressão observada é na proximidade de 2 atmosferas à temperatura ambiente e deve ser aproximadamente 2,6 atmosferas sob as condições de reação. Portanto, sob as condições na etapa 1, 2-metil-4-fenil-butanamine pode ser obtido com 69% de rendimento (Figura 2). Purgando primeiro balão de ar através de deslocamento por sublimação CO2 (etapa 2), o rendimento pode ser ligeiramente aumentado para 72%. Para distinguir entre esses resultados no ~2.6 atmosferas de pressão, realizando a reação abaixo dos 1 atmosfera de CO2 , usando uma instalação padrão de Schlenk fornece o produto desejado com apenas 49% de rendimento isolado. Se nenhum CO2 é usado, ou o frasco não está devidamente lacrado e, assim, um ambiente estável de2 CO não é mantido, então < 5% de rendimento do produto desejado é detectado por 1H NMR (usando 1,1,2,2-tetrachloroethane como padrão de referência). Enquanto isso, intensificação da reação por um fator de 5 enquanto simultaneamente usar um frasco de reação maior (etapa 3) ainda pode dar o produto, embora em um rendimento ligeiramente diminuído de 42%. As reações também podem ser realizadas em tubos de reação de pressão (Figura 1), neste caso, permitindo que a síntese de 2-metil -N-(3-methylbenzyl)-4-phenylbutan-2-amine com 40% de rendimento (Figura 3).

Figura 1. Reação dos navios utilizados neste estudo. Da esquerda para a direita: 2 dram frasco, Dram 10 frasco, tubo de pressão de 35 mL). Clique aqui para ver uma versão maior desta figura.

Figura 2. 1 H NMR de 2-metil-4-fenil-butanamine. 400 MHz, CDCl3, 298 K. , por favor clique aqui para ver uma versão maior desta figura.
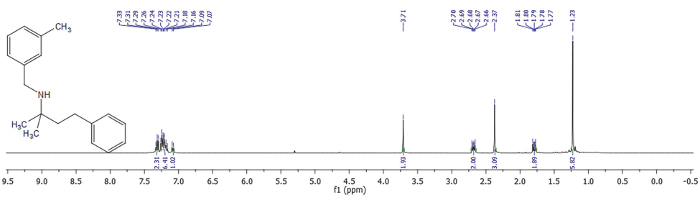
Figura 3. 1 H NMR de 2-metil -N-(3-methylbenzyl)-4-phenylbutan-2-amine. 400 MHz, CDCl3, 298 K. , por favor clique aqui para ver uma versão maior desta figura.
| Dióxido de carbono em frascos vazios de carregamento | ||||||||||||
| 100 mg | 125 mg | 150 mg | 175 mg | 200 mg | 225 mg | 250 mg | 275 mg | 300 mg | Lenda | |||
| 25º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ = Estável sob condições | ||
| 60º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x = instável sob condições | ||
| 70º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 80º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 90º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| Temperatura | 100º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | ||
| 110º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 120ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 130º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 140 º C | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 150º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 160ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
Tabela 1. Estabilidade relativa de 7,5 mL frascos com base na carga de CO2 e temperatura. Os frascos foram carregados com a quantidade necessária de gelo seco, seguido imediatamente de vedação com um tampão de PTFE-alinhado. Os frascos foram colocados imediatamente em torta-blocos atrás de um escudo de explosão em um fumehood, seguido de aquecimento a 60 ° C, seguido de levantar 10 ° C a cada hora para um pico de 160 ° C. Os frascos foram então refrigerados e abertos cuidadosamente para confirmar que sem perda de pressão de CO2 tinha ocorrido.
| Dióxido de carbono em frascos vazios de carregamento | |||||||||||||
| 300 mg | 325 mg | 350 mg | 375 mg | 400 mg | 425 mg | 450 mg | 475 mg | 500 mg | 525 mg | Lenda | |||
| 25º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | √ = Estável sob condições | ||
| 60º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | x = instável sob condições | ||
| 70º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 80º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 90º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| Temperatura | 100º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | ||
| 110º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 120ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 130º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 140 º C | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 150º c | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 160ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
Tabela 2. Estabilidade relativa de 40 mL frascos com base na carga de CO2 e temperatura. Os frascos foram carregados com a quantidade necessária de gelo seco, seguido imediatamente de vedação com um tampão de PTFE-alinhado. Os frascos foram colocados imediatamente em torta-blocos atrás de um escudo de explosão em um fumehood, seguido de aquecimento a 60 ° C, seguido de levantar 10 ° C a cada hora para um pico de 160 ° C. Os frascos foram então refrigerados e abertos cuidadosamente para confirmar que sem perda de pressão de CO2 tinha ocorrido.
Discussão
Usando o van der Waals, equação de estado, a pressão aproximada destes sistemas pode ser calculado45
EQ. 1:
Nas condições no protocolo 1, podemos assumir 26,3 mg de CO2 dá n = 5.98 x 10-4 mols
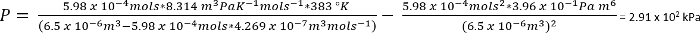
Como uma estimativa aproximada, isto sugere que, no protocolo n º 1, as reações foram realizadas sob aproximadamente 2,8 atmosferas de CO2. Supondo que o deslocamento insignificante da atmosfera nativa no vaso (como mencionado acima, uma pátina de congelados ácido acético retardará a inicial sublimação do gelo seco, facilitando a melhor precisão na medição de adicionado gelo seco), no entanto, a pressão total seria então de esperar para ser modelado melhor pela lei de Dalton:
EQ. 2:
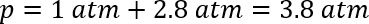
Este modelo não leva em conta que alguns dos gases serão dissolvida no solvente. Nesse caso, foi necessário anexar um manómetro de pressão para avaliar adequadamente a pressão. Anexar um septo no frasco e inserindo um calibre de pressão, foi possível medir a pressão à temperatura ambiente. As observadas as pressões múltiplas reações eram apenas 15 ± 3 psi acima da pressão atmosférica (atmosferas ≈ 1 ± 0,2), ou total à volta de 2 atmosferas. Embora a constante de Henry de CO2 em puro ácido acético não era facilmente disponível para comparação, sabe-se que a adição de ácido acético a água melhora a solubilidade do dióxido de carbono,46. A pressão estimada em temperatura ambiente poderia ser calculada usando a abordagem anterior:

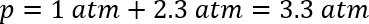
A pressão esperada, portanto, seria um atmosferas 3.3 ligeiramente inferior à temperatura ambiente na ausência de gás se dissolver no solvente. A diferença entre as pressões observadas e calculadas implica que o CO2 tem relativamente alta solubilidade no solvente orgânico. Assumindo a diferença insignificante no montante de dissolvido CO2 sobre a faixa de temperatura, um aumento na temperatura de 298 K para a temperatura de reação de 383 K iria aumentar a pressão dentro do frasco 2 dram ~2.6 atmosferas.
Para avaliar adequadamente as condições de funcionamento práticas, dram 2 frascos foram set-up com diferentes quantidades de CO2, seguido de triagem estas em temperaturas diferentes. Para garantir a segurança do operador, os frascos foram apenas aquecida após ser colocado atrás de uma viseira para conter quaisquer falhas do frasco. Se os frascos explodiram, as condições foram consideradas demasiado duras para os frascos. Através destas experiências, foi determinado que o CO2 carga de até 200 mg foi tolerada a 110 ° C para os tubos de ensaio 2 dram (7,5 mL) através de ensaios de consistentes. Isso corresponde a aproximadamente 20,7 atmosferas de pressão, com base na abordagem anterior, não obstante a quantidade de gás dissolvido, que pode diminuir a pressão total em algumas atmosferas. Além de 200 mg de carregamento, no entanto, os frascos de reação geralmente explodiria antes de atingir a temperatura-alvo de 110 ° C. Cuidado deve ser exercitado quando modificar as condições, no entanto: em um cenário, uma reação relacionada foi tentada a 160 ° C, com apenas 150 mg de CO2, mas o frasco falhou antes ele tinha alcançado a temperatura-alvo. O maior perigo para modificar a reação condições seria de aumentar a carga de CO2, pois isso pode causar os frascos a falhar antes de engenharia controles de segurança, tais como escudos, pode ser implementado.
Uma limitação potencial desta estratégia é a falta de dados sobre a estabilidade dos frascos sob diferentes condições. Portanto, era necessário para a tela os frascos para sua capacidade de resistir a pressões diferentes sob uma variedade de diferentes temperaturas. Isto foi iniciado com os frascos de 7,5 mL (tabela 1). Cada frasco foi carregado com uma quantidade pré-determinada de gelo seco, seguido por vedação imediata com uma tampa de rosca PTFE-alinhado. Estes frascos foram observados para ser tolerante com estas condições, e nenhuma falha em temperatura ambiente. Em seguida, a temperatura foi gerada para todos os frascos, e não há explosões ocorreram durante o experimento. Em cima de refrigerar, cada frasco foi aberto para confirmar que eles tinham mantido pressurização com CO2. Isto sugere que os frascos podem tolerar mais de 26,5 atmosferas de pressão, que está em contraste com as condições de reação na quais ~20.7 atmosferas de pressão foi o limite consistente. Portanto, é incentivado que identidade solvente e volume ser cuidadosamente considerada no desvio do método divulgado.
Uma tela semelhante para tolerância máxima foi realizada usando frascos de reação de 40 mL (tabela 2). Neste caso, um limite superior para o carregamento de2 CO de frascos vazios estava determinado a ser 500 mg. acima dos frascos falharam rapidamente à temperatura ambiente. Surpreendentemente, a pressão calculada das amostras que começaram a falhar na temperatura de quarto era aproximadamente 7 atmosferas e acima. Isto está em contraste com o frasco que contém 500 mg de CO2, que era estável a 160 ° C, o que corresponde a uma pressão calculada de pouco menos de 10,5 atmosferas. Estes resultados foram reprodutíveis em frascos diferentes, mas não há nenhuma explicação clara para esse fenômeno neste momento. Nas condições descritas no protocolo 3, eram toleradas somente aproximadamente 300 mg cargas de CO2 . No entanto, este é realmente em sintonia com as experiências anteriores, como nas condições de pressão, não corrigida para potencial absorção de dióxido de carbono pelo solvente, seria aproximadamente 10 atmosferas. A diminuição da estabilidade dos frascos de maior pressão é esperada e sugere que estes procedimentos são melhor realizados em vasos com diâmetros menores e mais grossas paredes47.
Em resumo, este protocolo para o uso de gelo seco como uma fonte de2 CO sólida em produtos vidreiros prontamente disponível deverá abrir novos rumos no campo da química sintética. Através da geração de baixa a moderada pressões dentro de frascos selados ou tubos de pressão, processos de fixação de dióxido de carbono tais como carboxilação48,,49,50, bem como CO2 redução51, 52 , 53, pode ser alcançado sem o uso de equipamentos especializados caro. Esta estratégia recém-adotado facilitará os avanços na área da valorização de CO2 por incorporação do útil matérias-primas químicas, tais como carbonatos cíclicos, carbonatos de poli e carbamatos54. Além disso, a estratégia de introdução de CO2 como um sólido também pode ser benéfica onde as misturas de gases são desejadas, tais como CO2 e CO, ou CO2 e H2, como isso facilita a adição de dois reagentes em um não gasosas formulário. Embora o uso de gelo seco para introduzir líquidos CO2 tem sido usado para extrações e cromatografia40,41,42,,43,44, este protocolo para introdução de CO2 por um sólido pode também ser útil para in situ geração de CO2 para uso como uma reação solvente55,56,57, trabalho futuro, explorando outros usos para este abordagem, especialmente a combinação de CO2 com outros precursores-gás, estão em andamento no nosso grupo.
Divulgações
O uso de CO2 como um grupo diretor para a ativação do C-H de substratos básicos de Lewis é atualmente o foco de patente provisória dos Estados Unidos #62/608, 074.
Agradecimentos
Os autores desejam reconhecer o financiamento de start-up da Universidade de Toledo, bem como os fundos da Herman Frasch Foundation do American Chemical Society em suporte parcial deste trabalho. Sr. Thomas Kina é reconhecida por sua ajuda com o desenvolvimento de um calibre de pressão adequado para medir as pressões de reação. Mr. Steve Modar é agradeceu por discussões úteis.
Materiais
| Name | Company | Catalog Number | Comments |
| 7.5 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-00984 | Can be reused. |
| 40 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-01039 | Can be reused. |
| Pressure Tube, #15 Thread, 7" Long, 25.4 mm O.D. | Ace Glass | 8648-06 | Can be reused. |
| Pie-Block for 2 Dram Vials | ChemGlass | CG-1991-P14 | Can be reused. |
| Pie-Block for 10 Dram Vials | ChemGlass | CG-1991-P12 | Can be reused. |
| 3.2 mm PTFE Disposable Stir Bars | Fisher | 14-513-93 | Can be reused. |
| C-MAG HS 7 Control Hotplate | IKA | 20002695 | |
| Analytical Weighing Balance | Sartorius | QUINTIX2241S | |
| Double-Ended Micro-Tapered Spatula | Fisher Scientific | 21-401-10 | |
| Hei-VAP Advantage - Hand Lift Model with G5 Dry Ice Condenser Rotary Evaporator | Heidolph | 561-01500-00 | |
| Bump Trap 14/20 Joint | ChemGlass | CG-1322-01 | |
| tert-Amyl amine | Alfa Aesar | B24639-14 | Used as received. |
| 2-Methyl-N-(3-methylbenzyl)butan-2-amine | N/A | N/A | Prepared from reductive amination of tert-amyl amine and 3-tolualdehyde in the presence of sodium borohydride in methanol. |
| Palladium Acetate | Chem-Impex International, Inc. | 4898 | Used as received. |
| Silver Trifluoroacetate | Oakwood Chemicals | 007271 | Used as received. |
| Phenyl Iodide | Oakwood Chemicals | 003461 | Used as received. |
| Acetic Acid | Fisher Chemical | A38 | Used as received. |
| 1,1,1,3,3,3-Hexafluoroisopropanol | Oakwood Chemicals | 003409 | Used as received. |
| Deionized Water | Obtained from in-house deionized water system. | ||
| Dry Ice | Carbonic Enterprises Dry Ice Inc. | Non-food grade dry ice. | |
| Concentrated Hydrochloric Acid | Fisher Chemical | A144SI | Diluted to a 1.2 M solution prior to use. |
| Diethyl Ether, Certified | Fisher Chemical | E138 | Used as received. |
| Hexanes, Certified ACS | Fisher Chemical | H292 | Used as received. |
| Saturated Ammonium Hydroxide | Fisher Chemical | A669 | Used as received. |
| Dichloromethane | Fisher Chemical | D37 | Used as received. |
| Sodium Sulfate, Anhydrous | Oakwood Chemicals | 044702 | Used as received. |
| 250 mL Separatory Funnel | Prepared in-house by staff glassblower. | ||
| 100 mL Round Bottom Flask | Prepared in-house by staff glassblower. | ||
| Scientific Disposable Funnel | Caplugs | 2085136030 | |
| Borosilicate Glass Scintillation Vials, 20 mL | Fisher Scientific | 03-337-15 | |
| 5 mm O.D. Thin Walled Precision NMR Tubes | Wilmad | 666000575 | |
| Chloroform-d | Cambridge Isotope Laboratories, Inc. | DLM-7 | Used as received. |
Referências
- Verboom, W. Selected Examples of High-Pressure Reactions in Glass Microreactors. Chemical Engineering and Technology. 32 (11), 1695-1701 (2009).
- Schettino, V., Bini, R. Constraining Molecules at the Closest Approach: Chemistry at High Pressure. Chemical Society Reviews. 36, 869-880 (2007).
- Hemminger, O., Marteel, A., Mason, M. R., Davies, J. A., Tadd, A. R., Abraham, M. A. Hydroformylation of 1-Hexene in Supercritical Carbon Dioxide Using a Heterogeneous Rhodium Catalyst. 3. Evaluation of Solvent Effects. Green Chemistry. 4, 507-512 (2002).
- Mo, F., Dong, G. Regioselective Ketone α-Alkylation with Simple Olefins via Dual Activation. Science. 345 (6192), 68-72 (2014).
- Schultz, A. G., Kirincich, S. J., Rahm, R. Asymmetric Organic Synthesis. Preparation and Birch Reduction-Alkylation of 2-Methyl-3,4-Dihydroisoquinolin-1-ones. Tetrahedron Letters. 36 (26), 4551-4554 (1995).
- Dong, L., Aleem, S., Fink, C. A. Microwave-Accelerated Reductive Amination Between Ketones and Ammonium Acetate. Tetrahedron Letters. 51 (39), 5210-5212 (2010).
- Wang, D., Astruc, D. The Golden Age of Transfer Hydrogenation. Chemical Reviews. 115 (13), 6621-6686 (2015).
- Morimoto, T., Kakiuchi, K. Evolution of Carbonylation Catalysis: No Need for Carbon Monoxide. Angewandte Chemie International Edition in English. 43 (42), 5580-5588 (2004).
- Iranpoor, N., Firouzabadi, H., Motevalli, S., Talebi, M. Palladium-Free Aminocarbonylation of Aryl, Benzyl, and Styryl Iodides and Bromides by Amines Using Mo(CO)6 and Norbornadiene. Tetrahedron. 69 (1), 418-426 (2013).
- Ren, W., Yamane, M. Mo(CO)6-Mediated Carbamoylation of Aryl Halides. Journal of Organic Chemistry. 75 (24), 8410-8415 (2010).
- Wang, H., Dong, B., Wang, Y., Li, J., Shi, Y. A Palladium-Catalyzed Regioselective Hydroesterification of Alkenylphenols to Lactones with Phenyl Formate as CO Source. Organic Letters. 16 (1), 186-189 (2014).
- Zhang, Y., Chen, J. -L., Chen, Z. -B., Zhu, Y. -M., Ji, S. -J. Palladium-Catalyzed Carbonylative Annulation Reactions Using Aryl Formate as a CO Source: Synthesis of 2-Substituted Indene-1,3(2H)-Dione Derivatives. Journal of Organic Chemistry. 80 (21), 10643-10650 (2015).
- Wan, Y., Alterman, M., Larhed, M., Hallberg, A. Dimethylformamide as a Carbon Monoxide Source in Fast Palladium-Catalyzed Aminocarbonylations of Aryl Bromides. Journal of Organic Chemistry. 67 (17), 6232-6235 (2002).
- Gockel, S. N., Hull, K. L. Chloroform as a Carbon Monoxide Precursor: In or Ex Situ Generation of CO for Pd-Catalyzed Aminocarbonylations. Organic Letters. 17 (13), 3236-3239 (2015).
- Zhao, H., Du, H., Yuan, X., Wang, T., Han, W. Iron-Catalyzed Carbonylation of Aryl Halides with Arylborons Using Stoichiometric Chloroform as the Carbon Monoxide Source. Green Chemistry. 18, 5782-5787 (2016).
- Chen, P., Xu, C., Yin, H., Gao, X., Qu, L. Shock Induced Conversion of Carbon Dioxide to Few Layer Graphene. Carbon. , 471-476 (2017).
- Iijima, T., Yamaguchi, T. Efficient Regioselective Carboxylation of Phenol to Salicylic Acid with Supercritical CO2 in the Presence of Alumnium Bromide. Journal of Molecular Catalysis A: Chemical. 295 (1-2), 52-56 (2008).
- Jevtovikj, I., Manzini, S., Hanauer, M., Rominger, F., Schaub, T. Investigations on the Catalytic Carboxylation of Olefins with CO2 Towards α, β-Unsaturated Carboxylic Acid Salts: Characterization of Intermediates and Ligands as well as Substrate Effects. Dalton Transactions. 44, 11083-11094 (2015).
- Juliá-Hernández, F., Moragas, T., Cornella, J., Martin, R. Remote Carboxylation of Halogenated Aliphatic Hydrocarbons with Carbon Dioxide. Nature. 545, 84-88 (2017).
- North, M., Pasquale, R. Mechanism of Cyclic Carbonate Synthesis from Epoxides and CO2. Angewandte Chemie International Edition. 48 (16), 2946-2948 (2009).
- Yeung, C. S., Dong, V. M. Beyond Aresta's Complex: Ni- and Pd-Catalyzed Organozinc Coupling to CO2. Journal of the American Chemical Society. 130 (25), 7826-7827 (2008).
- Zhu, D. -Y., Fang, L., Han, H., Wang, Y., Xia, J. -B. Reductive CO2 Fixation via Tandem C-C and C-N Bond Formation: Synthesis of Spiro-Indopyrrolidines. Organic Letters. 19 (16), 4259-4262 (2017).
- Kapoor, M., Liu, D., Young, M. C. Carbon Dioxide Mediated C(sp3)–H Arylation of Amine Substrates. J. Am. Chem. Soc. , (2018).
- Zhang, Y. -F., Zhao, H. -W., Wang, H., Wei, J. -B., Shi, Z. -J. Readily Removable Directing Group Assisted Chemo- and Regioselective C(sp3)-H Activation by Palladium Catalysis. Angewandte Chemie International Edition. 54 (46), 13686-13690 (2015).
- He, G., Chen, G. A Practical Strategy for the Structural Diversification of Aliphatic Scaffolds Through the Palladium-Catalyzed Picolinamide-Directed Remote Functionalization of Unactivated C(sp3)-H Bonds. Angewandte Chemie International Edition. 50 (22), 5192-5196 (2011).
- Nack, W. A., Wang, X., Wang, B., He, G., Cheng, G. Palladium-Catalyzed Picolinamide-Directed Iodination of Remote ortho-C-H Bonds of Arenes: Synthesis of Tetrahydroquinolines. Beilstein Journal of Organic Chemistry. 12, 1243-1249 (2016).
- Feng, P., Li, M., Ge, H. Room Temperature Palladium-Catalyzed Decarboxylative ortho-Acylation of Acetanilides with α-Oxocarboxylic Acids. Journal of the American Chemical Society. 132 (34), 11898-11899 (2010).
- Coomber, C. E., Benhamou, L., Bučar, D. -K., Smith, P. D., Porter, M. J., Sheppard, T. D. Silver-Free Palladium-Catalyzed C(sp3)-H Arylation of Saturated Bicyclic Amine Scaffolds. Journal of Organic Chemistry. 83 (5), 2495-2503 (2018).
- Mei, T. -S., Wang, X., Yu, J. -Q. Pd(II)-Catalyzed Amination of C-H Bonds Using Single-Electron or Two-Electron Oxidants. Journal of the American Chemical Society. 131 (31), 10806-10807 (2009).
- Xie, W., Yang, J., Wang, B., Li, B. Regioselective Ortho Olefination of Aryl Sulfonamide via Rhodium-Catalyzed Direct C-H Bond Activation. Journal of Organic Chemistry. 79 (17), 8278-8287 (2014).
- Rodriguez, N., Romero-Revilla, J. A., Fernández-Ibáñez, M. Á, Carretero, J. C. Palladium-Catalyzed N-(2-pyridyl)sulfonyl-Directed C(sp3)-H γ-Arylation of Amino Acid Derivatives. Chemical Science. 4, 175-179 (2013).
- Zheng, Y., Song, W., Zhu, Y., Wei, B., Xuan, L. Pd-Catalyzed Acetoxylation of γ-C(sp3)-H Bonds of Amines Directed by a Removable Bts-Protecting Group. Journal of Organic Chemistry. 83 (4), 2448-2454 (2018).
- Jain, P., Verma, P., Xia, G., Yu, J. -Q. Enantioselective Amine α-Functionalization Via Palladium-Catalysed C-H Arylation of Thioamides. Nature Chemistry. 9, 140-144 (2017).
- Tran, A. T. Practical Alkoxythiocarbonyl Auxiliaries for Ir(I)-Catalyzed C-H Alkylation of Azacycles. Angewandte Chemie International Edition. 56 (35), 10530-10534 (2017).
- Huang, Z., Wang, C., Dong, G. A Hydrazone-Based exo-Directing Group Strategy for β-C-H Oxidation of Aliphatic Amines. Angewandte Chemie International Edition. 55 (17), 5299-5303 (2016).
- Xu, Y., Young, M. C., Wang, C., Magness, D. M., Dong, G. Catalytic C(sp3)-H Arylation of Free Primary Amines via an in situ Generated Exo-Directing Group. Chemie International Edition. 55 (31), 9084-9087 (2016).
- Liu, Y., Ge, H. Site-Selective C-H Arylation of Primary Aliphatic Amines Enabled by a Catalytic Transient Directing Group. Nature Chemistry. 9, 26-32 (2017).
- Wu, Y., Chen, Y. -Q., Liu, T., Eastgate, M. D., Yu, J. -Q. Pd-Catalyzed γ-C(sp3)-H Arylation of Free Amines Using a Transient Directing Group. Journal of the American Chemical Society. 138 (44), 14554-14557 (2016).
- Yada, A., Liao, W., Sato, Y., Murakami, M. Buttressing Salicylaldehydes: A Multipurpose Directing Group for C(sp3)-H Bond Activation. Angewandte Chemie International Edition. 56 (4), 1073-1076 (2017).
- Baldwin, B. W., Kuntzleman, T. S. Liquid CO2 in Centrifuge Tubes: Separation of Chamazulene from Blue Tansy (Tanacetum annum) Oil via Extraction and Thin-Layer Chromatography. Journal of Chemical Education. 95 (4), 620-624 (2018).
- McKenzie, L. C., Thompson, J. E., Sullivan, R., Hutchison, J. E. Green Chemical Processing in the Teaching Laboratory: A Convenient Liquid CO2 Extraction of Natural Products. Green Chemistry. 6, 355-358 (2004).
- Hudson, R., Ackerman, H. M., Gallo, L. K., Gwinner, A. S., Krauss, A., Sears, J. D., Bishop, A., Esdale, K. N., Katz, J. L. CO2 Dry Cleaning: A Benign Solvent Demonstration Accessible to K-8 Audiences. Journal of Chemical Education. 94, 480-482 (2017).
- Barcena, H., Chen, P. An Anesthetic Drug Demonstration and an Introductory Antioxidant Activity Experiment with "Eugene, the Sleepy Fish.". Journal of Chemical Education. 93, 202-205 (2016).
- Bodsgard, B. R., Lien, N. R., Waulters, Q. T. Liquid CO2 Extraction and NMR Characterization of Anethole from Fennel Seed: A General Chemistry Laboratory. Journal of Chemical Education. 93, 397-400 (2016).
- Fishbane, P. M., Gasiorowicz, S. G., Thornton, S. T. Physics for Scientists and Engineers. , (2005).
- Rumpf, B., Xia, J., Maurer, G. Solubility of Carbon Dioxide in Aqueous Solutions Containing Acetic Acid or Sodium Hydroxide in the Temperature Range from 313 to 433 K and at Total Pressures up to 10 MPa. Industrial & Engineering Chemistry Research. 37, 2012-2019 (1998).
- Technical Information: Nomogram of Allowable Pressures. , Available from: http://www.adamschittenden.com/nomogram_of_pressures.pdf (2018).
- Luo, J., Larrosa, I. C-H Carboxylation of Aromatic Compounds Through CO2 Fixation. ChemSusChem: Chemistry & Sustainability, Energy & Materials. 10, 3317-3332 (2017).
- Manjolinho, F., Arndt, M., Gooßen, K., Gooßen, L. J. Catalytic C-H Carboxylation of Terminal Alkynes with Carbon Dioxide. ACS Catalysis. 2, 2014-2021 (2012).
- Banerjee, A., Dick., G. R., Yoshino, T., Kanan, M. W. Carbon Dioxide Utilization via Carbonate-Promoted C-H Carboxylation. Nature. 531, 215-219 (2016).
- Fei, H., Sampson, M. D., Lee, Y., Kubiak, C. P., Cohen, S. M. Photocatalytic CO2 Reduction to Formate Using a Mn(I) Molecular Catalyst in a Robust Metal-Organic Framework. Inorganic Chemistry. 54, 6821-6828 (2015).
- Chabolla, S. A., Yang, J. Y. For CO2 Reduction, Hydrogen-Bond Donors Do the Trick. ACS Central Science. 4, 315-317 (2018).
- Kim, D., Kley, C. S., Li, Y., Yang, P. Copper Nanoparticle Ensembles for Selective Electroreduction of CO2 to C2-C3 Products. Proceedings of the National Academy of Sciences of the United States of America. , C2-C3 (2017).
- Liu, Q., Wu, L., Jackstell, R., Beller, M. Using carbon dioxide as a building block in organic synthesis. Nature Communications. 6, 5933-5945 (2015).
- Hâncu, D., Green, J., Beckman, E. J. H2O2 in CO2 Sustainable Production and Green Reactions. Accounts of Chemical Research. 35, 757-764 (2002).
- Ballivet-Tkatchenko, D., Camy, S., Condoret, J. S. Carbon Dioxide, a Solvent and Synthon for Green Chemistry. Environmental Chemistry. Lichtofouse, E., Scwarzbauer, J., Robert, D. , Springer: Berlin. 541-552 (2005).
- Hyatt, J. A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. Journal of Organic Chemistry. 49, 5097-5101 (1984).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados