Method Article
Mäßiger Druck in verschlossenen Gefäßen, die Verwendung von Trockeneis als Solid CO2 zu erreichen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll zur Ausführung von Reaktionen in einfachen Reaktionsgefäße unter niedrigen bis mäßigen Druck von CO2. Die Reaktionen können in einer Vielzahl von Schiffen durchgeführt werden, einfach indem Sie verwalten das Kohlendioxid in Form von Trockeneis, ohne die Notwendigkeit für teure oder aufwendige Ausrüstung oder Set-ups.
Zusammenfassung
Hierin wird eine allgemeine Strategie zur Durchführung von Reaktionen unter Mild, moderate CO2 Druck mit Trockeneis vorgestellt. Diese Technik entfällt die Notwendigkeit für Spezialgeräte, bescheidene Druck zu erreichen, und kann auch verwendet werden, um höhere Drücke in spezielleren Ausrüstung und stabiler Reaktionsgefäßen zu erreichen. Am Ende der Reaktion können die Fläschchen leicht durch Öffnung bei Raumtemperatur drucklos geschaltet werden. Im vorliegenden Beispiel dient CO2 als eine vermeintliche Regie Gruppe sowie eine Möglichkeit, Amin Substrate, wodurch verhindert Oxidation während der metallorganischen Reaktion passiviert. Neben leicht hinzugefügt wird, wird die Regie Gruppe auch unter Vakuum entfernt vermieden die Notwendigkeit einer umfassenden Reinigung die Regie-Gruppe entfernen. Diese Strategie ermöglicht die einfache γ-C(sp3)-H Arylation aliphatische Amine und hat das Potenzial, zu einer Vielzahl anderer Amin-basierte Reaktionen angewendet werden.
Einleitung
Der Einsatz von gasförmigen Substanzen in chemischen Reaktionen erfordert in der Regel spezialisierte Ausrüstung und Verfahren1,2. Tischwaage können einige Gase direkt aus einem Tank mit einem hohem Druckregler3hinzukommen. Eine alternative Methode ist das Gas unter kryogenen Bedingungen4,5zu kondensieren. Zwar nützlich, erfordern diese Strategien den Einsatz von spezialisierten Druckreaktoren mit Ventilen, die unerschwinglich für zahlreiche Reaktionen parallel ausgeführt werden können. Dies kann daher erheblich die Rate verlangsamen welche Reaktion Screening fortgesetzt werden kann. Infolgedessen habe es Chemiker wünschenswert, diese Verbindungen mit alternativen Methoden einzuführen. Ammoniak kann zu Reaktionen mit verschiedenen carboxylat Ammoniumsalze, unter Ausnutzung des schwachen Gleichgewichts zwischen diesen Salzen und frei Ammoniak6hinzugefügt werden. Transfer-Hydrierung ist eine wichtige Strategie für Reduktionsreaktionen von Olefinen, Carbonyl und Nitro-Gruppen, die die Verwendung von brennbaren Wasserstoffgas mit Verbindungen wie Ammonium Formiat oder Hydrazin als Träger von H27umgeht. Ein anderes Gas von Interesse in diesem Bereich ist Kohlenmonoxid8 kann-CO generierten in Situ durch Befreiung von Metal Carbonyl-komplexe9,10, oder Alternativ können Sie durch Decarbonylation von erzeugt werden Quellen wie Formiate und Formamides11,12,13 oder Chloroform14,15.
Ein Gas, das nicht, bedeutende Entwicklung in dieser Hinsicht genossen hat ist Kohlendioxid16. Ein Grund dafür ist, dass viele Transformationen, bei denen CO2 auch hohe Temperaturen und drücke erfordern, und sind somit automatisch auf spezialisierte Reaktoren17,18verbannt. Jüngsten Bemühungen zur reaktive Katalysatoren, jedoch entwickeln, konnten viele dieser Reaktionen unter atmosphärischem Druck von CO219,20,21,22ausgeführt. Kürzlich entdeckten wir eine Reaktion in dem Kohlendioxid verwendet werden, könnte um die γ-C (sp3) vermitteln – H Arylation aliphatische Amine23. Diese Strategie wurde erwartet, dass die Vorteile eines statischen Regie Gruppe Ansatzes einschließlich Amid24,25,26,27,28, Sulfonamide kombinieren 29 , 30 , 31 , 32, Thiocarbonyl33,34oder Hydrazone35-basierten Gruppen (chemische Robusticity), mit der Leichtigkeit einer Transienten Regie Gruppe (verminderte Schritt Wirtschaft)36, Regie 37,38,39.
Obwohl die Reaktion unter atmosphärischem Druck von CO2auftreten kann, die Notwendigkeit für ein Schlenk Setup Bildschirm Reaktionen unerschwinglich war langsam. Darüber hinaus erhöhen den Druck leicht führte zur Reaktion Erträge verbessert, aber nicht erreicht werden könnte leicht mit einer Schlenk-Linie. Wir suchten daher eine alternative Strategie, und anschließend identifiziert, dass Trockeneis leicht genutzt werden als solide Informationsquelle CO2 , die eine Vielzahl von Reaktionsgefäßen, die notwendige Menge an Kohlendioxid zu moderaten einzuführen hinzugefügt werden könnte Druck (Abbildung 1). Obwohl in der Synthese ausgelastet, ist eine ähnliche Strategie ziemlich häufig als eine Methode zur Erzeugung flüssiger CO2 für Chromatographie und Extraktion Anwendungen40,41,42,43, 44. Unter Verwendung dieser Strategie erlaubt, dass unsere Gruppe zu schnell große Bildnummern Reaktionen parallel, während die Fähigkeit, Zugang moderate CO2 Druck zwischen 2-20 Atmosphären entscheidend für die Steigerung der Erträge der Reaktionen waren. Unter diesen Bedingungen können primär (1°) und sekundäre (2°) Amine Arylated mit Elektron-reichen und Elektron Armen Aryl Halide sein.
Protokoll
Achtung: (1) die folgenden Protokolle gibt sicher durch wiederholte Versuche gehalten wurden. Jedoch Vorsicht sollte ausgeübt werden, wenn Fläschchen, während die Reaktion, Abdichtung und vor allem, wenn die Reaktionen zu öffnen, als Inhomogenität der Reaktion können Fläschchen zum Ausfall des Geräts führen. Fläschchen sollte auf körperliche Mängel vor der Verwendung überprüft werden. Fläschchen sollten hinter irgendeine Form von Blast Schild gesetzt werden oder Haube Schärpe unmittelbar nach der Versiegelung um Vorfälle zu vermeiden sollte die Fläschchen scheitern. (2) Es gibt, zwar kaum eine Chance für Erstickung aufgrund der geringen Mengen CO2 verwendet Reaktionen sollten eingerichtet werden sowie in einem gut belüfteten Raum oder unter einem Abzug geöffnet. (3) Trockeneis ist ein Cryogen und können schwere Gewebeschäden verursachen. Sorgfalt sollte daher während der Manipulation zur Vermeidung von Erfrierungen, z. B. Begrenzung der direkten Kontakt oder kryogene Handschuhe verwenden. (4) Trockeneis wird Wasserdampf, was bedeutet, dass vor dem Einsatz das Trockeneis mechanisch abgeblättert werden sollten, um sicherzustellen, dass die Masse der CO2 (s) nur kondensieren. Dies kann durch einfaches Reiben das Trockeneis erreicht werden zwischen den Fingern, oder sicherer, reiben Sie es zwischen den Fingern mit einer schützenden Schicht wie ein Handschuh oder ein Handtuch.
1. Reaktion in einer 7,5 mL Durchstechflasche (Luft nicht ausgeschlossen)
- Fügen Sie eine Stir Bar zu einem trockenen 7,5 mL-Fläschchen.
- Das Fläschchen Palladium Acetat (6,7 mg, 0,03 Mmol) hinzufügen.
- Das Fläschchen Silber Trifluoroacetate (99,9 mg, 0,45 Mmol) hinzufügen.
- Das Fläschchen Phenyl Jodid (92,3 mg, 0,45 Mmol) hinzufügen.
- Hinzufügen von Tert-Amyl Amin (26,3 mg, 0,30 Mmol) um das Fläschchen.
- Das Fläschchen Essigsäure (1,0 mL) hinzufügen.
Hinweis: Das Verhältnis der Lösung Lautstärke zu Fläschchen Größe ist wichtig, wie die unmittelbare Sublimation von CO2 auf Zugabe von Trockeneis mechanisch verdrängen kann Lösungsmittel wenn zuviel wird relativ zur Größe des den Reaktionsbehälter verwendet. - Das Fläschchen deionisiertes Wasser (21,7 μL, 12,1 Mmol) hinzufügen.
- Trockeneis (26,3 mg, 0,60 Mmol) wiegen, und sofort hinzufügen das Trockeneis, das Fläschchen, gleichzeitig auch sofort Dichtung das Fläschchen mit einer PTFE-gefütterte Mütze.
Hinweis: Sollte der gesamte Vorgang innerhalb von ca. 5 Sekunden, um zu verhindern, dass die Sublimation und die Flucht von der geringen Menge an CO2 hinzugefügt durchgeführt werden (Dies wird durch die Bildung von gefrorenen Essigsäure um das Trockeneis verlangsamt). Die Menge an CO2 hinzugefügt werden ein ungefährer Wert, und in unseren Händen ist eine Abweichung von ein paar mg zulässig. - Rühren Sie das versiegelte Reaktion Fläschchen für 15 Minuten bei Raumtemperatur.
- Übertragen Sie den Reaktionsbehälter auf einen vorgewärmten Teller bei 110 ° C und 14 Stunden bevor man abkühlen umrühren.
- Öffnen Sie beim Abkühlen vorsichtig das Fläschchen um CO2zu entlüften.
- Entfernen Sie alle die flüchtigen Bestandteile im Vakuum.
Hinweis: Dieser Vorgang kann in der Durchstechflasche ausgeführt werden, oder die Lösung auf einem größeren Rundboden-Kolben übertragen werden kann. - Das Reaktionsgemisch 1,2 M HCl(Aq) (6 mL) hinzu und rühren Sie für 15 Minuten offen an der Luft.
- Übertragen den wässrigen Anteil auf ein separatory Trichter, Waschen mit zusätzlichen 1,2 M HCl (4 mL) und Extrakt mit einer Mischung von 1:1 Diethylether/Hexanes (3 x 8 mL).
Hinweis: Diese Bio Wash enthält überschüssiges Phenyl Jodid und andere neutrale Nebenprodukte und entsorgt werden. - Neutralisieren und stellen grundlegende wässrige Lösung durch Zugabe von gesättigter NH4OH(Aq) (10 mL ist ein guter Ausgangspunkt).
- Die wässrige Schicht mit Dichlormethan (2 x 10 mL) zu extrahieren.
- Trocknen Sie die kombinierten organischen Fraktionen über Na2, also4, dann Filter in einer tarierten Probe Fläschchen.
- Verdunstet das Lösungsmittel im Vakuum, was dem Produkt (2-Methyl-4-Phenyl-Butanamine) als ein gelbes Öl.
2. Reaktion in einer 7,5 mL Durchstechflasche (Spülung Bedingungen – Luft ausgeschlossen)
- Fügen Sie eine Stir Bar zu einem trockenen 7,5 mL-Fläschchen.
- Das Fläschchen Palladium Acetat (6,7 mg, 0,03 Mmol) hinzufügen.
- Das Fläschchen Silber Trifluoroacetate (99,9 mg, 0,45 Mmol) hinzufügen.
- Das Fläschchen Phenyl Jodid (92,3 mg, 0,45 Mmol) hinzufügen.
- Hinzufügen von Tert-Amyl Amin (26,3 mg, 0,30 Mmol) um das Fläschchen.
- Das Fläschchen Essigsäure (1,0 mL) hinzufügen.
Hinweis: Das Verhältnis der Lösung Lautstärke zu Fläschchen Größe ist wichtig, wie die unmittelbare Sublimation von CO2 auf Zugabe von Trockeneis mechanisch verdrängen kann Lösungsmittel wenn zuviel wird relativ zur Größe des den Reaktionsbehälter verwendet. - Das Fläschchen deionisiertes Wasser (21,7 μL, 12,1 Mmol) hinzufügen.
- Tarieren Sie das Fläschchen auf ein ausgewogenes Verhältnis, fügen Sie etwa 98 mg Trockeneis hinzu und dann erlauben Sie die CO2 , ab zu sublimieren, bis eine endgültige Masse von etwa 26 mg erreicht wird, gefolgt von sofort das Fläschchen mit einer PTFE-ausgekleidet Kappe Abdichtung.
Hinweis: Wenn erwünscht, kann dieser Schritt mit einer größeren Masse von Trockeneis um weitere Luft aus dem Fläschchen auszuschließen ausgeführt werden. Es ist bemerkenswert, dass das Wasser vorstellen kann, und so möglicherweise nicht die effektivste Strategie für Wasser empfindliche Reaktionen. - Rühren Sie das versiegelte Reaktion Fläschchen für 15 Minuten bei Raumtemperatur.
- Übertragen Sie den Reaktionsbehälter auf einen vorgewärmten Teller bei 110 ° C und 14 Stunden bevor man abkühlen umrühren.
- Öffnen Sie beim Abkühlen vorsichtig das Fläschchen um CO2zu entlüften.
- Entfernen Sie alle die flüchtigen Bestandteile im Vakuum.
Hinweis: Dieser Vorgang kann in der Durchstechflasche ausgeführt werden, oder die Lösung auf einem größeren Rundboden-Kolben übertragen werden kann. - Das Reaktionsgemisch 1,2 M HCl(Aq) (6 mL) hinzu, und rühren Sie für 15 Minuten offen an der Luft.
- Übertragen den wässrigen Anteil auf ein separatory Trichter, Waschen mit zusätzlichen 1,2 M HCl (4 mL) und Extrakt mit einer Mischung von 1:1 Diethylether/Hexanes (3 x 8 mL).
Hinweis: Diese Bio Wash enthält überschüssiges Phenyl Jodid und andere neutrale Nebenprodukte und entsorgt werden. - Neutralisieren und stellen grundlegende wässrige Lösung durch Zugabe von gesättigter NH4OH(Aq) (10 mL ist ein guter Ausgangspunkt).
- Die wässrige Schicht mit Dichlormethan (2 x 10 mL) zu extrahieren.
- Trocknen Sie die kombinierten organischen Fraktionen über Na2, also4, dann Filter in einer tarierten Probe Fläschchen.
- Verdunstet das Lösungsmittel im Vakuum geben das Produkt (2-Methyl-4-Phenyl-Butanamine) als ein gelbes Öl.
3. Reaktion in einem 40 mL Fläschchen (Luft nicht ausgeschlossen)
- Fügen Sie eine Stir Bar zu einem trockenen 40 mL Fläschchen.
- Das Fläschchen Palladium Acetat (33,5 mg, 0,15 Mmol) hinzufügen.
- Das Fläschchen Silber Trifluoroacetate (499,5 mg, 2,25 Mmol) hinzufügen.
- Das Fläschchen Phenyl Jodid (461,5 mg, 2,25 Mmol) hinzufügen.
- Das Fläschchen Tert-Amyl Amin (131,5 mg, 1,5 Mmol) hinzufügen.
- Das Fläschchen Essigsäure (5,0 mL) hinzufügen.
Hinweis: Das Verhältnis der Lösung Lautstärke zu Fläschchen Größe ist wichtig, wie die unmittelbare Sublimation von CO2 auf Zugabe von Trockeneis mechanisch verdrängen kann Lösungsmittel wenn zuviel wird relativ zur Größe des den Reaktionsbehälter verwendet. - Das Fläschchen deionisiertes Wasser (108.5 μL, 6,02 Mmol) hinzufügen.
- Wiegen Sie Trockeneis (131,5 mg, 3,0 Mmol), und sofort fügen Sie das Trockeneis das Fläschchen hinzu, und gleichzeitig damit auch sofort das Fläschchen mit einer PTFE-ausgekleidet Kappe verschließen.
Hinweis: Sollte der gesamte Vorgang innerhalb von ca. 5 Sekunden, um zu verhindern, dass die Sublimation und die Flucht von der geringen Menge an CO2 hinzugefügt durchgeführt werden (Dies wird durch die Bildung von gefrorenen Essigsäure um das Trockeneis verlangsamt). Die Menge an CO2 hinzugefügt werden ein ungefährer Wert, und in unseren Händen ist eine Abweichung von ein paar mg zulässig. - Rühren Sie das versiegelte Reaktion Fläschchen für 15 Minuten bei Raumtemperatur.
- Übertragen Sie den Reaktionsbehälter auf einen vorgewärmten Teller bei 110 ° C und 14 Stunden bevor man abkühlen umrühren.
- Öffnen Sie beim Abkühlen vorsichtig das Fläschchen um CO2zu entlüften.
- Entfernen Sie alle die flüchtigen Bestandteile im Vakuum.
Hinweis: Dieser Vorgang kann in der Durchstechflasche ausgeführt werden, oder die Lösung auf einem größeren Rundboden-Kolben übertragen werden kann. - Das Reaktionsgemisch 1,2 M HCl(Aq) (30 mL) hinzu und rühren Sie für 15 Minuten offen an der Luft.
- Übertragen den wässrigen Anteil auf ein separatory Trichter, Waschen mit zusätzlichen 1,2 M HCl (20 mL) und Extrakt mit einer Mischung von 1:1 Diethylether/Hexanes (3 x 8 mL).
Hinweis: Diese Bio Wash enthält überschüssiges Phenyl Jodid und andere neutrale Nebenprodukte und entsorgt werden. - Neutralisieren und stellen grundlegende wässrige Lösung durch Zugabe von gesättigter NH4OH(Aq) (10 mL ist ein guter Ausgangspunkt).
- Die wässrige Schicht mit Dichlormethan (2 x 20 mL) zu extrahieren.
- Trocknen Sie die kombinierten organischen Fraktionen über Na2, also4, dann Filter in einer tarierten Probe Fläschchen.
- Verdunstet das Lösungsmittel im Vakuum, was dem Produkt (2-Methyl-4-Phenyl-Butanamine) als ein gelbes Öl.
4. Reaktion in einem 35 mL Druckrohr (Luft nicht ausgeschlossen)
- Eine trockene 35 mL-Druckrohr Stir Bar hinzufügen.
- Das Druckrohr Palladium Acetat (6,7 mg, 0,03 Mmol) hinzufügen.
- Das Druckrohr Silber Trifluoroacetate (132,5 mg, 0,6 Mmol) hinzufügen.
- Das Druckrohr Phenyl Jodid (183,6 mg, 0.9 Mmol) hinzufügen.
- Fügen Sie 2-Methyl -N-(3-methylbenzyl) Butan-2-Amin (57,4 mg, 0,3 Mmol) in die Druckleitung.
- Das Fläschchen, gefolgt von 1,1,1,3,3,3, Essigsäure (1,0 mL) hinzufügen-Hexafluoroisopropanol (1,0 mL).
Hinweis: Das Verhältnis der Lösung Lautstärke zu Fläschchen Größe ist wichtig, wie die unmittelbare Sublimation von CO2 auf Zugabe von Trockeneis mechanisch verdrängen kann Lösungsmittel wenn zuviel wird relativ zur Größe des den Reaktionsbehälter verwendet. - Das Druckrohr deionisiertes Wasser (21,7 μL, 1,2 Mmol) hinzufügen.
- Trockeneis (1,32 g, 30 Mmol) wiegen, und sofort hinzufügen das Trockeneis das Druckrohr und gleichzeitig auch sofort Dichtung Druckschlauch mit dem entsprechenden Teflon-Schraubverschluss.
Hinweis: Sollte der gesamte Vorgang innerhalb von ca. 5 Sekunden, um zu verhindern, dass die Sublimation und die Flucht von der geringen Menge an CO2 hinzugefügt durchgeführt werden (Dies wird durch die Bildung von gefrorenen Essigsäure um das Trockeneis verlangsamt). Die Menge an CO2 hinzugefügt werden ein ungefährer Wert, und in unseren Händen ist eine Abweichung von ein paar mg zulässig. - Rühren Sie das verschlossenen Reaktionsgefäß für 15 Minuten bei Raumtemperatur.
- Übertragen Sie den Reaktionsbehälter auf einen vorgewärmten Teller bei 90 ° C und rühren Sie für 24 Stunden bevor Sie Abkühlen zulassen.
- Beim Abkühlen, legte ein Handtuch oder gepolsterten Handschuh über die GAP, und öffnen Sie vorsichtig die Druckleitung zur CO2zu entlüften.
- Entfernen Sie alle die flüchtigen Bestandteile im Vakuum.
Hinweis: Dieser Vorgang kann in die Druckleitung mit einem geeigneten Adapter ausgeführt werden, oder die Lösung auf einem größeren Rundboden-Kolben übertragen werden kann. - Das Reaktionsgemisch 1,2 M HCl(Aq) (12 mL) hinzu und rühren Sie für 15 Minuten offen an der Luft.
- Übertragen den wässrigen Anteil auf ein separatory Trichter, Waschen mit zusätzlichen 1,2 M HCl (8 mL) und Extrakt mit einer Mischung von 1:1 Diethylether/Hexanes (3 x 8 mL).
Hinweis: Diese Bio Wash enthält überschüssiges Phenyl Jodid und andere neutrale Nebenprodukte und entsorgt werden. - Neutralisieren und stellen grundlegende wässrige Lösung durch Zugabe von gesättigter NH4OH(Aq) (10 mL ist ein guter Ausgangspunkt).
- Die wässrige Schicht mit Dichlormethan (2 x 10 mL) zu extrahieren.
- Trocknen Sie die kombinierten organischen Fraktionen über Na2, also4, dann Filter in einer tarierten Probe Fläschchen.
- Verdunstet das Lösungsmittel im Vakuum, was dem Produkt (2-Methyl-N-(3-methylbenzyl)-4-phenylbutan-2-amine) als ein gelbes Öl.
Ergebnisse
Im Anschluss an diese Protokolle ist es möglich, laden Sie eine Reaktion Phiole mit einer entsprechenden Menge an Kohlendioxid, chemische Reaktionen zu erreichen, die CO erfordern2 Atmosphären. Der Druck im Schritt 1 erreicht errechnet sich zu ca. 3 Atmosphären (siehe Diskussion zur Bestimmung dieses Wertes), obwohl aufgrund der teilweisen Solvatation der beobachteten Druck in der Nähe von 2 Atmosphären bei Raumtemperatur ist, und sollte ca. 2,6 Atmosphären unter den Reaktionsbedingungen. Daher ist unter den Bedingungen in Schritt 1, 2-Methyl-4-Phenyl-Butanamine in 69 % Ertrag (Abbildung 2) erhältlich. Durch erste Spülung des Kolbens Luft durch Verschiebung von sublimieren CO2 (Schritt2), kann die Ausbeute etwas auf 72 % gesteigert werden. Zur Unterscheidung zwischen diese Ergebnisse bei ~2.6 Atmosphären Druck, Durchführung der Reaktion unter 1 Atmosphäre CO2 liefert mit einem Serieninbetriebnahme Schlenk das gewünschte Produkt in nur 49 % isolierten Ausbeute. Wenn kein CO2 verwendet wird, oder das Fläschchen nicht richtig verschlossen ist und somit eine stabile CO2 Atmosphäre nicht, dann beibehalten wird < 5 % Ausbeute an das gewünschte Produkt um 1H NMR (mit 1,1,2,2-Tetrachloroethane als Referenzstandard) erkannt wird. Unterdessen Aufstockung der Reaktions um den Faktor 5 während gleichzeitig mit einer größeren Reaktion Phiole (Schritt 3) Produkt, noch geben kann allerdings in einer leicht verringerten Ausbeute von 42 %. Die Reaktionen können auch durchgeführt werden, in Druck-Reaktionsgefäßen (Abbildung 1), in diesem Fall ermöglicht die Synthese von 2-Methyl -N-(3-methylbenzyl)-4-phenylbutan-2-amine in 40 % Ausbeute (Abbildung 3).

Abbildung 1: Reaktion in dieser Studie verwendeten Schiffe. Von links nach rechts: 2 Dram Vial, 10 Dram Vial, 35 mL Druckrohr). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2. 1 H-NMR des 2-Methyl-4-Phenyl-Butanamine. 400 MHz, CDCl3, 298 K. Bitte klicken Sie hier für eine größere Version dieser Figur.
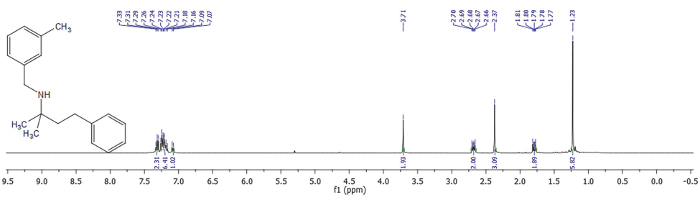
Abbildung 3. 1 H-NMR von 2-Methyl -N-(3-methylbenzyl)-4-phenylbutan-2-amine. 400 MHz, CDCl3, 298 K. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Kohlendioxid in leeren Fläschchen be- | ||||||||||||
| 100 mg | 125 mg | 150 mg | 175 mg | 200 mg | 225 mg | 250 mg | 275 mg | 300 mg | Legende | |||
| 25 º C | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ = Stabil unter Bedingungen | ||
| 60OC | √ | √ | √ | √ | √ | √ | √ | √ | √ | X = instabil unter Bedingungen | ||
| 70ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 80 | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 90ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| Temperatur | 100 º C | √ | √ | √ | √ | √ | √ | √ | √ | √ | ||
| 110ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 120ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 130ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 140ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 150 | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
| 160ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | |||
Tabelle 1. Relative Stabilität von 7,5 mL Fläschchen basierend auf CO2 Belastung und Temperatur. Fläschchen wurden mit der erforderlichen Menge an Trockeneis, gefolgt von unmittelbar mit einer PTFE-ausgekleidet Kappe Abdichtung geladen. Die Fläschchen wurden sofort hinter einer Explosion Schild in einem Fumehood, gefolgt durch Erhitzen auf 60 ° C, gefolgt von 10 ° C pro Stunde bis zu einem Höchstwert von 160 ° c erhöhen in Pie-Blöcke platziert. Die Schalen wurden dann gekühlt und vorsichtig geöffnet, um zu bestätigen, dass kein Druckverlust CO2 geschehen war.
| Kohlendioxid in leeren Fläschchen be- | |||||||||||||
| 300 mg | 325 mg | 350 mg | 375 mg | 400 mg | 425 mg | 450 mg | 475 mg | 500 mg | 525 mg | Legende | |||
| 25 º C | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | √ = Stabil unter Bedingungen | ||
| 60OC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | X = instabil unter Bedingungen | ||
| 70ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 80 | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 90ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| Temperatur | 100 º C | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | ||
| 110ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 120ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 130ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 140ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 150 | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
| 160ºC | √ | √ | √ | √ | √ | √ | √ | √ | √ | x | |||
Tabelle 2. Relative Stabilität von 40 mL Fläschchen basierend auf CO2 Belastung und Temperatur. Fläschchen wurden mit der erforderlichen Menge an Trockeneis, gefolgt von unmittelbar mit einer PTFE-ausgekleidet Kappe Abdichtung geladen. Die Fläschchen wurden sofort hinter einer Explosion Schild in einem Fumehood, gefolgt durch Erhitzen auf 60 ° C, gefolgt von 10 ° C pro Stunde bis zu einem Höchstwert von 160 ° c erhöhen in Pie-Blöcke platziert. Die Schalen wurden dann gekühlt und vorsichtig geöffnet, um zu bestätigen, dass kein Druckverlust CO2 geschehen war.
Diskussion
Verwenden die van der Waals Gleichung des Zustandes, lässt der ungefähren Druck dieser Systeme berechneten45
GL. 1:
Unter den Bedingungen in Protokoll Nr. 1, können wir davon ausgehen, 26,3 mg CO2 gibt n = 5,98 x 10-4 Mols
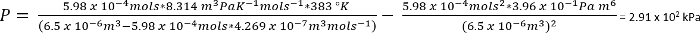
Als eine grobe Schätzung bedeutet dies, dass im Protokoll Nr. 1 die Reaktionen unter ca. 2,8 Atmosphären von CO2durchgeführt wurden. Vorausgesetzt, vernachlässigbar Verdrängung der heimischen Atmosphäre im Behälter (wie oben erwähnt, eine Patina von gefrorenen Essigsäure wird langsam die ersten Sublimation von Trockeneis, höhere Genauigkeit bei der Messung von zusätzlichen Trockeneis zu erleichtern), jedoch der Gesamtdruck dann dürften von Dalton Gesetz besser modelliert werden:
GL. 2:
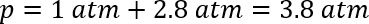
Dieses Modell berücksichtigt nicht, dass einige der Gase im Lösungsmittel aufgelöst wird. In diesem Fall war es erforderlich, eine Manometer, um den Druck ausreichend zu beurteilen. Durch Anfügen einer Scheidewand, das Fläschchen und einfügen eine Manometer, war es möglich, den Druck bei Raumtemperatur messen. Die beobachteten Druck über mehrere Reaktionen waren nur 15 ± 3 Psi über Atmosphärendruck (≈ 1 ± 0,2 Atmosphären) oder insgesamt rund 2 Atmosphären. Obwohl die Henry-Konstante CO2 in ordentlich Essigsäure nicht ohne weiteres zum Vergleich zur Verfügung war, ist es bekannt, dass Zusatz von Essigsäure zu Wasser die Löslichkeit von Kohlendioxid46 verbessert. Der geschätzte Druck bei Zimmertemperatur konnte mit dem bisherigen Ansatz berechnet werden:

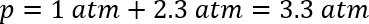
Der erwartete Druck wäre daher ein etwas niedriger 3.3 Atmosphären bei Raumtemperatur in der Abwesenheit des Gases in dem Lösungsmittel auflösen. Der Unterschied zwischen der beobachteten und berechneten Druck implizieren, dass CO2 hat relativ hohe Löslichkeit in organischen Lösungsmitteln. Vorausgesetzt vernachlässigbaren Unterschied in Höhe von gelöstem CO2 über den Temperaturbereich, würde ein Anstieg der Temperatur von 298 K auf die Reaktionstemperatur von 383 K innerhalb der 2 DRAM-Fläschchen ~2.6 Atmosphären Druckerhöhung.
Um die praktischen Betriebsbedingungen angemessen zu beurteilen, wurden 2 DRAM-Fläschchen Set-up mit unterschiedlichen Mengen von CO2, gefolgt von screening-diese bei unterschiedlichen Temperaturen. Um die Sicherheit des Bedieners zu gewährleisten, wurden die Fläschchen nur beheizten nach Ihrem Eingang hinter eines Explosion Schildes Fläschchen Fehler enthalten. Wenn die Fläschchen sprengten, galten die Bedingungen zu hart für die Fläschchen. Durch diesen Experimenten wurde festgestellt, dass CO2 Laden von bis zu 200 mg bei 110 ° C für die 2 Dram (7,5 mL) Fläschchen durch einheitliche Prüfungen toleriert wurde. Dies entspricht etwa 20,7 Atmosphären Druck basiert auf dem früheren Ansatz, nicht standhalten, die Menge des Gases aufgelöst, die durch wenige Atmosphären den Gesamtdruck verringern kann. Über 200 mg laden würde jedoch die Reaktionsgefäße in der Regel explodieren vor Erreichen der soll-Temperatur von 110 ° C. Vorsicht sollte ausgeübt werden, wenn die Bedingungen jedoch ändern: In einem Szenario wurde eine ähnliche Reaktion bei 160 ° C mit nur 150 mg CO2versucht, aber das Fläschchen gescheitert, bevor es die Zieltemperatur erreicht hatte. Die größte Gefahr für die Änderung der Reaktions wäre Bedingungen erhöhen die Belastung der CO2, da dies die Fläschchen vor dem sicheren technischen Steuerelemente, z. B. Blast Shields, fehlschlagen verursachen kann umgesetzt werden kann.
Eine mögliche Einschränkung für diese Strategie ist das Fehlen von Daten über die Stabilität der Fläschchen unter verschiedenen Bedingungen. Daher war es notwendig, die Fläschchen für ihre Fähigkeit, unterschiedliche Drücke unter einer Reihe von unterschiedlichen Temperaturen zu widerstehen-Bildschirm. Dies wurde mit 7,5 mL Fläschchen (Tabelle 1) initiiert. Jedes Fläschchen wurde mit einer vorgegebenen Menge von Trockeneis, gefolgt von sofortige Abdichtung mit einem PTFE-ausgekleidet Schraubverschluss beauftragt. Diese Fläschchen beobachtet, um der diesen Bedingungen tolerant zu sein und keine Fehler bei Raumtemperatur. Die Temperatur wurde dann für alle Ampullen und keine Explosionen aufgetreten während des Experiments. Beim Abkühlen, wurde jedes Fläschchen eröffnet, um zu bestätigen, dass sie Druckbeaufschlagung mit CO2gewartet hatte. Dies deutet darauf hin, dass die Fläschchen aufwärts von 26,5 Atmosphären Druck, der im Gegensatz zu den Reaktionsbedingungen ist in die ~20.7 Atmosphären Druck war die konsequente Beschränkung tolerieren können. Es wird daher empfohlen, dass Lösungsmittel Identität und Volumen sorgfältig werden in Abweichung vom das offenbarte Verfahren betrachtet.
Ein ähnlicher Bildschirm für maximale Toleranz erfolgte mittels 40 mL Reaktionsgefäße (Tabelle 2). In diesem Fall eine Obergrenze für das CO2 Laden der leere Fläschchen war entschlossen, 500 mg. oberhalb dieser werden die Fläschchen schnell versagt bei Raumtemperatur. Überraschenderweise war der berechnete Druck der Proben, die bei Raumtemperatur Scheitern begann ca. 7 Atmosphären und höher. Dies steht im Gegensatz zu der Durchstechflasche enthält 500 mg des CO2, welcher bei 160 ° C stabil war und eine berechnete Druck von knapp 10,5 Atmosphären entsprechen würde. Diese Ergebnisse waren reproduzierbar über verschiedene Fläschchen, aber es gibt keine eindeutige Erklärung für dieses Phänomen zu diesem Zeitpunkt. Unter den Bedingungen gemäß Protokoll 3 beschrieben wurden nur etwa 300 mg Belastungen von CO2 toleriert. Dies ist jedoch tatsächlich im Einklang mit der bisherigen Experimenten wie unter den Bedingungen der Druck, unkorrigierte für mögliche Absorption von Kohlendioxid durch das Lösungsmittel ca. 10 Atmosphären wäre. Die verminderte Stabilität des größeren Fläschchen Druck wird erwartet, und deutet darauf hin, dass diese Verfahren besser in Gefäßen durchgeführt werden, die kleineren Durchmessern und dickere Wände47haben.
Zusammenfassend lässt sich sagen wird dieses Protokoll für die Verwendung von Trockeneis als solide CO2 Quelle in leicht zugänglich Glaswaren voraussichtlich neue Wege im Bereich der synthetischen Chemie zu öffnen. Durch die Generierung von gering bis mäßig Druck innerhalb des geschlossenen Fläschchen oder Druckrohre, Fixierung von Kohlendioxid verarbeitet wie Carboxylierung48,49,50, sowie CO2 Reduktion51, 52 , 53, erreicht werden, ohne den Einsatz von teuren Spezialausrüstung. Diese neu verabschiedeten Strategie werden Fortschritte im Bereich der Verwertung von CO2 durch Einbindung in nützlichen chemischen Rohstoffe wie zyklische Karbonate, Poly Karbonate und Carbamate54erleichtern. Darüber hinaus die Strategie der Einführung von CO2 als Feststoff kann auch von Vorteil sein wo Gasgemische, wie z. B. CO2 und CO gewünscht sind, oder CO-2 und H2, da dies die Zugabe der beiden Reagenzien in ein nicht-gasförmige erleichtert Form. Obwohl die Verwendung von Trockeneis, flüssiges CO2 einzuführen hat worden für Extraktionen und Chromatographie40,41,42,43,44, dieses Protokoll für benutzt Einführung von CO2 als eine solide Mai auch sein für in Situ -Generation von CO2 Buchst für den Einsatz als eine Reaktion Lösungsmittel55,56,57, Zukunft Arbeit erkunden andere Verwendungen dafür nützlich Ansatz, vor allem die Kombination von CO2 mit anderen Gas-Vorstufen, werden derzeit in unserer Gruppe.
Offenlegungen
Die Verwendung von CO2 als richtende Gruppe für die C-H Aktivierung von Lewis grundlegende Substraten ist derzeit im Mittelpunkt der Vereinigten Staaten vorläufige Patent #62/608, 074.
Danksagungen
Die Autoren möchten Anschubfinanzierung von der University of Toledo sowie Mittel aus der American Chemical Society Herman Frasch Stiftung in teilweise Unterstützung dieser Arbeit anerkennen. Herr Thomas Kina ist bekannt für seine Unterstützung bei der Entwicklung von geeigneten Manometers zur Messung der Reaktion Druck anerkannt. Herr Steve Modar wird für nützliche Diskussionen gedankt.
Materialien
| Name | Company | Catalog Number | Comments |
| 7.5 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-00984 | Can be reused. |
| 40 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-01039 | Can be reused. |
| Pressure Tube, #15 Thread, 7" Long, 25.4 mm O.D. | Ace Glass | 8648-06 | Can be reused. |
| Pie-Block for 2 Dram Vials | ChemGlass | CG-1991-P14 | Can be reused. |
| Pie-Block for 10 Dram Vials | ChemGlass | CG-1991-P12 | Can be reused. |
| 3.2 mm PTFE Disposable Stir Bars | Fisher | 14-513-93 | Can be reused. |
| C-MAG HS 7 Control Hotplate | IKA | 20002695 | |
| Analytical Weighing Balance | Sartorius | QUINTIX2241S | |
| Double-Ended Micro-Tapered Spatula | Fisher Scientific | 21-401-10 | |
| Hei-VAP Advantage - Hand Lift Model with G5 Dry Ice Condenser Rotary Evaporator | Heidolph | 561-01500-00 | |
| Bump Trap 14/20 Joint | ChemGlass | CG-1322-01 | |
| tert-Amyl amine | Alfa Aesar | B24639-14 | Used as received. |
| 2-Methyl-N-(3-methylbenzyl)butan-2-amine | N/A | N/A | Prepared from reductive amination of tert-amyl amine and 3-tolualdehyde in the presence of sodium borohydride in methanol. |
| Palladium Acetate | Chem-Impex International, Inc. | 4898 | Used as received. |
| Silver Trifluoroacetate | Oakwood Chemicals | 007271 | Used as received. |
| Phenyl Iodide | Oakwood Chemicals | 003461 | Used as received. |
| Acetic Acid | Fisher Chemical | A38 | Used as received. |
| 1,1,1,3,3,3-Hexafluoroisopropanol | Oakwood Chemicals | 003409 | Used as received. |
| Deionized Water | Obtained from in-house deionized water system. | ||
| Dry Ice | Carbonic Enterprises Dry Ice Inc. | Non-food grade dry ice. | |
| Concentrated Hydrochloric Acid | Fisher Chemical | A144SI | Diluted to a 1.2 M solution prior to use. |
| Diethyl Ether, Certified | Fisher Chemical | E138 | Used as received. |
| Hexanes, Certified ACS | Fisher Chemical | H292 | Used as received. |
| Saturated Ammonium Hydroxide | Fisher Chemical | A669 | Used as received. |
| Dichloromethane | Fisher Chemical | D37 | Used as received. |
| Sodium Sulfate, Anhydrous | Oakwood Chemicals | 044702 | Used as received. |
| 250 mL Separatory Funnel | Prepared in-house by staff glassblower. | ||
| 100 mL Round Bottom Flask | Prepared in-house by staff glassblower. | ||
| Scientific Disposable Funnel | Caplugs | 2085136030 | |
| Borosilicate Glass Scintillation Vials, 20 mL | Fisher Scientific | 03-337-15 | |
| 5 mm O.D. Thin Walled Precision NMR Tubes | Wilmad | 666000575 | |
| Chloroform-d | Cambridge Isotope Laboratories, Inc. | DLM-7 | Used as received. |
Referenzen
- Verboom, W. Selected Examples of High-Pressure Reactions in Glass Microreactors. Chemical Engineering and Technology. 32 (11), 1695-1701 (2009).
- Schettino, V., Bini, R. Constraining Molecules at the Closest Approach: Chemistry at High Pressure. Chemical Society Reviews. 36, 869-880 (2007).
- Hemminger, O., Marteel, A., Mason, M. R., Davies, J. A., Tadd, A. R., Abraham, M. A. Hydroformylation of 1-Hexene in Supercritical Carbon Dioxide Using a Heterogeneous Rhodium Catalyst. 3. Evaluation of Solvent Effects. Green Chemistry. 4, 507-512 (2002).
- Mo, F., Dong, G. Regioselective Ketone α-Alkylation with Simple Olefins via Dual Activation. Science. 345 (6192), 68-72 (2014).
- Schultz, A. G., Kirincich, S. J., Rahm, R. Asymmetric Organic Synthesis. Preparation and Birch Reduction-Alkylation of 2-Methyl-3,4-Dihydroisoquinolin-1-ones. Tetrahedron Letters. 36 (26), 4551-4554 (1995).
- Dong, L., Aleem, S., Fink, C. A. Microwave-Accelerated Reductive Amination Between Ketones and Ammonium Acetate. Tetrahedron Letters. 51 (39), 5210-5212 (2010).
- Wang, D., Astruc, D. The Golden Age of Transfer Hydrogenation. Chemical Reviews. 115 (13), 6621-6686 (2015).
- Morimoto, T., Kakiuchi, K. Evolution of Carbonylation Catalysis: No Need for Carbon Monoxide. Angewandte Chemie International Edition in English. 43 (42), 5580-5588 (2004).
- Iranpoor, N., Firouzabadi, H., Motevalli, S., Talebi, M. Palladium-Free Aminocarbonylation of Aryl, Benzyl, and Styryl Iodides and Bromides by Amines Using Mo(CO)6 and Norbornadiene. Tetrahedron. 69 (1), 418-426 (2013).
- Ren, W., Yamane, M. Mo(CO)6-Mediated Carbamoylation of Aryl Halides. Journal of Organic Chemistry. 75 (24), 8410-8415 (2010).
- Wang, H., Dong, B., Wang, Y., Li, J., Shi, Y. A Palladium-Catalyzed Regioselective Hydroesterification of Alkenylphenols to Lactones with Phenyl Formate as CO Source. Organic Letters. 16 (1), 186-189 (2014).
- Zhang, Y., Chen, J. -L., Chen, Z. -B., Zhu, Y. -M., Ji, S. -J. Palladium-Catalyzed Carbonylative Annulation Reactions Using Aryl Formate as a CO Source: Synthesis of 2-Substituted Indene-1,3(2H)-Dione Derivatives. Journal of Organic Chemistry. 80 (21), 10643-10650 (2015).
- Wan, Y., Alterman, M., Larhed, M., Hallberg, A. Dimethylformamide as a Carbon Monoxide Source in Fast Palladium-Catalyzed Aminocarbonylations of Aryl Bromides. Journal of Organic Chemistry. 67 (17), 6232-6235 (2002).
- Gockel, S. N., Hull, K. L. Chloroform as a Carbon Monoxide Precursor: In or Ex Situ Generation of CO for Pd-Catalyzed Aminocarbonylations. Organic Letters. 17 (13), 3236-3239 (2015).
- Zhao, H., Du, H., Yuan, X., Wang, T., Han, W. Iron-Catalyzed Carbonylation of Aryl Halides with Arylborons Using Stoichiometric Chloroform as the Carbon Monoxide Source. Green Chemistry. 18, 5782-5787 (2016).
- Chen, P., Xu, C., Yin, H., Gao, X., Qu, L. Shock Induced Conversion of Carbon Dioxide to Few Layer Graphene. Carbon. , 471-476 (2017).
- Iijima, T., Yamaguchi, T. Efficient Regioselective Carboxylation of Phenol to Salicylic Acid with Supercritical CO2 in the Presence of Alumnium Bromide. Journal of Molecular Catalysis A: Chemical. 295 (1-2), 52-56 (2008).
- Jevtovikj, I., Manzini, S., Hanauer, M., Rominger, F., Schaub, T. Investigations on the Catalytic Carboxylation of Olefins with CO2 Towards α, β-Unsaturated Carboxylic Acid Salts: Characterization of Intermediates and Ligands as well as Substrate Effects. Dalton Transactions. 44, 11083-11094 (2015).
- Juliá-Hernández, F., Moragas, T., Cornella, J., Martin, R. Remote Carboxylation of Halogenated Aliphatic Hydrocarbons with Carbon Dioxide. Nature. 545, 84-88 (2017).
- North, M., Pasquale, R. Mechanism of Cyclic Carbonate Synthesis from Epoxides and CO2. Angewandte Chemie International Edition. 48 (16), 2946-2948 (2009).
- Yeung, C. S., Dong, V. M. Beyond Aresta's Complex: Ni- and Pd-Catalyzed Organozinc Coupling to CO2. Journal of the American Chemical Society. 130 (25), 7826-7827 (2008).
- Zhu, D. -Y., Fang, L., Han, H., Wang, Y., Xia, J. -B. Reductive CO2 Fixation via Tandem C-C and C-N Bond Formation: Synthesis of Spiro-Indopyrrolidines. Organic Letters. 19 (16), 4259-4262 (2017).
- Kapoor, M., Liu, D., Young, M. C. Carbon Dioxide Mediated C(sp3)–H Arylation of Amine Substrates. J. Am. Chem. Soc. , (2018).
- Zhang, Y. -F., Zhao, H. -W., Wang, H., Wei, J. -B., Shi, Z. -J. Readily Removable Directing Group Assisted Chemo- and Regioselective C(sp3)-H Activation by Palladium Catalysis. Angewandte Chemie International Edition. 54 (46), 13686-13690 (2015).
- He, G., Chen, G. A Practical Strategy for the Structural Diversification of Aliphatic Scaffolds Through the Palladium-Catalyzed Picolinamide-Directed Remote Functionalization of Unactivated C(sp3)-H Bonds. Angewandte Chemie International Edition. 50 (22), 5192-5196 (2011).
- Nack, W. A., Wang, X., Wang, B., He, G., Cheng, G. Palladium-Catalyzed Picolinamide-Directed Iodination of Remote ortho-C-H Bonds of Arenes: Synthesis of Tetrahydroquinolines. Beilstein Journal of Organic Chemistry. 12, 1243-1249 (2016).
- Feng, P., Li, M., Ge, H. Room Temperature Palladium-Catalyzed Decarboxylative ortho-Acylation of Acetanilides with α-Oxocarboxylic Acids. Journal of the American Chemical Society. 132 (34), 11898-11899 (2010).
- Coomber, C. E., Benhamou, L., Bučar, D. -K., Smith, P. D., Porter, M. J., Sheppard, T. D. Silver-Free Palladium-Catalyzed C(sp3)-H Arylation of Saturated Bicyclic Amine Scaffolds. Journal of Organic Chemistry. 83 (5), 2495-2503 (2018).
- Mei, T. -S., Wang, X., Yu, J. -Q. Pd(II)-Catalyzed Amination of C-H Bonds Using Single-Electron or Two-Electron Oxidants. Journal of the American Chemical Society. 131 (31), 10806-10807 (2009).
- Xie, W., Yang, J., Wang, B., Li, B. Regioselective Ortho Olefination of Aryl Sulfonamide via Rhodium-Catalyzed Direct C-H Bond Activation. Journal of Organic Chemistry. 79 (17), 8278-8287 (2014).
- Rodriguez, N., Romero-Revilla, J. A., Fernández-Ibáñez, M. Á, Carretero, J. C. Palladium-Catalyzed N-(2-pyridyl)sulfonyl-Directed C(sp3)-H γ-Arylation of Amino Acid Derivatives. Chemical Science. 4, 175-179 (2013).
- Zheng, Y., Song, W., Zhu, Y., Wei, B., Xuan, L. Pd-Catalyzed Acetoxylation of γ-C(sp3)-H Bonds of Amines Directed by a Removable Bts-Protecting Group. Journal of Organic Chemistry. 83 (4), 2448-2454 (2018).
- Jain, P., Verma, P., Xia, G., Yu, J. -Q. Enantioselective Amine α-Functionalization Via Palladium-Catalysed C-H Arylation of Thioamides. Nature Chemistry. 9, 140-144 (2017).
- Tran, A. T. Practical Alkoxythiocarbonyl Auxiliaries for Ir(I)-Catalyzed C-H Alkylation of Azacycles. Angewandte Chemie International Edition. 56 (35), 10530-10534 (2017).
- Huang, Z., Wang, C., Dong, G. A Hydrazone-Based exo-Directing Group Strategy for β-C-H Oxidation of Aliphatic Amines. Angewandte Chemie International Edition. 55 (17), 5299-5303 (2016).
- Xu, Y., Young, M. C., Wang, C., Magness, D. M., Dong, G. Catalytic C(sp3)-H Arylation of Free Primary Amines via an in situ Generated Exo-Directing Group. Chemie International Edition. 55 (31), 9084-9087 (2016).
- Liu, Y., Ge, H. Site-Selective C-H Arylation of Primary Aliphatic Amines Enabled by a Catalytic Transient Directing Group. Nature Chemistry. 9, 26-32 (2017).
- Wu, Y., Chen, Y. -Q., Liu, T., Eastgate, M. D., Yu, J. -Q. Pd-Catalyzed γ-C(sp3)-H Arylation of Free Amines Using a Transient Directing Group. Journal of the American Chemical Society. 138 (44), 14554-14557 (2016).
- Yada, A., Liao, W., Sato, Y., Murakami, M. Buttressing Salicylaldehydes: A Multipurpose Directing Group for C(sp3)-H Bond Activation. Angewandte Chemie International Edition. 56 (4), 1073-1076 (2017).
- Baldwin, B. W., Kuntzleman, T. S. Liquid CO2 in Centrifuge Tubes: Separation of Chamazulene from Blue Tansy (Tanacetum annum) Oil via Extraction and Thin-Layer Chromatography. Journal of Chemical Education. 95 (4), 620-624 (2018).
- McKenzie, L. C., Thompson, J. E., Sullivan, R., Hutchison, J. E. Green Chemical Processing in the Teaching Laboratory: A Convenient Liquid CO2 Extraction of Natural Products. Green Chemistry. 6, 355-358 (2004).
- Hudson, R., Ackerman, H. M., Gallo, L. K., Gwinner, A. S., Krauss, A., Sears, J. D., Bishop, A., Esdale, K. N., Katz, J. L. CO2 Dry Cleaning: A Benign Solvent Demonstration Accessible to K-8 Audiences. Journal of Chemical Education. 94, 480-482 (2017).
- Barcena, H., Chen, P. An Anesthetic Drug Demonstration and an Introductory Antioxidant Activity Experiment with "Eugene, the Sleepy Fish.". Journal of Chemical Education. 93, 202-205 (2016).
- Bodsgard, B. R., Lien, N. R., Waulters, Q. T. Liquid CO2 Extraction and NMR Characterization of Anethole from Fennel Seed: A General Chemistry Laboratory. Journal of Chemical Education. 93, 397-400 (2016).
- Fishbane, P. M., Gasiorowicz, S. G., Thornton, S. T. Physics for Scientists and Engineers. , (2005).
- Rumpf, B., Xia, J., Maurer, G. Solubility of Carbon Dioxide in Aqueous Solutions Containing Acetic Acid or Sodium Hydroxide in the Temperature Range from 313 to 433 K and at Total Pressures up to 10 MPa. Industrial & Engineering Chemistry Research. 37, 2012-2019 (1998).
- Technical Information: Nomogram of Allowable Pressures. , Available from: http://www.adamschittenden.com/nomogram_of_pressures.pdf (2018).
- Luo, J., Larrosa, I. C-H Carboxylation of Aromatic Compounds Through CO2 Fixation. ChemSusChem: Chemistry & Sustainability, Energy & Materials. 10, 3317-3332 (2017).
- Manjolinho, F., Arndt, M., Gooßen, K., Gooßen, L. J. Catalytic C-H Carboxylation of Terminal Alkynes with Carbon Dioxide. ACS Catalysis. 2, 2014-2021 (2012).
- Banerjee, A., Dick., G. R., Yoshino, T., Kanan, M. W. Carbon Dioxide Utilization via Carbonate-Promoted C-H Carboxylation. Nature. 531, 215-219 (2016).
- Fei, H., Sampson, M. D., Lee, Y., Kubiak, C. P., Cohen, S. M. Photocatalytic CO2 Reduction to Formate Using a Mn(I) Molecular Catalyst in a Robust Metal-Organic Framework. Inorganic Chemistry. 54, 6821-6828 (2015).
- Chabolla, S. A., Yang, J. Y. For CO2 Reduction, Hydrogen-Bond Donors Do the Trick. ACS Central Science. 4, 315-317 (2018).
- Kim, D., Kley, C. S., Li, Y., Yang, P. Copper Nanoparticle Ensembles for Selective Electroreduction of CO2 to C2-C3 Products. Proceedings of the National Academy of Sciences of the United States of America. , C2-C3 (2017).
- Liu, Q., Wu, L., Jackstell, R., Beller, M. Using carbon dioxide as a building block in organic synthesis. Nature Communications. 6, 5933-5945 (2015).
- Hâncu, D., Green, J., Beckman, E. J. H2O2 in CO2 Sustainable Production and Green Reactions. Accounts of Chemical Research. 35, 757-764 (2002).
- Ballivet-Tkatchenko, D., Camy, S., Condoret, J. S. Carbon Dioxide, a Solvent and Synthon for Green Chemistry. Environmental Chemistry. Lichtofouse, E., Scwarzbauer, J., Robert, D. , Springer: Berlin. 541-552 (2005).
- Hyatt, J. A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. Journal of Organic Chemistry. 49, 5097-5101 (1984).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten