Method Article
Diferença de potencial nasal para quantificar o transporte do íon Trans-epitelial em ratos
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para medir a diferença de potencial nasal em ratos. O teste quantifica a função de transportadores transmembrana de íons como o regulador de condutância transmembranar de fibrose cística e o canal de sódio epitelial. É valioso para avaliar a eficácia de novas terapias para a fibrose cística.
Resumo
O teste de diferença de potencial nasal tem sido usado por quase três décadas para auxiliar no diagnóstico de fibrose cística (CF). Provou ser útil em casos de atenuado, oligo - ou mono-sintomática formas de CF geralmente diagnosticados mais tarde na vida e de distúrbios relacionados com a CF, tais como ausência bilateral congênita de deferente, pancreatite crónica idiopática, alérgica aspergilose broncopulmonar e bronquiectasias. Em contextos clínicos e pré-clínicos, o teste tem sido utilizado como um biomarcador para quantificar respostas para estratégias terapêuticas específicas para adaptação cf. o teste de um rato é um desafio e pode acarretar uma mortalidade associada. Este paper descreve a profundidade adequada de anestesia necessária para manter um cateter nasal em situ para perfusão contínua. Ele enumera as medidas para evitar Bronco-aspiração de soluções perfundidos no nariz. Ele também descreve o cuidado animal no final do teste, incluindo a administração de uma combinação de antídotos das drogas anestésicas, levando a inverter rapidamente a anestesia com recuperação total dos animais. Dados representativos obtidos de um CF e um rato selvagem-tipo mostram que o teste discrimina entre CF e não-CF. No total, o protocolo descrito aqui permite medições correctas do estatuto funcional de trans-epitelial transportadores de cloreto e sódio em ratos de respirar espontaneamente, bem como vários testes no mesmo animal reduzindo relacionados ao teste mortalidade.
Introdução
Há quase três décadas, utilizaram-se medições elétricas de diferença (PD) potencial para avaliar o estado funcional de transportadores de íons transmembrana expressado na mucosa nasal, como representante das vias aéreas distais1. Como uma dinâmica multipasso teste2,3, nasal PD permite funcional dissecação de fibrose cística regulador de condutância transmembrana (CFTR) e atividade de sódio epitelial canal (ENaC), ambos localizados na membrana apical as células epiteliais e exercendo cargos críticos na superfície hidratação das vias aéreas. A principal aplicação clínica do teste PD nasal é auxiliar no diagnóstico da CF, a doença genética fatal mais comum em populações caucasianas com uma incidência média de 1 de 2.500 nascidos vivos em países europeus. O teste de tempo revelou-se útil no diagnóstico das formas oligo - ou mono-sintomática atenuada, da CF, geralmente diagnosticados mais tarde na vida e de distúrbios relacionados com a CF, tais como ausência bilateral congênita de deferente, pancreatite crónica idiopática, alérgica aspergilose broncopulmonar e bronquiectasias4. Mais recentemente, clinometric avaliação de modulação terapêutica do CFTR básico defeito5,6,7,8,9,10,11 ,12,13,14,15,16 tem feito uso do PD nasal em ensaios clínicos de novas terapias de CF. Na configuração de pré-clínicos, o teste foi adaptado para o rato17 para permitir a investigação da Bioatividade da nova CF terapias alvo18,19,20,21. Em camundongos, a técnica é delicada, com base em espécies relacionadas com diferenças anatômicas no tamanho da região nasal entre roedores e seres humanos e principalmente sobre o papel essencial de entradas sensoriais da região nasofacial em roedores. Requer operadores treinados e qualificados, equipamentos e suprimentos.
CF é uma desordem sistêmica múltipla das glândulas exócrinas, na qual doença respiratória crônica domina o quadro clínico. A doença é causada por mutações no gene da codificação do adenosina monofosfato cíclica (cAMP)-regulamentado CFTR cloreto canal22. Até à data, mais de 2.000 mutações CFTR foram identificados23. O mais comum mutação24,25, encontrado em quase 90% dos alelos CF, corresponde a uma exclusão da fenilalanina na posição 508 da corrente do polypeptide da proteína (F508del-CFTR). A proteína CFTR é um canal de cloreto puramente ôhmica da condutibilidade. Também há evidência considerável que CFTR regula outros mecanismos de transporte, em particular, ENaC26,27. Transporte de eletrólito defeituosos, incluindo a condutância de cloreto CFTR-dependente reduzida e maior condutância de sódio ENaC-dependente, é uma característica dos epitélios CF. O antigo defeito é refletido por uma repolarização reduzida ou abolida em resposta a um eletroquímico efluxo favorecendo gradiente de cloreto e a adição de isoproterenol (β-adrenérgico agonista que aumenta cAMP intracelular) ou forskolin (um adenilato ciclase agonista, não aprovada para uso clínico). O último defeito é refletido por uma hiperpolarização basal da mucosa nasal (um PD mais negativa) e uma resposta aumentada a amilorida, um medicamento diurético que bloqueia ENaC28.
Modelos de rato CF têm sido frequentemente utilizados na investigação de CF e tem sido inestimáveis em dissecando patologia CF. Hoje em dia, pelo menos quinze modelos têm sido descritos29, três dos quais são homozigotos para a mutação F508del mais clinicamente relevantes30,31,32. Dentre estes três estirpes30, desenvolvido na Universidade de Erasmus em Roterdão, tem sido usado por quase 20 anos no laboratório Université catholique de Louvain (UCL). O modelo detm1Eur de Cftr30 provou para ser muito útil para estudar a dysregulation fisiopatologia da doença CF e para testar a eficácia de novas estratégias terapêuticas18,19,20, 21. Inúmeros problemas podem ocorrer durante ou início após (< 24h) o teste de PD nasal em ratos. Neste trabalho, são descritos a profundidade adequada de anestesia necessária para manter um cateter nasal em situ para perfusão contínua e medidas para evitar Bronco-aspiração de soluções perfundidos no nariz. O cuidado animal no final do teste também é descrito, incluindo a administração de uma combinação de antídotos de drogas anestésicas, levando a inverter rapidamente a anestesia com completa recuperação dos animais. No total, estes procedimentos permitem medições correctas em ratos de respirar espontaneamente, reduzida mortalidade relacionados ao teste e repetir o teste no mesmo animal. Obtidos a partir do teste de PD nasal em um CF e em um rato selvagem-tipo de dados representativos são mostrados e discutidos.
O protocolo de teste PD nasal murino é relatado em três sessões: avaliação e gestão antes, durante e depois do teste. No pré-teste avaliação e gestão, o protocolo de preparação do cateter de lúmen duplo nasal e de soluções usadas para perfusão nasal contínua é descrito em detalhes. Durante a avaliação e gestão porções do teste, a instalação experimental e a manipulação do mouse é minuciosamente dissecado. Finalmente, a gestão do animal no final do teste é descrito para melhorar a recuperação total de animais.
Protocolo
Os estudos e procedimentos foram aprovados pelo Comitê de ética para pesquisas com animais da UCL (2017/UCL/MD/015) e de acordo com as normas da Comunidade Europeia para uso de animais na pesquisa (CEE n º 86/609). Os investigadores estão qualificados para a experimentação animal, seguindo a Directiva 2010/63/UE do Parlamento Europeu e do Conselho, de 22 de setembro de 2010, relativa à protecção dos animais utilizados para fins científicos.
1. pré-teste de avaliação e gestão
- Prepare o cateter nasal de duplo lúmen.
Nota: Um cateter nasal é feito como um tubo de duplo lúmen capilar, um lúmen sendo usado para a perfusão contínua de soluções, e o outro como uma medida do canal.- Aquecer a seção central de uma parte, cerca de 20 cm de comprimento, de tubo de polietileno (2,0 mm de diâmetro interno; 3,0 mm de diâmetro externo; Figura 1 uma) na chama de um queimador de gás até que é macio o suficiente para puxar (10-15 s).
- Separe as duas extremidades para obter um tubo capilar fino de comprimento adequado (~ 15 cm) e (~0.1 mm) de diâmetro externo para a sonda nasal (Figura 1b).
- Limpar e desengordurar dois tais capilares com etanol puro, juntá-los com fita (Figura 1c) e cola-los juntos usando cola de cianoacrilato.
- Corte o excesso de comprimento das sondas com uma lâmina de barbear ou um bisturi para obter um comprimento ideal do cateter de lúmen duplo de cerca de 8 cm (Figura 1d).
- Injete água através de ambos os lúmens para verificar se eles são permeáveis.
- Aplica uma marca a uma distância de 5 mm da ponta.
Nota: A sonda é introduzida até a marca na narina, para que todas as medições são feitas no mesmo local no interior da cavidade nasal. - Armazene o cateter de lúmen duplo em uma caixa seca.
Nota: Pode ser usado de 6 - 10 vezes se adequadamente limpa imediatamente após o teste.
- Prepare a mistura de creme.
- Misture suavemente o creme do eletrólito e 3M KCl solução saturada em uma proporção de 1:1 (volumétrica), evitando a formação de pequenas bolhas de ar.
Nota: A mistura de creme é usada para construir as pontes do eletrodo para a medição e a referência Ag/AgCl eletrodos, conforme ilustrado na Figura 1.
- Misture suavemente o creme do eletrólito e 3M KCl solução saturada em uma proporção de 1:1 (volumétrica), evitando a formação de pequenas bolhas de ar.

Figura 1 : Sondas com eletrodos e pontes. A figura ilustra o tubo de polietileno, antes (a) e após o aquecimento e puxando (b), a fita se juntar as duas partes capilares (c) do cateter de duplo lúmen (d), os conectores de tubo de silicone (e) e os eletrodos (f). Para clareza de imagem, os conectores não foram preenchidos com a mistura de creme. Clique aqui para ver uma versão maior desta figura.
| Rótulo de solução | Descrição da solução |
| A | Solução salina tamponada basal |
| B | Livre de cloreto de sal solução tampão |
| C | Solução-mãe de amilorida 10-2 M |
| D | Solução 10-3 M forskolina |
Tabela 1: Solução de estoque para o teste de PD nasal em ratos.
| Sal | mM | Peso molecular | g/L |
| Cloreto de sódio (NaCl) | 135 | 58.44 | 7.889 |
| Cloreto de cálcio dihidratado (CaCl2.2h2O) | 2.25 | 147 | 0.331 |
| Hexaidrato do cloreto de magnésio (MgCl2.6h2O) | 1.2 | 203.3 | 0.244 |
| Fosfato dipotássico (K2HPO4) | 2.4 | 174.2 | 0.418 |
| Fosfato monopotássico (KH2PO4) | 0.4 | 136,1 | 0.054 |
Tabela 2: Composição de basal em buffer solução salina (solução estoque A).
- Prepare as soluções.
- Prepare as quatro soluções estoque necessárias para o protocolo experimental (tabela 1).
- Preparar a solução tamponada basal (solução A; Tabela 2) e a cloreto livre solução tamponada (solução B; Tabela 3) misturando os sais na água pura, à temperatura ambiente. Ajuste o pH para 7,4 (gama 7,0-7,6) usando 1 N NaOH para elevar o pH, 1 N HCl para pH inferior. Verifique a osmolaridade da solução (275 mOsm/L).
- Armazene em garrafas de vidro rotulado a 4 ° C por até 3 meses ou congelados em garrafas de plástico por até 6 meses.
- Prepare a solução de amilorida 10-2 M (solução C) adicionando 26,6 mg de cloridrato de amilorida a 10 mL de água pura. Aquecer a mistura durante 5 a 10 minutos a 70 ° C. Como amilorida é sensível à luz, manter a solução C em um recipiente escuro. Rotular o recipiente e armazenar em 4 ° C por até 3 meses.
- Prepare a solução de forskolina 10-3 M (solução estoque D) pela adição de 10 mg de forskolina 24,36 ml de água pura. Rotular a alíquotas de 0,1 mL da solução-mãe forskolin e armazenar a-20 ° C por até 6 meses.
- Prepare as quatro soluções estoque necessárias para o protocolo experimental (tabela 1).
- Preparar soluções novas, A1, B1 e B2 (tabela 4).
- Preparar a solução fresca A1 (solução salina tamponada basal além de 10-4 M amilorida) obtendo 10 mL da solução de sal basal (solução estoque A) e adicionar 0,1 mL de solução de amilorida 10-2 M (solução C). Rotular o recipiente e usar dentro de 24 horas de preparação.
- Preparar a solução fresca B1 (cloreto de tampão solução além de 10-4 M amilorida) obtendo 10 mL de solução salina tamponada cloreto livre (solução B) e adicionar 0,1 mL de solução de amilorida 10-2 M (solução C). Rotular o recipiente e usar dentro de 24 horas de preparação.
- Preparar a solução fresca B2 (solução salina tamponada cloreto livre além de 10-4 M amilorida e 10-5 M forskolina) obtendo 10 mL de solução salina tamponada cloreto livre (solução B) e adição de 0,1 mL de 10-2 M solução de amilorida (solução C) e 0,1 mL de solução de forskolina 10-3 M (solução estoque D). Rotular o recipiente e usar dentro de 2 horas de preparação.
| Sal | mM | Peso molecular | g/L |
| Gluconato de sódio (sal monossódico) | 135 | 218,1 | 29.444 |
| Gluconato de cálcio (pó anidro) | 2.2 | 430.4 | 0,947 |
| Sulfato de magnésio hepta-hidratado (MgCl2.6h2O) | 1.2 | 246.5 | 0,296 |
| Fosfato dipotássico (K2HPO4) | 2.4 | 174.2 | 0.418 |
| Fosfato monopotássico (KH2PO4) | 0.4 | 136,1 | 0.054 |
Tabela 3: Composição de cloreto livre solução (solução B) tampão.

Figura 2 : Posição do mouse durante a perfusão da mucosa nasal. A figura ilustra a almofada de aquecimento (a), o voltímetro (b), o eletrodo de referência inserido no espaço subcutâneo em um membro posterior (c), o proximal (d) e a distal (e) da bomba peristáltica, o travesseiro (f), e a cama da folha (g). Clique aqui para ver uma versão maior desta figura.
2. avaliação e gestão durante o teste
- Prepare a instalação experimental.
- Para evitar a hipotermia durante e após o teste, use duas almofadas de aquecimento, mantidas em temperaturas fisiológicas, um para a instalação de medição (18,8 x 37.5 cm; Figura 2 um) e o outro (15,5 x 15,5 cm) para a caixa em que o animal será colocado para recuperação no final do teste.
- Ligue o computador carregado com o software de captura de dados conectado a impedância de entrada alta com memória de dados (> 1012Ω) e alta resolução (0.1 mV) voltímetro (Figura 2b).
- Conecte os eletrodos para o voltímetro. Conecte o eletrodo positivo de medição para o cateter nasal e o eletrodo de referência negativa ao cateter inserido no espaço subcutâneo em um membro posterior, conforme mostrado na Figura 2c.
- Mergulhe as pontas dos eletrodos juntos no mix creme. Verifique o valor de deslocamento inicial do eletrodo. Rejeitar os eletrodos se o valor for maior que (±) 2 mV (idealmente 0 mV).
- Ligue a bomba peristáltica e introduza o tubo de bomba na posição, conforme ilustrado na Figura 2.
- Conecte a saída de proximal do tubo da bomba para o frasco contendo a solução selecionada por perfusão nasal (Figura 2d). Conecte a saída de distal do tubo da bomba ao lúmen do cateter nasal (Figura 2e) de perfusão.
- Preencha um lúmen do cateter nasal com a mistura de creme de eletrólito através de uma ponta de pipeta de 10 µ l. Adaptar o cateter a um conector de tubo de silicone (Figura 1e), preencher o conector com a mistura de creme e inserir o eletrodo positivo no conector (Figura 1f). Verifique o valor de deslocamento de ponte medição eletrodo. Rejeitar as pontes, se o valor for maior que (±) 2 mV (idealmente 0 mV).
- Encha o segundo lúmen do cateter nasal com a solução fresca A1. Mergulhe a ponta do cateter nasal no frasco contendo solução r. inverter a direção da bomba peristáltica para preencher um comprimento do cateter nasal correspondente a 10 s de perfusão.
Nota: Isto permite gravar valores basais de PD para 10 s antes de aplicar a amilorida. Mergulhe a ponta do cateter nasal no mix creme dentro do conector do eléctrodo de referência (Figura 1).
- Começa a lidar com o mouse.
- Registro do peso do mouse para calcular a dose exata de anestésicos a ser injetada por via intraperitoneal (ip)17.
- Usando uma agulha 26G (0.45 x 10 mm), injetar pré-medicação intraperitonealmente para promover a indução da anestesia: uma dose fixa de 50 µ l de midazolam 5mg/mL. Espere por 5 min.
- Preparar a mistura anestésica (fentanil, medetomidina, droperidol em concentrações finais de 0.05 0.40 e 20 mg/kg peso corporal respectivamente e Clonidina na dose fixa de 0,375 µ g) permitindo profundidade ideal e estável da anestesia (estágio III, avião 2)17 . Injetar o volume da mistura anestésica intraperitonealmente e em seguida, injetar o volume de Clonidina.
Nota: Depois de 15 min, o mouse deve estar dormindo e a anestesia pode durar pelo menos 30 min. - Dobre uma folha de tecido para fazer um 3 cm Largura 'almofada' (Figura 2f) que irá cobrir a parte superior da almofada do aquecimento (Figura 2um) como apoio para a cabeça de rato de absorção.
- Cobrir a compressa com uma folha de absorver o tecido ('lençol'; Figura 2 g). colocar o mouse sobre as costas da almofada de aquecimento. Fita para fora os membros e a cauda (Figura 2).
- Inserir o cateter intravenoso de referência (Figura 1g) no espaço subcutâneo de um membro posterior. Retire a agulha e adaptar o conector do tubo de silicone (Figura 1e, 2C).
- Encha o cateter e o conector com creme misturar e inserir o elétrodo negativo do conector (Figura 1f).
- Fixe o cateter e o eletrodo com fita conforme o necessário para impedir qualquer deslocamento. Após a colocação do eletrodo de referência e pontes, verifique se o valor de deslocamento de ponte medição eletrodo novamente mergulhando a ponta do cateter nasal no mix creme eletrodo dentro do conector do cateter IV. Registre o valor de deslocamento final estável (idealmente menos (±) 2 mV).
- Ajeite o mouse orelhas com fita "suave" na plataforma de aquecimento em um espaço livre entre as duas peças do absorvente de tecido ('almofada' (Figura 2f) e 'lençol'; (Figura 2g)). Corrigi o vibrissae (os pelos rígidos crescendo perto das narinas) sem tocar os olhos.
- Para absorver o líquido da cavidade oral, mover a língua para os lados (Figura 3uma) e insira um pavio aguçado de papel de filtro (o ' pipe'; Figura 3 b) cerca de 1 cm na boca. Para absorver fluido esgotar a narina perfundida, coloque um segundo pedaço de papel de filtro (o ' lenço'; Figura 3 c) realizada na ponta do nariz.
- Verificar um valor de controle positivo do potencial epitelial, colocando a ponta do cateter nasal, em contacto com o interior da boca.
Nota: A leitura deve ser estável e intervalo entre -10 mV e -20 mV. - Segurando-o com a pinça fina e sob boa iluminação direta, delicadamente Introduza o cateter nasal em uma das narinas até 4 - 6 mm do nariz de ponta.
Nota: O cateter nasal de PD situa-se na concha nasal média na posição que dá a linha de base estável máxima PD valor17,20. - 5 min após a injeção de drogas anestésicas, inclinar suavemente a bolsa de água quente por cerca de 30° com a cabeça do animal para baixo. Monitore o máximo valor basal do PD.
- Quando é estável durante um período de cerca de 30 s, iniciar perfusing a mucosa nasal, a uma taxa constante de 10 µ l / min, com as 4 soluções tamponadas (A, A1, B1, B2) em sucessão. Perfundir a primeira solução (etapa 1.3.1.1) por 10 s e cada solução seguinte (etapa 1.4) por 5 min ou até que se chegou a um valor estável. Pare perfusing forskolin (B2) quando a resposta transiente forskolin começa a descer.
- Selecione um 1 intervalo de s para gravação de dados. Inicie a gravação de dados no momento do início da perfusão. Exibir dados em função do tempo na tela do computador.
- Captura de dados parar ao final da perfusão com solução de B2. Salve os dados como um arquivo de planilha.
- Dados corretos, subtraindo o valor de deslocamento final.

Figura 3 : Posição do mouse sobre a almofada de aquecimento com o cateter nasal e os papéis de filtro no local. A figura ilustra a língua colocar lateral (a), a tubulação (b) e o lenço (c). Clique aqui para ver uma versão maior desta figura.
3. pós-teste de avaliação e gestão
- Solte o mouse do aquecimento pad.
- Limpar o nariz do mouse com o 'lençol' (Figura 2g).
- Injete intraperitonealmente mistura anestésica antagonista composta por uma dose fixa (4 µ g) de naloxona, um antagonista competitivo morfina e atipamezole, um antídoto específico medetomidina (2 mg/kg de peso corporal).
- Coloque o mouse sobre a almofada de aquecimento menor na caixa de recuperação até a recuperação completa, que normalmente é observada após 1 a 2 h.
Nota: O laboratório UCL, cerca de 10% mortalidade, principalmente relacionada à bronchoaspiration de soluções perfundido na cavidade nasal durante o teste, observa-se independentemente do gênero ou genótipo.
Resultados
A fim de ilustrar as anomalias de transporte do íon característico em CF, foram realizadas medidas de PD nasais seguindo o protocolo descrito acima em um rato F508del-CF e um controle do tipo selvagem do fundo genético FVB/129 da colônia de Bruxelas CFTRtm1Eur ratos30. Este modelo clinicamente relevante, abrigando um dos mais graves F508del-CFTR mutação23,24,25e o mais comum é o melhor disponível atualmente CF do mouse modelo30,31, 32.
Traçados de PD nasais representativos, obtidos em um rato fêmea 4 meses de idade homozigoto para a mutação F508del-CF e em um littermate do selvagem-tipo combinado por idade e sexo, são mostrados na Figura 4. Durante as duas primeiras fases do teste, o estado funcional do ENaC foi estudado por perfusing soluções A e A1, a último contendo amilorida. O estado funcional do CFTR (e de transportadores alternativos cloreto na ausência de forskolina) foi avaliado durante as duas últimas fases do teste, quando a contribuição da ENaC permaneceu bloqueada pelo amilorida.
No mouse F508del-CF, observaram-se um valor de base hyperpolarized (um PDmax mais negativo comparado ao valor do selvagem-tipo rato) juntamente com uma resposta aumentada amilorida; ambos os achados refletem a hiperatividade associada a CFTR ENaC. De forma mais consistente, uma repolarização drasticamente reduzida em resposta a ambos um gradiente electroquímico favorável ao efluxo de cloreto e adição de forskolin, aqui denominado como total de cloreto de resposta, foi observado. Apesar da magnitude da resposta forskolin nos ratos do selvagem-tipo é pequena (-3 mV), em CF, a resposta é geralmente arredondada, consistente com a perda CFTR-de-função.
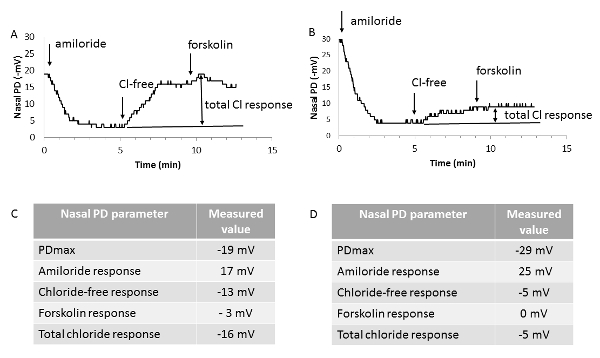
Figura 4 -Representante nasais traçados de PD. Representante nasais traçados de PD de um rato normal homozigoto (A) e um rato homozigoto para a mutação CFTR-F508del (B), juntamente com os valores individuais obtidos para os parâmetros de PD nasais (C e D). PDmax: valor estável máxima da linha de base. Amilorida resposta: diferença entre os valores de PD nasal no final e no início da perfusão da mucosa nasal com basal em buffer solução salina contendo amilorida (solução A1). Livre de cloreto de resposta: diferença entre os valores de PD nasal no final e no início da perfusão da mucosa nasal com cloreto livre em buffer solução salina mais amilorida (solução B1). Forskolin resposta: diferença entre os valores de PD nasal no final e no início da perfusão da mucosa nasal com cloreto livre em buffer solução sal plus forskolin e amilorida (solução B2). Resposta de cloreto total: soma dos dois últimos parâmetros obtidos sob zero-cloreto de perfusão. As setas indicam alterações de soluções perfundidas na narina. Clique aqui para ver uma versão maior desta figura.
Antídotos dos anestésicos foram aplicados ao final dos testes, reduzindo assim a duração da anestesia, que pode ser de até 45 min. além da conclusão do teste. Como a recuperação dos animais ocorreu sem sequelas, eles foram testados novamente após um intervalo de sete dias, quando o mesmo protocolo foi aplicado. A mesma narina foi explorada durante ambos os testes. Exemplos do segundo teste e diferenças pareadas de cada parâmetro de PD nasal individual entre os dois testes são mostradas na Figura 5. Como relatado anteriormente,35, as diferenças entre teste foram perto de zero, em particular para resposta de cloreto total, reflectindo o estado funcional de transporte de cloreto CFTR-dependente, defeituoso no CF.

Figura 5 -Valores individuais dos parâmetros nasais do PD. Valores foram obtidos em um segundo teste (t2), realizado em um rato normal homozigoto (A) e um rato homozigoto da mutação CFTR-F508del (B), juntamente com as diferenças pareadas entre o segundo e o primeiro teste (t1) para cada parâmetro correspondente. PDmax: valor estável máxima da linha de base. Amilorida resposta: diferença entre os valores de PD nasal no final e no início da perfusão da mucosa nasal com a basal em buffer solução salina contendo amilorida (solução A1). Livre de cloreto de resposta: diferença entre os valores de PD nasal no final e no início da perfusão da mucosa nasal com o cloreto livre em buffer e solução salina mais amilorida (solução B1). Forskolin resposta: diferença de valores do PD nasal no final e no início da perfusão da mucosa nasal com o cloreto livre em buffer solução sal plus forskolin e amilorida (solução B2). Resposta de cloreto total: soma dos dois últimos parâmetros obtidos sob zero-cloreto de perfusão. Clique aqui para ver uma versão maior desta figura.
| Rótulo de solução | Descrição da solução |
| A1 | Basal em buffer solução de sal (A) e mais de 10-4 M amilorida |
| B1 | Livre de cloreto de tampão solução salina (B) e mais de 10-4 M amilorida |
| B2 | Livre de cloreto de tampão solução salina (B) Além de 10-4 M amilorida mais de 10-5 M forskolina |
Tabela 4: Lista das novas soluções para o teste de PD nasal em ratos.
Discussão
O objetivo deste trabalho é descrever um protocolo adequado para medição PD nasal sob perfusão contínua de soluções em espontaneamente ratos de respirar por um período de tempo necessário para testar a integridade dos transportadores de íons, principalmente CFTR e ENaC. Todas as etapas do protocolo foram cuidadosamente otimizadas para garantir a recuperação completa de animais e de boa qualidade e de dados podem ser reproduzidos. Em particulares, a críticos passos são avaliação de anestesia e de gestão e posição adequada de animais e cuidados durante e após o teste.
Estudos anteriores mostraram que o avião 2 estágio III de exposição anestésica, que pode ser conseguida aplicando a mistura cocktail aqui utilizado17, está associado com a respiração regular e com ausência de efeito inotrópico negativo e de blink, da pupila e pedal reflexos de retirada. A este nível de profundidade anestésica, o cateter nasal pode ser mantido em situ para perfusão contínua da cavidade nasal e para uso como uma ponte do eléctrodo de medição com boa tolerância. Também, a inserção do cateter no espaço subcutâneo, servindo como ponte do eletrodo de referência, não foi seguida por qualquer reação dolorosa ou sinal de efeito nocivo. Em roedores, o papel essencial da entrada sensorial da região nasofacial no controle do comportamento vis-à-vis uma situação externa, incluindo uma ameaça, faz adequada profundidade da anestesia, particularmente desafiador quando operando na cavidade nasal. Nebulização em vez de perfusão nasal contínua tem sido aplicada para executar o teste de PD nasal em alguns estudos de rato33,34. No entanto, esse método leva a resultados não-confiáveis, devido a repetidas remoções e reinsertions da sonda nasal. Por uma questão de fato, devido à distribuição não homogênea de tipos de células no rato mucosa nasal20, reposicionando a ponta da sonda no mesmo local na narina é crítico. Além disso, respostas às mudanças de soluções, soluções de cloreto livre em particular, rapidamente desaparecem quando a perfusão é interrompida.
Broncho-aspiração de soluções, levando a parada respiratória é uma limitação crítica do processo e é a principal causa de mortalidade do teste. Várias medidas essenciais visam a prevenção, incluindo uma posição de decúbito dorsal do animal, levemente inclinando-a de cabeça para baixo e absorvendo o excesso de líquido de cavidades oral e nasal17. Um nível rápido e reversível da anestesia, com recuperação completa dos animais é assegurado através da aplicação de antídotos das drogas anestésicas no final do teste. O protocolo aqui apresentado permite medições correctas em espontaneamente ratos a respirar e repetir o teste no mesmo animal. Os impactos sobre o número de ratos, necessários para obter significância estatística35 e conformes com a 3R (substituir, refinar e reduzir) regras para o animal usam em procedimentos experimentais36. Em humanos como em ratos, a menor variabilidade entre-teste foi encontrada para resposta de cloreto total, sugerindo que ele como o parâmetro de PD nasal mais confiável para detectar a eficácia de novas estratégias terapêuticas de CF. Em camundongos CF, o erro de medição da resposta cloreto total foi mostrado para ser menor do que ±1.7 mV35. Em outras palavras, quando avaliando a bioatividade de um CFTR-corrigindo droga em camundongos F508del-CF, a diferença entre a resposta de cloreto total na ausência e na presença de tratamento maior do que 2 mV indica 95% de probabilidade de um efeito de melhoria relacionados com a droga.
Interpretação de dados de traçados representativos ilustra a capacidade do teste de PD nasal para discriminar entre CF e ratos do selvagem-tipo18,19,20,21,35 e mostra que o modelo de rato Erasmus F508del-CF30 imita a mucosa nasal humana em relação as anormalidades de transporte do íon clínico típico. No entanto, no modelo animal, uma condutância de cloreto residual é detectável, resultante de uma função F508del-CFTR residual ou de uma contribuição de canais alternativos de cloreto CFTR não-dependentes. Traduzir os resultados da pesquisa de CF de pré-clínicos em ajustes clínicos implica lidar com vários grandes diferenças entre as duas configurações. O fenótipo de CF do mouse exibe uma síndrome respiratória atenuada. A ausência de várias terapias em conjunto com o fato de que o modelo do rato está alojado em condições privilegiadas com barreiras sanitárias também contribuem para as diferenças de37. O protocolo descrito aqui mostra uma variabilidade muito baixa35 e foi adaptada para o porco38,39 e o furão modelos40. Em um estudo anterior, o protocolo experimental foi modificado, incluindo a perfusão da mucosa nasal de rato com um inibidor de transportadores alternativos de cloreto, para explorar a possível contribuição de cloreto de cálcio-ativado não CFTR-dependentes canais18. O teste também tem sido usado para estudar o transporte de sódio no β-ENaC overexpressing rato modelo41, projetado para imitar a doença de pulmão CF42. No futuro, ainda mais aplicações do teste podem ser consideradas para estudar outros transportadores, tais como o ATP12A, um independente CFTR H+-bomba de proteína expressada em humanos e em porco, mas ausente no rato airways43. No total, o protocolo descrito aqui permite medições correctas do estatuto funcional do transepitelial transportadores de cloreto e sódio em respirar espontaneamente ratos, reduzida mortalidade relacionados ao teste e vários testes no mesmo animal.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores Agradecemos a Prof J. Lebacq edição criticamente o manuscrito. CFTRtm1Eur (homozigotos ratos F508del-CFTR (FVB/129) foram desenvolvidos por Erasmus MC, Rotterdam, Países Baixos, com o apoio da Comunidade Económica Europeia acção de Coordenação Europeia para a investigação no 6º PQ UE de fibrose cística LHHM-CT-2005-018932.
Materiais
| Name | Company | Catalog Number | Comments |
| Portex polyethylene tube | Smiths Medical, Hythe, Kent, England CT21 6JL | Portex 800/100/500;2.0mm ID, 3.0 mmOD | to prepare capillary tubes for nasal probe |
| Electrode cream | Parker, Fairfield, NJ, USA | Redux cream | to build electrode bridges |
| Ag/AgCl electrodes | Biomedical, Clinton Township, MI, USA | JNS BNT131-1,0 | measuring and reference electrodes |
| amiloride hydrochloride | Sigma, St Louis, MI, USA | A7410 | to prepare perfusion solutions |
| forskolin | Sigma, St Louis, MI, USA | F6886 | to prepare perfusion solutions |
| Knick Portamess voltmeter | Elektronisch Meβgeräte, Berlin, Germany | Portavo 904 pH | to measure potential difference |
| Paraly SW 112 Software | Elektronisch Meβgeräte, Berlin, Germany | Paraly SW112 software | to capture potential difference data |
| midazolam | Mylan, Hoeilaart, Belgium | Dormicum 15mg/3ml | to serve as anaesthetic premedication |
| fentanyl | Janssen Cilag, Berchem, Belgium | Fentanyl-Janssen 0.05 mg/ml | to serve as anaesthetic medication |
| medetomidine | Orion Pharma, Espoo, Finland | Domitor 1 mg/ml | to serve as anaesthetic medication |
| droperidol | Janssen Cilag, Berchem, Belgium | Dehydrobenzperidol 2.5 mg/ml | to serve as anaesthetic medication |
| clonidine | Boehringer Ingelheim Pharma KG, Ingelheim am Rhein, Germany | Catapressan 0.15 mg/ml, | to serve as anaesthetic medication |
| refernce IV catheter | Becton Dickinson, Sandy, UT, USA | 24 GA x 0.75 IN, BD Insyte-W | to build electrode bridges |
| forceps | Fine science Tools, Heidelberg, Germany | Dumont #5, Fine science Tools | to place the nasal catheter |
| naloxone | Braun Medical, Brussels, Belgium | Narcan, 0.4 mg/ml | to serve as anaesthetic antagonist |
| atipamezole | Zoetis, Bloomberg, Belgium | Antisedan, 5 mg/ml | to serve as a medetomedine specific antidote |
| Heating pads | Harvard Apparatus, Holliston, MA, USA | 18,8x37,5 cm; 15,5x15,5 cm | to avoid hypothermia during and after the test |
| Peristaltic pump P1 | GE Life Sciences, Uppsala, Sweden | 18111091 | to perfuse solutions in the mouse nose |
| cyanoacrylate glue | Loctite, Henkel, Düsseldorf, Germany | super glue 3 | to glue together two capillary tubes for nasal probe |
| NaCl | Sigma, St Louis, MI, USA | RES0926S-A7 | Pharma-Grade, USP |
| CaCl2.2H2O | Sigma, St Louis, MI, USA | M7304 | Pharma-Grade, USP |
| MgCl2.6H2O | Sigma, St Louis, MI, USA | 1551128 | Pharma-Grade, USP |
| K2HPO4 | Sigma, St Louis, MI, USA | 1551139 | Pharma-Grade, USP |
| Na gluconate | Sigma, St Louis, MI, USA | S2054 | Pharma-Grade, USP |
| Ca gluconate | Sigma, St Louis, MI, USA | C8231 | Pharma-Grade, USP |
| MgSO4.7H2O | Sigma, St Louis, MI, USA | RES0089M-A7 | Pharma-Grade, USP |
| BD needle | Becton Dickinson, Franklin Lakes, USA | BD 26G (0.45x10 mm) | intraperitoneal injection |
Referências
- Knowles, M., Gatzy, J., Boucher, R. Increased bioelectric potential difference across respiratory epithelia in cystic fibrosis. New England Journal of Medicine. 305 (25), 1489-1495 (1981).
- Middleton, P. G., Geddes, D. M., Alton, E. F. W. Protocols for in vivo measurement of the ion transport defects in cystic fibrosis nasal epithelium. European Respiratory Journal. 7 (11), 2050-2056 (1994).
- Knowles, M. R., Paradiso, A. M., Boucher, R. C. In vivo nasal potential difference: techniques and protocols for assessing efficacy of gene transfer in cystic fibrosis. Human Gene Therapy. 6 (4), 445-455 (1995).
- Paranjape, S. M., Zeitlin, P. L. Atypical cystic fibrosis and CFTR-related disorders. Clinical Reviews in Allergy & Immunology. 35 (3), 116-123 (2008).
- Wilschanski, M., et al. A pilot study of the effect of gentamicin on nasal potential difference measurements in CF patients carrying stop mutations. American Journal of Respiratory and Critical Care Medicine. 161 (3), 860-865 (2000).
- Clancy, J. P., et al. Evidence that systemic gentamicin suppresses premature stop mutations in patients with CF. American Journal of Respiratory and Critical Care Medicine. 163 (7), 1683-1692 (2001).
- Wilschanski, M., et al. Gentamicin-induced correction of CFTR function in patients with CF and CFTR stop mutations. New England Journal of Medicine. 349 (15), 1433-1441 (2003).
- Sermet-Gaudelus, I., et al. In vitro prediction of stop-codon suppression by intravenous gentamicin in patients with CF: a pilot study. BMC Medicine. 5, 5 (2007).
- Clancy, J. P., et al. No detectable improvements in CF transmembrane conductance regulator by nasal aminoglycosides in patients with CF with stop mutations. American Journal of Respiratory and Cell Molecular Biology. 37 (1), 57-66 (2007).
- Kerem, E., et al. Effectiveness of PTC124 treatment of CF caused by nonsensemutations: a prospective phase II trial. Lancet. 372 (9640), 719-727 (2008).
- Sermet-Gaudelus, I., et al. Ataluren (PTC124) induces CF transmembrane conductance regulator protein expression and activity in children with nonsense mutation CF. American Journal of Respiratory and Critical Care Medicine. 182 (10), 1262-1272 (2010).
- Wilschanski, M., et al. Chronic ataluren (PTC124) treatment of nonsense mutation cystic fibrosis. European Respiratory Journal. 38 (1), 59-69 (2011).
- Accurso, F. J., et al. Effect of VX-770 in persons with CF and the G551D-CFTR mutation. New England Journal of Medicine. 363 (21), 1991-2003 (2010).
- Clancy, J. P., et al. Results of a phase IIa study of VX-809, an investigational CFTR corrector compound, in subjects with cystic fibrosis homozygous for the F508del-CFTR mutation. Thorax. 67 (1), 12-18 (2012).
- Leonard, A., Lebecque, P., Dingemanse, J., Leal, T. A randomized placebo-controlled trial of miglustat in cystic fibrosis based on nasal potential difference. Journal of Cystic Fibrosis. 11 (3), 231-236 (2012).
- De Boeck, K., et al. CFTR biomarkers: time for promotion to surrogate end-point. European Respiratory Journal. 41, 203-216 (2013).
- Leal, T., et al. Successful protocol of anaesthesia for measuring transepithelial nasal potential difference in spontaneously breathing mice. Laboratory Animals. 40 (1), 43-52 (2006).
- Lubamba, B., et al. Preclinical evidence that sildenafil and vardenafil activate chloride transport in cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 177 (5), 506-515 (2008).
- Lubamba, B., et al. Airway delivery of low-dose miglustat normalizes nasal potential difference in F508del cystic fibrosis mice. American Journal of Respiratory and Critical Care Medicine. 179 (11), 1022-1028 (2009).
- Lubamba, B., et al. Inhaled PDE5 inhibitors restore chloride transport in cystic fibrosis mice. European Respiratory Journal. 37 (1), 72-78 (2011).
- Vidovic, D., et al. rAAV-CFTRΔR Rescues the Cystic Fibrosis Phenotype in Human Intestinal Organoids and Cystic Fibrosis Mice. American Journal of Respiratory and Critical Care Medicine. 193 (3), 288-298 (2016).
- Stutts, M. J., et al. CFTR as a cAMP-dependent regulator of sodium channels. Science. 269 (5225), 847-850 (1995).
- Lubamba, B., Dhooghe, B., Noel, S., Leal, T. Cystic fibrosis: insight into CFTR pathophysiology and pharmacotherapy. Clinical Biochemistry. 45 (15), 1132-1144 (2012).
- Kerem, B., et al. Identification of the cystic fibrosis gene: genetic analysis. Science. 245 (4922), 1073-1080 (1989).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA. Science. 245 (4925), 1066-1073 (1989).
- Stutts, M. J., Rossier, B. C., Boucher, R. C. Cystic fibrosis transmembrane conductance regulator inverts protein kinase A-mediated regulation of epithelial sodium channel single channel kinetics. Journal of Biological Chemistry. 272 (22), 14037-14040 (1997).
- Ismailov, I. I., et al. Regulation of epithelial sodium channels by the cystic fibrosis transmembrane conductance regulator. Biological Chemistry. 271 (9), 4725-4732 (1996).
- Althaus, M. ENaC inhibitors and airway re-hydration in cystic fibrosis: state of the art. Current Molecular Pharmacology. 6 (1), 3-12 (2013).
- Wilke, M., et al. Mouse models of cystic fibrosis: phenotypic analysis and research applications. Journal of Cystic Fibrosis. 10, 152-171 (2011).
- Van Doorninck, J. H., et al. A mouse model for the cystic fibrosis delta F508 mutation. The EMBO Journal. 14 (18), 4403-4411 (1995).
- Colledge, W. H., et al. Generation and characterization of a delta F508 cystic fibrosis mouse model. Nature Genetics. 10 (4), 445-452 (1995).
- Zeiher, B. G., et al. A mouse model for the delta F508 allele of cystic fibrosis. Journal of Clinical Investigation. 96 (4), 2051-2064 (1995).
- Ghosal, S., Taylor, C. J., McGray, J. Modification of the nasal membrane potential difference with inhaled amiloride and loperamide in the cystic fibrosis (CF) mouse. Thorax. 51 (12), 1229-1232 (1996).
- Ghosal, S., Taylor, C. J., Colledge, W. H., Ratcliff, R., Evans, M. J. Sodium channel blockers and uridine triphosphate: effects on nasal potential difference in cystic fibrosis mice. European Respiratory Journal. 15 (1), 146-150 (2000).
- Leonard, A., et al. Comparative Variability of Nasal Potential Difference Measurements in Human and Mice. Open Journal of Respiratory Disease. 2, 43-56 (2012).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Rs then and now: the need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Pritchett-Corning, K. R., et al. AALAS/FELASA Working Group on Health Monitoring of rodents for animal transfer. Journal of the American Association for Laboratory Animal Science. 53 (6), 633-640 (2014).
- Salinas, D. B., et al. CFTR involvement in nasal potential differences in mice and pigs studied using a thiazolidinone CFTR inhibitor. American Journal of Physiology. Lung Cell Molecular Physiology. 287 (5), 936-943 (2004).
- Fisher, J. T., et al. Comparative processing and function of human and ferret cystic fibrosis transmembrane conductance regulator. Journal of Biological Chemistry. 287 (26), 21673-21685 (2012).
- Kaza, N., et al. Use of ferrets for electrophysiologic monitoring of ion transport. PLoS One. 12 (10), 0186984 (2017).
- Leal, T., Beka, M., Panin, N., Mall, M. A., Noel, S. Nasal potential difference in βENaC-overexpressing mouse reveals pH-sensitive channel hyperactivity and shift of subunits stoichiometry. Journal of Cystic Fibrosis. 16 (S1), 72 (2017).
- Mall, M., Grubb, B. R., Harkema, J. R., O'Neal, W. K., Boucher, R. C. Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice. Nature Medicine. 10 (5), 487-493 (2004).
- Shah, V. S., et al. Airway acidification initiates host defense abnormalities in cystic fibrosis mice. Science. 351 (6272), 503-507 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados