Method Article
Nasale Potentialdifferenz, Trans-epithelialen Ionentransport bei Mäusen zu quantifizieren
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll zur nasalen Potentialdifferenz bei Mäusen zu messen. Der Test wird die Funktion des transmembranen Ion Transporter wie der Mukoviszidose transmembranen Leitwert Regler und der epithelialen Natrium-Kanal quantifiziert. Es ist wertvoll zur Bewertung der Wirksamkeit neuartiger Therapien für Mukoviszidose.
Zusammenfassung
Die nasale potenzielle Unterschied Test wurde seit fast drei Jahrzehnten zur bei der Diagnose der zystischen Fibrose (CF) zu unterstützen. Es hat sich als hilfreich im Falle von gedämpft, Oligo oder Mono-symptomatischen Formen von CF in der Regel später diagnostiziert, und CF-bedingten Erkrankungen wie kongenitale bilaterale Fehlen der Samenleiter, idiopathischer chronischer Pankreatitis, allergische bronchopulmonale Aspergillose und Bronchiektasen. In klinischen und präklinischen Einstellungen wurde der Test verwendet wie ein Biomarker, Antworten auf gezielte therapeutische Strategien für vgl. Anpassung der Test eine Maus zu quantifizieren anspruchsvoll ist und kann einen damit verbundenen Sterblichkeit zur Folge haben. Dieses Papier beschreibt die ausreichende Tiefe der Narkose erforderlich, um einen nasalen Katheter in Situ für kontinuierliche Perfusion. Es werden Maßnahmen zur Vermeidung von Broncho-Aspiration von Lösungen in der Nase durchströmt. Es beschreibt auch die Pflege der Tiere am Ende des Tests, einschließlich Verwaltung aus einer Kombination von Gegenmittel von Anästhetika, rasch die Rücknahme der Narkose mit vollständige Genesung der Tiere führt. Repräsentative Daten aus einem CF und Wildtyp Maus zeigen, dass der Test zwischen CF und nicht-CF unterscheidet. Insgesamt ermöglicht das Protokoll hier beschriebenen zuverlässige Messungen des funktionellen Status von Trans-epithelialen Chlorid und Natrium-Transporter in spontan atmen Mäuse sowie mehrere Tests im gleichen Tier und gleichzeitig Test-bezogene Mortalität.
Einleitung
Seit fast drei Jahrzehnten wurden elektrischen möglichen Unterschied (PD) Messungen zur funktionellen Status von transmembranen Ionen-Transporter auf der Nasenschleimhaut, als Vertreter des distalen Airways1ausgedrückt zu bewerten. Wie ein mehrstufiger dynamischer test2,3, Nasal PD ermöglicht funktionale Dissektion der Cystic Fibrosis Transmembrane Leitwert Regulator (CFTR) und epitheliale Natrium-Kanal (ENaC) Aktivität, lokalisiert sowohl an der apikalen Membranen der Epithelzellen und kritische Rollen in Oberfläche Hydratation Atemwege ausübt. Die große klinische Anwendung der nasalen PD-Test ist bei der Diagnose von CF, die häufigste tödliche genetische Störung in den kaukasischen Bevölkerungen mit einer durchschnittlichen Inzidenz der 1 von 2.500 Lebendgeburten in europäischen Ländern zu unterstützen. Der Test hat lange hilfreich bei der Diagnose von abgeschwächten, Oligo oder Mono-symptomatischen Formen von CF in der Regel später diagnostiziert, und CF-bedingten Erkrankungen wie kongenitale bilaterale Fehlen der Samenleiter, idiopathischer chronischer Pankreatitis, allergische bewiesen. bronchopulmonale Aspergillose und Bronchiektasen4. In jüngerer Zeit, clinometric Bewertung der therapeutischen Modulation der grundlegenden CFTR defekt5,6,7,8,9,10,11 ,12,13,14,15,16 der nasalen PD in klinischen Studien mit neuen CF-Therapien Gebrauch gemacht hat. In der präklinischen Einstellung wurde der Test die Maus17 Untersuchung des die Bioaktivität der neuen CF Target Therapien18,19,20,21zuzulassen angepasst. Bei Mäusen ist die Technik zarte, basierend auf Art verwandt anatomische Unterschiede in der Größe der nasalen Region zwischen Nagern und Menschen, und vor allem auf die wesentliche Rolle der Sinneseindrücke aus der Nasofacial Region bei Nagetieren. Es erfordert ausgebildete und qualifizierte Betreiber, spezielle Ausrüstungen und Zubehör.
CF ist eine Multi-systemische Erkrankung therapeutisches Drüsen, in denen chronische Erkrankung der Atemwege das klinische Bild dominiert. Die Krankheit wird verursacht durch Mutationen im Gen Kodierung der zyklischen Adenosin Monophosphate (cAMP)-CFTR-Chlorid-Kanal22geregelt. Bis heute wurden mehr als 2.000 CFTR-Mutationen identifiziert23. Die häufigste Mutation24,25, gefunden in fast 90 % der CF-Allele, entspricht eine Deletion von Phenylalanin in Position 508 der Polypeptidkette des Proteins (F508del-CFTR). Das CFTR-Protein ist ein rein ohmschen kleiner Leitwert-Chlorid-Kanal. Außerdem gibt es beträchtlichen Beweis, dass CFTR andere Transportmechanismen, insbesondere ENaC26,27regelt. Defekten Elektrolyt Transport, einschließlich reduzierter CFTR-abhängigen Chlorid Leitwert und erhöhte ENaC-abhängige Natrium Leitwert, ist ein Markenzeichen von CF Epithelien. Der ehemalige defekt spiegelt sich ein reduziert oder abgeschafft Repolarisation als Reaktion auf einen elektrochemischen Gradienten bevorzugen Chlorid Ausfluss und Zugabe von Isoprenalin (einen β-adrenerge Agonisten, die intrazellulären cAMP erhöht) oder Forskolin (eine Adenylat Cyclase-Agonist, nicht für den klinischen Einsatz zugelassen). Der letztere defekt spiegelt sich eine basale Hyperpolarisation der Nasenschleimhaut (ein negativer PD) und eine erhöhte Reaktion auf Amilorid, ein Diuretikum, das ENaC28blockiert.
CF-Maus-Modellen in CF Forschung häufig verwendet worden und wurden bei CF Pathologie sezieren von unschätzbarem Wert. Heute wurden mindestens fünfzehn Modellen beschriebenen29, drei davon homozygot für die klinisch relevanten F508del Mutation30,31,32 sind. Eines dieser drei Sorten30, entwickelt an der Erasmus Universität in Rotterdam, hat seit fast 20 Jahren in der Université Catholique de Louvain (UCL) Labor eingesetzt. Die Cftrtm1Eur Modell30 hat erwies sich als sehr nützlich, die Gewebehypoxie Pathophysiologie der CF-Krankheit zu studieren und testen Sie die Wirksamkeit von neuen therapeutischen Strategien18,19,20, 21. Zahlreiche Probleme können auftreten, während oder nach der frühen (< 24 h) der nasalen PD-Test an Mäusen. In diesem Papier die ausreichende Tiefe der Narkose, Broncho-Aspiration von Lösungen in der Nase durchströmt zu vermeiden halten einen nasalen Katheter in Situ für kontinuierliche Perfusion und Maßnahmen gefordert werden beschrieben. Die Pflege der Tiere am Ende des Tests ist auch beschrieben, einschließlich der Verwaltung aus einer Kombination von Gegenmittel von Anästhetika, rasch die Rücknahme der Narkose mit vollständige Genesung der Tiere führt. Insgesamt können diese Verfahren zuverlässige Messungen in spontan atmen Mäuse, reduzierte Test-Mortalität und Wiederholung des Tests in das gleiche Tier. Repräsentative Daten aus der nasalen PD-Test in eine CF und Wildtyp Maus werden gezeigt und diskutiert.
Das murine nasale PD Testprotokoll wird in drei Sitzungen berichtet: Bewertung und das Management vor, während und nach dem Test. In der Pre-Test-Bewertung und Management wird das Protokoll der Vorbereitung des doppelten Lumen nasale Katheters und Lösungen für kontinuierliche nasale Perfusion verwendet ausführlich beschrieben. Bei der Bewertung und Management Teile des Tests der experimentelle Aufbau und die Handhabung der Maus minutiös seziert. Schließlich ist Management des Tieres am Ende des Tests beschrieben, um die vollständige Tier Erholung zu verbessern.
Protokoll
Die Untersuchungen und Verfahren wurden von der Ethikkommission für Tierversuche des UCL (2017/UCL/MD/015) und im Einvernehmen mit der Gesetze der Europäischen Union für Tierversuche in der Forschung (CEE n ° 86/609) genehmigt. Die Ermittler sind für die Tierversuche, die nach der Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere geeignet.
(1) vor dem test Bewertung und das Management
- Bereiten Sie die doppelte Lumen nasale Katheter.
Hinweis: Ein nasale Katheter erfolgt als eine doppelte Lumen Kapillarrohr, ein Lumen für die kontinuierliche Perfusion von Lösungen, und das andere als eine Mess-Kanal.- Erwärmen der Mittelteil aus einem Stück, ca. 20 cm lang, Polyethylenschlauch (2,0 mm Innendurchmesser; 3,0 mm Außendurchmesser; Abbildung 1 ein) in der Flamme eines Gasbrenners, bis es weich genug zum ziehen (10-15 s) ist.
- Ziehen Sie die zwei Enden auseinander, um einen sehr dünnen Kapillarrohr von entsprechender Länge (~ 15 cm) und Außendurchmesser (~0.1 mm) für die nasale Sonde (Abbildung 1b) zu erhalten.
- Reinigen Sie und Entfetten Sie zwei solche Kapillaren mit reinem Ethanol, begleiten Sie sie mit Klebeband (Abbildung 1c) und kleben Sie sie zusammen mit Cyanacrylat-Klebstoff.
- Schneiden Sie die überschüssige Länge der Sonden mit einer Rasierklinge oder einem Skalpell, eine optimale Länge der Doppel-Lumen Katheter von ca. 8 cm (Abbildung 1-d) zu erhalten.
- Spritzen Sie Wasser durch beide Lumen um sicherzustellen, dass sie durchlässig sind.
- Anwenden einer Markus in einem Abstand von 5 mm von der Spitze.
Hinweis: Die Sonde ist bis zur Markierung in das Nasenloch eingelassen, so dass alle Messungen an der gleichen Stelle innerhalb der Nasenhöhle gemacht werden. - Die Doppel-Lumen Katheter in eine trockene Box aufbewahren.
Hinweis: Es kann gebrauchte 6 - 10 Mal, wenn unmittelbar nach der Prüfung entsprechend gereinigt.
- Bereiten Sie die Creme mischen.
- Mischen Sie vorsichtig Elektrolyt Creme und gesättigten 3 M KCl-Lösung im Verhältnis 1:1 (Volumen/Volumen), Bildung von Luftbläschen zu vermeiden.
Hinweis: Die Creme Mischung dient der Elektrode für die Mess- und die Ag/AgCl Elektroden, Brücken zu schlagen wie in Abbildung 1dargestellt.
- Mischen Sie vorsichtig Elektrolyt Creme und gesättigten 3 M KCl-Lösung im Verhältnis 1:1 (Volumen/Volumen), Bildung von Luftbläschen zu vermeiden.

Abbildung 1 : Sonden mit Elektroden und Brücken. Die Abbildung veranschaulicht die Polyethylenschlauch vor (a) und nach Erhitzen und ziehen (b), das Band Beitritt der Kapillare zweiteilig (c) von der Doppel-Lumen Katheter (d), Silikon-Rohrverbinder (e) und der Elektroden (f). Für Bildschärfe sind die Anschlüsse nicht mit Creme Mischung gefüllt worden. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Lösung-Label | Lösungsbeschreibung |
| A | Basalen gepufferte Salzlösung |
| B | Chlorid-freie gepufferte Salzlösung |
| C | 10-2 M Amilorid Stammlösung |
| D | Forskolin-Stammlösung 10-3 M |
Tabelle 1: Lager-Lösung für den nasalen PD-Test an Mäusen.
| Salz | mM | Molekulargewicht | g/L |
| Natriumchlorid (NaCl) | 135 | 58.44 | 7.889 |
| Calciumchlorid Dihydrat (CaCl2.2H2O) | 2.25 | 147 | 0,331 |
| Magnesium-Chlorid-Hexahydrat (MgCl2.6H2O) | 1.2 | 203.3 | 0.244 |
| Dipotassium Phosphat (K2HPO4) | 2.4 | 174,2 | 0.418 |
| Monopotassium Phosphat (KH2PO4) | 0,4 | 136,1 | 0.054 |
Tabelle 2: Zusammensetzung der basalen gepufferte Salzlösung (Stammlösung).
- Bereiten Sie die Lösungen.
- Bereiten Sie die vier Lager Lösungen für experimentelles Protokoll (Tabelle 1).
- Bereiten Sie die basalen gepufferte Lösung (Stammlösung A; Tabelle 2) und frei von Chlorid gepufferten Lösung (Stammlösung B; Tabelle 3) durch das Mischen der Salze in reinem Wasser bei Raumtemperatur. Stellen Sie pH auf 7,4 (Bereich 7,0-7,6) mit 1 N NaOH, um pH-Wert, 1 N HCl zu niedrigeren pH-Wert zu erhöhen. Überprüfen Sie die Osmolarität der Lösung (275 mOsm/L).
- Speichern Sie in beschrifteten Glasflaschen bei 4 ° C für bis zu 3 Monaten oder gefroren in Kunststoff-Flaschen für bis zu 6 Monaten.
- Bereiten Sie die 10-2 M Amilorid Lösung (Stammlösung C) durch das Hinzufügen von 26,6 mg Amilorid Hydrochlorid 10 ml reines Wasser. Erhitzen Sie die Mischung für 5 bis 10 Minuten bei 70 ° C. Wie Amilorid lichtempfindlich ist, aufzubewahren Sie Lösung C ist in einem dunklen Behälter. Beschriften Sie die Behälter und bei 4 ° C bis zu 3 Monate lagern.
- Bereiten Sie die 10-3 M Forskolin Lösung (Stammlösung D) indem Sie 10 mg von Forskolin 24,36 mL reines Wasser hinzufügen. Beschriften Sie 0,1 mL Aliquots der Vorratslösung von Forskolin und bei-20 ° C bis zu 6 Monate zu speichern.
- Bereiten Sie die vier Lager Lösungen für experimentelles Protokoll (Tabelle 1).
- Bereiten Sie frische Lösungen A1, B1 und B2 (Tabelle 4).
- Bereiten Sie frische Lösung A1 (basale gepufferte Salzlösung plus 10-4 M Amilorid) 10 mL der basalen Salzlösung (Stammlösung) und 0,1 mL 10-2 M Amilorid Lösung (Stammlösung C) hinzufügen. Beschriften Sie die Behälter und innerhalb von 24 Stunden nach der Zubereitung zu verwenden.
- Bereiten Sie frische Lösung B1 (Chlorid gepufferte Lösung plus 10-4 M Amilorid) 10 mL Chlorid-freie gepufferte Salzlösung (Stammlösung B) und 0,1 mL 10-2 M Amilorid Lösung (Stammlösung C) hinzufügen. Beschriften Sie die Behälter und innerhalb von 24 Stunden der Vorbereitung verwenden.
- Bereiten Sie frische Lösung B2 (Chlorid-freie gepufferte Salzlösung plus 10-4 M Amilorid und 10-5 M Forskolin) 10 mL Chlorid-freie gepufferte Salzlösung (Stammlösung B) und Hinzufügen von 0,1 mL 10-2 M Amilorid Lösung (Lager C) und 0,1 mL 10-3 M Forskolin Lösung (Stammlösung D). Beschriften Sie die Behälter und innerhalb von 2 Stunden der Vorbereitung verwenden.
| Salz | mM | Molekulargewicht | g/L |
| Natrium Gluconat (Mononatrium-Salz) | 135 | 218.1 | 29.444 |
| Kalzium-Glukonat (wasserfreie Pulver) | 2.2 | 430.4 | 0,947 |
| Magnesiumsulfat Heptahydrat (MgCl2.6H2O) | 1.2 | 246,5 | 0.296 |
| Dipotassium Phosphat (K2HPO4) | 2.4 | 174,2 | 0.418 |
| Monopotassium Phosphat (KH2PO4) | 0,4 | 136,1 | 0.054 |
Tabelle 3: Zusammensetzung des Chlorid-freie gepufferte Lösung (Stammlösung B).

Abbildung 2 : Position der Maus während der Durchblutung der Nasenschleimhaut. Die Abbildung zeigt das Akku-Heizkissen (a), das Voltmeter (b), die Bezugselektrode eingefügt in den subkutanen Raum in einer hinteren Gliedmaßen (c), die proximalen (d) und die distalen (e) Outlets der peristaltischen Pumpe, Kissen (f), und das Bett Blatt (g). Bitte klicken Sie hier für eine größere Version dieser Figur.
2. Bewertung und das Management während des Tests
- Bereiten Sie den Versuchsaufbau.
- Zur Vermeidung von Hypothermie während und nach dem Test benutzen Sie zwei Heizkissen gepflegt bei physiologischen Temperaturen, eine für den Messaufbau (18,8 x 37,5 cm; Abbildung 2 ein), und der andere (15,5 x 15,5 cm) für das Feld, in dem das Tier für Erholung am Ende des Tests platziert werden.
- Schalten Sie den Computer mit der Software für die Datenerfassung mit den Daten Speicher hohe Eingangsimpedanz verbunden (> 1012Ω) und hoher Auflösung (0,1 mV) Voltmeter (Abb. 2b).
- Verbinden Sie die Elektroden mit dem Voltmeter. Anschließen Sie die positive Messelektrode an der nasalen Katheter und die negativen Bezugselektrode, den Katheter in den subkutanen Raum in einer hinteren Extremität, wie in Abbildung 2cgezeigt.
- Tauchen Sie die Spitzen der Elektroden in die Sahne-Mischung zusammen. Überprüfen Sie die erste Elektrode-Offset-Wert. Die Elektroden dann ablehnen, wenn der Wert größer als (±) 2 mV ist (im Idealfall 0 mV).
- Peristaltische Pumpe schalten Sie ein und stecken Sie das Pumpenrohr in Position, wie in Abbildung 2dargestellt.
- Schließen Sie proximalen Auslass der Pumpe Schlauch an das Fläschchen mit der gewählten Lösung für nasale Perfusion (Abbildung 2d an). Distale Auslass der Pumpe Schlauch an die Perfusion Lumen der nasalen Katheter (Abb. 2e) anschließen.
- Füllen Sie ein Lumen des Katheters nasale mit Elektrolyt Creme Mischung durch eine 10 µL PIPETTENSPITZE. Anpassen des Katheters an einen Silikon-Rohr-Anschluss (Abbildung 1e), füllen Sie den Connector mit Sahne mischen und legen Sie die positive Elektrode in die Stecker (Abbildung 1-f). Überprüfen Sie die Elektrode Brücke Offset Messwert. Die Brücken ablehnen, wenn der Wert größer als (±) 2 mV ist (im Idealfall 0 mV).
- Füllen Sie das zweite Lumen des Katheters nasale mit der frischen Lösung A1. Tauchen Sie die Spitze des nasalen Katheters in die Fläschchen mit Lösung A. Reverse die Richtung der peristaltischen Pumpe füllen eine Länge von den nasalen Katheter entspricht 10 s der Perfusion.
Hinweis: Dies ermöglicht Aufnahme basale PD-Werte für 10 s vor dem Auftragen Amilorid. Tauchen Sie die Spitze des nasalen Katheters in die Creme Mischung innerhalb der Stecker der Bezugselektrode (Abbildung 1).
- Beginnen Sie mit der Maus.
- Nehmen Sie die Maus Gewicht berechnen die genaue Dosis von Anästhetika durch die intraperitoneale (Ip) Route17injiziert werden.
- Mit Hilfe einer Nadel 26G (0,45 x 10 mm) injizieren Prämedikation intraperitoneal, die Induktion der Anästhesie zu fördern: eine feste Dosis von 50 µL 5 mg/mL Midazolam. 5 min. warten.
- Bereiten Sie die Narkose Mischung (Fentanyl, Medetomidine, Droperidol bei Endkonzentrationen von 0,05, 0,40 und 20 mg/kg Körpergewicht bzw. und Clonidin bei der festen Dosis von 0,375 µg) ermöglicht optimale und stabile Tiefe der Narkose (Stadium III, Ebene 2)17 . Das Volumen der Narkose Mischung intraperitoneal injizieren, und dann das Volumen von Clonidin zu injizieren.
Hinweis: Nach 15 min, die Maus sollte schlafen und die Anästhesie kann für mindestens 30 Minuten dauern. - Falten Sie ein Blatt des Aufsaugens Gewebe machen einen 3 cm breiten "Kissen" (Abbildung 2-f), das den oberen Teil des heizkissens (Abbildung 2eine) als Unterstützung für den Maus-Kopf abdecken wird.
- Decken Sie das Heizkissen mit einem Blatt des Aufsaugens Gewebe ("Bettlaken"; Abbildung 2 ( g). Legen Sie die Maus auf den Rücken auf das Heizkissen. Kleben Sie die Gliedmaßen und das Heck (Abbildung 2).
- Legen Sie den Verweis intravenöse Katheter (Abb. 1g) in den subkutanen Raum einer hinteren Extremität. Entfernen Sie die Nadel und passen Sie den Silikon Schlauch Anschluss (Abbildung 1e, 2 c).
- Füllen Sie den Katheter und der Stecker mit Sahne mischen und legen Sie die negative Elektrode in die Stecker (Abbildung 1-f).
- Fixieren Sie den Katheter und die Elektrode mit Klebeband wie erforderlich, um eine Verschiebung zu verhindern. Überprüfen Sie nach der Platzierung der Referenzelektrode und Brücken den Elektrode Brücke Offset Messwert wieder durch die Spitze des Katheters in der Elektrode Sahne-Mischung in den Stecker von der IV-Katheter nasale eintauchen. Aufzeichnung der stabilen Offset Endwert (idealerweise weniger als (±) 2 mV).
- Fixieren Sie die Maus Ohren mit "sanften" Klebeband auf das Heizkissen in einem freien Raum zwischen den zwei Stücken des Aufsaugens Gewebe ("Kissen" (Abbildung 2-f) und "Bettlaken"; (Abbildung 2g)). Beheben Sie die Tasthaare (die steifen Haare wachsen in der Nähe von den Nasenlöchern) ohne die Augen zu berühren.
- Flüssigkeit aus der Mundhöhle zu absorbieren, bewegen Sie die Zunge seitwärts (Abbildung 3ein) und legen Sie einen Spitzen Docht Filterpapier ("Rohr"; Abbildung 3 ( b) ca. 1 cm in den Mund. Flüssigkeit läuft aus der PERFUNDIERTEN Nasenloch zu absorbieren, legen Sie ein zweites Stück Filterpapier (das Taschentuch; Abbildung 3 ( c) statt an der Spitze der Nase.
- Überprüfen Sie einen Positivkontrolle Wert des epithelialen Potentials, indem die Spitze des nasalen Katheters in Kontakt mit der Innenseite des Mundes.
Hinweis: Die Lesung sollte stabil und liegen zwischen-10 mV und-20 mV. - Halten Sie es mit feinen Zangen und unter guten direkte Beleuchtung, zart führen Sie die nasale Katheter in ein Nasenloch bis zu 4 - 6 mm aus der Nase tip.
Hinweis: Die nasale PD-Katheter befindet sich in der mittleren Nasenmuschel an der Position, die die maximale stabilere Basislinie PD Wert17,20gibt. - 5 min nach Injektion von Anästhetika, kippen leicht das Heizkissen um etwa 30° mit Tierkopf nach unten. Überwachen Sie die maximale basalen PD-Wert.
- Wann ist es stabil über einen Zeitraum von ca. 30 s, Start Vorrichtung die Nasenschleimhaut mit einer Konstanten Rate von 10 µL / min, mit 4 gepufferten Lösungen (A, A1, B1, B2) in Folge. Perfundieren die erste Lösung (Schritt 1.3.1.1) für 10 s und jede folgende Lösung (Schritt 1.4) für 5 Minuten oder bis ein stabiler Wert erreicht ist. Stoppen Sie die Vorrichtung Forskolin (B2), wenn die vorübergehende Forskolin Antwort beginnt hinunter.
- Wählen Sie ein 1 s-Intervall für die Datenerfassung. Starten Sie Daten zum Zeitpunkt der Gründung Perfusion Aufnahme. Daten als Funktion der Zeit auf dem Bildschirm anzeigen.
- Stop Datenerfassung am Ende der Perfusion mit B2-Lösung. Speichern Sie Daten als eine Tabellenkalkulationsdatei.
- Korrekte Daten durch Subtraktion den letzten Offset-Wert.

Abbildung 3 : Position der Maus auf das Heizkissen mit der nasalen Katheter und der Filterpapiere vorhanden. Die Abbildung zeigt die Zunge seitwärts (a), Rohr (b) und das Taschentuch (c) setzen. Bitte klicken Sie hier für eine größere Version dieser Figur.
(3) nach dem test, Bewertung und das Management
- Lassen Sie die Maustaste aus der Heizkissen.
- Wischen Sie die Maus-Nase mit "Bettlaken" (Abbildung 2g).
- Injizieren Sie intraperitoneal den Narkose Antagonist-Mix bestehend aus einer festen Dosis (4 µg) von wettbewerbsfähigen Morphin Antagonisten Naloxon und Atipamezol, ein Medetomidine spezifisches Antidot (2 mg/kg Körpergewicht).
- Legen Sie die Maus auf das kleinere Heizkissen im Feld Erholung bis zur endgültigen Genesung, die in der Regel nach 1 bis 2 h beobachtet wird.
Hinweis: Der UCL-Labor wird etwa 10 % Mortalität, vor allem im Zusammenhang mit Bronchoaspiration Lösungen in der Nasenhöhle durchblutet, während des Tests unabhängig von Geschlecht oder Genotyp beobachtet.
Ergebnisse
Um die charakteristischen Ionen-Transport Anomalien in CF zu verdeutlichen, wurden nasale TE-Messungen durchgeführt, nach der oben beschriebenen, in eine F508del-CF-Maus und ein Wildtyp Kontrolle über den FVB/129 genetischen Hintergrund aus der Kolonie Brüssel-Protokolls CFTRtm1Eur Mäuse30. Diese klinisch relevante Modell, beherbergen die häufigste und einer der schwersten F508del-CFTR-Mutation23,24,25, ist das beste derzeit verfügbare CF Maus Modell30,31, 32.
Repräsentative nasale PD Umzeichnungen, erhalten in einer 4 - Monate alten weiblichen Maus homozygot für die Mutation F508del-CF und ein Alter und Geschlecht abgestimmt Wildtyp stellt, sind in Abbildung 4dargestellt. Während der ersten beiden Phasen der Prüfung wurde der funktionalen Status der ENaC von Vorrichtung Lösungen A und A1, die letzteren mit Amilorid untersucht. Funktionsstatus der CFTR (und der alternative Chlorid-Transporter in der Abwesenheit von Forskolin) wurde während der letzten beiden Phasen der Prüfung bewertet, wenn der Beitrag der ENaC durch Amilorid blockiert blieb.
In der F508del-CF-Maus ein hyperpolarisierten Ausgangswert (ein negativer PDmax gegenüber dem Wildtyp Maus-Wert) zusammen mit einer erhöhten Amilorid Reaktion beobachtet; Beide Ergebnisse spiegeln die CFTR-assoziierten ENaC Überaktivität. Konsequenter, beobachtet eine drastisch reduzierte Repolarisation als Reaktion auf beide ein elektrochemischer Gradient günstig für Chlorid Ausfluss und Zugabe von Forskolin, hier als Summe Chlorid Antwort genannt. Obwohl das Ausmaß der Forskolin Reaktion in Wildtyp Mäusen klein ist (-3 mV), CF, die Antwort ist in der Regel abgestumpft, Einklang mit der CFTR Verlustfunktion.
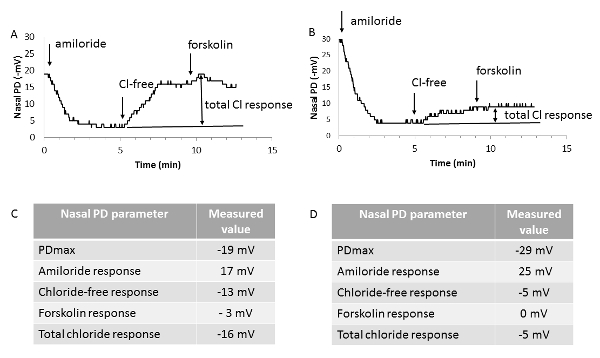
Abbildung 4 -Repräsentative nasale PD Umzeichnungen. Repräsentative nasale PD Umzeichnungen von einer homozygoten normale Maus (A) und eine Maus homozygot für F508del-CFTR-Mutation (B), zusammen mit den einzelnen Werten für die nasale PD-Parameter (C und D) erhalten. PDmax: maximale stabile Ausgangswert. Amilorid Antwort: Unterschied zwischen den Werten der nasalen PD am Ende und am Anfang der Durchblutung der Nasenschleimhaut mit basalen gepufferte Salzlösung mit Amilorid (Lösung A1). Chlorid-freie Antwort: Unterschied zwischen den Werten der nasalen PD am Ende und am Anfang der Durchblutung der Nasenschleimhaut mit Chlorid-free gepufferte Salzlösung plus Amilorid (B1-Lösung). Forskolin Antwort: Unterschied zwischen den Werten der nasalen PD am Ende und am Anfang der Durchblutung der Nasenschleimhaut mit Chlorid-free gepufferte Salzlösung plus Forskolin und Amilorid (B2-Lösung). Gesamt-Chlorid Antwort: Summe der beiden letzten Parameter unter Null-Chlorid Perfusion erhalten. Pfeile zeigen Veränderungen der Lösungen in das Nasenloch durchblutet. Bitte klicken Sie hier für eine größere Version dieser Figur.
Gegenmittel der Anästhetika galten am Ende des Tests, wodurch die Dauer der Narkose, die bis zu 45 min über Test abgeschlossen werden können. Als Erholung der Tiere ohne Nachwirkungen aufgetreten ist, wurden sie erneut nach einem Intervall von sieben Tagen getestet wenn dasselbe Protokoll angewendet wurde. Das gleiche Nasenloch war bei beiden Tests untersucht. Beispiele für den zweiten Test und gekoppelten Unterschiede jedes einzelnen nasale PD-Parameters zwischen den beiden Tests sind in Abbildung 5dargestellt. Wie bereits berichtet35waren die Unterschiede zwischen Test nahe Null, insbesondere für insgesamt Chlorid Antwort, reflektieren die funktionellen Status von CFTR-abhängigen Chlorid Transport, Defekte in CF.

Abbildung 5 -Einzelwerte der nasalen PD Parameter. Werte wurden in einem zweiten Test (t2) trat in eine homozygote normale Maus (A) und eine Maus homozygoten F508del-CFTR-Mutation (B), zusammen mit den gekoppelten Differenzen zwischen der zweiten und der erste Test (t1) für jeden entsprechenden Parameter erhalten. PDmax: maximale stabile Ausgangswert. Amilorid Antwort: Unterschied zwischen den Werten der nasalen PD am Ende und am Anfang der Durchblutung der Nasenschleimhaut mit den basalen gepufferte Salzlösung mit Amilorid (Lösung A1). Chlorid-freie Antwort: Unterschied zwischen den Werten der nasalen PD am Ende und am Anfang der Durchblutung der Nasenschleimhaut mit dem Chlorid-free gepufferte Salzlösung plus Amilorid (B1-Lösung). Forskolin Antwort: Differenz der Werte der nasalen PD am Ende und am Anfang der Durchblutung der Nasenschleimhaut mit dem Chlorid-free gepufferte Salzlösung plus Forskolin und Amilorid (B2-Lösung). Gesamt-Chlorid Antwort: Summe der beiden letzten Parameter unter Null-Chlorid Perfusion erhalten. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Lösung-Label | Lösungsbeschreibung |
| A1 | Basale gepufferte Salzlösung (A) plus 10-4 M Amilorid |
| B1 | Chlorid-freie gepufferte Salzlösung (B) plus 10-4 M Amilorid |
| B2 | Chlorid-freie gepufferte Salzlösung (B) + 10-4 M Amilorid + 10-5 M forskolin |
Tabelle 4: Liste der frische Lösungen für den nasalen PD-Test an Mäusen.
Diskussion
Dieses Papier soll eine angemessene Protokoll zur Messung der nasalen PD unter kontinuierlicher Perfusion der Lösungen in spontan atmen Mäuse auf einer Länge von Zeitaufwand für die Prüfung der Integritätdes der Ionen-Transporter, hauptsächlich CFTR und ENaC beschreiben. Alle Schritte des Protokolls wurden sorgfältig optimiert, um vollständige Tier Erholung und gute Qualität und reproduzierbare Daten zu gewährleisten. In bestimmten, wichtigen Schritte sind Anästhesie Bewertung und Management und adäquate Tier Position und Betreuung während und nach dem Test.
Frühere Studien zeigten, dass Flugzeug 2 Stufe III der Narkose Exposition, die erreicht werden kann, durch die Anwendung der cocktail Mischung hier17 verwendet, ist verbunden mit regelmäßigen Atmung und Fehlen von negativ Inotrope Wirkung und Blink, Pupillen und pedal Rückzug Reflexe. Auf dieser Ebene der Narkose Tiefe kann der nasale Katheter in Situ für kontinuierliche Perfusion der Nasenhöhle und für den Einsatz als eine Brücke von der Messelektrode mit guten Toleranz gehalten werden. Auch einführen des Katheters im subkutanen Bereich, die Brücke der Bezugselektrode, eine schmerzhafte Reaktion oder Anzeichen für schädliche Wirkung folgte nicht. Bei Nagetieren macht die wesentliche Rolle der sensorischen Input aus der Nasofacial Region in der Kontrolle des Verhaltens gegenüber eine äußere Situation, einschließlich eine Bedrohung, ausreichende Tiefe der Narkose eine besondere Herausforderung beim Einsatz in der Nasenhöhle. Vernebelung statt kontinuierliche nasale Perfusion ist für nasale PD-Test in einigen Maus Studien33,34angewendet worden. Diese Methode führt jedoch zu nicht-zuverlässige Ergebnisse aufgrund der wiederholten Umzüge und Reinsertions der nasale Sonde. In der Tat ist aufgrund der inhomogenen Verteilung der Zelltypen in der Maus Nasenschleimhaut20, Neupositionierung der Sondenspitze an der gleichen Stelle in das Nasenloch entscheidend. Darüber hinaus verschwinden Reaktionen auf Änderungen der Lösungen, insbesondere Chlorid-frei, schnell bei der Durchblutung unterbrochen wird.
Broncho-Aspiration von Lösungen zu Atemstillstand ist eine wichtige Einschränkung des Verfahrens und ist die Hauptursache der Sterblichkeit des Tests. Einige wesentliche Maßnahmen sollen verhindern, dass es, einschließlich einer dorsalen Dekubitus-Position des Tieres leicht mit dem Kopf nach unten kippen und absorbieren überschüssigen Flüssigkeit aus der Mund-und Nasenschleimhaut17. Eine schnelle und reversible Anästhesie mit vollständige Genesung der Tiere ist gewährleistet durch die Anwendung der Gegenmittel von Anästhetika am Ende des Tests. Die hier vorgestellten Protokoll ermöglicht zuverlässige Messungen in spontan atmen Mäuse und Wiederholung des Tests in das gleiche Tier. Es wirkt sich auf die Anzahl der Mäuse benötigt, um die statistische Signifikanz35 und auf Einhaltung der 3R (ersetzen, zu verfeinern und zu reduzieren) Regeln für Tier in experimentellen Verfahren36verwenden. Bei Menschen wie bei Mäusen die niedrigsten zwischen Test-Variabilität insgesamt Chlorid als Reaktion darauf hindeutet, dass es als zuverlässigste nasale PD-Parameter zur Wirksamkeit des neuen CF therapeutische Strategien zu erkennen befindet sich. Bei CF Mäusen zeigte der Messfehler der gesamten Chlorid Antwort ±1.7 mV35unterschreiten. In anderen Worten, wenn in F508del-CF Mäuse, einen Unterschied zwischen Gesamt-Chlorid Antwort drug bewerten die Bioaktivität der CFTR-Korrektur in Abwesenheit und Anwesenheit Behandlung größer als 2 mV zeigt 95 % ige Chance eine Droge-in Verbindung stehenden verbessernden Wirkung.
Interpretation der Daten der repräsentativen Umzeichnungen veranschaulicht die Fähigkeit des nasalen PD Tests zur Unterscheidung zwischen CF und Wildtyp Mäusen18,19,20,21,35 und zeigt, dass die F508del-CF Erasmus Maus Modell30 imitiert die menschlichen Nasenschleimhaut in Bezug auf die typischen klinischen Ionen-Transport Anomalien. Allerdings ist eine verbleibende Chlorid Leitfähigkeit im Tiermodell, nachweisbar, wodurch ein passives F508del-CFTR-Funktion oder aus einen Beitrag von alternativen CFTR-abhängigen chloridkanälen. Übersetzung von CF Forschungsergebnisse aus präklinischen in klinischen Umgebungen bedeutet Umgang mit mehrere große Unterschiede zwischen den beiden Einstellungen. Die Maus-CF-Phänotyp zeigt ein abgeschwächte respiratorisches Syndrom. Das Fehlen von mehreren Therapien zusammen mit der Tatsache, dass die Maus-Modell in privilegierten Verhältnissen mit hygienischen Barrieren untergebracht ist auch auf die Unterschiede37beitragen. Das Protokoll beschrieben hier zeigt eine sehr geringe Variabilität35 und es wurde auf das Schwein38,39 angepasst und das Frettchen Modelle40. In einer früheren Studie war das experimentelle Protokoll geändert von einschließlich Durchblutung der Nasenschleimhaut die Maus mit einem Inhibitor der alternative Chlorid-Transporter, den möglichen Beitrag der CFTR-abhängigen aktiviert Kalzium-Chlorid zu erkunden 18Kanäle. Der Test hat auch zur Natrium-Transport in den β-ENaC überexprimierenden Maus Modell41, entwickelt, um CF-Lungen Krankheit42imitieren zu studieren. In der Zukunft weitere Anwendungen des Tests könnte als andere Transporter, wie z. B. die ATP12A, eine CFTR-unabhängige H+zu studieren-Pumpe Protein ausgedrückt in Mensch und Schwein aber abwesend in Maus Airways43. Insgesamt ermöglicht das Protokoll hier beschriebenen zuverlässige Messungen des funktionellen Status berührt Chlorid und Natrium-Transporter in Mäuse, reduzierte Test-Mortalität und mehrere Tests im gleichen Tier spontan zu atmen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken Prof. J. Lebacq kritisch bearbeitet das Manuskript. CFTR-tm1Eur (homozygoten F508del-CFTR (FVB/129) Mäuse wurden entwickelt durch die Erasmus MC, Rotterdam, Niederlande, mit Unterstützung der Europäischen Wirtschaftsgemeinschaft Europäische Koordination Aktion für Forschung in der Mukoviszidose EU FP6 LHHM-CT-2005-018932.
Materialien
| Name | Company | Catalog Number | Comments |
| Portex polyethylene tube | Smiths Medical, Hythe, Kent, England CT21 6JL | Portex 800/100/500;2.0mm ID, 3.0 mmOD | to prepare capillary tubes for nasal probe |
| Electrode cream | Parker, Fairfield, NJ, USA | Redux cream | to build electrode bridges |
| Ag/AgCl electrodes | Biomedical, Clinton Township, MI, USA | JNS BNT131-1,0 | measuring and reference electrodes |
| amiloride hydrochloride | Sigma, St Louis, MI, USA | A7410 | to prepare perfusion solutions |
| forskolin | Sigma, St Louis, MI, USA | F6886 | to prepare perfusion solutions |
| Knick Portamess voltmeter | Elektronisch Meβgeräte, Berlin, Germany | Portavo 904 pH | to measure potential difference |
| Paraly SW 112 Software | Elektronisch Meβgeräte, Berlin, Germany | Paraly SW112 software | to capture potential difference data |
| midazolam | Mylan, Hoeilaart, Belgium | Dormicum 15mg/3ml | to serve as anaesthetic premedication |
| fentanyl | Janssen Cilag, Berchem, Belgium | Fentanyl-Janssen 0.05 mg/ml | to serve as anaesthetic medication |
| medetomidine | Orion Pharma, Espoo, Finland | Domitor 1 mg/ml | to serve as anaesthetic medication |
| droperidol | Janssen Cilag, Berchem, Belgium | Dehydrobenzperidol 2.5 mg/ml | to serve as anaesthetic medication |
| clonidine | Boehringer Ingelheim Pharma KG, Ingelheim am Rhein, Germany | Catapressan 0.15 mg/ml, | to serve as anaesthetic medication |
| refernce IV catheter | Becton Dickinson, Sandy, UT, USA | 24 GA x 0.75 IN, BD Insyte-W | to build electrode bridges |
| forceps | Fine science Tools, Heidelberg, Germany | Dumont #5, Fine science Tools | to place the nasal catheter |
| naloxone | Braun Medical, Brussels, Belgium | Narcan, 0.4 mg/ml | to serve as anaesthetic antagonist |
| atipamezole | Zoetis, Bloomberg, Belgium | Antisedan, 5 mg/ml | to serve as a medetomedine specific antidote |
| Heating pads | Harvard Apparatus, Holliston, MA, USA | 18,8x37,5 cm; 15,5x15,5 cm | to avoid hypothermia during and after the test |
| Peristaltic pump P1 | GE Life Sciences, Uppsala, Sweden | 18111091 | to perfuse solutions in the mouse nose |
| cyanoacrylate glue | Loctite, Henkel, Düsseldorf, Germany | super glue 3 | to glue together two capillary tubes for nasal probe |
| NaCl | Sigma, St Louis, MI, USA | RES0926S-A7 | Pharma-Grade, USP |
| CaCl2.2H2O | Sigma, St Louis, MI, USA | M7304 | Pharma-Grade, USP |
| MgCl2.6H2O | Sigma, St Louis, MI, USA | 1551128 | Pharma-Grade, USP |
| K2HPO4 | Sigma, St Louis, MI, USA | 1551139 | Pharma-Grade, USP |
| Na gluconate | Sigma, St Louis, MI, USA | S2054 | Pharma-Grade, USP |
| Ca gluconate | Sigma, St Louis, MI, USA | C8231 | Pharma-Grade, USP |
| MgSO4.7H2O | Sigma, St Louis, MI, USA | RES0089M-A7 | Pharma-Grade, USP |
| BD needle | Becton Dickinson, Franklin Lakes, USA | BD 26G (0.45x10 mm) | intraperitoneal injection |
Referenzen
- Knowles, M., Gatzy, J., Boucher, R. Increased bioelectric potential difference across respiratory epithelia in cystic fibrosis. New England Journal of Medicine. 305 (25), 1489-1495 (1981).
- Middleton, P. G., Geddes, D. M., Alton, E. F. W. Protocols for in vivo measurement of the ion transport defects in cystic fibrosis nasal epithelium. European Respiratory Journal. 7 (11), 2050-2056 (1994).
- Knowles, M. R., Paradiso, A. M., Boucher, R. C. In vivo nasal potential difference: techniques and protocols for assessing efficacy of gene transfer in cystic fibrosis. Human Gene Therapy. 6 (4), 445-455 (1995).
- Paranjape, S. M., Zeitlin, P. L. Atypical cystic fibrosis and CFTR-related disorders. Clinical Reviews in Allergy & Immunology. 35 (3), 116-123 (2008).
- Wilschanski, M., et al. A pilot study of the effect of gentamicin on nasal potential difference measurements in CF patients carrying stop mutations. American Journal of Respiratory and Critical Care Medicine. 161 (3), 860-865 (2000).
- Clancy, J. P., et al. Evidence that systemic gentamicin suppresses premature stop mutations in patients with CF. American Journal of Respiratory and Critical Care Medicine. 163 (7), 1683-1692 (2001).
- Wilschanski, M., et al. Gentamicin-induced correction of CFTR function in patients with CF and CFTR stop mutations. New England Journal of Medicine. 349 (15), 1433-1441 (2003).
- Sermet-Gaudelus, I., et al. In vitro prediction of stop-codon suppression by intravenous gentamicin in patients with CF: a pilot study. BMC Medicine. 5, 5 (2007).
- Clancy, J. P., et al. No detectable improvements in CF transmembrane conductance regulator by nasal aminoglycosides in patients with CF with stop mutations. American Journal of Respiratory and Cell Molecular Biology. 37 (1), 57-66 (2007).
- Kerem, E., et al. Effectiveness of PTC124 treatment of CF caused by nonsensemutations: a prospective phase II trial. Lancet. 372 (9640), 719-727 (2008).
- Sermet-Gaudelus, I., et al. Ataluren (PTC124) induces CF transmembrane conductance regulator protein expression and activity in children with nonsense mutation CF. American Journal of Respiratory and Critical Care Medicine. 182 (10), 1262-1272 (2010).
- Wilschanski, M., et al. Chronic ataluren (PTC124) treatment of nonsense mutation cystic fibrosis. European Respiratory Journal. 38 (1), 59-69 (2011).
- Accurso, F. J., et al. Effect of VX-770 in persons with CF and the G551D-CFTR mutation. New England Journal of Medicine. 363 (21), 1991-2003 (2010).
- Clancy, J. P., et al. Results of a phase IIa study of VX-809, an investigational CFTR corrector compound, in subjects with cystic fibrosis homozygous for the F508del-CFTR mutation. Thorax. 67 (1), 12-18 (2012).
- Leonard, A., Lebecque, P., Dingemanse, J., Leal, T. A randomized placebo-controlled trial of miglustat in cystic fibrosis based on nasal potential difference. Journal of Cystic Fibrosis. 11 (3), 231-236 (2012).
- De Boeck, K., et al. CFTR biomarkers: time for promotion to surrogate end-point. European Respiratory Journal. 41, 203-216 (2013).
- Leal, T., et al. Successful protocol of anaesthesia for measuring transepithelial nasal potential difference in spontaneously breathing mice. Laboratory Animals. 40 (1), 43-52 (2006).
- Lubamba, B., et al. Preclinical evidence that sildenafil and vardenafil activate chloride transport in cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 177 (5), 506-515 (2008).
- Lubamba, B., et al. Airway delivery of low-dose miglustat normalizes nasal potential difference in F508del cystic fibrosis mice. American Journal of Respiratory and Critical Care Medicine. 179 (11), 1022-1028 (2009).
- Lubamba, B., et al. Inhaled PDE5 inhibitors restore chloride transport in cystic fibrosis mice. European Respiratory Journal. 37 (1), 72-78 (2011).
- Vidovic, D., et al. rAAV-CFTRΔR Rescues the Cystic Fibrosis Phenotype in Human Intestinal Organoids and Cystic Fibrosis Mice. American Journal of Respiratory and Critical Care Medicine. 193 (3), 288-298 (2016).
- Stutts, M. J., et al. CFTR as a cAMP-dependent regulator of sodium channels. Science. 269 (5225), 847-850 (1995).
- Lubamba, B., Dhooghe, B., Noel, S., Leal, T. Cystic fibrosis: insight into CFTR pathophysiology and pharmacotherapy. Clinical Biochemistry. 45 (15), 1132-1144 (2012).
- Kerem, B., et al. Identification of the cystic fibrosis gene: genetic analysis. Science. 245 (4922), 1073-1080 (1989).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA. Science. 245 (4925), 1066-1073 (1989).
- Stutts, M. J., Rossier, B. C., Boucher, R. C. Cystic fibrosis transmembrane conductance regulator inverts protein kinase A-mediated regulation of epithelial sodium channel single channel kinetics. Journal of Biological Chemistry. 272 (22), 14037-14040 (1997).
- Ismailov, I. I., et al. Regulation of epithelial sodium channels by the cystic fibrosis transmembrane conductance regulator. Biological Chemistry. 271 (9), 4725-4732 (1996).
- Althaus, M. ENaC inhibitors and airway re-hydration in cystic fibrosis: state of the art. Current Molecular Pharmacology. 6 (1), 3-12 (2013).
- Wilke, M., et al. Mouse models of cystic fibrosis: phenotypic analysis and research applications. Journal of Cystic Fibrosis. 10, 152-171 (2011).
- Van Doorninck, J. H., et al. A mouse model for the cystic fibrosis delta F508 mutation. The EMBO Journal. 14 (18), 4403-4411 (1995).
- Colledge, W. H., et al. Generation and characterization of a delta F508 cystic fibrosis mouse model. Nature Genetics. 10 (4), 445-452 (1995).
- Zeiher, B. G., et al. A mouse model for the delta F508 allele of cystic fibrosis. Journal of Clinical Investigation. 96 (4), 2051-2064 (1995).
- Ghosal, S., Taylor, C. J., McGray, J. Modification of the nasal membrane potential difference with inhaled amiloride and loperamide in the cystic fibrosis (CF) mouse. Thorax. 51 (12), 1229-1232 (1996).
- Ghosal, S., Taylor, C. J., Colledge, W. H., Ratcliff, R., Evans, M. J. Sodium channel blockers and uridine triphosphate: effects on nasal potential difference in cystic fibrosis mice. European Respiratory Journal. 15 (1), 146-150 (2000).
- Leonard, A., et al. Comparative Variability of Nasal Potential Difference Measurements in Human and Mice. Open Journal of Respiratory Disease. 2, 43-56 (2012).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Rs then and now: the need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Pritchett-Corning, K. R., et al. AALAS/FELASA Working Group on Health Monitoring of rodents for animal transfer. Journal of the American Association for Laboratory Animal Science. 53 (6), 633-640 (2014).
- Salinas, D. B., et al. CFTR involvement in nasal potential differences in mice and pigs studied using a thiazolidinone CFTR inhibitor. American Journal of Physiology. Lung Cell Molecular Physiology. 287 (5), 936-943 (2004).
- Fisher, J. T., et al. Comparative processing and function of human and ferret cystic fibrosis transmembrane conductance regulator. Journal of Biological Chemistry. 287 (26), 21673-21685 (2012).
- Kaza, N., et al. Use of ferrets for electrophysiologic monitoring of ion transport. PLoS One. 12 (10), 0186984 (2017).
- Leal, T., Beka, M., Panin, N., Mall, M. A., Noel, S. Nasal potential difference in βENaC-overexpressing mouse reveals pH-sensitive channel hyperactivity and shift of subunits stoichiometry. Journal of Cystic Fibrosis. 16 (S1), 72 (2017).
- Mall, M., Grubb, B. R., Harkema, J. R., O'Neal, W. K., Boucher, R. C. Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice. Nature Medicine. 10 (5), 487-493 (2004).
- Shah, V. S., et al. Airway acidification initiates host defense abnormalities in cystic fibrosis mice. Science. 351 (6272), 503-507 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten