Method Article
Caracterização hemodinâmica invasiva da síndrome hipertensiva-Portal em ratos cirrose
Neste Artigo
Resumo
Aqui descrevemos um protocolo detalhado para medição invasiva dos parâmetros hemodinâmicos, incluindo pressão portal, fluxo sanguíneo esplâncnico e hemodinâmica sistêmica para caracterizar a síndrome de hipertensão portal em ratos.
Resumo
Este é um protocolo detalhado descrevendo medições hemodinâmicas invasivas em cirrose ratos para a caracterização da síndrome de hipertensão portal. Hipertensão portal (PHT) devido a cirrose é responsável para as complicações mais graves em pacientes com doença hepática. A imagem completa da síndrome hipertensiva portal caracteriza-se por aumento da pressão portal (PP), devido ao aumento da resistência vascular intra-hepática (IHVR), circulação hiperdinâmica e o fluxo sanguíneo esplâncnico maior. Progressiva esplâncnico vasodilatação arterial e débito cardíaco aumentado com elevada frequência cardíaca (FC), pressão arterial baixa mas caracteriza a síndrome de hipertensão portal.
Novas terapias estão atualmente sendo desenvolvidas que visam diminuir o PP por qualquer direcionamento IHVR ou aumento do fluxo sanguíneo esplâncnico — mas podem ocorrer efeitos secundários na hemodinâmica sistêmica. Assim, uma caracterização detalhada do portal venoso, esplâncnico e parâmetros hemodinâmicos sistêmicos, incluindo medição de PP, fluxo de sangue venoso portal (PVBF), fluxo de sangue arterial mesentérica, pressão arterial média (mapa) e HR é necessária para pré-clínicos avaliação da eficácia dos novos tratamentos para PHT. Nosso vídeo artigo fornece o leitor com um protocolo estruturado para realização de medições de hemodinâmicas invasivas em ratos cirrose. Em particular, descreveremos a cateterização da artéria femoral e a veia porta através de uma veia ileocólica e a medição do portal venoso e esplâncnico sangue fluir através de sondas de fluxo perivascular Doppler ultra-som. São mostrados resultados representativos dos modelos do rato diferente da PHT.
Introdução
PHT é definido como patologicamente aumento da pressão arterial no sistema venoso portal que pode causar complicações graves em pacientes com cirrose, tais como hemorragia varicosa e ascite1. Enquanto a pré-hepática (por exemplo, trombose de veia porta) e pós-hepática (por exemplo, síndrome de Budd-Chiari) PHT são raros, colestase PHT devido a cirrose hepática representa a causa mais comum de PHT2.
Na cirrose hepática, PP principalmente é aumentado como consequência elevados IHVR3. Em estágios avançados, PHT é agravada pelo PVBF aumentado devido ao maior débito cardíaco e diminuição da resistência vascular sistêmica e esplâncnico — definindo a síndrome de hipertensão portal4. A lei de Ohm (ΔP = Q * R) implica que o fluxo IHVR e sangue são proporcionais à PP5. Em pacientes, medição directa do PP é arriscado e não rotineiramente realizados; em vez disso, o gradiente de pressão venosa hepática (HVPG) é usado como uma medida indireta do PP6,7. O HVPG é calculado subtraindo-se a pressão venosa hepática (FHVP) livre da vendendores hepática pressão venosa (WHVP), que são medidos através de um cateter de balão colocado em uma veia hepática8. O HVPG fisiológica varia entre 1 a 5 mmHg, enquanto um HVPG ≥ 10 mmHg define clinicamente significativa hipertensão portal (CSPH) e indica um risco aumentado para complicações PHT-relacionados, tais como hemorragia varicosa, ascite e encefalopatia hepática9 . Apesar de PP (ou seja, HVPG) é o parâmetro mais relevante para a severidade PHT, informações sobre outros componentes do PHT, incluindo a gravidade da circulação hiperdinâmica (HR, mapa), fluxo de sangue arterial mesentérica/esplâncnico e IHVR, são fundamentais para obter uma compreensão abrangente do mecanismo subjacente distinta da PHT.
Assim, em contraste com medições indirectas de PP em humanos, a metodologia introduzida para ratos oferece a vantagem de uma medida direta do PP e permite a gravação de parâmetros hemodinâmicos adicionais, caracterizando a síndrome de hipertensão portal. Além disso, a medição directa do PP é uma excelente leitura Integrativa da quantidade de fibrose hepática (um determinante importante da IHVR) e supera a determinadas limitações de quantificação de fibrose relacionadas a erros de amostragem de tecido do fígado.
Os modelos de roedores mais comumente usados de cirrose PHT incluem ligadura cirúrgica do colédoco (BDL), induzida pela toxina lesão hepática (isto é, pela administração de dimetilnitrosamina, tioacetamida ou tetracloreto de carbono) e fígado metabólico induzida por dieta modelos de doença. Prehepatic PHT (não-cirrose) pode ser induzida por parcial de veia porta ligadura (CPPV)10.
Pequenos roedores são adequados para o método apresentado, incluindo ratos, hamsters, ratos ou coelhos e são associados com relativamente baixo custo de manutenção. Apesar disso, todas as avaliações hemodinâmicas são viáveis para executar em ratos, melhor precisão e reprodutibilidade dos resultados são vistas com ratos ou roedores maiores devido a óbvia vantagem de tamanho animal. Além disso, microinstrumentos específicos e dispositivos são necessários para obter parâmetros hemodinâmicos semelhantes em ratos. Finalmente, os ratos são mais robustos com mortalidade e baixa morbidade associada e assim, as taxas de abandono são prováveis menor em ratos do que em ratos.
A metodologia apresentada é well-suited para avaliar tratamentos específicos de doença hepática (ou seja, drogas anti fibróticas ou anti-inflamatórios) ou farmacológica romance aproxima-se aquele tom vascular de influência e/ou biologia endotelial; e assim, de provável efeito parâmetros hemodinâmicos em PHT.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo Comitê de ética da universidade médica de Viena e Ministério da ciência, investigação e economia (BMWFW) da Áustria. Os procedimentos devem ser realizados em condições assépticas, em uma sala de operação ou similares limpar área de trabalho, desde que as medidas hemodinâmicas representam intervenções cirúrgicas. Em geral, trabalhando em condições estéreis é recomendado. Ao usar uma anestesia por inalação, considere ventilação adequada da sala de cirurgia para a segurança do trabalho. Um período de tempo de 40-50 min/animal tem de ser considerado no caso todas as leituras hemodinâmicas apresentadas neste protocolo.
1. pré-cirúrgicas preparações
- Ligue e calibrar o gravador multicanal electrónico, incluindo os transdutores de pressão de acordo com as instruções do fabricante.
- Conecte as sondas de vazão ultrassônicos (1mm e 2mm) para o amplificador de ponte.
- Prepare um reservatório de solução de soro fisiológico estéril, aquecida à temperatura do corpo, 37 ° C, para umedecer tecidos ou compressas de gaze.
- Recorde o peso do corpo animal para fornecer anestesia peso ajustado e normalização dos parâmetros hemodinâmicos, de acordo com o peso do corpo.
- Prepare todos os equipamentos para uma anestesia por inalação.
Nota: Se a anestesia por inalação e/ou equipamentos necessários não no local ou viável, então anestesia de injeção usando ketamina e xilazina pode ser usada (cetamina 80-100 mg/kg com 5 a 10 mg/kg de xilazina em solução salina fisiológica, intraperitoneal (i.p.)). Um re-dosagem de ketamina (dose reduzida de 20 a 30 mg/kg, intramuscular (i.m.)) após 30-45 min é necessária para induzir anestesia cirúrgica-avião contínua. - Colocar o animal sob anestesia de isoflurano curto prazo usando uma caixa de indução para anestesia por inalação (5 min, isoflurano 5% v/v, 3-4 L O2-fluxo). Com cuidado incline a caixa e a profundidade da anestesia para verificar o status de imobilidade do animal.
-
Entube o rato com um tubo endotraqueal self-made apropriado.
Nota: Para o pessoal que são novo para a técnica de intubação, a anestesia/analgesia (etapa 1.10) pode ser dado logo após a anestesia por inalação de curto prazo para permitir um tempo extra para intubação. Outra opção é uma máscara de animal específico para anestesia por inalação.- Use um tubo endotraqueal self-made de um cateter venoso periférico modificado (14 G). Cortar as asas de manipulação e apor um laço de fita adesiva para fixação posterior na bochecha do rato para evitar o deslocamento do tubo endotraqueal (figura 1A).
- Use um dispositivo de fio guia autodidacta de uma cânula arterial modificado como um suporte de fio guia e um fio apropriado de ponta romba (figura 1B).
- Use uma mesa de intubação adequado para o posicionamento adequado do animal. Coloque o animal em posição supina com a cabeça na posição angular.
Nota: Se nenhuma mesa de intubação está disponível, é possível colocar o animal em posição supina com o pescoço esticado cuidadosamente sobre a borda da tabela. No entanto, este procedimento não é recomendado devido ao aumento do risco de lesões. - Corrigir uma sutura por trás dos incisivos de um lado do rato e esticar suavemente o pescoço do animal, amarrando a sutura para baixo do outro lado (Figura 1).
- Ilumine a área de pre-traqueal colarinho ventral por um feixe de luz concentrado. Especialmente em animais albinos, certifique-se de que as cordas vocais são iluminadas através da pele para permitir melhor visualização e intubação rápida.
Nota: Utilize um laringoscópio animal específico para a intubação de animais pigmentadas. - Pegue a língua e gentilmente puxe-o usando dois dedos.
- Use um cotonete tratado por lidocaína (pulverizador de bomba) para cuidadosamente anestesiar a área da laringe.
- Entube o animal através da inserção do tubo endotraqueal, entre as pregas vocais e na traqueia, usando o suporte do dispositivo de fio guia (Figura 1).
- Retire o dispositivo de fio guia.
- Conecte o tubo do ventilador.
- Comece o ventilador usando as configurações apropriadas para o animal (1 L/min O2-fluxo, Auto fluxo = 90/min; pressão inspiratória: 18 mmHg; PEEP: 3 mmHg, eu / E = 1:2) e verifique a intubação apropriada.
Nota: Se a inflação do estômago é de notar, retire o tubo e tente novamente. Além disso, comparar a atividade respiratória ao ritmo do ventilador, ou coloque dois dedos na parede abdominal direita sobre o estômago para avaliar o potencial da inflação do estômago.
- Iniciar a anestesia de isoflurano em 0.5-1.0% v/v e 1 L/min O2-fluxo imediatamente após a intubação bem sucedida (Figura 2A).
- Fixe o tubo endotraqueal por uma sutura de transbuccal através da bochecha e a aposta fita adesiva volta do tubo.
- Administrar adicional anestesia e analgesia por duas seringas de 1 mL, por exemplo, i.p. cetamina (100 mg/kg) (cânula de 23 G) [ou i.m., distribuindo o volume injetado (dose) em injecções bilaterais no músculo da coxa caudal (cânula de 30 G)] e piritramide (2 mg/kg) por via subcutânea (s.c.) (cânula de 23 G). Observe o volume máximo de injeções i.m. por injecção (Figura 2B).
- Aplica a pomada. Corte os pelos do corpo na região abdominal e ambas as coxas. Desinfecte a pele.
Nota: Ambas as parte interna das coxas deve ser raspada para permitir o uso de artéria femoral contralateral para RH e mapa de medições, no caso o cateterismo da artéria femoral falhou em um lado. Barbear em um momento posterior de tempo pode causar o cabelo contaminar o campo cirúrgico. - Corrigi o animal em posição supina sobre uma almofada de aquecimento (38 ° C) com fita adesiva (Figura 2).
- Monitore a temperatura do corpo do animal continuamente, por exemplo, usando uma sonda de temperatura retal (Figura 2D).
- Avalie a profundidade da anestesia pelo fechamento da tampa reflexo e dedo do pé--teste do beliscão antes de qualquer intervenção ou cirurgia.
2. medição de RH e mapa
- Faça uma incisão na pele na parte interna da coxa (selecione um lado) acima a suposta localização da artéria femoral levantando a pele pelas pinças de tecido e removendo uma área da pele de cerca de 2 cm de comprimento por Mayo tesoura (Figura 3A).
- Expor e sem rodeios, dissecar o nervo-artéria-veia complexo que inclui a artéria femoral do tecido conjuntivo (adventícia) repetidamente abrindo uma pinça hemostática ao longo do complexo.
- Disse o complexo artéria-veia-nervo no tecido circundante ao longo de ~1–1.5 cm (Figura 3B).
- Se necessário, remova a gordura subcutânea/perivascular para uma melhor visualização e dissecação.
Nota: Tenha cuidado ao remover a gordura subcutânea/perivascular por tesoura de cutícula, desde que a lesão dos vasos sanguíneos pode causar hemorragias. Se o sangramento é observado, aplicar pressão sobre a área de sangramento usando uma pequena gaze ou parar o sangramento por uma pinça hemostática. - Separar a artéria femoral a veia femoral e o nervo com pinça ponto amplo ângulo de 45° de alta precisão de dois (considere que a veia femoral é a estrutura mais medial e a artéria femoral está localizada mais lateral) (Figura 3-F).
- Coloque uma ligadura da artéria femoral distal como possível e usar uma pinça curvada na sutura para aplicar suave tração longitudinal na artéria femoral.
- Coloque uma segunda sutura pre-atada (mas não fechado nó) na artéria femoral proximal como como possível (Figura 3).
- Prepare um cateter adequado (PE-50 para artéria femoral de ratos) com uma ponta de corte inclinada (~ 45°) com solução heparinizada soro fisiológico estéril (5 mL seringa e 23 G romba cânula). Certifique-se de que nenhuma bolha de ar está dentro do cateter como eles dificultam a pressão arterial e leitura HR (Figura 3-H).
- Comprima a artéria femoral na extremidade proximal da seção exposta usando uma pinça micro interromper temporariamente o fluxo de sangue arterial (Figura 3I).
- Perfure a parede arterial numa localização distal da seção dissecada usando uma cânula dobrada (23 G) ao colocar uma espátula de metal micro suporte debaixo da artéria femoral (Figura 3J).
- Cuidadosamente cateterismo da artéria femoral através a perfuração com a ponta inclinada do cateter voltada para cima. Avance o cateter até a pinça micro é aproximada (Figura 3 K).
Nota: Em caso de êxito cateterização da artéria femoral na primeira tentativa, uma segunda tentativa mais proximal pode ser executada (começam a passo 2.8). Se ocorre a ruptura da artéria ou hemorragia grave, ligate ou grampear a artéria proximal como possível evitar mais perda de sangue. Se a perda de sangue é mínima, tentativa catheterizing artéria femoral contralateral (começam no passo 2.1). - Abra a pinça micro e verificar se há fluxo de sangue arterial pulsátil dentro do cateter (Figura 3 L).
- Evitar mais fluxo de sangue dentro do cateter através do bloqueio da saída do cateter.
- Fixe o cateter na sua localização intraluminal, fechando a ligadura proximal preparada em torno da artéria femoral e o cateter introduzido (Figura 3 M).
- Repetidamente, lave e aspire o cateter na artéria femoral para avaliar o posicionamento adequado intravascular. Pulsação arterial na coluna de sangue aspirado deve ser facilmente perceptível.
- Fixe a posição do cateter ao longo do navio, usando as extremidades da ligadura distal para evitar a luxação e assegurar uma posição longitudinal do cateter (Figura 3N).
- Além disso, fita o cateter junto o animal sobre a mesa cirúrgica para fixá-lo e prevenir luxação acidental.
- Conecte o cateter preenchido com solução salina fisiológica para o transdutor de pressão, evitando a formação de bolhas de ar.
- Começa a gravar o HR e o mapa usando a interface digital (Figura 3O).
- Cobrir a área exposta na parte interna da coxa com uma compressa de gaze umedecida pequeno (Figura 3 P).
- Calcular o índice de hiperdinâmica (HD): HD = mapa/HR.
Nota: Na PHT avançado, o índice de HD é elevado em comparação com animais não-portal hipertensiva. No entanto, um aumento no índice de HD durante a cirurgia também pode indicar hemorragia, hipovolemia ou dor. Se os valores registrados mapa são muito baixos, mas o sinal é bom e fluxo pulsátil é detectado no cateter, verifique o nível de anestesia e potencialmente reduzir o nível de anestesia. Não pare completamente isoflurano anestesia, já que isso pode levar a profundidade de anestesia insuficiente, de acordo com o bem-estar dos animal e das boas práticas científicas.
3. fluxo de sangue da artéria mesentérica superior (SMABF)
-
Realizar uma laparotomia mediana (Figura 4A-C)
- Levante a camada de pele com fórceps do tecido 5 a 6 cm abaixo do xifoide e remove uma tira fina da pele usando uma maionese de tesoura acima o linea alba até xifoide é alcançado.
- No meio da incisão na pele, levante a camada muscular pelo fórceps do tecido ao longo da linea alba para criar a distância entre a parede abdominal e órgãos esplâncnico.
- Abra a cavidade peritoneal por incisão da parede abdominal com um bisturi no linea alba. Estender a abertura enquanto levanta a parede abdominal por fórceps do tecido com uma tesoura de Metzenbaum junto a linea alba a mesma distância como a camada de pele.
- Cuidadosamente escavar o intestino usando cotonetes molhados, iniciando com o coecum e coloque-o sobre uma compressa de gaze grande embebida em solução de soro fisiológico estéril, ao lado da incisão (Figura 4-F).
- Embrulhe o intestino para a compressa de gaze e certifique-se que é umedecido com solução de soro fisiológico estéril (Figura 4).
- E expôr a artéria mesentérica superior.
- Dissecar a artéria mesentérica superior com dois self-made romba 'Schwabl'-ganchos: Levante a artéria com o primeiro gancho e tentar colocar um segundo através do túnel de tecido mesmo. Expor a artéria mesentérica superior ao longo de uma distância de 5 mm para garantir que a sonda de fluxo (1 mm) pode ser colocada em torno dele (Figura 4 H-K).
Nota: Se preferir, um fórceps de amplo ponto de ângulo de 45° precisão pode ser usado para levantar a artéria também. 'Schwabl'-ganchos são preparadas com cânulas de 30g com pontas quebradas sem rodeios inclinou-se para uma forma de gancho. Se das artérias colaterais são extensas, o 'Schwabl'-ganchos podem ser mais seguros como sangramentos de cauções enquanto dissecando a artéria mesentérica superior pode ser evitado. Se o sangramento ocorre durante a preparação da artéria mesentérica superior, coloque uma compressa de gaze pequeno no site do sangramento por 1 – 2 minutos com pressão suave. Pequeno sangramento geralmente para rapidamente; tenha sempre em mente para umedecer o tecido periodicamente (etapa 1,12). Se a artéria mesentérica superior em si é prejudicada, as avaliações de hemodinâmicas devem ser finalizadas. - Aplicar o gel de ultra-som para sensor da sonda de fluxo ultra-sônico e anexá-lo à artéria mesentérica esplâncnico. Alinhá-lo para a rota natural da artéria mesentérica superior (Figura 4L-M).
- Fechar a sonda de fluxo (1 mm) e se necessário suavemente aplique o gel de ultra-som adicionais no Doppler sensor para melhorar a qualidade do sinal. Fazê-lo usando uma seringa (20 mL), preenchida com gel de ultra-som e uma cânula de ponta romba (18 G) (Figura 4N-O).
Nota: Se a sonda de fluxo não estiver bem alinhada ao longo do curso natural da embarcação, tensão pode causar constrição vascular e, portanto, fluxo turbulento, o que reduz a precisão das medidas do fluxo. Tente re-alinhar a direção da sonda fluxo ao longo da rota natural do navio e depois suficientemente fixar a sonda de fluxo na posição apropriada. - Medir a SMABF e avaliar a conformidade do sinal de fluxo pulsátil para os picos de pressão sistólico da artéria femoral gravação.
Nota: Se os valores registrados mapa são muito baixos, mas o sinal é bom e fluxo pulsátil é detectado no cateter, verifique o nível de anestesia e potencialmente reduzir o nível de anestesia. Não pare completamente isoflurano anestesia, já que isso pode levar a profundidade insuficiente de anestesia de acordo com o bem-estar dos animal e das boas práticas científicas. - Encontrar uma posição estável da sonda fluxo (1 mm) e fixar o cabo da sonda de fluxo. Começa a gravar o SMABF sem outra manipulação da sonda fluxo (1 mm) (Figura 4 P.).
4. PVBF
- E expôr a veia porta na face dorsal do mesentério que está perto do hilo hepático (Figura 5A).
- Dissecar cuidadosamente a veia porta no tecido circundante, usando uma pinça de ampla ponto alta precisão ângulo de 45°: isolar a veia porta empurrando suavemente e repetidamente a pinça sob a veia porta para criar um túnel de tecido (Figura 5B).
Nota: Se um sangramento ocorre no tecido periportal enquanto prepara a veia porta, aplicar pressão suave no local de sangramento por 1-2 min utilizando um cotonete; isso muitas vezes interrompe o sangramento. - Alargue o túnel abrindo a pinça de amplo ponto de ângulo de 45° alta precisão lentamente e expor a veia porta ao longo de uma distância de 5 a 6 mm para permitir a colocação da sonda fluxo perivascular (2 mm) (Figura 5, D).
- Aplicar o gel de ultra-som para sensor da sonda de fluxo ultra-sônico e anexá-lo para a veia porta, alinhada com sua rota natural (Figura 5E).
- Fechar a sonda de fluxo (2 mm) e aplicar o gel de ultra-som adicionais se necessário, como descrito anteriormente (passo 3.7) (Figura 5F).
- Certifique-se que a sonda de fluxo é colocada em uma maneira non-constritiva em torno da veia porta (Figura 5).
Nota: Se a sonda de fluxo não estiver bem alinhada ao longo do curso natural da embarcação, tensão pode causar constrição vascular e, portanto, fluxo turbulento, o que reduz a precisão das medidas do fluxo. Tente re-alinhar a direção da sonda fluxo ao longo da rota natural do navio e depois suficientemente fixar a sonda de fluxo na posição apropriada. - Encontrar uma posição estável da sonda fluxo (2 mm) e fixar o cabo da sonda de fluxo. Em seguida, inicie a gravação do PVBF (Figura 5 H).
Nota: Se os valores registrados mapa são muito baixos, mas o sinal é bom e fluxo pulsátil é detectado no cateter, verifique o nível de anestesia e potencialmente reduzir o nível de anestesia. Não pare completamente isoflurano anestesia, já que isso pode levar a profundidade insuficiente de anestesia de acordo com o bem-estar dos animal e das boas práticas científicas.
5. PP
- Preparar um cateter (PE-50 para as veias mesentéricas rato) com uma inclinada (cerca de 45°) ponta de corte que é lavada com solução de soro fisiológico estéril (seringa de 5 mL e cânula romba de 23 G). Preste atenção que não há bolhas de ar estão dentro do cateter como que obstruam a leitura PP (figura 6A).
- Lidar com o intestino com luvas molhadas e lugar que dispersa através dos dedos (Figura 6B).
- Otimize a vista da cama vascular mesentérica perto do intestino delgado (Figura 6).
- Identifica os vasos mesentéricos venosos principais levando a veia porta (veia ileocolica - superior de veia mesenterica - vena portae).
- Encontre uma adequado junção da veia ileocolonic acessível para cateterização.
- Primeiro enfiar o cateter no tecido mesentérico por perfura o peritônio visceral do mesentério perto de junção vascular escolhida por cateterismo.
- Avance cuidadosamente a ponta inclinada do cateter mais perto para uma junção da veia ileocólica até uma ligeira impressão da junção navio é vista (Figura 6).
- Finalmente, cateterismo sistema venoso em consonância com a rota de navio a junção por perfurar a parede vascular para o ângulo de cruzamento dos vasos. (Figura 6E).
Nota: Se o sangramento ocorre na cateterização da veia ileocólica, usando um polegar pressione com uma compressa de gaze pequena na área de sangramento. Esta pressão deve ser mantida por 1 – 2 min parar o sangramento. Depois, tente inserir o cateter em uma filial mais proximal da veia ileocólica. - Avance o cateter mais cuidadosamente ao longo da rota principal vaso venoso para a veia porta sem perfurar a veia (Figura 6F).
Nota: Mantenha o cateter a uma distância suficiente para a sonda de fluxo colocada ao redor do ramo principal da veia porta para evitar artefatos no sinal de fluxo e para evitar a perfuração da veia portal. - Conecte o cateter preenchido com solução salina fisiológica para o transdutor de pressão, evitando a formação de bolhas de ar.
- Começa a gravar o PP.
- Registre todos os parâmetros hemodinâmicos simultaneamente em condições estáveis durante vários minutos (Figura 6, H). Opcionalmente, o cateter venoso portal pode ser fixado no lugar usando cola de tecido e os intestinos podem ser re-localizados na cavidade abdominal.
Nota: Se os valores registrados mapa são muito baixos, mas o sinal é bom e fluxo pulsátil é detectado no cateter, verifique o nível de anestesia e potencialmente reduzir o nível de anestesia. Não pare completamente isoflurano anestesia, já que isso pode levar a profundidade insuficiente de anestesia de acordo com o bem-estar dos animal e das boas práticas científicas.
6. IHVR
- Após sacrificar o animal, medir o peso do fígado. Calcular o IHVR: IHVR = PVBF/PP. normalizar esse valor PVBF para o peso do fígado.
Resultados
Dependendo do modelo animal e da gravidade da doença hepática, o grau de PHT e severidade da síndrome de hipertensão portal são diferente (Figura 7).
O modelo BDL causa Cirrose biliar devido a colestase. Por conseguinte, PP aumenta com o tempo e uma hiperdinâmica circulação desenvolve-se, como visto por um aumento de RH e diminuição do mapa. Em animais de cirrose, SMABF, PVBF e IHVR também aumentam respondendo às alterações hemodinâmicas e hepáticas (Figura 7A–F).
Em contraste, CPPV provoca PHT prehepatic, não-cirrose, que é caracterizado por um aumento imediato em PP e correspondentes alterações na hemodinâmica sistêmica (Figura 7-eu). No entanto, durante o curso de tempo transjugular cauções desenvolvem que podem baixar o PP.
Os valores hemodinâmicos de animais operação permanecem em níveis fisiológicos e não mudam significativamente ao longo do tempo. A pressão portal em animais saudáveis SO é no máximo 5 a 6 mmHg (figura 7J-L).

Figura 1: dispositivos de intubação self-made: (A) tubo endotraqueal. (B) guia de fio mesa de intubação do dispositivo (C). (D) tubo conectado ao dispositivo de fio de guia. Clique aqui para ver uma versão maior desta figura.

Figura 2: preparações pré-cirúrgicas: (A) intubação do animal. (B) Intramuscular e subcutânea para anestesia. (C) fixação do animal na esteira de aquecimento. (D) colocação e fixação de sonda de temperatura retal. Clique aqui para ver uma versão maior desta figura.

Figura 3: frequência cardíaca (FC) e Pressão Arterial média (mapa): (A) incisão de pele. (B) preparação da femoral vascular e estruturas nervosas. (C–F) Dissecação da artéria femoral. (G) Distal sutura e fixação - proximal pre-nó sutura proximal. (H) preparação do cateter femoral. (eu) colocação da mordaça micro vascular. (J) perfuração da artéria femoral, com uma agulha curva. (K) cateterismo da artéria femoral. (L) abertura da pinça micro para avaliação do pulso. (M) a fixação Proximal do cateter. (N) fixação Distal do cateter. (O) medição de mapa e HR (P), abrangendo o campo cirúrgico com gaze embebida de pequeno comprimir. Clique aqui para ver uma versão maior desta figura.

Figura 4: fluxo de sangue Arterial mesentérica Superior (SMABF): (–C) Laparotomia mediana. (D) a escavação de coecum. (E–F) Escavação do intestino. (G) envolvimento dos intestinos em compressa de gaze embebida. (H–K) Preparação da artéria mesentérica esplâncnico, com ganchos de cânula romba. (L, M) Fixação da sonda fluxo. (N) aplicação do ultra-som gel sobre o sensor de sonda de fluxo. (O) 'não-constritiva' colocação da da sonda fluxo. (P) medida de SMABF. Clique aqui para ver uma versão maior desta figura.
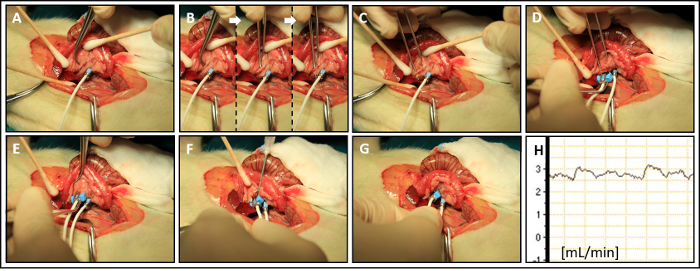
Figura 5: fluxo de sangue venoso Portal (PVBF): (A) otimizado dorsal Ver os na veia porta (B) dissecação da veia portal de tecido adiposo mesentérico. (C) a criação de um túnel de tecido para a sonda de fluxo da veia porta. (D, E) Fixação da sonda fluxo veia porta. (F) aplicação do ultra-som gel sobre o sensor de sonda de fluxo. (G) 'não-constritiva' correto posicionamento da sonda fluxo. (H) medição de PVBF. Clique aqui para ver uma versão maior desta figura.

Figura 6: pressão Portal (PP): (A) preparação do cateter. (B) preparação dos intestinos. (C) otimizado Ver os na vasculatura mesentérica venosa principal. (D) perfuração do peritônio visceral e avanço do ramo vascular mais perto de apropriado de cateter. (E) a cateterização da veia ileocólica ângulo de junção entre o ramo principal e um ramo. (F) avanço da ponta do cateter na veia portal mais próximo ao Hilo hepático. (G, H) Medição de PP. clique aqui para ver uma versão maior desta figura.
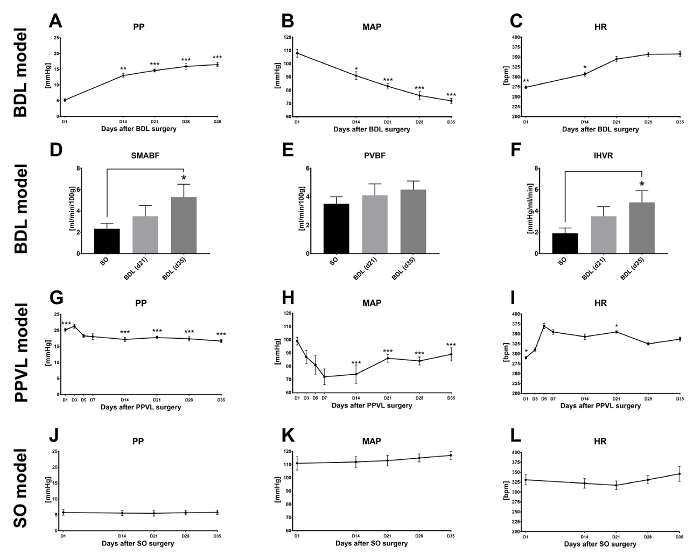
Figura 7: resultados do representante: Tempo de curso do (A) PP, mapa (B) e (C) HR em ratos BDL. Nesse sentido, são observadas alterações na SMABF (D), PVBF (E) e (F) IHVR. No CPPV, alterações hemodinâmicas de PP (G), mapa (H) e (eu) HR são mais pronunciadas nos primeiros dias após a cirurgia. Em saudável operação (então) animais, PP (J), (K) mapa e HR (L) permanecem dentro dos valores fisiológicos e não mudam ao longo do tempo. Clique aqui para ver uma versão maior desta figura.
Discussão
PP é o resultado principal parâmetro para avaliação da síndrome de hipertensão portal e reflete a gravidade da cirrose subjacente. Tanto a deposição de matriz (ou seja, fibrose) e sinusoidal vasoconstrição (devido ao aumento da expressão hepática de vasoconstritores e diminuição da capacidade de resposta a vasodilatadores) causam aumento IHVR. A importância do PP e seu impacto na doença hepática crônica tem sido demonstrada em vários pré-clínicos11,12,13,14 e estudos clínicos15,16, 17 , 18. portanto, em pacientes com cirrose, o PP é um parâmetro de resultado difícil, e sua redução é recomendada pelo tratamento orientações19,20 e um objetivo principal da pesquisa de Hepatologia atual. Abrangente de modelos animais são necessários para caracterizar e traduzir as opções de tratamento romance de21 16,de PHT22. Este protocolo apresenta a metodologia necessária para uma detalhada caracterização hemodinâmica, incluindo a avaliação da pressão portal, circulação hiperdinâmica, vasodilatação esplâncnico e resistência intra-hepática. Para conseguir um representante e hemodinâmico completo conjunto de dados de modelos de roedores, experiência e formação do operador de desempenho é de extrema importância.
Prevenção e controle de hemorragias graves são competências-chave especial. Rude e precisas preparações das seções vasculares de interesse é fundamental para evitar falhas de canulação e hemorragias graves. Perda de sangue significativa tem um impacto sobre a hemodinâmica e impede as medidas exatas de PP ou pode até resultar em morte do animal de laboratório. Hemorragias de documento que ocorreram durante as medições nos protocolos e caracterizam a severidade e a localização do sangramento.
Digno de nota, usar sondas de fluxo perivascular ultra-som para avaliar o fluxo de sangue gera apenas uma aproximação e pode ser sujeitos a erros, devido a embarcação de diferentes tamanhos e alinhamento incorreto da sonda de leitura. Outra técnica para medir o fluxo de sangue e especialmente com a distribuição de fluxo sanguíneo (incluindo o cálculo de transjugular "manobras") é a técnica de microesfera coloridas23. No entanto, órgãos inteiros devem ser colhidos, dissolvidos e analisados, e isto omite a possibilidade de realizar histológica ou análise de expressão. Daí, a técnica de ultra-som apoia os princípios de 'Os três Rs' em pesquisas com animais (reduzir, refinar e substituir) por Russel e Burch24. Além disso, sondas de fluxo são adequadas para monitorar o fluxo de sangue esplâncnico em tempo real e paralelo a outros parâmetros hemodinâmicos, enquanto a técnica de microesfera coloridas requer integrar órgão (sangue mesentérico) fluxo ao longo do tempo. Além disso, colorido microesferas, que geralmente têm um diâmetro de 15 µm, exigem uma distribuição normal de micronavios com um diâmetro < 15 µm nos respectivos órgãos para evitar tornar-se presa e imóvel, que pode não ser o caso em fígados de cirrose.
A principal limitação deste método é a necessidade de um estado de inconsciência e anestesia durante a caracterização hemodinâmica da síndrome PHT em animais. A injeção mais comum e amplamente utilizado anestesia cetamina/xilazina muitas vezes requer redosing após 30-45 min para obter a profundidade necessária de anestesia25,,26; Isso adiciona pressão de tempo, especialmente se houver necessidade de solução de problemas. Usar anestesia por inalação envolve muitas vantagens, mas equipamento especial é exigido e anestésicos relacionados a volátil de segurança regulamentos devem ser seguidos. A profundidade da anestesia pode ser rapidamente adaptada sem interferir com os procedimentos de cirurgia, ajustando a concentração de anestesia. O tubo endotraqueal protege as vias respiratórias especialmente após ativação da salvação por cetamina e a ventilação garante suficiente oxigenação e ventilação do animal para reduzir o risco de morte induzida por anestesia27. Enquanto xilazina/cetamina é ainda amplamente usado, baixa dose de isoflurano anestesia faz com que nenhuma alteração significativa dos parâmetros hemodinâmicos ou cardiovasculares em ratos28,29.
Regulamentos e experiência local fornecem stateoftheart recomendações e melhores práticas da anestesia e os pesquisadores continuamente devem reconsiderar o tipo de anestesia utilizada para realizar essas avaliações hemodinâmicas30. Experiências futuras podem usar telemetria com transdutores de pressão sem fio implantado que vão superar a atual anestesia relacionados a geral de limitações e permitir a caracterização hemodinâmica dos animais conscientes.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a médicos veterinários, enfermeiros e criadores de animais no centro de investigação biomédica por seu apoio contínuo durante nossos projetos de pesquisa. Os autores reconhecem a importante contribuição de todos os comentadores do presente protocolo. Algumas das pesquisas foi financiado pelo "prêmio Young ciência" da sociedade austríaca de Gastroenterologia e Hepatologia (ÖGGH) para o PS e o "Skoda Award" da sociedade austríaca de medicina interna para TR.
Materiais
| Name | Company | Catalog Number | Comments |
| Instruments | |||
| LabChart 7 Pro software | ADInstruments, Colorado Springs, CO, USA | - | Software |
| ML870 PowerLab 8/30 | ADInstruments, Colorado Springs, CO, USA | - | Electronic multichannel recorder |
| MLT0380/D | ADInstruments, Colorado Springs, CO, USA | - | Pressure transducer (x2: for Portal Pressure and Arterial Pressure) |
| ML112 Quad Bridge Amplifier | ADInstruments, Colorado Springs, CO, USA | - | Bridge amplifier |
| TS420 | Transonic Systems Inc., Ithaca, NY, USA | - | Flowmeter module |
| Biological Research Apparatus 7025 | UGO BASILE S.R.L., Comerio, Italy | - | Ventilator |
| Vapor 2000 | Dräger Medical AG & Co. KG, Lübeck, Germany | - | Isofluran Vaporizer |
| Perivascular probes (rat) for Transonic systems (Superior Mesenteric Artery) | Transonic Systems Inc., Ithaca, NY, USA | #MA1PRB | Ultrasonic flow probe (1mm) |
| Perivascular probes (rat) for Transonic systems (Portal Vein) | Transonic Systems Inc., Ithaca, NY, USA | #MA2PSB | Ultrasonic flow probe (2mm) |
| 1st for intubation & 2nd for clean skin incisions | - | - | Mayo scissor [x2] |
| Metzenbaum scissor | - | - | - |
| Cuticle scissor | - | - | - |
| e.g. Adson Brown tissue forceps | - | - | Tissue Forceps |
| High precision 45° angle broad point forceps [x2] | - | - | - |
| Hemostat [x4] | - | - | - |
| e.g. Mikulicz peritoneal clamp | - | - | Curved clamp |
| e.g. Dieffenbach clamp | - | - | Micro clamp |
| e.g. micro spatula with flat ends, width 4 mm, | - | - | Micro metal spatula |
| for transbuccal suture at intubation | - | - | Needle holder |
| Scalpel grip | - | - | - |
| selfmade | - | - | Intubation desk |
| blut, flexible and with a suitable diameter for arterial cannula and venflow | - | - | Blunt steel wire |
| modified arterial line 20G with Flowstich | Becton Dickinson, Farady Road, Swindon, UK | #682245 | Arterial line |
| Heating pad | - | - | - |
| Rectal temerature probe | - | - | - |
| Saline heater | - | - | - |
| Laryngoscope (specific for animal size, e.g. rat) | - | - | - |
| Inductionbox for inhalation anesthesia | - | - | - |
| Scale (able to measure mg) | - | - | - |
| Hair clipper | - | - | - |
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| e.g. modified BD Venflon Pro Safety 14GA | Becton Dickinson Infusion Therapy, AB, SE251 06 Helsingborg, Sweden | #393230 | Peripheral venous catheter (14G) |
| Fine-Bore Polyethylene Tubing, ID 0.58mm, OD 0.96mm, Portex, | Smiths Medical International Ltd., Kent, UK | #800/100/200 | Catheter tube (PE-50) |
| e.g. Omnifix-F Solo | B. Braun Melsungen AG, Melsungen, Germany | #9161406V | Syringe 1mL |
| e.g. Injekt Solo | B. Braun Melsungen AG, Melsungen, Germany | #4606051V | Syringe 5mL |
| e.g. Injekt Solo | B. Braun Melsungen AG, Melsungen, Germany | #4606205V | Syringe 20mL |
| e.g. BD Microlance 3, 18G - 1 1/2" | Becton Dickinson S.A., Fraga, Spain | #304622 | Cannula (18G) |
| e.g. BD Microlance 3, 23G - 1" | Becton Dickinson S.A., Fraga, Spain | #300800 | Cannula (23G) |
| e.g. BD Microlance 3, 30G - 1/2" | Becton Dickinson S.A., Fraga, Spain | #304000 | Cannula (30G) |
| e.g. Leukoplast S | BSN medical GmbH, Hamburg, Germany | #47619-00 | Adhesive tape |
| e.g. Gazin RK Mullkompressen (18x8cm) | Lohmann & Rauscher, Vienna, Austria | #10972 | Gauze compress (small) |
| e.g. Gazin RK Mullkompressen (5x5cm) | Lohmann & Rauscher, Vienna, Austria | #10961 | Gauze compress (big) |
| Silk Braided black, USP 4/0, EP 1.5 | SMI AG, St. Vith, Belgium | #2021-04 | Suture (Silk 4/0, EP 1.5) |
| e.g. Mersilk, 2-0 (3 Ph. Eur.), PS-1 Prime | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Germany | #EH7552 | Transbuccal suture |
| e.g. Cottonbuds (2.2mm, 15cm) | Paul Hartmann AG, Heidenheim, Germany | #967936 | Cotton buds |
| e.g. Vue Ultrasoundgel | Optimum Medical Limited, UK | #1157 | Ultrasound gel |
| e.g. Glubran 2 | Gem srl, Viareggio, Italy | #G-NB2-50 | Tissue glue |
| e.g. Surgical scalpell knife Nr. 10 - carbon steel | Swann-Morton, England, B.S. | #202 | Scalpel Knife |
| Heparin, 5000 i.E./mL (Natriumheparin) | Medicamentum Pharma GmbH, Allerheiligen im Mürztal, Austria | - | Heparin |
| Florane | Aesica Queenborough Ltd., Queenborough, UK | - | Isoflurane |
| OeloVital (5g) | Fresenius Kabi Austira Gmbh, Graz, Austria | - | Eye gel |
| Ketasol | aniMedica GmbH, Senden-Bösensell, Germany | - | Ketamine |
| Rompun | Bayer Austria Ges.m.b.H., Vienna, Austria | - | Xylazine |
| Xylocain 10% Pumpspray | AstraZeneca Österreich GmbH, Vienna, Austria | - | Lidocaine pump spray |
| Dipidolor | Jansen-Cilag Pharma GmbH, Vienna, Austria | - | Piritramide |
| NaCl 0.9% Fresenius, 1L | Fresenius Kabi Austira GmbH, Graz, Austria | #13LIP132 | Physiological saline solution |
Referências
- Ripoll, C., et al. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology. 133 (2), 481-488 (2007).
- Bosch, J., Groszmann, R. J., Shah, V. H. Evolution in the understanding of the pathophysiological basis of portal hypertension: How changes in paradigm are leading to successful new treatments. J Hepatol. 62, S121-S130 (2015).
- Blachier, M., Leleu, H., Peck-Radosavljevic, M., Valla, D. C., Roudot-Thoraval, F. The burden of liver disease in Europe: a review of available epidemiological data. J Hepatol. 58 (3), 593-608 (2013).
- Colle, I., Geerts, A. M., Van Steenkiste, C., Van Vlierberghe, H. Hemodynamic Changes in Splanchnic Blood Vessels in Portal Hypertension. Advances in Integrative Anatomy and Evolutionary Biology. 291 (6), 699-713 (2008).
- Laleman, W., Van Landeghem, L., Wilmer, A., Fevery, J., Nevens, F. Portal hypertension: from pathophysiology to clinical practice. Liver International. 25 (6), 1079-1090 (2005).
- Franchis, R. d Updating Consensus in Portal Hypertension: Report of the Baveno III Consensus Workshop on definitions, methodology and therapeutic strategies in portal hypertension. Journal of Hepatology. 33 (5), 846-852 (2000).
- Zardi, E. M., Di Matteo, F. M., Pacella, C. M., Sanyal, A. J. Invasive and non-invasive techniques for detecting portal hypertension and predicting variceral bleeding in cirrhosis: a review. Annals of medicine. 46 (1), 8-17 (2014).
- Kumar, A., Sharma, P., Sarin, S. K. Hepatic venous pressure gradient measurement: time to learn. Indian J Gastroenterol. 27 (2), 74-80 (2008).
- Tsochatzis, E. A., Bosch, J., Burroughs, A. K. Liver cirrhosis. Lancet. 383 (9930), 1749-1761 (2014).
- Abraldes, J. G., Pasarín, M., García-Pagán, J. C. Animal models of portal hypertension. World Journal of Gastroenterology : WJG. 12 (41), 6577-6584 (2006).
- Reiberger, T., et al. Sorafenib attenuates the portal hypertensive syndrome in partial portal vein ligated rats. Journal of Hepatology. 51 (5), 865-873 (2009).
- Schwabl, P., et al. Pioglitazone decreases portosystemic shunting by modulating inflammation and angiogenesis in cirrhotic and non-cirrhotic portal hypertensive rats. Journal of Hepatology. 60 (6), 1135-1142 (2014).
- Reiberger, T., et al. Nebivolol treatment increases splanchnic blood flow and portal pressure in cirrhotic rats via modulation of nitric oxide signalling. Liver International. 33 (4), 561-568 (2013).
- Schwabl, P., et al. The FXR agonist PX20606 ameliorates portal hypertension by targeting vascular remodelling and sinusoidal dysfunction. Journal of Hepatology. 66 (4), 724-733 (2017).
- Mandorfer, M., et al. Sustained virologic response to interferon-free therapies ameliorates HCV-induced portal hypertension. J Hepatol. 65 (4), 692-699 (2016).
- Schwabl, P., et al. Interferon-free regimens improve portal hypertension and histological necroinflammation in HIV/HCV patients with advanced liver disease. Aliment Pharmacol Ther. 45 (1), 139-149 (2017).
- Reiberger, T., Mandorfer, M. Beta adrenergic blockade and decompensated cirrhosis. Journal of Hepatology. 66 (4), 849-859 (2017).
- Reiberger, T., et al. Carvedilol for primary prophylaxis of variceal bleeding in cirrhotic patients with haemodynamic non-response to propranolol. Gut. 62 (11), 1634-1641 (2013).
- Reiberger, T., et al. Austrian consensus guidelines on the management and treatment of portal hypertension (Billroth III). Wiener klinische Wochenschrift. 129 (3), 135-158 (2017).
- de Franchis, R. Expanding consensus in portal hypertension. Journal of Hepatology. 63 (3), 743-752 (2015).
- Pinter, M., et al. The effects of sorafenib on the portal hypertensive syndrome in patients with liver cirrhosis and hepatocellular carcinoma - a pilot study. Alimentary Pharmacology & Therapeutics. 35 (1), 83-91 (2012).
- Schwabl, P., Laleman, W. Novel treatment options for portal hypertension. Gastroenterol Rep (Oxf). 5 (2), 90-103 (2017).
- Klein, S., Schierwagen, R., Uschner, F., Trebicka, J. Mouse and Rat Models of Induction of Hepatic Fibrosis and Assessment of Portal Hypertension. , (2017).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , (1959).
- Langhans, W., Myrtha, A., Riediger, T., Lutz, T. A. Routine animal use procedures. , Institute of Veterinary Physiology, University of Zurich, Physiology and Behavior Laboratory, Institute of Food, Nutrition and Health, ETH Zurich. (2016).
- Animal Care and Use Program. Rat and Mouse anesthesia and analgesia: Formulary and General Drug Information. , The University of British Columbia. (2016).
- Davis, J. A. Current Protocols in Neuroscience. , John Wiley & Sons, Inc. (2001).
- Albrecht, M., Henke, J., Tacke, S., Markert, M., Guth, B. Effects of isoflurane, ketamine-xylazine and a combination of medetomidine, midazolam and fentanyl on physiological variables continuously measured by telemetry in Wistar rats. BMC Veterinary Research. 10 (1), 198(2014).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Laboratory Animals. 48 (1), 6-14 (2014).
- Becker, K., et al. Statement on anesthesia methodologies: Recommondations on anaesthesia methodologies for animal experimentation in rodents and rabbits. , GV-SOLAS - German veterinary association for animal welfare. (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados