Method Article
In Vitro e In Vivo de abordagens para determinar a permeabilidade da célula epitelial Intestinal
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui são apresentados dois métodos para determinar a função de barreira intestinal. Um medidor epitelial (volts/ohms) é usado para a medição da resistência elétrica transepitelial de epitélios cultivadas diretamente nos poços de cultura de tecidos. Nos ratos, o método de gavage FITC-dextrano é usado para determinar a permeabilidade intestinal na vivo.
Resumo
A barreira intestinal defende contra microorganismos patogênicos e toxinas microbianas. Sua função é regulada pela célula epitelial integridade e permeabilidade da junção apertada, e perturbações da função de barreira intestinal contribuem para a progressão da doença sistêmica e gastrointestinal. Dois métodos simples são descritos aqui para medir a permeabilidade do epitélio intestinal. In vitro, células Caco-2BBe são banhadas em poços de cultura de tecidos como uma monocamada e resistência elétrica transepitelial (TER) pode ser medida por um medidor de epiteliais (volts/ohms). Este método é convincente devido à sua operação user-friendly e repetibilidade. Os ratos in vivo são gavaged com 4 kDa isotiocianato de fluoresceína (FITC)-dextrano e as concentrações de FITC-dextrano são medidos em amostras de soro coletadas de ratos para determinar a permeabilidade epitelial. Gavagem oral fornece uma dose exata e, portanto, é o método preferido para medir a permeabilidade intestinal na vivo. Tomados em conjunto, estes dois métodos podem medir a permeabilidade do epitélio intestinal em vitro e em vivoe, portanto, ser usados para estudar a conexão entre as doenças e a função de barreira.
Introdução
Células epiteliais intestinais não são apenas responsáveis pela absorção de nutrientes, mas também formam uma barreira importante para a defesa contra microorganismos patogênicos e toxinas microbianas. Esta função de barreira intestinal é regulada pela junção apertada permeabilidade e células epiteliais integridade1,2,3, e disfunção da função de barreira epitelial está associada com inflamação intestinal doença (IBD). O anel de actomyosin de perijunctional (PAMR) encontra-se dentro da célula que é estreitamente contígua às junções apertadas. A contração da PAMR, que é regulada pela cadeia leve da miosina (MLC), é crucial para a regulação da junção apertada permeabilidade4,5,6,7,8, 9,10. Fator de necrose tumoral (TNF) é fundamental para a perda da barreira intestinal por estrogenos intestinal epitelial MLC quinase (houve) expressão e induzir a interiorização occludin11,12,13.
Íons como Cl– e at+ pode cruzar o espaço de paracellular pelos poros ou vazamento via14. Em um "vazamento" epitélio, alterações em TER principalmente refletem permeabilidade alterada junção apertada. Medição de TER é uma abordagem eletrofisiológica comumente usada para quantificar a permeabilidade de junção apertada, principalmente para at+ e Cl-, baseada-se a impedância de monocamadas de células. Tipos de diversas células, incluindo células epiteliais intestinais, células epiteliais pulmonares e vascular em células endoteliais, foram relatados para TER medições. As vantagens desse método são que TER medições são não-invasivo e podem ser usadas para monitorar as células vivas em tempo real. Além disso, a técnica de medição de TER é útil para de estudos de toxicidade de drogas15.
Caco-2BBe são células de adenocarcinoma colorretal epitelial humana com uma estrutura e função semelhante a pequenas células epiteliais intestinais diferenciadas: por exemplo, estas células têm microvilli e enzimas associadas com pequena escova intestinal fronteira. Portanto, monocamadas de Caco-2BBe cultivadas são utilizadas como um modelo in vitro para testar a função de barreira.
Em camundongos, uma forma de estudar a permeabilidade intestinal paracellular é medindo-se a capacidade do FITC-dextran cruzar do lúmen para o sangue. Assim, a permeabilidade intestinal pode ser avaliada por gavaging FITC-dextrano diretamente em ratos e medir a fluorescência dentro o sangue. O seguinte protocolo descreve dois métodos simples para avaliar a permeabilidade do epitélio intestinal tanto in vitro e in vivo.
Protocolo
Este estudo foi aprovado pelo cuidado Animal e usar protocolo de Cambridge-Suda Genomic Resource Center (CAM-SU), Universidade de Soochow.
1. chapeamento e manutenção de Caco-2bbe na membrana porosa de policarbonato
- Desenvolvem-se células em balão T75 mídia (DMEM contendo 10% FBS). Frascos devem ser alimentados regularmente, dependendo da densidade da célula.
Nota: Para o chapeamento ideal, células devem dividir rapidamente e têm uma forma plana "frito-ovo", que indica que as células estão em fase de crescimento. - Uma vez que as células são 80% de confluencia, pegue o frasco fora da incubadora e remova a mídia. Enxague qualquer mídia residual com 1 a 2 mL de PBS estéril (sem o Ca2 +). Pipetar 1,5 mL do Trypsin-EDTA para o balão e suavemente agitar o frasco; em seguida, coloque o frasco na incubadora 37 ° C por 20 min sem balanço.
- Enquanto as células são trypsinizing, lugar insere contendo membranas porosas policarbonato (tamanho do pore, 0,4 µm; área de superfície, 0,33 cm2; ver Tabela de materiais) em placas de 24 poços. Adicione 1,0 mL de meio de cultura na câmara basal (o espaço inferior da membrana).
- Pipetar 5 mL de mídia para o balão e vigorosamente Pipetar as células contra o lado do balão de 5 - 10 vezes atingir células individuais, soltas ou 2-3 célula agrupa.
-
Placa de 0,166 mL de células (alcançar uma diluição de 1:8) na câmara apical (o espaço superior da membrana). Incube a 37 ° C por até 3 semanas.
- Alimente as células três vezes semanalmente aspirando cuidadosamente a mídia do compartimento basal de cada poço usando uma bomba de pressão. Delicadamente, gotejamento 1ml de mídia na câmara apical de cada inserção.
2. uso de medidor epitelial (volts/ohms) para medir a TER
Nota: Após cerca de 3 semanas de cultura nas membranas de policarbonato, células Caco-2BBe estão prontas para TER medição.
- Para estudos de citocina, um dia antes da medição, substitua a mídia basal com mídia contendo 10 ng/mL de relato. No dia do experimento, substitua a mídia com HBSS contendo 2,5 ou 7,5 ng/mL de TNF.
Nota: Tratamento de relato aumenta a expressão de receptores TNF 2 (TNFR2)16. - Para corrigir o medidor, insira o eléctrodo de correção na porta de entrada e escolher o modo "Ohm". Ajuste o parafuso Adj R com uma chave de fenda até que o medidor mostra uma leitura de 1.000 Ω.
- Esterilizar os eléctrodos, colocando-os em etanol a 70% por 15-30 min e depois deixe-os secar ao ar para 15 s. Enxágue o eléctrodo em meios de cultura a célula experimental.
- Ligue a alimentação e escolher o modo "Ohm". Coloque cuidadosamente as extremidades longas das pontes eletrodo na câmara de basal e as extremidades curtas na câmara apical. Certifique-se de que os eléctrodos mais tocarem no fundo do prato, mantendo-se os eléctrodos menores abaixo da superfície da mídia mas acima as inserções de cultura de tecidos. Manter os eletrodos verticais.
- Medir a resistência da amostra inserções e inserções em branco (ou seja, a cultura insere sem células mas com HBSS) em 0, 1, 2, 3, 4 h após o tratamento de citocina. Registro da resistência.
- Para obter consistência em formatos diferentes de placa, calcule o produto da resistência e da área de membrana eficaz:
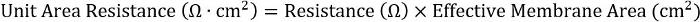
Para inserções de 24-bem, a área de membrana eficaz é 0,33 cm2.
3. modelo murino de dextrano sulfato de sódio (DSS)-induzida colite
- Adicione DSS para água esterilizada para uma concentração final de 3,5% (wt/vol).
- Administrar 3,5% DSS para camundongos C57BL/6 machos de 8 semanas para um total de 7 dias. Dar água potável normal sem DSS aos ratos controle.
- Mude a água contendo DSS para regular de água potável após dia 7.
- Pesar de ratos e avaliar resultados clínicos de cada mouse todos os dias. Normalize o peso corporal de cada rato para seu peso corporal inicial. Pontuações são definidas de acordo com a severidade da doença por quatro parâmetros: prolapso retal (0-2), consistência de fezes (0-2), hemorragia (0-2) e atividade (0-2)5. Soma as pontuações desses parâmetros para um escore clínico final.
- Para analisar a condição histopatológica do tecido do cólon, eutanásia em ratos pela injeção intraperitoneal (i.p.), com 1,2% (vol/vol) tratamento do Avertin (0,6 mL/10 g de massa corporal) 7 dias post-DSS. Para preparar um estoque de 100% avertin, misture 10 g de 2, 2,2-tribromoetanol com 10 ml de álcool terc-Amil. Armazenar no escuro a 4° C. Para usar, dilua o estoque de 100% para 2% em água.
- Isolar o cólon e o ceco e meça o comprimento do cólon5.
- Corte segmentos de 0,5 cm do cólon distal e correção em um tubo falcon de 15 mL contendo 10 mL de formol a 10% durante a noite. Lavar os tecidos fixos com classificados etanol (75, 95 e 100%) e xileno. Incorporar os tecidos em parafina e cortar seções de 6 mm para a hematoxilina & eosina coloração8.
4. medir a permeabilidade de barreira epitelial em camundongos colite induzida por DSS
- Medir a permeabilidade de barreira 7 dias após o início da administração de DSS.
- No dia do ensaio, rápido ratos para 3h.
- Autoclave a gavagem agulha para garantir a esterilidade, então gavage ratos com 150 µ l 80 mg/mL 4 kDa FITC-dextran em água estéril e manter o FITC-dextran não utilizado para medir a curva padrão após a coleta de soro. Pese os ratos para o cálculo da permeabilidade.
Nota: A solução de dextran-FITC deve ser feita em água. - Usando um par de tesouras, cortar um pedaço de 1 cm da cauda e coletar 100 µ l de sangue da cauda em tubos de colheita de soro. Gire o sangue coletado a 10.000 x g durante 10 minutos à temperatura ambiente.
- Dilua o soro 1:4 em água. Tornar-se um padrão curva, diluir FITC-dextran não utilizada com água a 1: 300, 1:1, 000, 1:3, 000, 01:10, 000, 01:30, 000, 1: 100, 000, 1: 300, 000, 1:1, 000, 000 e 1:3, 000, 000. Adicione 100 µ l/poço de soro e as amostras de curva padrão em placas de 96 poços.
- Lê a fluorescência em um leitor de placas com emissão de excitação/528 485. Calcular os valores de permeabilidade com base na curva padrão e multiplicar por 4 para corrigir a diluição.
- Divida a concentração de FITC-dextrano pelo peso para normalizar os valores (isso ajuda a normalizar a diferença na entrega FITC-dextran se ratos estão doentes e tem perdido peso).
Resultados
Na cultura, células Caco-2BBe crescem como uma monocamada em lentamente se diferenciar em enterócitos absorção maduros que têm fronteiras de escova. Neste protocolo, células Caco-2BBe foram revestidas com uma alta densidade nas membranas de policarbonato, e células alcançou a confluência de 100% um dia após a semeadura. No entanto, as células são indiferenciadas nesta fase: para diferenciar totalmente as células, a mídia é alterada a cada 2-3 dias por 3 semanas. As células foram coradas com núcleos e F-Actina manchas para mostrar as diferenças entre as células indiferenciadas e diferenciadas. Fibras de estresse são claramente vistas em células indiferenciadas. Em comparação com células indiferenciadas, células diferenciadas têm um volume menor, núcleos maiores e menos stress fibras (Figura 1).
TNF é central para a perda da barreira intestinal através de uma regulação dependente houve junção apertada. TER de células sem ou com tratamento de TNF em pontos diferentes do tempo foi analisado. Como mostrado na Figura 2, TNF diminui significativamente a TER da monocamada de Caco-2BBe de forma dose-dependente, sugerindo que o TNF aumenta permeabilidade epitelial.
Administração de DSS induz colite aguda em camundongos. Ratos tratados com DSS perdem peso significativamente em relação ao seu peso inicial (Figura 3A). A severidade da colite é marcada por prolapso retal, consistência de fezes, sangramento e atividade (Figura 3B). Secções transversais dos tecidos do cólon, corados com hematoxilina & eosina mostram danos na mucosa do cólon em ratos tratados de DSS (Figura 3). O comprimento da cripta do cólon é diminuído em camundongos tratados de DSS (Figura 3D). O comprimento do cólon é encurtado em camundongos tratados de DSS (Figura 3E). Como visto na Figura 3F, há aproximadamente um 2 vezes aumento nos níveis de FITC-dextran em camundongos DSS tratados em comparação comparados o controle de ratos.
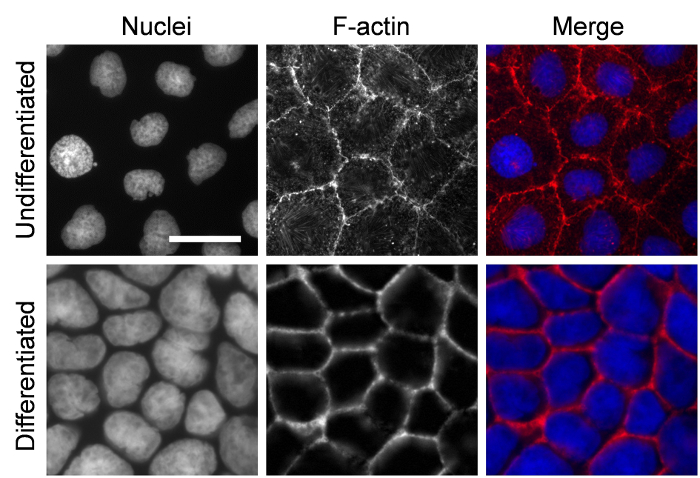
Figura 1: Caco-2BBe células cultivadas nas membranas de policarbonato. Células cultivadas 1 dia (indiferenciado) e 3 semanas (totalmente diferenciadas) após chapeamento estão manchadas com Hoechst 33342 (azul) para o núcleo e Alexa Fluor 594 faloidina para F-Actina (vermelho). Barra de escala = 20 µm. clique aqui para ver uma versão maior desta figura.

Figura 2: TNF reduz o TER da monocamada de Caco-2BBe. As células são aprontadas com 10 ng/mL de relato durante a noite. No dia seguinte, o meio de cultura é substituído com HBSS contendo 2,5 ou 7,5 ng/mL de TNF. TER é medido por um medidor epitelial (volts/ohms) nos pontos de tempo indicado. Os valores são média ± SEM, n = 4. Diferenças significativas são indicadas por * (p < 0,05) e * * (p < 0,01), em comparação com os valores de TER das células sem tratamento de TNF, por bicaudal t-teste. Clique aqui para ver uma versão maior desta figura.
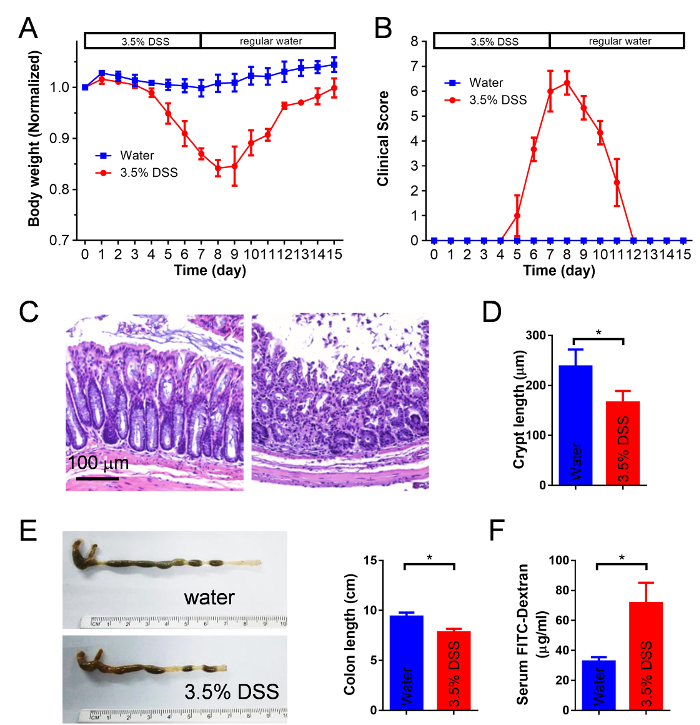
Figura 3: colite DSS-induzida em camundongos. Camundongos C57Bl/6 do sexo masculino são dadas 3,5% DSS em água potável durante 7 dias. Peso corporal (A) e escores clínicos (B) são avaliados diariamente para cada grupo (quer dizer SEM ±, n = 4 para cada grupo). Controle de ratos receberam água sem DSS. (C) a análise histológica de seções do tecido do cólon coletados no tratamento de dia 7 post – DSS. (D) cólon comprimentos cripta são medidos no tratamento de dia 7 post – DSS. (E) cólon comprimentos são medidos em tratamento de dia 7 post – DSS. (F) permeabilidade do epitélio do cólon é medida no tratamento de post-DSS 7 dia por gavagem FITC-dextrano. Os valores são média ± SEM, n = 4. Diferenças significativas são indicadas por * (p < 0.05 por bicaudal t-teste). Clique aqui para ver uma versão maior desta figura.
| Pontuação | Prolapso retal | Consistência de fezes | Sangramento | Atividade |
| 0 | Nenhum | Normal | Nenhum | Ativo |
| 1 | Sinal de prolapso | Suave | Vermelho | Diminuição da atividade |
| 2 | Prolapso de extensivo | Diarreia | Sangramento bruto | Letárgico |
Tabela 1. Escore clínico de doença
Discussão
Existem vários passos críticos no protocolo. Células caco-2BBe (fronteira de escova-expressando) sempre são utilizadas para medição de TER, seleccionada a partir da linhagem de células Caco-2 para expressão de proteínas de escova-fronteira. Caco-2BBe células têm um fenótipo de absorção das vilosidades quando totalmente diferenciadas (após cerca de 3 semanas de pós-confluência cultura)17. É necessário para evitar a contaminação durante a medição e para esterilizar o eletrodo. Porque o procedimento não-estéril, medições só podem ser realizadas por até 8 h na maioria dos casos. Durante a medição, determinamos o valor da resistência dos dois pontos dentro e fora da inserção. As medições de resistência em vários locais por vezes extremamente podem diferir devido às diferenças no estado de célula; Esta é uma grande limitação do método. No entanto, esta variação pode ser significativamente reduzida por métodos estatísticos e outros métodos. O método TER pode ser aplicado a outras células, tais como determinar a integridade da barreira de células epiteliais pulmonares e vascular em células endoteliais. Além disso, TER as medições podem ser usadas em estudos de toxicidade da droga.
Administração de macromoléculas indigestas, que insere o epitélio intestinal através da difusão, pode ser usada para avaliar a permeabilidade intestinal. A vantagem deste método é que a função de barreira do intestino pode ser examinado na vivo. Existem vários tipos de marcadores que podem ser usados, incluindo radioisótopos, Polietilenoglicóis e açúcares18. No entanto, vários fatores devem ser considerados para uma medição precisa da permeabilidade: (1) a posição de anormalidade de barreira do intestino não pode sempre ser precisamente determinada; e (2) o fluxo sanguíneo da mucosa e a motilidade gastrointestinal podem afetar a absorção e a excreção de macromoléculas.
Neste estudo, 4 kDa FITC-dextrano foi administrado intragastrically em camundongos e foi medida a quantidade de FITC-dextrano no soro do mouse. Este método tem várias vantagens. Gavagem oral reduz possíveis riscos que estão associados com o uso de clisteres. Por exemplo, a deficiência não intencional para o epitélio do cólon pode ser causada por instilação rectal, levando a um resultado falso-positivo. Efeitos adicionais causados por stress também devem ser eliminados. Permeabilidade é conhecida por aumentar quando os ratos estão estressados. Recomenda-se realizar um experimento preliminar pelo menos uma semana antes da experiência. Uma experiência prática ajudará a minimizar o ruído experimental para a experiência real. Um selvagem-tipo controle (sem tratamento) sempre deve ser incluído.
FITC-dextrano viaja através do intestino e começa a entrar o cólon 3 h depois de gavaging. Assim, 3 h é um ponto de tempo ideal para medir a permeabilidade intestinal pequena. Para medição da permeabilidade do colo, o tempo pode ser estendido, mas isto então torna-se um equilíbrio entre o escapamento da FITC-dextrano no lúmen e afastamento destas moléculas do fluxo de sangue. 4h é geralmente aceite como um ponto de tempo bom para medições do cólon.
Em conclusão, dois métodos distintos foram descritos para determinar a permeabilidade da célula epitelial intestinal tanto in vitro e in vivo. Considerando que ambos TER medição e métodos de gavage FITC-dextrano medem paracellular permeabilidade, cada fornecem Propriedades independentes e distintas da permeabilidade de paracellular.
Divulgações
Os autores declaram não concorrentes interesses financeiros.
Agradecimentos
Agradecemos o Dr. Jerrold R. Turner, do Hospital Brigham e feminino, Harvard Medical School, por sua generosa ajuda na conclusão deste estudo. Este trabalho é apoiado pela Fundação Nacional de ciências naturais da China (número de concessão 81470804, 31401229 e 81200620), a ciência Natural Fundação da província de Jiangsu (número de concessão BK20180838 e BK20140319), o programa de inovação de pesquisa para Graduados faculdade da província de Jiangsu (número de concessão KYLX16-0116), avançada pesquisa projetos de Soochow University (número de concessão SDY2015_06) e Crohn e colite Foundation Research Fellowship Award (conceder número 310801).
Materiais
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
Referências
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados