Method Article
Efeitos de alogênico Plasma rico em plaquetas (PRP) sobre o processo de cicatrização dos tendões de Aquiles seccionados de ratos: uma descrição metodológica
Neste Artigo
Resumo
Este protocolo descreve o processo de avaliação de cura os tendões em ratos que foram injetados com plasma rico de alogênico plaquetas (PRP) ou solução salina após a remoção de parte do tendão de Aquiles. O progresso da cicatrização do tendão é avaliado em vários pontos de tempo usando diferentes tipos de análises.
Resumo
Este artigo descreve os procedimentos experimentais usados para observar se PRP pode afetar positivamente o tendão cicatrização. Há 4 etapas principais a seguir: induzir uma lesão no tendão de Aquiles; preparar o PRP e injetá-lo (ou a solução salina); remover o tendão; e realizar avaliações biomecânicas, moleculares e histológicas. Em cada etapa, todos os procedimentos e métodos são descritos em detalhe, para que possam ser reproduzidos facilmente.
Tendões de Aquiles tem sido seccionada cirurgicamente (remoção de uma seção longa de 5 mm). Depois, PRP ou solução salina foi injetada para estudar se o PRP tem um efeito positivo sobre a cicatrização do tendão. Três grupos de 40 animais (um total de 120 ratos foram utilizados neste estudo) foram subdivididos em 2 subgrupos: grupo de controle grupo de injeção de PRP e uma injeção de solução salina. Ratos foram sacrificados em aumentar os pontos de tempo (grupo r: 5 dias; Grupo b: 15 dias; Grupo c: 30 dias) e tendões foram removidos. 90 tendões foram submetidos a testes biomecânicos antes de executar a análise de transcriptomic e os 30 restantes tendões foram submetidos à análise histológica.
Introdução
Coagulação, processos inflamatórios e as funções de modulação da imunidade de plaquetas são conhecidos1. Mais recentemente, foi demonstrado que eles também têm propriedades restauradoras2,3. Na verdade, vários fatores citocinas e crescimento (VEGF, PDGF, TGF-B e IGF-I e HGF) são liberados pelas plaquetas durante a degranulação. Estes fatores de crescimento promovem a angiogênese, remodela o tecido e ferida de cura (ossos, pele, músculo, tendão)2. Centrifugação de sangue autólogo produz plasma rico plaquetas (PRP) que contém concentrações de plaquetas alta dependendo do método de isolamento (entre 3 e 10 vezes sangue concentrações de linha de base). De fato, várias técnicas de preparação do PRP não podem fornecer um produto final idêntico. Até agora, não houve nenhum acordo geral internacional sobre esta questão. No geral, o PRP pode ser uma atraente opção terapêutica no tratamento de condições crônicas músculo-esqueléticas, tais como tendinopatia, fascite plantar, osteoartrite e pseudartrose4. Foi usado pela primeira vez em cirurgia oral e Implantologia4 para melhorar e acelerar a consolidação depois de colocar um implante dentário. Neste estudo, descrevemos um método reprodutível que permite a aquisição de PRP para experimentação animal4.
Desde lesões dos tendões são frequentemente observadas em esportistas e trabalhadores físicos, reforçar o processo de cura e reduzindo o tempo de recuperação são de grande interesse5. Novos métodos de tratamento que estão desenvolvendo frequentemente envolvem o uso de fatores de crescimento, e a administração do PRP é uma maneira simples e minimamente invasiva para entregar uma mistura de fatores de crescimento endógeno4.
Vários estudos em vitro ou em animais demonstraram que a administração de plasma que contém um alto nível de plaquetas, liberando mediadores biológicos, pode estimular a reparação do tendão e ligamento pela liberação de mediadores biológicos6 ,7,8,9. Além disso, outros estudos têm mostrado que o PRP pode estimular tipo eu e a síntese de colágeno III no tendão células de10,9,11. Também tem sido sugerido que o PRP pode diminuir a ativação de metaloproteinases de matriz (MMPs) e, portanto, reduzir a degradação da matriz. As células que estão envolvidas no processo de inflamação podem produzir MMP-9, que desempenha um papel no tecido remodelação (fisiológica e patológica) induzida por inflamação12.
Com base nesta informação, formulamos a hipótese que uma única injeção de PRP para os tendões de Aquiles seccionados de ratos poderia melhorar o processo de recuperação e a resistência mecânica do tecido reparado. Isso é testado medindo as propriedades biomecânicas dos tendões curativas durante o processo de recuperação e realizando análises histológicas e moleculares para avaliar colágeno remodelando o tecido recém-formado. O objetivo do estudo foi observar se uma única injeção de células alogénica PRP poderia influenciar a cicatrização dos tendões de Aquiles seccionados.
Protocolo
Cuidados e tratamento dos animais foram realizados em conformidade com o guia para o cuidado e uso de animais de laboratório preparado pela Academia Nacional de Ciências e publicado pelos institutos nacionais de saúde (EUA). Legislação europeia e nacional foram seguidas com cuidado.
1. preparação animal
- Use 132 ratos Sprague-Dawley machos 2 - meses de idade pesando 320-450 g (120 ratos para experimentação) e 12 ratos para amostragem de sangue, Figura 1. Com base na Dell13, 15 ratos para cada grupo foi o suficiente para uma potência de 0.8 (80% de chance de encontrar significância estatística, se existir o efeito especificado).
- Todos os ratos em gaiolas clássicas em condições de isolamento em uma instalação convencional equipado com uma estação de mudança de casa. Instigar a reprodução em um rack IVC (gaiola ventilada individualmente), com ratos SPF (livre de patógenos específicos) especificamente ser comprados.
- Use as seguintes condições de habitação: escala de temperatura de 19-24 ° C; umidade relativa: 40-60%; ventilação: frequência de renovação de ar: 10-15 por h; o ciclo claro/escuro: 12 h - 12 h.
- Esterilizar todos os equipamentos de enjaulamento e usar roupa de cama irradiada. Sistemicamente implemente o enriquecimento de gaiola, colocando toalhas e bandejas de papelão estéril dentro de jaulas.
- Permitir o acesso à zona sob condições restritas: chapéu casaco, máscara, luvas, calçados e cabelo do novo laboratório na entrada.
- Realizar monitoramento de integridade de colônia na sentinela animais alojados na roupa de cama suja numa base anual, de acordo com as recomendações de14 Felasa para instalações convencionais. Manter animais de quatro a cinco por gaiola, com o apropriado irradiados e fornecem dieta acidificadas água ad libitum. Monitore diariamente.
- Transferência de ratos eleitos para intervenção cirúrgica na filtragem superiores gaiolas para as salas cirúrgicas 2 h antes da cirurgia.
2. ato cirúrgico
- Preparar os instrumentos cirúrgicos: finas tesoura, uma pinça, duas Pinças hemostáticas e um porta-agulha. Durante todos os procedimentos, use luvas, máscara, uma capa e um jaleco.
- Aleatoriamente, divida os ratos em dois grupos (PRP e solução salina).
- Leve o rato sair da jaula e pesá-lo. Use marcas auriculares numerada para identificar os ratos. Para evitar a dessecação dos olhos, coloque gotas de água sobre a córnea.
- Anestesia o rato intraperitonealmente com xilazina (10mg/kg de peso corporal) e cetamina (80 mg/kg de peso corporal). Para confirmar anesthetization, coloque os animais sob monitorização cardio-respiratória e verificar se há quaisquer reflexos do olho.
- Injetar 50 µ l de buprenorfina por via subcutânea (0,01-0,05 mg/kg cada 8-12 h) na área do pescoço como um analgésico.
- O membro posterior esquerdo a barba com um barbeador elétrico, desinfectá-la com 3 alternando uniforme de solução de álcool/iso-betadine (diluídos 01:10) e coloque o rato sobre uma almofada quente (20 ° C) sob um microscópio de dissecação. Coloque o rato em decúbito lateral com a perna a ser operado em uma posição superior. Segure a pata com pinça cirúrgica.
- Usando a tesoura, faça uma pequena incisão lateral (20-25 mm) na pele ao redor do tendão de Aquiles esquerdo e dissecar a fáscia usando tesouras bem para expor o tendão de Aquiles complexo (Figura 2a).
- Retire o tendão plantar com uma tesoura (Figura 2b).
- Cortar o tendão de Aquiles transversalmente 5mm proximais à sua inserção no calcâneo e remover a porção longa de 5 mm, usando uma tesoura. Não sutura do tendão (Figura 2C, 2d).
- A fáscia e, em seguida, a pele da sutura com fios absorvíveis, fazendo uma sutura overjet (sutura contínua). Suturas monofilamento podem ser usadas também para evitar a absorção da pele para a incisão cirúrgica.
- Coloque o rato sob uma lâmpada de aquecimento até acordado e, em seguida, coloque o rato em uma gaiola (58 x 38 cm) (Nota bene: não imobilização é imposta).
3. PRP preparação15
- Anestesia os ratos de doador com xilazina (10mg/kg de peso corporal) e cetamina (80 mg/kg de peso corporal) por injeção intraperitoneal. A injeção de PRP é realizada por 2 h no pós-operatório sem qualquer re-anestésico.
- Injecte por via subcutânea 50 µ l de buprenorfina como um analgésico.
- Colher o sangue total (20 mL por rato, sangramento final) por punção cardíaca em tubos estéreis contendo 3,2% tamponada de citrato de sódio (0,109 M, anticoagulante). Então eutanásia o rato por Injeção intracardíaca.
- Para obter o PRP, centrifugar o sangue durante 10 minutos a 150 x g e temperatura de quarto. Esta etapa de centrifugação inicial baixa velocidade produz duas fases distintas: uma fase inferior, que consiste de glóbulos vermelhos (hemácias) que é responsável por cerca de 80-90% do volume total e uma fase superior consistindo de plasma rico em plaquetas (PRP) (tipicamente 10-20% do sangue amostra).
- Delicadamente, colete o PRP (fase superior) em um tubo de plástico secundário usando uma pipeta de transferência plástica. Como a interface entre o PRP e células vermelhas do sangue está muito solta, não pipete demasiado perto para a interface. Quando tratada adequadamente, contaminar hemácias em PRP deve estar abaixo de 0,05 x 103 células / µ l. descarte a fase inferior restante e o tubo de coleta primária de sangue.
- Determinar o volume de PRP coletado e medir a contagem de plaquetas em um analisador de hematologia. Esses valores são necessários para os cálculos ajustar a concentração de plaquetas na próxima etapa. Uma contagem de células do sangue também é útil para avaliar o potencial de contaminação com hemácias e a concentração de glóbulos brancos. plaquetas no PRP nesta fase é tipicamente 1-1.5 x106/µL.
- Realize uma segunda centrifugação do PRP durante 10 minutos a 1.000 g de x e a temperatura ambiente. Esta etapa de centrifugação de alta velocidade produz uma pelota de plaquetas solto e um sobrenadante consistindo de autólogo plasma pobre em plaquetas (PPP). Usando os valores determinados no passo 3.6, calcular o volume de sobrenadante para ser Descartado para concentrar o PRP e chegar a uma concentração final de 2.5 x106/µL.
- Delicadamente, recolha o sobrenadante (PPP) em um tubo de plástico secundário usando uma pipeta de transferência plástica, deixando cerca de dois terços do volume final calculado na etapa 3.7. Como a pelota é solta, uma quantidade significativa de plaquetas é perdida quando PPP é descartada, portanto, potencialmente reduzindo a concentração final desejada.
- Cuidadosamente resuspenda o pellet de plaquetas com o restante sobrenadante por pipetagem repetidas suave. Medir a contagem de plaquetas no PRP concentrado. Se necessário, adicione o volume apropriado de PPP autólogo para atingir a concentração alvo final.
Nota: Use o PRP até 3 horas após preparação. - Adicionar 50 µ l de CaCl2 (11 mEq 10ml) por mL de PRP para ativar as plaquetas.
- Injete 50 µ l de PRP fresco ou solução salina com uma agulha 21G diretamente no local da operação suturado cerca de 1h após a preparação. Durante este tempo, manter o PRP em temperatura ambiente.
- Acompanhar a recuperação funcional dos ratos de perto durante os dias após a cirurgia e antes da remoção do tendão de Aquiles.
4. remoção do tendão de Aquiles e testes biomecânicos16
- 5, 15 ou 30 dias depois5, pesar o rato. Em seguida, anestesiamos com xilazina (10mg/kg de peso corporal) e cetamina (80 mg/kg de peso corporal) por injeção intraperitoneal.
- Injecte por via subcutânea 50 µ l de buprenorfina como um analgésico. Retire o tendão antes de sacrificar o animal para manter as condições fisiológicas para contanto que possível.
- Raspar o membro posterior esquerdo e colocar o rato sob um microscópio de dissecação. Coloque o rato em decúbito lateral com a perna a ser operado em uma posição superior. Segure a pata com os dedos.
- Faça uma pequena incisão (10 mm) no site da operação anterior e estender até a suralis de tríceps é exposta.
- Para remover o tendão de Aquiles a cura, corte o osso calcâneo transversalmente de 5-10 mm distal para sua fixação do tendão de Aquiles. Então disse uma parte do tríceps suralis, que é anexado ao tendão de Aquiles (Figura 3b). A parte do músculo tem que ser grande o suficiente para caber na cryo-mandíbula (Figura 3 c-d). Colocar a amostra imediatamente para o cryo-mandíbula usando fórceps (Figura 3e).
- Depois de remover o complexo músculo-tendão-osso, eutanásia o rato por Injeção intracardíaca com Nembutal (200 mg/kg). Confirme a morte, avaliando a ausência de ritmo cardíaco e a respiração durante 15 min.
- Coloque a unidade do músculo na mandíbula superior (Figura 3e), fechá-lo e colocá-lo verticalmente em uma máquina de teste de universal (106,2 kN, Figura 3a). Em seguida fixe o osso entre as pinças inferiores da máquina (Figura 3f).
- Adicione nitrogênio líquido em ambas as bacias do maxilar superior para congelar o músculo, que é uma ordem de magnitude mais duro que o tendão e não se deforma durante o ensaio de tracção.
- Quando a zona de congela atinge a borda da braçadeira de metal, começa o ensaio de tracção, o tendão vai preservar a sua estrutura. Defina a taxa de deslocamento da máquina a uma velocidade constante de 1 mm/s até a ruptura. Grave a resistência à tração (UTS) dada em Newtons (N) em um computador.
- Para calcular a área de seção transversal, coloque duas câmeras perpendiculares uns aos outros, formando uma forma elíptica e tirar fotos.
- Para compensar a diferença de área transversal dos tendões curativas, normalize as UTS para uma unidade de área (N por milímetro quadrado), que representa o esforço mecânico experimentado pelo tecido.
5. histológica análise
Nota: 15 tendões de cada grupo foram submetidos a análise histológica.
- Após sua remoção, mergulhe imediatamente em paraformaldeído 4%, para preservar a sua estrutura, o tendão de Aquiles (1mm de tecido é fixado por hora, então o tempo de fixação varia de acordo com o tamanho do tendão).
- Substituir o paraformaldeído por etanol a 70% e deixar a amostra pelo menos uma noite nesta solução.
- Coloque o tendão em um pequeno recipiente de plástico com furos e coloque o recipiente em uma solução de etanol 70% fresca por 1h.
- Coloque o recipiente em etanol a 95% por 1 h. repetir.
- Coloque o recipiente em etanol 100% para 1 h. repetir.
- Coloque o recipiente em 100% de xilol por 1 h. repetir.
- Agora coloque o recipiente de plástico, que contém o tendão, em parafina líquida (56 ° C) e deixe durante a noite.
- Usando uma estação de encaixe (equipada com cera derretida, um prato quente e um prato frio), escolher um molde metálico que melhor se adapta a amostra de tecido e encha-o com parafina líquida um pouco para que a base é coberta.
Nota: Oriente a amostra para obter as seções verticais no micrótomo. - Quando a amostra está corretamente posicionada, encher o molde com parafina líquida e coloque-a sobre a máquina de refrigerante. Deixe arrefecer durante pelo menos 15 minutos.
- Retire o bloco de parafina e coloque-o no gelo pelo menos 30 min.
- Preparar várias lâminas de vidro limpas e lhes colocamos algumas gotas de água desionizada.
- No micrótomo, cortar os blocos em seções de 5 µm (só uso seções da parte média do tendão) e colocar a seção em um slide.
- Coloque os slides em um forno de aquecimento a 65 ° C por vários minutos, para que a parafina só começa a derreter para unir o tecido para o vidro.
- Coloque os slides contendo cortes de parafina em um suporte de fatia.
- Agora deparaffinize e Re-hidratar o tecido, colocando-o nos seguintes banhos sucessivos:
8 min em xilol (banho 1)
4 min em xilol (2 de banho)
2 min em etanol 100%
2 min em etanol a 95%
2 min em etanol a 70%
2 min em água desionizada - Para coloração de hematoxilina-eosina, coloque o tecido nas seguintes soluções.
- Mergulhe o tecido durante 8 min em solução de hematoxilina (monohidrato de hematoxilina de 1g, 0,2 g KIO3, 50g AIK (SO4)2.12h2O; glicerina 200ml; ajustar para 1 L com água destilada).
- Mergulhe o tecido durante 8 min sob água corrente.
- Mergulhe o tecido por 30 s em solução de eosina (eosina 0,25% em 100 mL de água destilada contendo 200 µ l de não diluída de ácido acético).
- Mergulhe o tecido por 2 min sob água corrente.
- Para coloração tricromo de Masson, siga estas etapas.
- Após a reidratação, colocar as seções em um recipiente com alúmen de ferro (0,5 g (NH4) Fe (SO4)2.12h2O em 10 mL de H2O) e feche o recipiente. Aqueça-o por 3 min em 280 W em um microondas.
- Deixe esfriar por um minuto e em seguida, enxágue-o com água desionizada.
- Colocar as seções em um recipiente fechado com solução de hematoxilina de Regaud (hematoxilina de 0,5 g dissolvida em 50 mL de H2O a 50 ° C, em seguida, adicione 5 mL de etanol 95% e glicerina 5 mL), aquecê-lo por 90 s em 280 w.
- Enxágue com água desionizada.
- Colocar as seções em uma solução de ácido pícrico (a saturação em metanol) por 3 min, enxaguar por 5 min sob água corrente e coloque-o em água desionizada durante alguns segundos.
- Agora, colocar as seções em fucsina ácida (0,5 g em 50 mL de H2O contendo 0,25 mL de ácido acético diluído) durante 5 segundos e enxaguar sob água corrente até que a tinta desapareça.
- Incubar as secções em solução de ácido fosfomolíbdico (0,5 g em 50 mL de H2O) por 5 min, coloque-o por alguns segundos em água desionizada.
- Colocar as seções em solução de luz verde (0,5 g em 50 mL de H2O contendo 0,25 mL de ácido acético diluído) por mais 5 minutos e coloque-o sob água corrente até que a tinta desapareça.
- Agora desidrate o tecido novamente.
- Mergulhe a seção por 1 min em etanol a 70%.
- Mergulhe a seção por 1 min em etanol a 95%.
- Mergulhe a seção por 1 min em 100% de etanol.
- Mergulhe a seção por 1 min em xilol (banho 1).
- Mergulhe a seção por 1 min em xilol (2 de banho).
- Remova as seções sem retirar demais xileno e coloque uma gota de meio de montagem na amostra.
- Colocar uma lamela por cima (sem provocar quaisquer bolhas) e deixe endurecer pelo menos 2 h.
- Hidrolisar 5 cortes histológicos (cada um de um tendão diferente) de cada grupo em 6 N HCl para 3h e determinar a concentração de colágeno medindo hidroxiprolina como um índice em 5 seções µm inocente.
- Normalize os resultados por área de seção utilizando o software do fabricante.
- Mancha de algumas seções com luz verde mancha para visualizar e quantificar fibrillar colágeno por análise de computador assistida.
- Digitalizar as seções e converter as fotos em nuances de cinza usando o software IrfanView. Use o software para quantificação semi (por exemplo, uma quantidade).
6. molecular avaliação
- Após a ruptura do tendão, que ocorre durante o ensaio mecânico, tirar as amostras, snap congelá-los em nitrogênio líquido e armazená-los no-80 ° C (PRP e solução salina)17.
- Use um kit de RNA Total comercial para isolar de RNA total17.
- Medir a expressão de colágeno (Col I e III Col), matriz metaloproteinases (MMP-2, MMP-3 e MMP-9) e tenomodulin (TNMD) por RT-PCR17,18.
- Normalize os níveis de expressão de RNAm para os níveis de 28S19.
Resultados
Os resultados são expressos como o média ± desvio-padrão da média e foram comparados com a análise de variância (ANOVA). Uma ANOVA bidirecional e post hoc testam de Scheffé, que é um teste paramétrico, foram usados.
A resistência à tração (UTS) necessária para provocar uma ruptura dos tendões de Aquiles não-feridas de ratos foi 42.0 ± 5,7 N (n = 10). A resistência à tração aumentou significativamente (p < 0,0001) em ambos os grupos após o dia 5. Comparando os dois grupos, as UTS foi maior no grupo PRP em qualquer altura medida, especialmente no dia 15 e 30. Medindo-se a área de seção transversal dos tendões que foram removidos antes de se submeter a avaliação biomecânica (11,4 ± 5,5 mm2 tendões não feridos), verificou-se que no dia 5, foi maior no grupo tratado salino. Mas no dia 15 e 30, a área de seção transversal foi maior no grupo PRP, embora esta quantidade foi mais variável quando comparado ao grupo tratado salino (Figura 4 e Figura 5).
A avaliação histológica dos tendões, usando hematoxilina-eosina, coloração, mostrou uma alta celularidade no dia 5, que diminuiu depois (não foi observada nenhuma diferença significativa entre o grupo PRP e solução salina). A Masson Trichrome coloração mostrou uma maior presença de colágeno fibrillar no grupo PRP no dia 5 e 15. No entanto a intensidade da coloração foi semelhante nos dois grupos de 30 dias após a injeção (Figura 6). A quantificação semi obtida pela coloração das amostras com luz verde mostrou que no dia 5 e 15, a intensidade foi maior no grupo PRP (estatisticamente não significativo), mas no dia 30, não houve diferença observada entre os dois grupos.
Os dados foi normalizados, medindo a quantidade de um aminoácido, hidroxiprolina, que é específico para o colágeno, confirmando a quantificação semi histológica (dia 5: valor maior no grupo PRP). A concentração de colágeno não era estável no grupo PRP mas foi estabilizada no dia 30, em dois grupos. O volume do calo foi medido e foi encontrado para ser significativamente maior nos animais tratados com PRP durante os primeiros estágios do processo de cura. Tomados em conjunto, estes resultados implicam que a injeção de PRP no tendão lesionado faz com que uma quantidade importante de colágeno fibrillar para depositar.
Medir o nível de expressão de várias moléculas que mostrou em tendões não-lesionado, Col III e TNMD estavam presente em uma menor quantidade (2.5 - 3.0 vezes) do que em cura tendões no dia 15, no entanto não houve diferença na Col eu expressão entre os grupos. MMPs estavam presentes em uma 12-fold maior concentração em tendões a cura. Além disso, no dia 30, houve um aumento significativo de COL1A1 no grupo PRP, e verificou-se uma correlação positiva entre a expressão de COL1A1 e as UTS. Em ambos os grupos, verificou-se que Col III foi expressa em uma quantidade elevada de 1 dia até dia 14, antes de que diminuiu (o mesmo para ambos os grupos). Concentração de MMP-9 não mudou em ambos os grupos, mas estavam presentes em altas concentrações durante o período de cicatrização MMP-2 e MMP-3. No dia 5, TNDM foi expressa em uma quantidade maior em PRP (p < 0,03) mas então diminuíram entre 15 e 30 dias.

Figura 1: desenho Experimental do estudo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Procedimento cirúrgico.
(a) o tendão do complexo após a remoção da fáscia circundante.
(b) remoção do tendão plantaris.
(c) a remoção de uma secção do tendão de Aquiles.
(d) o 2 tendões que foram removidos. Clique aqui para ver uma versão maior desta figura.

Figura 3: Testes biomecânicos
(uma) máquina de teste Universal (106,2 kN).
(b) o complexo músculo-tendão-osso que será corrigido para o cryo-maxilar.
(c) superior e inferior mandíbula cryo
(d) superior e inferior cryo-mandíbula
(e) o complexo colocar o maxilar de cryo
(f) fechado cryo-mandíbula contendo o complexo músculo-tendão-osso fixado na máquina. Clique aqui para ver uma versão maior desta figura.

Figura 4: Resultados de testes biomecânicos
Resistência à tração, expressada em Newtons (N) no controle e grupos PRP nos pontos de tempo diferente após a cirurgia. Houve um aumento de UTS em ambos os grupos ao longo do tempo, com o grupo PRP, apresentando valores significativamente superiores às 15 e 30 dias após a cirurgia.
Barra de erro define o desvio padrão (SD). Clique aqui para ver uma versão maior desta figura.
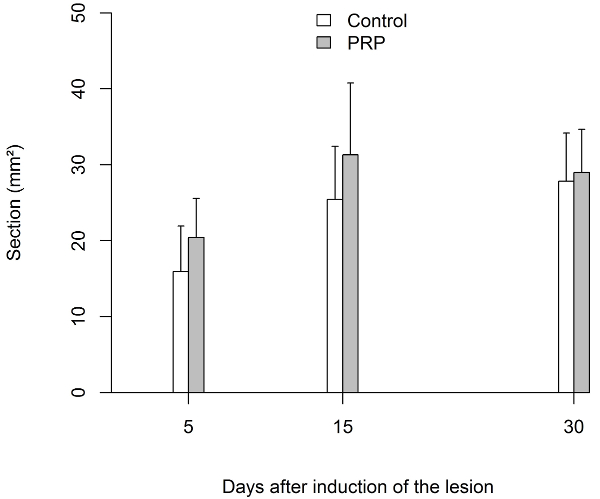
Figura 5: Resultados de testes biomecânicos
Área transversal do tendão expressado em milímetros quadrados (mm2). A área de seção transversal foi significativamente maior no grupo PRP até dia 15. Depois disso, a seção foi semelhante nos dois grupos.
Barra de erro define o desvio padrão (SD). Clique aqui para ver uma versão maior desta figura.

Figura 6: Resultados histológicos
Representante secções longitudinais do tendão de Aquiles, de controle e os grupos PRP, manchado com Trichrome de Masson. Barra de escala = 100 µm. Há uma coloração verde mais forte no tendão do grupo PRP no dia 5. Clique aqui para ver uma versão maior desta figura.
Discussão
As plaquetas são essenciais para a fase inflamatória inicial do tendão processo de cura. Quando estas plaquetas estão expostas a um tecido ou fatores que induzem a coagulação, liberam fatores de crescimento que são estocados em grânulos α. Devido a essa interação, macromoléculas da matriz extracelular são synthetized e células mesenquimais proliferam. As plaquetas também têm uma atividade quimiotáctica em células progenitoras a circulação de sangue, aumentando a angiogênese e estimulando a diferenciação celular6,20.
O teste biomecânico foi feito usando um dispositivo de fixação feito especialmente para o ex vivo teste tração do tendão de Aquiles em ratos15. O cryo-mandíbula permite o congelamento do músculo pela adição de nitrogênio líquido, e o calcâneo, que é a parte inferior da amostra, é fixado diretamente na máquina. É muito importante iniciar o ensaio de tracção quando o músculo está completamente rígido, mas o tendão é ainda flexível. Esta técnica evita danos nos tecidos e preserva a integridade mecânica. Também esta técnica é simples, seguro, não-compressivo e comprovadamente reprodutíveis, como vários estudos têm utilizado este método4,15.
Para apoiar os resultados mecânicos, alguns tendões foram submetidos a avaliação histológica. A coloração de hematoxilina-eosina mostra uma visão grande do tecido cicatrizada e dá informações gerais sobre a quantidade de células e colágeno presente. Também, a medição da hidroxiprolina é útil como é um aminoácido encontrado somente em colágeno e permite que o objectivation dos dados histológicos. No entanto, é necessário fazer a coloração tricromo de Masson, um, que mostra informações muito mais detalhadas sobre a deposição e a concentração de fibras de colágeno4.
Embora o nível de colágeno III mRNA em PRP tratada tendões não foi alterada, no dia 30 mRNA do Col eu estava presente em uma concentração mais elevada nos tendões feridos tratados com PRP. Ele tinha sido mostrado anteriormente que o PRP interfere com a proliferação de macrófagos e a produção de IL-121, que assim poderia evitar a reação inflamatória excessiva durante as fases iniciais do processo cura11. É possível que o PRP estimula a proliferação, a ativação de vias metabólicas e a transformação das células mesenquimais em tenocytes que estão ativos.
Altas concentrações de TNDM nos tendões do grupo PRP indicam que as moléculas injetadas poderiam atrair células circulantes na corrente sanguínea e induzir uma diferenciação para o fenótipo de tenocyte11. Tomados em conjunto, estes resultados demonstram que apenas uma injeção de PRP para uma ruptura do tendão de Aquiles tem um efeito positivo na fase inicial de cura e leva a uma maior resistência mecânica.
Vários estudos pré-clínicos já mostraram que o PRP melhora o processo de cura, e que os diferentes fatores de crescimento têm ações específicas durante este processo,22. Mazzocca e sua equipe demonstraram que o PRP estimula a proliferação celular em músculos, ossos e tendões. De diferentes preparações, fortemente concentrada PRP sem quaisquer células brancas do sangue provou para ser o mais eficaz tratamento23. McCarrell et al. Fiz um experimento semelhante, testando várias preparações de PRP contendo diferentes concentrações de PRP e células brancas do sangue em tendões de cavalo. Preparações que contenham uma concentração intermediária de plaquetas e uma alta concentração de glóbulos brancos levaram a uma maior liberação de citocinas pró-inflamatórias, como IL-1ß e TNFa e menor síntese de colágeno. As misturas com uma alta concentração de glóbulos brancos e plaquetas também levaram a um aumento de citocinas inflamatórias, mas a síntese de colágeno inibida. Concluindo, isto significa que se a concentração de plaquetas é muito alta, metabolismo de síntese e célula de colágeno são lento24. Boswell et al. confirmou estas conclusões25. A mais eficiente preparação PRP conteria, portanto, uma concentração de plaquetas inferior a 106 plaquetas / µ l e sem glóbulos brancos.
Uma grande vantagem do uso de PRP é autogenity. Embora em nosso estudo, nós costumávamos PRP alogênico sacrificando ratos doadores têm uma quantidade suficiente de sangue. Além disso, tirar sangue de ratos operados enfraqueceria-los demais. Outra limitação deste estudo é que todas as rupturas são agudas e realizada em tendões saudáveis, que não é sempre o caso em humanos, como os tendões rompem-se muitas vezes por causa de degeneração prévia. Este modelo sendo baseado nas lesões dos tendões afiados, nenhuma conclusão definitiva pode ser desenhada para tendinopatias degenerativas.
Usando esse método, existem algumas etapas críticas de me lembrar, o primeiro sendo a preparação do PRP, que deve ser o mais reprodutível possível. Outro passo crítico é o procedimento cirúrgico: a remoção do tendão e músculo-tendão complexo deve ser feito de forma reprodutível para evitar qualquer preconceito. Por último, a preparação para o teste biomecânico: nitrogênio líquido é adicionado para congelar o músculo, e é muito importante que o tendão não está congelado neste processo porque poderia levar a resultados tendenciosos, como a rigidez do tendão seria alterada. Esta também é uma limitação do estudo, desde que não há nenhum protocolo padronizado para garantir que a elasticidade do tendão não é modificada.
Baseamos nosso método no método desenvolvido por Virchenko et al. 26, mas adaptado usando o cryo-maxilar, que protege o tendão contra agressões exteriores induzida por grampos. A grande vantagem deste método é que é reprodutível mesmo se ele ainda não está normalizado. Dá uma ideia sobre como lesões do tendão podem ser tratadas em seres humanos, apesar de experimentos com ratos não sempre traduzem bem a tratar lesões humanas. É provável que uma versão adaptada do método pode ser útil no tratamento dessas lesões no futuro, apoiada pelo fato de que é fácil de usar, tem um custo relativamente baixo e é menos invasiva do que outros métodos.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este estudo foi suportado pelo Standard de Liège e Lejeune - Lechien concede dos fundos Leon Frédéricq.
Materiais
| Name | Company | Catalog Number | Comments |
| Xylazine (Xyl-M) | VMD | none | anesthetic |
| Ketamin (Jétamine 1000 CEVA) | CEVA Santé Animale | none | anesthetic |
| Buprenorphin (Vetergésic Multidosis) | ALSTOE | none | Painkiller |
| iso-Betadine | MEDA-Pharma | none | Desinfectant |
| resorbable yarn Vicryl 6/0 | Johnson & Johnson | ||
| Nembutal | CEVA Santé Animale | none | Anesthetic |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Preserves structure of the tissue |
| Isopropanol 100% | VWR | 20,922,364 | |
| Ethanol 95% | VWR | 20,823,362 | |
| Xylene | VWR | 28973.363 | |
| Paraffin | VWR | LEIC3950.1006 | |
| Hematoxylin | Millipore | 1.15938.0025 | Colorant |
| Eosin | Millipore | 1.15935.0100 | Colorant |
| Eukitt | Sigma-Aldrich | 3989 | Mounting Medium |
| CaCl2 |
Referências
- Kaux, J., Degrave, N., Crielaard, J. Platelet rich plasma traitement des tendinopathies chroniques? Revue de la littérature. Platelet rich plasma treatment of chronic tendinopathies? Review of literature. J. Traumatol. du Sport. 24, 99-102 (2007).
- Anitua, E., et al. Autologous preparations rich in growth factors promote proliferation and induce VEGF and HGF production by human tendon cells in culture. J. Orthop. Res. 23, 281-286 (2005).
- Bosch, G., et al. Effects of platelet-rich plasma on the quality of repair of mechanically induced core lesions in equine superficial digital flexor tendons: A placebo-controlled experimental study. J. Orthop. Res. 28, 211-217 (2010).
- Kaux, J. F., Drion, P., Croisier, J. L., Crielaard, J. M. Tendinopathies and platelet-rich plasma (PRP): From pre-clinical experiments to therapeutic use. J. Stem Cells Regen. Med. 11, P7-P17 (2015).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin. Sports Med. 22, 675-692 (2003).
- Molloy, T., Wang, Y., Murrell, G. The roles of growth factors in tendon and ligament healing. Sports Med. 33, 381-394 (2003).
- Lyras, D. N., et al. The effect of platelet-rich plasma gel in the early phase of patellar tendon healing. Arch. Orthop. Trauma Surg. 129, 1577-1582 (2009).
- Aspenberg, P., Virchenko, O. Platelet concentrate injection improves Achilles tendon repair in rats. Acta Orthop. Scand. 75, 93-99 (2004).
- Visser, L. C., et al. Growth Factor-Rich Plasma Increases Tendon Cell Proliferation and Matrix Synthesis on a Synthetic Scaffold: An In Vitro Study. Tissue Eng. Part A. 16, 1021-1029 (2010).
- Zhang, J., Wang, J. H. -. C. Platelet-Rich Plasma Releasate Promotes Differentiation of Tendon Stem Cells Into Active Tenocytes. Am. J. Sports Med. 38, 2477-2486 (2010).
- Kajikawa, Y., et al. Platelet-rich plasma enhances the initial mobilization of circulation-derived cells for tendon healing. J. Cell. Physiol. 215, 837-845 (2008).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors-diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Dell, R. B., Holleran, S., Ramakrishnan, R. Sample size determination. ILAR J. 43, 207-213 (2002).
- Mähler Convenor, M., et al. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units. Lab. Anim. 48, 178-192 (2014).
- Kaux, J. -. F., et al. Étude comparative de cinq techniques de préparation plaquettaire (platelet-rich plasma). Pathol. Biol. 59, 157-160 (2011).
- Wieloch, P., Buchmann, G., Roth, W., Rickert, M. A cryo-jaw designed for in vitro tensile testing of the healing Achilles tendons in rats. J. Biomech. 37, 1719-1722 (2004).
- Kaux, J. -. F., et al. Vascular Endothelial Growth Factor-111 (VEGF-111) and tendon healing: preliminary results in a rat model of tendon injury. Muscles. Ligaments Tendons J. 4, 24-28 (2014).
- Docheva, D., Hunziker, E. B., Fässler, R., Brandau, O. Tenomodulin is necessary for tenocyte proliferation and tendon maturation. Mol. Cell. Biol. 25, 699-705 (2005).
- Lambert, C. A., Colige, A. C., Munaut, C., Lapière, C. M., Nusgens, B. V. Distinct pathways in the over-expression of matrix metalloproteinases in human fibroblasts by relaxation of mechanical tension. Matrix Biol. 20, 397-408 (2001).
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front. Biosci. 13, 3532-3548 (2008).
- Woodall, J., Tucci, M., Mishra, A., Benghuzzi, H. Cellular effects of platelet rich plasma: a study on HL-60 macrophage-like cells. Biomed. Sci. Instrum. 43, 266-271 (2007).
- Taylor, D. W., Petrera, M., Hendry, M., Theodoropoulos, J. S. A systematic review of the use of platelet-rich plasma in sports medicine as a new treatment for tendon and ligament injuries. Clin. J. Sport Med. 21, 344-352 (2011).
- Mazzocca, A. D., et al. The positive effects of different platelet-rich plasma methods on human muscle, bone, and tendon cells. Am. J. Sports Med. 40, 1742-1749 (2012).
- McCarrel, T. M., Minas, T., Fortier, L. A. Optimization of leukocyte concentration in platelet-rich plasma for the treatment of tendinopathy. J. Bone Joint Surg. Am. 94 (1-8), e143 (2012).
- Boswell, S. G., et al. Increasing platelet concentrations in leukocyte-reduced platelet-rich plasma decrease collagen gene synthesis in tendons. Am. J. Sports Med. 42, 42-49 (2014).
- Virchenko, O., Aspenberg, P. How can one platelet injection after tendon injury lead to a stronger tendon after 4 weeks?: Interplay between early regeneration and mechanical stimulation. Acta Orthop. 77, 806-812 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados