Method Article
Efectos del trasplante Allogeneic Plasma rico en plaquetas (PRP) en el proceso de cicatrización de los tendones de Aquiles seccionado de las ratas: una descripción metodológica
En este artículo
Resumen
Este protocolo describe el proceso de evaluación de la curación de tendones en ratas que han sido inyectados con plasma rico en plaquetas alogénicas (PRP) o solución salina después de quitar parte del tendón de Aquiles. Se evalúa el progreso de la curación del tendón en varios puntos del tiempo utilizando diferentes tipos de análisis.
Resumen
Este artículo describe los procedimientos experimentales utilizados para observar si PRP puede afectar positivamente curación del tendón. Hay 4 principales pasos a seguir: inducir una lesión en el tendón de Aquiles; preparar PRP e inyecte (o solución salina); quitar el tendón; y realizar evaluaciones biomecánicas, moleculares e histológicas. En cada paso, todos los procedimientos y métodos se describen en detalle, para que puedan reproducirse fácilmente.
Tendones de Aquiles han sido seccionado quirúrgicamente (extirpación de una sección larga de 5 mm). Luego, se inyectó PRP o solución salina para estudiar si el PRP tiene un efecto positivo en la curación del tendón. Tres grupos de 40 animales (un total de 120 ratas fueron utilizados en este estudio) se subdividieron en 2 subgrupos: Grupo de control grupo de inyección de PRP y una inyección de solución salina. Las ratas fueron sacrificadas a aumentar puntos de tiempo (grupo A: 5 días; Grupo B: 15 días; Grupo C: 30 días) y tendones fueron quitados. 90 tendones experimentaron la prueba biomecánica antes de realizar el análisis transcriptómico y los 30 restantes tendones fueron sometidos a análisis histológico.
Introducción
Las funciones de modulación de la inmunidad de las plaquetas, la coagulación y procesos inflamatorios son conocida1. Más recientemente, se ha demostrado que también tienen propiedades restaurativas2,3. De hecho, varios factores de crecimiento y citocinas (VEGF, TGF-B, PDGF, IGF-I y HGF) son liberados por las plaquetas durante la degranulación. Estos factores de crecimiento promueven la angiogénesis, remodelación tisular y herida curativo (hueso, piel, músculo, tendón)2. La centrifugacion de sangre autóloga produce plasma rico en plaquetas (PRP) que contiene plaquetas altas concentraciones dependiendo del método de aislamiento (entre 3 y 10 veces de la sangre las concentraciones de línea base). De hecho, diversas técnicas de preparación de PRP no pueden proporcionar un producto final. Hasta ahora, no ha habido ningún acuerdo general internacional sobre este tema. En general, el PRP podría ser una opción terapéutica atractiva para el tratamiento de crónicos musculoesqueléticos como Tendinopatía, fascitis plantar, osteoartritis y consolidación4. Fue utilizado por primera vez en cirugía bucal e implantología4 para mejorar y acelerar la curación después de colocar un implante dental del hueso. En este estudio, describimos un método reproducible que permite la adquisición de PRP para experimentación animal4.
Puesto que las lesiones de tendones se observan con frecuencia en deportistas y trabajadores físicos, mejorar el proceso de curación y reduciendo el tiempo de recuperación son de gran interés5. Nuevos métodos de tratamiento que se están desarrollando a menudo implican el uso de factores de crecimiento, y la administración de PRP es una manera simple y mínimamente invasiva para entregar una combinación de factores endógenos de crecimiento4.
Varios estudios en vitro o en animales han demostrado que la administración de plasma que contiene un alto nivel de las plaquetas, liberando mediadores biológicos, puede estimular la reparación de tendones y ligamentos por liberación de mediadores biológicos6 ,7,8,9. Además, otros estudios han demostrado que puede estimular la PRP tipo I y la síntesis de colágeno III en tendón las células9,10,11. También se ha sugerido que el PRP puede disminuir la activación de metaloproteinasas de matriz (MMPs) y por lo tanto reducir la degradación de la matriz. Las células que intervienen en el proceso de la inflamación pueden producir MMP-9, que juega un papel en la remodelación tisular (fisiológicos y patológicos) inducida por inflamación12.
Basado en esta información, la hipótesis de que una sola inyección de PRP en los tendones de Aquiles seccionados de las ratas podría mejorar el proceso de recuperación y la resistencia mecánica del tejido reparado. Esto se prueba mediante la medición de las propiedades biomecánicas de los tendones de sanación durante el proceso de recuperación y realizando los análisis histológicos y moleculares para evaluar colágeno remodelado en el tejido recién formado. El objetivo del estudio fue observar si una sola inyección de PRP allogeneic pueda influir en la curación de tendones de Aquiles seccionados.
Protocolo
Cuidado y manejo de los animales se realizaron según la guía para el cuidado y uso de animales de laboratorio preparado por la Academia Nacional de Ciencias y publicado por los institutos nacionales de salud (USA). Legislación europea y nacional siguieron cuidadosamente.
1. animal preparación
- Utilice 132 2 meses de edad macho ratas Sprague-Dawley peso 320-450 g (120 ratas para experimentación) y 12 ratas para tomar muestras de sangre, figura 1. Dell13, 15 ratas de cada grupo fue suficiente para una potencia de 0,8 (80% de probabilidades de encontrar significación estadística, si existe el efecto especificado).
- Todas las ratas en jaulas clásicas en condiciones de aislamiento en una instalación convencional equipada con una estación de cambio de la casa. Instigar a cría en un rack IVC (jaula individual ventilada), con las ratas SPF (libres de patógenos específicos) ser compradas específicamente.
- Utilice las siguientes condiciones de la vivienda: rango de temperatura de 19-24 ° C; humedad relativa: 40-60%; ventilación: frecuencia de renovación de aire: 10-15 por h; luz/oscuridad: 12 h - 12 h.
- Esterilizar todo el equipo de jaulas y utilizar lecho irradiado. Implementar sistemáticamente enriquecimiento jaula colocando toallas y bandejas de cartón estériles dentro de las jaulas.
- Permitir el acceso a la zona bajo condiciones restringidas: nuevo capó de laboratorio capa, máscara, guantes, calzado y cabello en la entrada.
- Realizar vigilancia de la salud Colonia de animales centinela ubicados en ropa de cama sucia en una base anual, según las recomendaciones de personal14 para instalaciones convencionales. Mantener cuatro o cinco animales por jaula, con el apropiado irradiado de la dieta y proporcionaran acidifica el agua ad libitum. Diario monitor.
- Transferencia de ratas elegidas para la intervención quirúrgica en jaulas superior a las habitaciones quirúrgicas 2 h antes de la cirugía de filtración.
2. quirúrgico
- Preparar el instrumental quirúrgico: fino tijeras, una pinza, dos pinzas hemostáticas y un sostenedor de la aguja. Durante todos los procedimientos, usar guantes, una máscara, una capucha y una capa del laboratorio.
- Las ratas se dividen aleatoriamente en dos grupos (PRP y solución salina).
- Sacar a la rata de su jaula y pésalo. Utilice etiquetas de oreja numeradas para identificar las ratas. Para evitar la desecación de los ojos, colocar gotas en la córnea.
- Anestesiar la rata por vía intraperitoneal con xilacina (10 mg/kg de peso corporal) y ketamina (80 mg/kg de peso corporal). Para confirmar la anestesia, colocar los animales bajo vigilancia cardio-respiratoria y verifique cualquier reflejos oculares.
- Inyectar 50 μl de la buprenorfina por vía subcutánea (0.01-0.05 mg/kg cada 8-12 h) en la zona del cuello como un analgésico.
- Afeitarse las extremidades izquierda con una afeitadora eléctrica, desinfectar con 3 alternando peelings de solución alcohol iso-betadine (diluido 1:10) y colocar la rata en una almohadilla caliente (20 ° C) con un microscopio de disección. Colocar la rata en decúbito lateral con la pierna para ser operados en una posición superior. Sostenga la pata con pinzas quirúrgicas.
- Con las tijeras, haga una pequeña incisión lateral (20-25 mm) en la piel que rodea el tendón de Aquiles izquierdo y disecar la fascia con tijeras finas para exponer el complejo del tendón de Aquiles (Figura 2a).
- Retire el tendón de los plantaris con un par de tijeras (figura 2b).
- Cortar el tendón de Aquiles transversalmente 5 mm proximal a su inserción calcánea y quitar una porción larga de 5 mm con unas tijeras. La no sutura del tendón (figura 2C, 2d).
- La sutura la fascia y la piel con hilo reabsorbible haciendo una overjet sutura (sutura continua). Suturas de monofilamento pueden utilizarse también para prevenir la absorción de la piel en la incisión quirúrgica.
- Coloque la rata bajo una lámpara de calefacción hasta que despierto y luego vuelva a colocar la rata en una jaula (58 x 38 cm) (Nota bene: no se impone inmovilización).
3. PRP preparación15
- Anestesiar las ratas donantes con xilacina (10 mg/kg de peso corporal) y ketamina (80 mg/kg de peso corporal) por inyección intraperitoneal. La inyección de PRP se realiza 2 h después de la operación sin ningún re-anestésico.
- Inyectar 50 μl de la buprenorfina por vía subcutánea como un analgésico.
- Recoger sangre (20 mL por rata, sangrado final) por punción cardiaca en tubos estériles que contienen 3.2% tamponada con citrato de sodio (0,109 M, anticoagulante lúpico). Entonces eutanasia la rata por inyección intracardiaca.
- Para obtener PRP, centrifugar la sangre 10 min a 150 x g y temperatura ambiente. Este paso de centrifugación de baja velocidad inicial rinde dos fases: una fase baja de glóbulos rojos (gr) que representa el 80-90% del volumen total y una fase superior de plasma rico en plaquetas (PRP) (típicamente 10-20% de la sangre muestra).
- Recoger suavemente el PRP (fase superior) en un tubo de plástico secundario utilizando una pipeta de transferencia plástica. Como la interfaz entre PRP y células de sangre rojas es muy floja, no pipetear demasiado cerca a la interfaz. Cuando se maneja adecuadamente, contaminando los glóbulos rojos en el PRP debe estar por debajo de 0.05 x 103 células / μl. descartar la fase inferior restante y el tubo de la colección de sangre primaria.
- Determinar el volumen de PRP recoger y medir el recuento de plaquetas en un analizador de la hematología. Estos valores son necesarios para los cálculos ajustar la concentración de plaquetas en el siguiente paso. Un recuento de células sanguíneas es también útil para evaluar la posible contaminación con glóbulos rojos y concentración de glóbulos blancos. plaquetaria en PRP en esta etapa suele ser de 1 a 1,5 x106/µL.
- Realizar una segunda centrifugación de PRP por 10 min a 1.000 x g y temperatura ambiente. Este paso de centrifugación de alta velocidad produce un pellet de plaqueta flojo y un sobrenadante de plasma pobre en plaquetas autólogo (PPP). Utilizando los valores determinados en el paso 3.6, calcular el volumen de sobrenadante que se descarten para concentrar el PRP y llegar a una concentración final de 2.5 x106/µL.
- Recoger con cuidado el sobrenadante (PPP) en un tubo de plástico secundario utilizando una pipeta de plástico, dejando cerca de dos tercios del volumen final calculado en el paso 3.7. Como el sedimento suelto, una cantidad significativa de plaquetas se pierde cuando PPP se descarta, por lo tanto, potencialmente reduciendo la concentración final deseada.
- Con cuidado Resuspender el precipitado de la plaqueta con el sobrenadante restante mediante pipeteo repetido suave. Medir el recuento de plaquetas en este concentrado PRP. Si es necesario, añadir el volumen adecuado de PPP autólogo para alcanzar la concentración final del objetivo.
Nota: Use el PRP dentro de 3 horas de preparación. - Añadir 50 μl de CaCl2 (11 mEq 10 mL) por cada mL de PRP para activar las plaquetas.
- Inyectar 50 μl de PRP fresco o solución salina con una aguja de 21G directamente en el sitio de operación suturado sobre 1 h después de la preparación. Durante este tiempo, mantener el PRP a temperatura ambiente.
- Monitorear la recuperación funcional de las ratas de cerca durante los días después de la cirugía y antes del retiro del tendón de Aquiles.
4. retiro del tendón de Aquiles y pruebas biomecánicas16
- 5, 15 o 30 días más5, peso de la rata. Entonces, anestesiar con xilacina (10 mg/kg de peso corporal) y ketamina (80 mg/kg de peso corporal) por inyección intraperitoneal.
- Inyectar 50 μl de la buprenorfina por vía subcutánea como un analgésico. Retire el tendón antes de sacrificar al animal para mantener las condiciones fisiológicas durante el mayor tiempo posible.
- Afeitarse las extremidades izquierda y coloque la rata con un microscopio de disección. Colocar la rata en decúbito lateral con la pierna para ser operados en una posición superior. Sostenga la pata con los dedos.
- Hacer una incisión pequeña (10 mm) en el sitio de la operación anterior y extender hasta que quede expuesto el tríceps suralis.
- Para remover el curación del tendón de Aquiles, corte distal del hueso calcáneo transversalmente de 5-10 mm para su fijación al tendón de Aquiles. Luego diseccionar una parte de los tríceps suralis, que se une al tendón de Aquiles (figura 3b). La parte de músculo tiene que ser lo suficientemente grande como para caber en el cryo-maxilar (figura 3 c-d). Coloque la muestra inmediatamente en la crio-mandíbula con unas pinzas (figura 3e).
- Después de quitar el complejo músculo-tendón-hueso, eutanasia la rata por inyección intracardiaca con Nembutal (200 mg/kg). Confirman muerte por evaluar la ausencia de ritmo cardíaco y la respiración durante 15 minutos.
- Coloque la unidad del músculo en la mandíbula superior (figura 3e), cerrarlo y colocarlo verticalmente en un universal máquina de prueba (106.2 kN, figura 3a). A continuación fijar el hueso entre las abrazaderas inferiores de la máquina (figura 3f).
- Añadir nitrógeno líquido en dos de las cuencas de la mandíbula superior para inmovilizar el músculo, por lo que es un orden de magnitud más rígido que el tendón y no se deforma durante el ensayo de tracción.
- Cuando la zona de congelación alcanza la frontera de la abrazadera metálica, iniciar el ensayo de tracción, por lo que el tendón conservan su estructura. Fijar la tasa de desplazamiento de la máquina a una velocidad constante de 1 mm/s hasta la ruptura. Grabar la última resistencia a la tracción (UTS) dado en Newtons (N) en un equipo.
- Para calcular el área transversal, colocar dos cámaras perpendiculares entre sí, formando una forma elíptica y tomar fotografías.
- Para tener en cuenta la diferencia en el área transversal de los curación de tendones, normalizar las UTS a una área de unidad (N por milímetro cuadrado), que representa el estrés mecánico sufrido por el tejido.
5. histológico análisis
Nota: 15 tendones de cada grupo experimentaron el análisis histológico.
- Después de su retiro, sumerja el tendón de Aquiles en paraformaldehído al 4% para preservar su estructura (1 mm de tejido se fija por hora, por lo que el tiempo de fijación varía según el tamaño del tendón).
- Sustituir el paraformaldehído por etanol al 70% y dejo la muestra para al menos una noche en esta solución.
- Coloque el tendón en un pequeño recipiente plástico con agujeros y colocar ese contenedor en una solución de etanol 70% fresco durante 1 hora.
- Lugar el contenedor en etanol al 95% para h. 1 repetición.
- Lugar el contenedor en etanol al 100% para 1 h. repetir.
- Lugar el contenedor 100% xileno de 1 h. repetir.
- Coloque el envase de plástico, que contiene el tendón, en parafina líquida (56 ° C) y dejarlo toda la noche.
- Usando una estación empotrar (equipada con cera fundida, un plato caliente y una placa fría), elija un molde metálico que mejor se adapte a la muestra de tejido y llene con parafina líquida un poco para que la base es cubierta.
Nota: Orientar la muestra para obtener las secciones verticales en el micrótomo. - Cuando la muestra esté correctamente posicionada, llenar el molde con parafina líquida y colóquela en la máquina de refrigeración. Deje que se enfríe durante al menos 15 minutos.
- Retire el bloque de parafina y coloque en hielo durante al menos 30 minutos.
- Preparar varios portaobjetos de vidrio limpio y poner algunas gotas de agua desionizada en ellos.
- En el micrótomo, cortar los bloques en secciones de 5 μm (sólo uso las secciones de la parte media del tendón) y coloque la sección en una diapositiva.
- Coloque los portaobjetos en un horno de calentamiento a 65 ° C durante varios minutos, para que la parafina sólo comienza a derretir para adherir el tejido para el vidrio.
- Coloque el portaobjetos que contiene secciones de la parafina en un sostenedor de la rebanada.
- Ahora Desparafinizar y rehidratar el tejido, colocando en los baños sucesivos siguientes:
8 min en xileno (baño 1)
4 min en xileno (baño 2)
2 minutos en etanol al 100%
2 minutos en etanol al 95%
2 minutos en etanol al 70%
2 min en agua desionizada - Para la coloración de la Hematoxylin-eosina, colocar el tejido en las siguientes soluciones.
- Sumergir el tejido durante 8 min en la solución de hematoxilina (1 g hematoxilina monohidrato, 0,2 g KIO3, 50 g AIK (SO4)2.12H2O; glicerina 200 mL; ajustar a 1 L con agua destilada).
- Sumergir el tejido durante 8 min con agua corriente.
- Sumergir el tejido durante 30 s en la solución de eosina (eosina de 0.25% en 100 mL de agua destilada que contiene 200 μL de ácido acético sin diluir).
- Sumergir el tejido por 2 min con agua corriente.
- Para la tinción tricrómica de Masson, siga estos pasos.
- Después de la rehidratación, colocar los elementos en un recipiente con el alumbre de hierro (0.5 g (NH4) Fe (SO4)2.12H2O en 10 mL de H2O) y cerrar el recipiente. Caliente durante 3 minutos a 280 W en el microondas.
- Dejarlo enfriar unos minutos y luego enjuague con agua desionizada.
- Colocar los elementos en un recipiente cerrado con solución de hematoxilina de Regaud (hematoxilina 0.5 g disuelta en 50 mL de H2O a 50 ° C, luego agregar 5 mL de etanol de 95% y 5 mL glicerina), calor para 90 s a 280 w.
- Enjuague con agua desionizada.
- Colocar los elementos en una solución de ácido pícrico (a saturación en metanol) para 3 minutos, enjuague durante 5 minutos con agua corriente y colocarla en agua desionizada durante unos segundos.
- Ahora coloque las secciones en fuchsin ácido (0,5 g en 50 mL de H2O que contenga 0.25 mL de ácido acético sin diluir) durante 5 s y enjuague con agua corriente hasta que desaparezca el tinte.
- Incubar las secciones de solución de ácido fosfomolíbdico (0,5 g en 50 mL de H2O) durante 5 minutos, colocar unos segundos en agua desionizada.
- Colocar los elementos en una solución de verde claro (0,5 g en 50 mL de H2O que contenga 0.25 mL de ácido acético sin diluir) durante otros 5 minutos y colóquelo bajo el chorro de agua del grifo hasta que desaparezca el tinte.
- Ahora deshidratar el tejido otra vez.
- Sumerja la sección durante 1 minuto en etanol al 70%.
- Sumerja la sección durante 1 minuto en etanol al 95%.
- Sumerja la sección durante 1 minuto en etanol al 100%.
- Sumerja la sección durante 1 minuto en xileno (baño 1).
- Sumerja la sección durante 1 minuto en xileno (baño 2).
- Quitar las secciones sin quitar demasiado xileno y poner una gota de medio de montaje en la muestra.
- Poner un cubreobjetos encima (sin provocar burbujas) y se deja endurecer durante al menos 2 h.
- Hidrolizar 5 secciones histológicas (cada uno de un tendón diferentes) de cada grupo en 6 N HCl 3 h y determinar la concentración de colágeno mediante la medición de hidroxiprolina como un índice de 5 μm sin mancha secciones.
- Normalizar los resultados por el área de la sección utilizando el software del fabricante.
- Algunas de las secciones de la mancha con luz verde de la mancha para visualizar y cuantificar colágeno fibrilar por análisis asistida por ordenador.
- Analizar las secciones y convertir las imágenes en matices de gris utilizando el software IrfanView. Utilice el software para la semi-cuantificación (p. ej., una cantidad).
6. evaluación molecular
- Después de la ruptura de un tendón, que ocurre durante las pruebas mecánicas, tomar las muestras, complemento los congelan en nitrógeno líquido y almacenar a-80 ° C (PRP y solución salina)17.
- Use un kit comercial de ARN Total para aislar RNA total17.
- Medir la expresión de colágeno (Col I y III de la Col), metaloproteinasas de matriz (MMP-2 y MMP-9 y MMP-3) y tenomodulin (TNMD) por RT-PCR17,18.
- Normalizar los niveles de expresión de mRNA a los niveles de 28S19.
Resultados
Los resultados se expresan como la media ± desviación estándar de la media y se compararon con el análisis de varianza (ANOVA). Un dos vías ANOVA y post hoc de Scheffé, que es una prueba paramétrica, se utilizaron la prueba.
Máxima resistencia a la tracción (UTS) necesaria para provocar una ruptura de los tendones de Aquiles no lesionados de las ratas fue 42.0 ± 5.7 N (n = 10). La fuerza extensible aumenta significativamente (p < 0.0001) en ambos grupos después de día 5. Comparando ambos grupos, las UTS fue mayor en el grupo PRP en cualquier momento medido, sobre todo en el día 15 y 30. Al medir el área transversal de los tendones que fueron quitadas antes de someterse a evaluación biomecánica (11,4 ± 5.5 mm2 para tendones no heridos), se encontró que en el día 5, fue mayor en el grupo tratado salino. Pero en el día 15 y 30, el área transversal fue mayor en el grupo PRP, aunque esta cantidad fue más variable en comparación con el grupo tratado salino (figura 4 y figura 5).
La evaluación histológica de los tendones, usando la hematoxylin-eosina, tinción, demostró una alta celularidad en día 5, que luego disminuyeron (ninguna diferencia significativa fue observada entre el grupo PRP y solución salina). TRICROMICA de Masson la coloración mostró una mayor presencia de colágeno fibrilar en el grupo PRP en día 5 y 15. Sin embargo la intensidad de la tinción fue similar en ambos grupos de 30 días después de la inyección (figura 6). La semi-cuantificación obtenido por la coloración de las muestras con luz verde demostró que en el día 5 y 15, la intensidad fue mayor en el grupo PRP (no estadísticamente significativo) pero en el día 30, no hubo diferencias entre los dos grupos.
Los datos se normalizaron midiendo la cantidad de un aminoácido, hidroxiprolina, que es específica para colágeno, confirmando la semi-cuantificación histológica (día 5: valor mayor en el grupo PRP). La concentración de colágeno no era estable en el grupo PRP pero fue estabilizada en el día 30 en los dos grupos. El volumen del callo se midió y fue encontrado para ser perceptiblemente más grande en animales tratados con PRP en las primeras etapas del proceso curativo. Tomados en conjunto, estos resultados implican que la inyección de PRP en el tendón lesionado causa una importante cantidad de colágeno fibrilar a depositar.
No medir el nivel de expresión de varias moléculas mostró que en los no lesionados tendones, Col III y TNMD se presente en menor cantidad (2.5 - 3.0 veces) que en curación de tendones en el día 15, sin embargo hubo diferencias en Col I expresión entre los grupos. MMPs estuvieron presentes en mayor concentración en la curación de tendones 12-fold. Además, en el día 30, hubo un aumento significativo de COL1A1 en el grupo PRP, y se encontró una correlación positiva entre expresión de COL1A1 y los UTS. En ambos grupos, se encontró que Col III fue expresada en una gran cantidad desde el día 1 hasta el día 14, antes de que disminuyó (igual para ambos grupos). Concentración de MMP-9 no cambió en ambos grupos pero MMP-2 y MMP-3 estaban presentes en concentraciones más altas durante el período de cicatrización. En el día 5, TNDM fue expresado en una mayor cantidad en el PRP (p < 0,03) pero luego se redujo entre 15 y 30 días.

Figura 1: diseño Experimental del estudio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Procedimiento quirúrgico.
(a) el complejo del tendón después del retiro de la faja circundante.
(b) retiro del tendón de los plantaris.
(c) eliminación de una sección del tendón de Aquiles.
(d) los 2 tendones que han sido eliminados. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Pruebas biomecánicas
(a) máquina de prueba Universal (106.2 kN).
(b) el complejo músculo-tendón-hueso que se fija en la mandíbula de cryo.
(c) superior e inferior mandíbula cryo
(d) superior e inferior cryo-mandíbula
(e) el complejo en la mandíbula de cryo
(f) la cerrada cryo-mandíbula que contiene el complejo músculo-tendón-hueso fijado en la máquina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Resultados de las pruebas biomecánicas
Resistencia a la tracción expresada en Newtons (N) en el control y grupos PRP en los diferentes puntos temporales después de la cirugía. Hubo un aumento de UTS en ambos grupos con el tiempo, con el grupo PRP muestra valores significativamente superiores a los 15 y 30 días después de la cirugía.
Barra de error define la desviación estándar (SD). Haga clic aquí para ver una versión más grande de esta figura.
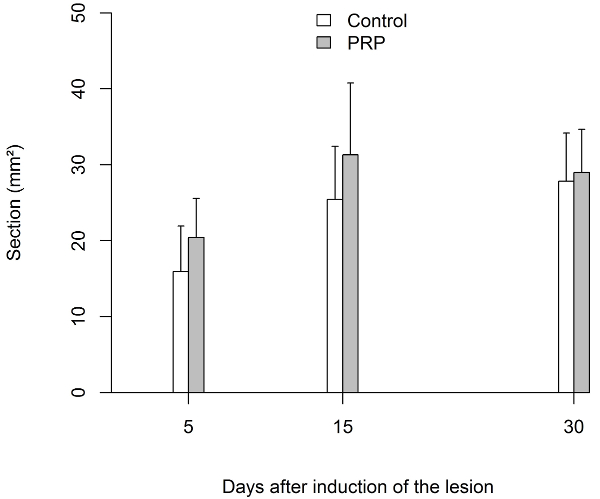
Figura 5: Resultados de las pruebas biomecánicas
Área transversal del tendón expresado en milímetros cuadrados (mm2). El área transversal fue significativamente mayor en el grupo PRP hasta el día 15. Luego, la sección era similar en ambos grupos.
Barra de error define la desviación estándar (SD). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Resultados histológicos
Secciones representativas longitudinales del tendón de Aquiles de control y grupos PRP, teñidas con TRICROMICA de Masson. Barra de escala = 100 μm. Hay una coloración verde más fuerte en el tendón del grupo PRP en día 5. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las plaquetas son esenciales para la primera fase inflamatoria del tendón del proceso de curación. Cuando estas plaquetas están expuestas a atar el tejido o factores que inducen coagulación, liberan factores de crecimiento que se almacenan en los gránulos α. Debido a esta interacción, macromoléculas de la matriz extracelular son sintetizado y proliferan las células mesenquimales. Las plaquetas tienen también una actividad quimiotáctica sobre las células progenitoras en la circulación de la sangre, mejorar la angiogénesis y estimular la diferenciación celular6,20.
Pruebas biomecánicas se realizó utilizando un dispositivo de sujeción hecho especialmente para ex vivo ensayos de tracción del tendón de Aquiles en ratas15. La cryo-mandíbula permite la congelación del músculo mediante la adición de nitrógeno líquido, y el hueso del calcáneo, que es la parte inferior de la muestra, se fija directamente en la máquina. Es muy importante iniciar el ensayo de tracción cuando el músculo está completamente rígido, pero el tendón es aún flexible. Esta técnica evita el daño tisular y preserva la integridad mecánica. También esta técnica es simple, seguro, no compresiva y demostrable, reproducible, ya que varios estudios han usado este método4,15.
Para apoyar los resultados mecánicos, algunos tendones experimentaron la evaluación histológica. La tinción de hematoxilina-eosina muestra un gran Resumen del tejido curado y proporciona información general acerca de la cantidad de células y el colágeno presente. Además, la medición de hydroxyprolin es útil ya que es un aminoácido que sólo se encuentra en colágeno y permite la objetivación de los datos histológicos. Sin embargo, es necesario realizar una tinción tricrómica de Masson, ya que muestra mucha más información detallada acerca de la deposición y la concentración de colágeno fibras4.
Aunque el nivel de colágeno III mRNA de PRP trata tendones no fue alterada, al día 30 mRNA de Col yo estuve presente en una concentración más alta en los tendones lesionados tratados con PRP. Previamente se había demostrado que PRP interfiere con la proliferación de macrófagos y la producción de IL-121, que así podría evitar una excesiva reacción inflamatoria durante las primeras etapas de la curación del proceso11. Es posible que el PRP estimula la proliferación, la activación de vías metabólicas y la transformación de células mesenquimales en tenocytes activos.
Altas concentraciones de TNDM en los tendones del grupo PRP indican que las moléculas inyectadas podrían atraer las células circulantes en el torrente sanguíneo e inducir una diferenciación hacia el fenotipo de tenocyte11. Tomados en conjunto, estos resultados demuestran que una única inyección de PRP en una ruptura del tendón de Aquiles tiene un efecto positivo en la fase de cicatrización temprana y conduce a una mayor resistencia mecánica.
Varios estudios preclínicos han demostrado ya que PRP mejora el proceso de curación, y que los diferentes factores de crecimiento tienen acciones específicas durante este proceso22. Mazzocca y su equipo demostraron que PRP estimula la proliferación celular en los músculos, huesos y tendones. De diferentes preparaciones, PRP fuertemente concentrado sin cualquier células blancas de la sangre demostró para ser el más eficaz tratamiento23. McCarrell et al. hizo un experimento similar, prueba varias preparaciones de PRP que contienen diferentes concentraciones de PRP y células de sangre blancas en tendones de caballo. Los preparados que contengan una concentración intermedia de plaquetas y una alta concentración de glóbulos blancos condujeron a una mayor liberación de citoquinas proinflamatorias, como IL-1ß y el TNFa y la menor síntesis de colágeno. Mezclas con alta concentración de plaquetas y glóbulos blancos también condujeron a un aumento de citoquinas inflamatorias, pero la síntesis de colágeno inhibido. En conclusión, esto significa que si la concentración de plaquetas es demasiado alta, metabolismo de la célula y la síntesis del colágeno se retrasó24. Boswell et al. confirmaron estos resultados25. La más eficaz preparación de PRP así contendría una concentración de plaquetas inferior a 106 plaquetas/μl y sin leucocitos.
Una ventaja importante del uso de PRP es autogenity. Aunque en nuestro estudio, utilizamos PRP allogeneic por sacrificar ratas donantes para tener una cantidad suficiente de sangre. Además, tomando la sangre de las ratas operadas debilitarlos demasiado. Otra limitación de este estudio es que todas las rupturas son agudas y realizados en tendones sanos, que no siempre es el caso de los seres humanos, como los tendones se rompen a menudo debido a degeneración previa. Este modelo está basado en lesiones aguda del tendón, no puede extraerse ninguna conclusión definitiva para tendinopatías degenerativas.
Usando este método, hay algunos pasos importantes para recordar, la primera de ellas es la preparación de PRP, que debe ser como reproducible como sea posible. Otro paso fundamental es el procedimiento quirúrgico: el retiro del tendón y músculo-tendón complejo debe hacerse de una manera reproducible para evitar cualquier sesgo. Por último, la preparación para las pruebas de Biomecánica: se añade nitrógeno líquido para congelar el músculo, y es muy importante que el tendón no está congelado en este proceso porque podría conducir a resultados sesgados, como la rigidez del tendón se alteraría. Esto también es una limitación del estudio, ya que no existe ningún protocolo estandarizado para asegurar que no se modifica la elasticidad del tendón.
Basamos nuestro método en el método desarrollado por Virchenko et al. 26, pero adaptada con la crio-mordaza que protege el tendón contra agresiones exteriores inducida por abrazaderas. La gran ventaja de este método es que es reproducible, incluso si no está todavía estandarizado. Da una idea de cómo podían tratar lesiones de los tendones en humanos, aunque experimentos con ratas no siempre traducen bien al tratamiento de lesiones humanas. Es probable que una versión adaptada de este método puede ser útil en el tratamiento de esas lesiones en el futuro, apoyado por el hecho de que es fácil de usar, tiene un costo relativamente bajo y es menos invasivo que otros métodos.
Divulgaciones
No hay conflicto de interés declarado.
Agradecimientos
Este estudio fue apoyado por el Standard de Lieja y Lejeune - Lechien subvenciones de los fondos de Frédéricq de León.
Materiales
| Name | Company | Catalog Number | Comments |
| Xylazine (Xyl-M) | VMD | none | anesthetic |
| Ketamin (Jétamine 1000 CEVA) | CEVA Santé Animale | none | anesthetic |
| Buprenorphin (Vetergésic Multidosis) | ALSTOE | none | Painkiller |
| iso-Betadine | MEDA-Pharma | none | Desinfectant |
| resorbable yarn Vicryl 6/0 | Johnson & Johnson | ||
| Nembutal | CEVA Santé Animale | none | Anesthetic |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Preserves structure of the tissue |
| Isopropanol 100% | VWR | 20,922,364 | |
| Ethanol 95% | VWR | 20,823,362 | |
| Xylene | VWR | 28973.363 | |
| Paraffin | VWR | LEIC3950.1006 | |
| Hematoxylin | Millipore | 1.15938.0025 | Colorant |
| Eosin | Millipore | 1.15935.0100 | Colorant |
| Eukitt | Sigma-Aldrich | 3989 | Mounting Medium |
| CaCl2 |
Referencias
- Kaux, J., Degrave, N., Crielaard, J. Platelet rich plasma traitement des tendinopathies chroniques? Revue de la littérature. Platelet rich plasma treatment of chronic tendinopathies? Review of literature. J. Traumatol. du Sport. 24, 99-102 (2007).
- Anitua, E., et al. Autologous preparations rich in growth factors promote proliferation and induce VEGF and HGF production by human tendon cells in culture. J. Orthop. Res. 23, 281-286 (2005).
- Bosch, G., et al. Effects of platelet-rich plasma on the quality of repair of mechanically induced core lesions in equine superficial digital flexor tendons: A placebo-controlled experimental study. J. Orthop. Res. 28, 211-217 (2010).
- Kaux, J. F., Drion, P., Croisier, J. L., Crielaard, J. M. Tendinopathies and platelet-rich plasma (PRP): From pre-clinical experiments to therapeutic use. J. Stem Cells Regen. Med. 11, P7-P17 (2015).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin. Sports Med. 22, 675-692 (2003).
- Molloy, T., Wang, Y., Murrell, G. The roles of growth factors in tendon and ligament healing. Sports Med. 33, 381-394 (2003).
- Lyras, D. N., et al. The effect of platelet-rich plasma gel in the early phase of patellar tendon healing. Arch. Orthop. Trauma Surg. 129, 1577-1582 (2009).
- Aspenberg, P., Virchenko, O. Platelet concentrate injection improves Achilles tendon repair in rats. Acta Orthop. Scand. 75, 93-99 (2004).
- Visser, L. C., et al. Growth Factor-Rich Plasma Increases Tendon Cell Proliferation and Matrix Synthesis on a Synthetic Scaffold: An In Vitro Study. Tissue Eng. Part A. 16, 1021-1029 (2010).
- Zhang, J., Wang, J. H. -. C. Platelet-Rich Plasma Releasate Promotes Differentiation of Tendon Stem Cells Into Active Tenocytes. Am. J. Sports Med. 38, 2477-2486 (2010).
- Kajikawa, Y., et al. Platelet-rich plasma enhances the initial mobilization of circulation-derived cells for tendon healing. J. Cell. Physiol. 215, 837-845 (2008).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors-diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Dell, R. B., Holleran, S., Ramakrishnan, R. Sample size determination. ILAR J. 43, 207-213 (2002).
- Mähler Convenor, M., et al. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units. Lab. Anim. 48, 178-192 (2014).
- Kaux, J. -. F., et al. Étude comparative de cinq techniques de préparation plaquettaire (platelet-rich plasma). Pathol. Biol. 59, 157-160 (2011).
- Wieloch, P., Buchmann, G., Roth, W., Rickert, M. A cryo-jaw designed for in vitro tensile testing of the healing Achilles tendons in rats. J. Biomech. 37, 1719-1722 (2004).
- Kaux, J. -. F., et al. Vascular Endothelial Growth Factor-111 (VEGF-111) and tendon healing: preliminary results in a rat model of tendon injury. Muscles. Ligaments Tendons J. 4, 24-28 (2014).
- Docheva, D., Hunziker, E. B., Fässler, R., Brandau, O. Tenomodulin is necessary for tenocyte proliferation and tendon maturation. Mol. Cell. Biol. 25, 699-705 (2005).
- Lambert, C. A., Colige, A. C., Munaut, C., Lapière, C. M., Nusgens, B. V. Distinct pathways in the over-expression of matrix metalloproteinases in human fibroblasts by relaxation of mechanical tension. Matrix Biol. 20, 397-408 (2001).
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front. Biosci. 13, 3532-3548 (2008).
- Woodall, J., Tucci, M., Mishra, A., Benghuzzi, H. Cellular effects of platelet rich plasma: a study on HL-60 macrophage-like cells. Biomed. Sci. Instrum. 43, 266-271 (2007).
- Taylor, D. W., Petrera, M., Hendry, M., Theodoropoulos, J. S. A systematic review of the use of platelet-rich plasma in sports medicine as a new treatment for tendon and ligament injuries. Clin. J. Sport Med. 21, 344-352 (2011).
- Mazzocca, A. D., et al. The positive effects of different platelet-rich plasma methods on human muscle, bone, and tendon cells. Am. J. Sports Med. 40, 1742-1749 (2012).
- McCarrel, T. M., Minas, T., Fortier, L. A. Optimization of leukocyte concentration in platelet-rich plasma for the treatment of tendinopathy. J. Bone Joint Surg. Am. 94 (1-8), e143 (2012).
- Boswell, S. G., et al. Increasing platelet concentrations in leukocyte-reduced platelet-rich plasma decrease collagen gene synthesis in tendons. Am. J. Sports Med. 42, 42-49 (2014).
- Virchenko, O., Aspenberg, P. How can one platelet injection after tendon injury lead to a stronger tendon after 4 weeks?: Interplay between early regeneration and mechanical stimulation. Acta Orthop. 77, 806-812 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados