Method Article
Fabricação de dispositivos microfluídicos tridimensional baseados em papel para imunoensaios
Neste Artigo
Resumo
Nós pormenor um método para fabricar dispositivos microfluidicos tridimensionais à base de papel para uso no desenvolvimento de imunoensaios. A nossa abordagem para o dispositivo de montagem é um tipo de camadas múltiplas, de fabrico aditivo. Nós demonstramos um imunoensaio sanduíche para fornecer resultados representativos para esses tipos de dispositivos baseados em papel.
Resumo
Papel absorve fluidos autonomamente devido à ação capilar. Por padronização papel com barreiras hidrofóbicos, o transporte de fluidos pode ser controlada e orientada dentro de uma camada de papel. Além disso, empilhando camadas múltiplas de papel decorado cria sofisticadas redes microfluídicos tridimensionais que podem apoiar o desenvolvimento de ensaios analíticos e bioanalíticos. microcanais à base de papel são barato, portátil, fácil de usar, e não requerem equipamento externo para operar. Como resultado, eles são uma grande promessa como uma plataforma para diagnóstico point-of-care. A fim de avaliar adequadamente a utilidade e o desempenho analítico de dispositivos baseados em papel, devem ser desenvolvidos métodos adequados para assegurar o seu fabrico é reprodutível e a uma escala que é apropriado para ambientes de laboratório. Neste texto, um método para fabricar uma arquitectura geral do dispositivo que pode ser utilizado para os imunoensaios à base de papel é descrito. Nós usamos uma forma de manufacturin aditivog (laminação multi-layer) para preparar dispositivos que integram múltiplas camadas de papel decorado e adesivo padronizado. Além de demonstrar o uso correto desses dispositivos microfluídicos tridimensionais baseados em papel com um imunoensaio para gonadotrofina coriônica humana (hCG), erros no processo de fabricação que podem resultar em falhas do dispositivo são discutidas. Esperamos que esta abordagem para a fabricação de dispositivos baseados em papel vai encontrar ampla utilidade no desenvolvimento de aplicações analíticas projetadas especificamente para as configurações de recursos limitados.
Introdução
O papel é amplamente disponível numa gama de graus ou formulações, pode ser funcionalizado de modo a ajustar as suas propriedades, e podem transportar fluidos de forma autónoma, por acção capilar ou de drenagem. Se o papel é modelado com uma substância hidrofóbica (por exemplo, uma foto-resistente ou cera 2), o que a absorção de fluidos pode ser controlada espacialmente dentro de uma camada de papel. Por exemplo, uma amostra aquosa pode ser aplicada dirigida para um certo número de zonas diferentes para reagir com reagentes químicos e bioquímicos armazenados dentro do papel. Estes dispositivos de microfluidos à base de papel tem sido demonstrado ser uma plataforma útil para o desenvolvimento de ensaios analíticos portáteis e barato 3, 4, 5, 6, 7. Aplicações de dispositivos microfluídicos em papel incluem diagnósticos point-of-careef "> 8, a monitorização dos contaminantes ambientais 9, a detecção de produtos farmacêuticos falsificados 10, e cuidados de saúde deslocalizado (ou" telemedicina ") em recursos limitados definições 11.
Múltiplas camadas de papel modelado podem ser montadas em um dispositivo integrado onde as zonas hidrofílicas de camadas vizinhos (ou seja, acima ou abaixo) se unem para formar redes fluídicos contínuas cujas entradas e saídas podem ser acoplados ou para a esquerda independente. 12 Cada camada pode compreender um padrão único, o que permite a separação espacial dos reagentes e ensaios múltiplos a serem realizadas num único dispositivo. O dispositivo de microfluidos resultante tridimensional é não só capaz de fluidos de drenagem para permitir que os ensaios analíticos (por exemplo, a função hepática testa 13 e detecção electroquímica de pequenas moléculas de 14), mas pode também supporta de uma série de funções sofisticadas (por exemplo, as válvulas 15 e simples máquinas 16) comuns às abordagens microfluídicos tradicionais. Importante, porque o papel absorve fluidos por acção capilar, estes dispositivos podem ser operados com um mínimo esforço por parte do utilizador.
Uma vez que os reagentes podem ser armazenados no interior da arquitectura tridimensional de um dispositivo à base de papel, protocolos complexos pode ser reduzida a uma única adição da amostra aquosa de um dispositivo. Recentemente, foi introduzido um dispositivo de arquitectura tridimensional geral que pode ser utilizado para o desenvolvimento de imunoensaios à base de papel utilizando a técnica de cera-impressão para criar camadas padronizadas. 17, 18 Estes estudos concentraram-se sobre a forma como os aspectos relacionados com a concepção do dispositivo de número de camadas empilhadas utilizado, a composição das camadas, e o padrão da rede controlado-a por global de microfluidos tridimensionaldesempenho do imunoensaio. Em última análise, nós fomos capazes de usar essas regras de design para facilitar o rápido desenvolvimento de um imunoensaio multiplexado 19. Neste manuscrito, um imunoensaio previamente desenvolvido para gonadotrofina coriônica humana (hCG; hormônio da gravidez) 17 é usado como um exemplo para ilustrar as estratégias que desenvolvemos para a montagem e fabrico de imunoensaios baseados em papel tridimensionais. Assim, vamos nos concentrar na montagem e operação de um dispositivo em vez do desenvolvimento de um ensaio.
Em um imunoensaio sanduíche, que é o formato utilizado para detectar hCG, um anticorpo de captura específico para uma subunidade da hormona é revestida sobre um substrato sólido, o qual é então bloqueado para limitar a adsorção não específica de uma amostra ou qualquer reagente subsequente. Este substrato é na maioria das vezes uma placa de micropoços de poliestireno (por exemplo, por um ensaio de imunossorvente ligado a enzima ou ELISA). A amostra é entãoadicionada a um poço e deixadas a incubar durante um período de tempo. Após lavagem rigorosa, é adicionado um anticorpo específico para a outra subunidade da hCG e deixado a incubar. Este anticorpo de detecção pode ser conjugado com uma partícula coloidal, enzima, fluoróforo ou a fim de produzir um sinal mensurável. O poço é novamente lavadas antes da interpretação dos resultados de um ensaio (por exemplo, utilizando um leitor de placas). Enquanto kits comerciais contam com este processo de vários passos que consomem tempo, todos estes passos podem ser executados rapidamente em microcanais à base de papel com um mínimo de intervenção para o utilizador.
O dispositivo utilizado para o imunoensaio hCG é composto por seis camadas activas, que são, de cima para baixo, utilizadas para a adição da amostra, armazenamento conjugado, incubação, captura, lavagem e blot (Figura 1). A camada de adição da amostra é feita de papel de filtro qualitativo. Isso facilita a introdução de uma amostra líquida e protege os reagentes na Laye conjugador de contaminação do ambiente ou de contacto acidental por parte do utilizador. A camada de conjugado (papel de filtro qualitativo) mantém o reagente produtor de cor (por exemplo, anticorpo, marcado com ouro coloidal) para o imunoensaio. A camada de incubação (papel de filtro qualitativo) permite que a amostra de viajar lateralmente dentro do plano do papel para promover a ligação do analito com reagentes antes de atingir a camada seguinte, a camada de captura. A camada de captura (membrana de nylon) contém ligandos específicos para o analito adsorvido ao material. Depois o ensaio é terminado, esta camada é revelada a permitir a visualização do imunocomplexo concluída. A camada de lavagem (papel filtro qualitativo) chama o excesso de líquidos, incluindo reagentes conjugados livres de distância da face da camada de captura para a camada de blot (papel de cromatografia de espessura). O dispositivo de seis camadas é realizada em conjunto por cinco camadas de adesivo padronizado, de dupla face: quatro camadas de adesivo permanente manter a integridade da assemdispositivo sangrados e uma camada de adesivo removível facilita a descamação do dispositivo para inspeccionar os resultados do imunoensaio na camada de captura.
Para o propósito deste manuscrito, que utilizam apenas as amostras de controlo positivas e negativas de hCG (0 mIU / ml e 81 mIU / mL, respectivamente) para se obter resultados representativos de um ensaio imunológico baseado em papel, o que permite uma discussão dedicado da relação entre métodos de fabricação e o desempenho de um dispositivo. Além de demonstrar como fabricar dispositivos com sucesso, destacam-se vários erros de fabricação que poderiam levar à falha de um dispositivo ou os resultados do ensaio irreproduzíveis. O protocolo e discussão detalhada neste manuscrito irá fornecer pesquisadores com informações valiosas sobre como imunoensaios baseados em papel são projetados e fabricados. Enquanto focamos a nossa demonstração sobre imunoensaios, antecipamos que as diretrizes aqui apresentadas serão de grande utilidade para a fabricação de Tridimensional de papel baseado em dispositivos microfluídicos.
Protocolo
1. Preparação de camadas Dispositivo de microfluidos baseados em papel
- Prepare padrões para camadas de papel, nylon, e adesivo usando um programa de software de design gráfico. 6 Cada camada pode ter um padrão diferente.
NOTA: O padrão pode incluir furos de alinhamento que não são necessários para um imunoensaio baseado em papel funcional, mas auxiliar com o fabrico de dispositivos reprodutível tridimensionais. Colocação destes furos vai diferir se os dispositivos são montados individualmente, em tiras, ou como folhas completas. O programa de software usado para projetar padrões podem variar de acordo com a escolha da técnica de padronização (por exemplo, fotolitografia, impressão de cera, ou corte). 6 - Pulverizar a área de trabalho com uma solução de etanol a 70% (v / v) e água. Limpe a área de trabalho com uma toalha de papel limpa.
2. Preparação de camadas de papel: Amostra disso, Conjugado de armazenamento, incubação e Camadas Wash
- Prepare camadas de papel de filtro qualitativo usando um grande cortador de papel de mesa. Corte uma folha estoque de papel em um tamanho de papel padrão para facilitar a padronização usando uma impressora (cera) de tinta sólida. Por exemplo, um único 460 x 570 mm2 de folha pode fazer 4 folhas de papel Carta EUA (8,5 x 11 polegadas 2). Manusear papel com luvas limpas em todos os momentos para minimizar a contaminação.
- Carregue uma folha solta de papel cromatografia na bandeja da impressora. Imprimir camadas previamente desenhados (ver Figura 1).
NOTA: Um padrão pode ser impressos diretamente sobre esta folha usando a alimentação automática. Apenas uma folha de papel deve ser impresso em um tempo para evitar obstruções. Para todas as camadas, use as configurações de impressão "melhorado".
3. Preparação de nylon membrana da camada: Camada de captura
- Cortar o rolo estoque de membrana de nylon em folhas (7,5 x 10 polegadas 2) usando um cortador de papel de mesa. Tome muito cuidado no manuseamento do nylonmembrana para manter a sua integridade e proteger contra cópia. Armazenar qualquer material não utilizado em um armário secador, como membranas de nylon são sensíveis à umidade.
NOTA: Corte as folhas são mais estreitas do que o papel Carta EUA. Porque as membranas de nylon são fina e frágil, que não pode ser processado pela impressora directamente e necessitam de apoio. Os detalhes são discutidos abaixo. - Utilizando uma impressora de cera, imprimir um padrão de camada de captura sobre um pedaço de papel de cópia e gravá-lo para uma caixa de luz para servir como um guia para o posicionamento da membrana de nylon. A caixa de luz auxilia o alinhamento de várias camadas.
- Coloque uma folha de papel de cópia para a folha previamente impressa do papel de cópia. Tape a folha de papel em branco para a caixa de luz, mas não tape as duas folhas juntas.
- Coloque uma folha solta de membrana de nylon para o pedaço de papel em branco cópia. Certifique-se de que cobre a membrana área impressa da camada de fundo do papel de cópia. Revestir todos os quatro lados da membrana de nylon para a folha limpade papel de cópia.
NOTA: Certifique-se de que a membrana de nylon é plana e lisa de modo que não há problemas com a impressão (por exemplo, atolamentos de papel ou impressão desigual de cera). A cera pode ser impresso na fita em que a membrana de nylon está ligado ao papel de cópia. Se isso ocorrer, as áreas em que o nylon é incompletamente modelado, devido à cobertura de fita deve ser descartado. Para as preparações futuras, pedaços maiores de membrana de nylon pode ser utilizado para evitar este erro de impressão. - Coloque uma folha de membrana de nylon (apoiado pelo papel de cópia afixada a ele) no tabuleiro da impressora de alimentação manual. Imprimir apenas uma folha de membrana de nylon de cada vez.
NOTA: Não existem etapas de preparação necessárias para a camada de mancha, uma vez que não é padronizado.
4. Criação de Barreiras hidrofóbicas na camada impressa
- Fita as camadas impressas sobre uma moldura acrílica para um aquecimento uniforme de cima e por baixo da camada, quando colocado num forno de convecção a gravidade. Mantenha a membrana de nylon coladoa folha de suporte de papel de cópia até depois de a cera é fundida e hidrofóbicas são formadas barreiras.
NOTA: O quadro acrílico é, um pedaço cortado a laser feito por encomenda de 1/2 ".. Plástico acrílico de espessura Dois tamanhos de quadro, dependendo do número de dispositivos que estão sendo fabricados foram utilizados A borda externa da moldura menor mede 11 5/8" x 2 3/4 ", e o orifício interno da armação mede 10 3/8" x 1 3/4 ". a fronteira exterior da estrutura maior mede 11 5/8" x 8 7/8 ", e o interior furo da armação mede 10 1/4 "x 7 7/8". o espaço aberto, permite ainda interior fusão da cera através de toda a espessura do papel. - Coloque as camadas no forno a 150 ° C durante 30 segundos até que a cera derrete na espessura do papel. Confirmar que a cera tem permeado a espessura do papel, agitando-o e verificação de imperfeições no design.
NOTA: fornos de ar forçado ou placas quentes, também pode ser utilizado para fundir a tinta cera sólida. tempos de fusãoou temperaturas podem variar em função do método de aquecimento. - Remover o papel e a membrana de nylon a partir da moldura acrílica. Além disso, remova membrana de nylon da folha de suporte de papel de cópia.
5. Preparação de camadas adesivas
- Padrão folhas frente e verso de folhas de cola usando uma plotter faca robótica, usando arquivos de projeto previamente preparado (passo 1.1). Proteger qualquer superfície adesiva exposta usando uma folha de forro de cera.
NOTA: O adesiva de face dupla deve ser modelado com furos que permitem que a amostra flua através de camadas como uma via contínua fluídica. O revestimento de cera é facilmente removido do adesivo, e serve para a proteger da contaminação e rasgar durante o corte. Um cortador a laser ou morrer de imprensa também pode ser utilizado para camadas padrão de películas adesivas.
6. Backing de camadas de dispositivos com adesivo
- Pulverizar a caixa de luz, com uma solução de 70% (v / v) de etanol e água. Limpe com um papel t limpaowel.
- Tape uma camada padronizada de papel ou membrana de nylon que precisa ser feito com adesivo sobre a caixa de luz com o lado impresso para baixo.
- Casca de um lado da camada protectora a partir da folha moldada de adesivo e apor à camada de papel ou membrana de nylon. Use a caixa de luz para garantir o alinhamento correcto dos padrões. Imprensa juntos. Coloque o dispositivo parcialmente montado em um deslizamento de proteção.
NOTA: O deslizamento de proteção é um pedaço dobrado de laminação de cobertura de película que protege os dispositivos de contaminação ou danos, garantindo que eles não entrar em contato com os rolos laminadores. - Passe o conjunto de duas camadas, resultante através de um laminador automatizado para premir completamente o adesivo e de papel em conjunto, a remoção de quaisquer bolsas de ar a partir das camadas contíguas.
NOTA: bolsas de ar entre as camadas do dispositivo pode interferir com a integridade do dispositivo e que a absorção reprodutibilidade, causando vazamentos.
7. Tratamento de Conjugado LAyer com reagentes para imunoensaios antes da montagem do dispositivo
- conjugado camada de fita para um quadro de acrílico de modo a que a zona hidrófila a ser tratada é suspensa e não em contacto com a moldura.
- Adicionar 2,5 uL de 100 mg / ml de albumina de soro bovino (BSA) em 1x tampão fosfato salino (PBS) para a zona hidrófila na camada do conjugado. Deixar secar à temperatura ambiente durante 2 minutos e depois a 65 ° C durante 5 min.
NOTA: Este volume é apenas o suficiente para molhar a zona do papel. A solução de BSA ajuda a evitar a agregação das nanopartículas coloidais durante o processo de secagem, o que irá facilitar a libertação das nanopartículas quando o papel e os reagentes são re-hidratadas pela amostra. - Adicionar 5 uL de 5 OD coloidal de nanopartículas de ouro conjugadas com anticorpo anti-hCG-β, e repetir o processo de secagem.
NOTA: As unidades de concentração de nanopartículas de ouro coloidal são frequentemente expressos em densidade óptica (DO) medida pelo absorbance em λ = 540 nm. Nenhum tratamento é necessário para o bloco pavio antes da montagem do dispositivo no ponto 10.
8. Tratamento de Canal Lateral com Reagente para imunoensaios antes da montagem do dispositivo
- Fita camada de canal lateral, para um quadro de acrílico de modo a que a zona hidrófila a ser tratada é suspensa e não em contacto com a moldura.
- Adicionar 10 ul de agente de bloqueio (5 mg leite não gordo / mL e 0,1% (v / v) de Tween 20 em PBS 1x) para tratar o canal lateral. Repetir o mesmo processo de secagem (2 min à temperatura ambiente e depois a 65 ° C durante 5 min) como a camada de conjugado.
9. O tratamento da camada de captura com reagentes para imunoensaios antes da montagem do dispositivo
- camada de captura de fita para um quadro de acrílico de modo a que a zona hidrófila a ser tratada é suspensa e não em contacto com a moldura.
- Tratar a camada de captura com 5 uL de 1 mg / ml de anticorpo anti-α-hCG e, em seguida, permitir que oamostra secar à temperatura ambiente durante 2 min, seguido por 8 min a 65 ° C.
- Adicionar 2 mL de agente de bloqueio (5 mg / ml de leite sem gordura e 0,1% (v / v) de Tween 20 em PBS 1x). Repetir o processo de secagem para a camada de captura.
NOTA: Este valor é adequado para revestir os artigos sem a oclusão dos poros da membrana de nylon, o que pode acontecer quando um excesso de um agente muito bloqueio é usado.
Microfluídicos em suporte de papel 10. Assembly of Three-dimensional
- Tape a camada de lavagem para a caixa de luz (o lado impresso virado para cima). Se forem utilizados furos de alinhamento, removê-los a partir de camadas subsequentes usando uma ferramenta do furador de mão.
- Remover a película de protecção sobre a parte de trás da camada de captura para expor o adesivo. Alinhar a camada de captura de acima da camada de lavagem utilizando os furos de alinhamento como uma guia. Pressione as duas camadas em conjunto. Evitar tocar zonas hidrofílicas para minimizar a contaminação, ou danos no dispositivo. Pinças podem ser utilizados para auxiliar assembly.
- Remover a película de protecção sobre a parte de trás da camada de incubação para expor o adesivo. Alinhe a camada de incubação acima da camada de captura e pressioná-los juntos. Continuar a adicionar camadas desta maneira até que todas as camadas activas são montados.
- Coloque o dispositivo parcialmente montado em um deslizamento de protecção e firmemente apor as camadas em conjunto, utilizando um laminador.
- Remover a película de protecção sobre a parte de trás da camada da lavagem e fixar a camada de mancha para a parte inferior do dispositivo. etapa de laminação Repita 10,4 para completar a montagem do dispositivo microfluídico baseado em papel tridimensional. Corte desejado número de dispositivos a partir de tiras ou folhas de dispositivos totalmente montados usando uma tesoura.
NOTA: folhas inteiras de dispositivos, as tiras de dispositivos ou dispositivos individuais podem ser preparados utilizando uma abordagem similar.
11. Realizar um imunoensaio baseado em papel
- Adicionar 20 ul de uma amostra para a zona hidrófila na parte superior do dispositivo (isto é, Tele provar layer).
- Esperar para a amostra de pavio completamente para dentro do dispositivo, em seguida, adicionar 15 ul de tampão de lavagem (0,05% v / v de Tween 20 em solução salina tamponada 1x com fosfato). Após a primeira aliquota de tampão de lavagem tem mau completamente para dentro do dispositivo, adicionar uma segunda aliquota de 15 ul de tampão de lavagem.
NOTA: O tampão de lavagem tem mau completamente para dentro do dispositivo quando a gotícula de líquido ter desaparecido, não mostrando nenhum menisco na superfície do papel. O ensaio é concluído quando a segunda aliquota de tampão de lavagem tenha entrado completamente o dispositivo. - Para revelar o resultado do ensaio, descascar as três camadas de topo do dispositivo utilizando uma pinça para expor a camada de captura.
- Interpretar os resultados do ensaio qualitativamente por observação da presença ou ausência de cor. Alternativamente, a imagem da camada de leitura usando um scanner de desktop e uso de imagem do software de processamento ou algoritmos para quantificar os resultados e caracterizar as distribuições de intensidade dentro de umzona de detecção. 20
Resultados
A obtenção de desempenhos de ensaio reprodutíveis em microcanais tridimensionais à base de papel baseia-se num método de fabricação que garante a consistência entre os dispositivos. Para atingir este objetivo, nós identificamos um número de processos de fabricação e considerações materiais, e discuti-los aqui no contexto de demonstrar um imunoensaio baseado em papel. Usamos um método de impressão de cera de modo a formar barreiras hidrófobos dentro de dispositivos de microfluidos à base de papel (Figura 2A). 2 Este método é ideal porque ele se baseia apenas em equipamentos de escritório amplamente disponível, requer passos processuais mínimas para completar, e não requer o uso de produtos químicos (por exemplo, fotorresistentes) que possam interferir com a adsorção de proteínas ou alterar o molhabilidade das fibras de papel. Além disso, a impressão de cera produz vias fluídicos com dimensões reprodutíveis, o que é crítico para os ensaios com performances repetíveis e ti duraçãomes. Após as barreiras hidrofóbicas são formadas, as folhas adesivas são aplicados às camadas para facilitar a montagem de dispositivos tridimensionais (Figura 2B). Todos os reagentes necessários para o imunoensaio pode ser aplicada depois de a película de adesivo é adicionado à volta de uma camada (Figura 2C). Este processo é útil para processos de fabricação de um laboratório académico porque muitos dispositivos pode ser preparada em paralelo. O processo de montagem de um dispositivo de imunoensaio é completada após todas as camadas do dispositivo são empilhadas e laminadas em conjunto (Figura 2D). Acrescentamos amostra para iniciar o ensaio. Neste exemplo, usamos um controlo de urina para definir os testes de gravidez, que contém as amostras negativas e positivas de hCG em tampão, como exemplos para demonstrar a operação dos nossos dispositivos e a reprodutibilidade dos ensaios realizados utilizando-os. Duas alíquotas de tampão de lavagem são então adicionados sequencialmente. Uma vez que a aliquota final do tampão de lavagem tenha entrado completamente o dispositivo, oensaio é considerada completa. As três camadas superiores são então descoladas para revelar a camada de captura (Figura 3A). Este passo irreversivelmente danifica o dispositivo que assegura que não pode ser usado novamente. A conclusão de um paper-based resultados de imunoensaios em uma leitura de cor qualitativa que podem indicar uma saída negativo ou positivo após uma inspeção visual. A objetividade destes resultados é evidente em imagens não corrigidas adquiridos usando um scanner de mesa (Figura 3B).
experiências fracassadas muitas vezes pode destacar certas etapas processuais, cuja importância pode ser de outra forma imperceptível quando a análise de um experimento é focado em resultados bem sucedidos. Nós demonstramos três erros no fabrico e montagem de dispositivos tridimensionais baseados em papel de microfluidos que resultam em falhas do imunoensaio: (i) Ocasionalmente, falhas do dispositivo não são visíveis depois de um ensaio é concluído. Por exemplo, a misalignment entre as camadas que compreendem a zona de canal e de incubação de captura pode causar o desenvolvimento de um padrão irregular no sinal positivo, o que pode resultar em má interpretação do sinal qualitativa por um utilizador (Figura 4A). (Ii) Se a cera não é impresso em uma quantidade suficiente ou não deixou-se fundir completamente a espessura total do papel, em seguida, a integridade das barreiras hidrófobos resultantes podem ser comprometidas. formação incompleta destas barreiras irá causar uma perda de controle sobre a absorção da e levar a vazamentos dentro do dispositivo. Por exemplo, em vez de limitar o fluxo de um canal dentro de uma camada, uma barreira de cera semi-permeável vai permitir que o fluido de pavio em outras partes do plano do papel. Sem canais definidos, a amostra é improvável que alcance as camadas de captura ou de lavagem. O usuário vai perceber esse tipo de erro como um tempo de duração do ensaio muito reduzido. Demonstramos isso falha do dispositivo através da aplicação de uma solução de corante vermelho para a layer cujo padrão de cera não foi autorizado a derreter para a completa 30 seg (Figura 4B). Um imunoensaio usando uma tal camada foi "concluída" em 6 min, o que é claramente diferente do que a duração prevista de 15 min. (Iii) Os ensaios que levam mais tempo do que o esperado para concluir pode indicar um defeito na fabricação de um dispositivo. Por exemplo, impropriamente cortadas poros adesivas ou oclusa devido à aplicação de uma quantidade excessiva de reagentes (por exemplo, agentes de bloqueio ou de ouro coloidal) pode proibir um tampão de amostra ou de lavagem de entrarem no dispositivo (Figura 4C).
No geral, nosso protocolo de fabricação é útil para fabricar inúmeros dispositivos microfluídicos em papel em paralelo em uma escala que é útil para um laboratório acadêmico. Nós demonstramos o desempenho do imunoensaio baseado em papel hCG preparados usando este método através da realização de 70 ensaios em paralelo: 35 repetições negativas e 35 r positivaeplicates. Para efeitos dessa demonstração, preparamos um conjunto de camadas com os projetos de nosso dispositivo, aposta as camadas de papel com cola, e depois cortar as folhas em linhas de dispositivos. Cada folha foi cortada em 7 linhas, que continham dez dispositivos. Isto facilitou o arranjo das camadas sobre os quadros de acrílico menores, onde as camadas são gravadas e, em seguida, tratados com os reagentes necessários para realizar os ensaios. Este método de preparação do dispositivo é sugerido em uma nota no protocolo. A seguir ao tratamento de camadas, os dispositivos foram montados em tiras de dez e, em seguida, laminada. Após os passos finais dispositivo de fabricação foram concluídas, os dispositivos permaneceu nas tiras de dez e de amostra foram adicionados a cada dispositivo. Observou-se uma taxa de falha de 0% para dispositivos fabricados usando nosso protocolo. Nós usamos um software de processamento de imagem de código aberto de 20 a quantificar os resultados destes ensaios. Embora um certo número de métodos estão disponíveis para analisar os distribuindo intensidadeion em pontos circulares (por exemplo, radial ou distribuições lineares) 21 medimos a intensidade média do canal verde de uma imagem RGB do dispositivo usando todo o local de detecção como uma região de interesse. 17, 18, 19 Em seguida, normalizar as medições de ensaios positivos e negativos, subtraindo os dados de negativos (Figura 3B). Determinou-se o coeficiente de variação para cada conjunto de dados ser de 1% para os ensaios realizados utilizando amostras negativas e de 3% para os ensaios realizados utilizando amostras positivas.

Figura 1: Representação esquemática do dispositivo à base de papel tridimensional. Esta ilustração mostra as regiões hidrófobas e hidrófilas que definem o percurso de fluidos no interior do dispositivo, bem como o padrcamadas erned de adesivo permanente e removível que mantenha camadas juntas. Cada camada é marcada pela função que desempenha no ensaio. O contorno vermelho, azul ou verde em cada camada indica o material usado para fabricar a camada específica (vermelho: papel de cromatografia, azul: membrana de nylon, verde: papel de cromatografia de espessura). As dimensões são dadas para cada zona no interior do dispositivo, em mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: Procedimento utilizado para fabricar imunoensaios de microcanais tridimensionais baseados em papel. Imagens (A) da frente e de trás de uma folha de papel para cromatografia modelado usando a impressão de cera antes e depois do aquecimento. (B) Uma folha de papel cromatografiafeito com um filme de adesivo padronizado. (C) Os tratamentos aplicados às zonas hidrófilas de uma tira de membrana de nylon modelado. (D) Montagem de tiras de um dispositivo de múltiplas camadas usando uma caixa de luz e furos de alinhamento como um guia. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: Interpretando resultados de um imunoensaio baseado em papel. (A) As três camadas superiores do dispositivo à base de papel são descascadas para trás para expor a camada de captura e interpretar os resultados do ensaio. (B) A representação gráfica do desempenho de um imunoensaio baseado em papel para a hCG. Os resultados apresentados são as médias das 70 repetições realizado simultaneamente em 35 réplicas de cada são utilizados for amostras positivas e negativas de hCG. As barras de erro representam o desvio padrão do conjunto de dados. imagens não corrigidas, representativos que descrevem (cor vermelha) positivo e resultados negativos (cor branca) a partir de um imunoensaio hCG são mostrados acima dos respectivos dados. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: Exemplos de erros de fabrico. (A) devido ao desalinhamento do canal lateral acima da camada de captura, o sinal positivo é concentrada numa pequena área da zona de leitura. Uma região circular "molhada" (contorno tracejado) pode ser observado para a direita da zona de leitura, resultante do contacto entre o canal lateral, desalinhada com a camada de captura (esquerda). Imagem de uma leitura positiva sobrea camada de captura de um dispositivo devidamente alinhados (à direita). (B) de fusão incompleta de cera ao longo da espessura de uma camada pode levar a fugas de dentro do dispositivo. Corante alimentar foi adicionado à solução para auxiliar a visualização da amostra em camadas com barreiras hidrofóbicos incompletos ou totalmente formados. (C) adesiva impropriamente cortadas pode bloquear a rede de fluidos entre as camadas de papel, o qual interrompe o fluxo de uma amostra. Por favor clique aqui para ver uma versão maior desta figura.
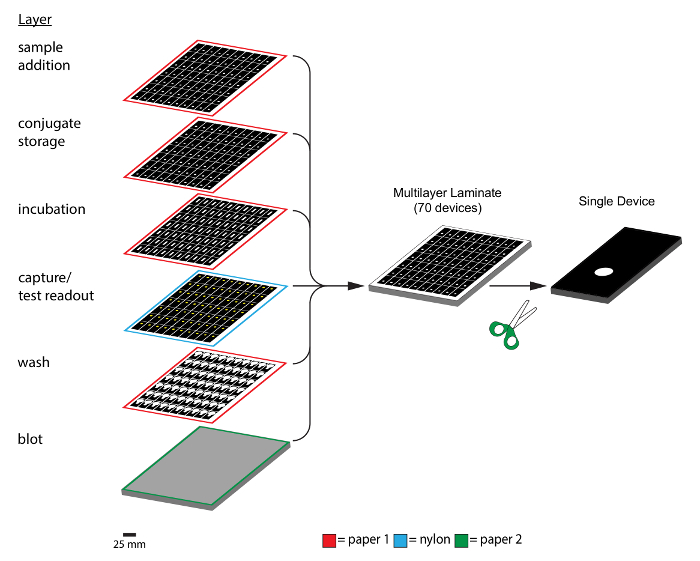
Figura 5: fabricação de dispositivos microfluídicos tridimensionais baseados em papel. O esquema ilustra a montagem e a laminação de várias camadas de papel com padrão em dispositivos tridimensionais cumpridos. Neste exemplo, os dispositivos 70 Cum ser feitas simultaneamente. As camadas adesivas de orifícios de alinhamento e foram removidos a partir do esquema para fins de simplificação. Após a montagem, os dispositivos individuais podem ser removidos e usados em ensaios. Os contornos vermelhos, azuis e verdes em cada camada indicam o material usado para fabricar a camada específica (vermelho: papel de cromatografia, azul: membrana de nylon, verde: papel de cromatografia de espessura). A barra de escala = 25 mm, excepto para o dispositivo separado (à direita), que tem dimensões de 12 x 28 mm 2. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Identificação de uma estratégia de produção reproduzível é uma componente essencial do desenvolvimento do ensaio. 22 Usamos uma camada por camada de abordagem sequencial, para a fabricação de dispositivos microfluídicos tridimensionais baseados em papel. Em contraste com os métodos que se aplicam de dobragem ou origami técnicas para produzir dispositivos de multicamadas a partir de uma única folha de papel 23, 24 de fabrico aditivo oferece uma série de vantagens: (i) materiais múltiplos podem ser incorporados numa única arquitectura do dispositivo, sem modificação de métodos para a impressão, alinhamento, ou conjunto de camadas. (Ii) películas adesivas modelados podem ser integrados no processo de montagem. Estes filmes apor camadas adjacentes, e, com base na força do adesivo, pode ser reversível, para permitir a avaliação da casca e das camadas internas. Além disso, os adesivos proporcionar integridade estrutural ao dispositivo tridimensional, que exclui a necessidadepara ligante 25 clipes ou invólucros usinados. 23 (iii) folhas individuais de papel US Letter cromatografia pode acomodar uma série de repetições, o que pode melhorar significativamente a taxa de transferência de produção à escala laboratorial (Figura 5). Isto é particularmente benéfico quando se avalia numerosas condições experimentais que exigem técnicas repetições. Por esta abordagem, 70 dispositivos baseados em papel tridimensionais podem ser preparados em simultâneo. (iv) abordagens múltiplas camadas similares de laminação são utilizados para o fabrico de grandes volumes de muitos produtos comerciais na área da saúde (por exemplo, curativos de cuidados e emplastros transdérmicos), o que consequentemente diminui a barreira de produção de traduzir estes dispositivos de microfluidos tridimensionais baseados em papel.
Além de facilitar a descamação e a montagem, a escolha do adesivo é também crítica para a concepção da rede de fluidos tridimensional. Um anúnciohesive filme pode servir como uma barreira adicional entre as camadas de papel, que pode permitir que o mascaramento de zonas hidrofílicas em camadas adjacentes. Na prática, a utilização de camadas finas de adesivo é desejável. Se o adesivo é muito grosso (por exemplo, muitas fitas de dupla face), em seguida, a folga formada entre as camadas de papel será demasiado grande para facilitar a absorção e deve ser preenchido com uma substância hidrófila (por exemplo, pó de celulose) para recuperar a função. 12 Enquanto este passo adicional adiciona complexidade para fabricar e a substância utilizada pode interferir com alguns ensaios, essas diferenças se tornam um recurso útil para a produção de válvulas de push-down controláveis, fluídicos. 15 Outras formas de adesivo têm sido utilizados no fabrico de dispositivos de microfluidos tridimensionais baseados em papel. O adesivo sprays oferecer um método simples para fixar as camadas umas às outras. 26 Usando este método, o material adesivo é aplicado uniformemente sobre ambos tele área hidrofóbica e hidrofílica do papel. Uma vantagem deste método é que o equipamento adicional (por exemplo, faca ou plotter cortador a laser) não é necessário para criar o padrão para a camada adesiva. No entanto, as condições para a aplicação uniforme do pulverizador adesivo deve ser determinado experimentalmente para cada tipo de material utilizado. A topografia do material pode afectar a interface de material adesivo e os tempos de pulverização mais longos podem ser necessários para superfícies mais rugosas. Além disso, a pulverização de adesivo sobre as zonas hidrófilas da via fluídico pode resultar em que a absorção prejudicada pela alteração da molhabilidade do papel. Alternativamente, a utilização de matrizes 27 ou serigrafia 8 pode ser utilizada para adesivo impresso directamente sobre as camadas de papel decorado.
Duas considerações principais para o desenvolvimento de dispositivos de microfluidos baseados em papel tridimensionais são a escolha de materiais e a concepção do Fluirede dic. (I) para escolher materiais e combinações de materiais à base de velocidade de mecha, resistência a húmido, espessura, e a capacidade de ligação de proteína. Wicking taxa pode influenciar a duração de um ensaio e a quantidade de reagentes de tempo têm de reagir ou ligar-se dentro de uma camada. Diferentes qualidades de papel são caracterizados por taxas de absorção à base de, por exemplo, o tratamento do papel, a sua porosidade e a sua espessura. É possível utilizar várias camadas de papel para aumentar a razão de absorção eficaz de um dispositivo. 28 Uma boa força molhada é desejável para aplicações que requerem um tratamento (por exemplo, peeling um imunoensaio) depois que o dispositivo foi saturada com uma amostra. Materiais que são demasiado grossa ou que não podem ser passadas através de impressão comercial, devido à fragilidade exigirá um método alternativo para produzir canais padronizados (por exemplo, fotolitografia). No entanto, em contraste, materiais mais grossos são ideais para camadas blot (ou sumidouros) para desenhar fluidos através the dispositivo. Muitos tipos de membranas de nylon estão disponíveis comercialmente, que podem diferir na sua capacidade para se ligar irreversivelmente proteínas para a zona de captura. Substituição de materiais (por exemplo, nitrocelulose, em vez de uma membrana de nylon) pode também influenciam a capacidade, o que pode afectar a sensibilidade do ensaio de ligação. (ii) A utilização de simetria na concepção das redes fluídicos garante que os canais originais modelado em dispositivos tridimensionais comportamento idêntico (por exemplo, preenchido simultaneamente), que é crítico para ensaios multiplexados. 19 Symmetry simplifica ainda mais projeto da camada, auxilia no alinhamento camada ao montar folhas inteiras de dispositivos, e pode minimizar o desperdício. As modificações ao desenho do dispositivo podem influenciar o desempenho do ensaio. Por exemplo, aumentando o comprimento do canal lateral na camada de incubação irão afectar a duração do ensaio, porque o fluido será pavio uma distância proporcionalmente mais longo antes de atingir a UOtlet. 17 Em aplicações que se baseiam na ligação de uma biomolécula alvo, um tempo mais longo ensaio pode ser vantajoso porque pode aumentar a fracção de espécies ligadas, etiquetados antes da imobilização na camada de captura.
Em conclusão, temos apresentado um método para fabricar dispositivos microfluídicos em papel tridimensionais que suportem o desenvolvimento de imunoensaios. Este método, que utiliza um tipo de aditivo de fabrico para produzir dispositivos multicamadas, facilita a produção de dispositivos em uma escala que é adequado para a pesquisa de laboratório. O protocolo descrito neste manuscrito é específico para dispositivos de imunoensaio baseados em papel; No entanto, esperamos que os procedimentos relacionados com a montagem destes impressão imunoensaios-cera, padronização adesiva, alinhando as camadas, e laminação-será facilmente extensível a numerosas arquiteturas dispositivo microfluídico tridimensionais baseados em papel. Uma compreensão da metodologia de fabricação pode levarpara o desenvolvimento de novos testes point-of-care com uma ampla gama de aplicações na área da saúde, meio ambiente e agricultura.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by Tufts University and by a generous gift from Dr. James Kanagy. This material is based upon work supported by the National Science Foundation Graduate Research Fellowship Program under Grant No. (DGE-1325256) that was awarded to S.C.F. D.J.W. was supported by a U.S. Department of Education GAANN fellowship. We thank Dr. Jeremy Schonhorn (JanaCare), Dr. Jason Rolland (Carbon3D), and Rachel Deraney (Brown University) for helping develop the design of the three-dimensional paper-based microfluidic device and immunoassay.
Materiais
| Name | Company | Catalog Number | Comments |
| Illustrator CC | Adobe | to design patterns for layers of paper and adhesive | |
| Xerox ColorQube 8580 printer | Amazon | B00R92C9DI | to print wax patterns onto layers of paper and Nylon |
| Isotemp General Purpose Heating and Drying Oven | Fisher Scientific | 15-103-0509 | to melt wax into paper |
| Artograph LightTracer | Amazon | B000KNHRH6 | to assist with alignment of layers |
| Apache AL13P laminator | Amazon | B00AXHSZU2 | to laminate layers together |
| Graphtec CE6000 Cutting Plotter | Graphtec America | CE6000-40 | to pattern adhesive films |
| Swingline paper cutter | Amazon | B0006VNY4C | to cut paper or devices |
| Epson Perfection V500 photo scanner | Amazon | B000VG4AY0 | to scan images of readout layer |
| economy plier-action hole punch | McMaster-Carr | 3488A9 | to remove alignment holes |
| Whatman chromatogrpahy paper, Grade 4 | Sigma Aldrich | WHA1004917 | |
| Fisherbrand chromatography paper (thick) | Fisher Scientific | 05-714-4 | to function as blot layer |
| Immunodyne ABC (0.45 µm pore size ) | Pall Corporation | NBCHI3R | to function as material for capture layer |
| removable/permanent adhesive-double faced liner | FLEXcon | DF021621 | to facilitate peeling |
| permanent adhesive-double faced liner | FLEXcon | DF051521 | |
| wax liner | FLEXcon | FLEXMARK 80 D/F PFW LINER | to assist with patterning adhesive |
| acrylic sheet | McMaster-Carr | 8560K266 | to fabricate frame |
| self-adhesive sheets | Fellowes | CRC52215 | to use as protective slip |
| absolute ethanol | VWR | 89125-172 | to sanitize work area |
| bovine serum albumin | AMRESCO | 0332 | |
| Sekisui Diagnostics OSOM hCG Urine Controls | Fisher Scientific | 22-071-066 | to use as positive and negative samples |
| anti-β-hCG monoclonal antibody colloidal gold conjugate (clone 1) | Arista Biologicals | CGBCG-0701 | to treat conjugate layer |
| goat anti-α-hCG antibody | Arista Biologicals | ABACG-0500 | to treat capture layer |
| 10X phosphate buffered saline | Fisher Scientific | BP3991 | |
| Oxoid skim milk powder | Thermo Scientific | OXLP0031B | |
| Tween 20 | AMRESCO | M147 |
Referências
- Martinez, A. W., Phillips, S. T., Wiley, B. J., Gupta, M., Whitesides, G. M. FLASH: A rapid method for prototyping paper-based microfluidic devices. Lab Chip. 8 (12), 2146-2150 (2008).
- Carrilho, E., Martinez, A. W., Whitesides, G. M. Understanding wax printing: a simple micropatterning process for paper-based microfluidic devices. Anal. Chem. 81 (16), 7091-7095 (2009).
- Martinez, A. W., Phillips, S. T., Butte, M. J., Whitesides, G. M. Patterned paper as a platform for inexpensive, low-volume, portable bioassays. Angew. Chem. Int. Ed. 46 (8), 1318-1320 (2007).
- Martinez, A. W., Phillips, S. T., Whitesides, G. M. Diagnostics for the developing world: microfluidic paper-based analytical devices. Anal. Chem. 82 (1), 2-10 (2010).
- Cate, D. M., Adkins, J. A., Mettakoonpitak, J., Henry, C. S. Recent developments in paper-based microfluidic devices. Anal. Chem. 87 (1), 19-41 (2015).
- Li, X., Ballerini, D. R., Shen, W. A perspective on paper-based microfluidics: Current status and future trends. Biomicrofluidics. 6, 011301 (2012).
- Lisowski, P., Zarzycki, P. K. Microfluidic paper-based analytical devices (µPADs) and micro total analysis systems (µTAS): Development, applications and future trends. Chromatographia. 76, 1201-1214 (2013).
- Pollock, N. R., et al. A paper-based multiplexed transaminase test for low-cost, point-of-care liver function testing. Sci. Transl. Med. 4 (152), 152ra129 (2012).
- Mentele, M. M., Cunningham, J., Koehler, K., Volckens, J., Henry, C. S. Microfluidic paper-based analytical device for particulate metals. Anal. Chem. 84 (10), 4474-4480 (2012).
- Weaver, A. A., et al. Paper analytical devices for fast field screening of beta lactam antibiotics and antituberculosis pharmaceuticals. Anal. Chem. 85 (13), 6453-6460 (2013).
- Martinez, A. W., Phillips, S. T., Carrilho, E., Thomas, S. W., Sindi, H., Whitesides, G. M. Simple telemedicine for developing regions: camera phones and paper-based microfluidic devices for real-time, off-site diagnosis. Anal. Chem. 80 (10), 3699-3707 (2008).
- Martinez, A. W., Phillips, S. T., Whitesides, G. M. Three-dimensional microfluidic devices fabricated in layered paper and tape. Proc. Natl. Acad. Sci. USA. 105 (50), 19606-19611 (2008).
- Vella, S. J., et al. Measuring markers of liver function using a micro-patterned paper device designed for blood from a fingerprick. Anal Chem. 84 (6), 2883-2891 (2012).
- Nie, Z., Deiss, F., Liu, X., Akbulut, O., Whitesides, G. M. Integration of paper-based microfluidic devices with commercial electrochemical readers. Lab Chip. 10 (22), 3163-3169 (2010).
- Martinez, A. W., et al. Programmable diagnostic devices made from paper and tape. Lab Chip. 10 (19), 2499-2504 (2010).
- Connelly, J. T., Rolland, J. P., Whitesides, G. M. "Paper machine" for molecular diagnostics. Anal. Chem. 87 (15), 7595-7601 (2015).
- Schonhorn, J. E., Fernandes, S. C., Rajaratnam, A., Deraney, R. N., Rolland, J. P., Mace, C. R. A device architecture for three-dimensional, patterned paper immunoassays. Lab Chip. 14 (24), 4653-4658 (2014).
- Fernandes, S. C., Logounov, G. S., Munro, J. B., Mace, C. R. Comparison of three indirect immunoassay formats on a common paper-based microfluidic device architecture. Anal. Methods. 8 (26), 5204-5211 (2016).
- Deraney, R. N., Mace, C. R., Rolland, J. P., Multiplexed Schonhorn, J. E. patterned-paper immunoassay for detection of malaria and dengue fever. Anal. Chem. 88 (12), 6161-6165 (2016).
- Abramoff, M., Magalhaes, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics Int. 11 (7), 36-42 (2004).
- Derda, R., et al. Multizone paper platform for 3D cell cultures. PLoS ONE. 6 (5), e18940 (2011).
- Mace, C. R., Deraney, R. N. Manufacturing prototypes for paper-based diagnostic devices. Microfluid. Nanofluidics. 16 (5), 801-809 (2014).
- Liu, H., Crooks, R. M. Three-dimensional paper microfluidic devices assembled using the principles of origami. J. Am. Chem. Soc. 133 (44), 17564-17566 (2011).
- Kalish, B., Tsutsui, H. Using Adhesive patterning to construct 3D paper microfluidic devices. J. Vis. Exp. (110), e53805 (2016).
- Scida, K., Cunningham, J. C., Renault, C., Richards, I., Crooks, R. M. Simple, sensitive, and quantitative electrochemical detection method for paper analytical devices. Anal. Chem. 86 (13), 6501-6507 (2014).
- Lewis, G. G., DiTucci, M. J., Baker, M. S., Phillips, S. T. High throughput method for prototyping three-dimensional, paper-based microfluidic devices. Lab Chip. 12 (15), 2630-2633 (2012).
- Kalish, B., Tsutsui, H. Patterned adhesive enables construction of nonplanar three-dimensional paper microfluidic circuits. Lab Chip. 14 (22), 4354-4361 (2014).
- Camplisson, C. K., Schilling, K. M., Pedrotti, W. L., Stone, H. A., Martinez, A. W. Two-ply channels for faster wicking in paper-based microfluidic devices. Lab Chip. 15 (23), 4461-4466 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados