Method Article
Neural Activity Propagação em uma Unfolded Hippocampal Preparação com um penetrante Micro-eletrodo Matriz
Neste Artigo
Resumo
Nós desenvolvemos uma hipocampo in vitro desdobrada que preserva CA1-CA3 matriz de neurónios. Combinada com a rede de micro-eléctrodo penetrante, actividade neuronal pode ser monitorizada em ambas as orientações longitudinais e transversais. Este método oferece vantagens em relação a preparações de fatias do hipocampo como a propagação em todo o hipocampo podem ser gravados simultaneamente.
Resumo
Este protocolo descreve um método para a preparação de uma nova preparação de hipocampo in vitro fixa combinada com uma rede de micro-maquinado para mapear a actividade neuronal no hipocampo. A preparação transversal fatia do hipocampo é a preparação do tecido mais comum para estudar hipocampo eletrofisiologia. Uma fatia de hipocampo longitudinal também foi desenvolvido a fim de investigar as ligações longitudinais no hipocampo. Os hipocampo do rato também intactos podem ser mantidas in vitro, porque a sua espessura permite a difusão de oxigénio adequado. No entanto, estas três preparações não fornecem acesso direto a propagação neural já que alguns dos tecidos está ausente ou dobrado. O hipocampo intacto desdobrado fornece tanto transversais e longitudinais conexões em uma configuração plana para acesso direto ao tecido para analisar toda a extensão da propagação do sinal no hipocampo in vitro. A fim de controlar eficazmente a atividade neural de tele camada de células, um feito penetrar rede de micro-eléctrodo (PMEA) foi fabricado e aplicado ao hipocampo desdobrado. O PMEA com 64 eletrodos de 200 mm de altura poderia gravar a atividade neural profundo dentro do hipocampo do rato. A combinação única de uma preparação do hipocampo e desdobrada a PMEA fornece uma nova ferramenta in vitro para estudar a velocidade e direcção de propagação da actividade neural nas regiões bidimensionais CA1-CA3 do hipocampo, com uma alta relação sinal-ruído.
Introdução
Compreendendo a condução neural ou propagação de sinais neurais é crucial para a determinação do mecanismo da comunicação neuronal, tanto no funcionamento normal e em condições patológicas do cérebro 1-3. O hipocampo é uma das estruturas mais estudadas no cérebro, uma vez que desempenha papel fundamental em diversas funções cerebrais como memória, e rastreamento espacial e está envolvido em várias alterações patológicas que afetam drasticamente o comportamento bem 1,6. Embora, o hipocampo exibe uma organização complexa, os diferentes elementos da sua estrutura pode ser facilmente identificado e consultados na preparação fatia 4-6. No sentido transversal do hipocampo, actividade neuronal é conhecida a propagar através da via de tri-sináptica que compreendem o giro dentado (DG), CA3, CA1 andsubiculum 4,5. Acredita-se que a transmissão sináptica e a condução axonal, desempenham um papel importante para comuniem neste circuito transversal 4,6. No entanto, a propagação do sinal neural ocorre em ambas direções transversal e longitudinal 4,6. Isto implica que o hipocampo não pode ser totalmente investigado usando preparações de fatias que limitam a observação de uma determinada direcção de propagação 4. A fatia longitudinal foi desenvolvido para investigar os caminhos axonal ao longo do eixo longitudinal 5. Pesquisadores observaram gama e teta oscilações específicas de comportamento predominantemente ao longo eixos transversal e longitudinal, respectivamente 6. Esses comportamentos foram estudados separadamente, mas o acesso simultâneo a ambos os sentidos é crucial para entender esses comportamentos. Mesmo com o desenvolvimento da preparação hipocampo intactos, é difícil controlar a propagação ao longo de todo o tecido devido à estrutura dobrada do hipocampo 4. O hipocampo desdobrado dá acesso aos neurônios embaladosem uma forma de uma camada de células de 7,8 bidimensional plana.
Por desdobramento do giro dentado (DG) (Figura 1), o hipocampo adopta um formato achatado com uma configuração rectangular, em que ambos transversais e longitudinais permanecem intactos ligações com a camada de células piramidais dispostos numa chapa bidimensional contendo tanto CA3 e CA1, deixando uma peça plana de tecido neural que pode ser utilizado para investigar a propagação neural (Figura 2) 8. Actividade neural pode ser monitorada com pipetas individuais de vidro, matrizes microeléctrodos, eléctrodos estimulantes, bem como corantes sensíveis à voltagem (VSD) 3,7,8. Além disso, o indicador de tensão geneticamente codificado a partir de ratinhos transgénicos que pode ser usado para controlar o padrão de propagação 9.
A configuração plana da rede do hipocampo desdobrada é bem adequado para a gravação óptica método mas também para uma matriz de microeléctrodos. Most das matrizes disponíveis no mercado são fabricados com eletrodos de perfil plano ou baixo e pode gravar a atividade neural em ambas as fatias de tecido e neurônios cultivados 10-12. No entanto, a relação sinal-para-ruído (SNR) decresce quando os sinais são obtidos a partir de um tecido intacta uma vez que a soma dos neurónios estão localizadas mais profundamente no tecido. Matrizes de eletrodos de microeletrodos com proporções elevadas são necessárias para melhorar o SNR.
Para este efeito, uma matriz de microeléctrodos penetrante (PMEA), foi desenvolvido no nosso laboratório, e proporciona a capacidade para sondar directamente no tecido através da inserção de 64 pontos com um diâmetro de 20 mm e altura de 200 mm no hipocampo desdobradas 7,13 . Esta matriz de microeléctrodos tem SNR superior em comparação com o corante de imagem sensível à voltagem e o SNR permanece estável durante uma experiência 7,13. A combinação da preparação do hipocampo e desdobrada a PMEA proporciona uma nova maneira de investirIGATE a propagação neural ao longo de um plano bidimensional. Experimentos usando esta técnica já produziu resultados significativos sobre os mecanismos de propagação do sinal neural no hipocampo em que a atividade neural pode propagar de forma independente das sinapses sinápticas ou elétricos 7.
Protocolo
NOTA: Animal protocolos experimentais foram revisados e aprovados pelo Comitê de Uso e Cuidado Animal Institucional na universidade. Ratos CD1 de ambos os sexos com a idade de P10 a P20 são usadas neste estudo.
1. Soluções para Cirurgia Experimental e Gravação
- Preparar tampão normal de fluido cerebrospinal artificial (ACSF) contendo (mM): NaCl 124, KCl 3,75, KH 2 PO 4 1,25, MgSO4 2, NaHCO3 26, glicose 10, e CaCl 2 2. Utilizar esta ACSF normal para a recuperação do tecido após a dissecação, bem como para o sistema de lavagem no início da experiência.
- Prepare ACSF sacarose que é usada durante a dissecção do hipocampo e contém (mM): Sacarose 220, KCl 2,95, NaH 2 PO 4 1,3, MgSO 4 2, NaHCO3 26, glicose 10, e CaCl 2 2. A fim de induzir a actividade epileptiforme na preparação intacta tecido do hipocampo, e adicionar 4-aminopiridina (4-AP) para ACSF normal noa concentração de 100 uM.
2. Procedimento cirúrgico para a Intacta Hippocampus Preparação
- Gota isoflurano (1 ml) para dentro da câmara na parte inferior de um frasco de vidro exsicador (No.1 em Materiais e Equipamento específicos) e usar uma toalha de papel comum para cobrir a superfície da fase de fundo, de modo que o animal não entrar em contacto com o líquido. Em seguida, coloque o CD1 do mouse dentro do frasco e feche a tampa. Manter o animal no frasco fechado durante cerca de 1 min e 2 min. Quando a freqüência de respiração é de cerca de um por segundo, retire o mouse do frasco.
- Posicione o mouse sobre o estágio de cirurgia e decapitar com uma tesoura adequados. Imediatamente após a decapitação, coloque a cabeça para dentro do gelado (3-4 ° C), oxigenado aCSF sacarose por cerca de 30 segundos.
- Utilize uma tesoura fina (No.5 em Materiais e Equipamento específicos) para remover a pele na parte superior do crânio e para cortar o crânio, ao longo da linha média da cabeça, bem como em duas extremidades perto do ritmolóbulo ral. Use uma pinça (# 6 em materiais específicos e equipamentos) para descascar o crânio corte no sentido de cada lado da cabeça, a fim de expor o cérebro.
- Insira uma espátula laboratório micro (No. 8 em materiais específicos e equipamentos) no espaço entre os lobos parietais do cérebro e do crânio de descascar cuidadosamente o cérebro a partir do fundo do crânio e, em seguida, solte-o em uma gelada preparada (3 -4 ° C) estágio cirúrgico coberto com papel de filtro molhado (No.2 em materiais específicos e equipamentos). Remover o cerebelo com uma lâmina de gelo-refrigerados e separar os dois hemisférios por corte da linha média do cérebro. Em seguida, colocar os dois hemisférios separadas em um copo cheio com a sacarose ACSF gelado borbulhar com 95% de O2 / 5% de CO 2.
- Pegue uma metade do hemisfério e lugar no cenário papel de filtro gelada. Coloque toalhas de papel regulares ou filtro de papel ao redor do cérebro para sugar a solução extra. Use duas ferramentas de pipetas de vidro polido-fogo (# 10 em Materiais eEquipamento) para separar o córtex do resto da parte central do cérebro.
- Após o hipocampo é exposta a partir de dentro do córtex e colocou na fase gelada, colocar dois ou três gotas de sacarose gelada ACSF sobre o tecido e, em seguida, remover a solução extra em torno do hipocampo. Corte as ligações com o córtex em duas extremidades do hipocampo. Em seguida, dissecar o hipocampo para fora do cérebro com as ferramentas de vidro polido de fogo e remover a restante parte do cérebro.
- Separe toda a hipocampo com o seu lado alveus voltada para cima e hipocampo sulco voltado para baixo. Cair rapidamente duas ou três gotas de sacarose gelada ACSF sobre o tecido novamente e remover a solução extra em torno do tecido usando um pedaço de toalha de papel. Usar uma ferramenta de vidro polido ao fogo entregar todo o hipocampo para expor o sulco (Figura 1B, C).
- Sob um microscópio óptico normal, inserir uma agulha de vidro feita sob encomenda (No. 11 em Materi Specificals e Equipamento) em uma das extremidades do sulco e cortar as conexões de fibra, a partir de giro dentado (DG) para subículo ou o campo CA1, ao longo da direcção do sulco (Figura 1C). Aplicar uma lâmina gelada para aparar as extremidades do septo e temporais do hipocampo, se necessário. Insira um loop fio de metal personalizado feito (No. 12 em materiais específicos e equipamentos) no sulco de corte e encostar o DG longe do tecido, mantendo o final subiculum / CA1 do hipocampo por uma ferramenta de fogo de vidro polido (Figura 1D) .
- Seguindo o procedimento acima desdobramento, adicionar mais duas ou três gotas de sacarose ACSF gelado para remover o tecido e a solução extra em torno do tecido. Em seguida, a guarnição do hipocampo desdobrado com a lâmina gelada nas bordas (Figura 1E) e colocar a preparação de uma espátula para a câmara de recuperação preenchido com ACSF normal e borbulhada com 95% de O2 / 5% de CO2 à temperatura ambiente (cerca de 25 ° C). Deixaro tecido de hipocampo desdobrado para recuperar cerca de 1 hora antes da sua colocação na câmara de gravação.
- Pegue o outro hemisfério cerebral e usá-lo a passar por etapas 2,5-2,9. Geralmente, levam cerca de 1 a 2 minutos para terminar todo o processo a se desenrolar um único hipocampo e soltar gelada sacarose aCSF continuamente para manter o tecido oxigenada e hidratada.
Setup 3. Sistema Experimental
- Cole um PMEA fabricados sob encomenda em um pacote pin grid array (PGA) e usar ligação micro fios para conectar cada almofada a partir de um único microeléctrodos para a almofada de um pino sobre o pacote (Figura 3B). Em seguida, insira o pacote no soquete em uma placa de circuito feito sob medida 13.
- Individualmente conectar cada microeletrodos para seus filtros com passagem de banda de freqüência de corte de 1 Hz a 4 KHz e amplificadores com ganho de 100 na placa de circuito personalizado feito 13. Digitalize a saída analógica da placa de circuito por um A D conv /sistema Erting, e adquirir e armazenar os dados em um computador.
- Cole numa câmara de registo de plástico feito por medida em torno da matriz e com uma entrada de tubo de saída para o fluxo da solução (Figura 4A). Use pelo menos duas garrafas para manter as soluções diferentes no sistema, e se juntar e controlar a tubagem de saída das garrafas por um grupo tri-válvula. Ligue a saída do tri-válvula para um sistema de tubagem com uma câmara de gotejamento IV, que é guiar a solução para a câmara de gravação.
- Entre os tri-válvula e a entrada da câmara de gravação, adicionar um aquecedor eléctrico para aquecer a solução a uma temperatura controlada (35 ° C) antes que a solução é orientada para a câmara de registo. Anexar a saída da câmara de registo para um tubo de vácuo para recolher a solução para um balão ligado tubo de vácuo. Não reciclar qualquer solução em qualquer experiência neste estudo.
4. Colocar o Unfolded Hippocampus para o PMEA para registrar a atividade Neural
- Para preparar a configuração experimental, encha uma garrafa com aCSF normal e outra garrafa com 4-AP aCSF. Em ambos os frascos, bolha de 95% de O2 / 5% de CO 2 a partir do início de cada experiência. Usar um conector tri-válvula para controlar qual a solução será seleccionado durante uma experiência. Conectar um tubo de vácuo na saída da câmara para bombear a solução para um recipiente de pó. Aquece-se a tubagem antes de serem enviados para a câmara de registo e manter a solução a um nível de temperatura controlada (35 ° C).
- Quando a entrada e a saída de câmara de registo está fechado, utilizar um conta-gotas de pipeta de vidro feito à medida para transferir e colocar o hipocampo desdobrado para dentro da câmara de gravação. Sob o microscópio, posicionar o hipocampo desdobrado utilizando um pequeno pincel de pintura regular, enquanto o tecido está a flutuar na solução. Coloque o hipocampo desdobrado com o seu lado alveus voltada para baixo, a área CA3 apontando para fora, e no campo CA1 apontando para o pesquisador.
- Chupar cuidadosamente afastado da solução na câmara de vácuo com uma pipeta a partir da borda da câmara de registo para reduzir o nível da solução até que a câmara é seca e o tecido é reduzido, para o agrupamento. Em seguida, coloque cuidadosamente uma âncora de tecido feito à medida (Figura 4) (No. 14 em materiais específicos e equipamentos) em cima do tecido para segurar o hipocampo desdobrado para a matriz. Coloque algumas gotas de solução para a câmara de registo para encher-lo, e abrir gradualmente a entrada e a saída para ajustar a taxa de fluxo de cerca de duas gotas por segundo na câmara de gotejamento IV.
- Incubar o tecido na câmara de registo com ACSF normal durante cerca de 1 min para recuperar, depois mudar para o abastecimento da solução de 4-AP ACSF dissolvido e ajustar a taxa de fluxo adequada. Incubar o tecido em 4-AP dissolvido ACSF para cerca de 5 a 10 minutos e, em seguida, o investigador poderia iniciar o software para gravar o sinal de actividade espontânea quando aparece.
5. Retirar oTecido da PMEA Após uma experiência
- Controlar a âncora do tecido por um micromanipulador e gradualmente levantar o tecido a partir da câmara de gravação. Desligue ambos entrada e saída para interromper o fluxo na câmara de gravação. A câmara de gravação deve estar cheio com solução ou adicionar algumas gotas de solução para encher a câmara se a câmara de gravação não é completa.
- Usar um pequeno pincel de pintura para levantar cada canto do tecido. Se o tecido não está a flutuar na solução, em seguida, utilizar o tubo de vácuo para secar a câmara de cuidado com o tecido ainda está sentado sobre a matriz. Em seguida, abra cuidadosamente a entrada para encher gradualmente a câmara e fechou a entrada para interromper o fluxo quando a câmara de gravação está cheia. Aplique o pincel pequeno para levantar cada canto do tecido novo.
- Repetir o passo 5.2 até o tecido é separado da matriz e que flutua na solução. Se o tecido está flutuando na solução, em seguida, usar o tubo de vácuo para sugar o tecido de distância. Abrir tele fluir na entrada e abrir o vácuo na saída. Lavar o sistema com água destilada e seca-lo.
Resultados
Os dados mostrados nas figuras aqui foram registados na preparação hipocampo desdobrado com 4-AP (100 uM) aCSF adicionado durante a incubação do tecido na câmara de gravação à TA (25 ° C). Normalmente atividade começa dentro de 5 min, mas em alguns tecidos do hipocampo dos animais mais velhos pode demorar mais tempo. O disparo neuronal induzida por AP-4 observado com o PMEA é o mesmo que anteriormente relatado 14,15. Uma vez que os eléctrodos têm uma altura de 200 mm, as pontas dos eléctrodos estão localizados logo abaixo da camada de células (Figura 3C) porque a camada de células é geralmente 250 a 300 mm acima do alveus do hipocampo (Figura 2), as gravações (57 de 64 no exemplo de experimento) de diferentes canais têm uma deflexão em sua maioria positivas. No entanto, algumas dessas gravações positivos poderia exibir pequenos desvios negativos, bem como (Figura 5B), se as pontas de eletrodos de gravação estão perto o suficiente para a camada de células.Se as dicas de eléctrodos estão localizados ao nível da camada de células, a gravação terá spiking negativo muito afiada com mudança positiva sobre ele ou apenas spiking negativo (Figura 5C) 16. Na amostra de dados mostrado aqui, 5 canais de 57 gravações têm spiking negativo. Após a aquisição dos dados de todos os 64 canais, o método de normalização individual (Figura 6B) é aplicada para mapear a propagação neural num plano 2-D ao longo do eixo do tempo da gravação 7. Com uma combinação de a PMEA e o hipocampo desdobrado, propagação neural é mapeado para iniciar e observado principalmente em um lado da CA3 e deslocar-se longitudinalmente em uma frente de onda em diagonal, atravessando toda a área do hipocampo (Figura 6).

Figura 1. O procedimento cirúrgico para um hipocampo desdobrado . (A) Um dos dois hipocampos é dissecado a partir do lobo temporal de cérebro de rato. (B) do septo e terminações temporais ao longo do eixo longitudinal. (C) O hipocampo é virada ao contrário, com uma pipeta de vidro polido ao fogo expor o sulco. Ambas as extremidades do hipocampo são aparados e uma agulha de vidro é usada para cortar as conexões entre a DG e CA1 ou subiculum ao longo do eixo longitudinal. (D) O hipocampo é desdobrada por uma alça de fio de metal feito por encomenda. (E) hipocampo Unfolded com subiculum e DG aparada. (F) A preparação final do tecido de um hipocampo desdobrado. Esta posição mostra a orientação do hipocampo quando ela é colocada sobre a matriz em uma experiência. Para detalhes adicionais sobre a anatomia hipocampo desdobrado consulte métodos experimentais em manuscritos publicados anteriormente 7."target =" _ g1large.jpg blank "> Clique aqui para ver uma versão maior desta figura.
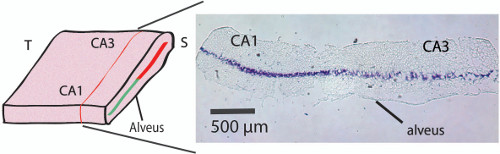
Figura 2. Corte histológico do hipocampo desdobrado. Mancha de cristal-violeta mostra a posição da camada de células piramidais de CA1-CA3 do hipocampo desdobradas dentro de um nível de 250 a 300 mm acima do alveus localizando assim os microeléctrodos logo abaixo da camada de células (consulte a Figura 3C). Para obter as secções coradas com violeta de cristal a, o tecido foi pós-fixada após o hipocampo foi desdobrado. O hipocampo foi colocado desdobrado em PFA a 4% O / N. Em seguida, o tecido foi transferido e mantidas em solução de sacarose (30%) durante 48 horas, e seguido por snap-congelação de motociclista contendo isopentano (2-metilbutano) para arrefecer a -35 ° C em gelo seco. Congelação foram então cortados em criostato com20 mm de espessura no plano transversal (como mostrado na Figura 2) para revelar a localização da camada de células piramidais. Por favor clique aqui para ver uma versão maior desta figura.
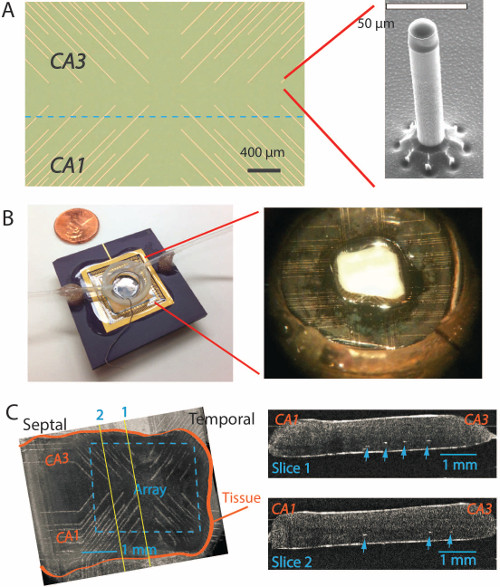
Figura 3. unfolded no hipocampo a PMEA. (A) Vista de cima de um novo PMEA com os microeletrodos localizados no final de cada traço de metal ouro. A inserção no lado direito mostra uma única microeléctrodo sob microscopia de electrões com uma altura de 200 mm e um diâmetro de 20 mm 7,13. (B) A matriz de microeléctrodos está colado sobre um pacote de PGA, com uma câmara de registo de plástico em torno dos microeléctrodos sobre um substrato de vidro. A inserção da direita mostra um hipocampo desdobrado colocado no arr microeletrodosay no meio. (C) À esquerda, Tomografia de Coerência Óptica (OCT) imagem mostra o tecido desdobrado posicionado no topo da matriz em uma experiência diferente. À direita, duas imagens de corte longitudinais obtidos a partir da imagem de outubro à esquerda mostra as dicas de microeletrodos (pontos brancos apontado pelas setas) chegar para a área logo abaixo da camada de corpo celular. Por favor, clique aqui para ver uma versão maior desta figura .

Figura 4. configuração Experimental. (A) A tampa de cobertura de plástico com parafusos é colocada sobre os circuitos para protegê-lo contra possíveis danos causados pela água. A câmara de gravação tem tanto de entrada e saída de tubos para transportar o fluxo de solução. Uma âncora de tecido feito à medida coladas com uma malha de fibra de nylon é usado para proteger o TISSue durante os experimentos. (B) Imagem tirada da parte inferior do substrato de vidro da PMEA que mostra a âncora segurando uma fatia de tecido da amostra durante uma experiência. Os arames curvos são as fibras de nylon da malha pressionando na parte superior do tecido. Os pontos redondos são as bases de microeletrodos. As setas indicam a eletrodos que foram danificados após várias experiências. Por favor, clique aqui para ver uma versão maior desta figura.
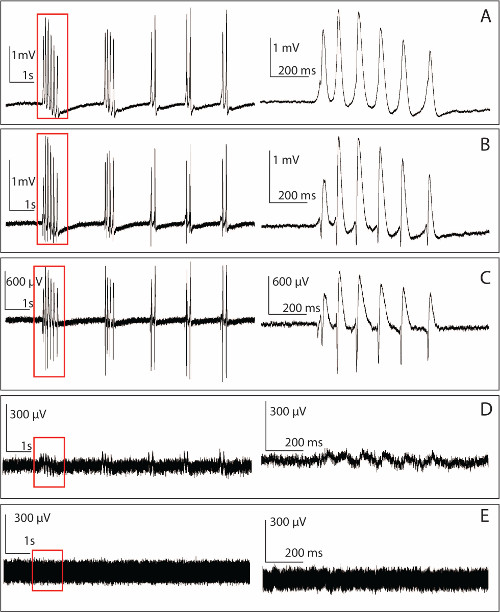
Figura 5. Os dados brutos registrados pela PMEA de um hipocampo se desenrolava. Painel esquerdo: 4-AP-induzida actividade epileptiforme gravado a partir de um único painel de microeléctrodos direita:.-Zunidas na versão do sinal marcado na janela de tempo do lado esquerdo. 10 seg secção de um exemplo da actividade espontânea em (A)produzida por 100 | iM de AP-4 ACSF obtido para um dos microeléctrodos localizados na região basal dendrítica com base na polaridade dos sinais com um SNR de 34,9 dB. (B) Os dados em bruto a partir de um outro microeléctrodo localizada mais próxima do somata com um SNR de 27,2 dB. (C) Exemplo de gravação obtido a partir de um eléctrodo posicionado no interior da camada somática. Neste exemplo, o SNR é 18,53 dB (D) de gravação. Obtidas a partir de um eléctrodo de realização ainda curvado mas não penetra no tecido. O eléctrodo dobrado tem uma significativa SNR mais baixo em comparação com os eléctrodos de 1,5 dB intactos (neste exemplo). (E) o ruído de linha de base gravada a partir de um microeléctrodo. A linha de base geralmente tem um valor pico a pico 150-200 mV e a impedância de um único eletrodo é de cerca de 1 a 2 mohms. Por favor, clique aqui para ver uma versão maior desta figura.
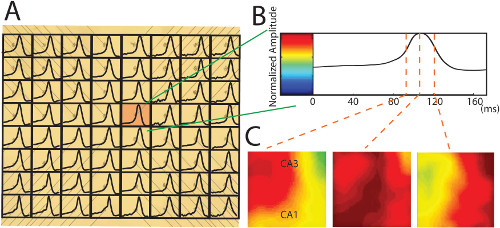
Figura 6. A conversão de dados de gravação neurais no mapas propagação 2-D. (A) A janela de tempo ms 170 trunca um único spiking neural em cada canal plotados na fotografia do PMEA. Os dados brutos é filtrado por um filtro passa-baixa a 100 Hz. Os sinais provenientes dos eléctrodos quebradas são interpolados com as gravações em torno dele. Neste exemplo, todos os pontos são positivos. (B) Um único ponto neural a partir do pixel vermelho (A) é normalizado para a barra de cores com um método desenvolvido sob medida para a normalização individual (Por favor, consulte a publicação anterior para obter mais detalhes sobre a normalização 7). (C) Os mapas de cor criados pela normalização indivíduo mostram que se move de propagação ao longo de toda a área do hipocampo desdobrada em diferentes pontos de tempo."target =" _ www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/52601/52601fig6large.jpg blank "> Clique aqui para ver uma versão maior desta figura.
Discussão
O desenvolvimento do hipocampo preparação desdobrada, em que os eixos longitudinais e transversais do hipocampo são preservadas em combinação com uma matriz de microeléctrodos penetrante, fornece uma ferramenta poderosa para investigar as ligações anatomia ou propagação neural no hipocampo 7. Este procedimento de desdobramento é também aplicável para estudar hipocampo em ratos adultos. Estudos recentes com esta preparação mostrou que a actividade epileptiforme induzido-4-AP poderia propagar com uma frente de onda diagonal através de toda a área do hipocampo desdobrado (Figura 6) 7,8. Estes estudos mostraram que o hipocampo intactos desdobrada oferece vantagens significativas sobre fatias transversais ou longitudinais ou quando a propagação de células neurais em rede neural do hipocampo plana pode ser investigado (Figura 6).
O microeletrodos penetrante fornece uma vantagem significativa sobre mi existentematrizes croelectrode (MEA), que consistem em vários contatos posicionados sobre uma superfície plana 11,12,17. MEA com eléctrodos de superfície plana são difíceis de usar com o hipocampo desdobrado desde a camada de células é localizada a cerca de 250 a 300 mm de distância da superfície (Figura 2). A PMEA aqui descrito foi concebido para resolver este problema com 64 eléctrodos de penetração adequados para estudar a propagação neural com uma altura de 200 mm de penetrar profundamente dentro do tecido 7,13. Além disso, o PMEA também aplicável em qualquer preparação de tecido liso, tais como fatias de córtex, hipocampo transversal fatias, etc.
Outra vantagem da utilização deste PMEA é a melhoria da SNR. Um estudo deste protótipo PMEA mostra a relação SNR de sinais neurais registadas pelo presente PMEA tem um valor médio de 19,4 ± 3 dB, o que é significativamente mais elevada e mais estável em comparação com a de uma gravação CIV uma vez que estudos anteriores indicam que a toxicidade efoto de branqueamento de VSD prejudicada claramente a capacidade de gravar dados 8. Com um protocolo experimental melhorada usando a âncora tecido neste estudo, o SNR de gravação a partir dos aumentos PMEA para uma gama de cerca de 20 a 30 dB (Figura 5), que tem um SNR mais elevada em comparação com as matrizes de achatar-eléctrodos com um valor de 10 a 15 dB 11,18. A capacidade de se desdobrar o hipocampo é essencial para se obter uma camada de neurónios (CA1-CA3), que podem ser interrogados por uma matriz de gravação plana.
Além disso, uma vez que a matriz é construída de silício sobre um substrato transparente, tensão técnica de imagiologia corante sensível pode ser integrado no sistema de PMEA para estudar a propagação de actividade neuronal no hipocampo 8. Os ratinhos transgénicos com indicadores sensíveis à voltagem fluorescente também pode ser utilizada para investigar a origem e propagação do sinal, sob condições fisiológicas, bem como as alterações induzidas por pharmacologiagentes CAL ou tecido modificado genético de vários modelos animais 9.
Há vários passos críticos, a fim de garantir uma gravação de alta qualidade. Em primeiro lugar, para assegurar a viabilidade do tecido, o procedimento cirúrgico deve ser realizado tão rapidamente quanto possível. Normalmente, leva cerca de 1 a 2 minutos para passar por todas as etapas de 2.1) para 2.10). Prática do processo de desdobramento em alguns animais de amostra é altamente recomendado antes da cirurgia experimental real é realizado. Em segundo lugar, as necessidades da taxa de fluxo de ser mantido constante para evitar qualquer flutuação do nível do fluido de perfusão em câmara de gravação. Além disso, o tecido deve ser ancorada para baixo para evitar o movimento do tecido em relação à matriz.
Embora a PMEA descrito aqui pode proporcionar indicações úteis no controlo da propagação neuronal no hipocampo desdobrada, há alguns inconvenientes e limitações deste método de gravação.
Em primeiro lugar, Os microeléctrodos pode quebrar devido à força mecânica exercida sobre eles (Figura 5D, E). Durante o procedimento de colocação e remoção do tecido, o contato acidental entre o pincel pequeno e matriz poderia causar os microeletrodos para entortar ou quebrar. Quando a âncora de tecido é reduzido para baixo pelo micromanipulador, o movimento horizontal do tecido ao longo do fundo da câmara poderia criar uma força de cisalhamento que pode conduzir à flexão ou quebra dos eléctrodos. Em um projeto de futuro, os microeletrodos deve ser reformulado com uma base um pouco mais grosso para torná-los mais fortes. Na versão atual deste PMEA, os eletrodos de registro tem uma base estreita em comparação com o seu diâmetro 13, enfraquecendo assim os eletrodos (Figura 3A).
O procedimento de limpeza também deve ser melhorado para remover adequadamente o tecido residual e fibras que poderia anexar à matriz. Após cada experimento, pequenos pedaçosde tecido pode permanecer solidários com os microeléctrodos e este tecido residual deixada sobre os eléctrodos devem ser removidos. Se estes tecidos residuais não forem removidos, a impedância dos eléctrodos e o SNR das gravações pode ser afectada. Flushing do sistema com água destilada é sugerido como indicado na parte 5 da seção Protocol. Os usuários também são aconselhados a lavar o sistema com alguma solução ácida fraca que pode dissolver o tecido sem danificar o sistema
Outra desvantagem deste protocolo é que durante o processo de desdobramento, o caminho perfurante neste hipocampo desdobrada é cortado, impedindo investigação dos possíveis sinais neurais de propagação da DG para as outras camadas do hipocampo.
Em conclusão, nós descrevemos aqui uma nova metodologia para investigar a propagação de actividade neuronal no hipocampo, combinando uma alta relação de aspecto de microeléctrodos matriz com desdobrado tissu hipocampoe. O método não conduzir a uma melhor compreensão de como a actividade neuronal pode propagar-se em ambas as direcções longitudinal e transversal. Esta técnica também pode ser aplicada ao tecido cortical colocada de uma forma semelhante no topo da matriz. Além disso, a combinação de técnica de gravação óptica com esta preparação é possível desde que a matriz é transparente e também poderia levar a algumas conclusões importantes sobre a propagação do sinal no tecido neural.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by National Institutes of Health (National Institute of Neurological Disorders and Stroke) Grant 1R01NS060757-01 and by the E.L. Lindseth endowed chair to Dominique M. Durand. We thank Dr. Andrew M. Rollins’ laboratory for the help on the OCT imaging.
Materiais
| Name | Company | Catalog Number | Comments |
| desiccator jar | LABRECYCLERS Inc. | 5410 | Place regular paper towels at the bottome of the jar for animal anesthesia use. |
| A blade and Custome made surgical stage for unfolding hippocampus | N/A | N/A | A petri dish is place upside down (in the center) in the ice with a wet filter paper place on top of it. |
| Custom made tissue recovery chamber | N/A | N/A | Plastic tubes were glued with plastic mesh at the bottom and bubbled with 95% O2/ 5% CO2 in the aCSF. |
| Straight Operating Scissors | Fisher Scientific | S17336B Medco Instruments No.:81995 | This scissors is used to decapitate the mice. |
| Integra Miltex Goldman-Fox Scissors | Fisher Scientific | 12-460-517 MILTEX INC No.:5-SC-320 | This scissors is used to cut the skull of the mice. |
| Miltex Hysterectomy Forceps | Claflin Medical equipment | CESS-722033-00001 | This Forceps is used to peel the cut skull to expose the brain |
| Micro Spatula | Cardinal Health | This micro spatula is used to tranfer the whole brain of a semisphere into the recorering chamber. | |
| Frey Scientific Stainless Steel Semi-Micro Spatula | Cardinal Health | this semi micro spatula is used to tranfer the unfolded hippocampus into the glucose aCSF in the recovering chamber. | |
| small paint brush | Lowe's | tem #: 105657 Model #: 90219 | The one with the smallest size in a normal paint brush package |
| Fire polished glass help tool | N/A | N/A | This tool was fire polished and made from the regular Pasteur glass pipettes. |
| Custom made glass needle | N/A | N/A | This tool was fire polished and made from the regular Pasteur glass pipettes. |
| Custom made glass tool with a metal wire loop | N/A | N/A | This tool was fire polished and made from the regular Pasteur glass pipettes with a reshaped metal wire loop. |
| Custom made glass solution dropper | N/A | N/A | This tool was made from the regular Pasteur glass pipettes with its tips cut and a rubber head attached with the cut end. |
| Custom made tissue anchor | N/A | N/A | Nylon fiber mesh was glued on a insulated copper wire ring. The tissue anchor was hold by an micromanipulator. |
| Custom fabricated microelectrode array | N/A | N/A | More detail about the array please refer to Kibler, et al, 2011. |
| Custom made filter and amplifiers circuits for the array | N/A | N/A | More detail about the array please refer to Kibler, et al, 2011. |
| Data acquisition processor 3400a | Microstar Laboratories | N/A | This is a complete data acquisition system with A/D converter. |
Referências
- Richardson, K. A., Schiff, S. J., Gluckman, B. J. Control of traveling waves in the Mammalian cortex. Phys Rev Lett. 94 (2), 028103-028112 (2005).
- Luhmann, H. J., Dzhala, V. I., Ben-Ari, Y. Generation and propagation of 4-AP-induced epileptiform activity in neonatal intact limbic structures in vitro. Eur J Neurosci. 12 (8), 2757-2768 (2000).
- Grinvald, A., Manker, A., Segal, M. Visualization of the spread of electrical activity in rat hippocampal slices by voltage-sensitive optical probes. J Physiol. 333, 269-291 (1982).
- Gloveli, T., et al. Orthogonal arrangement of rhythm-generating microcircuits in the hippocampus. Proc Natl Acad Sci USA. 102 (37), 13295-13300 (2005).
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Albani, S. H., McHail, D. G., Dumas, T. C. Developmental studies of the hippocampus and hippocampal-dependent behaviors: insights from interdisciplinary studies and tips for new investigators. Neurosci Biobehav Rev. 43, 183-190 (2014).
- Zhang, M., et al. Propagation of Epileptiform Activity Can Be Independent of Synaptic Transmission, Gap Junctions, or Diffusion and Is Consistent with Electrical Field Transmission. J Neurosci. 34 (4), 1409-1419 (2014).
- Kibler, A. B., Durand, D. M. Orthogonal wave propagation of epileptiform activity in the planar mouse hippocampus in vitro. Epilepsia. 52 (9), 1590-1600 (2011).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108 (11), 3147-3160 (2012).
- Wingenfeld, K., Wolf, O. T. Stress , memory, the hippocampus. Front Neurol Neurosci. 34, 109-121 (2014).
- Liu, J. S., et al. Spatiotemporal dynamics of high-K+-induced epileptiform discharges in hippocampal slice and the effects of valproate. Neurosci Bull. 29 (1), 28-36 (2013).
- Oka, H., Shimono, K., Ogawa, R., Sugihara, H., Taketani, M. A new planar multielectrode array for extracellular recording: application to hippocampal acute slice. J Neurosci Methods. 93, 61-68 (1999).
- Kibler, A. B., Jamieson, B. G., Durand, D. M. A high aspect ratio microelectrode array for mapping neural activity in vitro. J Neurosci Methods. 204 (2), 296-305 (2012).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. J Pharmacol Exp Ther. 282 (1), 262-270 (1997).
- Perreault, P., Avoli, M. 4-aminopyridine-induced epileptiform activity and a GABA-mediated long-lasting depolarization in the rat hippocampus. J Neurosci. 12 (1), 104-115 (1992).
- Chesnut, T. J., Swann, J. W. Epileptiform activity induced by 4-aminopyridine in immature hippocampus. Epilepsy Res. 2 (3), 187-195 (1988).
- Nam, Y., Wheeler, B. C. In Vitro Microelectrode Array Technology and Neural Recordings. Crit Rev Biomed Eng. 39 (1), 45-62 (2011).
- Gonzalez-Sulser, A., et al. Hippocampal neuron firing and local field potentials in the in vitro 4-aminopyridine epilepsy model. J Neurophysiol. 108 (9), 2568-2580 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados