Method Article
地中マイクロ電極アレイと非折り畳み海馬準備神経活動の伝播
要約
私たちは、ニューロンのCA1-CA3配列を保持するインビトロ折り畳まれていない海馬を開発した。貫通微小電極アレイと組み合わせて、神経活動は、長手方向および横方向の向きでモニターすることができる。全体の海馬での伝搬を同時に記録することができますように、この方法は、海馬スライス標本上の利点を提供する。
要約
このプロトコルは、海馬における神経活動をマッピングするための微細加工のアレイと組み合わせる新しいインビトロフラット海馬の準備を調製するための方法を説明します。横断海馬スライス標本は、海馬の電気生理学を研究するための最も一般的な組織調製である。縦海馬スライスはまた、海馬における縦の接続を調べるために開発されました。その厚さは、十分な酸素の拡散を可能にするので、無傷のマウスの海馬はまた、インビトロで維持することができる。組織の一部が欠落している9893のどちらかであるので、これらの3つの調製は、神経伝播への直接アクセスを提供しません。折り畳まれていない無傷の海馬横断し、インビトロで海馬における信号伝搬の全範囲を分析する組織に直接アクセスするための平坦な構成の縦接続の両方を提供する。効果的にtから神経活動を監視するために彼細胞層、カスタムを作製した微小電極アレイ(PMEA)を貫通製折り畳ま海馬に適用する。高さが200μmの64の電極を有するPMEAは、深いマウス海馬の中に神経活動を記録することができます。折り畳ま海馬調製およびPMEAのユニークな組み合わせは、高い信号対雑音比と海馬の二次元CA1-CA3領域における神経活動の伝播速度と方向を研究するための新規のin vitroツールを提供する。
概要
神経信号の神経伝導または伝播を理解することは、脳1-3の正常な機能および病理学的状態の両方における神経コミュニケーションのメカニズムを決定するために重要である。海馬は、メモリ、および空間追跡などのいくつかの脳機能において基本的な役割を果たしており、劇的に挙動ならびに1,6に影響を与えるいくつかの病理学的変化に関与しているため、脳の中で最も広く研究構造の一つである。海馬は複雑な組織を示すが、その構造の異なる要素は、容易に識別され、スライス標本4-6にアクセスすることができる。海馬の横方向に、神経活動は、歯状回(DG)、CA3、CA1 andsubiculum 4,5を備えてトライシナプス経路を介して伝播することが知られている。これは、シナプス伝達および軸索伝導communicatiために主要な役割を果たすと考えられているこの横方向の回路4,6のオン。しかし、神経信号の伝播が横方向と縦方向4,6の両方で行われます。これは海馬が完全に伝播4の特定の方向に観測を制限スライス標本を使って調べることができないことを意味します。長手方向のスライスは、長手方向軸5に沿って軸索経路を調査するために開発された。研究者は、主に横方向と縦軸にそれぞれ6に沿って行動固有のガンマ及びシータ振動を観測した。これらの動作は別々に研究されてきた、まだ両方向への同時アクセスは、これらの動作を理解することが重要です。でも無傷の海馬製剤の開発は、海馬4の折り畳まれた構造に起因する組織全体を通して伝播を監視することは困難である。折り畳まれていない海馬はパックニューロンへのアクセスを提供します平らな二次元の細胞層7,8の形態である。
歯状回(DG)( 図1)を展開することによって、海馬は、横方向及び縦方向の両方の接続がCA3およびCA1の両方を含む二次元のシートに配置された錐体細胞層に無傷のままでいる長方形の形状と平坦な形状を採用している神経伝播を研究するために使用することができる神経組織のフラット部分を残して( 図2)8。神経活動は、個々のガラスピペット、マイクロ電極アレイ、刺激電極、ならびに電圧感受性色素(VSD)、3,7,8でモニターすることができる。また、トランスジェニックマウスの遺伝的にコードされた電圧インジケータは、伝播パターン9を追跡するために使用することができる。
折り畳まれていない海馬ネットワークの平坦な構成は、光学的な方法の記録のためにだけでなく、微小電極アレイに適しています。 M市販の配列のOSTは、平らなまたはロープロファイル電極が製造され、両方の組織スライスと培養神経細胞10-12に神経活動を記録することができます。しかしながら、信号対雑音比(SNR)は、ニューロンの細胞体は、組織内に深く配置されているので、信号が無傷の組織から得られた場合に減少する。高アスペクト比を有する微小電極アレイは、SNRを改善するために必要とされる。
この効果により、貫通微小電極アレイ(PMEA)が我々の研究室で開発され、折り畳まれていない海馬7,13に直径20μmと200μmの高さのスパイク64を挿入することにより、組織に直接プローブする能力を提供する。この微小電極アレイは、電位感受性色素イメージングに比べてより高いSNRを有しており、SNRが、実験7,13の間に安定している。折り畳まれていない海馬準備とPMEAの組み合わせが投資する新しい方法を提供します2次元平面上での神経伝達をIGATE。この技術を用いた実験では、すでに神経活動は、独立して、シナプスや電気シナプス7の伝播することが可能となる海馬における神経信号伝搬のメカニズムについての重要な結果が得られている。
プロトコル
注:動物実験プロトコルを見直し、大学で施設内動物管理使用委員会によって承認された。 P20へP10歳の時にいずれかの性別のCD1マウスをこの研究で使用されている。
手術と実験録音1.ソリューション
- のNaCl 124、KClの3.75、KH 2 PO 4 1.25、MgSO 4を2、NaHCO 3で26、ブドウ糖10、およびCaCl 2 2:(mm)を含む通常の人工脳脊髄液(aCSFの)バッファを準備します。実験の開始時に切開した後、同様に洗浄システムのための組織の回復のために、この正常なaCSFのに使用します。
- スクロース220、塩化カリウム2.95、のNaH 2 PO 4 1.3、MgSO 4を2、 炭酸水素ナトリウム26、ブドウ糖10、およびCaCl 2 2:海馬の解剖中に使用して含んでいるショ糖のaCSF(mm)を準備します。無傷の海馬組織標本におけるてんかん様活動を誘導するために、正常なaCSFの少なくとも4アミノピリジン(4-AP)を追加100μMの濃度。
無傷の海馬の準備のために2の外科的処置
- デシケーターガラスジャー(具体的な材料および装置における第1号)の底でチャンバ内にイソフルラン(1ミリリットル)をドロップし、動物が接触取得していませんので、下段の表面を覆うように、通常の紙タオルを使用液体。その後、瓶にCD1マウスを置き、蓋を閉じます。約1分〜2分間、閉鎖瓶で動物を保管してください。息周波数は約1秒あたりのとき、ジャーからマウスを取り外します。
- 手術台の上でマウスを置き、適切なはさみで首を切る。すぐに断頭した後、約30秒間氷冷(3-4℃)に頭部、酸素スクロースaCSFのを置く。
- 頭蓋骨の上に皮膚を除去するために、テンポに近い2つの端部にだけでなく、頭の真ん中の線に沿って頭蓋骨をカットする細かいハサミ(特定の材料および機器で5番)を使用してくださいRAL葉。脳を露出させるために、ヘッドの各側にカット頭蓋骨を剥離する鉗子(具体的な材料および装置で第6)を使用します。
- 慎重に頭蓋骨の底から脳を剥離し、脳と頭蓋骨の頭頂葉の間の隙間にマイクロラボへら(具体的な材料および装置における第8号)を挿入した後、準備された氷のように冷たい上にドロップします(3湿ったろ紙(具体的な材料および装置における第2号)に覆われて-4℃)外科段階。氷冷刃で小脳を外し、脳の正中線を切断して2半球を分離する。その後、氷冷スクロースaCSFのを満たしたビーカー中に分離した2つの半球を配置し、95%O 2/5%CO 2でバブリング。
- 半球の半分を取り、氷冷したろ紙ステージ上に置く。余分なソリューションを吸うために脳を中心に定期的なペーパータオルまたはろ紙を置きます。材料における2ファイアーポリッシュガラスピペットツール(第10号を使用して、脳の中心部の残りの部分から大脳皮質を分離する装置)。
- 海馬は皮質の内側から露出し、氷冷ステージに置かれた後、組織上の氷冷スクロースのaCSFの2〜3滴を配置し、海馬の周りに余分な溶液を除去する。海馬の両端に皮質との接続を切断します。その後、火災研磨されたガラスのツールで脳から海馬を解剖し、脳の残りの部分を削除します。
- その白板側を上に向けおよび海馬溝を下に向けて全体の海馬を分離します。すぐに再び組織上の氷冷スクロースのaCSFの2〜3滴をドロップし、ペーパータオルの一片を用いて組織の周りに余分な溶液を除去する。溝( 図1B、C)を公開する全体海馬を裏返しする火災研磨されたガラスツールを使用します。
- 通常の光学顕微鏡下では、具体的なMateriに特注のガラス針(11号を挿入溝の方向( 図1C)に沿ってALSと機器)溝の一端にと鉤状回する歯状回(DG)から、ファイバ接続を切断したりCA1フィールド、。必要に応じて、海馬の中隔と時間的な端をトリミングするために氷のように冷たい刃を適用します。カット溝に(具体的な材料および装置における第12号)カスタムメイドの金属ワイヤループを挿入し、火災研磨されたガラスツールによって海馬の海馬台/ CA1の端部を保持しながら、組織から離れてDGの上に引き出します( 図1D) 。
- 上記の展開手順の後、組織上の氷冷スクロースのaCSFの別の2〜3滴を追加し、組織の周りに余分な溶液を除去する。その後、約(エッジ( 図1E)で氷のように冷たい刃で折り畳まれていない海馬をトリミングし、通常aCSFので満たされた回復室にスパチュラで準備を置き、室温で95%O 2/5%CO 2でバブリング25°C)。去る折り畳ま海馬組織は、記録チャンバーにそれを配置する前に約1時間を回復する。
- 他の脳半球を取り、2.5から2.9のステップを経るためにそれを使用。通常、単一の海馬を展開し、組織酸素化および水和を維持するために継続的に氷のように冷たい蔗糖aCSFのをドロップするように全体の手順を完了するのに約1から2分を取る。
3.実験システムのセットアップ
- カスタムは、ピングリッドアレイ(PGA)パッケージPMEAを作製し、パッケージ( 図3B)上のピンのパッドに単一微小電極の各パッドに接続するために、マイクロワイヤボンディングを使用し接着。その後、カスタムメイドの回路基板13上のソケットに、パッケージを挿入します。
- 個別にカスタムメイドの回路基板13上の100のゲインで4 kHzとアンプに1ヘルツからバンドパスカットオフ周波数とのフィルタに各微小電極を接続してください。 A / D convは回路基板からのアナログ出力をデジタル化システムertingし、コンピュータのデータを取得し、格納する。
- 溶液流( 図4A)のための入口及び出口管を有するアレイの周りにカスタムメイドのプラスチック記録チャンバーを接着。システム内のさまざまなソリューションを維持し、トライ弁によりボトルの出力管に参加し、制御するために、少なくとも2つのボトルを使用してください。記録室にソリューションをガイドされている点滴室で配管システムにトライバルブの出力を接続します。
- 三バルブと記録チャンバーの入口との間、溶液を記録チャンバーに導かれる前に、制御された温度(35℃)に溶液を加熱する電気ヒータを追加する。フラスコに接続された真空管に液を収集するために真空管に記録チャンバーの出口に取り付ける。この研究では、任意の実験ではすべてのソリューションをリサイクルしないでください。
4. PMEA上に非折り畳み海馬を配置すると、神経活動を記録するために
- 実験装置を製造するために、通常のaCSFのと4-AP aCSFの持つ別のボトルで1ボトルを埋める。両方のボトル、バブル95%O各実験の当初2/5%CO 2。実験中に選択される解決策を制御するためにトライバルブコネクタを使用してください。集塵容器内に溶液をポンプするチャンバーの出口に真空管を接続します。記録チャンバーにそれを配信する前に、パイプラインを加熱して制御された温度レベル(35℃)で溶液を維持する。
- チャンバ記録の入口と出口が閉じられたときに、記録チャンバー内に折り畳ま海馬を転送し、配置するカスタムメイドガラスピペットスポイトを使用する。顕微鏡下で、組織は溶液中に浮遊している中に、通常の小さなペイントブラシを使用して折り畳まれていない海馬を配置。研究者の方を向いて、下に向けてその白板側に折り畳まれていない海馬を置きCA3エリアまでを指し、およびCA1フィールド。
- 注意深くチャンバーを乾燥させ、組織アレイ上に下降するまで溶液のレベルを下げて記録チャンバーの端から真空ピペットを用いてチャンバ内の溶液を離れて吸う。その後、慎重にアレイ上に折り畳まれていない海馬を保持するために組織の上にカスタムメイドの組織アンカー( 図4)(具体的な材料および装置で第14)を配置します。それを補充する記録チャンバーへの溶液の数滴を入れて、徐々に点滴チャンバ内で毎秒約2滴に流量を調整するための入口および出口を開く。
- 4-APに溶解するaCSFへの液供給を切り替えて、適切に流量を調整し、その後、回復するために約1分間の通常のaCSFた記録室で組織をインキュベートする。約5から10分間aCSFの溶解した4-APで組織をインキュベートした後、研究者は、自発的な活動が表示されたときに信号を記録するためにソフトウェアを起動できます。
5.削除実験後にPMEAからの組織
- マイクロマニピュレータによる組織アンカーを制御し、徐々に記録チャンバーから組織を持ち上げる。記録チャンバー内の流れを停止し、入口と出口の両方をシャットダウンします。記録チャンバーは、ソリューションとの完全であることや、記録室が満杯でない場合室を埋めるために、溶液の数滴を追加する必要があります。
- 組織の各コーナーを持ち上げるために小さなペイントブラシを使用してください。組織は、溶液中に浮遊していない場合、組織は、まだアレイの上に座って注意深くチャンバーを乾燥させるために真空管を使用する。その後、慎重に徐々に室を再充填し、記録室がいっぱいになったときに流れを止めるために注入口をシャットダウンする入口を開きます。再び組織の各コーナーを持ち上げるために小さなペイントブラシを適用します。
- 手順を繰り返し5.2組織がアレイから切り離され、溶液中に浮遊しているまで。組織は、溶液中に浮遊している場合、離れた組織を吸引する真空管を使用する。オープントン彼は、入口に流れと出口に真空を開く。蒸留水でシステムを洗って、それを完全に乾く。
結果
ここで、図面に示されたデータは、4-AP(100μM)を室温で記録チャンバー内の組織のインキュベーションの間に添加するaCSF(25°C)で折り畳ま海馬製剤で記録した。通常、アクティビティが5分以内に開始しますが、高齢の動物からいくつかの海馬組織中でそれは時間がかかることがあります。以前に14,15を報告したようにPMEAで観察4-APによって誘発される神経細胞の発火は同じです。電極は、200μmの高さを有しているので、細胞層は海馬の白板上記通常250~300程度( 図2)、録音(外57であるため、電極先端がちょうど細胞層( 図3C)の下方に配置されている異なるチャネルからのサンプル実験では64)は、主に正のたわみを持っている。しかし、これらの陽性録音の一部は、同様に( 図5B)記録電極先端が細胞層に十分近い場合には、小さい負の偏向を表示することができます。電極先端が右のセル層のレベルに位置している場合は、録音はそれにプラスのシフトか、単に負のスパイク( 図5C)16と非常に鋭い負のスパイクを持つことになります。ここに示したデータサンプルでは、57の録音のうち、5チャネルは、負のスパイクを持っている。全64チャンネルからデータを取得した後、個々の正規化方法( 図6B)は、記録7の時間軸に沿って2次元平面上の神経伝播をマッピングするために適用される。 PMEAと折り畳まれていない海馬の組み合わせによって、神経伝達をマッピングした( 図6)海馬の全領域を横切る、CA3の一方の側に主に開始し、斜め波面に長手方向に移動することが観察される。

折り畳まれていない海馬図1.外科的手技 (A)は 、2つの海馬の一つは、マウスの脳の側頭葉から切除される。(B)海馬の溝を露出させるために、火災研磨したガラスピペットを用いてひっくり返される中隔及び縦軸に沿って時間的終端(C)。海馬の両端をトリミングされ、ガラス針をDGと長手方向軸に沿っCA1または海馬の間の接続を切断するために使用される。(D)海馬はカスタムメイドの金属線ループによって展開される。(E)を有する非折り畳み海馬海馬台とDGをトリミング。(F)折り畳まれていない海馬の最終組織調製。それは実験で、アレイ上に配置されている場合、この位置は、海馬の向きを示している。折り畳まれていない海馬の解剖学に関する追加の詳細については、以前に公開原稿7における実験的方法を参照してください。g1large.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
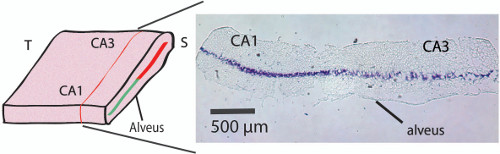
折り畳まれていない海馬の図2.組織学断面が。クリスタルバイオレット染色、それによって右細胞層の下に微小電極を配置する250から300程度のレベル白板上記折り畳まれていない海馬内のCA1-CA3錐体細胞層の位置を示している( 図3Cを参照してください)。海馬は、折り畳まれていないされた後にクリスタルバイオレットで染色した切片を得るためには、組織は、後固定した。折り畳ま海馬PFA 4%O / Nに入れた。その後、組織は、転送され、48時間のスクロース溶液(30%)に保管し、ドライアイスで-35℃に冷却イソペンタン(2-メチルブタン)を含むバイカーでスナップ凍結が続いた。凍結切片を、次いで、クライオスタットで切断した横断面で20μmの厚さの切片( 図2に示すように)錐体細胞層の位置を明らかにする。 この図の拡大版をご覧になるにはこちらをクリックしてください。
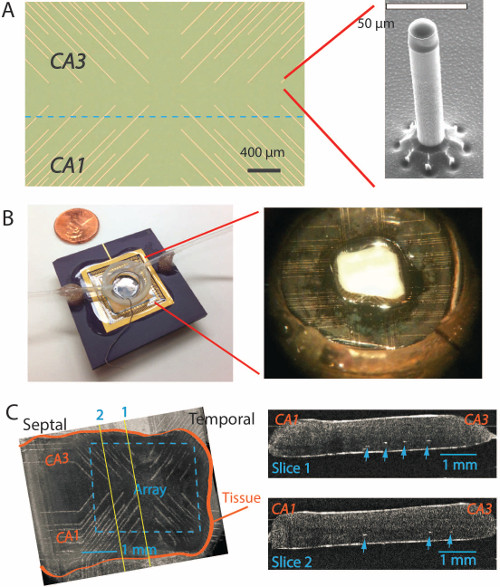
図3. PMEA上の非折り畳み海馬。 (A)は 、各金金属トレースの端部に位置する微小電極を使用して新しいPMEAの上面図。右側のインサートは200μmの高さが20μm7,13の直径を持つ電子顕微鏡の下で、単一の微小電極を示している。(B)微小電極アレイは、上の微小電極の周りにプラスチック製の記録室でPGAパッケージに接着されているガラス基板。右側のインサートは、微小電極ARR上に置かれ折り畳まれていない海馬を示していAY真ん中に。(C)左側には、光コヒーレンストモグラフィ(OCT)イメージング異なる実験で、アレイの上に配置折り畳まれていない組織を示しています。右側には、左のOCT画像から得られた二つの長手方向のスライス画像は、右の細胞体層の下の領域に達する(白ドットが矢印で指さ)微小電極のヒントを示している。 この図の拡大版を表示するには、こちらをクリックしてください。

4.実験セットアップ図。 (A)のネジ付きプラスチックカバー蓋が可能な水の損傷から保護するために回路上に配置される。記録チャンバーは、溶液の流れを運ぶための入口および出口の両方の管を有している。ナイロン繊維メッシュで接着カスタムメイドの組織アンカーはTISSを固定するために使用される実験中にサンプル·スライスを保持する組織アンカーを示すPMEAのガラス基板の底部から採取ueが実験中の(B)写真。湾曲したワイヤが組織の上に押し付けメッシュのナイロン繊維である。丸いドットは微小電極の塩基である。矢印は、いくつかの実験後に被害を受けた電極を指す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
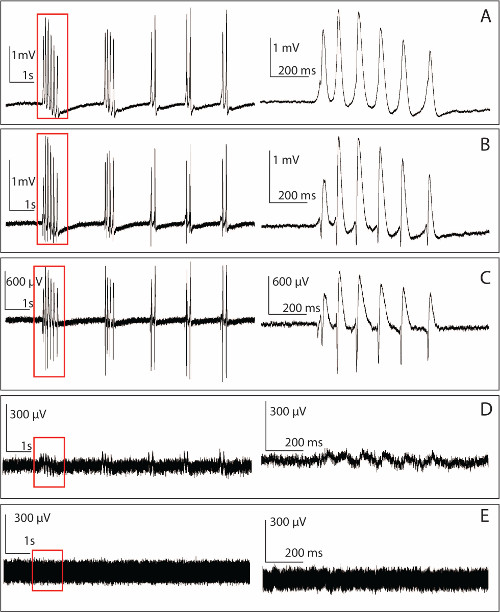
折り畳まれていない海馬からPMEAによって記録された図5.生データ。左パネル :シングル微小電極から記録された4-APによって誘発されるてんかん様活動右パネル :。ズームアップで左の時間ウィンドウでマーク信号のバージョン。 (A)における自発的活動の例の10秒区間34.9デシベルのSNRの信号の極性に基づいて、基底樹状突起領域に位置する微小電極の一つについて得られた、100μM4-APによってaCSFのduced。SNRと細胞体に近い側に位置する他の微小電極から(B)生データ体細胞層内に配置された電極から得られた記録の27.2デシベル。(C)例の。この例では、SNRは依然として導電性が、組織に浸透していない曲がった電極から得られた18.53デシベル(D)の記録である。曲がった電極は、それらの無傷の電極(本例では1.5デシベル)と比較して有意に低いSNRを有する。微小電極から記録された(E)ベースラインノイズを。ベースラインは通常150〜200μVからピーク値にピークを有しており、単一の電極のインピーダンスが約1MΩ〜2である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
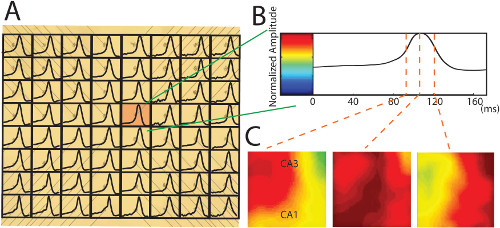
2-D伝搬マップに神経の記録データの図6の変換。 (A)170ミリ秒の時間ウィンドウは各チャネルの単一の神経スパイクは、PMEAの写真上にプロット切り捨てます。生データは、100 HZにローパスフィルタによってフィルタリングされる。壊れた電極からの信号は、その周りの録音で補間されます。この例では、すべてのスパイクが正である。(B)(A)における赤色画素から単一の神経スパイクは個々の正規化のためのカスタム開発の方法でカラーバーに正規化されます(詳細は以前の出版物を参照してください正規化7)。(C)について個々の正規化によって作成されたカラーマップは、異なる時点で折り畳ま海馬の全領域にわたってその伝播の動きを示している。www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/52601/52601fig6large.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
海馬の縦方向および横軸が貫通する微小電極アレイと組み合わせて保存されて折り畳まれていない海馬調製物の開発が海馬7の解剖接続または神経伝播を研究する強力なツールを提供する。この展開手順は、成体マウスにおける海馬の研究にも適用可能である。この調製物を用いた最近の研究では、4-AP誘発性てんかん様活動は、折り畳まれていない海馬( 図6)7,8の全領域にわたって対角線波面を伝搬することができることを示した。これらの研究は、フラット海馬神経回路網の神経伝達が( 図6)を調べることができる場合、無傷折り畳ま海馬、横または縦のいずれかのスライスに対して重要な利点を提供することを示した。
貫通微小電極は、既存のMI上の重要な利点を提供しています平らな面11,12,17の上に配置された複数のコンタクトで構成されcroelectrodeアレイ(MEA)。平面電極を有するMEAは、細胞層は、約250~300ミクロン離れた表面( 図2)から離れているので折り畳ま海馬で使用することが困難である。 PMEAは、ここで説明する組織7,13内部の深くに到達するために200μmの高さで、神経伝播を研究するのに適した64貫通電極と、この問題を解決するために設計されました。加えて、皮質スライスなど、任意の平らな組織標本におけるPMEAも適用、海馬の横断切片等
このPMEAを使用する別の利点は、改善されたSNRである。このPMEAの試作研究は以前の研究で示されているので、このPMEAによって記録された神経信号のSNR比は、VSDの記録に比べて有意に高く、より安定して19.4±3 dBでの平均値を有することを示して毒性およびVSDの写真漂白は明らかにデータ8を記録する機能が損なわれ。を有するもの平ら、電極アレイと比較してより高いSNRを有する20dB程度〜30の範囲に、本 研究において( 図5)PMEAが増加からの記録のSNRを組織アンカーを使用して、改善された実験プロトコルと10〜15デシベル11,18からの値。海馬を展開する能力は、平坦な記録アレイによって調べることができるニューロン(CA1-CA3)の層を得るために不可欠である。
シリコンアレイは、透明基板上に構築されているので、また、電位感受性色素イメージング技術は、海馬8における神経活動の伝播を研究するPMEAシステムに組み込むことができる。蛍光電位感受性指示薬を有するトランスジェニックマウスはまたpharmacologiによって誘導される元と伝播の生理学的条件下での信号ならびに変化を調査するために使用することができCAL剤又は種々の動物モデル9からの遺伝修正組織。
高品質の記録を保証するために、いくつかの重要なステップがある。まず、組織の生存を確保するために、外科的処置は、可能な限り迅速に行わなければならない。通常は、2.10に2.1からすべてのステップ))を通過するのに約1から2分かかります。実際の実験手術が行われる前に、いくつかのサンプルの動物上の展開手順の実施は非常に示唆されている。次に、流量を記録チャンバー内の灌流液のレベルの任意の変動を回避するために一定に維持する必要がある。さらに、組織は、アレイに組織の移動を回避するために下方に固定されるべきである。
ここで説明PMEAが折り畳まれていない海馬における神経伝播の監視に有効な信号を提供することができるが、この記録方法論にはいくつかの欠点と制限があります。
初めに、微小電極( 図5D、E)それらの上に置かれ、機械的な力のために破ることができる。組織の配置と除去の手順の間に、小さなペイントブラシとアレイとの間の偶発的な接触は、微小電極を曲げたり、破損の原因となります。組織アンカーは、マイクロマニピュレータにより下降されると、チャンバの底部に沿った組織の水平移動は、曲げや、電極の破損につながる可能性がせん断力を作成することができます。今後の設計では、微小電極は、それらをより強くするためにやや厚いベースで再成形する必要があります。このPMEAの現在のバージョンでは、記録電極は、狭いベース、それによって電極( 図3A)を弱め、その直径13と比較して持っている。
クリーニング手順も適切に配列に取り付けることができ、残留組織と繊維を除去するために改善されるべきである。各実験の後、小片組織の微小電極に付着したまま可能性があり、電極上に残され、この残留組織を除去しなければならない。これらの残留組織が削除されていない場合は、電極のインピーダンスと録音のSNRが影響を受ける可能性があります。蒸留水を用いて、システムのフラッシングをプロトコールセクションの部分5に示すように示唆されている。また、ユーザーはシステムに損傷を与えることなく組織を溶解することができるいくつかの弱い酸性溶液を使用してシステムをフラッシュすることをお勧めします
このプロトコルの別の欠点は、展開手順の間、この折り畳ま海馬perforantパスがDGからの海馬の他の層に伝播する可能性神経信号の調査を防止する、切断されることである。
結論として、我々は、折り畳まれていない海馬TISSU、高アスペクト比の微小電極アレイを組み合わせることにより、海馬内の神経活動の伝播を調査するために、ここでの新規の方法を記載しているE。この方法は、両方の縦方向と横方向に伝搬することができますどのように神経活動のより良い理解のリードを行った。この技術はまた、アレイの上に同様に配置された皮質組織に適用することができる。アレイは透明であり、また、神経組織内の信号伝搬についてのいくつかの重要な発見につながるので、この製剤を光記録技術を組み合わせることが可能である。
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by National Institutes of Health (National Institute of Neurological Disorders and Stroke) Grant 1R01NS060757-01 and by the E.L. Lindseth endowed chair to Dominique M. Durand. We thank Dr. Andrew M. Rollins’ laboratory for the help on the OCT imaging.
資料
| Name | Company | Catalog Number | Comments |
| desiccator jar | LABRECYCLERS Inc. | 5410 | Place regular paper towels at the bottome of the jar for animal anesthesia use. |
| A blade and Custome made surgical stage for unfolding hippocampus | N/A | N/A | A petri dish is place upside down (in the center) in the ice with a wet filter paper place on top of it. |
| Custom made tissue recovery chamber | N/A | N/A | Plastic tubes were glued with plastic mesh at the bottom and bubbled with 95% O2/ 5% CO2 in the aCSF. |
| Straight Operating Scissors | Fisher Scientific | S17336B Medco Instruments No.:81995 | This scissors is used to decapitate the mice. |
| Integra Miltex Goldman-Fox Scissors | Fisher Scientific | 12-460-517 MILTEX INC No.:5-SC-320 | This scissors is used to cut the skull of the mice. |
| Miltex Hysterectomy Forceps | Claflin Medical equipment | CESS-722033-00001 | This Forceps is used to peel the cut skull to expose the brain |
| Micro Spatula | Cardinal Health | This micro spatula is used to tranfer the whole brain of a semisphere into the recorering chamber. | |
| Frey Scientific Stainless Steel Semi-Micro Spatula | Cardinal Health | this semi micro spatula is used to tranfer the unfolded hippocampus into the glucose aCSF in the recovering chamber. | |
| small paint brush | Lowe's | tem #: 105657 Model #: 90219 | The one with the smallest size in a normal paint brush package |
| Fire polished glass help tool | N/A | N/A | This tool was fire polished and made from the regular Pasteur glass pipettes. |
| Custom made glass needle | N/A | N/A | This tool was fire polished and made from the regular Pasteur glass pipettes. |
| Custom made glass tool with a metal wire loop | N/A | N/A | This tool was fire polished and made from the regular Pasteur glass pipettes with a reshaped metal wire loop. |
| Custom made glass solution dropper | N/A | N/A | This tool was made from the regular Pasteur glass pipettes with its tips cut and a rubber head attached with the cut end. |
| Custom made tissue anchor | N/A | N/A | Nylon fiber mesh was glued on a insulated copper wire ring. The tissue anchor was hold by an micromanipulator. |
| Custom fabricated microelectrode array | N/A | N/A | More detail about the array please refer to Kibler, et al, 2011. |
| Custom made filter and amplifiers circuits for the array | N/A | N/A | More detail about the array please refer to Kibler, et al, 2011. |
| Data acquisition processor 3400a | Microstar Laboratories | N/A | This is a complete data acquisition system with A/D converter. |
参考文献
- Richardson, K. A., Schiff, S. J., Gluckman, B. J. Control of traveling waves in the Mammalian cortex. Phys Rev Lett. 94 (2), 028103-028112 (2005).
- Luhmann, H. J., Dzhala, V. I., Ben-Ari, Y. Generation and propagation of 4-AP-induced epileptiform activity in neonatal intact limbic structures in vitro. Eur J Neurosci. 12 (8), 2757-2768 (2000).
- Grinvald, A., Manker, A., Segal, M. Visualization of the spread of electrical activity in rat hippocampal slices by voltage-sensitive optical probes. J Physiol. 333, 269-291 (1982).
- Gloveli, T., et al. Orthogonal arrangement of rhythm-generating microcircuits in the hippocampus. Proc Natl Acad Sci USA. 102 (37), 13295-13300 (2005).
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Albani, S. H., McHail, D. G., Dumas, T. C. Developmental studies of the hippocampus and hippocampal-dependent behaviors: insights from interdisciplinary studies and tips for new investigators. Neurosci Biobehav Rev. 43, 183-190 (2014).
- Zhang, M., et al. Propagation of Epileptiform Activity Can Be Independent of Synaptic Transmission, Gap Junctions, or Diffusion and Is Consistent with Electrical Field Transmission. J Neurosci. 34 (4), 1409-1419 (2014).
- Kibler, A. B., Durand, D. M. Orthogonal wave propagation of epileptiform activity in the planar mouse hippocampus in vitro. Epilepsia. 52 (9), 1590-1600 (2011).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108 (11), 3147-3160 (2012).
- Wingenfeld, K., Wolf, O. T. Stress , memory, the hippocampus. Front Neurol Neurosci. 34, 109-121 (2014).
- Liu, J. S., et al. Spatiotemporal dynamics of high-K+-induced epileptiform discharges in hippocampal slice and the effects of valproate. Neurosci Bull. 29 (1), 28-36 (2013).
- Oka, H., Shimono, K., Ogawa, R., Sugihara, H., Taketani, M. A new planar multielectrode array for extracellular recording: application to hippocampal acute slice. J Neurosci Methods. 93, 61-68 (1999).
- Kibler, A. B., Jamieson, B. G., Durand, D. M. A high aspect ratio microelectrode array for mapping neural activity in vitro. J Neurosci Methods. 204 (2), 296-305 (2012).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. J Pharmacol Exp Ther. 282 (1), 262-270 (1997).
- Perreault, P., Avoli, M. 4-aminopyridine-induced epileptiform activity and a GABA-mediated long-lasting depolarization in the rat hippocampus. J Neurosci. 12 (1), 104-115 (1992).
- Chesnut, T. J., Swann, J. W. Epileptiform activity induced by 4-aminopyridine in immature hippocampus. Epilepsy Res. 2 (3), 187-195 (1988).
- Nam, Y., Wheeler, B. C. In Vitro Microelectrode Array Technology and Neural Recordings. Crit Rev Biomed Eng. 39 (1), 45-62 (2011).
- Gonzalez-Sulser, A., et al. Hippocampal neuron firing and local field potentials in the in vitro 4-aminopyridine epilepsy model. J Neurophysiol. 108 (9), 2568-2580 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved