Method Article
TIRFM e GFP-sondas sensíveis ao pH para avaliar Neurotransmitter Vesicle Dynamics em SH-SY5Y Neuroblastoma Cells: imagens de células e Análise de Dados
Neste Artigo
Resumo
This paper provides a method for investigating neurotransmitter vesicle dynamics in neuroblastoma cells, using a synaptobrevin2-pHluorin construct and Total Internal Reflection Fluorescence Microscopy. The strategy developed for image processing and data analysis is also reported.
Resumo
Vesículas sinápticas liberar neurotransmissores nas sinapses químicas através de um ciclo dinâmico de fusão e recuperação. Monitorando a atividade sináptica em tempo real e dissecando as diferentes etapas da exo-endocitose no nível single-vesícula são cruciais para entender as funções sinápticas na saúde e na doença.
Geneticamente codificado sondas sensíveis ao pH diretamente direcionados para vesículas sinápticas e Total Internal Reflection microscopia de fluorescência (TIRFM) fornecem resolução espaço-temporal necessário para acompanhar a dinâmica das vesículas. O campo evanescente gerado pela reflexão interna total só pode excitar fluorophores colocados em uma camada fina (<150 nm) acima da tampa de vidro no qual as células aderir, exatamente onde os processos de exo-endocitose ter lugar. As imagens de alto contraste resultantes são ideais para vesículas rastreamento e análise quantitativa de eventos de fusão.
Neste protocolo, SH-SY5Y n humanoeuroblastoma células são propostos como um modelo válido para estudar a libertação de neurotransmissores no nível único de vesículas por TIRFM, devido à sua superfície plana e a presença de vesículas dispersas. Os métodos para o crescimento SH-SY5Y como células aderentes e para transfectar-los com synapto-pHluorin são fornecidos, bem como a técnica para executar TIRFM e imagiologia. Finalmente, uma estratégia com o objetivo de selecionar, contar e analisar eventos de fusão a nível de célula inteira e única de vesículas é apresentado.
Para validar a abordagem de análise de procedimento de imagem e dados, a dinâmica das vesículas pHluorin-marcados são analisados sob repouso e estimulada (despolarização concentrações de potássio) condições. Despolarização da membrana aumenta a freqüência de eventos de fusão e provoca um aumento paralelo do sinal de fluorescência líquida registrada em células inteiras. Análise Single-vesícula revela modificações de comportamento fusion-evento (altura aumentou pico e largura). Estes dados sugerem tha despolarização de potássio não só induz uma liberação maciça neurotransmissor, mas também modifica o mecanismo de fusão das vesículas e reciclagem.
Com a sonda fluorescente adequada, esta técnica pode ser utilizada em diferentes sistemas celulares para dissecar os mecanismos de secreção constitutiva e estimulada.
Introdução
A transmissão sináptica química entre neurónios é um dos principais mecanismos de comunicação no sistema nervoso. Baseia-se na liberação de neurotransmissores através de um ciclo dinâmico de fusão das vesículas e recuperação no local da pré-sináptico. Muitas das proteínas envolvidas na dinâmica das vesículas foram identificados; no entanto, sua contribuição específica para o fenômeno ainda precisa ser esclarecido 1.
A nossa compreensão é parcialmente limitada pelo facto de que os ensaios mais amplamente utilizados para a exo / endocitose nem sempre são as mais adequadas. Vários estudos relacionados com a fusão das vesículas e dinâmicas dependem de técnicas eletrofisiológicas. Esta técnica fornece uma melhor resolução temporal e é excelente para investigar a fusão inicial de vesículas para a membrana do plasma, mas é incapaz de detectar muitos dos eventos moleculares subjacentes que suportem a função de pré-sináptico. A microscopia electrónica, por outro lado, proporciona os melhores morphological descrição de cada passo singular, mas o aspecto dinâmico do acontecimento não pode ser capturado, como as amostras devem ser fixados a fim de ser analisado.
O advento de novas técnicas de gravação óptica 2,3, em combinação com os avanços na fluorescente sondas moleculares desenvolvimento 4-6, permite a visualização de processos exocíticas em células vivas, proporcionando novos níveis de informações sobre a estrutura e função sináptica.
Estudos iniciais exploradas corantes dependentes de atividade estirilo (FM1-43 e corantes orgânicos relacionados) 7,8. State-of-the-art técnicas de imagem empregar variantes da proteína verde fluorescente (GFP) (pHluorin) amarrado a vesículas proteínas luminais 9 sensíveis ao pH. Estas sondas são normalmente desligado quando presente nas vesículas devido ao baixo pH luminal. Após a fusão com a membrana plasmática, o interior das vesículas está exposta ao espaço extracelular neutro, o pH abruptamente aumenta, alivia a extinção dependente de protões de pHluorin e o sinal fluorescente rapidamente aparece. Como a mudança de pHluorin é mais rápido do que o evento de fusão, através da monitorização da fluorescência aumenta, a fusão das vesículas com a membrana podem ser medidos e analisados. Como as moléculas da superfície marcadas com pHluorin sofrem endocitose, o sinal de fluorescência, subsequentemente, regressa ao nível basal, por conseguinte, a mesma construção pode também ser utilizada para monitorar vesícula reciclagem 9.
Enquanto o sensor de pH com etiquetas de vesículas assegura a visualização de somente aquelas vesículas que realmente fundem com a membrana plasmática, a imagem em alta resolução espacial e temporal, é necessário para descrever detalhadamente os passos envolvidos nos processos de endocitose exo /. A técnica óptica que proporciona a resolução espacial e temporal, é necessário microscopia de fluorescência de reflexão interna total (TIRFM), um pedido de microscopia de fluorescência 10.
"> A reflexão interna total ocorre na interface entre a lamela de vidro e a amostra. Quando o percurso da luz atinge a lamela de vidro com um ângulo de incidência maior do que o ângulo crítico, a luz de excitação não é transmitido para a amostra, mas é completamente reflectido de volta. Nestas condições, forma-se uma na interface onda evanescente de luz e se propaga no meio com menor densidade óptica (a amostra). À medida que a intensidade do campo evanescente decai exponencialmente com a distância a partir da interface (com uma profundidade de penetração cerca de 100 nm) apenas os fluoróforos mais próximo em proximidade com a tampa-derrapante pode ser animado, enquanto os mais longe do limite não são. Em células transfectadas com construções de GFP, esta profundidade corresponde a proteínas expressas na membrana plasmática ou em estruturas vesiculares aproximando-se. Tal como fluoróforos no interior da célula não pode ser excitado, a fluorescência de fundo é minimizado, e uma imagem com um sinal muito alta / rato fundoio é formada 11.Várias características tornam TIRFM a técnica de escolha para o monitoramento vesículas dinâmica. O perfeito contraste e o sinal-para-ruído elevado rácio de permitir a detecção de sinais de muito baixo a partir das vesículas resultantes individuais. Aquisição de imagem baseada em chip em cada quadro fornece a resolução temporal necessário para detectar processos altamente dinâmicos. Por fim, a exposição mínima de células à luz a qualquer outro avião na amostra reduz fortemente fototoxicidade e permite a gravação de longo lapso de tempo com duração de 12.
A análise dos dados continua a ser o aspecto mais desafiador e crucial desta técnica. A maneira mais simples para controlar a fusão das vesículas é medir a acumulação de proteínas repórter fluorescente à superfície da célula, ao longo do tempo 13. À medida que aumenta de fusão, líquidos aumenta de sinal de fluorescência bem. No entanto, este método pode subestimar o processo, particularmente em células grandes e em condições de repouso,porque os processos de endocitose e fotodegradação compensar o aumento na intensidade de fluorescência devido à vesícula exocitose. Um método alternativo é seguir cada evento único fusão 14. Este último método é muito sensível e pode revelar detalhes importantes sobre os mecanismos de fusão. No entanto, ele requer a seleção manual de eventos únicos, porque os procedimentos completamente automatizados para seguir vesículas e registrar a flutuação de seus sinais fluorescentes nem sempre estão disponíveis. Observação da dinâmica das vesículas requer células de amostragem em alta freqüência. Isto gera uma grande quantidade de dados que não podem ser analisados manualmente.
A proposta deste artigo é o de otimizar a técnica de imagem TIRFM para monitorar o basal e liberação de neurotransmissores estimulada na linha de células de neuroblastoma SH-5YSY, e descrever, passo-a-passo, um procedimento desenvolvido no laboratório de análise de dados, tanto em níveis de célula inteira e única de vesículas.
Protocolo
1. Cultura de Células e Transfection
- Cultura de células SH-SY5Y
NOTA: Os experimentos foram realizados utilizando o neuroblastoma humano SH-SY5Y (ATCC # CRL-2266) 15. As células SH-SY5Y crescem como uma mistura de agregados flutuantes e as células aderentes. Siga as instruções relatadas no protocolo (densidade celular, a relação de divisão, etc.) Para ter células que crescem firmemente ligados a tampa de vidro, que é crucial para TIRFM.- Antes de começar, sob a cabine de segurança biológica de fluxo laminar, perfazer o volume de solução de fosfato oportuno estéril salina de tampão (PBS) e meio de cultura.
- Adicione 50 ml de PBS com concentrações de 150 mM de NaCl, 24 mM de tampão fosfato, pH 7,4. Filtrar a solução.
- Adicione 50 ml de meio de células a partir de meio de Eagle modificado por Dulbecco (DMEM) com elevado teor de glucose, 10% inactivado pelo calor soro fetal bovino (FBS), penicilina (100 U / ml), estreptomicina (100 ug / ml), L-glutamina ( 2 mM), epiruvato de sódio (1 mM). Filtrar a solução.
- Remover o meio de crescimento completo e lava-se as células com 3 ml de PBS.
- Incubar as células com 2 ml de 0,05% de tripsina-ácido etilenodiaminotetracético (EDTA) (por placa de Petri de 6 centímetros) por 5 min a 37 ° C, 5% de CO 2 e separar as células utilizando uma pipeta.
- Inactivar a tripsina por adição de 2 ml de DMEM, e recolher as células por centrifugação a 300 xg durante 5 min.
- Remover o sobrenadante, adicionar 1 ml de DMEM para a pastilha e a solução pipetar para cima e para baixo o suficiente para dispersar as células numa suspensão de células única.
- Dividi-los 1: 4 em um novo diâmetro de prato 6 centímetros de Petri contendo 3 ml de meio completo. Manter as células em cultura em placas de Petri de diâmetro 6 cm, a 37 ° C numa atmosfera de 5% de CO2. Sub-cultura, uma vez por semana ou quando eles cobriram 80 - 90% da área da superfície.
- Antes de começar, sob a cabine de segurança biológica de fluxo laminar, perfazer o volume de solução de fosfato oportuno estéril salina de tampão (PBS) e meio de cultura.
- Chapeamento de células SH-SY5Y para geração de imagens
- Para experiências TIRFM, placacélulas nas tampas de vidro. Empregar tampas de vidro com 0,17 ± 0,005 milímetros de espessura e um índice de refração 1,5255 ± 0,00015. Antes de começar, prepare as lamelas de vidro como segue:
- Limpe o vidro cobre com 90% de etanol, O / N.
- Lave-os bem em água destilada (três mudanças de água destilada). Vidro cobre a seco num forno de secagem.
- Local cobre em placas de Petri e esterilizar em um forno pré-aquecido a 200 ° C durante 3 h.
- O dia antes da transfecção, colocar cada lamela numa caixa de Petri de 3,5 cm adicionar 1 ml de meio de cultura e incuba-se a 37 ° C numa atmosfera de 5% de CO2.
- Tripsinizar as células como descrito nos passos 1.1.3 - 1.1.5, suspender o sedimento de células em 1 ml de meio completo e contar. Calcula-se o volume correcto de suspensão de células a adicionar para cada placa de Petri para proporcionar 3 x 10 5 células / poço. Esta densidade é necessária para o crescimento celular óptimo e transfecção eficiente. Incubar a 37 ° C5% em uma incubadora de CO 2 O / N.
- Para experiências TIRFM, placacélulas nas tampas de vidro. Empregar tampas de vidro com 0,17 ± 0,005 milímetros de espessura e um índice de refração 1,5255 ± 0,00015. Antes de começar, prepare as lamelas de vidro como segue:
- SH-SY5Ytransfection por polietilenimina (PEI)
NOTA: Para visualizar vesículas sinápticas dinâmica, vetor pCB6 contendo synapto-pHluorin foi usado. O synapto-pHluorin foi gerada por fusão em quadro de uma variante da proteína fluorescente verde (GFP) e a proteína 16 de membrana vesicular sinaptobrevina 2. A construção tem sido extensivamente utilizada para investigar as propriedades dentro das vesículas sinápticas 9 neurónios sensíveis ao pH.- Antes de iniciar a transfecção, fazer 10 ml das seguintes soluções. Mantenha as soluções máxima de 1 mês.
- Adicione uma solução de 150 mM de NaCl. Ajustar a pH 5,5 com 0,01 N de HCl.
- Adicione uma solução de PEI a 10% de polietilenimina (PEI; linear de 25 kDa) em solução de NaCl 150 mM. O pH da solução sobe para 8,8. Ajustar o pH para 7,8 com 0,01 N de HCl.
- 24 h após o plaqueamento, o meio de remover e actualizar com 1,5 ml demeio completo. Manter as células a 37 ° C, numa atmosfera de 5% de CO2.
- De acordo com a cabine de segurança biológica de fluxo laminar, num tubo de microcentrífuga de 1,5 ml, adicionar 3 ug de ADN plasmídeo de 25 ul de solução de NaCl 150 mM e 100 ul de uma solução de PEI 3,5 centímetros por placa de Petri.
- Vortex durante 10 segundos, depois incubar a mistura de ADN / PEI durante 30 min à temperatura ambiente.
- Adicione cuidadosamente a mistura de ADN / PEI para a placa de Petri contendo lamelas com células e agitar suavemente para distribuir igualmente o reagente na placa de Petri.
- Após 4 h alterar a forma e incubar as células S / N a 37 ° C numa atmosfera de 5% de CO2. Realizar experimentos com imagens 24-48 horas após a transfecção.
- Antes de iniciar a transfecção, fazer 10 ml das seguintes soluções. Mantenha as soluções máxima de 1 mês.
Imagem 2. celular por reflexão interna total microscopia de fluorescência (TIRFM)
- Imagem set-up
- Realizar imagem TIRF com o set-up descrito na Figura 1. É composto por uma motorizada invertidamicroscópio (Figura 1, inserir A), a fonte de laser (Figura 1, inserir B) e o TIRF-deslizante (Figura 1, inserir C). Alcance iluminação TIRFM através de uma alta abertura numérica (NA 1,45 Alpha Plan-Fluar) óleo 100X, objetiva de imersão.
- Para iluminação TIRFM, empregar um multi-line (458/488/514 nm) 100 mW laser de argônio-ion. Usando um modo de fibra mono, introduzir a luz do laser polarizada linearmente para o caminho do feixe, através do controle deslizante TIRF. Insira o controle deslizante TIRF para o plano diafragma de campo luminoso do caminho do feixe de luz refletida.
- Para iluminação de campo grande, ligue o microscópio para uma lâmpada de mercúrio de curto-arco convencional HBO luz branca. Um duplo prisma-mantendo polarização no controle deslizante garante a combinação simultânea de iluminação TIRF e luz branca.
- Filtra-se a luz laser com um filtro de excitação (largura de banda 488/10 nm) montado sobre uma roda de filtro, introduzido no caminho do laser. Empregaruma alta velocidade, do obturador, controlado por software para permitir o controlo rápido da iluminação do laser. Para a análise pHluorin, montar uma banda passar 525/50 nm filtro de emissão. Capturar imagens digitais (512 x 512 pixels) em uma câmera CCD refrigeração rápida com o software ProPlus Imagem.
- Atingir iluminação TIRF (Figura 2)
- Ligue os lasers, o computador, a câmera, a roda de filtros, e os controladores do obturador; em seguida, aguarde 20 minutos antes do início do experimento, como os lasers precisa para se aquecer e estabilizar.
- Antes de imagem, faça o volume oportuno das seguintes soluções.
- Adicione 50 ml de solução de Krebs (KRH) em NaCl 125 mM, KCl 5 mM, MgSO4 1,2 mM, 1,2 mM de KH 2 PO 4, 25 mM de ácido 4- (2-hidroxietil) piperazina-1-etanossulfónico (HEPES) (tamponada a pH 7,4), 2 mM de CaCl 2, e 6 mM de glucose.
- Adicione 10 ml de solução de KCl-KRH (pH 7,4) com NaCl 80 mM, KCl 50 mM, MgSO4 1,2 mM, 1,2 mM de KH 2 PO 4, HEPES 25 mM (tamponado a pH 7,4), 2 mM de CaCl 2, e 6 mM de glucose.
- Remova a tampa de vidro com células transfectadas e inseri-lo na câmara de imagem adequada. Montar a câmara e adicionar 500 ul de solução de KRH no centro do copo.
- Adicione o óleo sobre o objetivo. Coloque a câmara de imagem na fase do microscópio e posicionar o objectivo sob a lamela de vidro. Posicione a tampa segura sobre a amostra.
- No modo de epifluorescência, concentrar-se na lamela (superfície superior) e escolha células transfectadas colocados no centro da câmara. Selecione as células cujo sinal fluorescente pode ser claramente gravada usando um tempo de exposição abaixo de 80 ms.
- Sob o controle do software, mude para iluminação TIRF no modo ao vivo.
- Para definir a configuração TIRF, verifique a posição da viga que emerge da objetiva, na capa da amostra (Figura 2B). Quando o feixe é posicionado no centro de tele lente objectiva (Figura 2A, esquerda), uma mancha é visível no centro da tampa TIRF amostra (Figura 2B, à esquerda) e a célula é criada uma imagem em modo de epifluorescência (vários planos focais, alta fluorescência de fundo; Figura 2C, esquerda) .
- Para atingir o ângulo crítico, mover o ponto focado na direcção Y (para a frente ou para trás; Figura 2B, ao centro) com o parafuso de ajustamento de ângulo sobre o cursor TIRF (Figura 1C). Quando o feixe converge sobre o plano da amostra com um ângulo maior que o ângulo crítico (Figura 2A, à direita), o local desaparece e uma fina linha recta, é evidente centrada no meio da tampa da amostra (Figura 2B, para a direita).
- Para ajustar o ângulo TIRF usar a amostra de células (Figura 2C). Assista a imagem de fluorescência no vídeo, nesta fase, uma imagem de epifluorescência-like é ainda visível. Delicadamente, mova o parafuso até TIRF concondição é alcançada: apenas um plano óptico da célula está em foco (ou seja, a membrana de plasma em contacto com a tampa-derrapante), isto resulta em uma imagem plana com alto contraste (Figura 2C, à direita).
- Imaging Amostra
- Defina o canal único experimento time-lapse. Para minimizar a fotodegradação, capturar a imagem usando baixo tempo de exposição e de alto ganho. Tempos de exposição apropriados são entre 40 - 80 ms. Adquirir imagens em 1 - frequência de amostragem de 2 Hz. Cinética de vesículas podem ser amostragem melhor apreciado com maior freqüência (10 Hz). O tempo normal de observação é geralmente 2 min.
- Adicionar 500 ul de células de solução e ficha KRH no modo TIRFM. Esta é a condição de repouso. Salve as imagens seqüenciais de tempo.
- Concentre-se na mesma célula e registro sob as mesmas condições de descanso (potência laser, tempo de exposição, número de quadro). Depois de cinco frames, adicionar 500 ml de solução de KCl-KRH e manter KCl na câmara.Esta é a condição estimulada; guardar as imagens seqüenciais de tempo.
Análise 3. Imagem e Processamento de Dados
NOTA: Para analisar imagens, macros têm sido desenvolvidos no laboratório, com base em funções existentes de software de análise de imagem; macros similares estão disponíveis on-line (URL fornecida na Tabela de Materiais e Equipamentos).
- A intensidade de fluorescência quantificação
- Usar uma macro "Sequência intensidade de fluorescência" para a quantificação da intensidade de fluorescência numa região de interesse (ROI) da imagem, ao longo do filme.
- Abra as imagens em tempo-seqüencial. Vá para o menu macro e selecione 'Sequence intensidade de fluorescência'. Na janela de "análise" aparece ", selecione o ROI".
- Escolha uma das ferramentas de seleção no menu para criar o ROI. Colocar 3 ROIs nas regiões da membrana celular, sem manchas (ROI fundo). Empregar this "ROI fundo" para avaliar a fotodegradação e para definir o limiar para a análise de eventos de fusão (Figura 3A).
- Fotodegradação correção e determinação do limiar (Figura 3B)
- Para avaliar a fotodegradação, abrir as linhas de fluorescência de intensidade "ROI de fundo", (Figura 3ba). Normalizar os valores da intensidade de fluorescência em cada quadro para o valor de intensidade inicial (F0) (F / F0) (Figura 3BB). Calcular a média dos valores.
- Realce os dados médios e criar um gráfico de linha usando as opções do menu gráfico.
- A partir do menu de análise de dados, selecione "linha de tendência" para abrir a caixa de diálogo análise trama. Selecione o tipo de regressão. Defina regressão "exponencial". Em seguida, selecione "equação de exibição no chart". Na janela de gráfico, a equação exponencial aparece e os valores dos parâmetros são atribuídos automaticamente, (Figura 3BC ).
- Aplicar a correcção exponencial para os valores de intensidade de cada quadro a seguir:
Fn (corrigida) = Fn / exp (-n * a)
Fn = intensidade de fluorescência experimental medido no quadro n; n = número de quadros; a = factor de branqueamento (constante que expressa a taxa de perda de intensidade devido à fotodegradação; Figura 3BD). - Para definir o limite, abrir um "ROI background" normalizada e corrigidos, calcular o sinal de fluorescência média e seu desvio padrão (SD). O valor médio mais 3 SD representa o limiar (Figura 3BE). Utilize este limiar para a análise de dados.
- Selecção de casos de fusão utilizando um procedimento semi-automático
- Abra as imagens em tempo-seqüencial com software de análise de imagem. Aplicar um filtro Gaussian para a seqüência de imagens ativa.
- Analisar as imagens usando a função "contar objetos" ou uma macro que permite a seleçãode um objeto cuja pixels têm intensidade média de fluorescência dentro de um intervalo definido. Definir a intensidade intervalo manualmente, usando a função de limiar (vá para o menu bar, definir um limiar medida → para destacar a área de interesse). Um limiar adequado é de 30% em relação ao sinal de fundo fluorescente local.
- Aplique uma macro "Filtros de objetos" para selecionar apenas os objetos que satisfaçam os seguintes critérios:
- Aplicar opção faixas (min e max inclusive) para o aspecto. Aspecto relata a relação entre o eixo maior e o eixo menor da elipse equivalente ao objecto. Aspect é sempre ≥1. Valores adequados são min = 1, max = 3.
- Aplicar gamas de diâmetro. Diâmetro relata o comprimento médio dos diâmetros medidos com intervalos de dois graus unir dois pontos de contorno e que passa através do centro de gravidade do objecto. Defina o intervalo em pixels (ou em um, se estiver usando um sistema calibrado).
- Defina o intervalo ideal em preliminexperimentos ary: selecionar manualmente os pontos de interesse e, em seguida medir o seu diâmetro usando a função de perfil trama.
- Selecione "objetos de exibição": objetos selecionados vão aparecer sobreposto à imagem TIRFM (Figura 4B).
- Inclua na análise apenas aqueles pontos que mostram uma curta (um a três quadros) aumento transitório na intensidade de fluorescência, imediatamente seguido por uma acentuada perda de sinal (manchas transientes). Empregar a seleção circular para criar um ROI diâmetro de aproximadamente um local radialmente em torno da vesícula / pontos selecionados (ROIs experimental). Execute esta etapa manualmente.
- Com os ROIs seleccionado, calcular a intensidade de fluorescência média de cada ROI ao longo do filme.
- A análise dos dados (Figura 3C-D)
- Exportar o curso a tempo das mudanças de fluorescência medidos em cada "ROI experimental" para uma folha de cálculo; (Figura 3DA). Normalizar o valor de intensidade em cada quadro com a intensidade de fluorescência inicial (F / F0), (Figura 3Db).
- Aplicar a correcção exponencial para os valores de intensidade de cada quadro como relatado no passo 3.2.4 (Figura 3Dc).
- Para calcular o número total de eventos de fusão (número máximo), o tempo de cada fusão ocorre (largura de pico) e a amplitude do pico fluorescente (altura do pico e AUC) aplicar funções lógicas usando pacotes de planilhas ou de matemática. Um exemplo de análise de eventos de fusão usando fórmulas lógicas é relatado na Figura 3DD e 3DE.
- Assuma que o aumento da intensidade de fluorescência que excede o limiar (intensidade média de fluorescência de fundo de 3 DP ±) como a fusão das vesículas com a membrana plasmática e o pico resultante como um evento de fusão.
- Calcule a largura do pico como diferença entre o último eo primeiro valor x de cada pico. Multiplique este valor para 1 / (frequência de amostragem). Considere isso um valoré o momento de fusão das vesículas e adesão na membrana plasmática antes vesícula re-acidificação e reciclagem (Figura 3DD).
- Calcule o AUC de células inteiras como uma soma de valores ao longo do limite. Considere esse valor como variação líquida fluorescente durante o tempo de gravação devido ao espontânea (repouso) ou evocado (estimulada) atividade sináptica.
- Calcula-se a altura do pico como a diferença entre o valor de y máxima de cada pico e o limiar. Considere esse valor como indicativo do tipo de fusão (fusão única vs. simultânea / sequencial ou transitória vs. fusão completa).
Resultados
Os procedimentos de imagem TIRF e análise de dados descritos foram concebidos para estudar vesículas dinâmica em sistemas celulares. Esta técnica pode ser usada para determinar os efeitos das moléculas de sinalização e as drogas em eventos de fusão e dinâmica das vesículas de neurotransmissores 17. Usando as proteínas da membrana de plasma marcadas com GFP, a análise TIRFM foi empregue para caracterizar o tráfico constitutiva de transportadores de glutamato GFP em células gliais e células epiteliais 18,19.
Para validar a estratégia procedimento de imagem e análise de dados relatados, eventos de fusão são registrados no basal e condições estimulada (despolarização induzida por potássio), em células de neuroblastoma SH-SY5Y transfectadas com synapto-pHluorin. (Vídeo 1, 2, respectivamente). Dois diferentes análises são realizadas: de célula completa (Figura 4) e análises simples de vesículas (Figura 5).
Análise de células inteiras meaSures o número total de eventos de fusão na célula e as resultantes alterações de fluorescência induzidas pela estimulação líquidos. Na Figura 4, as células transfectadas synapto-pHluorin são registados sob condições de repouso e de estimulação (KCl) estimuladas, utilizando o mesmo protocolo experimental (tempo de exposição, a potência do laser, etc). A Figura 4A mostra que synapto-pHluorin acumula no ponto lacrimal fluorescente espalhadas no membrana celular. Como descrito na literatura, um sinal fluorescente fraco está também presente na membrana de plasma 9; este sinal é útil para identificar as células a ser trabalhada. Na Figura 4B, pontos selecionados pelo procedimento automático descrito no documento (seção 3.3) são sobrepostos à imagem TIRFM relatado na Figura 4A. Figura 4C mostra os perfis de intensidade de fluorescência normalizados de pontos selecionados em condições de repouso. Estes perfis de revelar a presença dos picos individuais dos semelhante fluorescente intensity que saem em vários momentos durante a gravação e provavelmente correspondem a vesículas que, ocasionalmente, fundem com a membrana. A Figura 4D mostra os efeitos de estimulação de KCl. Como esperado, a despolarização com KCl 25 mM provoca uma resposta pronta e vários pontos lacrimais fluorescentes muito brilhantes aparecem na membrana celular (Video 2). Estes pontos lacrimais correspondem ao pool "prontamente libertável 'de vesículas sinápticas presentes debaixo da membrana plasmática. O curso do tempo da análise de alterações de fluorescência medidos em correspondência dos pontos individuais indica a presença de picos, da intensidade de fluorescência variável, que aparecer repentinamente após aplicação do estímulo de secreção (Figura 4D e 4F). Os resultados das análises de células inteiras durante o tempo de gravação são relatados na Figura 4E-H. Estimulação KCl provoca um rápido aumento marcado no número de eventos de fusão (2,5 vezes de aumento sobre condições de repouso) (Figura 4E-F) e nos resultantes mudanças de intensidade de fluorescência (9,3 vezes de aumento sobre condições de repouso) (Figura 4G-H), indicando assim liberação maciça neurotransmissor.
Análise de um único pico permite a caracterização de eventos de fusão único (Figura 5). A Figura 5A mostra o sequencial imagens de um representante "ROI experimental", gravado em condições de repouso. O especial destaca um synapto-pHluorin marcado vesícula que se funde com a membrana sob a zona TIRF. Após dois quadros, o sinal fluorescente desaparece, indicando provável recuperação das vesículas e re-acidificação. O perfil de fluorescência normalizada da região de interesse (Figura 5B) mede um aumento no sinal de fluorescência em correspondência com o aparecimento local na zona TIRF. Por outro lado, a fluorescência regressa ao valor basal após desaparecimento local (pico únicolargura média 1,91 ± 0,32 seg; altura de pico média 0,042 ± 0,005 intensidade de fluorescência normalizado). Figura 5C e 5D mostram as imagens seqüenciais de um "ROI experimental", gravado sob estímulo KCl e do perfil de intensidade de fluorescência normalizado correspondente. Notar o aumento na circulação de vesículas dentro e para fora da zona de KCl TIRF após despolarização.
40 eventos de fusão são seleccionados e analisados em condições de repouso e estimuladas. Os seguintes parâmetros são medidos: média AUC pico, largura e altura de pico. Width Peak especifica o tempo de fusão das vesículas, apego e endocitose antes de voltar a acidificação e reciclagem, Figura 5G. Altura de pico mede as mudanças na intensidade de fluorescência induzidas pela fusão das vesículas, Figura 5F. Alterações nestes parâmetros são indicativos de diferentes mecanismos de exocitose. Análise de um único pico revela que modifica a despolarização KClModo de fusão das vesículas com a membrana plasmática. De fato, o aumento da área de pico média (3,8 ± 0,2 vezes de aumento sobre condições de repouso, P <0,01 pelo teste t pareado, Figura 5E), altura do pico (2,75 ± 0,03 vezes maior, P <0,01 pelo teste t pareado, Figura 5F) e largura (2,6 ± 0,5 vezes de aumento, P <0,05 pelo teste t emparelhado. A Figura 5G) são detectados sob condições estimuladas. Várias explicações podem prever-se para estes resultados. Uma possibilidade é que KCl despolarização provoca a fusão simultânea e / ou sequencial de vesículas numa região restrita das células. Uma explicação alternativa é que forte despolarização favorece fusão completa contra fusão transitória. Em condições basais, o mecanismo predominante é uma fusão transitória: a fusão formas de poros, o pH nos aumentos de vesículas e o sinal de fluorescência é apresentada, mas a poro imediatamente fecha, permitindo assim uma rápida re-acidificação e reciclagem. Sobcondições estimuladas, a vesícula funde completamente com a membrana plasmática, a altura do pico e aumento da largura de recaptura de componentes das vesículas de membrana, re-acidificação e reciclagem podem exigir um período mais longo. Resultado semelhante foi recentemente obtida analisando-sináptica como microvesículas exocitose em endócrinas β células-20.
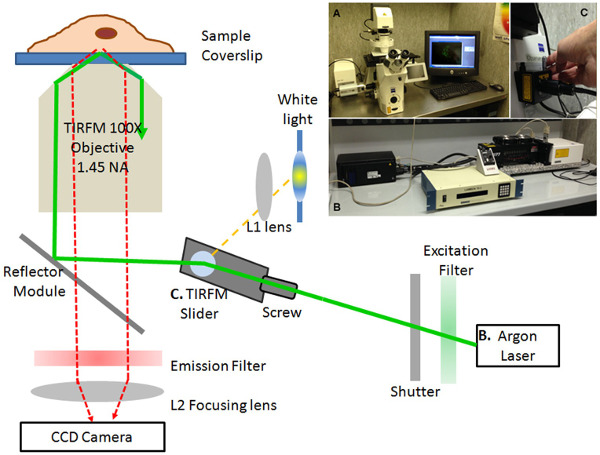
Figura 1. TIRF microscópio configurar. Representação esquemática e imagem (no detalhe) do sistema TIRF microscópio. A configuração compreende o Axio Observer Z1 microscópio invertido motorizado (A), um multi-linha de 100 mW de laser de argônio-ion (B) e uma TIRF-slider (C). A luz laser (linha verde) e de luz branca (linha amarela) são mostrados. As células são fotografada usando uma objetiva de imersão de 100 × óleo. As imagens digitais são capturadas em um RetigaSRV arrefecido câmera CCD Rápido. A refmódulo lector, a emissão (488/10 nm) ea excitação (passagem de banda nm 525/50) filtros, o colimador (L1) e focagem (L2) lente são indicadas. Por favor, clique aqui para ver uma versão maior desta figura.
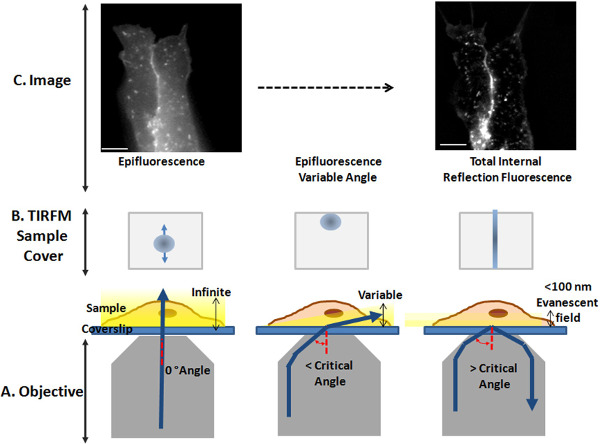
Figura 2. Obtendo configuração TIRFM. (A) dos desenhos animados esquemático ilustrando o objetivo, o cover-slip, a amostra ea posição do feixe de laser (linha azul). Esquerda, o feixe de excitação viaja diretamente através da interface do cover-slip-amostra . A amostra é animado como no modo de epifluorescência. Center, as formas de feixes de excitação da amostra com um ângulo de incidência menor que o ângulo crítico, a luz ilumina a amostra com um ângulo variável. Direito, o feixe de excitação faz INCIDent ângulo superior ao ângulo crítico, a luz é reflectida de volta para completado a lente objectiva, e um campo evanescente propaga na amostra. (B) dos desenhos que mostra a tampa da amostra e a posição do feixe de excitação (azul círculo), que emerge para fora do objectivo, durante a transição a partir de epifluorescência (à esquerda) para a iluminação TIRF (à direita). (C) epifluorescência (esquerda) e TIRFM (à direita) imagens de synapto-pHluorin fluorescência em uma célula SH-SY5Y ao vivo. Barra de escala:. 10 mm Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3. processamento e análise de dados. (A) imagem TIRFM de synapto-pHluorin fluorescência em um live SH-SYCélula 5Y. O quadrado verde indica um representante "ROI background". Barra de escala 10? M. (B) o fluxo de trabalho proposto para o fundo ROI. De cima para baixo:.... Um curso de tempo de mudanças na intensidade de fluorescência medidos no fundo do ROI; b normalização de alterações de fluorescência para o valor inicial da fluorescência (F / F0); c pedido de regressão exponencial; d correcção para a fotodegradação, e. avaliação limiar (quadrado cinza transparente). (C) TIRFM imagem de synapto-pHluorin fluorescência em uma célula SH-SY5Y ao vivo. O quadrado branco indica um representante "ROI experimental". Barra de escala 10? M. (D) o fluxo de trabalho proposto para ROI experimental. De cima para baixo:.. Um curso de tempo das alterações na intensidade da fluorescência; b normalização dos dados para o valor inicial da fluorescência (F / F0); c. correção fotodegradação;. de aplicação de funções lógicas para detectar número de pico, AUC, largura e altura. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 4. Análise de célula inteira. (A) imagem TIRFM de synapto-pHluorin fluorescência em uma célula SH-SY5Y ao vivo. As células são registrados em repouso e estimulado (25 mM de aplicação KCl) condições (amostrados a 1 Hz). Barra de escala: 10 ^ m. (B) os pontos identificados pelo procedimento automático são mostrados sobrepostos (de cor verde) a imagem em TIRFM. (C) perfis normalizados de intensidade de fluorescência (F / F0) de pontos selecionados pelo procedimento automático em toda a célula em condições de repouso. (D) Normalizperfis ed intensidade de fluorescência (F / F0) de pontos selecionados em condições estimulada. O bar ao longo dos traços indica aplicação KCl. (EH) Número de eventos e mudanças de intensidade de fluorescência registrados em toda a célula sob repouso (azul) e estimuladas (vermelho) condições. (E) Os histogramas mostrando o número total de eventos de fusão gravados na célula. (F) Distribuição temporal dos eventos de fusão. (L) Os histogramas representam mudanças na intensidade de fluorescência pHluorin que ocorrem em toda a-célula (AUC Total). (H) curvas que mostram a cumulativos pHluorin mudanças de intensidade de fluorescência em função do tempo. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 5. Único de vesículas de análise. (A) células SH-SY5Y expressam synapto-pHluorin são gravadas em 1 Hz, em condições de repouso. TIRFM Representante imagens sequenciais (a cada 2 segundos) de um ROI mostrando um synapto-pHluorin marcado vesícula. ROI = 40 x 35 pixels. (B) perfil de fluorescência Normalizada (F / F0) da ROI mostrado em A. O asterisco preto indica um evento de fusão, a linha limite é mostrado. (C) A mesma célula é gravado em condições estimuladas (KCl 25 mM), TIRFM representante imagens seqüenciais de um ROI são mostrados. Aplicação de KCl é indicado pelo asterisco amarelo. (D) O perfil de fluorescência normalizada da região mostrada em C destaca a chegada (entrada) e desaparecimento (para fora) de vesículas. Asteriscos pretos indicam eventos de fusão, é mostrada a linha limite. (EG) propriedades de eventos isolados de vesículas registrados em repouso (barra azul) e estimuladas ( bar) condições vermelhas. n = 40 eventos de fusão. (E) Esquerda, área de pico (AUC) é indicado pela luz azul, para a direita, histogramas das áreas médias de pico; ** P <0,01. (F) Esquerda, altura do pico (h) é indicado por uma seta de duas pontas; center, histogramas da altura média de pico; ** P <0,01; à direita, altura do pico especifica o mecanismo de fusão. A estrela no cartoon indica synapto-pHluorin. (G) Esquerda, largura do pico é indicado por uma seta de duas pontas; center, histogramas da largura média de pico; * P <0,05; direita, largura do pico especifica o tempo de vesícula exocitose, apego e endocitose. A cor da estrela fica verde quando a fluorescência synapto-pHluorin é visível e cinza quando ele é desligado. Por favor, clique aqui para ver uma versão maior desta figura.
Vídeo 2. células SH-SY5Y expressam synapto-pHluorin são registrados sob condições estimuladas (amostrados a 1 Hz). KCl perfusão é indicado. Por favor clique aqui para ver este vídeo.
Discussão
Este trabalho apresenta um protocolo para a imagem e analisar vesículas dinâmica em células secretoras, usando vetores codificados em cDNA fluorescentes e TIRFM. Os principais elementos de uma imagem com qualidade por TIRFM são a seleção do modelo de celular e transfecção de células com indicadores ópticos geneticamente codificados de liberação da vesícula e reciclagem.
TIRFM é idealmente adequado para as células em crescimento aderente a uma cobertura de vidro planas e suficientemente estável para permitir a visualização de membranas e eventos de fusão. Vesículas deveriam idealmente ser disperso na célula para que o seu tráfico, fusion e endocitose podem ser visualizados e quantificados a nível single-vesícula. Infelizmente, os neurônios não atender a esses critérios: eles têm formas irregulares, neurites que atravessam frequentemente uns sobre os outros, e vesículas de fusão é predominantemente concentrada em pequenas regiões (zonas activas). Para estas regiões é muito difícil para estudar a dinâmica das vesículas por TIRFM em culturas primárias de neurónios.
Nós demonstramos pela primeira vez que a linha de células de neuroblastoma humano SH-SY5Y pode ser um modelo alternativo valioso para investigar a libertação de neurotransmissores sob condições de repouso e estimuladas, por TIRFM. Esta linha celular tem um fenótipo neuronal com um corpo celular e processos finos, possui enzimas para a síntese de neurotransmissores, proteínas da maquinaria sináptica, e uma secreção regulada. Além disso, pode incluir-se em um fenótipo neuronal funcionalmente maduros na presença de vários agentes, incluindo o ácido retinóico, ésteres de forbol, e dibutiril AMP cíclico 21,22. As células são suficientemente plana para permitir a visualização das membranas estáveis e eventos de fusão em modo TIRFM (particularmente no corpo celular) e vesículas são relativamente dispersos. Finalmente, as células podem ser facilmente transfectadas com as proteínas marcadas com GFP codificando plasmídeo ou etiquetas proteicas sensíveis ao pH utilizando diferentes reagentes de transfecção. Neste protocolo, o PEI foi usado para transfectaras células. Este reagente constitui a base da maioria dos agentes de transfecção disponíveis comercialmente e apenas actua como um custo muito eficaz vector de transfecção. A eficiência de transfecção de 20% espera-se utilizando o protocolo relatado acima, que é adequada para a imagiologia de uma única célula.Embora a disponibilidade de diferentes reagentes e procedimentos de transfecção faz transfecção quase um procedimento padrão em SH-SY5Y e até mesmo em culturas neuronais primários, cuidados devem ser tomados durante a gravação, análise e interpretação de dados TIRFM. TIRFM facilita a recolha de informações relativas aos processos que ocorrem na ou perto da membrana em células vivas e permite a análise de eventos moleculares individuais através de detecção de alterações no sinal fluorescente derivados de proteínas marcadas que se movem dentro ou para fora da evanescente arquivado. No entanto, vários fatores podem modificar os sinais fluorescentes nesta zona, sem que isso implique necessariamente exo / eventos endocíticas, e isso deve ser tomarn em consideração durante a gravação e análise de dados. Entre elas estão as alterações morfológicas no celular, em especial os relativos ao plano em foco sob o campo e fluoróforo modificações evanescentes durante a gravação.
Alterações morfológicas
A alta resolução da técnica TIRF baseia-se na excitação de fluoróforos dentro do campo evanescente, com a profundidade de 100 nm a partir da interface de vidro 11. Esta é uma zona muito fina e modificações morfológicas imperceptíveis são esperados para alterar o plano de células em foco. Isso se aplica especialmente para os neurônios e células que apresentam vários processos e exibem ruffling pronunciado. Nestas células, a área da membrana em contacto com a lamela de durante a gravação é irregular e pode mudar rapidamente, causando assim uma avaliação imprecisa de exocitose. Por este motivo, sempre que possível, é importante escolher o modelo celular de investigação. Para limitar moveme célulants pode ser útil para revestimento de vidro com tampas-proteínas da matriz extracelular ou poli-L-lisina. No entanto, é preciso ter em mente que estes substratos podem modificar o comportamento das células e vesículas dinâmica.
Outras fontes possíveis de modificações morfológicas durante a gravação são a estimulação das células, além de soluções e mudanças de temperatura. Estímulos capaz de induzir libertação maciça de vesículas (ou seja, KCl despolarização) muitas vezes causar encolhimento da célula que, obviamente, modifica a superfície da célula sob a zona TIRF. Por conseguinte, é importante seleccionar com precisão o tempo tipo, concentração, e aplicação do estímulo em experiências preliminares.
A simples introdução das soluções para o banho com uma pipeta, independentemente da composição, pode causar modificação da morfologia celular por tensão de corte. Para resolver este artefato, adicionar meio de preferência utilizando um sistema de perfusão, possivelmente ligado a uma bomba de vácuo para reduzir o ruído.
morfologia e função celular são extremamente sensíveis às variações de temperatura, devido ao ambiente experimental, além médio e iluminação do laser intenso. O controle de temperatura em imagens ao vivo de células normalmente é conseguido usando incubadoras; grandes (câmara) incubadoras pequeno (fase-top) e estão disponíveis. Os primeiros são particularmente úteis e bem adaptadas para a observação de culturas de células, estas garantem uma temperatura constante de todos os dispositivos no interior da incubadora, incluindo uma grande parte do microscópio, minimizando, assim, o desvio de focagem, resultante do gradiente de temperatura. Na ausência de um sistema de regulação da temperatura, que é crítico para equilibrar as células, câmara de imagem de células vivas, e as soluções para a TA e para evitar experiências de imagiologia de longo prazo.
Fluoróforo
Alteração dos sinais fluorescentes podem também ser devido a modificação do fluoróforo durante a gravação. O mais importante é a fotodegradação 23. Fotobranqueamento é a decomposição induzida por fotões de um fluoróforo. É geralmente provoca uma perda permanente de fluorescência e escurecimento da amostra observada ao longo do tempo. Em TIRFM, apenas fluoróforos fechada para a origem do campo evanescente pode ser Foto-descoloração e as proteínas da membrana são GFP marcada com Foto-descoloração porque residem neste domínio. A prevenção do desvanecimento da intensidade de emissão de fluorescência é muito importante para se obter imagens de alta qualidade, e obrigatória para a microscopia de fluorescência quantitativa. Com uma aproximação razoável, para uma dada molécula em um ambiente constante, fotobranqueamento depende do tempo e o ciclo de exposição à fonte de excitação. Em muitos casos, a fotodegradação segue uma simples função de decaimento exponencial, o que torna a sua apreciação e sua correção mais fácil através da realização de gravações de controle 23. Fórmulas diferentes de correção / macros estão disponíveis on-line (ver Tabela de materiais e equipamentos); no protocolo de um exponenti simplesfunção ai foi usado.
Existem várias estratégias para superar a fotodegradação. Uma estratégia é boa para evitar a fotodegradação na fonte, por exemplo, utilizando fluoróforos com elevada fotoestabilidade. Infelizmente, neste momento, a escolha de sondas codificada em DNA é ainda limitada. Neste caso, a perda de actividade provocada por fotobranqueamento pode ser minimizada durante a aquisição de imagem e optimiza o tempo-espaço de exposição à luz, a energia dos fotões da luz de entrada e a frequência de amostragem.
Quando usando sondas sensíveis ao pH, uma fonte suplementar de modificação durante a gravação fluoróforo é a mudança de pH no meio. O volume de líquido da câmara de gravação é geralmente a aplicação da droga muito baixa e, actividade celular e metabolismo pode modificar o pH do meio, em particular o pequeno volume entre a célula e a superfície da lamela. Este, por sua vez, altera o sinal fluorescente pHluorin, causando assim acima / abaixo-estimativa da vesícula relocação. Por exemplo, estímulos fortes podem levar a uma acidificação dependente do cálcio no citosol de alcalinização e espelhado no espaço extracelular, resultando assim num aumento exagerado no sinal fluorescente 24.
Para evitar esse problema, use sempre soluções tamponadas e monitorar possíveis modificações de pH introduzidas pelo protocolo estabelecido, em experimentos preliminares. Para obter uma estimativa mais precisa de libertação evocada vesícula, quando a análise de dados, monitorizar o sinal de fluorescência numa região de superfície da célula, sem eventos de fusão, e utilizar modificações do sinal fluorescente dentro desta região, como factor de ajustamento.
Em conclusão, foi descrito um método para monitorizar e analisar a fusão das vesículas e dinâmica. Esta técnica pode ser utilizada em diferentes tipos de células (neurónios e células endócrinas) para visualizar e dissecar os vários passos de exo / endocitose, para revelar o papel das proteínas e os seus pathogenic mutantes na regulação da dinâmica de vesículas e para desvendar os mecanismos de ação de drogas que alvejam exocitose constitutiva e regulamentado.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Os autores gostariam de agradecer a Università degli Studi di Milano para apoio a Eliana Di Cairano (bolsa de pós-doutoramento) e Stefania Moretti (Ph.D. comunhão). Este trabalho foi apoiado pela Research University Programa PUR a CP
Gostaríamos de agradecer ao Prof. Jeremy M. Henley, School of Biochemistry, University of Bristol, Reino Unido, para o pHluorin construir e Dr. Francesco Dotti para assistência na análise de dados, e Silvia Marsicano para assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Axio Observer Z1 |  Zeiss Zeiss | 491912-9850-000 | inverted microscope |
| Multiline Argon Laser Lasos 77 |  Lasos Lasos | 00000-1312-752 | multi-line (458/488/514 nm), 100 mW argon-ion laser |
| Laser TIRF slider |  Zeiss Zeiss | 423681-9901-000 | |
| 100X Objective |  Zeiss Zeiss | 421190-9900-000 | Oil, NA 1.45 Alpha-Plan |
| CCD Camera RetigaSRV Fast 1394 |  QImaging QImaging | ||
| LAMBDA 10-3 optical filter changer with SmartShutter |  Sutter Instrument Company Sutter Instrument Company | ||
| Software | |||
| Image ProPlus 6.3 Software |  Media Cybernetics Media Cybernetics | spot selection, ROI selection, fluorescence intensity determination | |
| Excel |  Microsoft Microsoft | photobleaching correction, whole-cell and single-vesicle analyses | |
| GraphPad Prism 4.00 |  GraphPad Software, Inc. GraphPad Software, Inc. | statistical analysis | |
Referências
- Sudhof, T. C. The synaptic vesicle cycle. Annu. Rev. Neurosci. 27, 509-547 (1146).
- Denk, W., Svoboda, K. Photon upmanship: why multiphoton imaging is more than a gimmick. Neuron. 18 (3), 351-357 (1997).
- Helmchen, F., Svoboda, K., Denk, W., Tank, D. W. In vivo dendritic calcium dynamics in deep-layer cortical pyramidal neurons. Nat Neurosci. 2 (11), 989-996 (1999).
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Matz, M. V., et al. Fluorescent proteins from non bioluminescent Anthozoa species. Nat Biotechnol. 17 (10), 969-9673 (1999).
- Ribchester, R. R., Mao, F., Betz, W. J. Optical measurements of activity-dependent membrane recycling in motor nerve terminals of mammalian skeletal muscle. Proc Biol Sci. 255 (1342), 61-66 (1994).
- Polo-Parada, L., Bose, C. M., Landmesser, L. T. Alterations in transmission, vesicle dynamics, and transmitter release machinery at NCAM-deficient neuromuscular junctions. Neuron. 32 (5), 815-828 (2001).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nat Protoc. 1 (6), 2916-2921 (2006).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Axelrod, D. Total internal reflection fluorescence microscopy. Methods Cell. Biol. 89, 169-221 (2008).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys. J. 79, 2199-2208 (2000).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Wyatt, R. M. Balice-Gordon R.J. Heterogeneity in Synaptic Vesicle Release at Neuromuscular Synapses of Mice Expressing SynaptopHluorin. J. Neurosci. 28 (1), 325-335 (2008).
- Tsuboi, T., Rutter, G. A. Multiple forms of "kiss-and-run" exocytosis revealed by evanescent wave microscopy. Curr Biol. 13, 563-567 (2003).
- Miloso, M., et al. Retinoic Acid-Induced Neuritogenesis of Human Neuroblastoma SH-SY5Y Cells Is ERK Independent and PKC Dependent. J. Neurosci. Res. 75, 241-252 (2004).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent Membrane Drift Recruits AMPA Receptors to Dendritic Spines. J Biol Chem. 284 (18), 12491-12503 (2009).
- Treccani, G., et al. Stress and corticosterone rapidly increase the readily releasable pool of glutamate vesicles in synaptic terminals of prefrontal and frontal cortex. Mol Psychiatry. 19 (4), 433-443 (1038).
- D'Amico, A., et al. The surface density of the glutamate transporter EAAC1 is controlled by interactions with PDZK1 and AP2 adaptor complexes. Traffic. 11 (11), 1455-1470 (2010).
- Perego, C., Di Cairano, E. S., Ballabio, M., Magnaghi, V. Neurosteroid allopregnanolone regulates EAAC1-mediated glutamate uptake and triggers actin changes in Schwann cells. J Cell Physiol. 227 (4), 1740-1751 (2012).
- Bergeron, A., Pucci, L., Bezzi, P., Regazzi, R. Analysis of synaptic-like microvesicles exocytosis of B-cells using a live imaging technique. PlosOne. 9, e87758 (2014).
- Encinas, M., et al. Sequential treatment of SH-Sy5Y cells with retinoic acid and brain-derived neurotrophic factor gives rise to fully differentiated, neutrophic factor-dependent, human neuron-like cells. J. Neurochem. 75 (3), 991-1003 (2000).
- Kume, T., et al. Dibutyryl cyclic AMP induces differentiation of human neuroblastoma SH-SY5Y cells into a noradrenergic phenotype. Neurosci Lett. 443 (3), 199-203 (2008).
- Diaspro, A., Chirico, G., Usai, C., Ramoino, P., Dobrucki, J., Pawley, J. B. Photobleaching. Handbook of Biological Confocal Microscopy. , 690-699 (2006).
- Rossano, A. J., Chouhan, A. K., Macleod, G. M. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados