Method Article
TIRFM과 pH 민감성 GFP - 프로브는 SH-SY5Y 신경 모세포종 세포에서 신경 전달 물질 소포 역학을 평가하기 : 세포 이미징 및 데이터 분석
요약
This paper provides a method for investigating neurotransmitter vesicle dynamics in neuroblastoma cells, using a synaptobrevin2-pHluorin construct and Total Internal Reflection Fluorescence Microscopy. The strategy developed for image processing and data analysis is also reported.
초록
시냅스 소포가 융합 및 검색의 동적 사이클을 화학적 시냅스에서 신경 전달 물질을 방출. 실시간 시냅스 활성을 모니터링하고 단일 소포 수준에서 엑소 엔도 시토 시스의 여러 단계를 해부하면 건강과 질환에서 시냅스 기능을 이해하는데 중요하다.
직접 시냅스 소포 및 총 내부 반사 형광 현미경 (TIRFM)을 대상으로 pH 민감성 프로브 소포 역학을 수행하는 데 필요한 공간 - 시간 해상도를 제공을 유전자 인코딩. 내부 전반사에 의해 생성 산장은 엑소 엔도 시토 시스의 과정이 일어나는 정확한 위치, 세포가 접착 된 커버 유리 위에 박층 (<150 ㎚)에 배치 된 형광체를 여기 할 수있다. 얻어진 높은 콘트라스트 이미지는 이상적으로 추적 소포 융합 이벤트의 정량 분석에 적합하다.
이 프로토콜에서는, SH-SY5Y 인간의 Neuroblastoma 세포 때문에 평평한 표면, TIRFM에 의해 단일 소포 수준에서 신경 전달 물질 방출을 연구하기위한 귀중한 모델과 분산 된 소포의 존재로 제안된다. 부착 세포로 SH-SY5Y 성장과 synapto-pHluorin로 형질 감염에 대한 방법은 TIRFM 및 이미징을 수행 할 수있는 기술뿐만 아니라, 제공됩니다. 마지막으로, 개수를 선택하고, 전체 셀 및 단일 소포 수준에서 융합 이벤트를 분석하는 것을 목표로 전략을 제시한다.
이미지를 만드는 절차 및 데이터 분석 방법의 유효성을 검사하기 위해, pHluorin 태그가 소포의 역학은 휴식에서 분석하고 조건 (칼륨 농도 탈분극) 자극. 막 탈분극 융합 이벤트의 빈도를 증가시키고, 전체 셀 내에 기록 순 형광 신호의 병렬 인상을 야기한다. 단일 소포 분석 융합 이벤트 동작 (증가 피크의 높이와 폭)의 수정을 보여준다. 이 자료는 제 제안칼륨 탈분극에 엄청난 신경 전달 물질 방출을 유도뿐만 아니라 소포 융합 및 재활용의 메커니즘을 수정 아닙니다.
적절한 형광 프로브,이 기술은 항시 분비 자극 메커니즘을 해부 다른 셀룰러 시스템들에서 사용될 수있다.
서문
신경 세포 사이의 화학 시냅스 전달은 신경 시스템의 통신의 주요 메커니즘이다. 이 시냅스 사이트에서 소포 융합 및 검색의 동적 사이클을 통해 신경 전달 물질의 방출에 의존한다. 소포 역학에 관여하는 단백질의 대부분은 확인되었다; 그러나, 현상에 특정 공헌 1 명확히 남아있다.
이해 부분적 엑소 / 엔도 사이토 시스에 가장 널리 사용되는 분석은 항상 가장 적합하지 않은 사실에 의해 제한된다. 여러 소포 융합 관련 연구와 역학 전기 생리 기술에 의존하고있다. 이 기술은 최적의 시간 해상도를 제공하며 세포막에 소포 초기 융합을 조사하는 우수하지만 연접 기능을 지원하는 기본 분자 많은 이벤트를 감지 할 수있다. 전자 현미경은, 다른 측면에서, 최고의 morphologica을 제공합니다시료를 분석하기 위해 고정되어야하기 때문에 각 스텝 단수이지만 이벤트의 동적 양태의 설명은 L, 포착 할 수 없다.
형광 분자 프로브 개발 4-6의 발전과 함께 새로운 광 기록 기술 2,3의 출현, 따라서 시냅스 구조 및 기능에 대한 정보를 제공하는 새로운 수준, 생균의 exocytic 프로세스 시각화 할 수있다.
초기 연구 악용 활동에 의존 스티 릴 염료 (FM1 - 43 및 관련 유기 염료) 7,8. 최첨단 영상 기술은 내강 소포 단백질 9 닿는 녹색 형광 단백질 (GFP) (pHluorin)의 pH 민감성 변종을 사용합니다. 이 프로브는 일반적으로 낮기 때문에 내강의 pH의 소포에 존재하는 경우 꺼져 있습니다. 세포막과 융합 후, 소포 내부는 중성 세포 외 공간에 노출된다 산도 갑자기, 증가 pHluorin의 양성자에 의존 담금질을 완화하고, 형광 신호가 빠르게 나타납니다. pHluorin 변화 형광 증가를 모니터링함으로써, 융합 이벤트보다 빠르기 때문, 막과 소포 융합 측정하고 분석 할 수있다. 표면 pHluorin 태깅 분자 endocytosed되므로 형광 신호는 이후, 따라서 동일한 구조가 소포 9 재활용을 모니터링하도록 또한 사용될 수있다, 기저 레벨로 되돌아 간다.
베지 태그 pH의 센서 만 실제로 세포막과 융합 그 소포 시각화을 보장하면서, 높은 시공간 해상도 이미징은 상세 엑소 / 이입 과정에 관련된 단계를 설명하는 데 필요하다. 필요한 시공간 해상도를 제공하는 광학 기술은 전반사 형광 현미경 (TIRFM), 형광 현미경 (10)의 애플리케이션이다.
"> 내부 전반사가 광 통로가 임계각보다 큰 입사각으로 유리 커버 슬립에 도달 유리 커버 슬립 샘플. 사이의 계면에서 발생 된 여기 광은 샘플에 송신되지만되지 않는다 완전히 다시 반영. 이러한 조건, 계면에서의 에바 네 센트 광 웨이브 형태 및 아래 산장의 강도의 침투 깊이 (계면으로부터의 거리와 함께 지수 함수 적으로 감소있다. 이하의 광학 밀도 (샘플)과 매질에서 전파 멀리 경계로부터 사람들은 GFP-제물로 형질 세포에서.없는 동안 약 100㎚) 커버 슬립에 가장 가까운 근방에만 형광체가 여기 될 수 있으며, 이러한 깊이는 세포막에 발현 된 단백질 또는 소포 성 구조에 대응 셀 내부에 형광 물질이 여기 될 수 없기 때문에, 배경 형광을 최소화하고, 화상이 매우 높은 신호 / 배경 쥐된다. 그것에 접근IO (11)을 형성한다.몇 가지 특성은 소포 역학 모니터링을위한 선택의 TIRFM 기술을합니다. 완벽한 콘트라스트 및 높은 신호 대 잡음비는 단일 소체로부터 도출 매우 낮은 신호들의 검출을 허용한다. 각 프레임에 칩 기반 이미지 획득은 매우 동적 인 프로세스를 검출 할 필요 시간 해상도를 제공한다. 마지막으로, 샘플의 다른면에서 빛 세포의 최소한의 노출은 강하게 광독성을 줄이고 오래 지속 시간 경과 기록 (12)을 수 있습니다.
데이터 분석이 기술의 가장 도전적이고 중요한 측면 남아있다. 소포 융합을 모니터링하는 간단한 방법은 13 시간 동안, 세포 표면에 형광 리포터 단백질의 축적을 측정하는 것이다. 물론 융합 증가 순 형광 신호가 증가함에. 그러나,이 방법은 특히 큰 셀에서 및 휴식 조건에서, 공정을 과소 수도엔도 시토 시스와 광표백 프로세스 인해 엑소 사이토 시스 소포로 형광 강도의 증가를 상쇄하기 때문이다. 다른 방법은 각각의 단일 융합 이벤트 (14)을 따르는 것입니다. 이 후자의 방법은 매우 민감하고 융합 메커니즘에 대한 중요한 세부 사항을 공개 할 수 있습니다. 완전히 자동화 된 절차는 소포를 따라 자신의 형광 신호의 변동을 등록 항상 사용할 수 없기 때문에 그러나, 하나의 이벤트의 수동 선택이 필요합니다. 소포 역학 관측은 높은 주파수에서 샘플링 세포가 필요합니다. 이것은 거의 직접 분석 할 수없는 대량의 데이터를 생성한다.
이 논문의 제안은 모두, 실험실에서 개발 된 절차는 데이터를 분석하기 위해 SH-5YSY 신경 아세포종 세포주에서 기저 및 자극을 신경 전달 물질 방출을 모니터링 TIRFM 영상 법을 최적화하고 설명하는 단계별이고 전체 셀 및 단일 소포 수준.
프로토콜
1. 세포 배양 및 형질
- SH-SY5Y 세포 배양
주 : 실험 SY5Y 인간 신경 아세포종 SH- (ATCC # CRL-2266) (15)를 사용하여 수행되었다. SH-SY5Y 세포는 부동 클러스터 및 부착 세포의 혼합물로서 성장한다. 단단히 TIRFM 위해 매우 중요 유리 커버에 부착 성장 세포를 가지고 프로토콜 (셀 밀도, 분할 비율, 등.)에보고 된 지시 사항을 따르십시오.- 시작하기 전에, 층류 생물 안전성 캐비닛 하에서 멸균 인산 완충 식염수 (PBS)와 배양 배지의 부피를 좋은 기회.
- 150 mM의 NaCl을, 24 mM의 인산염 완충액, pH가 7.4의 농도로 PBS 50 ㎖를 확인합니다. 솔루션을 필터링합니다.
- 고 글루코스, 10 % 열 - 불 활성화 된 소 태아 혈청 (FBS), 페니실린 (100 U / ㎖), 스트렙토 마이신 (100 ㎍ / ㎖), L- 글루타민 (가진 둘 베코 변성 이글 배지 (DMEM)에서 세포 배지 50 mL로 2 mM)을하고피루브산 나트륨 (1 mM)을. 솔루션을 필터링합니다.
- 완전한 성장 배지를 제거하고 PBS의 3 ㎖로 세포를 씻어.
- 37 ° C에서 5 분 (6cm 페트리 접시)에 0.05 % 트립신 에틸렌 디아민 테트라 아세트산 2 ㎖ (EDTA)와 세포를 품어 5 % CO 2를 피펫을 사용하여 세포를 분리.
- 2 ml의 DMEM을 첨가함으로써 트립신을 비활성화하고, 5 분 동안 300 XG에서 원심 분리하여 세포를 수집한다.
- 단일 세포 현탁액으로 세포를 분산시키는 것이 충분히 아래로, 상층 액을 제거 펠릿 DMEM 1 ㎖를 추가하고, 용액을 피펫.
- 전체 매체의 3 ㎖를 포함하는 새로운 6cm 직경 페트리 접시에 4 : 그들에게 일을 분할합니다. 5 % CO 2 배양기에서 37 ° C에서, 6cm 직경 배양 접시에서 배양 세포를 유지한다. 일주일에 한 번씩 서브 배양 또는 80 덮여 때 - 표면적의 90 %.
- 시작하기 전에, 층류 생물 안전성 캐비닛 하에서 멸균 인산 완충 식염수 (PBS)와 배양 배지의 부피를 좋은 기회.
- 이미징을위한 SH-SY5Y 세포 도금
- TIRFM 실험의 경우, 판커버 글래스 상 세포. 고용 유리는 0.17 ± 0.005 mm 두께 1.5255 ± 0.00015 굴절률 다룹니다. 시작하기 전에 다음과 같이 커버 글라스를 준비 :
- 유리 청소 90 % 에탄올, O / N로 다룹니다.
- 증류수 (증류수 3 번)에 철저히 씻어. 드라이 유리 건조 오븐에서 다룬다.
- 장소는 유리 페트리 접시에서 커버하고 3 시간 동안 200 ° C로 예열 된 오븐에서 소독.
- 일 형질 감염 전에, 3.5 cm 페트리 접시에 각 커버 슬립을 배치 배지 1 ㎖를 추가하고, 5 % CO 2 인큐베이터에서 37 ° C에서 배양한다.
- 1.1.5, 완전 배지 1 ㎖로 세포 펠렛을 중단하고 카운트 - 단계 1.1.3에 기재된 바와 같이 세포를 Trypsinize. 잘 / 3 × 10 5 세포를 산출하기 위해 각 페트리 접시에 추가 세포 현탁액의 올바른 볼륨을 계산합니다. 이 밀도는 세포의 최적 성장 및 효율적인 형질 전환에 필요한. 37 ° C에서 품어5 % CO 2 배양기 O / N에서.
- TIRFM 실험의 경우, 판커버 글래스 상 세포. 고용 유리는 0.17 ± 0.005 mm 두께 1.5255 ± 0.00015 굴절률 다룹니다. 시작하기 전에 다음과 같이 커버 글라스를 준비 :
- 폴리에틸렌 이민으로 SH-SY5Ytransfection (PEI)
참고 : 시냅스 소포 역학을 시각화하려면, synapto - pHluorin를 포함 pCB6 벡터가 사용되었습니다. synapto-pHluorin 녹색 형광 단백질 (GFP) (16)와 구조가 광범위하게 뉴런 (9) 내에서 시냅스 소포 특성을 조사하기 위해 사용 된 2 시냅 토브 기공을 막 단백질의 pH에 민감한 변형의 프레임 융합에 의해 생성되었습니다.- 형질 전환을 시작하기 전에 다음과 같은 솔루션을 10 ㎖를 확인합니다. 1개월으로 최대로 솔루션을 유지합니다.
- 150 mM의 NaCl 용액을 확인합니다. 0.01 N 염산으로 pH 5.5로 조정합니다.
- 150 mM의 NaCl 용액에 10 % 폴리에틸렌 이민 (25 kDa의 선형 PEI)에서 PEI 솔루션을합니다. 용액의 pH는 8.8로 상승한다. 0.01 N HCl로 7.8 산도를 조정합니다.
- 도금 후 24 시간, 배지를 제거하고 1.5 ml의 새로완전 배지. 5 % CO 2 인큐베이터에서 37 ℃에서 세포를 유지.
- 층류 생물 안전성 캐비닛에서 1.5ml의 미세 원심 분리 튜브에, 150 mM의 NaCl 용액 25 μL 및 3.5 cm 페트리 접시 당 PEI 용액 100 ㎕로 플라스미드 DNA 3㎍을 추가.
- 와동 10 초 후, RT에서 30 분 동안 DNA / PEI 혼합물을 배양한다.
- 조심스럽게 세포와 커버 슬립을 함유하는 페트리 접시로 DNA / PEI 혼합물을 추가하고 부드럽게 동일 배양 접시에서 시약을 분배 흔들어.
- 4 시간 후에 배지를 변경하고, 5 % CO 2 인큐베이터에서 37 ° C에서 세포 O / N을 배양한다. 형질 전환 후 48 시간 - 이미징 실험 24을 수행합니다.
- 형질 전환을 시작하기 전에 다음과 같은 솔루션을 10 ㎖를 확인합니다. 1개월으로 최대로 솔루션을 유지합니다.
총 내부 반사 형광 현미경 2. 세포 이미징 (TIRFM)
- 영상 설정
- 그림 1에 설명 된 셋업과 TIRF 이미징을 수행합니다. 그것은 거꾸로 모터 구성현미경 (도 1, 인셋), 레이저 소스 (도 1, 인셋 B) 및 TIRF-슬라이더 (도 1, 인셋 C). 높은 개구 수 (NA 1.45 - 알파 플랜 Fluar) 100X 오일, 침지 대물 통해 TIRFM 조명에 도달한다.
- TIRFM 조명용, 멀티 라인 (458/488/514 ㎚) 100 mW의 아르곤 이온 레이저를 이용한다. 모노 모드 광섬유를 사용 TIRF 슬라이더를 통해, 빔 경로에 직선 편광의 레이저 광을 소개한다. 반사 된 빛의 빔 경로의 발광 필드 격막면에 TIRF 슬라이더를 삽입합니다.
- 넓은 필드 조명의 경우, 기존의 수은 쇼트 아크 램프 HBO 흰색 빛에 현미경을 연결합니다. 슬라이더의 편파 유지 이중 프리즘 TIRF 조명과 백색광의 동시 결합을 보장한다.
- 여기 필터 (밴드 폭 10분의 488 ㎚)와 레이저 광 필터 레이저 경로에 도입 필터 휠에 탑재. 고용고속, 소프트웨어 제어, 셔터는 레이저 조명의 빠른 제어를 가능하게합니다. pHluorin 분석을 위해, 밴드 50분의 525 nm의 방출 필터를 통과 마운트합니다. 이미지 PROPLUS 소프트웨어 냉각 고속 CCD 카메라에 디지털 이미지 (512 X 512 픽셀)를 캡처합니다.
- TIRF 조명을 달성 (그림 2)
- 레이저, 컴퓨터, 카메라, 필터 휠, 셔터 컨트롤러를 켭니다; 다음, 레이저는 따뜻하게하고 안정을 필요로하는 실험을 시작하기 전에 20 분을 기다립니다.
- 촬영하기 전에 다음과 같은 솔루션의 좋은 기회 볼륨을 확인합니다.
- 1.2 mM의 KH 2 PO 4, 25 mM의 4- (2- 히드 록시 에틸) 피페 라진 -1- 에탄 술폰산 (HEPES) (완충액을 125 mM의 염화나트륨, 5 mM의 KCl을, 1.2 mM의 MgSO4로에서 크렙스 (KRH) 용액 50 mL로 하여 pH 7.4), 2 mM의 CaCl2를, 6 mM의 포도당.
- 80 mM의 염화나트륨, 50 mM의 KCl을, 1.2 mM의 황산, 1.2 mM의 KH 2 PO 4에서의 KCl-KRH 솔루션 (PH 7.4) 10 mL로25 mM의 HEPES는, 2 mM의 CaCl2를, 6 mM의 포도당 (7.4의 pH로 완충).
- 형질 세포와 유리 커버를 제거하고 적절한 영상 실에 삽입합니다. 챔버를 조립하고 유리의 중앙에 KRH 용액 500 μL를 추가한다.
- 목표를 통해 오일을 추가합니다. 현미경의 무대에 영상 실을 놓고 유리 커버 슬립 아래의 목적을 놓습니다. 샘플을 통해 안전 커버를 배치합니다.
- 표면 형광 모드에서, 커버 슬립 (상면)에 초점을 실 중앙에 배치 형질 감염된 세포를 선택합니다. 그의 형광 신호 분명히 80 밀리 초 미만의 노출 시간을 사용하여 기록 될 수있는 셀을 선택.
- 소프트웨어 제어, 라이브 모드에서 TIRF 조명으로 전환합니다.
- TIRF 구성을 설정하려면, 샘플 커버 (그림 2B)에, 목적에서 나오는 빔의 위치를 확인합니다. t는 빔의 중심에 위치 할 때그 대물 렌즈 (좌측도 2a)은, 스폿 (왼쪽,도 2B) TIRF 샘플 커버의 중앙에 표시되고 셀 표면 형광 모드에 이미징된다 (몇몇 포커스 평면, 높은 배경 형광도 2C, 왼쪽) .
- 임계각에 도달하기 위해, Y 방향으로 집광 스폿을 이동 (전방 또는 후방도 2B, 중앙) TIRF 슬라이더 (도 1C)에 각도 조절 나사를 이용. 빔 (우측도 2a) 임계각보다 큰 각도로 시료면에 집광함으로써, 스폿은 사라지고 직선, 얇은 초점 선 (우측도 2B) 샘플 덮개의 중앙에 분명하다.
- 미세 조정하려면 TIRF 각도는 세포 샘플 (그림 2C)를 사용합니다. 이 단계에서, 표면 형광 같은 이미지가 여전히 표시, 비디오의 형광 이미지를보세요. 부드럽게, TIRF 콘 때까지 나사를 이동dition 달성된다 : 셀의 단지 하나의 광학면은 포커스 (즉, 커버 슬립에 접하는 플라즈마 막),이 (오른쪽,도 2C) 콘트라스트가 높은 평면 화상 결과이다.
- 샘플 영상
- 단일 채널 시간 경과 실험을 설정합니다. photobleaching에 최소화하기 위해, 낮은 노출 시간 및 높은 이득을 이용하여 이미지를 캡처. 80 밀리 초 - 적절한 노출 시간은 40 사이입니다. 2 Hz의 샘플링 주파수 - 1에서 이미지를 획득. 소포 반응 속도는 더 높은 주파수 (10 Hz에서)에서 더 극명하게 샘플링 할 수있다. 관찰 일정한 시간은 통상 2 분이다.
- TIRFM 모드에서 KRH 솔루션 및 기록 세포의 500 μl를 추가합니다. 이 휴식 상태이다. 시간 순차 이미지를 저장합니다.
- 휴식의 동일한 조건 (레이저 파워, 노출 시간, 프레임 번호)에서 동일한 셀 기록에 초점을 맞 춥니 다. 다섯 프레임 후, KCl을-KRH 솔루션의 500 μl를 추가하고 챔버에서의 KCl을 유지합니다.이것은 자극 된 상태이고; 시간 순차 이미지를 저장합니다.
3. 이미지 분석 및 데이터 처리
주 : 이미지를 분석하기가 매크로 이미지 분석 소프트웨어 기존의 기능에 기초하여, 실험실에서 개발되었다; 비슷한 매크로 온라인 (재료 및 장비의 표에서 제공하는 URL)를 사용할 수 있습니다.
- 형광 강도 정량화
- 동영상의 과정을 통해, 이미지 관심 영역 (ROI)의 영역에서 형광 강도 정량화 "시퀀스 형광 강도"매크로를 사용.
- 시간 순차 이미지를 엽니 다. 매크로 메뉴로 가서 '시퀀스 형광 강도'를 선택합니다. '분석'창에서 "투자 수익 (ROI)을 선택합니다"가 나타납니다.
- 투자 수익 (ROI)을 생성하기 위해 메뉴에서 선택 도구 중 하나를 선택합니다. 관광 명소 (배경 ROI)없이 세포막의 지역에서 3 ROI를 배치합니다. 생을 고용S "배경 ROI"광표백을 평가하고 융합 이벤트 분석 (도 3A)에 대한 임계 값을 설정.
- 광표백 수정 및 임계 값 결정 (그림 3B)
- 광표백을 평가하기 위해 형광 강도 행 "배경 ROI를", (그림도 3B)을 엽니 다. 초기 강도 값 (F0) (F / F0) (도 3BB) 각 프레임에서 형광 강도 값을 정규화한다. 값을 평균.
- 평균 데이터를 선택하고 차트 메뉴 옵션을 사용하여 선 그림을 만듭니다.
- 데이터 분석 메뉴에서 플롯 분석 대화 상자를 엽니 다 "추세선"를 선택합니다. 회귀의 유형을 선택합니다. 설정 "지수"회귀. 그런 다음 "차트에 표시 방정식"을 선택합니다. 그래프 창에서, 지수 방정식이 나타나고 매개 변수 값이 자동으로 (그림 3BC 할당 ).
- 다음과 같이 각각의 프레임의 휘도 값으로 보정 지수 적용 :
FN은 (수정) FN / 애 썼는데 = (α *)
FN = 프레임 N에서 측정 실험 형광 강도; N = 프레임 수; photobleaching에 의한 강도로 손실율을 발현 = 표백 계수 (정수; 그림 3BD). - 임계 값을 설정하려면, 정규화 및 수정 "배경 투자 수익 (ROI)을"열기 평균 형광 신호 및 표준 편차 (SD)를 계산한다. 3 SD 플러스 평균값은 임계 값 (도 3Be)을 나타낸다. 데이터 분석이 임계 값을 사용합니다.
- 반자동 절차를 이용하여 융합 이벤트의 선택
- 이미지 분석 소프트웨어와 시계열 화상을 연다. 활성 이미지 시퀀스에 가우시안 필터를 적용합니다.
- 을 선택할 수 있습니다 도구 "개체를 계산"또는 매크로를 사용하여 이미지를 분석픽셀들이 정의 된 범위 내에서의 평균 형광 강도를 가지고 개체. 수동 임계 함수를 사용 범위 설정 강도 (바 메뉴로 이동을, 계수 설정 → 임계치는 관심 영역을 강조하기 위해). 적절한 임계 값은 로컬 형광 배경 시그널이 30 % 이상이다.
- 매크로는 다음과 같은 기준을 충족 객체 만 선택 "개체를 필터"적용 :
- 측면에 대한 범위 옵션 (최소 및 최대 포함)를 적용합니다. 양태는 장축과 객체 타원 상당의 보조 축 간의 비율을보고한다. 화면은 항상 ≥1. 적절한 값은 분 = 1, 최대 = 3이다.
- 직경에 대한 범위를 적용합니다. 두 직경도 구간 두 윤곽 점 접합과 물체의 중심을 통과하는 직경 측정의 평균 길이를보고한다. 픽셀 범위를 설정 (또는 μm의에서, 보정 시스템을 사용하는 경우).
- prelimin에서 최적의 범위를 정의진 실험 수동 관심 지점을 선택하고 플롯 프로파일 함수를 사용하여 직경을 측정한다.
- "표시 객체"를 선택 : 선택된 개체가 TIRFM 이미지 (그림 4B)에 중첩되어 나타납니다.
- 분석 만 짧은 (1-3 프레임) 표시 스폿 즉시 신호 (과도 스폿)의 현저한 손실이어서 형광 강도 일시적인 증가를 포함한다. 선택한 소포 / 스팟 (실험의 ROI) 주위에 약 한 스폿 직경 반경 투자 수익 (ROI)을 생성하기 위해 원형 선택을 사용한다. 수동으로이 단계를 수행합니다.
- ROI 영역을 선택하면, 영화에 걸쳐 각 ROI의 평균 형광 강도를 계산한다.
- 데이터 분석 (도 3C-D)
- 스프레드 시트에 각 "실험적인 투자 수익 (ROI)"에서 측정 된 형광 변화의 시간 코스를 보냅니다; (그림 3DA). 초기 형광 강도 (F / F0) (도에서 3dB)에 대한 각 프레임의 강도 값을 정규화한다.
- 단계 3.2.4 (도 3DC)에보고 된 각 프레임의 강도 값의 지수에 보정을 적용한다.
- 융합 이벤트들의 총 수 (피크 수), 각각의 융합이 발생 시간 (피크 폭)와 형광 피크 (피크 높이 및 AUC)의 진폭을 계산하기 위해 스프레드 시트 또는 수학 패키지를 사용하여 논리 함수를 적용한다. 논리식을 사용하여 융합 이벤트 분석의 일례가도 3Dd 및 3DE에보고된다.
- 원형질막 소포 융합과 같은 임계 값 (평균 ± 3SD 배경 형광 강도)를 초과 형광 강도의 증가와 융합 이벤트로 인한 피크를 가정한다.
- 마지막으로 각 피크의 제 x 값의 차이로서 피크 폭을 계산한다. 1 / (샘플링 주파수)이 값을 곱합니다. 이 값을 고려소포 다시 산성화 및 재활용 (도 3Dd) 전에 세포막에서 소포 융합 및 부착 시간이야.
- 임계 값 이상의 값의 합으로 전체 세포 AUC를 계산합니다. 때문에 자연 (휴식)에 녹화 시간 동안 순 형광 변화 또는 유발 (자극) 시냅스 활동이 값을 고려하십시오.
- 각 피크 및 임계치 Y의 최대 값 사이의 차이로서 피크 높이를 계산한다. 융합 형 (대 단일 동시 / 순차 융합 또는 과도 대 전체 퓨전)의이 값으로 나타내는 것이 좋습니다.
결과
설명 TIRF 이미징 및 데이터 분석 절차는 셀룰러 시스템에서 소포 역학을 연구하기 위해 설계되었습니다. 이 기술은 융합 이벤트 및 신경 전달 물질 소포 (17) 상에 분자 역학 및 약물 시그널링의 효과를 결정하기 위해 사용될 수있다. GFP 표지 된 세포막 단백질 사용 TIRFM 분석 교세포에서 GFP 표지 된 글루타메이트 수송 상피 세포 (18,19)의 구성 적 특징을 거래하기 위해 사용되어왔다.
보고 이미지를 만드는 절차 및 데이터 분석 전략의 유효성을 확인하기 위해, 융합 이벤트는 기초에서 기록되고 synapto-pHluorin로 형질 SH-SY5Y 신경 모세포종 세포에서, (칼륨에 의한 탈분극) 조건을 자극. (비디오를 각각 1, 2). 두 개의 서로 다른 분석이 수행됩니다 : 전 세포 (그림 4) 및 단일 소포 분석 (그림 5).
전 세포 분석 MEA세포 융합의 이벤트 및 자극에 의해 유도 된 결과 순 형광 변화의 총 수를 sures. 그림 4에서, synapto-pHluorin 형질 세포가 휴식 아래 기록과 같은 실험 프로토콜 (시간 노출, 레이저 파워 등)을 사용하여, 조건 (KCl을 자극)을 자극. 그림 4a는 synapto-pHluorin가에 흩어져 형광 puncta에 축적 것을 보여줍니다 세포막. 문헌에 기술 된 바와 같이, 희미한 형광 신호는 세포막에 존재하는 9; 이 신호는 이미지에 표시 할 셀을 식별하는 데 유용합니다. 도 4b에, 종이 (3.3 절)에 설명 된 자동 절차에 의해 선택된 반점은 휴식 상태에서 선택된 지점의 정규화 된 형광 강도 프로파일은 그림 4A.도 4c에보고 된 TIRFM 이미지로 보여줍니다 겹쳐있다. 이러한 프로파일은 유사한 형광 INT의 각 피크의 존재를 공개가끔 막과 융합 소포에 기록 동안 여러 번에 나와서 아마 해당 ensity은. 그림 4D는 KCl을 자극의 효과를 보여줍니다. 예상 한 바와 같이, 25 mM의 KCl을 탈분극 함께 신속한 응답을 유도하는 몇몇 매우 밝은 형광 puncta의 세포막에 표시 (영상 2). 이러한 puncta에 플라즈마 막 아래에 존재하는 시냅스 소포의 '쉽게 탈착 가능한'풀에 해당합니다. 각각의 스폿의 형광 측정에 대응하여 변화의 시간 경과 분석 분비 자극 (도 4d 및도 4f)의 도포 후에 갑자기 나타나는 가변 형광 강도의 피크의 존재를 나타냅니다. 기록 시간 동안 전 세포 분석의 결과는도 4E-H에보고된다. KCl을 자극 융합 이벤트의 수의 급속한 증가로 표시된 (휴식 조건 이상의 2.5 배 증가) (원인따라서 대규모의 신경 전달 물질 방출을 나타내는 그림 4E-F)과 결과 형광 강도의 변화 (휴식 조건을 통해 9.3 배 증가) (그림 4G-H).
단일 피크 분석은 하나의 융합 이벤트 (그림 5)의 특성을 수 있습니다. 그림 5A가 순차을 보여줍니다 휴식 상태에서 기록 대표 "실험적인 투자 수익 (ROI)"의 이미지. 특히이 synapto-pHluorin는 TIRF 영역에서 막과 융합 소포를 표시 강조한다. 두 개의 프레임 후, 형광 신호가 가능한 소포 검색 및 재 산성화를 나타내는, 사라집니다. 관심 영역의 정규화 된 형광 프로파일 (도 5b) TIRF 시간대 스폿의 모양에 대응하여 형광 신호의 증가를 측정한다. 반대로, 형광 자리 실종 후 기저 수준으로 반환 (단일 피크평균 폭 1.91 ± 0.32 초; 평균 피크 높이 0.042 ± 0.005 표준화 형광 강도).도 5C 및 5D는 KCl을 자극 하에서 기록 "실험적인 ROI"의 순차 이미지와 대응하는 정규화 된 형광 강도 프로파일을 도시한다. 및 KCl을 탈분극 후 TIRF 영역 밖으로 소포의 이동의 증가를합니다.
40 융합 이벤트는 선택과 휴식 분석 및 조건을 자극한다. 다음 매개 변수를 측정 : 평균 피크 AUC, 피크 폭과 높이를. 피크 폭은 다시 산성화 및 재활용, 그림 5 세대 전에 소포 융합, 첨부 파일 및 엔도 시토 시스의 시간을 지정합니다. 피크 높이 소포 융합,도 5F에 의해 유도 된 형광 강도의 변화를 측정한다. 이러한 매개 변수의 변화는 다양한 세포 외 유출 메커니즘을 가리킨다. 단일 피크 분석 KCl을 탈분극을 수정 것을 알 수원형질막 소포 융합의 모드. 실제로, 평균 피크 면적 쌍 t-test를, 도표 (휴식 상태 이상 3.8 ± 0.2 배 증가, 쌍 t-test를하여 P <0.01, 그림 5E), 최대 높이 (2.75 ± 0.03 배 증가, P <0.01 증가 5 층)과 짝을 t-test를하여 폭 (2.6 ± 0.5 배 증가, P <0.05. 그림 5 세대)는 자극 조건에서 검출된다. 몇 가지 설명은 이러한 결과를 예상 할 수 있습니다. 가능성 KCl을 탈분극 세포의 제약 영역에 소포 동시에 및 / 또는 연속 융착을 야기한다는 것이다. 또 다른 설명은 강한 탈분극이 과도 융합 대 전체 퓨전을 선호한다는 것이다. 기저 조건 하에서, 일반적인 메커니즘은 과도 융합 : 융합 세공 형태, 소포 증가하고 형광 신호가 나타나기의 pH는하지만, 기공 즉시 따라서 신속한 재 산성화 및 재활용을 가능하게 닫힌다. 아래의자극 조건은 완전히 소포 세포막, 피크 높이 및 긴 기간을 요구할 수있다 막 소포 성분 탈환, 다시 산성화 및 재활용 같은 폭 증가 퓨즈. 유사한 결과는 최근 내분비 β 세포 (20)의 시냅스와 같은 마이크로 소포 세포 외 유출을 분석 획득하고있다.
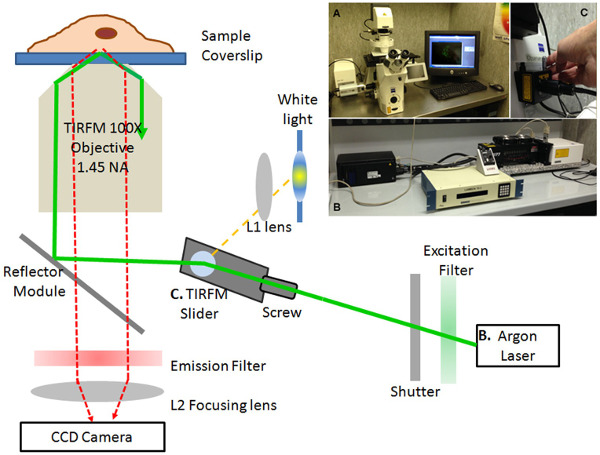
그림 1. TIRF 현미경 설정합니다. TIRF 현미경 시스템의 개략도 및 이미지 (삽입)를. AXIO 관찰자 Z1 동력 거꾸로 현미경 (A), 다중 회선 100 mW의 아르곤 이온 레이저 (B)와 TIRF-슬라이더 (C)를 포함하는 설정합니다. 레이저 빛 (녹색 선)과 흰색 빛 (노란 선)이 표시됩니다. 세포는 100 × 오일 침지 목표를 사용하여 몇 군데 있습니다. 디지털 이미지는 냉각 RetigaSRV 고속 CCD 카메라에 포착된다. 심판초점 강사 모듈, 방출 (10분의 488 ㎚)와 여기 (대역 통과 50분의 525 ㎚) 필터, 콜리메이터 (L1) 및 (L2) 렌즈가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
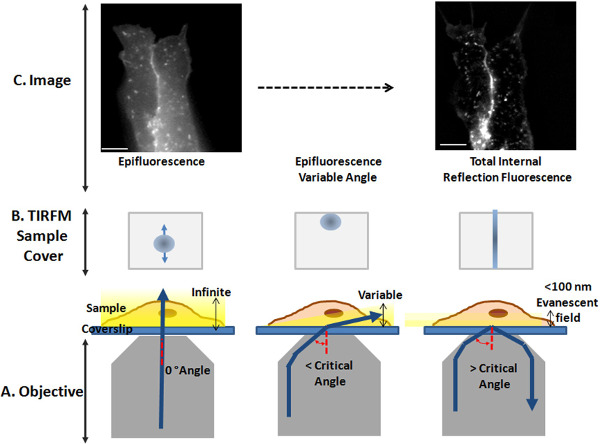
도 2 TIRFM 구성 얻기. (A) 도식 만화 대물, 커버 슬립, 샘플과 레이저 빔의 위치를 (청색 선) 도시는. 좌, 여기 빔은 커버 슬립 샘플 인터페이스를 통해 직접 이동 . 샘플 표면 형광 모드로 여기된다. 센터, 임계각 이상의 입사각 하부 샘플 여기 빔 형성, 광 가변 각도로 샘플을 조명한다. 좋아, 여기 빔은 incid 형성임계각보다 큰 각도 이비인후과, 광이 완료되어 다시 상기 대물 렌즈에 반사되어 소 산장은 샘플에서 전파. 샘플 표지 및 여기 빔 (청색 원)의 위치를 나타내는 (B) 만화, 즉 TIRF 조명 (오른쪽) 방향 (왼쪽) 표면 형광에서 전환하는 동안, 대물 밖으로 나온다. (C) 표면 형광 (왼쪽)과 TIRFM (오른쪽) 라이브 SH-SY5Y 세포에서 synapto-pHluorin 형광 이미지. 스케일 바 :. 10 μm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3. 데이터 처리 및 분석. 라이브 SH-SY에 synapto-pHluorin 형광 (A) TIRFM 이미지5Y 세포. 녹색 사각형은 대표 "배경 ROI"를 나타냅니다. 스케일 바 10 μm의. (B) 배경 투자 수익 (ROI)에 대한 제안 된 워크 플로우. 위에서 아래로 :.... 배경 ROI 측정 형광 강도 변화의 시간 코스, 초기 형광 값 (F / F0)에 형광 변화의 B 정상화, 지수 회귀의 C 응용 프로그램; D 보정 photobleaching에 대한, 전자. 임계 평가 (투명 회색 사각형). 라이브 SH-SY5Y 세포에서 synapto-pHluorin 형광 (C) TIRFM 이미지입니다. 흰색 사각형은 대표 "실험 ROI"를 나타냅니다. 스케일 바 10 μm의. 실험 ROI에 대한 (D) 제안 된 워크 플로우. .. 위에서 아래로 :; B 초기 형광 값 (F / F0)에 데이터 정규화, 형광 강도 변화의 시간 코스 다. photobleaching에 보정;. 논리적 기능의 드 응용 프로그램은 피크 수, AUC, 폭과 높이를 감지한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4. 전체 세포 분석. 라이브 SH-SY5Y 세포에서 synapto-pHluorin 형광 (A) TIRFM 이미지. 세포는 휴식 아래 기록 (1 Hz에서 샘플링) (25 mM의 KCl을 응용 프로그램) 조건 자극한다. 스케일 바 : 10 μm의. 자동 절차에 의해 식별 (B) 지점은 TIRFM 이미지에 중첩 (녹색)에 표시됩니다. 휴식 조건 하에서 셀 전체의 자동 절차에 의해 선택된 스폿 (C) 표준화 된 형광 강도 프로파일 (F / F0). (D) Normaliz자극 조건에서 선택 관광 명소의 에드 형광 강도 프로파일 (F / F0). 추적을 통해 바의 KCl 응용 프로그램을 나타냅니다. (EH) 이벤트 (파란색)과 자극 (빨간색) 조건을 쉬고에서 전체 셀에 기록 된 형광 강도 변화의 수. (E) 히스토그램 셀에 기록 융합 이벤트들의 총 수를 도시. (F) 융합 사건의 시간적 분포. (G) 전 세포 (총 AUC)에서 발생 pHluorin 형광 강도의 변화를 나타내는 막대 그래프. 시간의 함수로 누적 pHluorin 형광 강도의 변화를 나타내는 (H) 곡선. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

synapto-pHluorin을 표현하는 그림 5. 단일 소포 분석. (A) SH-SY5Y 세포가 휴식 상태에서, 1 Hz에서 몇 군데 있습니다. synapto-pHluorin를 보여주는 투자 수익 (ROI)의 대표 TIRFM 순차 이미지 (매 2 초) 소포를 표시. ROI는 40 X 35 픽셀 =. 도시 ROI의 (B) 표준화 형광 프로파일 (F / F0). 검은 색 별표는 임계 선이 표시됩니다, 퓨전 이벤트를 나타냅니다. (C) 같은 세포가 자극 조건 (25 mM의 KCl을)에서 기록, ROI의 대표 TIRFM 순차 이미지가 표시됩니다. KCl을 애플리케이션은 황색 별표로 표시된다. (D) C에 표시된 지역의 정규화 된 형광 프로파일은 소포의 (에) 도착과 실종 (교체 아웃)을 강조한다. 검은 색 별표 융합 이벤트를 나타내는, 임계 라인이 도시되어있다. (EG) 휴식 (파란색 막대)에서 기록 및 자극 단일 소포 사건의 특성 ( 빨간색 막대) 조건. n은 = 40 융합 이벤트. (E) 왼쪽이 피크 면적 (AUC)가 밝은 파란색으로 표시되며, 오른쪽, 평균 피크 면적의 히스토그램; ** P <0.01. (F) 좌, 피크의 높이 (H)은 양방향 화살표로 표시된다; 센터, 평균 피크 높이의 막대 그래프; ** p <0.01, 오른쪽 피크 높이가 융합 메커니즘을 지정합니다. 만화의 스타 synapto-pHluorin을 나타냅니다. (G)는 왼쪽, 피크 폭은 양방향 화살표로 표시된다; 센터, 평균 피크 폭의 히스토그램; * P <0.05; 오른쪽 피크 폭은 소포 세포 외 유출, 첨부 파일 및 엔도 시토 시스의 시간을 지정합니다. synapto-pHluorin 형광를 볼 수 있고 그것이 오프를 전환 할 때. 회색 때 스타의 색상이 녹색 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
synapto-pHluorin을 표현하는 비디오 2. SH-SY5Y 세포 (1 Hz에서 샘플링) 자극 조건에서 기록됩니다. KCl을 관류가 표시됩니다. 이 비디오를 시청하려면 여기를 클릭하십시오.
토론
이 논문은 이미지에 프로토콜을 제시하고, 형광 cDNA를 인코딩 벡터와 TIRFM를 사용하여, 분비 세포에서 소포 역학을 분석 할 수 있습니다. TIRFM에 의해 성공적으로 영상의 핵심 요소 소포 자료 및 재활용의 유전자 인코딩 광학 지표와 셀룰러 모델과 세포 형질의 선택입니다.
TIRFM는 이상적으로 유리 커버에 부착 성장과 세포막과 융합 이벤트의 안정적인 시각화를 허용하기에 충분히 평평한 세포에 적합합니다. 그들의 매매, 융합 및 엔도 시토 시스는 묘화 소포 및 단일 레벨에서 정량화 될 수 있도록 소체 이상적 셀에 분산되어야한다. 불행하게도, 신경 세포는 이러한 기준을 충족하지 않는 : 그들은 서로 자주 건너 불규칙한 모양, 신경 돌기가 있고, 융합이 prevalently 작은 지역 (활성 영역)에 집중되어 소포. 이 지역은 뉴런의 차 문화에 TIRFM에 의해 소포 역학을 연구하는 것은 매우 어렵다.
우리는 SH-SY5Y 인간 신경 아세포종 세포주 TIRFM으로, 휴식 조건 하에서 자극과 신경 전달 물질 방출을 조사하기 유용한 대안 모델이 될 수 있다는 것을 최초로 보여준다. 이 세포주는 셀룰러 본체 얇은 프로세스와 뉴런 표현형을 갖는 신경 전달 물질 합성 효소, 시냅스 기계의 단백질 및 분비를 조절 갖는다. 또한, 레티노 산 (retinoic acid), 포르 볼 에스테르 및 dibutyryl 환상 AMP (21, 22)를 포함하는 다양한 제제의 존재하에 기능적으로 성숙 뉴런 표현형으로 분화 될 수있다. 세포 (특히 전지 본체에서) TIRFM 모드 세포막과 융합 이벤트 안정된 시각화를 허용하기에 충분히 평평하고 소체 비교적 분산된다. 마지막으로, 세포는 쉽게 다른 형질 전환 시약을 사용하여 인코딩 플라스미드 GFP 표지 된 단백질 또는 pH 민감성 단백질 태그로 형질 감염 될 수있다. 이 프로토콜에서는, PEI는 트랜하는 데 사용되었습니다세포. 이 시약은 대부분의 시판되는 형질 감염 제의 기초를 구성하고, 단독으로 매우 비용 효율적인 형질 전환 벡터로서 작용한다. 형질 감염의 20 % 효율은 단일 세포 이미징에 적합보고 상기 프로토콜을 사용하여 예상된다.다른 형질 전환 시약 및 절차의 이용 가능성이 SH-SY5Y에, 심지어 차의 연결을 문화에 형질 거의 표준 절차를 기울이고 있으나, 관리 분석하고 TIRFM 데이터를 해석, 기록 할 때주의해야합니다. TIRFM은 살아있는 세포에서 세포막이나 근처 발생 프로세스에 관한 정보의 수집을 용이하게하고, 또는 소멸 출원 벗어날 태그 단백질로부터 유도 된 형광 신호의 변화의 검출을 통해 각각의 분자 수준의 분석을 가능하게한다. 그러나, 몇 가지 요소가 반드시 엑소 / 세포 내 이입 이벤트를 암시하지 않고,이 영역에서 형광 신호를 수정할 수 있습니다,이 걸릴해야N 고려 기록 데이터를 분석 할 때. 이 중 특히 산장과 형광 수정에서 초점면에 관한 그 기록하는 동안 셀의 형태 학적 변화가 있습니다.
형태 학적 변화
TIRF 기술의 높은 해상도는 유리 인터페이스 (11)에서 100 나노 미터의 깊이로, 산장 내에서 형광 물질의 여기에 의존한다. 이것은 매우 얇은 영역이며, 눈에 보이지 않는 형태 학적 변형 초점 평면 셀을 변경할 것으로 예상된다. 특히 여러 프로세스를 제시하고 뚜렷한 파동 운동을 나타내는 신경 세포에 적용됩니다. 이러한 세포에서는, 기록시 커버 슬립에 접하는 막 면적은 불규칙적이고, 따라서 세포 외 유출의 급속 부정확 평가 일으키는 변경할 수있다. 이 때문에, 가능하면,이 조사의 세포 모델을 선택하는 것이 중요합니다. 세포 MoveMe를 제한하려면NTS은 세포 외 기질 단백질 또는 폴리 -L- 리신으로 코팅 유리 커버하는 것이 도움이 될 수있다. 그러나, 하나는 이러한 기질 세포의 행동과 소포 역학을 수정할 수 있습니다 명심해야합니다.
기록시의 다른 형태 학적 변형 가능한 세포 공급원은 자극, 용액을 첨가하고, 온도 변화이다. 종종 명백하게 TIRF 영역하에 세포 표면을 수정 세포 수축이 발생할 (즉, 탈분극의 KCl) 대규모 소포 방출을 유도하는 자극 수. 정확하게 예비 실험에서의 자극의 종류, 농도, 및인가 시간을 선택하는 것이 중요하다.
피펫 욕조에 솔루션의 간단한 소개는 독립적으로 조성, 전단 응력에 의해 세포 형태의 변형의 원인이 될 수 있습니다. 이러한 이슈를 해결하기 위해, 바람직하게는 매체 노이즈를 감소시키기 위해 가능한 진공 펌프와 연결 관류 시스템을 사용하여, 추가.
세포 형태와 기능으로 인해 실험 환경, 매체 또한 강렬한 레이저 조명에 온도 변화에 매우 민감하다. 라이브 셀 이미징 온도 제어가 정상적으로 인큐베이터를 사용하여 달성된다; 작은 (무대 위)과 대형 (챔버) 창업 보육 센터를 사용할 수 있습니다. 전자는 특히 유용하고 세포 배양의 관찰에 적합하다, 후자는 이와 같이 온도 구배에 의한 포커스 드리프트를 최소화 현미경의 많은 부분을 포함하여, 인큐베이터 안에 모든 장치의 온도를 일정하게 보장한다. 온도 조절 시스템의 부재에서, RT로 세포, 라이브 세포 이미징 챔버 및 솔루션을 평형화 장기 촬상 실험을 방지하는 것이 중요하다.
형광
형광 신호의 변경은 녹화 중에 형광의 변경 때문일 수 있습니다. 가장 중요한 것은 23 photobleaching에있다. 광표백은 형광 물질의 광자 - 유도 분해이다. 그것은 일반적으로 시간이 지남에 관찰 된 샘플의 형광 및 디밍의 영구 상실을 초래하게됩니다. TIRFM에서, 단지 소 산장의 원점을 폐쇄 형광 발색단 광 퇴색 될 수 있으며이 필드에 존재하기 때문에 GFP 표지 된 막 단백질은 광 퇴색된다. 형광 방출 강도의 페이딩의 예방은 정량적 형광 현미경을위한 매우 높은 품질의 이미지를 획득하는 것이 중요하고, 필수이다. 합리적인 근사치로, 일정한 환경에서의 소정의 분자를 들어, 광표백은 시간 및 여진 원에 대한 노출의주기에 의존한다. 많은 경우에, 제어는 광표백 23 녹화를 수행하여 그 평가 및 정정 쉽게 간단한 지수 감쇠 함수를 따른다. 다른 보정 수식 / 매크로를 사용할 수 온라인 (재료 및 장비의 표 참조)이다; 프로토콜 간단한 exponenti에알 함수가 사용되어왔다.
photobleaching에 극복하기 위해 여러 가지 전략이있다. 좋은 전략은 높은 광 안정성과 형광 물질을 사용하여, 예를 들어, 소스에 photobleaching에 방지하는 것이다. 불행하게도, 지금, DNA로 인코딩 된 프로브의 선택은 여전히 제한된다. 이 경우, 활성의 손실은 노광의 시간 - 스팬을 최적화 촬상 취득 중에 최소화 될 수 photobleaching에 의한, 입력 광의 광자 에너지 및 샘플링 주파수.
pH 민감성 프로브를 사용하면, 기록시 형광 개질 상기 소스는 배지의 pH 변화이다. 기록 액체 챔버의 부피는 일반적으로 매우 낮은 약물 응용 프로그램, 세포 활성 및 대사, 특히 전지와 커버 슬립의 표면 사이의 작은 부피, 배지의 pH를 수정할 수있다. 이것은 차례로, 따라서 과소 추정 소포 다시의 / 이상 발생 pHluorin 형광 신호를 변경임대. 예를 들어, 강한 자극은 세포질의 칼슘 - 의존성 산성화로 이어질 수 있으므로 형광 신호 (24)에 과장하여 증가하게, 세포 외 공간에서 알카리 미러.
이 문제를 방지하려면 항상 버퍼링 솔루션을 사용하여 예비 실험에서 확립 된 프로토콜에 의해 도입 가능한 pH를 수정, 모니터링 할 수 있습니다. 더 정확한 유발 된 소포되던 추정치 데이터를 분석하기위한, 융합 이벤트없이 세포 표면의 영역에서 형광 신호를 모니터링하고, 조정 인자로서이 영역 내에서 형광 신호의 수정을 사용한다.
결론적으로, 소포 융합 및 역학을 모니터링하고 분석하는 방법이 설명되었다. 이 기술은 단백질과 그들의 pathogeni의 역할을 계시하는, 엑소 / 엔도 시토 시스의 다양한 단계를 시각화하고 해부 세포 유형 (신경 내분비 세포) 상이한 사용될 수있다C 돌연변이 소포 역학의 규제 및 제정과 규제 세포 외 유출을 대상으로 약물의 작용 메커니즘을 발견하는.
공개
The authors declare that they have no competing financial interests.
감사의 말
저자는 엘리 아나 디 카이 라노 (박사후)과 스테파니 모레티 (박사 교제)에 지원 Università 글리 스투 디 밀라노을 인정하고 싶습니다. 이 작품은 CP에 대학 연구 프로그램 PUR에 의해 지원되었다
pHluorin가 구성 박사 Dotti 프란체스코 데이터 분석 지원 및 기술 지원에 대한 실비아 Marsicano에 대해 우리는 교수 제레미 M. 헨리, 생화학 학교, 브리스톨, 영국의 대학에 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Axio Observer Z1 |  Zeiss Zeiss | 491912-9850-000 | inverted microscope |
| Multiline Argon Laser Lasos 77 |  Lasos Lasos | 00000-1312-752 | multi-line (458/488/514 nm), 100 mW argon-ion laser |
| Laser TIRF slider |  Zeiss Zeiss | 423681-9901-000 | |
| 100X Objective |  Zeiss Zeiss | 421190-9900-000 | Oil, NA 1.45 Alpha-Plan |
| CCD Camera RetigaSRV Fast 1394 |  QImaging QImaging | ||
| LAMBDA 10-3 optical filter changer with SmartShutter |  Sutter Instrument Company Sutter Instrument Company | ||
| Software | |||
| Image ProPlus 6.3 Software |  Media Cybernetics Media Cybernetics | spot selection, ROI selection, fluorescence intensity determination | |
| Excel |  Microsoft Microsoft | photobleaching correction, whole-cell and single-vesicle analyses | |
| GraphPad Prism 4.00 |  GraphPad Software, Inc. GraphPad Software, Inc. | statistical analysis | |
참고문헌
- Sudhof, T. C. The synaptic vesicle cycle. Annu. Rev. Neurosci. 27, 509-547 (1146).
- Denk, W., Svoboda, K. Photon upmanship: why multiphoton imaging is more than a gimmick. Neuron. 18 (3), 351-357 (1997).
- Helmchen, F., Svoboda, K., Denk, W., Tank, D. W. In vivo dendritic calcium dynamics in deep-layer cortical pyramidal neurons. Nat Neurosci. 2 (11), 989-996 (1999).
- Tsien, R. Y. The green fluorescent protein. Annu Rev Biochem. 67, 509-544 (1998).
- Matz, M. V., et al. Fluorescent proteins from non bioluminescent Anthozoa species. Nat Biotechnol. 17 (10), 969-9673 (1999).
- Ribchester, R. R., Mao, F., Betz, W. J. Optical measurements of activity-dependent membrane recycling in motor nerve terminals of mammalian skeletal muscle. Proc Biol Sci. 255 (1342), 61-66 (1994).
- Polo-Parada, L., Bose, C. M., Landmesser, L. T. Alterations in transmission, vesicle dynamics, and transmitter release machinery at NCAM-deficient neuromuscular junctions. Neuron. 32 (5), 815-828 (2001).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nat Protoc. 1 (6), 2916-2921 (2006).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Axelrod, D. Total internal reflection fluorescence microscopy. Methods Cell. Biol. 89, 169-221 (2008).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys. J. 79, 2199-2208 (2000).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Wyatt, R. M. Balice-Gordon R.J. Heterogeneity in Synaptic Vesicle Release at Neuromuscular Synapses of Mice Expressing SynaptopHluorin. J. Neurosci. 28 (1), 325-335 (2008).
- Tsuboi, T., Rutter, G. A. Multiple forms of "kiss-and-run" exocytosis revealed by evanescent wave microscopy. Curr Biol. 13, 563-567 (2003).
- Miloso, M., et al. Retinoic Acid-Induced Neuritogenesis of Human Neuroblastoma SH-SY5Y Cells Is ERK Independent and PKC Dependent. J. Neurosci. Res. 75, 241-252 (2004).
- Jaskolski, F., Mayo-Martin, B., Jane, D., Henley, J. M. Dynamin-dependent Membrane Drift Recruits AMPA Receptors to Dendritic Spines. J Biol Chem. 284 (18), 12491-12503 (2009).
- Treccani, G., et al. Stress and corticosterone rapidly increase the readily releasable pool of glutamate vesicles in synaptic terminals of prefrontal and frontal cortex. Mol Psychiatry. 19 (4), 433-443 (1038).
- D'Amico, A., et al. The surface density of the glutamate transporter EAAC1 is controlled by interactions with PDZK1 and AP2 adaptor complexes. Traffic. 11 (11), 1455-1470 (2010).
- Perego, C., Di Cairano, E. S., Ballabio, M., Magnaghi, V. Neurosteroid allopregnanolone regulates EAAC1-mediated glutamate uptake and triggers actin changes in Schwann cells. J Cell Physiol. 227 (4), 1740-1751 (2012).
- Bergeron, A., Pucci, L., Bezzi, P., Regazzi, R. Analysis of synaptic-like microvesicles exocytosis of B-cells using a live imaging technique. PlosOne. 9, e87758(2014).
- Encinas, M., et al. Sequential treatment of SH-Sy5Y cells with retinoic acid and brain-derived neurotrophic factor gives rise to fully differentiated, neutrophic factor-dependent, human neuron-like cells. J. Neurochem. 75 (3), 991-1003 (2000).
- Kume, T., et al. Dibutyryl cyclic AMP induces differentiation of human neuroblastoma SH-SY5Y cells into a noradrenergic phenotype. Neurosci Lett. 443 (3), 199-203 (2008).
- Diaspro, A., Chirico, G., Usai, C., Ramoino, P., Dobrucki, J. Photobleaching. Handbook of Biological Confocal Microscopy. Pawley, J. B. , Springer-Verlag New York, Inc.. New York. 690-699 (2006).
- Rossano, A. J., Chouhan, A. K., Macleod, G. M. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유