Method Article
Não enzimática, Soro livre de Cultura de Tecidos de lesões mamárias pré-invasivas para a geração espontânea de Mammospheres
Neste Artigo
Resumo
Cultura primária de células de tecidos intactos utilizando Organóides proporciona um sistema modelo que imita o microambiente de multi-celular, in vivo. Foi desenvolvido um modelo de cultura livre de soro primário tecido epitelial da mama que perpetua linhagens de cultura de células mistas e exposições diferenciadas morfologia, sem rompimento do tecido enzimática. Organóides mama permanecer viáveis por> 6 meses.
Resumo
Mama carcinoma ductal in situ (CDIS), por definição, é a proliferação de células epiteliais neoplásicas dentro dos limites do ducto mamário, sem ultrapassar a membrana basal colágeno. Enquanto DCIS é um precursor não-obrigatório para os cânceres de mama invasivos, os mecanismos moleculares e as populações de células que permitem a progressão para o câncer invasivo não são totalmente conhecidos. Para determinar se as células progenitoras, capazes de invasão existia dentro da população de células DCIS, desenvolvemos uma metodologia de recolha e cultura estéril tecido mamário humano no momento da cirurgia, sem interrupção enzimática do tecido.
Tecido mamário estéril contendo segmentos ductal é colhida a partir de tecido mamário extirpado cirurgicamente após exame anatomopatológico de rotina. Tissue contendo DCIS é colocado em meio rico em nutrientes, contendo antibióticos, soro livre, e transportadas para o laboratório de cultura de tecidos. O tecido mamário é mais dissected para isolar as áreas calcificadas. Vários pedaços de tecido da mama (Organóides) são colocados num volume mínimo de meio isento de soro num frasco com uma tampa removível e cultivadas numa incubadora de CO 2 humidificado. Populações de células epiteliais e de fibroblastos emergir da organ�de após 10 - 14 dias. Mammospheres formam espontaneamente e em torno da monocamada de células epiteliais. Populações de células específicas podem ser colhidas directamente a partir do frasco, sem perturbar as células vizinhas. Nosso sistema de cultura de tecidos não-enzimática revela de forma confiável, as células progenitoras invasivos citogeneticamente anormais de CDIS humanos frescos.
Introdução
A proliferação de células epiteliais dentro dos limites de ductos mamários e alvéolos (carcinoma ductal in situ) é reconhecido como um precursor obrigatório para ductal invasivo e carcinoma lobular da mama. No entanto, os mecanismos moleculares e dinâmica de populações de células que permitem a progressão para o câncer invasivo são mal compreendidos. Elucidar os mecanismos de sobrevivência utilizadas pelas células do carcinoma da mama pré-invasivas, ou qualquer tumor pré-invasivo, pode revelar estratégias terapêuticas para matar, ou mesmo impedindo, neoplasias pré-invasivas 1. No entanto, métodos de baixo custo simples para estudar funcionalmente lesões pré-invasivas humanos têm faltado. Embora a cultura in vitro em monocamada de linhas celulares transformadas é estabelecido um método de laboratório, o genótipo e o fenótipo destas linhas de células imortalizadas não recapitular o estatuto molecular de células de tumores humanos primários 2. Além disso, mesmo a linha não-tumorigenic células MCF-10A, que recapitulates 3-D arquitetura da glândula mamária, não representam adequadamente o fenótipo funcional e as características moleculares do pré-invasivo lesão peito de um paciente individual 3,4.
Para determinar se as células-tronco neoplásicas semelhantes capazes de invasão existiu dentro do carcinoma ductal in situ (CDIS) população de células, desenvolvemos uma metodologia de recolha e cultura estéril tecido mamário humano no momento da cirurgia (Figura 1) 5. O nosso ex vivo da mama sistema de cultura organ�de não depende de interrupção enzimática tecido, extracto de membrana basal da matriz, ou o esgotamento de fibroblastos, para o isolamento e propagação de células formadoras de mammosphere de fresco humano de mama ductal tecido de carcinoma de 6-8. O nosso novo sistema baseia-se no princípio da célula de fluxo / migração 5. Os ductos mamários discerníveis, e estroma circundante estão submersos num volume mínimo de meio nutriente livre de soro (e apenasnough a cobrir os fragmentos de condutas) para maximizar a troca de gás, com a superfície de corte da conduta exposta ao meio de cultura, mas em qualquer orientação específica no balão (Figura 1E-F). Este sistema de cultura permite que as células migrem para fora da conduta e para dentro / para o balão de estroma e cultura autólogo. O meio nutriente, suplementado apenas com o Factor de Crescimento Epidérmico (EGF), insulina, e antibióticos, suporta o crescimento de populações de células mistas que emanam do organ�de. O balão de cultura de tecidos tem um, re-selável tampa removível que permite que os Organóides e / ou células a serem colhidas, sem perturbar a totalidade do balão ou vizinhos Organóides, enquanto se mantém um ambiente estéril humidificada.
Protocolo
Tecido mamário humano foi coletado de pacientes inscritos em um estudo de pesquisa, com consentimento informado por escrito, na sequência do Departamento de Defesa, George Mason University, e protocolos aprovados do Sistema de Saúde Inova Institutional Review Board.
1. Prepare Nutrient meio rico com fatores de crescimento e antibióticos
- Preparar soluções de reserva de insulina, factor de crescimento epidérmico (EGF), sulfato de estreptomicina e sulfato de gentamicina.
- Reconstituir insulina em água filtrada estéril até uma concentração final de 10 mg / ml. Aspirar 10 ml de reagente do tipo 1 grau a água em uma seringa de 10 ml descartável estéril. Coloque um filtro de 0,22? M de polietersulfona à seringa. Dispense a água filtrada estéril em um tubo cônico de 15 ml estéril.
- Adicionar 10 ml de água filtrada estéril para um frasco de 100 mg de insulina. Misture o conteúdo brevemente em um misturador de vórtice. Mantenha o frasco de insulina no gelo. Dispensar 450 ml da solu estoque de insulinação marcadas, em tubos de microcentrífuga estéreis e armazenar a -20 ° C. Solução estoque de insulina é estável até a data de validade no frasco.
- Preparar a solução stock de factor de crescimento epidérmico (EGF): Adicionar 500 uL de água estéril para 500 ug de EGF (estoque 1 ug / ul). Misture o conteúdo brevemente em um misturador de vórtice. Manter o frasco EGF no gelo.
- Prepara-se uma solução estoque de trabalho de EGF: Adicionar 100 ul da solução de estoque de EGF para 900 ul meio nutriente (estoque de trabalho será de 0,1 ug / ul). Misture o conteúdo brevemente em um misturador de vórtice. Dispensar 50 ul da solução de EGF trabalhando em estoque rotulados, microtubos estéreis e armazenar a -80 ° C.
NOTA: solução de estoque de EGF (1 ug / ul) é estável durante um ano à temperatura de -80 ° C; Solução de trabalho de estoque (0,1 ug / uL) é estável durante 2 meses a -80 ° C.
- Prepara-se uma solução estoque de trabalho de EGF: Adicionar 100 ul da solução de estoque de EGF para 900 ul meio nutriente (estoque de trabalho será de 0,1 ug / ul). Misture o conteúdo brevemente em um misturador de vórtice. Dispensar 50 ul da solução de EGF trabalhando em estoque rotulados, microtubos estéreis e armazenar a -80 ° C.
- Pesar 40 mg de sulfato de estreptomicina em uma balança analítica. Colocar o sulfato de estreptomicina intoa estéreis tubo de 15 ml. Adicione 4 ml de meio nutriente. Misture o conteúdo brevemente em um misturador de vórtice. A solução deve ser ligeiramente rosa. Armazenar a 4 ° C, protegida da luz. Solução de sulfato de estreptomicina é estável durante 7 dias.
- Pesar 20 mg de sulfato de gentamicina em uma balança analítica. Coloque o sulfato de gentamicina em um estéril tubo de 15 ml. Adicionar 2 ml de meio nutriente. Misture o conteúdo brevemente em um misturador de vórtice. A solução deve ser amarelas. Armazenar a 4 ° C, protegida da luz. Solução de sulfato de gentamicina é estável durante 7 dias.
- Preparar dois lotes de 200 ml de meio nutriente suplementado com EGF humano recombinante (10 ng / ml de concentração final.), Insulina (10 ug / ml de concentração final.), Sulfato de estreptomicina (100 ug / ml de concentração final.) E sulfato de gentamicina (20 ug / ml de concentração final.).
- Adicionar meio nutriente para 200 ml um balão de filtração a vácuo equipado com um filtro de 0,2 um balão de polietersulfona e um frasco de 250 ml de receber. Adicionar 20 &# 181; l estoque trabalhando EGF, 200 mL de insulina estoque, 2 ml de sulfato de estoque estreptomicina e 400 sulfato de gentamicina estoque ul a 200 ml de meio nutriente. Fixar o frasco de filtração a vácuo. Filtre o meio. Descarte o filtro e rotular o frasco como "meio nutriente rico". Armazenar a 4 ° C por até 14 dias.
2. Aquisição de Tecidos e extrapolação
- Na sala de cirurgia, manter a técnica estéril após a aquisição do tecido mamário. Coloque o tecido mamário em uma bandeja estéril e cobrir a bandeja com filme plástico estéril.
- Transportar o tecido na bandeja coberta de Radiologia / Patologia conforme exigido pela sua instituição. Não abra a bandeja. Tempos de transporte variam dentro das instituições. Tecido pode permanecer viável neste bandeja coberta à temperatura ambiente por até 45 minutos após a excisão. No entanto, o prompt de processamento do tecido em meio rico em nutrientes proporciona as condições ideais para a cultura subseqüente organóide.
- Dissecção dos tecidos Gross para identificar áreas de CDIS dentro do tecido mamário: Use luvas estéreis, lâminas, bisturis, tecido tintas de marcação, e vinagre durante a dissecção do tecido para manter a esterilidade dos tecidos.
- Limpar a área de trabalho com etanol a 70% ou 1% de lixívia. Abra as luvas estéreis e colocar a capa luva na superfície de trabalho. Coloque o interior da luva estéril invólucro de face para cima. Coloque as luvas estéreis.
- Limpar a superfície do recipiente de amostra com etanol a 70%. Retire o filme plástico do recipiente de amostras de tecido e colocar a amostra na embalagem luva.
- Mergulhe dois cotonetes com ponta no corante marcação tecido. Aplicar o corante à superfície do tecido por laminagem os esfregaços em toda a superfície do tecido.
NOTA: Cada departamento de patologia tem um protocolo de orientação a cor da tintura / tecido padronizado. O tecido é marcada com corante para orientar o tecido em relação à sua posição no paciente. O corante é apagado oupintado sobre o tecido. Não despeje o corante sobre o tecido. Verter o corante pode causar o corante para executar / gotejamento em fendas de tecido confundindo, assim, a orientação das margens cirúrgicas. Orientação tecido fornece ao cirurgião e patologista com marcos anatômicos para a) descrever a amostra de tecido, e b) determinar a localização das margens cirúrgicas em relação ao tumor. - Pour vinagre branco destilado (5% de ácido acético) para compressas de gaze estéril. Seque o tecido tingido com o vinagre gaze embebida. Descarte a gaze. O vinagre é usado para corrigir a marcação corantes de tecidos.
- Corte o tecido mamário em fatias verticais de aproximadamente 5 mm de espessura. Não corte todo o caminho através do tecido (Figura 2). Observar / palpar o tecido para as áreas de calcificação. Identificar CDIS por sua característica firme, pálida aparência avermelhada cercada por, as fronteiras de borracha que se sentir corajoso (devido a espículas de cálcio).
NOTA: Em alguns casos, comedo (espinha-like) áreas podem servistos como pontos brancos, representando material necrótico de CDIS grande diâmetro. - Cortar áreas de CDIS / calcificada tecido mamário, incluindo uma pequena quantidade de tecido circundante da mama. Colocar o tecido da mama para um tubo de 50 ml estéril contendo 20-30 ml de meio nutriente rico preparado no passo 1.
- Misturar o tecido e meio invertendo suavemente o tubo várias vezes. Descarte a médio e adicione meio fresco. Colocar o tubo contendo o tecido e forma dentro de um recipiente isolado e transportar o tecido para o laboratório de cultura de tecidos.
- Limpar a área de trabalho com etanol a 70% ou 1% de lixívia. Abra as luvas estéreis e colocar a capa luva na superfície de trabalho. Coloque o interior da luva estéril invólucro de face para cima. Coloque as luvas estéreis.
3. Cultura de Tecidos
- Trabalhando numa câmara de segurança biológica, despeje o tecido e uma pequena quantidade do meio nutriente para uma placa de Petri esterilizada. Usando um bisturi estéril cortar e descartar o tecido fibroso. Cortar o tecido mamário em pedaços (Organóides) cerca de 3 mm 2 (Figura 1C-D). Tente cortar o tecido de modo que cada órgãooid contém pelo menos um segmento de conduta de discernível com estroma circundante.
- Abrir a tampa do frasco de cultura de tecido. Com uma pinça estéril ou pinça, coloque os Organóides para o balão. Fechar a tampa. Descarte a placa de Petri.
- Adicionar 11 ml de meio nutriente rico isento de soro (preparado no passo 1) para o frasco de cultura de tecido. Feche o frasco e agite o frasco de modo que os Organóides e médio estão distribuídas uniformemente por toda a superfície frasco (Figura 1E-F).
- Incubar o balão a 37 ° C numa atmosfera humidificada com 5,0% de CO2 durante 2 dias. Não mova o frasco durante este tempo.
- No dia 2 de pós incubação, retirar o balão da incubadora para verificar se há potencial de contaminação bacteriana / fúngica. Evite repente, movimentos bruscos, ou roda do balão. Colocar o balão num palco de microscópio invertido.
- Observar a forma de bactérias, leveduras e / ou fungos. Se nenhuma contaminação é observado, devolver o frasco para a incubadora para um suplementodia itional. Se a contaminação for observado, descartar o balão eo seu conteúdo em um recipiente adequado.
- No dia 3 pós incubação, substituir o meio condicionado com meio fresco.
- Colocar 11 ml de meio em um tubo estéril a 37 ° C durante 20-30 min. Retirar o frasco de cultura de tecido a partir do incubador. Sem perturbar os Organóides, remover e descartar o meio no frasco, utilizando uma pipeta serológica estéril.
- Usando uma pipeta serológica estéril novo, adicionar 11 ml de meio fresco pré-aquecido. Muito rodar cuidadosamente o frasco para distribuir o meio através da superfície do balão.
- Incubar o balão a 37 ° C numa atmosfera humidificada com 5,0% CO2.
4. Manutenção da estabeleceram colônias Celulares organóide / epiteliais
- Prepare meio fresco a cada 2 semanas e substituir os meios de comunicação no frasco de cultura de tecidos 3 vezes por semana.
- Colocar 11 ml do meio num recipiente estéril a 37° C por 20-30 min. Retirar o balão da incubadora. Com uma pipeta sorológica estéril, retire e descarte o meio condicionado a partir do balão, tomando cuidado para não perturbar os Organóides.
- Usando uma pipeta serológica estéril novo, adicionar 11 ml de meio fresco pré-aquecido. Muito rodar cuidadosamente o frasco para distribuir o meio através da superfície do balão. Incubar o balão a 37 ° C numa atmosfera humidificada com 5,0% CO2.
- Após 10-14 dias em cultura, remover quaisquer fragmentos de tecido do balão de cultura que não são aderentes.
- As células e / ou Organóides do balão para a propagação em novos frascos de cultura Periodicamente colheita, para o transplante de xenoenxerto, ou para fenotípica e / ou análise molecular.
- Retirar o frasco de cultura de tecido a partir do incubador. Pulverizar o balão com etanol a 70%. Limpe o excesso de etanol no frasco com uma toalha de papel que foi pulverizada com etanol 70%.
- Propagação organóide:
- Abra a tampa do frasco e coloque a tampa virada para cima na cabine de segurança biológica. Sob visualização microscópica, localizar o organóide (s) a ser colhida. Use uma pinça ou pinça estéril para pick-up um organóide.
- Para propagar o organóide em uma nova garrafa de cultura, coloque o organóide no novo frasco. Adicionar 11 ml, meio quente fresco. Incubar a 37 ° C, numa atmosfera humidificada com 5% de CO2, como descrito nas etapas 3.3 - 3.6.3. Substituir o meio de cultura de células na cultura de tecidos balão de três vezes por semana.
- Células de colheita:
- Sob vixualization microscópico direto, raspe e células de aspirado e mammospheres utilizando uma pipeta de 1000 mL com pontas de pipetas esterilizadas descartáveis. Aspirar as células e o meio circundante. Dispensar a células / meio para um tubo de microcentrífuga estéril.
- Rodar as células brevemente em um mini-centrifugar a 12100 xg durante 5 seg. Remova e descarte o meio.
- Para análise do DNA, congelar imediatamente o sedimento de células em gelo seco, num pequeno volume de meio (10 ul), com a armazenagem a longo prazo a -80 ° C.
- Para análise proteômica, lisar as células em 10 ml de 8 M de ureia para a espectrometria de massa ou de tampão tris-glicina 2x SDS por Western Blotting / reversa microarrays de proteínas de fase. Alternativamente, girar células em uma citocentrífuga fazer esfregaços de células para análise imuno-histoquímica.
- Após a colheita de células a partir de um frasco, retire e descarte o meio restante. Adicionar 11 ml de nutrientes fresco meio quente, rica. Incubar o balão a 37 ° C, numa atmosfera humidificada com 5% de CO2.
Resultados
Fluxo de trabalho para a aquisição e cultura carcinoma ductal de mama estéril em tecido situ
Esterilidade tecido mamário é mantida desde a sala de cirurgia para o laboratório de cultura de células via pequenas alterações no fluxo de trabalho típico de patologia do hospital (Figura 1). O tecido é transportado num recipiente esterilizado com um revestimento de película de plástico, que permite a avaliação radiológica, mantendo a esterilidade do tecido. Processamento de tecidos Bruta de uma mastectomia da mama ou mastectomia amostra é realizada com luvas estéreis, lâminas, e marcação de tecido corantes. Aparência morfológica bruta de carcinoma ductal in situ de mama se assemelha áreas pálidas, ligeiramente levantados com uma textura arenosa / firme, cercado por tecido emborrachado avermelhado / amarelo. Áreas de hiperplasia ductal e CDIS podem sentir "corajoso" e firme devido a calcificações. Estas áreas de tecido da mama muitas vezes aparecem tan ou uma cor ligeiramente diferente do que o tecido mamário circundante. No entanto, c ADHum só ser distinguida após a coleta do tecido patológico e revisão dos cortes de tecidos manchados. O tecido da mama permanece viável por imersão dos tecidos e / ou Organóides ductais em meio nutriente livre de soro suplementado com EGF humano recombinante (10 ng / ml), insulina (10 ug / ml), sulfato de estreptomicina (100 ug / ml) e sulfato de gentamicina (20 ug / ml) 5. Frascos de cultura celular com tampas removíveis / re-selável permitir a colheita periódica de células / Organóides (Figura 1E-F). Este modelo propagadas com êxito lesões pré-invasivas de mama humanos a partir de mais de 20 pacientes com diagnóstico de hiperplasia ductal atípica (n = 2) e carcinoma ductal in situ (n = 18).
Mammosphere formação espontânea in vitro e in vivo
Mammospheres e estruturas 3-D surgiu espontaneamente a partir de vários fragmentos, independente humanos DCIS duto de tecidos de diferentes pacientes com diagnóstico de hiper ductal atípicahiperplasia ou carcinoma ductal in situ (Figura 3 e 4) 5,9. Perturbação enzimática do tecido da mama não foi realizada antes da cultura do tecido, o que resultou num tipo de cultura de células mista. Nem soro, as matrizes extracto de membrana basal, nem tipo gel foram necessários para a formação mammosphere espontânea (Figura 4). Os tumores de xenoenxerto mammospheres gerado mamários num modelo de ratinho NOD / SCID com o mesmo padrão de crescimento como o do cancro invasivo (Figura 5) 5. Estes resultados demonstram que as células progenitoras com potencial invasivo pré-existem dentro do peito humano DCIS duto, mas aparentemente são colocados em cheque pela nicho ductal e pode ser persuadido a emergir na cultura organóide. Estas células constituem uma nova categoria de células estaminais do tipo de mama que existem antes da manifestação evidente da 5,9,10 fenótipo invasivo.
Confirmação da epiteliais derivadas mammospheres e xenografts
Os xenoenxertos mammospheres e derivados dos mammospheres foram confirmados por imunofluorescência como tendo origens epiteliais. Molécula de adesão da célula epitelial (EpCAM) é uma glicoproteína de membrana expressa em células epiteliais 11. A imunofluorescência com um anticorpo monoclonal de ratinho reactivo para EpCAM humana (verde) e um corante nuclear (DAPI, azul) mostrou células positivas EpCAM nas mammospheres em cultura (Figura 6A) e o centro de um xenoenxerto NOD / SCID (Figura 6B).
A verificação de limites de membrana basal intacta
O mammosphere formando, as células epiteliais neoplásicas nesse sistema de cultivo foram derivadas de lesões mamárias pré-invasivas que estavam desprovidos de invasão franca ou microinvasão, como verificado por análise patológica independente sob o padrão do exame histopatológico de cuidado. Várias estruturas organóide do mesmo paciente gerado mammosphere paracolônias ming que provaram ser tumorigenic. Além disso, o exame histopatológico do tecido utilizado para a cultura organ�de revelou lesões intraductais confluentes com limites de membrana basal intacta (Figura 7B) 5. Assim, pode concluir-se que os mammospheres espontâneos formados neste sistema de cultura são obtidas apenas a partir de áreas neoplásicas pré-invasivas e não constituem um produto de áreas raros de 5 microinvasão.
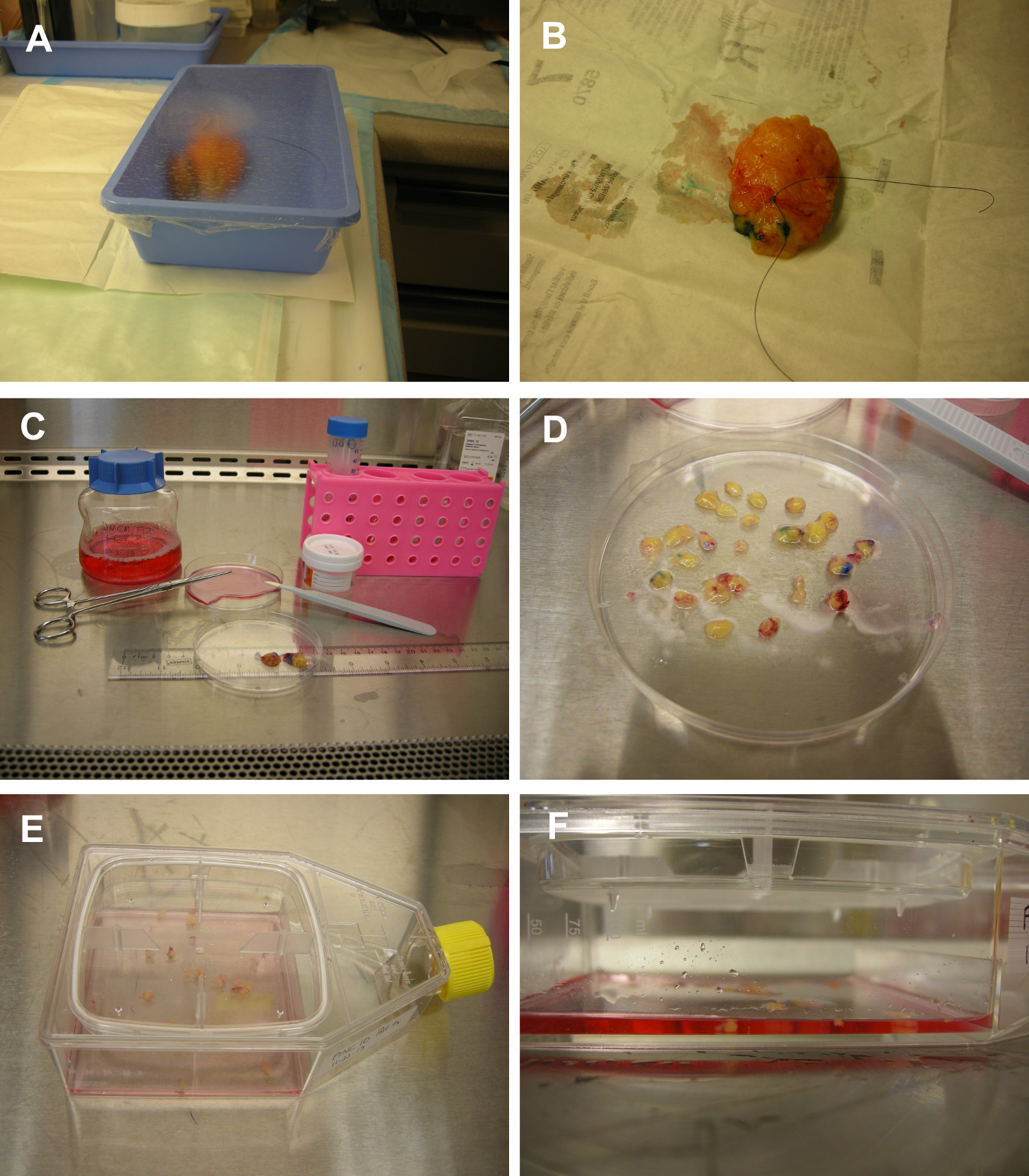
Figura 1. Fluxo de trabalho para manter a esterilidade do tecido durante o exame radiológico e dissecção dos tecidos bruto. (A) Na sala de cirurgia, o tecido da mama (mastectomia amostra mostrado) é colocado em uma bandeja estéril e coberta com filme plástico estéril. O tecido pode ser visualizado directamente na bandeja de plástico. (B) Tecido extrapolação para identificar áreas de CDIS. De uso único apenas corantes orientação tecido são pintados na superfície do tecido, utilizando algodão estéril cotonetes com ponta. Household de vinagre branco destilado é vertida directamente sobre o tecido e colocados a hibridar com gaze de algodão estéril. (C & D) tecido da mama é transportado para o laboratório de cultura de tecidos em meio rico em nutrientes suplementado com antibióticos. Dissecção dos tecidos, para isolar as áreas de CDIS, é realizada utilizando luvas esterilizadas e lâminas / bisturis / tesoura. O tecido de carcinoma ductal in situ é cortado em múltiplas Organóides de cultura. (E & F) cultura in vitro de Organóides mamários. Carcinoma ductal in situ de tecido humano é colocado directamente em frascos de cultura de tecidos com tampas removíveis, sem prévia digestão enzimática do tecido. Uma quantidade mínima de meio de cultura livre de soro suplementado com factor de crescimento epidérmico e insulina suporta o crescimento celular enquanto se mantém uma interface ar-líquido em torno do organ�de."Target =" _ 6fig1highres.jpg blank "> Clique aqui para ver uma versão maior desta figura.
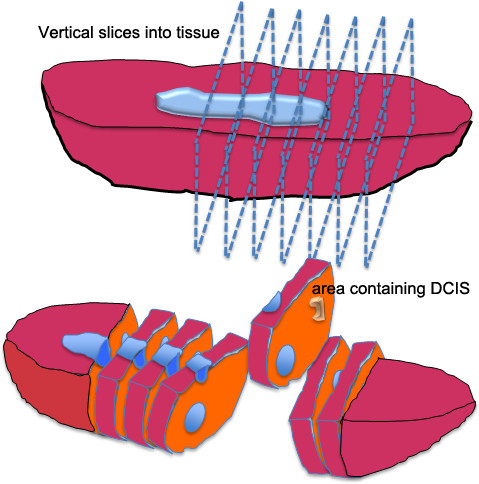
Figura 2. Ilustração de processamento de tecidos brutos para o tecido CDIS de mama. A lumpectomia ou mastectomia tecido é cortado em lâminas finas cortando o tecido na vertical, sem cortar todo o caminho através do espécime. Este método de dissecação é muitas vezes referida como "técnica de pão de forma", já que o tecido corte se assemelha a um pedaço de pão. A área (s) suspeito de conter DCIS são cortadas e cortadas em 2-3 fatias mm para patologia de diagnóstico e cultura organóide.
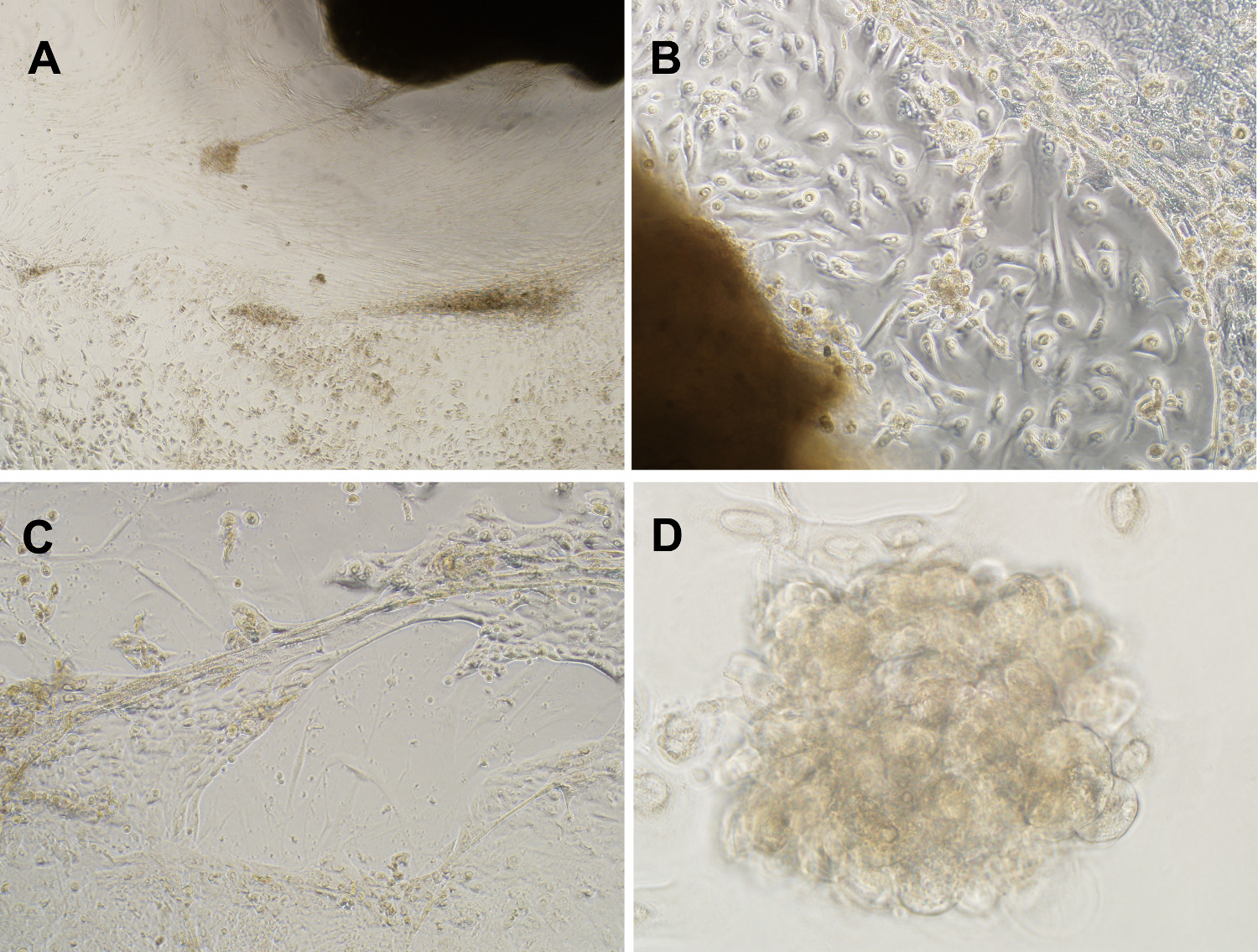
Figura 3. Um tipo de cultura celular mistamantém representante nas populações de células vivo. (A) imagem de contraste de fase de cultura de células mista gerada a partir de mama DCIS lesões ao longo de 11 semanas (ampliação 4x). (B & C) In vitro organóide cultivo com sucesso propagada DCIS derivados células epiteliais com crescimento independente de ancoragem, definidas como crescimento para cima e mammospheres expansão e lobulada, formações em 3-D de condutas semelhantes, em meio sem soro suplementado com EGF, insulina, estreptomicina e gentamicina (ampliação de 10X). (D) Exemplo mammosphere formado após 11 semanas em cultura (aumento de 40 vezes). Por favor, clique aqui para visualizar uma versão maior desta figura.

Figura 4. espontâneaformação de mammospheres na cultura organóide sem soro. Um exemplo formação mammosphere após 33 dias de cultura (ampliação de 10x, 20x inserção). Por favor, clique aqui para ver uma versão maior desta figura.
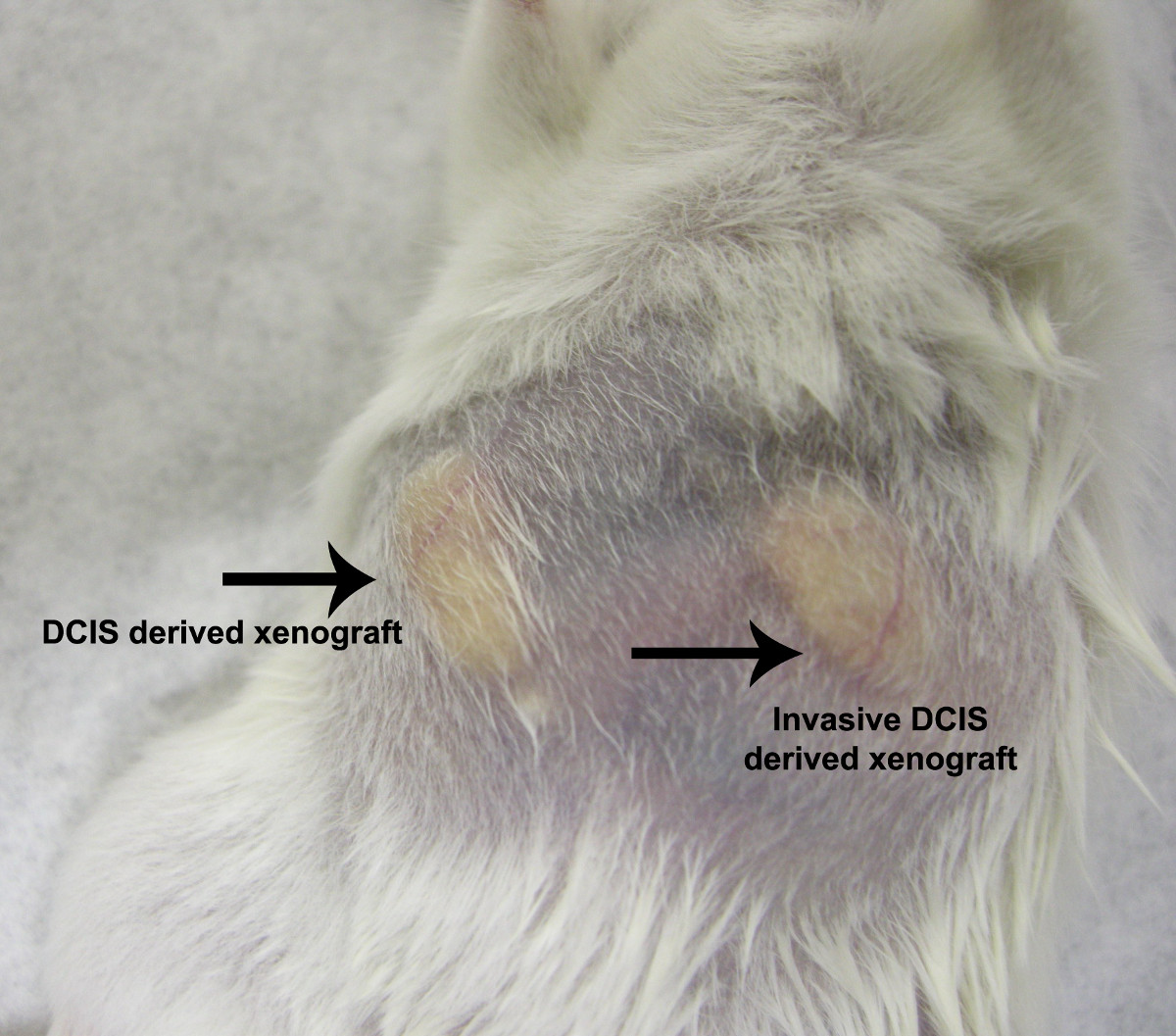
Figura 5. NOD / SCID mouse modelo de xenotransplante. Xenoenxertos foram geradas pela injeção de células epiteliais derivadas de um paciente com diagnóstico de carcinoma ductal in situ (botão direito do mouse pad mamário de gordura) ou a partir de um paciente com diagnóstico de carcinoma ductal in situ invasivo (mouse pad esquerda gordura mamária). Xenoenxertos derivados de ambos puro DCIS e invasivo DCIS revelou um padrão de crescimento semelhante e taxa. Por favor clique aqui para ver uma versão maior de tsua figura.
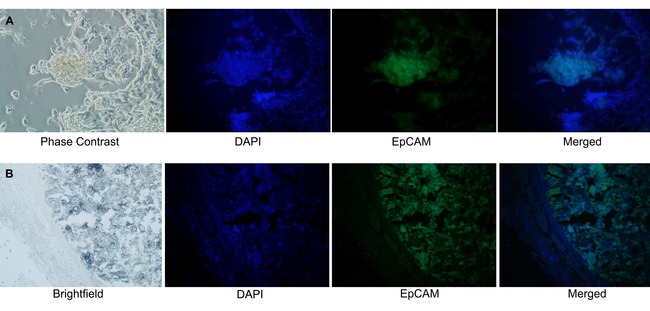
Figura 6. Mammospheres são confirmadas como sendo de origem epitelial. Imunofluorescência com anticorpos anti-EpCAM conjugado com FITC foi utilizada para confirmar a origem epitelial da mammospheres e xenoenxertos de rato gerada a partir de ductos mamários contendo DCIS. (A) células positivas EpCAM-FITC (pseudo de cor verde, 488 nm) foram observados em mammospheres das culturas de células mistas que emanam Organóides mama (DAPI (pseudo-colorida azul, 408 nm) corante nuclear). (B) Em secções de tecido embebidos em parafina de xenoenxerto de ratinho fixadas em formalina, EpCAM positiva As células foram detectadas apenas no centro da secção do tumor de xenoenxerto. (Ampliação de 20X) Por favor, clique aqui para ver uma versão maior desta figure.
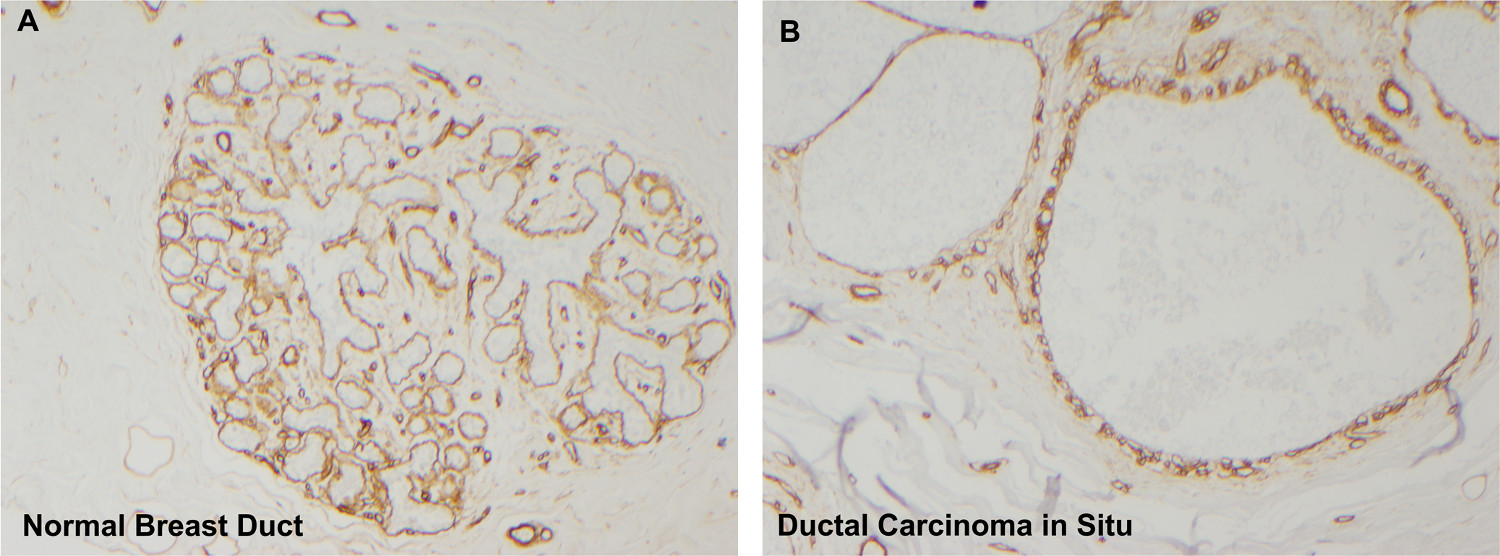
Figura 7. O colágeno IV imunohistoquímica revela membranas basais intactas circundantes dutos. Ductos mamários normais (A) estão rodeados por membranas basais intactas enriquecidos em colágeno IV (diaminobenzidina = coloração marrom). Após cultura organóide, tecido mamário também contém membranas basais intactas confirmando que os mammospheres são derivados de áreas de CDIS e não de câncer invasivo (colágeno IV imunohistoquímica, o painel A ampliação de 4X, 10X painel B). Por favor, clique aqui para ver uma versão maior esta figura.
Discussão
O sistema de cultura aqui descrito constitui um novo modelo para a geração de células mamárias neoplásicas vivos pré-invasivas para estudos básicos e Pesquisa Translacional. No passado, a pré-maligno de progressão do cancro da mama tem sido tipicamente estudada usando três métodos diferentes. O primeiro método é histopatológico e análise genética de amostras microdissecadas humanos congelados ou fixados 12-14. O segundo método utiliza modelos de mouse que contêm nódulos alveolares (HAN) lesões hiperplásicas que são pensados para ser semelhante a lesões mamárias pré-invasivas humanos 15. O terceiro modelo usa estabeleceu linhas de células de carcinoma de mama, como sublines MCF-7 (MCF10A) que têm um DCIS altamente diferenciados, como morfologia 3,4. Embora estes três modelos forneceram pistas moleculares para a progressão do cancro da mama, nenhum destes métodos é capaz de avaliar o potencial maligno ou o fenótipo da lesão molecular no (s) de um paciente individual. Histopathanálise ologic não fornece informações sobre o fenótipo funcional das células nas lesões pré-invasivas. O modelo do rato de progressão do câncer de mama podem não refletir com precisão o histomorfologia e diversidade de hiperplasia ductal atípica humano, carcinoma lobular in situ e carcinoma ductal in situ 16-18. Além disso, o microambiente estromal ea deposição de lesões precursoras do mouse ao redor da matriz extracelular são marcadamente diferente da contraparte humana 16. Lesões precursoras murino espontâneas podem apresentar um nível muito baixo de progressão para invasão e metástase. O terceiro método, as linhas de células cultivadas, pode fornecer apenas informações fenotípicas funcional se transplantadas para imunes anfitriões suprimidos 3,4. Além disso, as anormalidades genéticas de uma linha celular de longa passadas podem não representar espontânea progressão do cancro da mama em seres humanos 2. Finalmente, está bem estabelecido que a neoplasia de cada pacientetem uma combinação única de alterações genéticas e epigenéticas que impulsionam a taxa de crescimento, estado diferenciado, e progressão para invasão e metástase 13,14,17. Lesões pré-invasivas humanos são multifocal e heterogêneo na composição celular e histomorfologia. Além disso, o potencial maligno biológico é desconhecido para lesões pré-invasivas de um paciente individual.
O nosso método de cultura de tecido primário ultrapasse as deficiências dos modelos anteriores de cancro da mama pré-invasivo humano e fornece as seguintes vantagens: 1) O sistema de cultura organ�de suporta o crescimento de populações de células neoplásicas dentro do microambiente do tecido nativo que crescem espontaneamente e gerar mammospheres que produzirão tumores invasivos em modelos de rato de xenotransplante. As células representam o genótipo e o fenótipo de um paciente individual e, assim, proporcionar informações para a terapia personalizada, ou o prognóstico individual. 2) O sistema de cultura maint organ�deAINS as subpopulações celulares nativas e proporciona um meio para cultivar células não-malignas epiteliais, células estromais e células imunitárias originalmente presentes no tecido da mama primário, e levado para dentro da cultura organ�de. O baixo volume de mídia no sistema de cultura suporta a troca de oxigênio incentivando a formação espontânea mammosphere e conduta diferenciada e alvéolos como estruturas sem a necessidade de um andaime de três dimensional artificial. 3) A cultura celular primária é gratuita a partir de modificações e seleção gerados por dissociação enzimática ou modificação genética exógena. Além disso, o meio nutriente é de baixo custo e simples de preparar. 4) Análise molecular e genética pode ser realizada em populações de células específicas e / ou Organóides a partir da cultura em diferentes pontos no tempo, sem interromper toda a cultura. 5) O sistema de cultura organóide permite o crescimento, morfologia diferenciada e célula-célula interações das populações de células nativas que podemser estudados antes e após a introdução de agentes terapêuticos para o meio de cultura.
Embora a cultura de tecido primário tem certas vantagens, não é sem limitações. A cultura organóide suporta o crescimento de culturas de células mistas, sem crescimento de qualquer tipo de célula. No entanto, a proporção específica de tipos de células não pode ser controlada e, portanto, não podem recapitular as proporções exactas celulares encontrados in vivo. Cultivo organóide bem sucedida requer coleta de tecido estéril e processamento, sendo que ambos não são procedimentos de rotina em muitos laboratórios de patologia do hospital da comunidade. Uma boa comunicação entre os pesquisadores clínicos, a equipe cirúrgica e equipe patologia são essenciais para manter a esterilidade da amostra dentro do continuum de atendimento ao paciente.
Uma outra limitação da cultura organ�de é o efeito do substrato firmeza sobre o fenótipo celular e a expressão do gene 16,19. Diferenciação de células-tronco em culturapode ser induzido pela adição de meio contendo soro ou pode ser devido ao longo tempo em cultura. Um fenótipo tronco-like foi mantida após vários meses neste, sistema de cultura organóide sem soro não-enzimática 5. No entanto, em algum ponto no tempo, as células podem diferenciar o que pode ser visto morfologicamente - as células tornam-se menores, mais denso, e não conseguem formar mammospheres. Para evitar potenciais problemas com as alterações no fenótipo celular ao longo do tempo, experiências moleculares, tais como transfecções ou knock down ensaios, deve ser realizado com culturas jovens, em vez de com culturas velhas (mais de 6 meses).
As chaves para a cultura bem sucedida organ�de são usando um volume apropriado de meio de cultura no balão, e permitindo que o tempo Organóides a aderir ao frasco de cultura de tecidos. Excesso médio na difusão limites balão de oxigênio, inibindo a formação mammosphere. Os primeiros 3-7 dias de cultura de tecidos são críticas para os Organóides para anexar ao tisprocessar garrafa de cultura. Em geral, se um organ�de não tem anexado ao dia 14, é provável que não contém quaisquer segmentos ductais DCIS viáveis e não se tornar aderente. Organóides que não são aderentes ao dia 14 deve ser removida a partir da cultura. A falta de condutas DCIS mamários viável pode ser verificado a seguir cultura, fixando o organóide em formalina a 10% e o processamento do tecido em blocos de parafina para a coloração de tecidos e análise microscópica.
O nosso não-enzimática, os resultados do sistema de cultura isento de soro suporta a hipótese de que as células precursoras neoplásicas geneticamente anormais com potencial invasivo existir dentro de lesões da mama humano pré-invasivos 5,9,20. Este achado está de acordo com o trabalho anterior de Sgroi et al., Que realizou a análise genética das lesões pré-invasivas de mama humano e Damonte et al., Que estudaram o crescimento mamário neoplasia intra-epitelial (MINO) modelo murino de progressão do câncer de mama 12,14 , 21. Toge Tomadother com as conclusões dos outros, o nosso modelo de cultura de lesões pré-invasivas paciente individual apóia o conceito de que o fenótipo agressivo de câncer de mama invasivo do paciente pode ser em grande parte pré-determinada na fase pré-invasiva.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado parcialmente por (1) o Departamento de Defesa Breast Cancer Research Programa (US Army Medical Research Aquisição Atividade) prêmio # W81XVVH-10-1-0781 a LAL e VE, e (2) a concessão Susan G. Komen Foundation IR122224446 para Lal e VE. Apoio Patologia e bilheteria tecido foi gentilmente cedido pela Inova Fairfax Departamento de Patologia, Dr. Hassan Nayer, Dr. Gita A. Menezes e Dr. Charles Bechert. Consentimento dos pacientes e obtenção da amostra foi habilmente guiados por Inova Fairfax Hospital coordenadores da pesquisa clínica Holly Gallimore, Heather Huryk, e Emil Kamar.
Materiais
| Name | Company | Catalog Number | Comments |
| Ethanol | Fisher | A405-P | prepare a 70% solution in Type 1 reagent grade water |
| 18 MΩ-cm water, sterile filtered | sterile filtered, Type 1 reagent grade water | ||
| 10 cc plastic disposable syringe, sterile | BD | 305482 | |
| 0.2 µm polyethersulfone (PES) syringe filter, sterile | Thermo Scientific | 194-2520 | |
| 15 ml polypropylene conical tubes, sterile | Fisher | 14-959-49B | |
| 50 ml polypropylene conical tubes, sterile | Fisher | 05-539-6 | |
| 1.5 ml low retention microcentrifuge tubes, sterile | Fisher | 02-681-331 | |
| nutrient medium, DMEM-F12/HEPES | Invitrogen | 11330-032 | with L-glutamine |
| Insulin, human recombinant | Roche | 11376497001 | 10 mg/ml stock |
| Epidermal Growth Factor (EGF), human recombinant | Millipore | GF144 | 100 µg/ml stock |
| Streptomycin sulfate | Sigma-Aldrich | S1567 | 10 mg/ml stock |
| Gentamicin sulfate | Sigma-Aldrich | G19114 | 10 mg/ml stock |
| Filtration flask and filter top, sterile | Millipore | SCGPU02RE | 0.22 µm PES membrane |
| 25 ml sterile, disposable pipettes | Fisher | 4489 | paper-plastic wrapped |
| 10 ml sterile, disposable pipettes | Fisher | 4488 | paper-plastic wrapped |
| Tissue marking dyes (black, blue, red, green, yellow and orange) | CDI | MD2000 | after opening use only with single-use, sterile cotton tipped applicators, or use once and discard |
| Cotton tipped applicators, sterile | Fisher | 23-400-115 | single use only |
| Gauze pads, 10 x 10 cm, sterile | Fisher | 2187 | |
| Plastic transfer pipettes, sterile, disposable | Samco | 202-20S | |
| Vinegar, white distilled | household use | 5% acetic acid; after opening use only with sterile pipettes | |
| #10 scalpels, sterile, disposable | Thermo Scientific | 31-200-32 | |
| Petri dish, sterile | Fisher | FB0875713A | |
| TPP 115 cm2 flask, with removable lid | MidSci | 90652 | screw cap with filter |
| CO2 incubator | Fisher | 13-998-074 | 5% CO2, 37 °C, humidified chamber |
| inverted light microscope | Olypmus | IX51 | |
| 8 M urea | Fisher | BP169-500 | optional, for mass spectrophotometric analysis of cultured cells |
| 2X SDS tris-glycine buffer | Life Technologies | LC2676 | optional, for proteomic analysis of cultured cells |
| Cytocentrifuge | Thermo Scientific | A78300003 | optional, for preparing cell smears |
Referências
- Shaughnessy, J. A., et al. Treatment and prevention of intraepithelial neoplasia: an important target for accelerated new agent development. Clin Cancer Res. 8 (2), 314-346 (2002).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Behbod, F., et al. An intraductal human-in-mouse transplantation model mimics the subtypes of ductal carcinoma in situ. Breast Cancer Res. 11 (5), (2009).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Espina, V., et al. Malignant precursor cells pre-exist in human breast DCIS and require autophagy for survival. PLoS One. 5 (4), (2010).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes Dev. 17 (10), 1253-1270 (2003).
- Farnie, G., et al. Novel cell culture technique for primary ductal carcinoma in situ: role of Notch and epidermal growth factor receptor signaling pathways. J Natl Cancer Inst. 99 (8), 616-627 (2007).
- Wicha, M. S., Liotta, L. A., Garbisa, S., Kidwell, W. R. Basement membrane collagen requirements for attachment and growth of mammary epithelium. Exp Cell Res. 124 (1), 181-190 (1979).
- Espina, V., Liotta, L. A. What is the malignant nature of human ductal carcinoma in situ. Nat Rev Cancer. 11 (1), 68-75 (2011).
- Gong, C., et al. Beclin 1 and autophagy are required for the tumorigenicity of breast cancer stem-like/progenitor cells. Oncogene. 32 (18), 2261-2272 (2012).
- Simon, B., et al. Epithelial glycoprotein is a member of a family of epithelial cell surface antigens homologous to nidogen, a matrix adhesion protein. PNAS. 87 (7), 2755-2759 (1990).
- Ma, X. J., et al. Gene expression profiles of human breast cancer progression. Proc Natl Acad Sci U S A. 100 (10), 5974-5979 (2003).
- Schnitt, S. J., Harris, J. R., Smith, B. L. Developing a prognostic index for ductal carcinoma in situ of the breast. Are we there yet. Cancer. 77 (11), 2189-2192 (1996).
- Sgroi, D. C. Preinvasive breast cancer. Annu Rev Pathol. 5, 193-221 (2010).
- Asch, H. L., Asch, B. B. Heterogeneity of keratin expression in mouse mammary hyperplastic alveolar nodules and adenocarcinomas. Cancer Res. 45 (6), 2760-2768 (1985).
- LaBarge, M. A., Petersen, O. W., Bissell, M. J. Of microenvironments and mammary stem cells. Stem Cell Rev. 3 (2), 137-146 (2007).
- Smart, C. E., et al. In vitro analysis of breast cancer cell line tumourspheres and primary human breast epithelia mammospheres demonstrates inter- and intrasphere heterogeneity. PLoS One. 8 (6), (2013).
- Vaillant, F., Asselin-Labat, M. L., Shackleton, M., Lindeman, G. J., Visvader, J. E. The emerging picture of the mouse mammary stem cell. Stem Cell Rev. 3 (2), 114-123 (2007).
- Kim, D. H., et al. Actin cap associated focal adhesions and their distinct role in cellular mechanosensing. Sci Rep. 2, 555 (2012).
- Espina, V., Wysolmerski, J., Edmiston, K., Liotta, L. A. Attacking breast cancer at the preinvasion stage by targeting autophagy. Women's Health. 9 (2), 1-14 (2013).
- D'amonte, P. Mammary carcinoma behavior is programmed in the precancer stem cell. Breast Cancer Res. 10 (3), (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados