Method Article
비 효소, Mammospheres의 자연 발생에 대한 사전 침습 유방 병변의 혈청이없는 조직 문화
요약
손상 조직을 사용 organoids 차 세포 배양은 다세포 생체 내 미세 환경을 모방 모델 시스템을 제공한다. 우리는 효소 조직을 중단하지 않고 형태를 차별화 혼합 세포 배양 계통 및 전시회를 영속 무 혈청 차 유방 상피 조직 배양 모델을 개발했다. 유방 organoids>는 6 개월 가능한 남아있다.
초록
동일계 (DCIS)의 유방 유관 암종, 정의에 의해, 아교질 기저막을 위반하지 않고, 유방 덕트의 범위 내에서 종양의 상피 세포의 증식이다. DCIS는 침습적 유방암에 비 의무적 인 전구체이지만, 침습적 암의 진행을 허용하는 분자 메커니즘 및 세포 인구는 완전히 알려져 있지 않다. 침공 할 수있는 전구 세포가 DCIS 세포 인구 내에서 존재 여부를 확인하기 위해, 우리는 조직의 효소 중단하지 않고, 수술시 무균 인간의 유방 조직을 수집 및 배양 방법을 개발했다.
유관 분야를 포함하는 무균 유방 조직은 일상 병리 검사 다음과 같은 수술 적 절제 유방 조직에서 수확된다. DCIS 함유 조직은 조직 배양 실험실 풍부한 영양소, 항생제 - 함유, 무 혈청 배지에 넣고, 반송된다. 유방 조직은 더 dissecte입니다d는 석회화 된 영역을 분리한다. 다중 유방 조직 조각 (organoids)는 가습 CO 2 인큐베이터에서 이동식 뚜껑과 함께 배양 플라스크에서 무 혈청 배지의 최소 부피에 배치된다. 14 일 - 상피 세포와 섬유 아세포 세포 인구 10 후 organoid에서 등장. 자연에 형성 상피 세포 단층 주변 Mammospheres. 특정 세포 집단은 인접 셀에 영향을주지 않고 플라스크에서 직접 수확 할 수 있습니다. 우리의 비 효소 조직 배양 시스템은 안정적으로 신선한 인간 DCIS 병변에서 세포 유전 학적 이상, 침습성 전구 세포를 보여준다.
서문
유방 덕트 및 폐포 (현장에서 유관 암)의 범위 내에서 상피 세포의 증식은 침윤성 및 소엽 유방암에 대한 의무적 인 전구체로 인식되고 있습니다. 그럼에도 불구하고, 침윤성 암으로의 진행을 허용하는 분자 메커니즘 및 세포 집단 역학은 제대로 이해된다. 사전 침윤성 유방암 세포, 또는 임의의 미리 침습적 종양에서 사용 생존 메커니즘을 해명하기 죽이고, 심지어 사전 침습적 종양 1 방지용 치료 전략을 밝힐 수있다. 그러나, 기능적으로 공부 인간의 사전 침입 병변에 대한 간단한 저가의 방법이 결여되어있다. 형질 전환 된 세포주의 생체 외 단층 배양 확립 된 실험에있어서, 이러한 불멸화 세포주의 표현형과 유전자형이지만 일차 인간 종양 세포 (2)의 분자 상태를 요점을 되풀이하지 못한다. 또한, 심지어 비 - 발암 MCF-10A 세포주 어느 RECApitulates 3-D 유선 아키텍처는 적절하게 기능 표현형과 개별 환자의 사전 침습 유방 병변 3,4의 분자 특성을 표현하기 위해 실패합니다.
침공 할 수있는 줄기 같은 종양 세포가 현장 (DCIS) 세포 인구의 유관 암에서 존재 여부를 확인하기 위해, 우리는 (그림 1) (5) 수집 및 수술시 무균 인간의 유방 조직을 배양하기위한 방법론을 개발했다. 우리의 생체 가슴 organoid 문화 시스템은 분리하고 신선한 인간의 유방 유관 암 조직 6-8에서 mammosphere 형성 세포를 전파하기위한, 효소 조직 중단, 기저막 추출물 매트릭스, 또는 섬유 아세포 고갈에 의존하지 않습니다. 우리의 새로운 시스템은 셀 스트리밍 / 이주 (5)의 원리에 기초한다. 식별 유방 덕트 및 주변 기질 무 혈청 영양 배지 (단지 예 최소 체적에 빠져들배지에 노출 덕트의 절단면과, 가스 교환을 최대화하지만 플라스크 (도 1E-F)의 구체적인 배향하는) 덕트 단편을 덮도록, 계속하지. 이 문화 시스템은 세포가자가 기질과 문화 플라스크 위에 덕트에서 그리고 /로 마이그레이션 할 수 있습니다. 단지 표피 성장 인자 (EGF), 인슐린, 항생제로 보충 영양 배지는 organoid에서 냄새가 나는데 혼합 세포 집단의 성장을 지원합니다. 조직 배양 플라스크를 멸균 습한 환경을 유지하면서, organoids 및 / 또는 세포 전체 플라스크 또는 이웃 organoids 중단없이 수확 할 수 있도록 분리형 재 밀봉 가능한 뚜껑을 갖는다.
프로토콜
인간의 유방 조직은 국방부, 조지 메이슨 대학 (George Mason University), 그리고 이노 바 헬스 시스템 심사위원회 (Institutional Review Board)의 승인 된 프로토콜에 따라, 동의서로, 연구 대상으로 환자로부터 수집되었다.
1. 성장 인자와 항생제와 영양 리치 미디어를 준비
- 인슐린의 원액, 표피 성장 인자 (EGF), 황산 스트렙토 마이신 및 젠타 마이신 설페이트를 준비한다.
- 10 ㎎ / ㎖의 최종 농도로 멸균 여과 물에서 인슐린을 재생성. 멸균 10 ㎖의 일회용 주사기에 1 시약 등급의 물을 기음은 10 ml의. 주사기에 0.22 μm의 폴리 에테르 설폰 필터를 연결합니다. 멸균 15 ML 원뿔 튜브에 멸균 여과 물을 분배.
- 인슐린의 100 mg을 유리 병에 무균 여과 물 10ml를 추가합니다. 볼텍스 믹서 간략 내용을 섞는다. 얼음에 인슐린 병을 유지합니다. 인슐린 스톡 SOLU 450 μl를 분배-20 ° C에서 라벨, 멸균의 microcentrifuge 튜브 및 저장소로 기. 인슐린 원액 바이알에 만기일까지 안정하다.
- 표피 성장 인자 (EGF)의 주식 솔루션을 준비 : 500 μg의 EGF (주 1 ㎍ / μL)에 500 μL를 멸균 물을 추가합니다. 볼텍스 믹서 간략 내용을 섞는다. 얼음에 EGF의 병을 유지합니다.
- EGF의 작업 원액을 준비 : 900 μL 영양 배지 (일 주식 / μL 0.1 μg의 예정)에 주식 EGF 솔루션의 100 μl를 추가합니다. 볼텍스 믹서 간략 내용을 섞는다. -80 ° C에서 EGF 근무하는 표시, 멸균 마이크로 원심 튜브에 솔루션 및 저장의 50 μl를 분배.
참고 : EGF 원액 (1 ㎍ / μL)는 -80 ° C에서 1 년 동안 안정적이다; 원액 (0.1 ㎍ / μL)를 작업하는 -80 ° C에서 2 개월 동안 안정하다.
- EGF의 작업 원액을 준비 : 900 μL 영양 배지 (일 주식 / μL 0.1 μg의 예정)에 주식 EGF 솔루션의 100 μl를 추가합니다. 볼텍스 믹서 간략 내용을 섞는다. -80 ° C에서 EGF 근무하는 표시, 멸균 마이크로 원심 튜브에 솔루션 및 저장의 50 μl를 분배.
- 분석 저울에 스트렙토 마이신 황산염 40 mg의 무게가 나간다. 스트렙토 마이신 황산염 INT 배치OA 멸균 15 ML 원뿔 튜브. 영양 배지 4 ML을 추가합니다. 볼텍스 믹서 간략 내용을 섞는다. 이 솔루션은 약간 분홍색이어야한다. 4 ° C에서 보관은 빛으로부터 보호. 스트렙토 마이신 설페이트 용액을 7 일간 안정하다.
- 분석 저울에 겐타 마이신 황산염 20 mg의 무게. 멸균 15 ML 원뿔 튜브에 황산 젠타 마이신을 놓습니다. 영양 배지 2 ㎖를 추가합니다. 볼텍스 믹서 간략 내용을 섞는다. 이 솔루션은 노란색이어야한다. 4 ° C에서 보관은 빛으로부터 보호. 황산 젠타 마이신 용액을 7 일간 안정하다.
- (20 (. 100 ㎍ / ml의 최종 진한), (. 10 ㎍ / ml의 최종 진한), (. 10 NG / ml의 최종 진한) 스트렙토 마이신 황산 인슐린을 인간 재조합 EGF와 보충 영양 배지의 두 개의 200 ml의 배치를 준비하고 겐타 마이신 황산염 ㎍ / ml의 최종 농.).
- 0.2 μm의 폴리 에테르 설폰 필터 플라스크가 장착 된 진공 필터 플라스크에 250 ml의 수신 병에 200ml의 영양 배지를 추가합니다. 추가 20# 181; L 근무하는 EGF, 200 μL 스톡 인슐린, 2 ml의 주식 스트렙토 마이신 황산염, 및 영양 배지의 200 ml의 400 μL 재고 겐타 마이신 황산염. 진공 필터 플라스크를 연결합니다. 매체를 필터링합니다. 필터를 취소하고 "영양이 풍부한 매체"로 플라스크 레이블. 최대 14 일 동안 4 ° C에 보관하십시오.
2. 조직 수집 및 매출 동시
- 운영 제품군에서, 유방 조직을 조달 한 후 멸균 기술을 유지한다. 살균 트레이에 유방 조직을 배치하고 멸균 플라스틱 포장 트레이 커버.
- 당신의 기관이 필요에 따라 방사선 / 병리학에 해당 트레이에있는 조직을 운반. 트레이를 열지 마십시오. 전송 시간은 기관 내에서 다릅니다. 조직은 최대 45 분 후 절제에 대한 RT에서이 덮여 트레이에 실행 가능한 남아있을 수 있습니다. 그러나, 영양이 풍부한 매체로 조직의 신속한 처리 이후 organoid 문화에 대한 최적의 조건을 제공합니다.
- 총 조직 절개는 유방 조직 내에서 DCIS의 영역을 식별하기 : 조직 불임을 유지하기 위해 조직의 박리시 멸균 장갑, 블레이드, 메스, 조직 마킹 염료, 식초를 사용합니다.
- 70 % 에탄올 1 % 표백제와 작업 영역을 청소합니다. 멸균 장갑을 열고 작업 표면에 장갑 래퍼를 배치합니다. 장갑 래퍼 얼굴 위로의 멸균 내부를 놓습니다. 멸균 장갑을 착용 할 것.
- 70 % 에탄올로 시료 용기의 표면을 청소. 조직 표본 용기의 플라스틱 포장을 제거하고 장갑 래퍼에 시편을 배치합니다.
- 조직 표시 염료로 두면 스쳐 면봉을 찍어. 조직 표면에 걸쳐 면봉 압연하여 조직의 표면에 염료를 적용.
참고 : 각 병리 부서는 표준화 된 염료 색상 / 조직 방향 프로토콜을 가지고있다. 조직은 환자에서의 위치와 관련하여 조직의 방향을 염료로 표시됩니다. 염료 도말되거나조직에 그렸다. 조직을 통해 염료를 부어하지 마십시오. 염료를 붓는 염료 따라서 절제의 방향을 혼란 조직 틈새로 / 실행 똑 될 수 있습니다. 조직 배향 외과에 해부학과 병리학) 조직 표본을 설명하고, b) 종양 관련 절제면의 위치를 결정을 제공한다. - 멸균 거즈 패드에 증류 식초 (5 % 아세트산)을 붓는다. 식초를 적신 거즈로 염색 된 조직을 오 점. 거즈를 폐기하십시오. 식초는 염료 마킹 조직을 고정하는 데 사용됩니다.
- 약 5 mm 두께의 수직 조각으로 유방 조직을 잘라. 조직 (그림 2)을 통해 모든 방법을 절단하지 마십시오. / 관찰 석회화의 영역에 대한 조직을 촉진하다. 자신의 특성 회사가 DCIS 병변을 확인, 붉은에 둘러싸인 모습 창백한 (때문에 칼슘의 spicules에) 껄끄 러운 느낌을 고무 테두리.
NOTE : 일부 경우에, 여드름 (여드름 같은) 영역 일 수있다큰 직경 DCIS 병변에서 괴사 물질을 나타내는 흰색 점으로 볼. - 유방 조직 주변의 작은 금액을 포함, DCIS / 석회화 유방 조직의 영역을 잘라. 단계 1에서 제조 한 영양이 풍부한 배지 20-30 ml를 함유하는 멸균 50 ㎖ 튜브에 유방 조직을 놓는다.
- 조심스럽게 튜브를 수회 반전시켜 조직 및 매체를 섞는다. 매체를 취소하고 새로운 배지를 추가합니다. 단열 용기 내로 조직 및 배지를 함유하는 튜브를 삽입하고 조직 배양 실험실로 수송 조직.
- 70 % 에탄올 1 % 표백제와 작업 영역을 청소합니다. 멸균 장갑을 열고 작업 표면에 장갑 래퍼를 배치합니다. 장갑 래퍼 얼굴 위로의 멸균 내부를 놓습니다. 멸균 장갑을 착용 할 것.
3. 조직 문화
- 생물 안전 캐비닛에서 작업, 조직 및 멸균 페트리 접시에 영양 배지의 작은 금액을 붓는다. 멸균 메스가 절단 및 섬유 조직을 폐기 사용. 조각 (organoids)로 유방 조직 약 3mm 2 (그림 1C-D)를 잘라. 조직을 절단하려고 있도록 각 기관OID 주변 기질과 적어도 하나의 뚜렷한 덕트 세그먼트가 포함되어 있습니다.
- 조직 배양 플라스크의 뚜껑을 엽니 다. 멸균 핀셋이나 집게를 사용하여 플라스크에 organoids를 놓습니다. 뚜껑을 닫습니다. 페트리 접시를 폐기하십시오.
- 조직 배양 플라스크에 11 ㎖의 무 혈청 배지 영양이 풍부한 (단계 1에서 제조)를 첨가. 플라스크를 닫고 organoids 중간 균등 플라스크 표면 (그림 1E-F)에 분산되도록 플라스크 소용돌이 친다.
- 2 일 동안 가습 5.0 %의 CO 2 분위기하에 37 ° C에서 플라스크를 인큐베이션. 이 시간 동안 플라스크를 이동하지 마십시오.
- 2 일 후 배양에서 잠재적 인 세균 / 곰팡이 오염을 확인하기 위해 인큐베이터에서 플라스크를 제거합니다. 플라스크의 갑작스런 날카로운 움직임, 또는 소용돌이를 피하십시오. 거꾸로 현미경 무대에서 플라스크를 놓습니다.
- 박테리아, 효모, 및 / 또는 곰팡이에 대한 매체를 관찰합니다. 어떠한 오염이 관찰되지 않는 경우, 추가 동안 인큐베이터로 플라스크를 반환itional 일. 오염이 언급되는 경우, 적당한 용기에 플라스크 내용물을 폐기.
- 3 일 후 배양에서 신선한 매체와 조정 배지를 교체합니다.
- 20 ~ 30 분 동안 37 ° C에서 멸균 튜브에 배지 11 ml에 놓습니다. 인큐베이터에서 조직 배양 플라스크를 제거합니다. organoids을 방해하지 않고, 제거하고 멸균 혈청 피펫을 사용하여 플라스크에 매체를 폐기합니다.
- 새로운 멸균 혈청 피펫을 사용하여 미리 예열 신선한 배지 11 ml에 추가합니다. 아주 조심스럽게 플라스크의 표면을 가로 질러 매체를 배포하는 플라스크를 회전.
- 가습 5.0 % CO 2 분위기에서 37 ° C에서 플라스크를 품어.
설립 Organoid / 상피 세포 콜로니 4. 유지 보수
- 매 2 주마다 새로운 배지를 준비하고 조직 배양 플라스크에 일주일에 3 번 미디어를 교체합니다.
- 37 멸균 용기에 배지 11 ml에 배치20 ~ 30 분 동안 C를 °. 인큐베이터에서 플라스크를 제거합니다. 멸균 혈청 피펫을 사용하여 제거하고 organoids을 방해하지 않도록주의, 플라스크에서 조정 배지를 폐기합니다.
- 새로운 멸균 혈청 피펫을 사용하여 미리 예열 신선한 배지 11 ml에 추가합니다. 아주 조심스럽게 플라스크의 표면을 가로 질러 매체를 배포하는 플라스크를 회전. 가습 5.0 % CO 2 분위기에서 37 ° C에서 플라스크를 품어.
- 10 후 - 문화에서 14 일, 부착하지 않은 문화 플라스크에서 조직의 조각을 제거합니다.
- 이종 이식 이식 주기적으로 수확 세포 및 / 또는 새로운 배양 플라스크에 전파 플라스크에서 organoids, 또는 표현형 및 / 또는 분자 분석.
- 인큐베이터에서 조직 배양 플라스크를 제거합니다. 70 % 에탄올로 플라스크 스프레이. 70 % 에탄올을 분무 된 깨끗한 종이 타월로 플라스크에 여분의 에탄올을 닦아.
- Organoid 전파 :
- 플라스크의 뚜껑을 열고 생물 안전 캐비닛의 뚜껑면이 위로를 놓습니다. 현미경 시각화에서 organoid (들)을 수확 할을 찾습니다. 픽업하기 위해 organoid을 멸균 핀셋이나 집게를 사용합니다.
- 새로운 문화 플라스크에 organoid을 전파하기 위해, 새로운 플라스크에 organoid을 배치합니다. 11 ml의 신선하고 따뜻한 매체를 추가합니다. 3.6.3 - 단계 3.3에 설명 된대로 가습 된 5 % CO 2 분위기에서, 37 ° C에서 품어. 조직 배양에서의 세포 배양 배지는 일주일에 3 회 교체 플라스크.
- 세포를 수확 :
- 직접 현미경 vixualization에서 부드럽게 긁어 및 기음 세포와 mammospheres은 멸균 일회용 피펫 팁 1,000 μL 피펫을 사용하여. 세포와 주변 매체를 대기음. 멸균 마이크로 원심 튜브에 세포 / 매체 분배.
- 5 초 동안 12,100 XG에서 미니 원심 분리기에 간단히 세포를 스핀. 제거하고 매체를 폐기합니다.
- DNA 분석을 위해 즉시 -80 ° C에서 장기간 저장하여, 매체 (10 μL)의 소량으로, 드라이 아이스에서 세포 펠렛을 동결.
- 단백질체 분석을 위해, 질량 분석법 또는 웨스턴 블 롯팅 / 역상 단백질 마이크로 어레이를위한 2X SDS 트리스 - 글리신 완충액 8 M 우레아 10 μL에 용균. 또한, 면역 조직 화학 분석을위한 세포 얼룩을 만들기 위해 cytocentrifuge에서 셀을 회전.
- 플라스크에서 세포를 채취 한 후, 제거하고 나머지 매체를 폐기합니다. 따뜻한, 신선한 영양이 풍부한 매체의 11 ML을 추가합니다. 가습 된 5 % CO 2 분위기에서 37 ° C로 플라스크를 인큐베이션.
결과
현장 조직에 멸균 유방 유관 암 조달 및 배양을위한 워크 플로우
유방 조직 불임은 전형적인 병원 병리학 워크 플로우의 작은 변화 (그림 1)를 통해 세포 배양 실험실로 수술실에서 유지됩니다. 조직은 조직을 무균 상태로 유지하면서 방사선 평가를 허용 플라스틱 필름 커버 멸균 용기에 운반된다. 유방 유방 종양 절제술 또는 유방 절제술 샘플의 총 조직 처리 멸균 장갑, 블레이드 및 조직 마킹 염료로 수행됩니다. 현장에서 유방 유관 암의 심한 형태 학적 외관은 붉은 색 / 노란색 고무 조직으로 둘러싸인 견실 한 / 회사 질감, 창백한, 약간 올라와 영역을 닮았다. 유관 증식과 DCIS 분야 인해 석회화에 "견실 한"과 회사를 느낄 수 있습니다. 유방 조직의 이러한 구역은 황갈색 또는 주변 유방 조직보다 약간 다른 색상으로 나타난다. 그러나, ADH의 C은 조직 수집 및 스테인드 조직 섹션의 병리학 적 검토를 거쳐 구별 될 수있다. 유방 조직 인간 재조합 EGF (10 ng의 / ㎖), 인슐린 (10 ㎍ / ㎖), 스트렙토 마이신 설페이트 (100 ㎍ / ml) 및 황산 젠타 마이신이 보충 된 무 혈청 영양 배지에서 조직 및 / 또는 도관 organoids 침지하여 생존 유지 (20 ㎍ / ㎖) 5. 이동식 / 재 밀봉 뚜껑 세포 배양 플라스크 세포 / organoids (그림 1E-F)을 주기적으로 수확을 허용합니다. 이 모델은 성공적으로 (N = 18)를 현장에서 20 개 이상의 비정형 유관 증식증으로 진단 된 환자 (N = 2) 및 유관 암에서 인간의 유방암 사전 침입 병변을 전파.
생체 외 및 생체 내에서 자연 mammosphere 형성
Mammospheres 및 3-D 구조 비정형 유관 하이퍼 진단 다른 환자들로부터 다수의 독립적 인 인간 DCIS 덕트 조직편으로부터 자발적으로 일어나현장에서 plasia 또는 유관 암 (그림 3, 4) 5,9. 유방 조직의 파괴 효소 전에 혼합 세포 유형의 배양 결과 조직 배양에 수행되지 않았다. 어느 혈청, 기저막 추출물, 나 젤 같은 행렬은 자연 mammosphere 형성 (그림 4)에 요구했다. mammospheres 침습성 암과 같은 성장 패턴 NOD / SCID 마우스 모델에서 (그림 5) 5 유선 이종 이식 종양을 생성합니다. 이러한 결과는 인간 유방 내에 미리 존재 전위 침습와 전구 세포가 덕트 DCIS 그러나 명백하게 유관 틈새가 체크에 유지되고 organoid 문화 나타나기 기른 될 수 있다는 것을 보여준다. 이 세포는 침입 표현형 5,9,10의 명백한 표현 이전에 존재 유방암 줄기 같은 세포의 새로운 카테고리를 구성한다.
상피 유래 mammospheres과 xenograf의 확인TS
mammospheres에서 파생 mammospheres과 이종 이식은 상피 기원을 가진 것으로 면역에 의해 확인되었다. 상피 세포 부착 분자 (는 EpCAM)의 상피 세포에서 발현 11 막 당 단백질이다. 인체는 EpCAM (녹색) 및 핵 염색 (DAPI, 블루)에 반응성 마우스 모노클로 날 항체로 면역 형광은 배양 mammospheres에서 (도 6A) 및 NOD / SCID 이종 이식 (도 6b)의 중심을는 EpCAM 양성 세포를 나타내었다.
그대로 기저막 경계 검증
관리 조직 병리학 적 진단 기준에 따라 독립적 인 병리학 적 분석에 의해 확인으로 mammosphere,이 문화 시스템에서 종양 상피 세포, 프랭크 침략 또는 microinvasion없는 있었다 사전 침습 유방 병변에서 파생되었다 형성한다. 같은 환자에서 여러 organoid 구조에 대한 mammosphere 생성종양 것으로 판명 명나라 식민지. 또한, organoid 문화에 사용되는 조직의 병리 조직 학적 검사는 그대로 기저막 경계 (그림 7B) 5와 합류 관내 병변를 한 것으로 밝혀졌습니다. 따라서이 문화 시스템에 형성된 자연 mammospheres 사전 침습적 종양 영역에서만 파생 microinvasion 5 드문 지역의 제품에없는 것을 결론을 내릴 수있다.
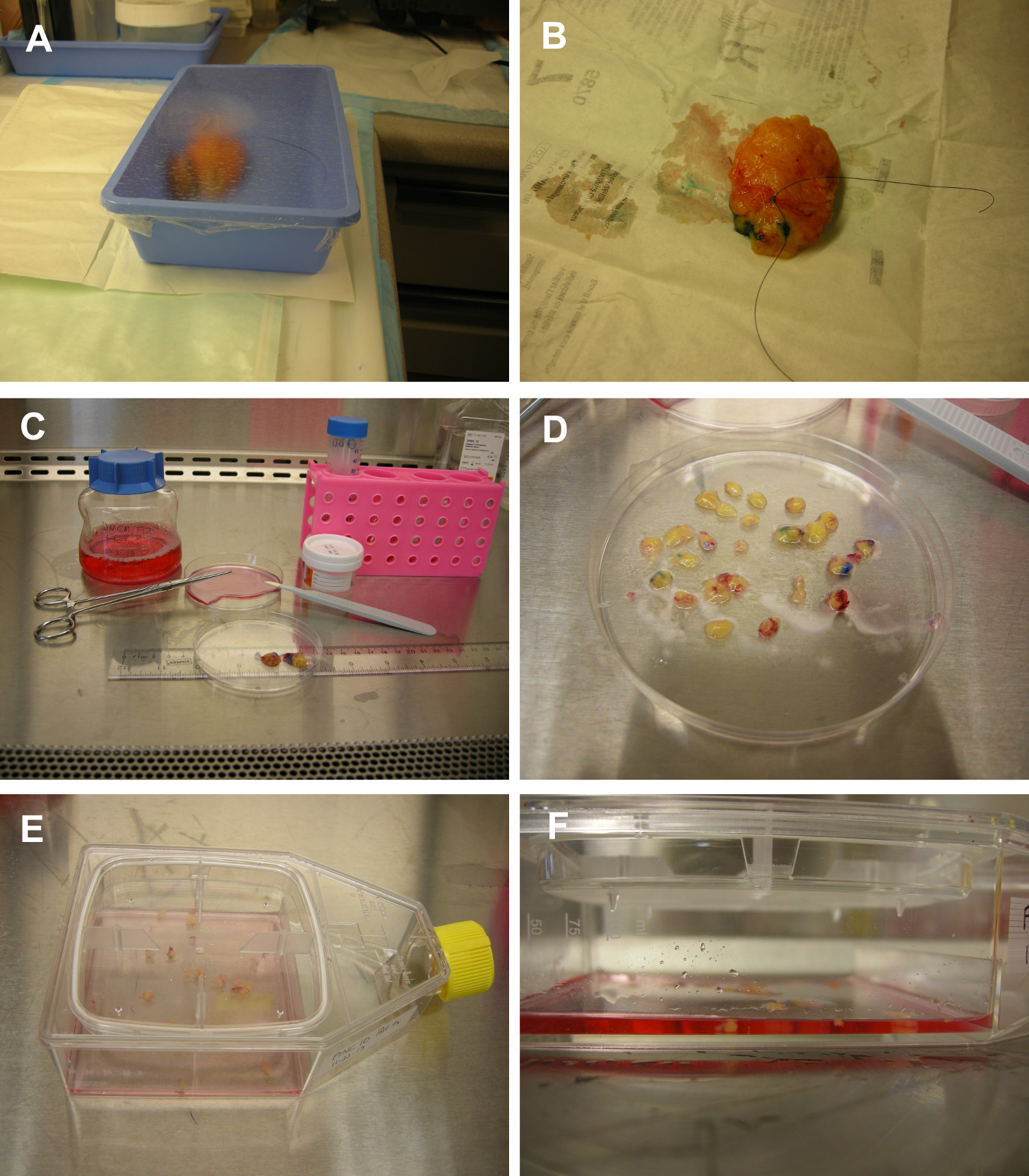
방사선 이미징 및 총 조직 해부하는 동안 조직 불임을 유지하기 위해 1. 워크 플로우 그림. 운영 스위트 (A), 유방 조직 (도시 유방 종양 절제술 샘플) 살균 트레이에 넣고 멸균 플라스틱 랩으로 덮여있다. 조직이 플라스틱 트레이에 직접 영상화 할 수있다. (B) 조직은 식별 흥행 DCIS의 영역. 단일 사용 만 조직 방향 염료는 소독면 스쳐 면봉을 사용하여 조직 표면에 페인트. 가정용 증류 식초는 조직에 직접 붓고 멸균 거즈로 얼룩진된다. (C & D) 유방 조직은 항생제로 보충 영양이 풍부한 매체에서 조직 배양 실험실로 운반된다. 조직의 해부는 DCIS의 영역을 분리하는 멸균 장갑과 블레이드 / 메스 / 가위를 사용하여 수행됩니다. DCIS 조직 배양을위한 여러 organoids로 절단된다. (E & F) 유방 organoids의 체외 배양. 인간 DCIS 조직은 조직의 사전 효소 소화하지 않고, 이동식 뚜껑 조직 배양 플라스크에 직접 배치됩니다. organoid 주위 공기 - 액체 계면을 유지하면서 표피 성장 인자 및 인슐린 보충 된 무 혈청 배지의 최소량 세포 성장을 지원한다.6fig1highres.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
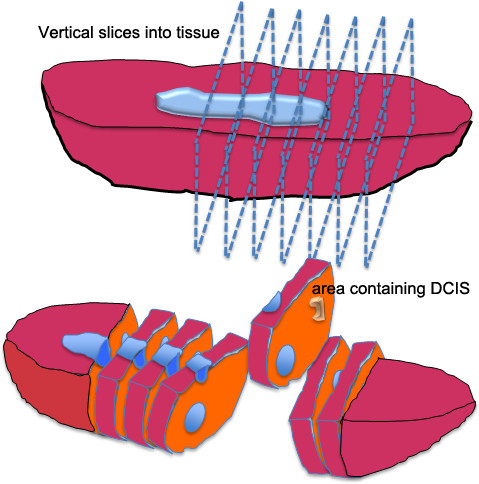
유방 DCIS 조직에 대한 총 조직 처리 그림 2. 그림. 유방 종양 절제술 또는 유방 조직 표본을 통해 모든 방법을 절단하지 않고 수직으로 조직을 자르는 얇은 부분으로 절단한다. 절단 된 조직은 빵 한 덩어리를 닮았다 때문에 절개 방법은 종종 "빵 덩어리 기술"이라고합니다. DCIS가 포함 된 의심 지역 (들)을 잘라 2로 썰어 - 진단 병리학 및 organoid 문화 3mm의 조각.
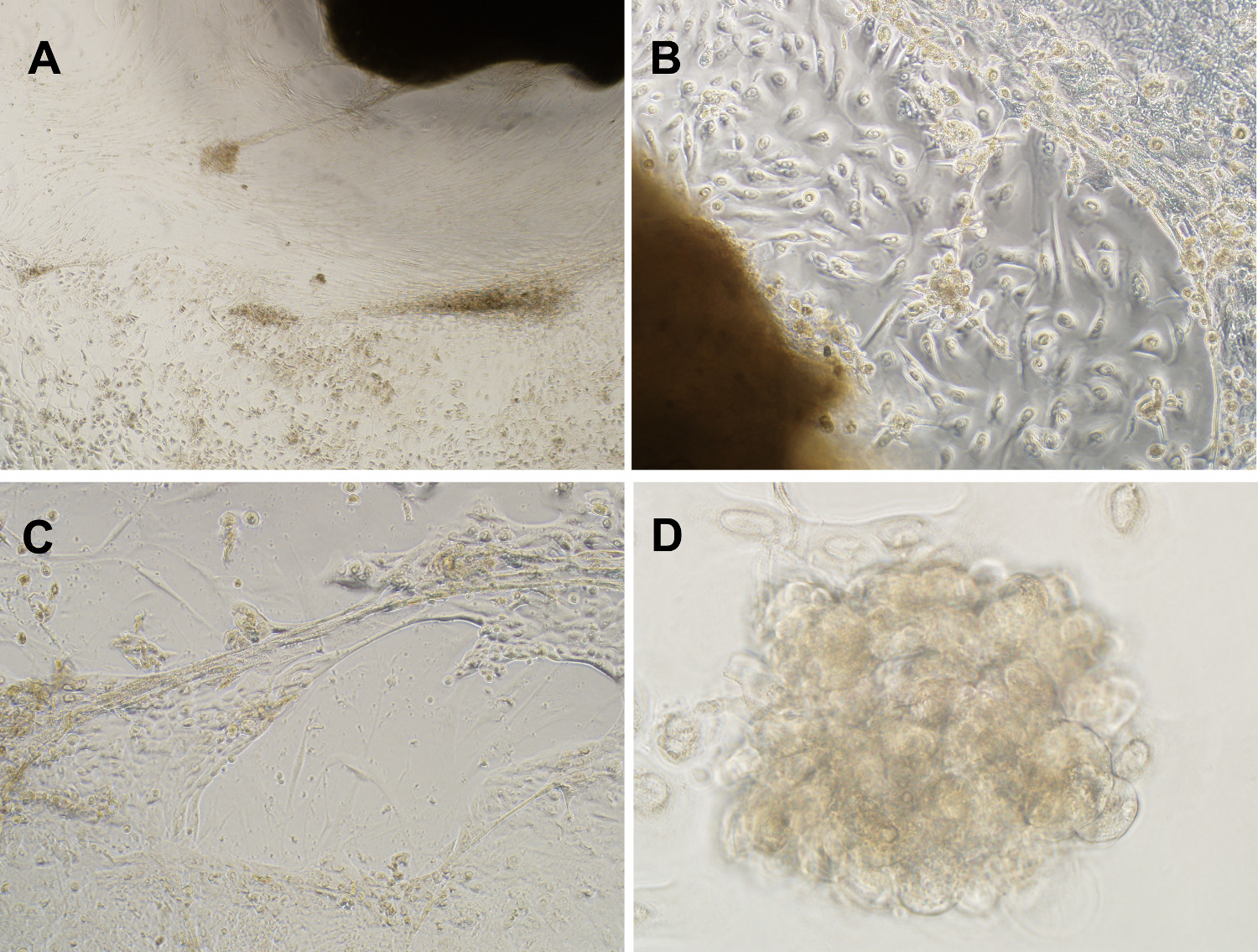
그림 3. 혼합 세포 형 문화생체 세포 집단의 대표를 유지한다. 유방에서 생성 된 혼합 세포 배양의 (A) 단계 대비 이미지의 재배가 성공적으로 DCIS는, 앵커리지 독립적 인 성장과 상피 세포를 유도 위쪽으로 성장 및 확장 mammospheres로 정의 전파 체외 organoid 11주 (4 배 확대). (B & C)를 통해 병변을 DCIS 및 EGF, 인슐린, 스트렙토 마이신 및 겐타 마이신 (10 배 확대) 보충 무 혈청 배지에서, 덕트와 같은 3-D 형성을 소엽. (D) 예는 문화 (40 배 배율) 11 주 후 형성 mammosphere. 여기를 클릭하십시오 이 그림의 더 큰 버전을 확인합니다.

자발적 그림 4.혈청 무료 organoid 문화 mammospheres의 형성. 문화의 삼십삼일 (10 배 배율 20 배 삽입) 다음과 같은 예를 mammosphere 형성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
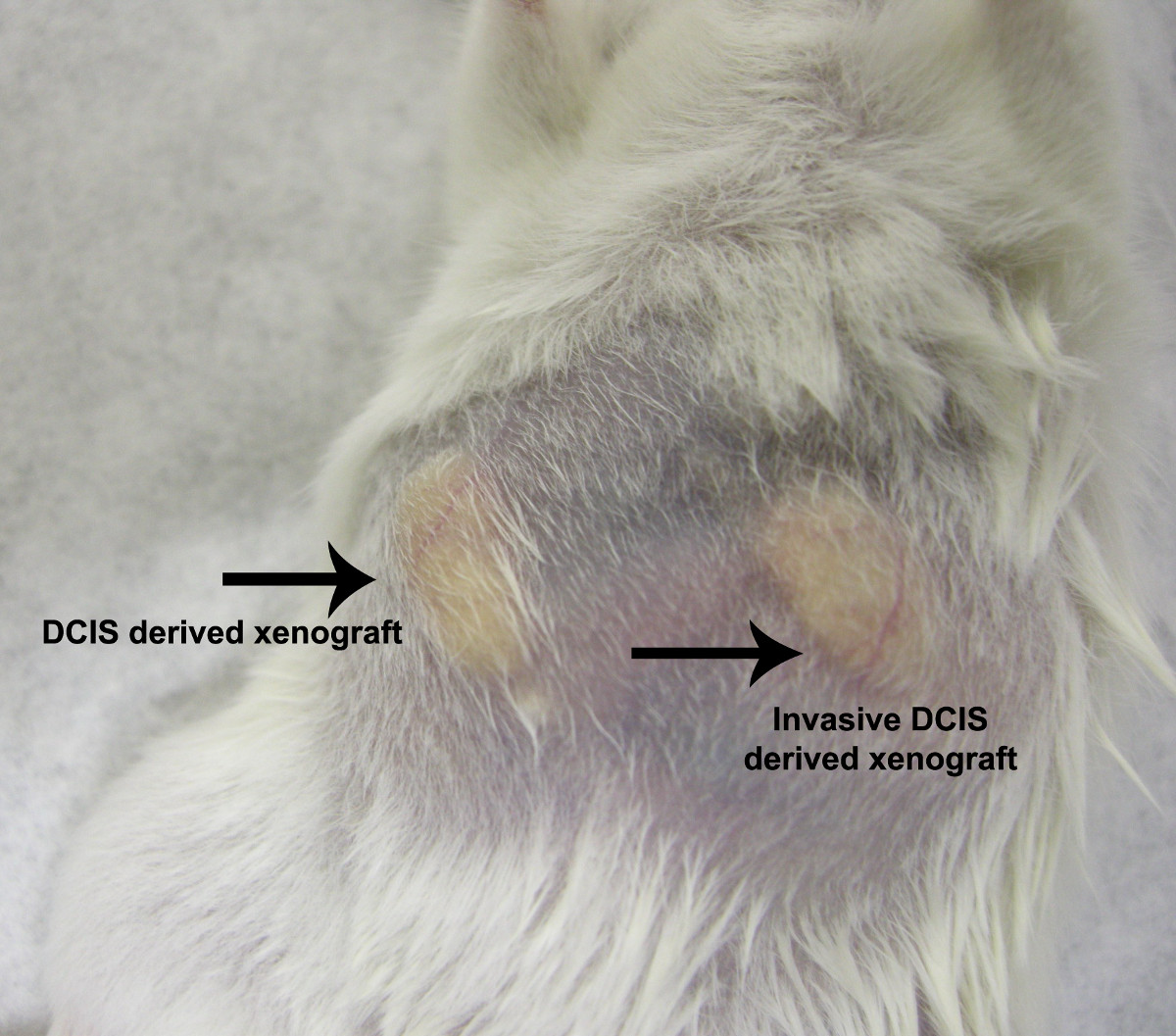
그림 5. NOD / SCID 마우스 이종 이식 모델. 이종 이식은 DCIS (마우스 우측 유방 지방 패드) 또는 침습적 인 DCIS (마우스 왼쪽 유방 지방 패드)으로 진단 된 환자에서 진단 된 환자로부터 유래 된 상피 세포 주입에 의해 생성되었다. 순수한 DCIS와 침략 DCIS 모두에서 파생 된 이종 이식은 비슷한 성장 패턴과 속도를 한 것으로 밝혀졌습니다. t의 더 큰 버전을 보려면 여기를 클릭하십시오그의 그림.
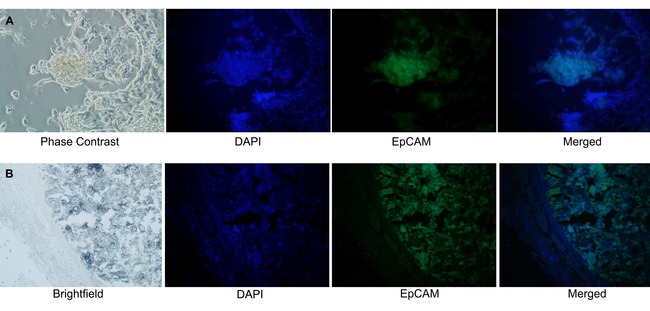
그림 6. Mammospheres이 상피 기원를 확인하고 있습니다. DCIS를 포함하는 가슴 덕트에서 발생 mammospheres 및 마우스 이종 이식의 상피 기원을 확인하는 데 사용 된 FITC 접합 방지는 EpCAM과 면역. (A)는 EpCAM-FITC 양성 세포 (모조 색깔 녹색, 488 nm의)에만 유방 organoids에서 나오는 혼합 된 세포 배양의 mammospheres (DAPI (의사 색 블루, 408 nm의) 핵 얼룩)에서 관찰되었다. (B) 포르말린 고정 파라핀 포함 된 마우스 이종 이식 조직 섹션에서는 EpCAM 긍정적 세포는 이종 이식 종양 부의 중심에서 검출된다. (20 배 확대) 이 figu의 더 큰 버전을 보려면 여기를 클릭하십시오다시.
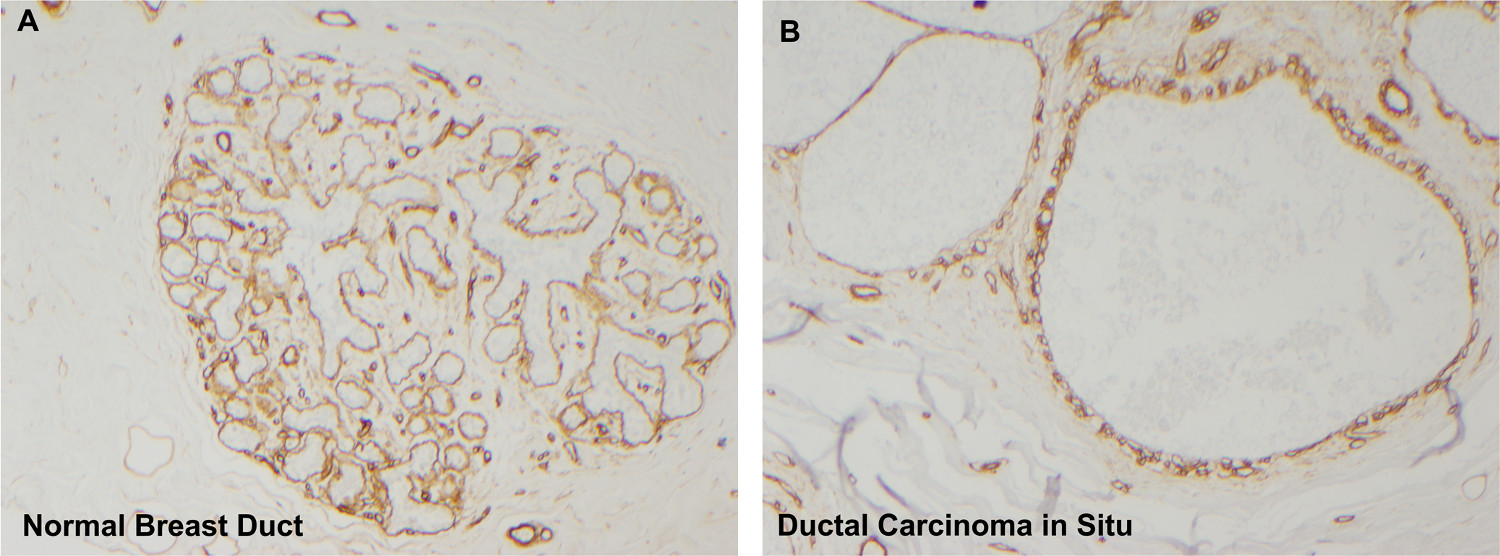
그림 7. 콜라겐 IV 면역 조직 화학 염색은 덕트를 둘러싼 그대로 기저막을 알 수있다. 보통 유방 덕트 (A)는 콜라겐 IV (디아 미노 = 갈색 염색)에 농축 그대로 지하 막에 둘러싸여 있습니다. organoid 문화에 따라, 유방 조직은 mammospheres이 DCIS의 영역에서 파생되어 있는지 확인 그대로 기저막을 포함하지 침습성 암 (콜라겐 IV의 면역 조직 화학 염색, 패널 4 배 확대, 패널 B 10 배).에서 의 더 큰 버전을 보려면 여기를 클릭하십시오 이 그림.
토론
본원에 기재된 배양 시스템은 기본 및 병진 연구 연구에 사는 예비 침습적 유방 종양 세포를 생성하는 새로운 모델을 구성한다. 과거에는, 전 악성 유방암의 진행은 일반적으로 세 가지 방법으로 연구되어왔다. 첫 번째 방법은 병리 조직 학적 및 microdissected 냉동 또는 고정 인간의 표본 12-14의 유전자 분석이다. 두 번째 방법은 인간 프리 침습성 유방암 병소 (15)와 유사한 것으로 생각된다 과형성 폐포 노쥴 (HAN 병변)가 포함 마우스 모델을 이용한다. 세 번째 모델은 형태 3,4- 같은 차별화 DCIS가 MCF7의 서브 라인 (MCF10A)로서 유방암 세포주를 확립 용도. 이 세 가지 모델은 유방암의 진행에 분자 단서를 제공하고 있지만, 이러한 방법 중에 악성 가능성 또는 개별 환자의 병변 (들)의 분자 표현형을 평가 할 수 없습니다. Histopathologic 분석 사전 침습 병변 세포의 기능 표현형에 대한 정보를 제공하지 않는다. 유방암 진행의 마우스 모델은 정확하게 현장 16-18에서 histomorphology과 인간의 비정형 유관 증식증, 현장에 소엽 암종의 다양성 및 유관 암을 반영하지 않을 수 있습니다. 또한, 간질 미세 환경과 세포 외 기질 주위 마우스 전구체 병변의 증착은 인간 상대 (16)로부터 현저하게 다르다. 자발 뮤린 전구체 병변에 침윤 및 전이 진행의 매우 낮은 수준을 나타낼 수있다. 면역 억제 호스트 3,4- 이식하면 세 번째 방법은, 배양 세포주 만 기능 표현형 정보를 제공 할 수있다. 또한 긴 계대 세포주의 유전 이상은 인간이 자발적 유방암 진행을 나타낼 수 없다. 마지막으로 잘 확립되어 각 환자의 종양침략과 전이 13,14,17에 성장의 속도, 차별화 상태 및 진행을 구동 유전 적, 후성 유전 학적 이상 소견의 고유 한 조합을 가지고있다. 인간 프리 침습적 병변 셀 구성과 histomorphology 병소에서 이질적이다. 또한, 생물학적 악성도는 개별 환자의 사전 침습성 병변을 알 수 없습니다.
우리의 주요 조직 배양 방법은 인간 프리 침윤성 유방암의 이전 모델의 결함을 극복하고 다음의 이점들을 제공한다 : 1) organoid 배양 시스템이 자발적으로 성장하고 생산할 예정 mammospheres 생성 네이티브 조직 미세 환경 내에서 종양 세포 집단의 성장을 지원 마우스 이종 이식 모델에서 종양 침습성. 세포는 개별 환자의 유전자형과 표현형을 나타내는함으로써 개인화 요법 또는 개별 예후에 대한 정보를 제공한다. 2) organoid 문화 시스템 MAINTAINS 원시 세포의 소집단 및 기본 유방 조직에 원래 존재하는 비 악성 상피 세포, 기질 세포와 면역 세포를 배양 할 수있는 수단을 제공하고, organoid 내에서 문화로 수행. 문화 시스템에서 미디어의 낮은 볼륨은 인공 입체 비계를 필요로하지 않고 구조와 같은 자연 mammosphere 형성과 차별화 된 덕트와 폐포를 격려 산소 교환을 지원합니다. 3) 주요 세포 배양은 효소 분해 또는 외인성 유전자 변형에 의해 생성 수정 및 선택에서 무료입니다. 또한, 영양 배지는 저비용 제조가 간단하다. 4) 분자 유전 분석은 전체 배양을 방해하지 않고 다른 시점에서 배양 물로부터 특정 세포 집단 및 / 또는 organoids에서 수행 될 수있다. 5) organoid 배양 시스템은 원시 세포 집단의 성장, 분화 된 형태 및 세포 - 세포 상호 작용을 허용하는 수전 배양 배지 내로 치료제의 도입 후 공부.
일차 조직 배양 특정 장점을 가지고 있지만, 제한이없는 것은 아니다. organoid 문화는 하나의 셀 타입의 자라하지 않고, 혼합 세포 배양의 성장을 지원합니다. 그러나, 세포 유형 특정한 비는 생체 내에서 발견되는 세포의 정확한 비율 요점을 되풀이하지 않을 수 이렇게 제어 될 수 없다. 성공적인 organoid 재배가 많은 지역 사회 병원 병리학 실험실에서 일상적인 절차가없는 둘, 무균 조직 수집 및 처리가 필요합니다. 임상 연구자 간의 원활한 의사 소통, 외과 직원, 병리 직원은 환자 진료의 연속성 내에서 샘플 불임을 유지하는 데 필수적이다.
organoid 배양 추가적인 제한은 세포 표현형 유전자 발현 16, 19에 하층의 탄력 효과이다. 문화에서 줄기 세포의 분화혈청 함유 배지의 첨가에 의해 유도 될 수 또는 문화에 장시간 때문일 수 있습니다. 줄기 같은 표현형이 비 효소, 혈청 organoid 문화 시스템 (5)에서 몇 달 후 유지되었다. 세포가 작아 조밀되고, mammospheres 형성 실패 - 다만, 어떤 시점에서, 세포는 형태 학적으로 볼 수있는 구별 할 수있다. 이러한 형질 감염으로 시간이 지남에 따라 세포의 표현형의 변화, 분자 실험, 잠재적 인 문제를 방지하거나 분석을 허물고, 오히려 오래된 문화 (6 개월 이상)보다 젊은 문화로 수행해야합니다.
성공적인 organoid 문화 키 배양 플라스크에 배지의 적당한 양을 사용하고 organoids 시간은 조직 배양 플라스크에 부착 할 수있게된다. 플라스크 제한 산소 확산에 과잉 매체 mammosphere 형성을 억제. 처음 3 - organoids가 TIS에 연결하는 조직 문화의 7 일이 중요하다문화 플라스크를 고소. organoid이 하루 (14)에 의해 연결되어 있지 않은 경우 일반적으로, 그것은 가능성이있는 실행 가능한 DCIS 유관 세그먼트를 포함하지 않고 접착이되지 않습니다. 하루 (14)에 의해 부착되지 않은 Organoids 문화에서 제거해야합니다. 가능한 유방 DCIS 덕트의 부족은 10 % 포르말린에서 고정 organoid 조직 염색 및 현미경 평가를위한 파라핀 블록으로 조직을 처리하여 다음 배양을 검증 할 수있다.
우리는 비 효소, 무 혈청 배양 시스템 소견은 잠재적 침입과 유 전적으로 비정상 신생 전구 세포 사전 침습적 인간 유방암 병소 5,9,20 내에 존재 가설을 뒷받침. 이 발견은 Sgroi 등., 인간의 유방 사전 침습적 병변 Damonte 등의 유전자 분석을 실시 하였다. 유방 상피내 종양 파생물을 공부 (MINO) 유방암의 진행 (12, 14)의 쥐 모델의 이전 작업과 유지에 21. 촬영 도게거기는 다른 결론으로, 개별 환자 미리 침습성 병변 문화 모델은 환자의 침윤성 유방암의 공격적인 표현형 크게 사전 침습 단계에서 미리 결정된 수있다 개념을 지원한다.
공개
저자가 공개하는 게 없다.
감사의 말
이 작품은에 의해 부분적으로 지원 (1) 국방부의 유방암 연구 프로그램 (미국 육군 의학 연구 수집 활동) #이 LAL에 W81XVVH-10-1-0781가 및 VE 상을, (2) 수잔 G. 코멘 재단 보조금 IR122224446는 LAL 및 VE합니다. 병리학 지원 및 조직의 매출 동시는 친절 이노 바 페어팩스 병리학 교실 박사 하산 Nayer 박사 Geetha A. 메네 제스, 박사 찰스 Bechert에 의해 제공되었다. 환자 동의 및 샘플 조달은 전문적 이노 바 페어팩스 병원 임상 연구 코디네이터 홀리 Gallimore, 헤더 Huryk, 그리고 에밀 카마르에 의해 인도되었다.
자료
| Name | Company | Catalog Number | Comments |
| Ethanol | Fisher | A405-P | prepare a 70% solution in Type 1 reagent grade water |
| 18 MΩ-cm water, sterile filtered | sterile filtered, Type 1 reagent grade water | ||
| 10 cc plastic disposable syringe, sterile | BD | 305482 | |
| 0.2 µm polyethersulfone (PES) syringe filter, sterile | Thermo Scientific | 194-2520 | |
| 15 ml polypropylene conical tubes, sterile | Fisher | 14-959-49B | |
| 50 ml polypropylene conical tubes, sterile | Fisher | 05-539-6 | |
| 1.5 ml low retention microcentrifuge tubes, sterile | Fisher | 02-681-331 | |
| nutrient medium, DMEM-F12/HEPES | Invitrogen | 11330-032 | with L-glutamine |
| Insulin, human recombinant | Roche | 11376497001 | 10 mg/ml stock |
| Epidermal Growth Factor (EGF), human recombinant | Millipore | GF144 | 100 µg/ml stock |
| Streptomycin sulfate | Sigma-Aldrich | S1567 | 10 mg/ml stock |
| Gentamicin sulfate | Sigma-Aldrich | G19114 | 10 mg/ml stock |
| Filtration flask and filter top, sterile | Millipore | SCGPU02RE | 0.22 µm PES membrane |
| 25 ml sterile, disposable pipettes | Fisher | 4489 | paper-plastic wrapped |
| 10 ml sterile, disposable pipettes | Fisher | 4488 | paper-plastic wrapped |
| Tissue marking dyes (black, blue, red, green, yellow and orange) | CDI | MD2000 | after opening use only with single-use, sterile cotton tipped applicators, or use once and discard |
| Cotton tipped applicators, sterile | Fisher | 23-400-115 | single use only |
| Gauze pads, 10 x 10 cm, sterile | Fisher | 2187 | |
| Plastic transfer pipettes, sterile, disposable | Samco | 202-20S | |
| Vinegar, white distilled | household use | 5% acetic acid; after opening use only with sterile pipettes | |
| #10 scalpels, sterile, disposable | Thermo Scientific | 31-200-32 | |
| Petri dish, sterile | Fisher | FB0875713A | |
| TPP 115 cm2 flask, with removable lid | MidSci | 90652 | screw cap with filter |
| CO2 incubator | Fisher | 13-998-074 | 5% CO2, 37 °C, humidified chamber |
| inverted light microscope | Olypmus | IX51 | |
| 8 M urea | Fisher | BP169-500 | optional, for mass spectrophotometric analysis of cultured cells |
| 2X SDS tris-glycine buffer | Life Technologies | LC2676 | optional, for proteomic analysis of cultured cells |
| Cytocentrifuge | Thermo Scientific | A78300003 | optional, for preparing cell smears |
참고문헌
- Shaughnessy, J. A., et al. Treatment and prevention of intraepithelial neoplasia: an important target for accelerated new agent development. Clin Cancer Res. 8 (2), 314-346 (2002).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Behbod, F., et al. An intraductal human-in-mouse transplantation model mimics the subtypes of ductal carcinoma in situ. Breast Cancer Res. 11 (5), (2009).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Espina, V., et al. Malignant precursor cells pre-exist in human breast DCIS and require autophagy for survival. PLoS One. 5 (4), (2010).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes Dev. 17 (10), 1253-1270 (2003).
- Farnie, G., et al. Novel cell culture technique for primary ductal carcinoma in situ: role of Notch and epidermal growth factor receptor signaling pathways. J Natl Cancer Inst. 99 (8), 616-627 (2007).
- Wicha, M. S., Liotta, L. A., Garbisa, S., Kidwell, W. R. Basement membrane collagen requirements for attachment and growth of mammary epithelium. Exp Cell Res. 124 (1), 181-190 (1979).
- Espina, V., Liotta, L. A. What is the malignant nature of human ductal carcinoma in situ. Nat Rev Cancer. 11 (1), 68-75 (2011).
- Gong, C., et al. Beclin 1 and autophagy are required for the tumorigenicity of breast cancer stem-like/progenitor cells. Oncogene. 32 (18), 2261-2272 (2012).
- Simon, B., et al. Epithelial glycoprotein is a member of a family of epithelial cell surface antigens homologous to nidogen, a matrix adhesion protein. PNAS. 87 (7), 2755-2759 (1990).
- Ma, X. J., et al. Gene expression profiles of human breast cancer progression. Proc Natl Acad Sci U S A. 100 (10), 5974-5979 (2003).
- Schnitt, S. J., Harris, J. R., Smith, B. L. Developing a prognostic index for ductal carcinoma in situ of the breast. Are we there yet. Cancer. 77 (11), 2189-2192 (1996).
- Sgroi, D. C. Preinvasive breast cancer. Annu Rev Pathol. 5, 193-221 (2010).
- Asch, H. L., Asch, B. B. Heterogeneity of keratin expression in mouse mammary hyperplastic alveolar nodules and adenocarcinomas. Cancer Res. 45 (6), 2760-2768 (1985).
- LaBarge, M. A., Petersen, O. W., Bissell, M. J. Of microenvironments and mammary stem cells. Stem Cell Rev. 3 (2), 137-146 (2007).
- Smart, C. E., et al. In vitro analysis of breast cancer cell line tumourspheres and primary human breast epithelia mammospheres demonstrates inter- and intrasphere heterogeneity. PLoS One. 8 (6), (2013).
- Vaillant, F., Asselin-Labat, M. L., Shackleton, M., Lindeman, G. J., Visvader, J. E. The emerging picture of the mouse mammary stem cell. Stem Cell Rev. 3 (2), 114-123 (2007).
- Kim, D. H., et al. Actin cap associated focal adhesions and their distinct role in cellular mechanosensing. Sci Rep. 2, 555 (2012).
- Espina, V., Wysolmerski, J., Edmiston, K., Liotta, L. A. Attacking breast cancer at the preinvasion stage by targeting autophagy. Women's Health. 9 (2), 1-14 (2013).
- D'amonte, P. Mammary carcinoma behavior is programmed in the precancer stem cell. Breast Cancer Res. 10 (3), (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유