Method Article
非酶中,预浸润性乳腺癌病变的无血清组织培养的微球体的自然发生
摘要
使用完整的组织组织体原代细胞培养提供了一个模型系统,模仿的多细胞在体内微环境。我们开发了一种无血清乳腺原发上皮细胞组织培养模式,延续了混合细胞培养系,并表现出分化的形态,没有酶的组织破坏。乳房组织体保持活力> 6个月。
摘要
原位 (DCIS)乳腺导管癌,顾名思义,是乳腺管的范围内肿瘤上皮细胞增生,不违反胶原基底膜。而原位癌是一种非专性前体浸润性乳腺癌,分子机制和细胞群,其允许进展为浸润性癌是不完全清楚。以确定是否能够入侵祖细胞的原位癌细胞群中存在的,我们开发了用于在外科手术时收集和培养无菌的人乳腺癌组织中的方法,没有组织的酶破坏。
含导管段无菌乳腺组织是由手术切除乳腺组织下面的常规病理检查收获。含原位癌组织被放置在营养丰富,含有抗生素的无血清培养基中,并输送到组织培养实验室。乳房组织是进一步dissected,来隔离钙化区域。多个乳房组织片(组织体)放置在无血清培养基中的最小体积的烧瓶中,一个可移动的盖子,并培养在加湿的CO 2培养箱中培养。上皮细胞和成纤维细胞群出现后,从10类器官 - 14天。微球体中自发形成上和周围的上皮细胞单层。特定的细胞群体可以直接从烧瓶中被收获,而不破坏邻近的细胞。我们的非酶组织培养系统可靠地揭示了从新鲜人原位癌病变细胞遗传学异常,侵入祖细胞。
引言
乳腺导管和腺泡( 导管原位癌 )的范围内上皮细胞的增生被认为是一种专为前驱体浸润性导管和乳腺小叶癌。然而,分子机制和细胞群的动力学允许进展为浸润性癌是知之甚少。阐明所使用的预浸润性乳腺癌细胞中,或任何预先侵入肿瘤的生存机理,揭示可能的治疗策略进行查杀,甚至预防,预侵入肿瘤1。然而,对于功能性研究人类浸润前病变简单的低成本方法已经缺乏。虽然在体外单层转化细胞系的培养是一个既定的实验室方法,这些永生化细胞系的表型和基因型未能概括原代人肿瘤细胞2的分子状态。此外,即使在非致瘤性乳腺癌MCF-10A细胞系,其recA启动pitulates三维乳腺架构,未能充分代表了功能表型和个体病人的预浸润性乳腺癌病灶3,4的分子特征。
以确定是否能够入侵干细胞样肿瘤细胞的原位 (DCIS)的细胞群的导管癌中的存在,我们开发了一种方法,用于收集和在外科手术时进行培养的无菌人类乳腺组织( 图1)5。我们的体外乳腺组织体培养系统不依赖于酶的组织破坏,基底膜提取物基质,或成纤维细胞的耗竭,用于分离和从新鲜人乳腺导管癌组织6-8传播乳腺球形成细胞。我们的新系统是基于细胞的流/迁移5的原理。的可辨别乳房导管,和周围的基质浸没在无血清培养基中(只是电子的最小体积交流或覆盖管的片段),以最大限度地提高气体交换,以暴露于培养基中的管的切割表面,但在没有在该烧瓶中( 图1E-F)的特定方位。该培养系统允许细胞迁移出导管并进入/到自体基质和培养瓶。营养培养基中,只用表皮生长因子(EGF),胰岛素,和抗生素补充的,支持混合的细胞群从组织体发出的增长。在组织培养瓶有一个可拆卸的,可重复密封的盖子,其允许组织体和/或细胞,而不会中断整个烧瓶或邻近组织体收获,同时保持无菌的湿润环境。
研究方案
人体乳腺组织是由患者参加一项研究,以书面的知情同意书收集起来,下面国防部乔治·梅森大学中文系,和INOVA的卫生系统机构审查委员会批准的协议。
1.准备营养丰富的培养基与生长因子和抗生素
- 制备储备溶液胰岛素,表皮生长因子(EGF),硫酸链霉素和庆大霉素硫酸盐。
- 重组胰岛素的无菌过滤的水,以10毫克/毫升的最终浓度。吸液加入10ml 1型试剂级水在10ml无菌一次性注射器。附加0.22微米聚醚砜过滤器,注射器。分配所述无菌过滤的水进入无菌的15毫升锥形管中。
- 加入10毫升的无菌过滤的水,以胰岛素100mg的小瓶中。简要地混合在涡流混合器上的内容。置于冰上胰岛素药瓶。分装450微升胰岛素股票的SOLU化入标,无菌的离心管中,并储存在-20℃。胰岛素储备溶液是稳定的,直到在管形瓶中的到期日期。
- 准备表皮生长因子(EGF)的储备液:加入500μl无菌水500微克EGF(股票1微克/微升)。简要地混合在涡流混合器上的内容。置于冰上的EGF小瓶。
- 准备EGF的工作储备液:将100μl股票EGF溶液900微升培养基(工作股价为0.1微克/微升)。简要地混合在涡流混合器上的内容。分配50μl的在-80℃的EGF的工作原液入标记,无菌微量离心管中并储存的。
注:EGF原液(1微克/微升)是稳定1年,在-80℃;工作储备溶液(0.1微克/微升)稳定2个月,在-80℃下。
- 准备EGF的工作储备液:将100μl股票EGF溶液900微升培养基(工作股价为0.1微克/微升)。简要地混合在涡流混合器上的内容。分配50μl的在-80℃的EGF的工作原液入标记,无菌微量离心管中并储存的。
- 称量在分析天平上硫酸链霉素40毫克。将硫酸链霉素INTOA无菌的15 mL锥形管。添加4毫升营养培养基。简要地混合在涡流混合器上的内容。解决的办法应该是淡粉红色。储存在4℃下避光保存。硫酸链霉素溶液是稳定7天。
- 称在分析天平上20毫克的硫酸庆大霉素。将硫酸庆大霉素到无菌的15毫升锥形管中。加2 ml培养基中。简要地混合在涡流混合器上的内容。该溶液应为黄色。储存在4℃下避光保存。硫酸庆大霉素溶液是稳定7天。
- 准备两个200毫升分批补充有重组人表皮生长因子的营养培养基(10毫微克/毫升的最终浓度),胰岛素(10μg/ ml的终浓度),硫酸链霉素(100μg/ ml的最终浓度)和硫酸庆大霉素(20微克/ ml终浓度)。
- 添加200毫升营养培养基中于真空过滤烧瓶配有0.2微米的聚醚砜过滤器烧瓶中,并在250ml接收瓶中。添加20#181;升工作原液EGF,200微升的库存胰岛素,2- ml储备硫酸链霉素,和400μl的股票硫酸庆大霉素到200毫升营养培养基。附加的过滤烧瓶中的真空度。过滤介质。丢弃过滤器和标签的瓶作为"营养丰富的培养基中。"储存在4℃下长达14天。
2.组织采集和卖座
- 在手术室,采购乳房组织后维持无菌技术。将乳腺组织在无菌纸盒,盖上无菌塑料包装托盘。
- 按要求通过体制运输组织中的覆盖托盘放射科/病理。不要打开托盘。机构内部的运输时间有所不同。组织可以在RT这个盖纸盒可容纳45分钟后切除仍然是可行的。然而,组织成营养丰富的培养基中的提示处理提供用于随后的组织体培养的最佳条件。
- 毛的组织解剖,以确定导管原位癌的区域内的乳房组织:使用无菌手套,刀片,解剖刀,组织标记染料和醋组织解剖期间保持组织无菌。
- 清洁用70%乙醇或1%的漂白粉的工作区。打开无菌手套,并放置在工作表面上的手套包装。地方的手套包装正面朝上的无菌室内。戴上无菌手套。
- 清洗,用70%乙醇的检体容器的表面上。取下组织样本容器的保鲜膜,然后将试样在手套包装。
- 浸二棉拭子插入组织标记染料。通过在组织表面上滚动的拭子应用的染料到组织的表面上。
注:每个病理科,建有标准化的染料颜色/组织定向协议。组织标记有染料定向相对于所述组织其在患者中的位置。染料被吸干或涂在组织上。不要倒在组织中的染料。浇注的染料会引起染料运行/点滴到组织中的缝隙从而混淆手术切缘的方向。组织的取向提供了外科医生和病理学家与解剖学界标,以a)描述的组织标本,以及b)确定与所述肿瘤的手术切缘的位置。 - 倾蒸馏白醋(5%乙酸)到无菌纱布垫。吸干用醋浸泡过的纱布染成组织。丢弃的纱布。醋是用来修复组织的标记染料。
- 切乳房组织成垂直切片约5毫米厚。切不要通过组织( 图2)的所有道路。观察/触诊组织的钙化区。鉴别原位癌病灶的特点事务所,面色苍白的外观由微红包围,橡胶边框的坚韧不拔的感觉(因为钙骨针)。
注意:在某些情况下,粉刺(疙瘩状)的区域可以是视为白点,表示从大直径的DCIS病灶坏死物质。 - 切出的DCIS /钙化的乳腺组织的区域,包括少量周围的乳房组织。放置在乳房组织进入无菌50ml管中含有20-30毫升,在步骤1中制备的营养丰富的培养基中。
- 轻轻颠倒试管几次混合组织和平台。弃去培养基,加入新鲜培养基。将装有组织和培养基中的管插入一个绝缘容器和输送到组织的组织培养室。
- 清洁用70%乙醇或1%的漂白粉的工作区。打开无菌手套,并放置在工作表面上的手套包装。地方的手套包装正面朝上的无菌室内。戴上无菌手套。
3.组织培养
- 工作在生物安全柜中,倒入组织和少量的营养培养基到无菌培养皿中。用无菌解剖刀切开并丢弃纤维组织。切开的乳房组织成块(组织体)约为3mm 2( 图1C-D)。试着切割组织,使得每个器官oid的含有至少一种可辨别的管段与周围的基质。
- 打开该组织培养瓶的盖子。用无菌镊子或镊子,将组织体到烧瓶中。合上盖子。丢弃的培养皿。
- 添加11毫升无血清的营养丰富的培养基(在步骤1中制备)于组织培养烧瓶中。收烧瓶中,摇动烧瓶使组织体和介质被均匀地分布在整个烧瓶表面( 图1E-F)。
- 孵育烧瓶中,在37℃,在湿润的5.0%的CO 2气氛中进行2天。在此期间,不要移动烧瓶中。
- 后第2天培养后,从培养箱取出烧瓶,以检查是否有潜在的细菌/真菌的污染。避免了瓶突然,剧烈运动,或旋涡。将烧瓶放置在倒置显微镜载物台上。
- 观察对细菌,酵母菌和/或真菌的培养基。如果没有污染注意,返回烧瓶培养箱为additional一天。如果污染注意,丢弃在适当的容器中的烧瓶和内容。
- 后第3天培养后,更换新鲜培养基的条件培养基。
- 放置11毫升介质中的无菌管中,在37℃下进行20-30分钟。请从孵化器的组织培养瓶。不干扰类器官,除去并丢弃使用无菌血清移液管将烧瓶中的介质。
- 在预热的新鲜培养基的使用新的无菌血清移液管中,添加11毫升。非常轻轻地旋转烧瓶,以分布到烧瓶表面的平台。
- 孵育烧瓶中,在37℃,在湿润的5.0%的CO 2气氛中。
4.维修建立类器官/上皮细胞集落
- 制备新鲜的培养基,每2周,并更换介质中的组织培养烧瓶中,每周3次。
- 放置11毫升培养基在无菌容器中,在37°℃,20〜30分钟。请从孵化器的烧瓶中。用无菌吸管血清,捞出从烧瓶中丢弃的调理液,注意不要打扰类器官。
- 在预热的新鲜培养基的使用新的无菌血清移液管中,添加11毫升。非常轻轻地旋转烧瓶,以分布到烧瓶表面的平台。孵育烧瓶中,在37℃,在湿润的5.0%的CO 2气氛中。
- 经过10 - 在培养14天,去除任何组织片在培养瓶中所没有粘附。
- 定期收获细胞和/或从烧瓶中用于传播到新的培养瓶中组织体,对异种移植物移植,或用于表型和/或分子的分析。
- 请从孵化器的组织培养瓶。喷雾用70%乙醇的烧瓶中。擦去用干净的纸巾已经用70%的乙醇的烧瓶中加入过量的乙醇。
- 类器官繁殖:
- 打开烧瓶的盖子,将盖面朝上,在生物安全柜中。在显微镜下可视化,找到组织体(S)收获。用无菌镊子或钳子回升的类器官。
- 传播在新的培养瓶中的组织体,将组织体中的新瓶。添加11毫升清新,温暖的媒介。 3.6.3 -如在步骤3.3中所述孵育在37℃下,在潮湿的5%的CO 2气氛中。替换在组织培养细胞培养基烧瓶中,每周3次。
- 收获细胞:
- 在直接镜检vixualization,轻轻刮去并吸出细胞和微球体使用1000微升吸管用无菌一次性吸头。吸出细胞和周围介质。分配所述细胞/培养基到无菌微量离心管中。
- 短暂离心细胞在微型离心机在12100×g离心5秒。取出并丢弃的媒介。
- 用于DNA分析,立即冻结细胞沉淀在干冰上,在小体积的培养基中(10微升),具有长期贮存于-80℃。
- 用于蛋白组学分析,溶解于10μl的8M尿素进行质谱法或免疫印迹/反相蛋白质微阵列的2×SDS tris-甘氨酸缓冲液中的细胞。另外,旋转细胞的cytocentrifuge使细胞涂片进行免疫组化分析。
- 后从瓶中收获细胞,取出并丢弃剩余的媒介。添加11毫升温暖,新鲜营养丰富的培养基中。孵育烧瓶中,在37℃,在潮湿的5%的CO 2气氛中。
结果
工作流原位组织采购和无菌培养乳腺导管癌
乳房组织无菌性从通过在典型的医院病理工作流小的变化( 图1)的操作室的细胞培养室保持。组织被输送在无菌容器用塑料薄膜覆盖物,它允许放射学评估,同时保持组织无菌。用无菌手套,刀片和组织标记染料进行乳房肿瘤切除术或乳房切除术的样品总值组织处理。乳腺导管原位癌总值(GDP)的细胞形态酷似苍白,微微凸起区域与坚韧不拔/质地结实,用淡红色/黄色胶状组织所包围。乳腺导管增生和原位癌领域可能会觉得"坚韧不拔",并坚定由于钙化。乳腺组织的这些区域经常出现棕褐色或略有不同颜色比周围的乳房组织。然而,ADHç组织收集和染色组织切片的病理审核后才能区分。乳房组织保持生存能力通过浸入所述组织和/或导管组织体在补充了人重组表皮生长因子(10毫微克/毫升),胰岛素(10微克/毫升),硫酸链霉素(100微克/毫升)和硫酸庆大霉素的无血清培养基中(20微克/毫升),5。细胞培养烧瓶可拆卸/可重复密封的盖子允许的细胞/组织体( 图1E-F)的定期收获。该模型成功地传播人类乳腺浸润前病变来自超过20例确诊为非典型性导管增生(N = 2)和导管原位癌 (N = 18)。
自发形成微球体在体外和体内
微球体和3-D结构产生自发地从多个独立的人类原位癌导管组织从不同患者的片段诊断患有典型导管超原位 plasia或导管癌( 图3和4)5,9。之前没有向组织培养物,这就造成了一个混合细胞型培养进行的乳房组织的酶破坏。进行所需的自发形成微球体( 图4)既不血清,基底膜提取物,也没有凝胶状基质。该微球体产生的乳腺肿瘤异种移植的NOD / SCID小鼠模型具有相同的增长模式作为浸润性癌( 图5),5。这些结果表明,与侵袭性潜力内的人乳腺癌预先存在祖细胞DCIS管但在检查通过所述导管小生显然保持,并且可以被诱导以类器官培养出现。这些细胞构成现有的侵袭性表型5,9,10的显性表现存在乳腺干细胞样细胞的一个新的类别。
上皮衍生的微球体和xenograf确认TS
从微球体得到的微球体和移植免疫荧光证实具有上皮起源。上皮细胞粘附分子(EpCAM的)是表达于上皮细胞11的膜糖蛋白。免疫的小鼠单克隆抗体反应的人EpCAM(绿色)和核染色(DAPI,蓝色)显示的EpCAM阳性细胞在微球体中的培养物( 图6A)和NOD / SCID异种移植物( 图6B)的中心。
完整的基底膜界限验证
该微球体形成,肿瘤上皮细胞在这种文化体系是从预侵入乳腺病变是缺乏坦诚入侵或微创的,因为在照顾病理诊断标准检验由独立的病理分析。来自同一患者的多个器官样结构生成的微球体为明殖民地被证明是致癌。此外,用于组织体培养的组织的病理组织学检查发现汇合导管内病变具有完整基底膜界限( 图7B)5。因此,可以得出结论,形成于该培养系统中自发微球体只是从预侵袭性肿瘤区域衍生的,但它们不是对微浸润5稀有区域的产物。
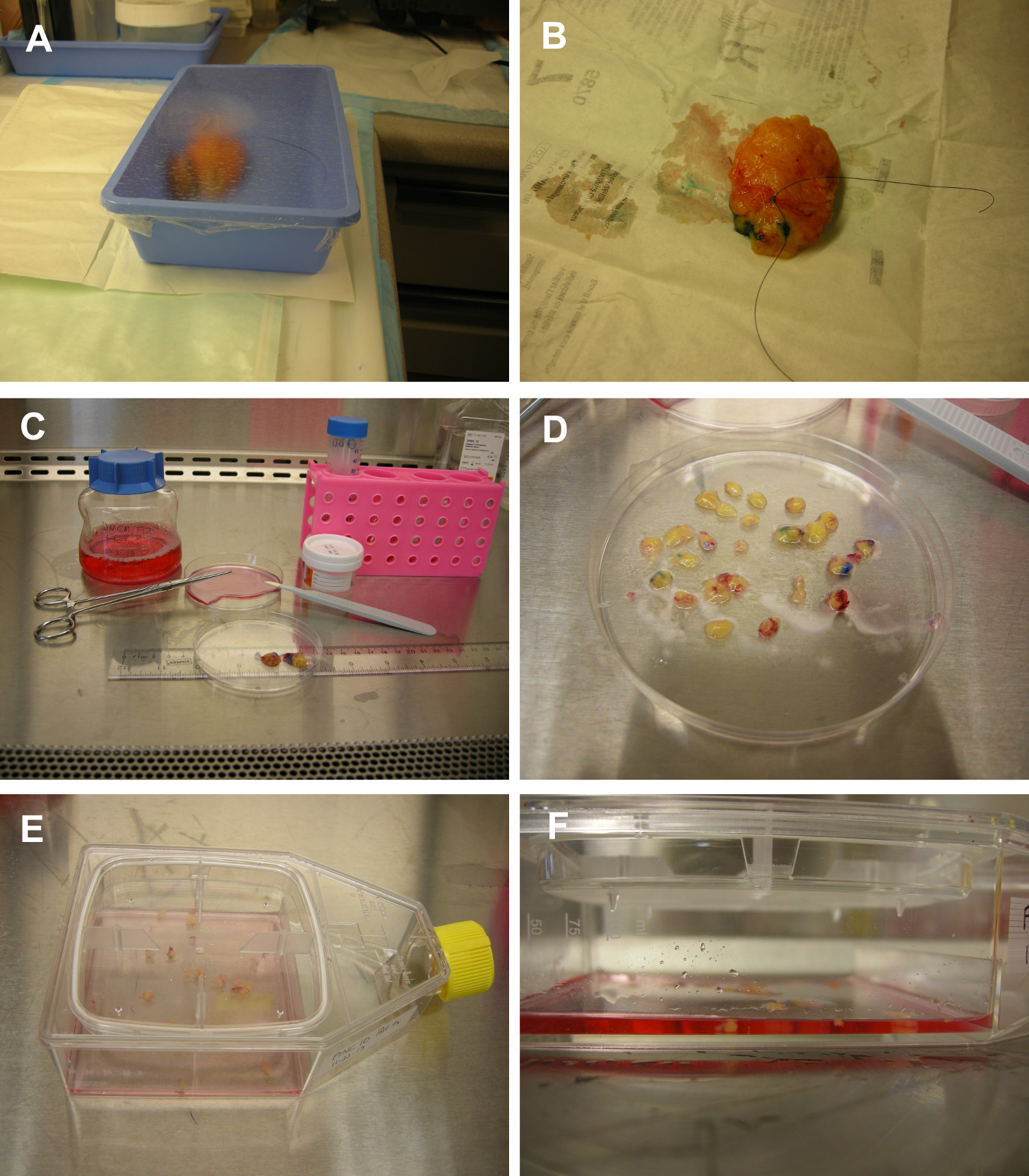
图1.工作流中放射成像和毛利率组织解剖组织保持无菌。 (A)在手术室,乳腺组织(肿块切除所示样品)置于无菌纸盒,盖上无菌保鲜膜。该组织可以直接在塑料托盘被成像。(B)的组织票房识别 DCIS的区域。只能使用一次组织定向染料是用无菌棉拭子涂到组织表面。家用蒸馏白醋直接倒入组织和吸干,用无菌纱布棉(C&D)乳房组织被运送到在营养丰富的培养基组织培养室中添加抗生素。组织解剖,分离DCIS的领域,用无菌手套及刀片/解剖刀/剪刀进行。在DCIS组织切成多个组织体进行培养。(E&F)乳腺组织体在体外培养。人类原位癌组织被直接放置在组织培养瓶中带有可拆卸的盖,没有组织的事先酶消化。补充有表皮生长因子和胰岛素的无血清培养基中使用最少量的支持细胞生长,同时保持周围的组织体的气 - 液界面。6fig1highres.jpg"TARGET ="_空白">请点击这里查看该图的放大版本。
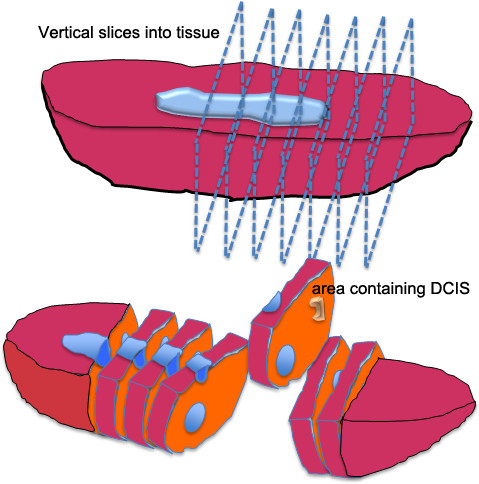
图2.插图总值(GDP)的组织处理,乳腺原位癌的组织。乳房肿瘤切除术或乳房切除组织是由垂直切片的组织,而不通过试样切割一路切成薄片。这种解剖方法通常被称为"长条面包的技术",因为切割组织类似于一个面包。的区域(多个)怀疑含有原位癌的切出并切成2 - 3 mm层厚为诊断病理学和组织体培养。
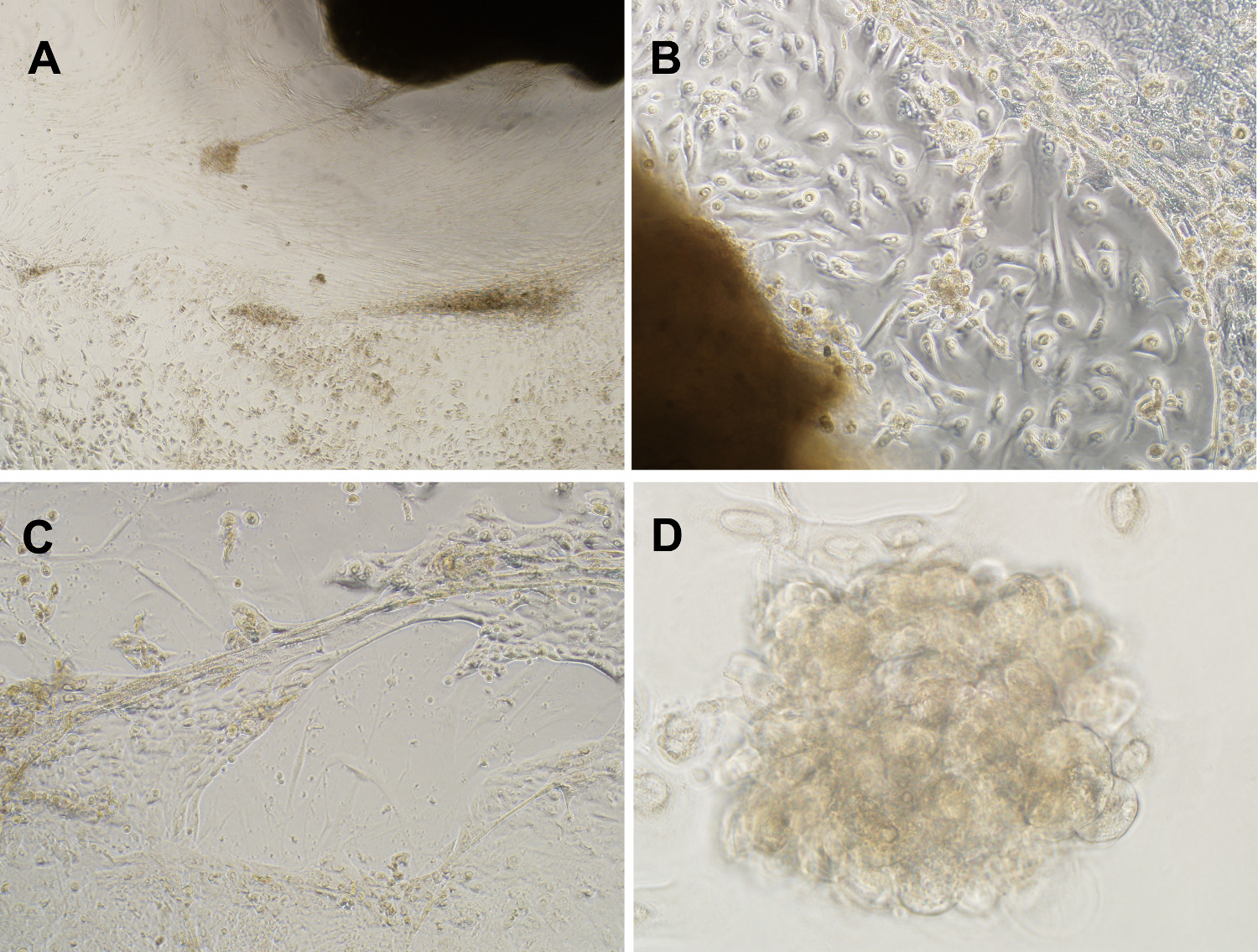
图3.混合细胞型文化代表保持体内的细胞群。乳腺癌产生的混合细胞培养(A)相衬图像原位癌病变超过11周(放大4倍)。(B&C) 在体外培养类器官成功传播原位癌的上皮细胞锚地独立生长,定义为向上发展扩大微球体,并呈分叶状,腺管样3-D单位,在补充EGF,胰岛素,链霉素和庆大霉素(放大10倍),无血清培养基。(D)例微球体11周文化(40倍放大倍率)后形成的。 请点击这里查看该图的放大版本。

图4.自燃形成的无血清化培养的微球体。一个例子形成微球体下面33天文化(放大10倍,20倍插图)。 请点击这里查看这个数字的放大版本。
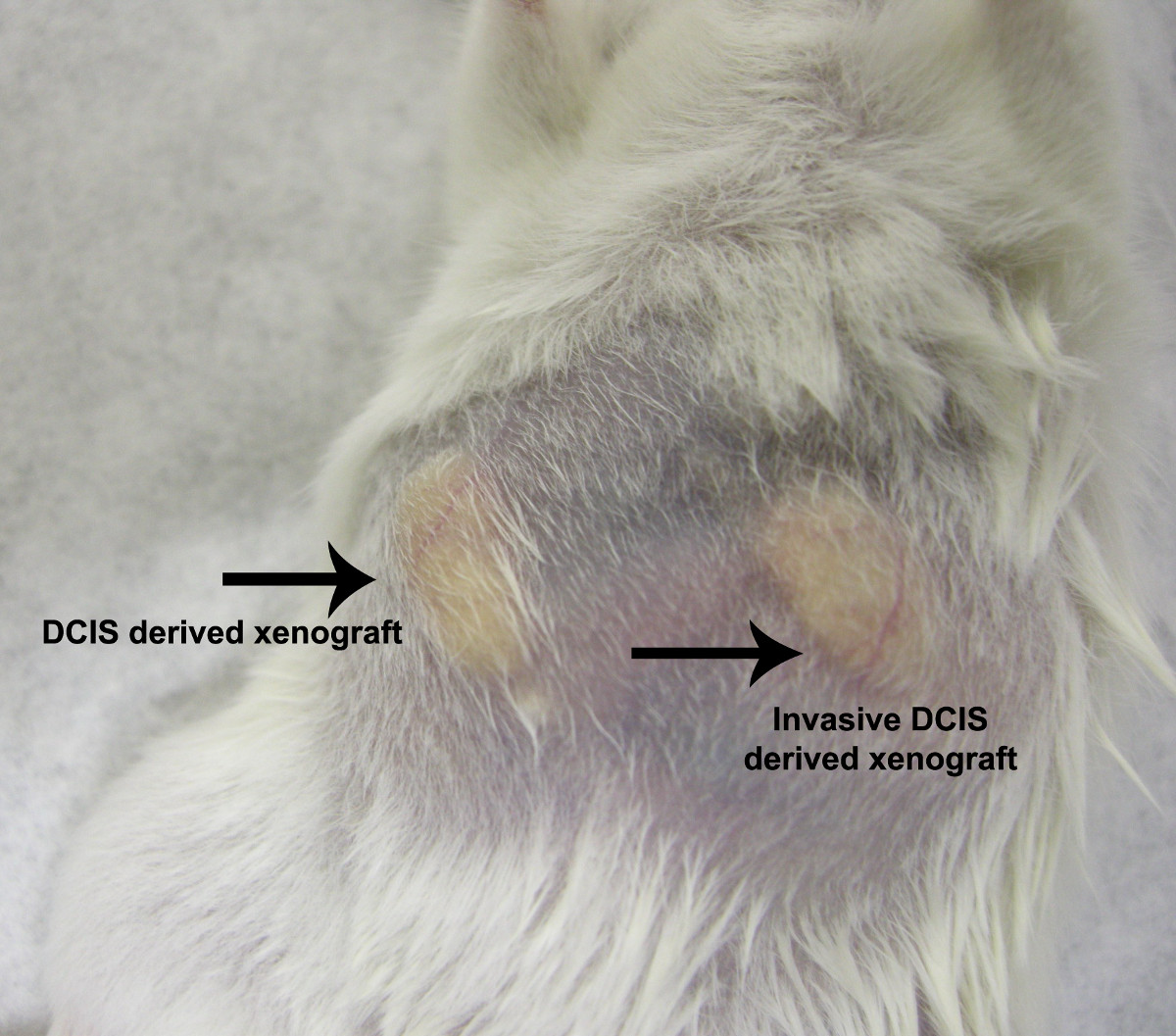
图5. NOD / SCID小鼠异种移植模型,异种移植物,通过注射从患者诊断为原位癌(鼠标右乳腺脂肪垫),或者从病人确诊为浸润性导管原位癌(鼠标左乳腺脂肪垫)的上皮细胞中产生。来自纯DCIS和浸润性导管原位癌衍生移植透露了类似的增长模式和速度。 请点击这里查看吨的放大版本。他的身影。
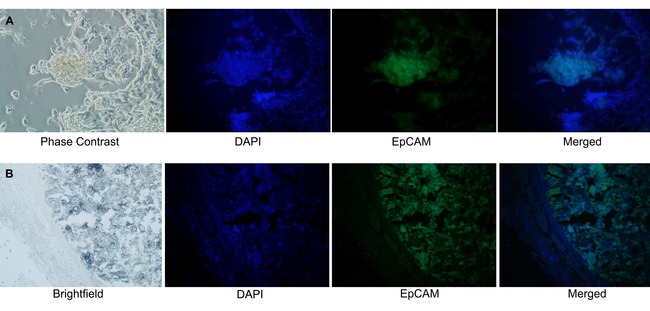
图6.微球体被证实是上皮起源的。免疫荧光抗EpCAM FITC偶联物用于证实从含有原位癌乳腺导管产生的微球体和小鼠异种移植物的上皮起源。(A)中的EpCAM-FITC阳性细胞(伪色的绿色,488纳米)仅见于混合细胞培养物从乳房组织体发出的微球体(DAPI(伪色的蓝色,408 nm)的核染色)(B)在福尔马林固定的石蜡包埋的小鼠异种移植物的组织切片,EpCAM的正细胞仅在异种移植肿瘤部的中心进行检测。 (放大20倍), 请点击这里查看此figu的放大版本。重。
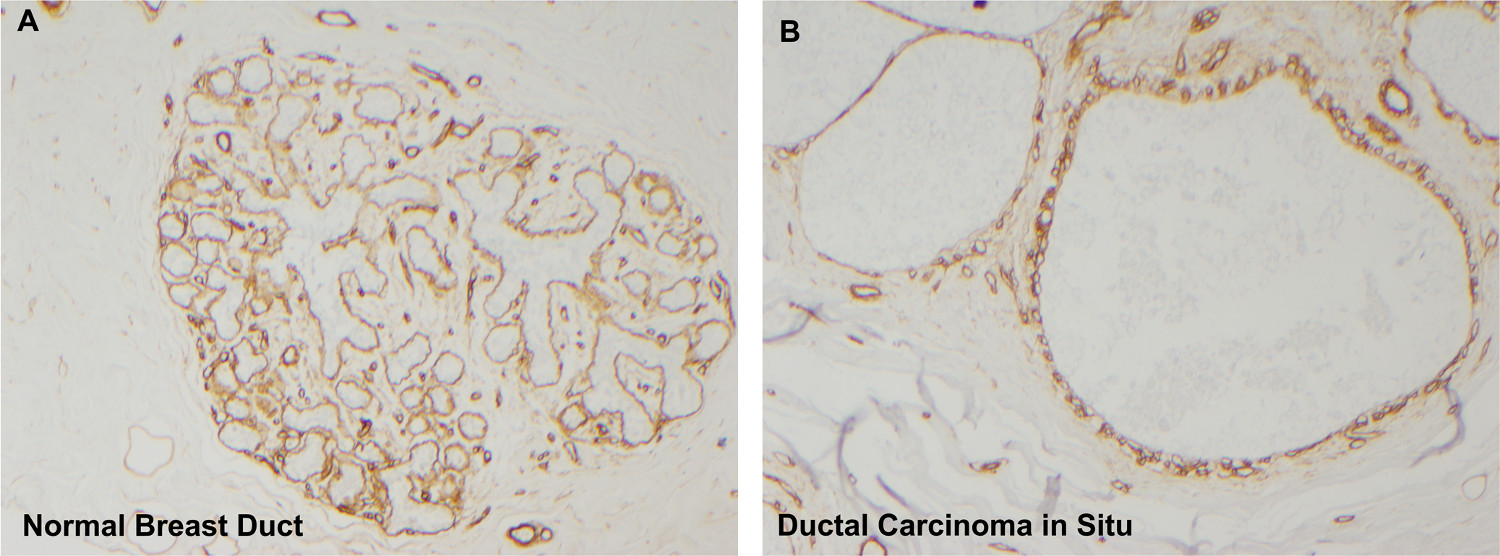
图7. IV型胶原蛋白免疫组织化学揭示了围绕管道完好基底膜。正常乳腺导管(A)中由富含IV型胶原(二氨基联苯胺=褐色染色)完整基底膜包围。继化培养,乳腺组织也包含完整的基底膜,确认该微球体来源于DCIS的领域,并没有从浸润性癌(IV型胶原免疫组化,面板4倍的放大倍率,B组10X)。 请点击这里查看大图这个数字。
讨论
本文所描述的培养体系构成的基础和转化研究工作产生的生活浸润前乳腺肿瘤细胞的新模式。在过去,恶变前乳房癌的进展已经典型地使用了三种不同的方法学。第一种方法是病理组织学和显微切割冷冻或固定的人体标本12-14的遗传分析。第二种方法利用了含有增生的肺泡结节(韩病灶)被认为是与人类相似的预浸润性乳腺癌病灶15小鼠模型。第三个模型使用建立的乳腺癌细胞系如MCF7亚系(MCF10A)具有高度差异化的DCIS样形态3,4。虽然这三种模式提供了分子线索乳腺癌进展,所有这些方法都能够评估潜在恶性或在个体患者的病变部位(多个)的分子表型。 HistopathOLOGIC分析没有提供有关细胞在侵袭前病变的功能表型信息。乳腺癌进展的小鼠模型不能准确反映在原地 16-18的组织形态和人类不典型导管增生,小叶原位癌的多样性,性导管癌。此外,基质微环境和细胞外基质周围鼠标癌前病变的沉积是从人对应16明显不同。小鼠自发性癌前病变可表现出非常低的发展水平来侵袭和转移。第三种方法中,培养的细胞系中,仅可提供的功能表型信息,如果移植到免疫抑制的宿主3,4。除了 长期传代细胞系的遗传异常可能不代表自发性乳腺癌进展在人中2。最后,公认的是,每个患者的肿瘤有遗传和表观遗传异常驱动的速度增长,分化的状态,并发展为浸润和转移13,14,17的独特组合。人类的侵袭前病变多灶性和异质细胞成分和组织形态。此外,生物恶性潜能是未知为个体患者的侵袭前病变。
我们主要的组织培养方法克服人类预先浸润性乳腺癌的前一模型的缺陷,并提供了以下优点:1)类器官培养系统支持肿瘤细胞群的天然组织微环境中生长自发地生长,并产生微球体,这将产生浸润性肿瘤在小鼠异种移植模型。的细胞代表一个个体患者的基因型和表型,从而提供的信息的个性化疗法,或个别的预后。 2)类器官培养体系MAINTAINS天然细胞亚群,并提供培养非恶性上皮细胞,基质细胞和免疫细胞的最初存在于原发性乳房组织的装置,以及类器官内搬入培养。介质的低容积的培养系统支持的氧气交换鼓励自发形成微球体和分化的导管和腺泡状结构,而不需要人工三维支架。 3)原代细胞培养免于被酶解或外源性基因改造产生的修改和选择。此外,营养培养基是低成本和简单的准备。 4)分子量和遗传分析可以对从在时间上的培养不同点处的特定的细胞群和/或组织体,而不会中断整个培养来进行。 5)类器官培养系统允许天然的细胞群体的生长,分化的形态和细胞 - 细胞相互作用从而可以之前和引入治疗剂到培养基之后进行研究。
虽然主要的组织文化具有一定的优势,但是它也存在局限性。的组织体培养支持混合细胞培养物的生长,而没有任何一种细胞类型的过度生长。然而,细胞类型的特定比率不能被控制,因此可能无法概括在体内发现的确切蜂窝比率。成功的组织体种植需要无菌组织收集和处理,这两者都没有在许多社区医院病理实验室的常规程序。临床研究人员之间的良好沟通,手术人员,病理检查的工作人员是维持病人护理的连续样本内的无菌至关重要。
化培养的另一个限制是底层坚定对细胞的表型和基因表达16,19的效果。干细胞培养分化可通过加入含有血清的培养基中被诱导,或者可以是由于延长的时间中培养。阿干细胞样表型几个月在此非酶,无血清类器官培养系统5之后保持。然而,在某个时间点,细胞可以分化能形态学可见 - 细胞变得更小,更密集的,并且不能形成微球体。为了避免潜在的问题与改变细胞表型随着时间的推移,分子的实验中,如转染或敲低分析,应该用年轻培养进行,而不是与旧培养物(6个月以上)。
成功的关键类器官培养使用的是介质中的培养烧瓶的一个适当的量,并且使组织体时附着在组织培养瓶。多余的介质烧瓶极限氧扩散,抑制形成微球体。第3 - 组织培养7天是关键的组织体附着到炎起诉培养瓶。在一般情况下,如果一个类器官未附着在第14天,它有可能不包含任何可行的原位癌导管段,并不会成为贴壁。未由14天贴壁组织体应该从培养物中除去。可行的乳腺导管原位癌导管的缺乏可通过固定在10%福尔马林的组织体,并处理该组织成用于组织染色和显微镜评价石蜡块进行验证以下培养。
我们的非酶,无血清培养系统发现支持了基因异常肿瘤前体细胞的侵袭性潜力预浸润性乳腺癌病灶5,9,20中存在的假说。这一发现是符合斯格罗伊等人 ,谁进行了乳腺癌浸润前病变和Damonte 等人的遗传分析。谁研究过乳腺上皮内瘤生长(MINO)乳腺癌进展12,14的小鼠模型的前期工作21。采取山口疗法与其他人的结论,我们的培养个体患者预先浸润性病变的模型支持一个病人的浸润性乳腺癌的侵袭性表型,可能主要是预先确定的在浸润前阶段的概念。
披露声明
作者什么都没有透露。
致谢
这项工作得到了部分支持(1)国防部乳腺癌研究发展计划(美国陆军医学研究收购活动)奖#W81XVVH-10-1-0781到LAL和VE,和(2)的苏珊科曼基金会资助IR122224446拉尔和VE。病理学的支持和组织卖座被好心Inova公司费尔法克斯病理科,哈桑Nayer博士,博士Geetha A.梅内塞斯和查尔斯Bechert博士提供。患者的知情同意和样品采购是通过熟练的INOVA的费尔法克斯医院临床研究协调员加利莫尔冬青,石楠Huryk和埃米尔卡玛指导。
材料
| Name | Company | Catalog Number | Comments |
| Ethanol | Fisher | A405-P | prepare a 70% solution in Type 1 reagent grade water |
| 18 MΩ-cm water, sterile filtered | sterile filtered, Type 1 reagent grade water | ||
| 10 cc plastic disposable syringe, sterile | BD | 305482 | |
| 0.2 µm polyethersulfone (PES) syringe filter, sterile | Thermo Scientific | 194-2520 | |
| 15 ml polypropylene conical tubes, sterile | Fisher | 14-959-49B | |
| 50 ml polypropylene conical tubes, sterile | Fisher | 05-539-6 | |
| 1.5 ml low retention microcentrifuge tubes, sterile | Fisher | 02-681-331 | |
| nutrient medium, DMEM-F12/HEPES | Invitrogen | 11330-032 | with L-glutamine |
| Insulin, human recombinant | Roche | 11376497001 | 10 mg/ml stock |
| Epidermal Growth Factor (EGF), human recombinant | Millipore | GF144 | 100 µg/ml stock |
| Streptomycin sulfate | Sigma-Aldrich | S1567 | 10 mg/ml stock |
| Gentamicin sulfate | Sigma-Aldrich | G19114 | 10 mg/ml stock |
| Filtration flask and filter top, sterile | Millipore | SCGPU02RE | 0.22 µm PES membrane |
| 25 ml sterile, disposable pipettes | Fisher | 4489 | paper-plastic wrapped |
| 10 ml sterile, disposable pipettes | Fisher | 4488 | paper-plastic wrapped |
| Tissue marking dyes (black, blue, red, green, yellow and orange) | CDI | MD2000 | after opening use only with single-use, sterile cotton tipped applicators, or use once and discard |
| Cotton tipped applicators, sterile | Fisher | 23-400-115 | single use only |
| Gauze pads, 10 x 10 cm, sterile | Fisher | 2187 | |
| Plastic transfer pipettes, sterile, disposable | Samco | 202-20S | |
| Vinegar, white distilled | household use | 5% acetic acid; after opening use only with sterile pipettes | |
| #10 scalpels, sterile, disposable | Thermo Scientific | 31-200-32 | |
| Petri dish, sterile | Fisher | FB0875713A | |
| TPP 115 cm2 flask, with removable lid | MidSci | 90652 | screw cap with filter |
| CO2 incubator | Fisher | 13-998-074 | 5% CO2, 37 °C, humidified chamber |
| inverted light microscope | Olypmus | IX51 | |
| 8 M urea | Fisher | BP169-500 | optional, for mass spectrophotometric analysis of cultured cells |
| 2X SDS tris-glycine buffer | Life Technologies | LC2676 | optional, for proteomic analysis of cultured cells |
| Cytocentrifuge | Thermo Scientific | A78300003 | optional, for preparing cell smears |
参考文献
- Shaughnessy, J. A., et al. Treatment and prevention of intraepithelial neoplasia: an important target for accelerated new agent development. Clin Cancer Res. 8 (2), 314-346 (2002).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9 (5), 391-403 (2006).
- Behbod, F., et al. An intraductal human-in-mouse transplantation model mimics the subtypes of ductal carcinoma in situ. Breast Cancer Res. 11 (5), (2009).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Espina, V., et al. Malignant precursor cells pre-exist in human breast DCIS and require autophagy for survival. PLoS One. 5 (4), (2010).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes Dev. 17 (10), 1253-1270 (2003).
- Farnie, G., et al. Novel cell culture technique for primary ductal carcinoma in situ: role of Notch and epidermal growth factor receptor signaling pathways. J Natl Cancer Inst. 99 (8), 616-627 (2007).
- Wicha, M. S., Liotta, L. A., Garbisa, S., Kidwell, W. R. Basement membrane collagen requirements for attachment and growth of mammary epithelium. Exp Cell Res. 124 (1), 181-190 (1979).
- Espina, V., Liotta, L. A. What is the malignant nature of human ductal carcinoma in situ. Nat Rev Cancer. 11 (1), 68-75 (2011).
- Gong, C., et al. Beclin 1 and autophagy are required for the tumorigenicity of breast cancer stem-like/progenitor cells. Oncogene. 32 (18), 2261-2272 (2012).
- Simon, B., et al. Epithelial glycoprotein is a member of a family of epithelial cell surface antigens homologous to nidogen, a matrix adhesion protein. PNAS. 87 (7), 2755-2759 (1990).
- Ma, X. J., et al. Gene expression profiles of human breast cancer progression. Proc Natl Acad Sci U S A. 100 (10), 5974-5979 (2003).
- Schnitt, S. J., Harris, J. R., Smith, B. L. Developing a prognostic index for ductal carcinoma in situ of the breast. Are we there yet. Cancer. 77 (11), 2189-2192 (1996).
- Sgroi, D. C. Preinvasive breast cancer. Annu Rev Pathol. 5, 193-221 (2010).
- Asch, H. L., Asch, B. B. Heterogeneity of keratin expression in mouse mammary hyperplastic alveolar nodules and adenocarcinomas. Cancer Res. 45 (6), 2760-2768 (1985).
- LaBarge, M. A., Petersen, O. W., Bissell, M. J. Of microenvironments and mammary stem cells. Stem Cell Rev. 3 (2), 137-146 (2007).
- Smart, C. E., et al. In vitro analysis of breast cancer cell line tumourspheres and primary human breast epithelia mammospheres demonstrates inter- and intrasphere heterogeneity. PLoS One. 8 (6), (2013).
- Vaillant, F., Asselin-Labat, M. L., Shackleton, M., Lindeman, G. J., Visvader, J. E. The emerging picture of the mouse mammary stem cell. Stem Cell Rev. 3 (2), 114-123 (2007).
- Kim, D. H., et al. Actin cap associated focal adhesions and their distinct role in cellular mechanosensing. Sci Rep. 2, 555 (2012).
- Espina, V., Wysolmerski, J., Edmiston, K., Liotta, L. A. Attacking breast cancer at the preinvasion stage by targeting autophagy. Women's Health. 9 (2), 1-14 (2013).
- D'amonte, P. Mammary carcinoma behavior is programmed in the precancer stem cell. Breast Cancer Res. 10 (3), (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。