Method Article
Murino Endoscopia para
Neste Artigo
Resumo
Pequenas técnicas de imagem animais permitem exames de diagnóstico de série e intervenções terapêuticas in vivo. Recentemente, o leque de aplicações tem aumentado significativamente e atualmente inclui avaliação do desenvolvimento de tumor do cólon, cicatrização de feridas e monitoramento da inflamação. Este protocolo ilustra essas aplicações potenciais diferentes de endoscopia murino.
Resumo
Modelos de mouse são amplamente utilizados para estudar patogênese de doenças humanas e para avaliar os procedimentos de diagnóstico, bem como intervenções terapêuticas pré-clínicos. No entanto, a avaliação válida de alterações patológicas, muitas vezes requer análise histológica, e quando realizado ex vivo, necessita de morte do animal. Portanto, em situações experimentais convencionais, exames de acompanhamento intra-individuais são raramente possível. Assim, o desenvolvimento de endoscopia de murino em ratinhos vivos investigadores permite pela primeira vez a ambos visualizar diretamente a mucosa gastrointestinal e também repetir o processo para a monitorização de alterações. Existem inúmeras aplicações para in vivo murino endoscopia, incluindo estudar inflamação intestinal ou cicatrização de feridas, a obtenção de biópsias da mucosa repetidamente, e localmente administrar agentes de diagnóstico ou terapêuticos em uso de cateter de injeção em miniatura. Mo de diagnóstico por imagem, mais recentemente, a imagem molecular tem estendidodalidades permitindo a detecção específica de moléculas alvo específicas distintas, usando as fotossondas. Em conclusão, a endoscopia murino surgiu como uma nova tecnologia de ponta para o diagnóstico experimental in vivo de imagens e pode ter um impacto significativo em pesquisas pré-clínicas em vários campos.
Introdução
Modelos animais têm muito enriquecido nossa compreensão de inúmeras patologias intestinais. O rato de laboratório (Mus musculus) surgiu como um modelo animal primordial na investigação biomédica devido à sua informação genética e genômica abundante e está prontamente disponível em linhagens transgênicas e mata-mata. Além de reforçar a compreensão patogênese da doença, modelos animais também são usados principalmente para testar drogas candidatos, bem como intervenções diagnósticas ou terapêuticas pré-clínicos. No entanto, apesar da variedade de modelos de ratos, simulando a doença humana, muitas opções de diagnóstico e de intervenção que são rotineiramente usados no tratamento do paciente não estão disponíveis para os ratos. Deste modo, as estratégias de vigilância para controlar o curso da doença de murino ou o efeito de intervenções terapêuticas são geralmente limitados para observações indirectas ou post mortem análises. Embora existam procedimentos não-invasivos para os ratos de monitoramento vitalidade como índices de atividade da doença, quantification de perda de peso ou ganho, sangue, urina e fezes análises, estas são apenas indicadores indiretos e são influenciados pela variabilidade inter-individual. Além disso, análises post mortem evitar observações longitudinais em momentos repetitivos. Técnicas de imagem sofisticados para monitorar a atividade da doença em camundongos só recentemente foram introduzidos 1,2. Embora essas técnicas de imagem permitem análises repetitivas, eles apenas fornecem uma visão descritiva e muitas vezes imprecisas sobre o intestino, não permitir a visualização da mucosa direta ou permitir intervenções diagnósticas ou terapêuticas, como a aquisição de biópsia ou aplicação tópica e intramucosal de candidatos a fármacos.
Recentemente, os sistemas de endoscopia de alta resolução para utilização em ratos vivos foram desenvolvidos 3,4. Pela primeira vez, essas técnicas endoscópicas permitir a visualização direta de patologias de doenças do cólon endoluminal como cicatrização de feridas ou inflamação intestinal proporcionando objective estado, em tempo real, permitindo estudos longitudinais no mesmo animal em intervalos de tempo repetitivos. Além de permitir que as biópsias repetidas em um ratinho individual, sistemas de endoscopia também pode ser utilizado para influenciar terapeuticamente um tumor distinta ou inflamação localizada, permitindo a aplicação directa de uma substância para a área de interesse. Além disso, como substâncias terapêuticas e de controlo podem ser entregues directamente para a área de interesse, esta pode ser realizada no mesmo ratinho, não incluindo a variabilidade inter-individual. Estes sistemas de terem sido utilizadas para a avaliação da inflamação do cólon, cicatrização de feridas, biópsias hepáticas laparoscópicas e indução ortotópico de tumores hepáticos 8 e desenvolvimento do tumor através de vários sistemas de pontuação, tais como o índice endoscópica murino de gravidade da colite (MEICS) 5-7. MEICS consiste de cinco parâmetros para avaliar a inflamação: espessamento da parede do cólon, alterações do padrão vascular, presença de fibrina, a granularidade dos Mucossuperfície al, e fezes de consistência.
Neste protocolo, descrevem o uso de endoscopia rígida em modelos murinos de cicatrização intestinal, inflamação e câncer de cólon. Em primeiro lugar, demonstrar a avaliação endoscópica da cicatrização e inflamação do cólon, bem como a avaliação longitudinal da atividade colite eo estudo da cancerogenesis no cólon murino. Além do uso descritivo da endoscopia murino, nós fornecemos instruções detalhadas sobre o uso de instrumentos endoscópicos para obter biópsias, bem como a aplicação tópica e intramucosal de diferentes componentes de interesse (por exemplo, candidatos a fármacos ou células tumorais). Finalmente, demonstramos a utilização de endoscopia fluorescência murino, que emprega técnicas sofisticadas de imagens moleculares, na definição de tumores colo-rectais.
Protocolo
Todos os experimentos com animais foram aprovados pelo Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV) de acordo com a Lei de Proteção de Animais alemão.
1. Materiais e montagem de experimento
- Cuidados com os animais
- Use feminino ou camundongos machos de qualquer tensão pesando 20 a 25 g e abrigá-los de acordo com a legislação cuidado animal local.
- Alimentar ratos com comida para roedores e especial aplicar ração isenta de alfafa pelo menos três dias antes da fluorescência exames para minimizar endoluminal auto-fluorescência.
- Fornecer autoclavado beber água ad libitum.
- A indução da colite induzida por DSS aguda
- Prepara-se uma 3% (w / v) de sulfato de sódio de dextrano (DSS, peso molecular: 36,000-50,000 Da) solução por dissolução de 3 g de DSS em 100 ml de água autoclavada. Oferecer esta solução como a água potável exclusiva para ad libitum camundongos e calcular 5 ml de solução por DSS-mouse / dia. Alimentação contcamundongos rol com água autoclavada sem DSS ad libitum 9.
- A indução de câncer colorretal
- Dissolver azoximetano mutagénicas (OMA) (CUIDADO Pode causar cancro e defeitos genéticos!) Em solução salina isotónica estéril para se obter uma concentração final de 1 mg / ml. Aplicar uma dose única de 10 mg por kg de peso corporal OMA intra-peritoneal com uma seringa de 1 ml (30 g) 10.
- Camundongos desafio (excluindo os ratos de controle) com ciclos repetitivos de 3% (w / v) DSS do dia 0-7, dia 14-21, dia 28-35 e dia 42 a 49 de induzir inflamatória impulsionado cancerogenesis colorretal. Alimentar ratos com água esterilizada apenas entre esses desafios (ver Figura 4A por um cronograma detalhado). Alimentar ratos de controle em água esterilizada durante todo o experimento.
- Preparação de fluorescência endoscopia (FE)
- Use Fluorescein-Isothiocyanat (ITCF) - dextrano (peso molecular de 70.000 Da; FITC: glicose = 1: 250) para detecção de adenoma do cólon por realce visual de displasia associada padrão vascular.
- Administrar 60 mg de dextrano conjugado com FITC diluído em 100 ul de PBS por via intravenosa 5 minutos antes da análise de fluorescência endoscópica.
- Anestesia
- Fornecer um suprimento contínuo para anestesia de isoflurano (1,5 LO 2 / min; 1,5-2% em volume de isoflurano [2-cloro-2-(difluorometoxi) -1,1,1-trifluoro-etano]). Use equipamentos especiais anestesia veterinária, com uma máscara para controlar firmemente a anestesia.
- Preparação de enema
- Instilar 2 ml de fluido de enema (conteúdo: hidrogenofosfato dissódico 1,5% (w / v) e di-hidrogenofosfato de sódio a 11% (w / v)) para o cólon, se se suspeita de significativa fecal que podem obscurecer a visão.
2 Equipamento técnico
- Use uma estação de trabalho endoscópica veterinária que é desenvolvida e aprovada para o uso de animais pequenos endoscopia. Conecte o workstation para uma unidade de câmera, uma fonte de luz xenon, uma bomba de ar e um monitor convencional PC para luz branca endoscopia. Em seguida, conecte a câmera eo telescópio rígido em miniatura (diâmetro externo 1,9 milímetros, 10 cm de comprimento; Figura 5).
- Use bainha endoscópio com canal de trabalho (Figura 5D) para a aplicação de pinça de biópsia ou tubo de injecção. Use a bainha sem canal de trabalho para colonoscopia diagnóstica.
- Defina as configurações da fonte de luz para fluorescência endoscopia para excitar traçadores utilizado (por exemplo, 490 nm para dextrano FITC-conjugado). Além disso, a integração de um filtro de passagem de banda adequada entre o telescópio e a câmara (por exemplo, 525 nm para o dextrano conjugado com FITC).
- Insira uma pinça de biópsia flexível (3, 28. Charr cm) através do canal de trabalho do endoscópio para obter biópsias.
- Introduzir tubo de injecção flexível (0,96 mm), através do canal de trabalho para tópica, intramucosal ou Endoluminal umdministração de agentes de diagnóstico ou terapêuticos.
- Use uma mesa de exame aquecida com uma temperatura de 42 ° C. Isso evita que os ratos se tornando hipotermia durante o exame.
3 Anestesia de Animais
- Coloque rato numa caixa à prova de fugas, mas pequena e administrar isoflurano (100% (v / v), 5% em volume, de 3 L / min). Espere até que o mouse perde a consciência.
- Transferir o mouse sobre a mesa de exame de endoscopia. Continue inalação isoflurano via máscara facial com uma dose de 100% v / v, 1,5 vol%, 1,5 L / min. Sempre aplique pomada para evitar o ressecamento dos olhos e sob anestesia.
- Avaliar a eficácia da anestesia, verificando os reflexos. Verifique a 'volta em torno do reflexo ": se suficientemente anestesiado, um rato que coloca em suas costas não deve virar. Confira os 'pés reflex ": quando a anestesia é adequado, macio apertando entre os dedos do animal não deve conduzir à retirada da perna (fase detolerância cirúrgico).
4. Colonoscopia
- Coloque rato anestesiado propenso / de costas na mesa de exame.
- Administrar 2 ml de enema através de uma cânula abotoado no cólon se houver suspeita de acúmulo fecal significativo que pode obscurecer a visão. Espere por ratos para defecar após a administração do enema. Insira o endoscópio com muito cuidado para evitar a perfuração.
- Abrir ambas as válvulas da bainha com um deles estar ligado à bomba de ar. Selar a outra válvula com o dedo indicador para dispensar o ar. Inflar cólon com ar, lentamente e com cuidado, em especial no caso de biópsia ou de injecção.
- Avance endoscópio apenas até a articulação do cólon direito de evitar a perfuração (4-5 cm de ânus).
- Colonoscopia diagnóstica
- Examine a mucosa por alterações inflamatórias ou malignas, enquanto puxa de volta o endoscópio. Puxar lentamente para avaliar toda a circunferência do intestino. Avaliar pa intraluminalthologies utilizando sistemas de pontuação estabelecidos apropriados necessários.
- Para justificar a posição endoscópica idêntico para a aquisição de imagens durante as visualizações repetitivas das áreas das feridas, observe a distância entre o ânus murino ea lesão da mucosa. Além disso, utilizar a ponta da pinça de biópsia como um espaçador, para atingir a distância idêntica entre o endoscópio e a área da ferida durante a aquisição de imagem. O tamanho da ferida está relacionada com o tamanho da bainha de endoscópio, que é composta por 3 mm.
NOTA: Coloque endoscópio em posição idêntica em comparação óptica com documentação fotográfica dos exames anteriores. Lesões de medidas no mesmo ângulo e distância em cada seguimento exame endoscópico.
- Procedimento de biópsia
- Tome biópsias com a ajuda de dois investigadores. Introduzir uma pinça de biópsia com cuidado através do canal de trabalho até que a ponta da pinça é visível no monitor para o segundo investigador. Fórceps Abra e feche com cuidado para aperfuração vazio.
- Mover uma pinça para o local da patologia.
- Procedimento de injeção
- Executar um procedimento de injecção, com a ajuda de dois investigadores. Pré-enchimento do tubo flexível de injecção (0,96 mm) completamente com o agente a ser administrado. Empurre tubo através do canal de trabalho até que a cânula (30 G) é visível no monitor para o segundo investigador. Preparar seringa fino e suavemente administrar a quantidade de agente de diagnóstico ou terapêutico requerido. Os volumes de injecção deve ser de 50 máximo l.
- Insira a agulha no submocosa em um ângulo de 15-30 graus. Encare o chanfro na direção da mucosa. A mucosa mostra um sinal de elevação característica após a injeção de sucesso.
- Fluorescência endoscopia (FE)
- Administrar 60 mg de dextrano conjugado com FITC diluído em 100 ul de PBS por via intravenosa antes fluorescência exame endoscópico.
- Verifique o ponto de tempo ideal entre a injeção deo traçador fluorescente marcado e o procedimento de imagem o qual é dependente do traçador farmacologia. Configurar as definições de sistema de filtro de banda de acordo com o comprimento de onda de excitação e emissão do traçador utilizado. Realizar endoscopia para marcadores de fluorescência de volume de sangue não-específicos (por exemplo, FITC), imediatamente após a injecção intravenosa do corante fluorescente para avaliar o padrão vascular da superfície da mucosa.
- Considere imaginando várias horas após a aplicação do traçador no caso dos marcadores direcionados ou "sondas inteligentes" para proporcionar uma melhor alvo para fundo de razão.
- Realizar foto e vídeo-documentação dos resultados.
5 Pós-colonoscopia
- Separe o rato em uma gaiola vazia e coloque-a sobre uma toalha de papel para proteger o mouse de aspiração de areia. Aqueça o mouse com uma lâmpada de luz vermelha para evitar a hipotermia. Observe o mouse e não deixe sem vigilância até que recuperou suficienteconsciência para manter decúbito esternal. Uma vez completamente consciente, coloque o mouse de volta para sua respectiva gaiola.
- No final da experiência, o lugar do rato numa caixa à prova de fugas, mas pequena e administrar CO 2 (100% (v / v), 100% em volume, de 3 L / min). Espere até que o mouse perde a consciência completa e pára de respirar. Despacho do mouse por fratura do colo. Realizar laparotomia eo explantar cólon. Abra o cólon longitudinalmente e lavá-lo para posterior avaliação histológica ou molecular.
Resultados
Na monitorização in vivo da cicatrização do intestino
Durante a endoscopia de rotina, feridas na mucosa foram induzidas mecanicamente por uma pinça de biópsia em miniatura com um diâmetro de 3 Francês (igual a 1 mm; Figura 1A). Subsequentemente, a cicatrização de feridas foi monitorada por exames endoscópicos diários e quantificada por medição da área de ferida residual utilizando o software de edição, por exemplo, o ImageJ (Figura 1B). O fechamento da ferida indivíduo ao longo do tempo é expressa pelo quociente da área ferida real / área ferida inicial. Por exemplo, no dia 3 após a geração de feridas, 41% ± 4,1% da área da ferida foi recuperado, enquanto que no dia 7 a ferida estava completamente curado normalmente (Figura 1C). Além disso, no final da experiência, as feridas podem ser ressecado para avaliação histológica ex vivo. Descrito são imagens representativas de hematoxilina e eosina (H & E) -stained camas ferida no day 0 e no dia 5 (figura 1D).
Terapia de injeção intramucosal guiada por endoscopia
Para a aplicação de agentes farmacológicos intramucosal, um tubo flexível (diâmetro de 0,96 mm) com uma cânula fixada à extremidade (30 L) foi introduzida no canal de trabalho do endoscópio (Figura 2A). Após a colocação intramucosal da agulha, um máximo de 50 mL foi cuidadosamente injetado. Indicativo de aplicação intramucosal sucesso, levantamento da mucosa do cólon pode ser facilmente observado macroscopicamente (Figura 2B, C).
A avaliação in vivo da colite experimental
Após a indução da colite, os ratos mostraram perda de peso a partir do dia 3 com a máxima perda de peso corporal de 19% que ocorre no dia 7 (Figura 3A). Em adição a medição diária de peso corporal, a actividade da doença foi monitorizada por endoscopia repetitivas e macroscópica quantificação de inflamação pelo índice endoscópica murino de gravidade da colite (MEICS). De acordo com a perda de peso do corpo, pontuação MEICS foi aumentada em 7 dias após o início do DSS, indicando um processo inflamatório em massa da mucosa do cólon, o qual foi melhorado no dia 13 (Figura 3B). Para ex vivo correlação de lesões histológicas, alterações inflamatórias de secções H & E-manchadas de cólon foram quantificados de acordo com o Índice de Dieleman 11. No dia 7 após DSS início, dano histológico foi significativamente maior nos camundongos tratados com DSS em comparação aos controles, reflectidos pelo desnudamento epitelial, ulcerações da mucosa, bem como o aumento da infiltração de neutrófilos e foi significativamente melhorada no dia 13 (Figura 3C, E). Além disso, a avaliação histológica de biópsias da mucosa, rotineiramente obtidos durante exames endoscópicos, corroborou o estágio avançado da colite no dia 7 (Figura 3F-H).
A cerca de 80 dias após a indução do tumor por OMA e três ciclos de DSS (Figura 4A), vários tumores do cólon (Figura 4C), bem como sinais macroscópicos de inflamação crónica tais como a mucosa granulado (Figura 4B) 10 foram observadas por endoscopia. A avaliação histológica dos tumores colorretais por coloração H & E revelou adenomas com e sem neoplasia intraepitelial de alto grau. Portanto, o DSS-modelo AOM se assemelha a um modelo perfeito para estudar processos moleculares da carcinogênese 12, bem como para avaliar novos dispositivos de diagnóstico 13. Imagens de fluorescência alvo moléculas específicas permite em imagem molecular vivo com 'métodos fotográficos' 14,15. Para demonstrar a viabilidade da FE, usamos FITC, um fluorocromo utilizado. Para a detecção de FITC específico, um sistema de filtro passa-banda combinada com o lfonte ight desde comprimentos de onda de excitação específica necessária (490 nm; Figura 4D). Para a detecção precisa do comprimento de onda de emissão de FITC específico de (525 nm), um segundo filtro passa-banda foi interposta entre a cabeça da câmara e o endoscópio (Figura 4E). FE sem aplicação do traçador não detectou nenhum sinal específico e nenhuma interação com o tecido do cólon ou autofluorescência fecal (Figura 4F, G). Em contraste, imediatamente após a aplicação intravenosa de FITC-dextrano, o fluorocromo pode ser observado na mucosa do cólon e pode ser utilizado para a avaliação de aumento da vascularização em regiões de inflamação crónica (Figura 4H), bem como malignos da mucosa (Figura 4I). Assim, a quantificação da intensidade de fluorescência por um software de edição de imagem mostraram um aumento significativamente a absorção do fluorocromo dentro do tecido maligno, em comparação com não-afetado mucosa do cólon (Figura 4K).
"Jove_content" fo: manter-together.within-page = "always"> 
Figura 1 acompanhamento endoscópico das epitelial cicatrização de feridas in vivo, bem como a avaliação quantitativa e histológica da cicatrização de feridas. Após a geração das feridas do cólon, fronteira feridas e fechamento da ferida pode ser facilmente detectado. A área da ferida (setas brancas) é avaliado durante endoscopias diárias de acompanhamento para acompanhar quantitativamente reparação epitelial (A - C) ex vivo, as feridas foram ressecados e H & E-corados para análise histológica da cicatrização de feridas (D).. As tabelas são definidas por barra de escala descrita. Clique aqui para ver uma versão maior desta figura.
re 2 "fo: Content-width =" 5 polegadas "src =" / files / ftp_upload / 51875 / 51875fig2highres.jpg "width =" 500 "/>
Figura 2.-endoscopia guiada intramucosal terapia de injecção. Sob controle visual, a ponta da agulha (A) é suavemente colocada na mucosa do cólon e 50 ul de substâncias dissolvidas é injectado (B). Posteriormente, o levantamento da mucosa marcado pode ser reconhecido (asterisco), sem qualquer sinal de sangramento agudo (C). As tabelas são definidas por barra de escala descrita. Clique aqui para ver uma versão maior desta figura.

Figura 3. avaliação endoscópica do curso de colite DSS experimental. O curso da colite foi avaliard por alterações no peso corporal, exames endoscópicos, bem como a análise histológica de cortes de cólon inflamado e biópsias endoscópicas. Em consonância com a perda maciça de peso corporal e dano histológico avançado no dia 7 (A, C, E, 10x), exames endoscópicos e avaliação histológica das biópsias obtidas sinais de inflamação grave (B, D, G, H representadas; ampliação 5X e 10X), enquanto que no dia 13 após DSS começar alterações inflamatórias foram melhorados significativamente. As tabelas são definidas por barra de escala descrita. Clique aqui para ver uma versão maior desta figura.
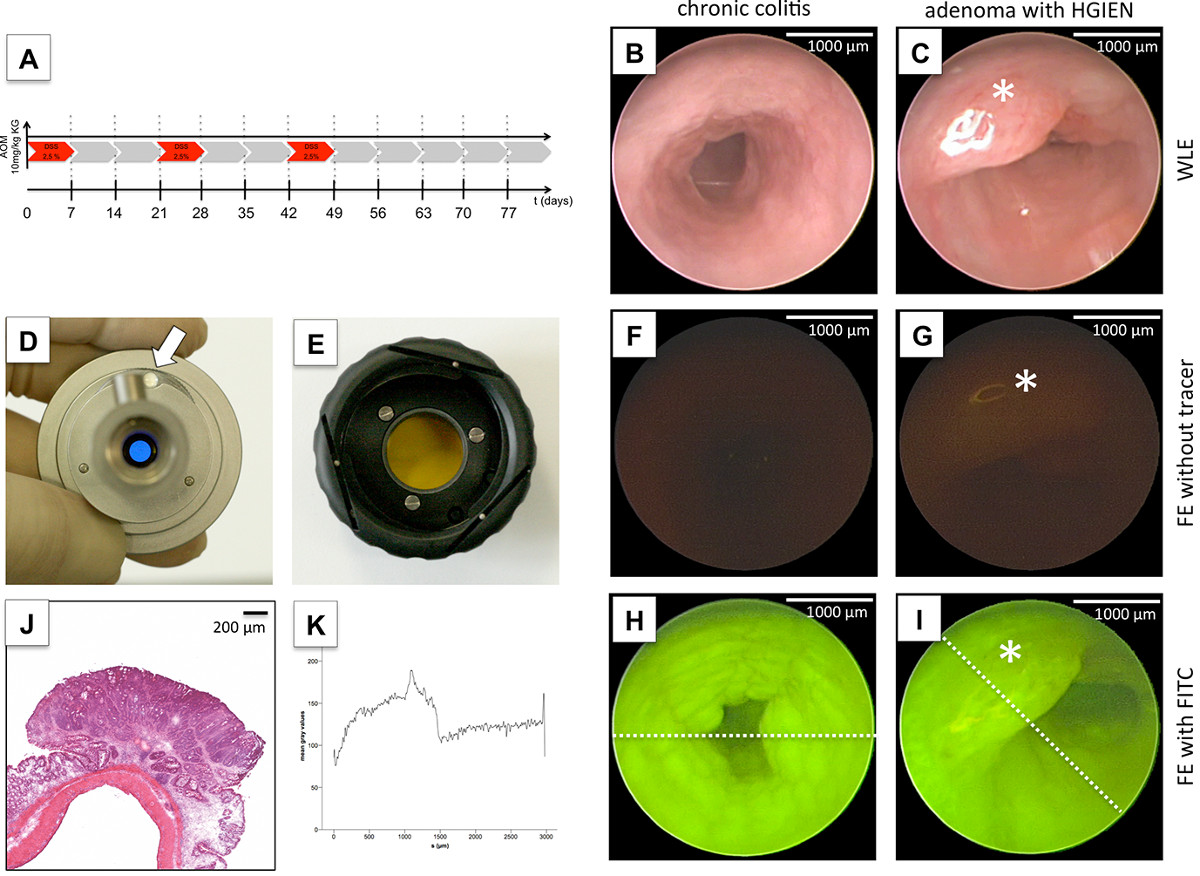
Figura 4 FE de tumores colorretais. Após a indução de cancerogenesis colorretal por AOM e administração DSS cíclica durante 11 semanas (A), de luz branca endoscopia detectada mucosa granulado indicativas de colite crônica (B) e numerosas lesões intraluminais (C) que foram diagnosticados como adenomas com alto grau de neoplasia intra-epitelial por coloração H & E ex vivo (L). Enquanto a visualização de inflamação crônica (H) e tumores (I) foi facilmente possível usando FE alvo FITC, FE, sem aplicação do traçador não permitir a detecção de tumores definitiva (F, G). Assim, a quantificação da intensidade de fluorescência foi significativamente aumentada no tecido maligno em comparação à mucosa do cólon não afetado, mostrado pelos perfis de escala de cinza (E, F). Para alternar para o modo de fluorescência durante branco colonoscop luzy, de um filtro de passagem de banda específico é adicionalmente ligado à fonte de luz fria para proporcionar o comprimento de onda de excitação específica (por exemplo, 490 nm para FITC; D). Este filtro facilita a comutação (seta branca) entre a luz e de fluorescência modos branco (D). Para capturar o comprimento de onda de emissão específicos (por exemplo, 525 nm para FITC), um segundo filtro passa-banda é interposta entre a cabeça da câmara do endoscópio e usando uma junta de baioneta (E). As tabelas são definidas por barra de escala descrita. Clique aqui para ver uma versão maior desta figura.

Figura 5 Experimental set-up da estação de trabalho endoscópica. A estação de trabalho endoscópica ( A) consiste nos seguintes componentes: telescópio simples (0 °, diâmetro: 1,9 milímetros, Comprimento: 10 cm; B), bainha endoscópio (9 Charr) sem (C) e com canal de trabalho (D), câmera (. E) e pinça de biópsia (F). Clique aqui para ver uma versão maior desta figura.
Discussão
Cicatrização do epitélio é um processo contínuo. Esfoliação fisiológica contínua de células superficiais da mucosa gastrointestinal ocorre exigindo a regeneração frequente de células epiteliais 16. Consequentemente, a cicatrização de feridas prejudicada tem um imenso impacto sobre várias doenças, incluindo úlceras gastrointestinais e vazamento da anastomose 17 18. Avaliação da base molecular, assim como potenciais candidatos a medicamentos para estimular a cicatrização, só pode ser realizada de forma incompleta nos sistemas de cultura de células in vitro, 19,20. Assim, montagens experimentais mais sofisticados, como a colonoscopia murino com geração de feridas nas mucosas definido por uma pinça de biópsia são necessárias para permitir uma avaliação fiável in vivo de cicatrização de feridas gastrointestinal e para avaliar possíveis interações entre inflamação intestinal e processos de cicatrização de feridas.
Além disso, uma agulha de injecção pode ser utilizado para local administração intramucosal de corantes de diagnóstico ou de potenciais candidatos a fármacos. Isto pode ser conseguido usando um tubo flexível (diâmetro de 0,96 mm) com uma agulha fixa à extremidade pode ser introduzido através do canal de trabalho. Tendo em conta que um agente de teste, bem como o controle de placebo pode ser entregue em lesões inflamatórias ou neoplásicas distintos para o mesmo animal, esta abordagem proporciona uma vantagem em termos de confiabilidade em comparação com configurações experimentais tradicionais. Uma outra aplicação de injecções locais é a implantação de células de tumor humano ou de murino para produzir tumores ortotópico no cólon murino 21.
Modelos murinos de colite são necessários para elucidar fisiopatologia, bem como para avaliar os potenciais agentes terapêuticos pré-clinicamente. Portanto, um acompanhamento preciso da evolução da doença é de extrema importância. Convencionalmente, a gravidade da doença é avaliada por meio de parâmetros indirectos, tais como o peso corporal, o teste haemoccult bem como análisede sangue e fezes. Em contraste, a determinação directa da gravidade da colite é muitas vezes limitado a análises histológicas post mortem, o que requer a morte do animal. No entanto, a colonoscopia murino oferece uma visualização direta da mucosa do cólon de ratos vivos. Além disso, o monitoramento direto e repetitivo para características de colite é possível, o que é um requisito em modelos experimentais com início da doença não homogênea, por exemplo, IL-10 camundongos deficientes ou no modelo de transfercolitis em camundongos RAG-deficiente. Por conseguinte, um índice de colite murina endoscópica foi estabelecida 6, que permite a quantificação objectivo da inflamação da mucosa e exames de acompanhamento em série do mesmo animal.
No contexto da carcinogênese colorretal, a colonoscopia oferece várias oportunidades benéficas. Por exemplo, em contraste com os métodos não invasivos, endoscopia é a primeira abordagem para permitir a determinação do tamanho do tumor in vivoe número de tumores. Além disso, a utilização de moléculas de direccionamento fotossondas fluorescentes específicos permite a visualização e quantificação dos processos moleculares. Num estudo realizado por translação Foersch et al. direccionamento específico da expressão de VEGF dentro da mucosa do cólon maligna foi demonstrado ser viável e pode ser utilizado para a caracterização da lesão e previsão da resposta ao tratamento em doentes humanos com cancro colorrectal 22. Além disso, a informação resultante desta abordagem imagiologia molecular pode ser capaz de ser traduzido para o uso em pacientes humanos. Isso permitiria ao vivo caracterização de lesões suspeitas durante a endoscopia. Finalmente, o chamado aumento de especificidade 'inteligentes' de sondas estes marcadores por activação dos fluoróforos por processos enzimáticos no lado da lesão-alvo 23.
Ao realizar a endoscopia murino, certos passos do protocolo dado são particularmente críticos. Por exemplo, mo diferentecepas de uso diferem em sua susceptibilidade a concentrações DSS anestesia e. Portanto, este protocolo pode ser obrigado a se adaptar às configurações locais. Além disso, a experiência na realização de exames endoscópicos e conhecimento exato da anatomia murino é necessária para realizar a endoscopia murino ideal que é segura e orientada para o alvo. No que diz respeito a possíveis limitações desta técnica, destacamos que o sistema de endoscópio usado é rígido, portanto, limitando o procedimento para o cólon, tanto quanto a articulação direita. Além disso, a maioria dos fluorocromos aplicáveis para FE estão actualmente a ser avaliado em relação aos seus perfis de segurança e, portanto, ao mesmo tempo disponível para estudos murino, ainda não são aprovados para uso em pacientes humanos.
A seguir estão as etapas críticas sobre os aspectos práticos do processo: (1) uma vez que a suscetibilidade ao DSS colite induzida pode variar entre as diferentes estirpes, a indução da colite aguda DSS pode arriscar a morte de animais se houver advANCED gravidade da colite. Por isso, consideramos a avaliação de várias concentrações de DSS para identificar a mais adequada para um indivíduo e a estirpe SAD lote específico utilizado. O exame endoscópico pode ser difícil na presença de grandes massas de fezes intracolônica. Induzir evacuação antes do procedimento usando aplicação rectal de 2 ml de líquido enema através de uma cânula abotoado vai melhorar a visibilidade se houver suspeita de acúmulo fecal significativo que pode obscurecer a visão. Se ocorrer altas taxas de perfuração durante a biópsia, diminuir o suprimento de ar para dentro do cólon antes de obter biópsias da mucosa e diminuir a pressão das pinças de biópsia na superfície da mucosa antes de fechar os ramos.
Tomados em conjunto, em contraste com os métodos convencionais para a avaliação da actividade da doença ou da colite experimental cancerogenesis por parâmetros indirectos, tais como o peso corporal, a ocorrência de sangue nas fezes, a análise de sangue periférico ou a análise histológica post mortem, a extremidadetécnicas baseadas em oscopy permitir o monitoramento ao vivo do curso da doença com a oportunidade de realizar biópsias sob controle visual. Além disso, a cicatrização de feridas e do impacto terapêutico de candidatos a fármacos de aplicação tópica pode ser avaliada in vivo.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos Sonja Dufentester e Elke Weber para assistência técnica especializada. Agradecemos Faekah Gohar pela revisão do manuscrito e Stefan Brückner para suporte informática médica. Este trabalho foi apoiado por uma bolsa interdisciplinar do Else-Kröner-Fresenius-Stiftung (2012_A94). D. Bettenworth foi apoiado por uma bolsa de pesquisa da Faculdade de Medicina da Westfälische Wilhelms-Universität Münster. M. Brückner foi apoiado por uma "Gerok" posição de rotação da Deutsche Forschungsgemeinschaft (DFG SFB1009B8). Agradecemos Heike Blum para ilustração do desenho animado mouse.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alfalfa-free diet | Harlan Laboritories, Madison, USA | 2014 | |
| Azoxymethane (AOM) | Sigma-Aldrich, Deisenhofen, Germany | A5486 | |
| Bepanthen eye ointment | Bayer, Leverkusen, Germany | 80469764 | |
| Dextran sulphate sodium (DSS) | TdB Consulatancy, Uppsala, Sweden | DB001 | |
| Eosin | Sigma-Aldrich, Deisenhofen, Germany | E 4382 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Deisenhofen, Germany | E 9884 | |
| Falcon Tube 50 ml | BD Biosciences, Erembodegem, Belgium | 352070 | |
| Florene 100 V/V | Abbott, Wiesbaden, Germany | B506 | |
| Haematoxylin | Sigma-Aldrich, Deisenhofen, Germany | HHS32-1L | |
| Isopentane (2-Methylbutane) | Sigma-Aldrich, Deisenhofen, Germany | M32631-1L | |
| Methylene blue | Merck, Darmstadt, Germany | 1159430025 | |
| O.C.T. Tissue Tek compound | Sakura, Zoeterwonde, Netherlands | 4583 | |
| Omnican F - canula | Braun, Melsungen, Germany | 9161502 | |
| Phosphate buffered saline, PBS | Lonza, Verviers, Belgium | 4629 | |
| Sodium Chloride 0.9% | Braun, Melsungen, Germany | 5/12211095/0411 | |
| Standard diet | Altromin, Lage, Germany | 1320 | |
| Tissue-Tek Cryomold | Sakura, Leiden, Netherlands | 4566 | |
| Vitro – Clud | R. Langenbrinck, Teningen, Germany | 04-0002 | |
| Equipment | |||
| AIDA Control | Karl Storz - Endoskope, Tuttlingen, Germany | 20 096020 | |
| Bandpass filter | Semrock, Rochester, USA | HC 716/40 | |
| Bandpass filter | Semrock, Rochester, USA | HC 809/81 | |
| Biopsy Forceps, 3 Fr., 28 cm | Karl Storz - Endoskope, Tuttlingen, Germany | 61071ZJ | |
| Dell Monitor | Dell, Frankfurt am Main, Germany | U2412Mb | |
| Examination Sheath, 9 Fr. | Karl Storz - Endoskope, Tuttlingen, Germany | 61029D | |
| Examination Sheath, 9 Fr. | Karl Storz - Endoskope, Tuttlingen, Germany | 61029C | |
| Fiber Optic Light Cable, 3.5 mm | Karl Storz - Endoskope, Tuttlingen, Germany | 69495NL | |
| Fluorescein Blue Filter System | Karl Storz - Endoskope, Tuttlingen, Germany | 20100032 | |
| Fluorescein Barrier Filter | Karl Storz - Endoskope, Tuttlingen, Germany | 20100033 | |
| Foot switch | Karl Storz - Endoskope, Tuttlingen, Germany | 20010430 | |
| HOPKINS Telescope, 1.9 mm, Length 10 cm | Karl Storz - Endoskope, Tuttlingen, Germany | 1830231 | |
| SCB D-light P | Karl Storz - Endoskope, Tuttlingen, Germany | 20 133720 | |
| SCB tricam SL II | Karl Storz - Endoskope, Tuttlingen, Germany | 20 2230 20 | |
| Tubing set instruments VETPUMP II | Karl Storz - Endoskope, Tuttlingen, Germany | 69811 | |
| Tricam PDD PAL | Karl Storz - Endoskope, Tuttlingen, Germany | 20221037 | |
| UniVet Porta | Groppler Medizintechnik, Deggendorf, Germany | BKGM 0451 | |
| Vetpump 2 | Karl Storz - Endoskope, Tuttlingen, Germany | 69321620 | |
Referências
- Bettenworth, D., et al. Translational 18F-FDG PET/CT imaging to monitor lesion activity in intestinal inflammation. Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 54, 748-755 (2013).
- Lewis, J. S., Achilefu, S., Garbow, J. R., Laforest, R., Welch, M. J. Small animal imaging. current technology and perspectives for oncological imaging. European journal of cancer. 38, 2173-2188 (2002).
- Huang, E. H., et al. Colonoscopy in mice. Surgical endoscopy. 16, 22-24 (2002).
- Becker, C., et al. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nature protocols. 1, 2900-2904 (2006).
- Neurath, M. F., et al. Assessment of tumor development and wound healing using endoscopic techniques in mice. Gastroenterology. 139, 1837-1843 (2010).
- Pickert, G., et al. STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing. The Journal of experimental medicine. 206, 1465-1472 (2009).
- Shapira, Y., et al. Utilization of murine laparoscopy for continuous in-vivo assessment of the liver in multiple disease models. Plos one. 4, e4776(2009).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature protocols. 2, 541-546 (2007).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nature protocols. 2, 1998-2004 (2007).
- Dieleman, L. A., et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clinical and experimental immunology. 114, 385-391 (1998).
- Gao, Y., et al. Colitis-accelerated colorectal cancer and metabolic dysregulation in a mouse model. Carcinogenesis. 34, 1861-1869 (2013).
- Foersch, S., Neufert, C., Neurath, M. F., Waldner, M. J. Endomicroscopic Imaging of COX-2 Activity in Murine Sporadic and Colitis-Associated Colorectal Cancer. Diagnostic and therapeutic endoscopy. 2013, 250641(2013).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Keller, R., Winde, G., Terpe, H. J., Foerster, E. C., Domschke, W. Fluorescence endoscopy using a fluorescein-labeled monoclonal antibody against carcinoembryonic antigen in patients with colorectal carcinoma and adenoma. Endoscopy. 34, 801-807 (2002).
- Jones, M. K., Tomikawa, M., Mohajer, B., Tarnawski, A. S. Gastrointestinal mucosal regeneration: role of growth factors. Frontiers in bioscience : a journal and virtual library. 4, 303-309 (1999).
- Mertz, H. R., Walsh, J. H. Peptic ulcer pathophysiology. The Medical clinics of North America. 75, 799-814 (1991).
- Pantelis, D., et al. The effect of sealing with a fixed combination of collagen matrix-bound coagulation factors on the healing of colonic anastomoses in experimental high-risk mice models. Langenbeck's archives of surgery / Deutsche Gesellschaft fur Chirurgie. 395, 1039-1048 (2010).
- Burk, R. R. A factor from a transformed cell line that affects cell migration. Proceedings of the National Academy of Sciences of the United States of America. 70, 369-372 (1973).
- Msaki, A., et al. The role of RelA (p65) threonine 505 phosphorylation in the regulation of cell growth, survival, and migration. Molecular biology of the cell. 22, 3032-3040 (2011).
- Zigmond, E., et al. Utilization of murine colonoscopy for orthotopic implantation of colorectal cancer. PloS one. 6, e28858(2011).
- Foersch, S., et al. Molecular imaging of VEGF in gastrointestinal cancer in vivo using confocal laser endomicroscopy. Gut. 59, 1046-1055 (2010).
- Mitsunaga, M., et al. Fluorescence endoscopic detection of murine colitis-associated colon cancer by topically applied enzymatically rapid-activatable probe. Gut. 62, 1179-1186 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados